«Deberíamos simplificar todas las cosas lo más posible, pero no más».
Albert Einstein.
El Mundo como yo lo veo, 1949.
La delgadez, independientemente de su causa, constituye un factor de riesgo de osteoporosis1, mientras que la obesidad ejerce efectos protectores del esqueleto y constituye la condición excepcional donde la obesidad ejerce un papel protector sobre el organismo2-6. Esta acción protectora se relaciona con la masa grasa, de hecho en las mujeres se ha descrito una correlación positiva entre ella y la densidad mineral ósea (DMO)7-9. Tras la menopausia, un mayor índice de masa corporal se asocia con una menor pérdida de masa ósea10,11, mientras que la disminución de la masa grasa aumenta el riesgo de fracturas en los ancianos12.
Este importante papel protector de la masa grasa sobre la masa ósea no depende tan sólo del estrés del sobrepeso sobre el hueso, potente y conocido estímulo osteogénico, sino más bien de otros factores hormonales9.
Un importante y potente factor de mantenimiento de la masa ósea tras la menopausia lo constituye la aromatización de andrógenos a estrógenos, y la síntesis de estrógenos por el tejido adiposo, lo que unido a la disminución de la proteína transportadora de hormonas sexuales (SHBG) representa una gran fuente de estrógenos tras la menopausia13.
La insulina tiene efectos mitogénicos sobre los osteoblastos, por lo que se pensó que podría contribuir a la mayor DMO en pacientes obesas14; sin embargo, en pacientes con diabetes mellitus tipo 2 y niveles circulantes de insulina, se ha encontrado masa ósea alta, baja y normal15.
Recientemente, se ha concedido una gran atención a la leptina como posible factor mediador de la osteogénesis aumentada en los obesos.
La leptina es una hormona polipeptídica de 116 aminoácidos y 14 kD, producida principalmente por las células del tejido adiposo blanco, descubierta en 199416, y que ha despertado el interés de muchos investigadores por su gran cantidad de interesantes acciones, en ocasiones antagónicas, en el organismo. Inicialmente, se describió que estaba relacionada con el gen de la obesidad e involucrada con la saciedad y el balance energético y se la propuso como factor anti-obesidad mediante un papel que ligaba el adipocito con el hipotálamo16.
La leptina es una hormona decisiva en la regulación de la ingesta, así como del peso corporal tanto en animales como en seres humanos, de hecho en numerosos estudios se encuentra una correlación positiva entre leptina y masa grasa17. A través de esa vía se vislumbró la posibilidad de que esta hormona pudiera tener un papel destacado en el metabolismo óseo.
La leptina, además de su conocido efecto anorexígeno vía sistema nervioso central (SNC), y sobre el adipocito regulando el balance energético18,19 tiene receptores en otros tejidos periféricos como gónadas, adrenales, páncreas, vasos sanguíneos, tejido hematopoyético, células inmunes, musculares y óseas19, donde modula diversos ejes endocrinos, actúa en el desarrollo sexual, la reproducción, función gastrointestinal, activación simpática, ejerce como factor de crecimiento sobre precursores de la hematopoyesis e inmunidad estimulando el desarrollo de células pulmonares y la angiogénesis por su acción sobre las células endoteliales vasculares y más recientemente sobre el hueso20-22.
Este conjunto de acciones pleiotrópicas de la leptina son debidas a su capacidad de actuar directamente sobre los tejidos periféricos o vía mecanismo central, involucrando un sistema de señalización mediante el sistema nervioso simpático (SNS)20,21.
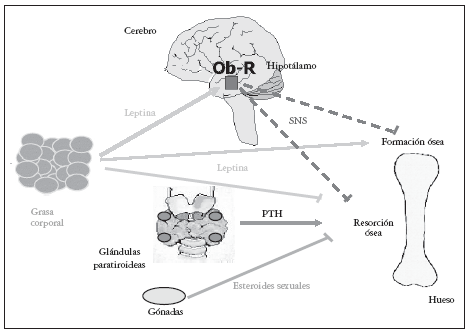
Sobre la masa ósea, la leptina también parece ejercer sus acciones mediante dos mecanismos alternativos23,24: uno periférico, directo, estimulante de la formación, y crecimiento óseo25 y otro central, indirecto a nivel hipotalámico que suprime la formación ósea26,27; muy recientemente, se ha descrito que el mecanismo hipotalámico indirecto de acción ósea de la leptina inhibe también la resorción ósea (fig. 1).
Fig. 1. La leptina ejerce sus acciones sobre hueso mediante dos mecanismos: uno periférico, directo estimulante de la formación y crecimiento óseo, y otro central, indirecto a nivel hipotalámico que suprime la formación y puede que frene la resorción ósea26,27. PTH: hormona paratioroidea.
Por lo tanto, aunque en el momento actual no está bien definido si la leptina debe considerarse un factor anti-osteogénico o un factor anabolizante para la formación ósea, tal vez para un entendimiento más exacto del papel de la leptina sobre el metabolismo mineral, éste debería considerarse dentro del amplio contexto del papel regulador de la leptina como reguladora de crecimiento, fertilidad y gasto energético28.
EVIDENCIA DE EFECTO PERIFÉRICO DIRECTO Y POSITIVO DE LA LEPTINA SOBRE EL REMODELADO ÓSEO
Las células estromales de la médula ósea (MSC) tienen una gran plasticidad para diferenciar en osteoblastos, adipocitos, mioblastos y condroblastos29.
Recientemente se ha demostrado in vitro que las MSC poseen tanto la forma larga como corta del receptor de la leptina, la cual es capaz de activar los mecanismos de señalización adecuados para la diferenciación a osteoblastos e inhibición de diferenciación hacia adipocitos, y además estimula el desarrollo de precursores hematopoyéticos29-31.
Las isoformas del receptor de la leptina persisten en osteoblastos maduros31-33 donde induce la proliferación y diferenciación de los mismos con síntesis de proteínas de la matriz ósea tales como el colágeno tipo I, osteocalcina etc.30,31,34; Además, la leptina inhibe la apoptosis de los osteoblastos34, e incrementa la mineralización35,36.
Todo ello en su conjunto promueve un importante incremento en la formación ósea, lo cual apoya el concepto de la leptina como agente anabólico óseo directo. Además de las acciones sobre los osteoblastos, hay evidencias consistentes de que la leptina regula directamente el desarrollo osteoclástico y modula la resorción ósea.
La leptina, incluso a bajas concentraciones (>= 10-11), inhibe la expresión del ligando del receptor activador del factor nuclear *ß (RANK-L), además induce la producción de osteoprotegerina (OPG), (señuelo del RANK-L en su unión con el RANK en las células mononucleares precursoras de los osteoclastos) tanto en osteoclastos como en sus precursores estromales35,37,38. En consecuencia, la leptina inhibe la osteoclastogénesis37,38. Además la leptina inhibe en monocitos y linfocitos la expresión del antagonista del receptor de la interleucina 139,40, lo que reduce el reclutamiento de osteoclastos en determinados estímulos como la deficiencia estrogénica.
Estos datos in vitro fueron confirmados por estudios de intervención ex vivo, que evaluaban los efectos de la acción de la administración periférica de leptina. Su administración a ratones ob/ob deficitarios en la hormona producía un efecto estimulador sobre el hueso41, con un gran incremento en la formación de hueso cortical42. De hecho, la administración subcutánea de leptina a ratas era suficiente para prevenir más de la mitad de la pérdida de hueso y las alteraciones estructurales inducidas por la deficiencia estrogénica37, o inducidas por desuso en el modelo de suspensión de los ratones por la cola43; la leptina en ratones adultos y sexualmente maduros aumentaba la resistencia mecánica en un 27%41.
Por tanto, los resultados ex vivo, avalaban que la leptina estimulaba la formación y disminuía la resorción ósea37,41,42,44.
Además, la leptina tiene receptores en condrocitos, en los que induce tanto la proliferación como la diferenciación35,36,45,46, estos efectos podrían ser directos o podrían estar intermediados por el sistema del factor de crecimiento insulínico (IGF), mediante la regulación de la expresión del receptor de IGF-I. Además, la leptina es un potente estimulador de la secreción de la hormona de crecimiento tanto a nivel central hipofisario47, como por los linfocitos48.
Por otra parte, Gat-Yablonski et al.49 han descrito que la leptina es capaz de estimular el crecimiento del hueso, independientemente del sistema IGF; el tratamiento con leptina corrige la deficiencia de crecimiento inducida por ayuno, pese a la gran reducción de niveles séricos del IGF-I49.
Estos efectos sobre el esqueleto han posibilitado que se proponga que el aumento de la leptina ha sido un importante factor intermediario del aumento de estatura observado en las generaciones a la largo del siglo pasado25,50.
La mayoría de los estudios de que disponemos ex vivo en seres humanos son estudios transversales, podríamos resumirlos como no concluyentes. De hecho, algunos autores han publicado una asociación positiva entre niveles séricos de leptina y DMO51-56 o contenido mineral óseo57, pero otros autores no encontraron dicha asociación58-60, o incluso esta asociación era negativa61,62. Además, cuando se ajusta por la grasa corporal esa asociación incluso desaparece en algunos estudios53,55-57.
Por otra parte, los marcadores de remodelado óseo, en algunos estudios no mostraban relación52,58 o mostraba una relación negativa entre los marcadores de resorción y la leptina51, incluso tras ajustar con la grasa corporal63.
Se han llevado a cabo pocos estudios de intervención en seres humanos, pero en un ensayo corto muy interesante realizado en mujeres con amenorrea hipotalámica el tratamiento durante tres meses con el análogo r-metHu Leptina provocó una elevación significativa de los marcadores óseos de remodelado osteocalcina y fosfatasa alcalina, pero no de los N-telopéptidos urinarios64.
No obstante, en mujeres posmenopáusicas con fracturas vertebrales los niveles séricos de leptina estaban disminuidos de modo significativo53. Este trabajo fue confirmado el pasado año por Schett et al.65, que evaluaron la asociación potencial entre niveles séricos de leptina y riesgo de fracturas periféricas y vertebrales clínicas, demostrando que niveles de leptina en el tercil alto disminuyen el riesgo de sufrir una fractura no traumática.
Se ha propuesto que la leptina protege de la fractura aumentando la calidad ósea66: aumentando la resistencia como sucede en los ratones35, o mediante un aumento del compartimento cortical del hueso como ha propuesto Matkovic67, con un resultado neto sobre el momento de inercia y la resistencia ósea. La leptina también podría mejorar la calidad ósea disminuyendo el recambio óseo51,63,65, predictor independiente del riesgo de fractura68.
El conjunto de estos datos tomados colectivamente confirmaban el pensamiento colectivo de la contribución de la leptina como factor hormonal intermediario positivo de las relaciones entre masa grasa y masa ósea.
Sin embargo, al tiempo que se daban a conocer estos datos de la acción periférica de la leptina Ducy et al69 describieron una novedosa, sorprendente, e intrigante acción negativa de la leptina sobre el hueso a través de un efecto hipotalámico central.
EVIDENCIA DE EFECTO CENTRAL DE LA LEPTINA. REGULACIÓN NEGATIVA DEL METABOLISMO ÓSEO
El grupo de Karsenty69,70, sugirió que la leptina ejerce un efecto negativo sobre la formación ósea, al observar que los ratones deficientes en leptina (ob/ob) y los ratones con receptor mutado, e inactivo para la leptina (db/db), tenían una aposición mineral más elevada y una masa ósea trabecular un 40% más elevada que los ratones normales, pese a su hipogonadismo e hipercortisolismo constitucional.
La señalización defectuosa de la leptina y no el sobrepeso parecía ser la causa de la formación elevada de hueso, puesto que el ratón transgénico «sin grasa» A-ZIP/F1 con un nivel bajo de leptina debido a su lipodistrofia también presentaba un fenotipo de elevada masa ósea69,71; mientras que el ratón deficiente en el receptor-4 de melanocortina, aunque obeso, no presenta modificaciones importantes en la masa ósea72,73. Además, en ratones ob/ob el incremento de masa ósea podría revertirse mediante la expresión transgénica de leptina74.
Una vez secretada por los adipocitos, la leptina debe traspasar la barrera hematoencefálica, llegar al sistema nervioso central y ejercer su acción uniéndose a un receptor hipotalámico. Así la infusión intracerebro-ventricular (ICV) de leptina aún a dosis bajas tanto en ratones ob/ob, db/db, como en normales disminuye la masa ósea69,70, sin que se produzca un incremento en la leptina circulante, lo que nos indica que la leptina controla la formación ósea a través de un mecanismo hipotalámico75.
IDENTIFICACIÓN DE LAS NEURONAS HIPOTALÁMICAS RESPONSABLES DE LA FUNCIÓN ANTIOSTEOGÉNICA DE LA LEPTINA
La leptina activa varios núcleos neuronales hipotalámicos muy ricos en receptores de leptina, donde posee la forma de receptores largos del receptor de leptina (OB-Rb), como el núcleo hipotalámico ventromedial (VMH) o núcleo arcuato (ARC)76. Para identificar los que controlan la formación ósea se utilizaron las técnicas de ablación farmacológica que hace varias décadas se emplearon para identificar los centros del hambre y de la saciedad77.
La destrucción farmacológica con glutamato monosódico de las neuronas anorexígenas del ARC no afectan la masa ósea, sin embargo la destrucción del VMH con tioglucosa de oro (GTG) convierte a los ratones en moderadamente obesos, pero incrementan la masa ósea de un modo semejante a los ratones ob/ob73, mientras que la infusión cerebroventricular de leptina a los ratones ob/ob tratados con GTG que destruye el VMH, produce disminución de su peso corporal pero no modifica su masa ósea.
Estos datos indican con claridad que la acción antiosteogénica hipotalámica de la leptina está fundamentalmente mediada por las neuronas del núcleo ventromedial73.
No obstante, estos datos no excluyen la existencia de otras vías neuronales involucradas en el control de la masa ósea, así Balock ha demostrado que la deleción del receptor específico del neuropéptido Y-2 del núcleo arcuato hipotalámico produce un aumento de masa ósea78, lo cual indica que esos receptores regulan la formación ósea modificando la función autonómica.
Paradójicamente los ratones deficientes en neuropéptido Y tienen masa ósea normal, lo cual contrasta con los resultados del ratón deficiente en el receptor NPY279 e indica que otro miembro de esta familia de neuropéptidos sería el ligando del receptor NPY2; por otra parte el ratón deficiente en NPY4 tenía una masa ósea normal, mientras que el ratón doble knockout de receptores NPY2 y NPY4 tiene un mayor incremento de volumen óseo que el ratón deficiente sólo en el receptor NPY280,81.
En varios modelos de ratones mutantes se ha demostrado que las funciones antiosteogénicas de la leptina no involucran mecanismos de la MSH o la CART (cocaine and amphetamine regulated transcript), las cuales son críticas en la acción anoréxigena de la leptina73.
EL SISTEMA NERVIOSO SIMPÁTICO LIGA EL CEREBRO Y EL HUESO
Experimentos realizados mediante la técnica de parabiosis sugerían que el mediador neuronal de la acción antiosteogénica de la leptina era un factor humoral, o más probablemente un mediador neuronal73.
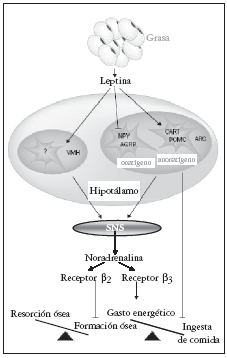
Los ratones ob/ob deficientes en leptina tienen un bajo tono simpático82, la leptina a través del núcleo VMH aumenta la actividad del SNS, incrementando la secreción de catecolaminas83, lo cual apoyaba la hipótesis de que el SNS podría ser el mediador de las acciones antiosteogénicas de la leptina84.
Para evaluar esa hipótesis se estudiaron ratones deficientes en dopamina ß hidroxilasa, que no pueden sintetizar adrenalina ni noradrenalina, los cuales, pese a tener concentraciones séricas elevadas de corticosterona y dopamina, tenían una elevada masa ósea debido a la formación aumentada73; en estos ratones la inyección ICV de leptina inducía pérdida de peso, pero no se producía la acción antiosteogénica de la leptina.
Todo ello indica claramente que a) el SNS no resulta esencial para la acción de la leptina sobre el peso corporal y b) que la acción antiosteogénica de la leptina es mediada (al menos parcialmente) por el SNS73.
Apoyando estos hallazgos, se detectaron terminaciones nerviosas productoras de catecolaminas, demostrándose la expresión de receptores ß2-adrenérgicos ubicados en la superficie de los osteoblastos y no de otro tipo. Los osteoblastos de cultivos primarios producen AMPc en respuesta al tratamiento con agonistas ß-adrenérgicos, lo que avala la funcionalidad de estos receptores73.
La demostración de que la modulación del SNS afecta a la masa ósea se produjo restaurando la actividad simpática en ratones ob/ob inyectando isoproterenol, un agonista ß-adrenérgico no selectivo, lo que disminuía la masa ósea, sin modificar el peso corporal; resultados similares se observaron en ratones normales73.
El propanolol, un bloqueador beta no selectivo, aumenta la masa ósea en ratones normales sin modificar el peso, y protege de la pérdida de masa ósea en ratas ovariectomizadas. Por otra parte, la infusión ICV de leptina en ratones tratados con propranolol produce una importante pérdida de peso, sin disminuir la masa ósea.
A la luz de los datos hasta aquí expuestos de la investigación sobre los mecanismos de las acciones centrales hipotalámicas de la leptina, se puede concluir que inhibe
la formación ósea mediante el SNS73; además, recientemente se ha publicado que la leptina podría inhibir mediante un mecanismo central indirecto la resorción ósea84. (figs. 1 y 2).
Fig. 2. Mecanismos de actuación hipotalámica de la leptina sobre hueso y metabolismo energético. Modificada de Cock TA et al27. SNS: sistema nervioso simpático.
Teniendo en cuenta la necesidad de fármacos anabolizantes para el tratamiento de la osteoporosis, fruto de esta investigación fue la hipótesis del empleo de bloqueadores beta para el tratamiento de la osteoporosis, dado que parece que incrementan la masa ósea26,27,85.
Los primeros estudios confirmaron los posibles efectos favorables de los bloqueadores beta sobre el incremento de masa ósea y la disminución del riesgo de fractura86,87, pero las publicaciones más recientes no asocian los bloqueadores beta con cambios de marcadores de remodelado que indiquen modificaciones en el metabolismo mineral, y justifiquen su empleo para aumentar la DMO y/o disminuir el riesgo de fractura88, ni se asocian con modificaciones significativas de la DMO, ni del riesgo de fractura, (hazards ratios para cualquier fractura: 0,92 [0,81, 1,05], para fractura de muñeca 0,74 [0,54, 1,01] y para la fractura de cadera 0,76 [0,58, 0,99]89).
En cualquier caso, hacen falta ensayos clínicos prospectivos que evalúen el efecto de los bloqueadores beta en el tratamiento de la osteoporosis.
El conocimiento de la modulación del SNS de la osteogénesis puede tener trascendencia en patologías como la distrofia simpático refleja, una enfermedad caracterizada por una up regulation del SNS en una zona localizada del hueso, acompañada de osteopenia local, y que tiene como uno
de los tratamientos más eficaces los bloqueadores beta90.
En resumen, las acciones periféricas y centrales de la leptina pueden tener una gran repercusión en el metabolismo óseo, hasta el punto de que su manipulación farmacológica puede tener importantes implicaciones terapéuticas en el tratamiento de la osteoporosis en un futuro próximo.