INTRODUCCION
El hiperparatiroidismo se caracteriza por altos niveles circulantes de hormona paratiroidea (PTH) debido a un incremento en la secreción de esta hormona por una o más de las glándulas paratiroides. Es la segunda endocrinopatía más frecuente estimándose en los Estados Unidos que 28 de cada 100.000 personas desarrollarán este trastorno. Actualmente el único tratamiento del hiperparatiroidismo es la remoción quirúrgica de la glándula(s) afectada(s). El receptor sensor de calcio (RSCa) es un receptor de baja afinidad acoplado a proteína G responsable del sensado del calcio por parte de la glándula paratiroides y consecuentemente de la regulación de la secreción de PTH. Su reciente identificación a nivel de las paratiroides1 y del túbulo renal2 y su clonación han permitido tener una mejor comprensión de la regulación normal del metabolismo del calcio y entender un número de trastornos relativamente poco frecuentes del metabolismo mineral3. Este descubrimiento también ha permitido desarrollar fármacos que imitan o potencian las acciones del calcio extracelular sobre el RSCa (llamados calciomiméticos) que disminuyen la secreción de PTH sin incrementar el calcio sérico. Los calciomiméticos de última generación son pequeñas moléculas orgánicas que actúan como moduladores alostéricos del RSCa, de las cuales el clorhidrato de cinacalcet se encuentra en su fase inicial de desarrollo clínico y es el objeto de esta revisión
CARACTERISTICAS ESTRUCTURALES Y FUNCIONALES DEL RECEPTOR SENSOR DE CALCIO
El RSCa humano está compuesto de 1.078 aminoácidos4. Tiene una gran porción extracelular aminoterminal compuesta de aproximadamente 600 aminoácidos. Los residuos de cisteína presentes en este dominio extracelular participan de la dimerización del receptor, un proceso que también modifica su función5. Los iones de calcio extracelular interaccionan con esta porción extracelular para modular la transducción de señal in vivo6.
La porción media del RSCa está compuesta por aproximadamente 250 aminoácidos con secuencias homologas a los 7 dominios que se expanden en la membrana que caracteriza a la gran superfamilia de receptores acoplados a proteínas G1,4. Finalmente posee una porción intracelular carboxilo terminal de más de 200 aminoácidos que contiene secuencias de consenso que representan sitios separados de fosforilación para la proteinkinasa C y A1,4. La fosforilación del dominio intracelular del RSCa por la proteinkinasa C disminuye la actividad del receptor7.
Una característica única de este receptor en comparación con otros receptores hormonales, que son activados a concentraciones muy pequeñas (nanomolares) del agonista, es que el RSCa es sensible a cambios relativamente pequeños del calcio iónico extracelular existiendo altas concentraciones de este ion en el mismo (por encima de 1 milimolar). El RSCa es un receptor acoplado a proteína G que como consecuencia de su activación estimula una fosfolipasa C, que da como resultado un incremento en los niveles de inositol 1,3,5-trifosfato, que a su vez eleva el calcio citosólico movilizándolo de varios sitios intracelulares8. La activación del RSCa también inhibe la acumulación de monofosfato de adenosina cíclico (AMPc) estimulado hormonalmente8. Otra característica del RSCa es su falta de especificidad, pudiendo ser activado por otros cationes divalentes, como el magnesio, por cationes trivalentes como el gadolinio y el lantano y por compuestos policatiónicos como la neomicina y la espermidina. Finalmente, como ya mencionamos anteriormente, otra característica del RSCa que puede complicar su farmacología es su habilidad de producir dimerización, y en esta configuración acoplar efectivamente los mecanismos de señalización transmembrana.
AGENTES CALCIOMIMÉTICOS: CLORHIDRATO DE CINECALCET (AMG 073)
Los ligandos que imitan o potencian las acciones del calcio extracelular a nivel del RSCa han sido denominados calciomiméticos. Existen dos clases de calciomiméticos que se distinguen por sus mecanismos de acción9.
Los calciomiméticos tipo I son agonistas completos del RSCa e incluyen a su ligando natural, el calcio extracelular, y una variedad de otros policationes orgánicos e inorgánicos. Los calciomiméticos de tipo I verdaderamente imitan al calcio extracelular y actúan inhibiendo la secreción de PTH en ausencia nominal de calcio extracelular. Este grupo de calciomiméticos incluye a cationes inorgánicos, polianiones, aminoglucósidos y aminoácidos polibásicos y péptidos. Probablemente los calciomiméticos tipo I policatiónicos difieren en su habilidad para promover la dimerización del RSCa y esto se refleja en sus diferentes potencias. Existe una correlación aunque no perfecta entre las potencias de los calciomiméticos tipo I y su carga positiva neta. Consistente con su mecanismo de acción, los calciomiméticos tipo I actúan a nivel de la porción extracelular del RSCa.
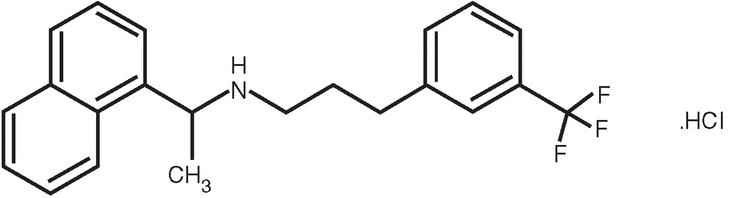
En contraste los calciomiméticos tipo II se comportan como moduladores alostéricos positivos e incrementan la sensibilidad del RSCa a la activación por parte del calcio extracelular actuando a nivel de la porción transmembrana del mismo. Estos compuestos no afectan la secreción de PTH en ausencia de calcio extracelular. Desplazan la curva de concentración respuesta al calcio extracelular hacia la izquierda sin alterar la respuesta máxima. Los calciomiméticos de tipo II son pequeños compuestos orgánicos que carecen de un alto grado de carga positiva. De éstos las fenilalquilaminas que contienen un nitrógeno básico son los mejor caracterizados (fig. 1).
Fig. 1. Estructura del clorhidrato de cinecalcet.
Los calciomiméticos de tipo fenilalquilaminas, como el NPS R-467 y el NPS R-568, son potentes y selectivos moduladores alostéricos del RSCa10 y son biodisponibles oralmente. Como muchas moléculas pequeñas que actúan sobre receptores acoplados a proteínas G, las fenilalquilaminas tienen estereoselectividad, de manera que el enantiómero R es por lo menos 10 veces más potente que el enantiómero S. El primer calciomimético en ser desarrollado fue el NPS R-56811. Si bien tenía una razonable potencia sobre el RSCa, carecía de efecto sobre otras proteínas G cuando se evaluó en condiciones similares. La administración del calciomimético NPS-568 por sonda nasogástrica a ratas con función renal y paratiroidea normal redujo los niveles de PTH dentro de los 15 minutos en una forma dosis dependiente, retornando luego a los niveles basales12. Dosis mayores produjeron reducciones más prolongadas en las concentraciones de PTH sérica. La disminución de la PTH sérica fue seguida por reducciones en la concentración del calcio sérico. La longitud de tiempo en que la PTH sérica permaneció por debajo del valor basal, como la duración de la hipocalcemia después de la administración del NPS-586, se incrementó progresivamente con el aumento en la dosis del fármaco12.
A pesar de que fue efectivo en estudios iniciales en seres humanos, el NPS-568 no se siguió desarrollando dado que tenía una farmacocinética inadecuada por su alta variabilidad13 y a que tenía interacciones con otros fármacos. Así se comenzó a estudiar otro calciomimético de tipo fenilalquilamina llamado AMG 073 (clorhidrato de cinacalcet) de mejor biodisponibilidad luego de su administración oral y de mejor perfil farmacocinético.
ESTUDIOS CLINICOS CON CINECALCET EN HIPERPARATIROIDISMO PRIMARIO
La seguridad y eficacia de cinecalcet en el tratamiento del hiperparatiroidismo (HPT) primario ha sido demostrado en varios estudios clínicos.
En un estudio clínico piloto, Shoback et al13 evaluaron la eficacia y seguridad de cinecalcet en 22 pacientes con HPT primario que fueron tratados con 30 (n:5), 40 (n:6), o 50 (n:5) mg de cinecalcet o placebo (n:6) dos veces durante 15 días. La PTH basal fue de 102 pg/ml y la calcemia basal de 10,6 mg/dl. Entre las 2 y 4 horas de la administración del fármaco, la PTH bajó un 45% y sólo un 2% en el grupo placebo. Los efectos adversos fueron leves, infrecuentes y primariamente relacionados con bajo calcio sérico total.
En un segundo estudio prospectivo doble ciego a 5 semanas, Shoback et al15 randomizaron 10 pacientes con HPT primario a recibir dosis orales de 65 mg de cinecalcet dos veces por día (6 pacientes) o placebo (4 pacientes) durante 4 semanas y luego los siguieron una semana más sin tratamiento. Al inicio los pacientes tenían calcio sérico superior a 11 mg/dl. Todos menos uno (83%) de los pacientes tratados con cinecalcet experimentaron reducción del calcio sérico al rango normal (≥ 10,3 mg%), comparado con 1 de 4 de los tratados con placebo (25%). El calcio sérico retornó a los niveles previos al tratamiento durante la semana de suspensión del fármaco. La reducción máxima de la PTHi con respecto a la basal fue de aproximadamente un 39% entre las 2 a 4 horas de la administración del cinecalcet. A los 28 días la PTHi promedio se había reducido en 14,5% ± 7,6% en el grupo con cinecalcet y se había incrementado en 10,6% ± 7,5% en el grupo placebo. El cinecalcet fue bien tolerado.
Peacock et al16 efectuaron un estudio prospectivo doble ciego de 24 semanas de duración en el que 78 pacientes con HPT primario con niveles de calcio sérico > a 10,3 y ≥ 12,5 mg/dl fueron randomizados a recibir dos veces por día 30 mg de cinecalcet o placebo. Las dosis fueron tituladas hasta 50 mg dos veces por día hasta alcanzar niveles de calcio sérico en el rango normal. Luego fueron tratados con una dosis fija durante 12 semanas (fase de mantenimiento). El 88% de los pacientes experimentaron una reducción del calcio sérico predosis de por lo menos 0,5 mg/dl y el calcio promedio predosis fue de ≥ 10,3 mg/dl a lo largo del período de mantenimiento comparado con sólo el 5% de los pacientes con placebo. Se observaron reducciones máximas de alrededor del 50% en la PTHi a las 2-4 horas de recibir cinecalcet. Las reducciones promedio de la PTHi a las 12 horas de la administración del fármaco durante el período de mantenimiento fueron del 7,6% ± 22,9%, mientras que el grupo placebo tuvo un incrementos de la PTHi del 7,7% ± 26,6% (p = 0,009). No hubo diferencias entre ambos grupos en el cambio con respecto al basal en la relación Ca/creatinina de 24 horas. Peacok et al17 evaluaron los mismos pacientes pero con 54 semanas de seguimiento (40 de mantenimiento): 90% de los pacientes permanecieron con la dosis de 30 mg dos veces por día y el resto requirió 40 mg dos veces por día. El cinecalcet redujo en forma significativa el calcio sérico y la PTHi sin cambiar la relación calcio urinario/creatinina comparado con placebo a lo largo del año de tratamiento. El cinecalcet incrementó significativamente la fosfata alcalina ósea y los N-telopéptidos séricos comparado con el placebo. A las 52 semanas, el cinecalcet redujo la PTHi en un 11,4% ± 17% mientras que no se modificó en el grupo placebo.
ESTUDIOS CLINICOS CON CINECALCET EN HIPERPARATIROIDISMO SECUNDARIO
Los resultados de estudios de fase II con cinecalcet también han mostrado ser prometedores en hiperparatiroidismo secundario a insuficiencia renal crónica.
Coburn et al18 efectuaron un estudio multicéntrico randomizado, doble ciego controlado con placebo en pacientes hemodializados con hiperparatiroidismo secundario a los cuales administraron 6 dosis simples secuenciales (5, 10, 25, 50, 75 y 100 mg) de cinecalcet o placebo. Las dosis de 25, 50, 75 y 100 mg causaron una reducción dosis dependiente en los niveles de PTHi plasmática, con una reducción máxima observada entre las 2 y las 4 horas de su administración seguida de una lenta recuperación de los niveles de PTHi pero sin llegar a los valores basales a las 24 horas. Las dosis simples de 75 y 100 mg redujeron los niveles de calcio plasmático en un 8,3% y 9,4% respectivamente.
En otro estudio Goodman et al18 evaluaron la respuesta a dosis simples y a dosis múltiples durante 8 días consecutivos del cinecalcet en pacientes hemodializados con valores plasmáticos de PTHi entre 250-1.500 pg/ml. En el estudio de dosis simples los pacientes recibieron dosis de 5, 10, 25, 50, 75 y 100 mg. Los valores de PTH se redujeron con las dosis de 25 a 100 mg, obteniéndose los mayores porcentajes de reducción entre las 2 y las 4 horas. Los valores de PTH permanecieron por debajo de los valores pretratamiento durante 24 horas en los pacientes que recibieron 25, 50 y 100 mg. En el estudio de dosis múltiples los pacientes fueron asignados a dosis de 10, 25 y 50 mg de cinecalcet o placebo. A tres de los pacientes inicialmente asignados a la dosis de 50 mg, se les tuvo que reducir la dosis a 25 mg, en un caso por desarrollar náuseas y en los otros dos por presentar calcemias inferiores a 8 mg%. Durante el primer día de tratamiento, las dosis de 25 y 50 mg se asociaron a reducciones en la PTH en promedio del 39,6% ± 33,1% y 44,5% ± 30,8% respectivamente a las 2 horas de la administración del fármaco. La disminución en los niveles de PTH con respecto a los valores basales a los 8 días de tratamiento fue del 28% ± 17% en el grupo de 25 mg, del 27% ± 34% en el grupo del 50 mg y del 34% ± 39% en el grupo 50/25 mg. El calcio sérico también disminuyó un 5% a 10% con respecto a los niveles pretratamiento en los pacientes a los que se les administró la dosis de 50 mg durante 8 días. Al octavo día los grupos que recibieron cinecalcet redujeron los niveles de fósforo sérico y producto calcio fósforo con respecto al basal.
Lindberg et al20 efectuaron otro estudio randomizado doble ciego controlado con placebo de incremento progresivo de las dosis (de 10 a 50 mg por día), con incrementos secuenciales de las mismas cada 3 semanas durante 12 semanas basados en la respuesta de la PTHi plasmática y en el perfil de seguridad (referido a desarrollo de hipocalcemia y efectos adversos). La dosis final de cinecalcet se mantenía luego por 6 semanas. Los 72 pacientes reclutados en este estudio continuaron con su tratamiento concomitante de quelantes de fósforo y vitamina D. Durante el período de mantenimiento hubo una disminución promedio del 26% en los niveles plasmáticos de PTH comparado con los valores basales mientras que se incrementó en un 22% en el grupo placebo. Al finalizar el período de mantenimiento el producto calcio fósforo se había reducido un 16,9% con respecto al basal mientras que se había incrementado un 11,4% en el grupo placebo. Los niveles de calcio sérico se redujeron en un 3,3% con respecto al basal y 3 de 38 pacientes tratados con cinecalcet desarrollaron hipocalcemia transitoria asintomática.
Debido al buen perfil de seguridad demostrado por el fármaco en el estudio anterior, Quarles et al21 repitieron el estudio pero administrando dosis progresivamente crecientes hasta alcanzar los 100 mg/día en 71 pacientes en hemodiálisis. Partiendo de PTHi basales de alrededor de 600 pg/ml, los 36 pacientes tratados con cinecalcet redujeron sus niveles en un 36% con respecto al basal en la fase de mantenimiento, mientras que el grupo placebo la incrementó en un 3%.
Recientemente se presentó un análisis combinado de tres estudios de fase II de administración de dosis crecientes de este nuevo calciomimético22. Los tres estudios partían de una dosis inicial de 20 mg de cinecalcet. Los incrementos secuenciales en la dosis podían producirse cada 3 semanas durante 12 semanas basados en la respuesta de la PTH y del perfil de seguridad. En el estudio europeo / australiano la dosis máxima a alcanzar era de 50 mg al igual que el estudio norteamericano / canadiense. El tercer estudio norteamericano permitía llegar hasta 100 mg. Se incluyeron en total 215 pacientes de los cuales 74 recibieron placebo y 141 cinecalcet. Para ingresar en los estudios los pacientes debían tener más de 300 pg/ml de PTH, calcio total mayor de 8,8 y menor de 11 mg/dl con producto Ca/P menor de 70 y una dosis estable de vitamina D durante 21 días precediendo el inicio del estudio. Comparado con el placebo, el cinecalcet redujo la PTH y el producto calcio fósforo en forma consistente a lo largo de las 12 semanas en los tres estudios. La PTH promedio se redujo en un 20% a 33% en los grupos con cinecalcet y se incrementó en un 16% en los grupos placebo. EL 83% de los pacientes tratados con cinecalcet tuvieron reducciones iguales o mayores al 30% en algún momento de las 12 semanas de estos estudios. El producto calcio fósforo disminuyó en el grupo cinecalcet en un 7,1% y se incrementó en el grupo placebo en un 14%
PERSPECTIVAS FUTURAS
Los estudios clínicos anteriormente mencionados demuestran que agentes calciomiméticos como el clorhidrato de cinecalcet reducen efectivamente los niveles plasmáticos de PTHi en pacientes con hiperparatiroidismo primario y secundario de distinto grado de intensidad con un perfil adecuado de seguridad. Si bien estos agentes reducen los niveles de calcio sérico, esto no parece representar un problema clínico para su administración. Es más, a pesar de los menores niveles de calcio sérico siempre hubo una consistente supresión de los niveles de parathormona. Por lo tanto los agentes calciomiméticos se agregarán en el futuro al arsenal terapéutico para el tratamiento no quirúrgico del hiperparatiroidismo primario y del secundario a la insuficiencia renal crónica23.