El propósito de la revisión es mostrar las características de imagen que presentan los tumores corticosuprarrenales pediátricos (TCSP).
Material y métodosSe realiza una revisión retrospectiva de los pacientes diagnosticados de TCSP en nuestro hospital terciario en el periodo comprendido entre los años 2000 y 2010, desde el punto de vista radiológico y anatomopatológico.
Se estudian las características radiológicas mediante ecografía, tomografía computarizada (TC) y resonancia magnética (RM), que ayudarán a orientar la lesión hacia benignidad o malignidad, y el seguimiento de imagen.
ResultadosSe presentan 8 TCSP: 5 carcinomas, 2 adenomas y un tumor borderline; se clasifican 2 en estadio I, uno en estadio II, 3 en estadio III y 2 en estadio IV.
La radiología permitió el diagnóstico de carcinoma en estadio IV en 2 casos, dada la presencia de metástasis iniciales en un paciente y el gran tamaño y desestructuración tumoral en otro, desarrollando posteriormente metástasis. En los otros 6 casos el diagnóstico radiológico fue de aproximación respecto a su naturaleza de carcinoma o adenoma.
ConclusionesLos TCSP son raros en la infancia. Engloban las entidades de adenoma y carcinoma, siendo difíciles de diferenciar histológica y radiológicamente en ausencia de infiltración vascular y/o metástasis. En un paciente en edad pediátrica la combinación de una masa suprarrenal y signos clínicos de hiperfunción corticosuprarrenal es virtualmente diagnóstica de TCSP.
This article aims to show the imaging characteristics of pediatric adrenocortical tumors.
Material and methodsWe review the imaging and histological findings in patients diagnosed with pediatric adrenocortical tumors at our tertiary hospital between 2000 and 2010. We analyze the findings at ultrasonography, computed tomography, and magnetic resonance imaging that can help orient the diagnosis toward benign or malignant lesions and guide imaging follow-up.
OutcomeWe found 8 adrenocortical tumors in children: 5 carcinomas, 2 adenomas, and 1 borderline tumor. Two tumors were classified as stage I, 1 as stage II, 3 as stage III, and 2 as stage IV.
Imaging enabled the diagnosis of stage IV carcinoma in 2 cases, due to the presence of initial metastases in one patient and to size of the tumor and structural changes in the other, who later developed metastases. In the other 6 cases, the imaging studies oriented the diagnosis toward carcinoma or adenoma.
ConclusionsAdrenocortical tumors are rare in children. Adrenocortical tumors include adenomas and carcinomas, and in the absence of vascular infiltration and/or metastases it is difficult to differentiate between the two types by imaging and histology. The combination of an adrenal mass and clinical signs of adrenocortical hyperfunction in a child is virtually diagnostic of an adrenocortical tumor.
Los tumores corticosuprarrenales pediátricos (TCSP) constituyen solo un 0,2% del total de las neoplasias pediátricas malignas1. La incidencia es llamativamente elevada en una región de Brasil, por lo que parecen conllevar un componente genético-ambiental1–3.
La clínica habitual es la manifestación de alteraciones endocrinas: en menores de 5 años inducen signos y síntomas de virilización que pueden ir acompañados de hipersecreción de otras hormonas suprarrenales1,2.
Es difícil diferenciar entre adenoma y carcinoma, tanto histológica como radiológicamente2. La presencia de metástasis y/o infiltración vascular es muy sugerente de malignidad.
La curación de los TCSP requiere resección completa. El papel de la quimioterapia y la radioterapia aún no está establecido2, aunque se han publicado respuestas definitivas a algunos fármacos como el mitotane1.
La combinación de una masa suprarrenal y signos de hiperfunción corticosuprarrenal en la edad pediátrica es muy sugestiva de TCSP.
El propósito de la revisión es mostrar las características de imagen que presentan los TCSP.
Material y métodosRealizamos un estudio retrospectivo de la casuística de TCSP en nuestro hospital pediátrico de tercer nivel, durante el periodo comprendido entre los años 2000 y 2010.
Se recogieron los TCSP clasificados por anatomía patológica como adenomas y carcinomas, excluyendo cualquier otro tipo histológico de masa suprarrenal (neuroblastoma, oncocitoma, feocromocitoma y metástasis).
Se realizó una nueva comprobación de las muestras anatomopatológicas de los pacientes inicialmente clasificados como TCSP, según los criterios diagnósticos propuestos en la actualidad para diferenciar entre adenoma y carcinoma4,5.
Se estudiaron los resultados de los estudios de ecografía, TC y RM de los 8 pacientes diagnosticados de TCSP con la finalidad de aunar datos para la distinción entre adenoma y carcinoma. Los estudios se realizaron con un ecógrafo Toshiba Applio XU, un equipo de TC BrightSpeed 16 de General Electric (los estudios entre 2000-2005, en TC Phillips secuencial) y un equipo de RM Phillips Achieva de 1.5 T. Con las 3 técnicas se valoraron las variables de tamaño (diámetro longitudinal máximo), bordes (bien o mal delimitados, lisos o lobulados), características internas de la masa (sólida homogénea o heterogénea, necrosis, hemorragia, áreas quísticas, calcificación), vascularización en la ecografía y comportamiento con contraste en TC/RM, infiltración de órganos vecinos (riñón, hígado, páncreas, bazo, diafragma), e infiltración o trombosis vascular. Todos los pacientes fueron estudiados al diagnóstico mediante ecografía Doppler color, 4 pacientes tenían un estudio de TC abdominal con contraste intravenoso (IV) y 4 pacientes un estudio de RM abdominal sin y con contraste IV siguiendo el protocolo tumoral establecido; los 8 presentaban seguimiento mediante ecografía y RM. No se realizó un seguimiento reglado con TC.
Resultados (tabla 1)La edad media al diagnóstico fue de 4,9 años (27 días-12 años). De los casos recogidos, 5 eran mujeres y 3 varones, siendo la relación 1,66/1.
Pacientes con tumores corticosuprarrenales de nuestro registro en el periodo 2000-2010
| N.° | Edad/sexo | Clínica | Radiología al diagnóstico | Anatomía patológica | Tratamiento | Evolución |
| 1 | 15 mesesM | Virilización | Masa derecha de 4,8cm, bien delimitada, heterogénea. Escaso realce con contraste | Carcinoma CSR(E III)Pieza fragmentada | QxRecidiva: QT | Trombo tumoral en VCI a los 2 meses de la cirugíaLibre de enfermedad |
| 2 | 4 años 4 mesesV | Virilización | Masa derecha de 5cm, bien delimitada, heterogénea, realce heterogéneo | Carcinoma CSR(E III)5cm, 90 g | QxRecidiva: 2.ª Qx + QT post | Recidiva local con masa de 3cm a los 2 añosLibre de enfermedad |
| 3 | 15 mesesM | Virilización | Masa derecha de 7,5cm, bien delimitada, homogénea. Realce homogéneo y débil | TCSP atípico (potencial maligno incierto)(E II)8cm, 210 g | Qx | Libre de enfermedad |
| 4 | 11 añosV | Enuresis nocturna | Masa derecha de 3cm, bien delimitada, homogénea. Calcificaciones centrales. Realce capsular | Adenoma(E I)3 cm | Qx | Libre de enfermedad |
| 5 | 27 díasM | Hh | Masa izquierda de 4cm, bien delimitada, homogénea. Pobre realce | Adenoma(E I)4 cm | Qx | (Hepatoblastoma en la evolución)Libre de enfermedad |
| 6 | 9 añosM | Masa palpable e HTA | Masa derecha de 18,5, borde lobulado, heterogénea, calcio abundante y realce heterogéneo con contraste | Carcinoma CSR(E IV)17cm, 1.400 g | QT pre + Qx + QT post | LOE hepáticas en la evoluciónFallecimiento |
| 7 | 12 añosM | Metrorragia prolongada | Masa derecha de 8cm, bien delimitada, homogénea. Calcificaciones centrales. Realce escaso. Trombosis tumoral parcial de VCI | Carcinoma CSR(E III)9cm, 160 g | QT pre + Qx + QT post | Exéresis parcial de VCILibre de enfermedad |
| 8 | 11 añosV | Astenia y anorexia | Masa derecha de 14,5cm, borde lobulado, heterogénea, invade y trombosa VCI desde aurícula a ilíacas, afectando ilíaca interna derecha y suprahepática derecha.Nódulos pulmonares milimétricos por metástasis hematógenas | Carcinoma CSR(E IV)10cm, 220 g | QT pre + Qx + QT post | Desaparición de nódulos pulmonares y disminución de diámetro tumoral tras QT. Resección tumoral completa + extirpación de VCI entre suprahepáticas y renales, con colocación de prótesisFallecimiento |
CSR: adrenocortical; E: estadificación tumoral; Hh: hemihipertrofia; HTA: hipertensión arterial; LOE: lesión ocupante de espacio; M: mujer; QT: quimioterapia; Qx: cirugía; V: varón; VCI: vena cava inferior.
El diámetro tumoral, estimando la media entre los diámetros máximos adquiridos mediante ecografía, TC y RM, osciló entre 3-18,5 cm; el de las piezas extirpadas fue menor en 2 pacientes sometidos a quimioterapia prequirúrgica, debido a la reducción de tamaño inducida por el tratamiento (casos 6 y 8). En aquellos en los que la pieza llegó completa a anatomía patológica, el peso estuvo entre 90-1,400g.
Todos presentaron límites tumorales bien definidos; en 2 carcinomas se apreció un borde lobulado con las 3 técnicas de imagen (casos 6 y 8).
No se constató una infiltración de órganos adyacentes mediante ecografía y TC o RM, excepto la infiltración tumoral de la vena cava inferior (VCI), mostrada en 2 casos al diagnóstico (casos 7 y 8) y en uno en el seguimiento (caso 1). Se constató la naturaleza tumoral de estas trombosis mediante ecografía Doppler color al demostrar la vascularización del trombo.
Cuatro lesiones eran heterogéneas al presentar focos de necrosis y hemorragia y 4 eran preferentemente homogéneas. Mediante ecografía y TC se apreciaron calcificaciones significativas en 3 masas, siendo en una de ellas muy groseras (caso 6). El realce con contraste fue heterogéneo y escaso en 5 pacientes correspondientes a carcinomas en estadios III y IV, capsular en uno (caso 4) y homogéneo y débil en 2 pacientes (casos 3 y 5).
Histológicamente correspondieron a 2 adenomas (fig. 1), 5 carcinomas (figs. 2 y 3) y un tumor tipificado como «atípico con potencial maligno incierto» o borderline.
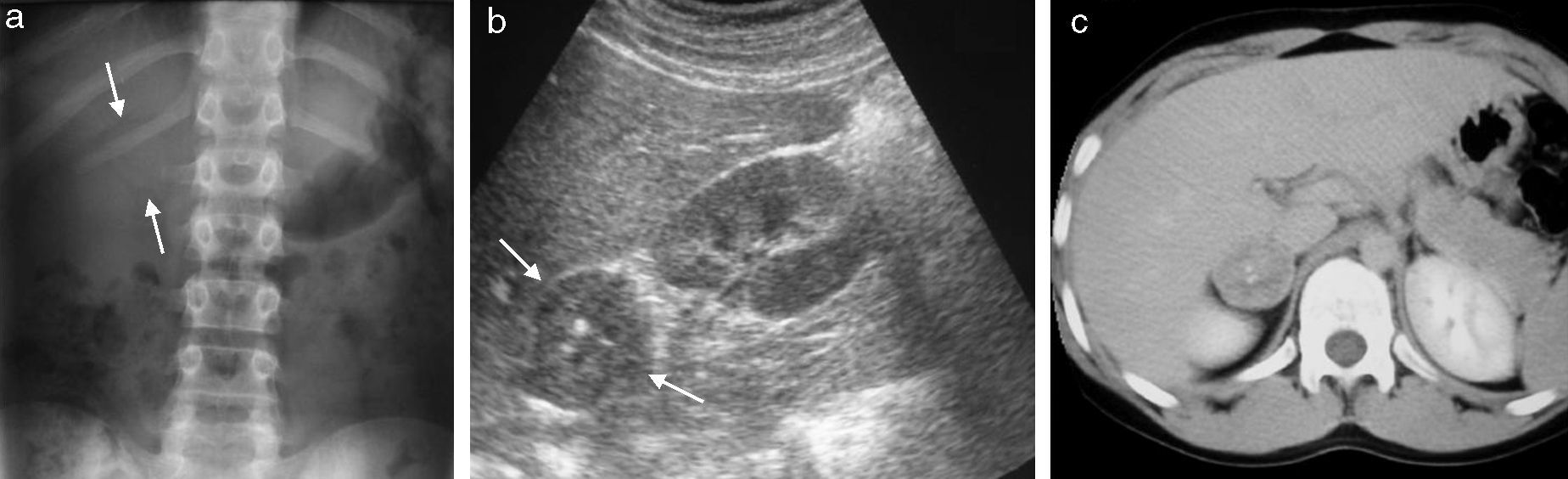
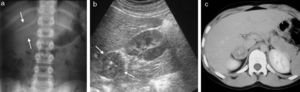
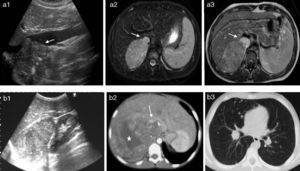
Adenoma suprarrenal (caso 4). a) En la radiografía de abdomen se observa un aumento de densidad en el área suprarrenal derecha (flechas). b) La ecografía muestra una masa suprarrenal sólida (flechas), bien delimitada, homogénea, con calcificaciones centrales. c) La TC con contraste IV en fase tardía muestra el realce capsular del tumor y el menor realce central, con las calcificaciones internas.
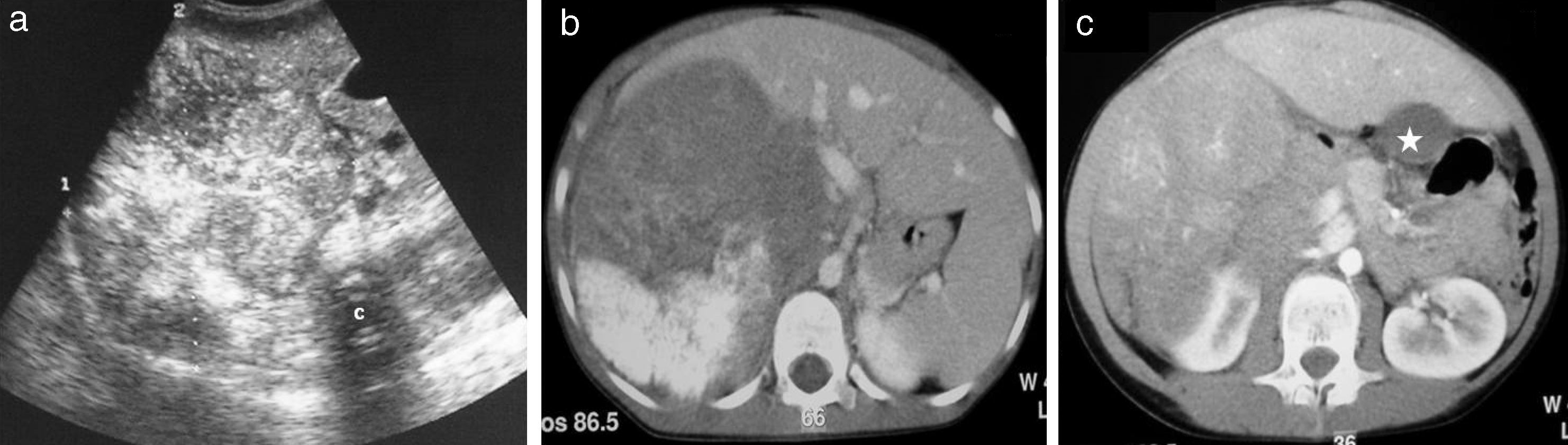
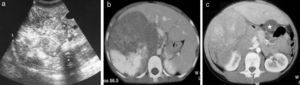
Carcinoma suprarrenal (caso 6). a) Plano ecográfico axial infrahepático que muestra una tumoración de 18,5cm de diámetro máximo, con extensa calcificación. b) La TC con contraste intravenoso en un nivel similar al de la ecografía muestra la heterogeneidad en el realce tumoral y las calcificaciones. c) En el plano inferior se observa mejor la forma lobulada del borde neoplásico. Se aprecia un desplazamiento de los vasos retroperitoneales, con una lateralización medial de la VCI, sin desplazamiento anterior, por tratarse de un tumor suprarrenal. Desplazamiento craneal y contralateral del hígado y la vesícula hacia el hipocondrio izquierdo (asterisco), y caudal del riñón derecho, por el gran efecto de masa tumoral.
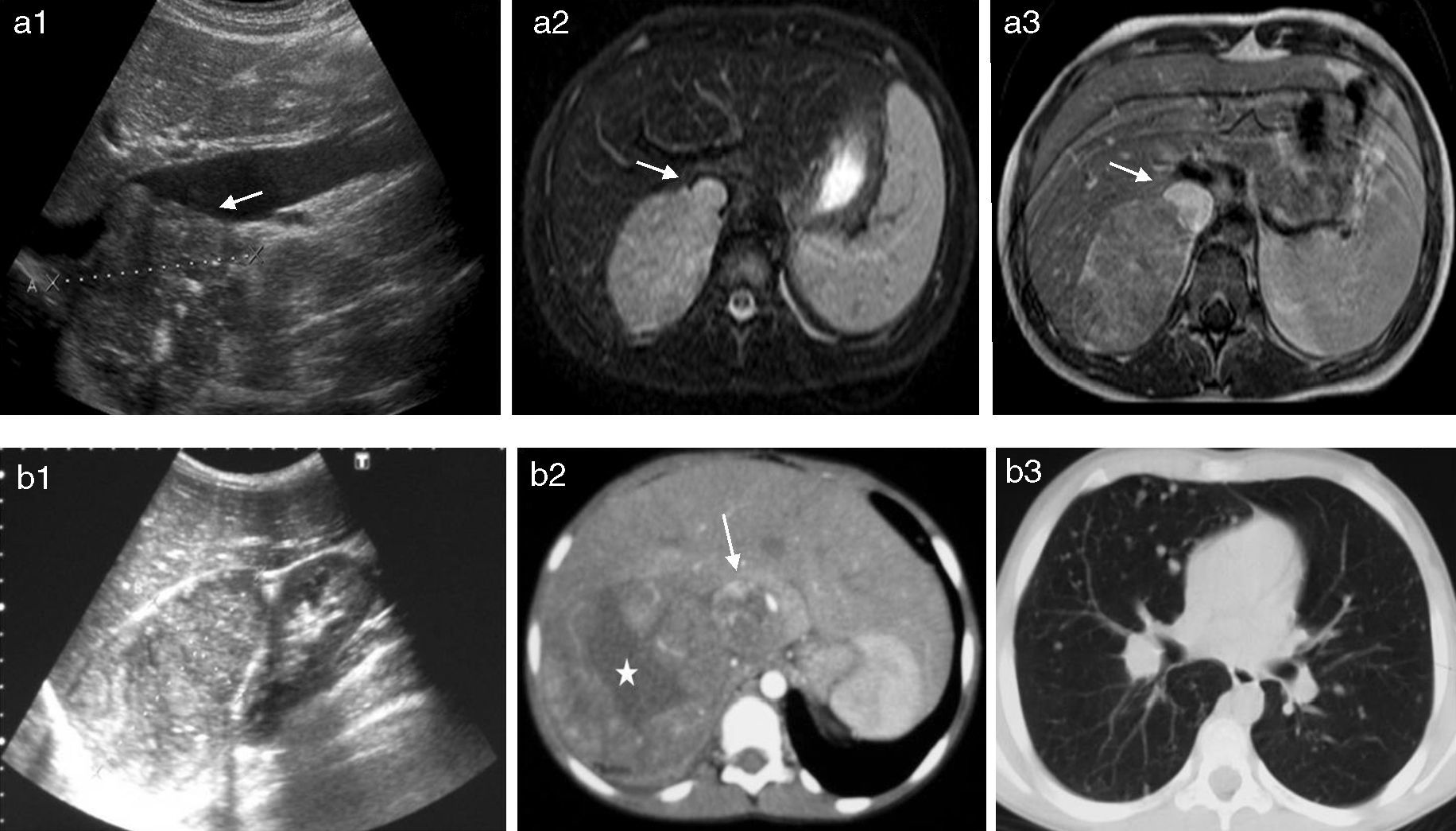
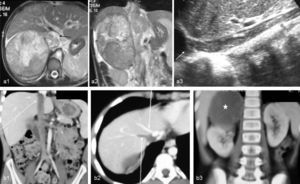
Carcinoma suprarrenal con invasión vascular y metástasis (casos 7 y 8). a1-a3) La ecografía muestra la masa suprarrenal con calcificaciones ecogénicas y la impronta que produce en la luz de la VCI (flecha) (a1). La RM en plano axial con secuencias T2 con supresión grasa (a2) y T1 con contraste (a3) muestra la masa suprarrenal derecha, sólida, bien delimitada, así como la trombosis parcial de la VCI con aumento de calibre de la misma y alteración de la señal luminal (flechas). b1-b3) Ecografía de la zona más inferior del tumor (b1). El plano ecográfico mostrado es muy útil para determinar la localización suprarrenal de la masa, descartando un origen renal o hepático, así como la infiltración de estos órganos, dado que las 3 masas se mueven independientemente con las incursiones respiratorias. En la TC con contraste IV en la región craneal del tumor (b2) se observa la marcada heterogeneidad con un área central sin realce debido a necrosis (asterisco), así como el aumento de calibre de la VCI por invasión y trombosis tumoral (flecha). TC de tórax en ventana de parénquima (b3) donde se aprecian múltiples nódulos milimétricos indicativos de diseminación hematógena. (Fig. 3b3, Reimpresión con permiso concedido por Springer Science + Business Media: Martínez et al. Learning Pediatric Imaging. Capítulo 6: Tumoral Abdomen, vol. 1, 2011, p. 10, caso 6.5, Romero Chaparro S, Martínez León MI, fig. 6.20.)
Los pacientes con TCSP fueron clasificados: 2 en estadio I, uno en estadio II, 3 en estadio III y 2 en estadio IV. Todos los tumores englobados como III y IV correspondieron a carcinomas, y los estadio I a adenomas.
En el momento del diagnóstico uno de los niños presentó metástasis pulmonares y una trombosis tumoral de la VCI (figs. 3 y 4) y otro, una trombosis parcial de la VCI (fig. 3).
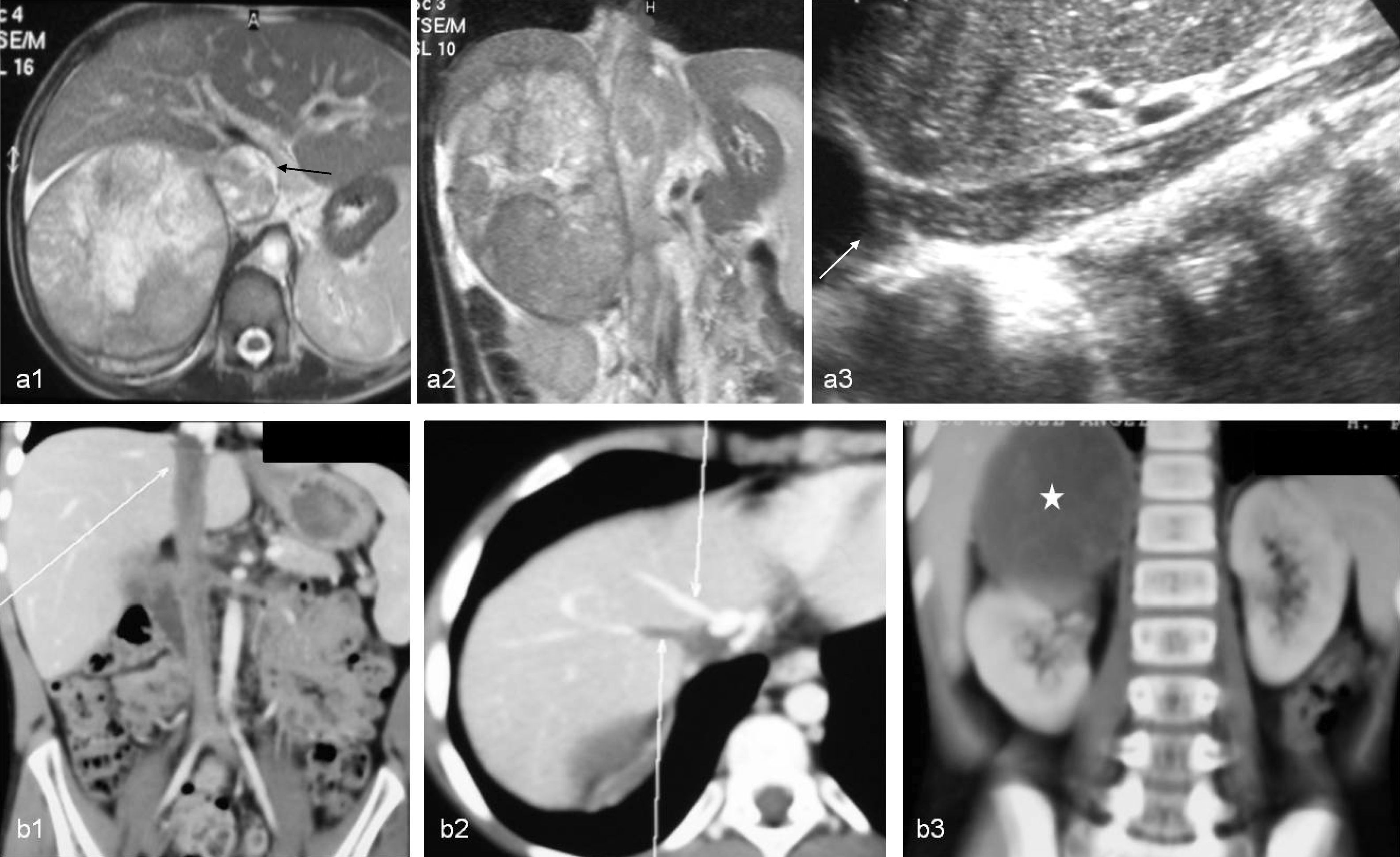
Trombosis tumoral de la VCI (caso 8). a1-a3) La RM con secuencias TSE T2 en planos axial (a1) y coronal (a2), y la ecografía en el plano sagital (a3) muestran el aumento de diámetro de la VCI por trombosis (flecha negra) y la posición superior del trombo apuntando a la aurícula derecha (flechas blancas), con diámetro craneocaudal que alcanza 14cm hasta la vena ilíaca interna.
b1-b3) La angio-TC con contraste IV delimita la persistencia del trombo en la VCI tras 7 ciclos de quimioterapia, con extensión craneal hacia la VCI torácica (flecha en la reconstrucción coronal) (b1) y la inclusión trombótica de la suprahepática derecha no realzada, en contraste con la suprahepática media con realce, en la visión axial (b2). Se observa la reducción de tamaño tumoral tras el tratamiento quimioterápico (incluyendo mitotane) previo a la intervención (asterisco) (b3).
Todos fueron tratados con resección quirúrgica. En 3 casos se requirió quimioterapia prequirúrgica y en 5 fue preciso completar con quimioterapia posquirúrgica por restos, recidiva, metástasis o trombosis tumoral.
En la evolución un niño desarrolló metástasis hepáticas y otro una trombosis parcial de la VCI.
Los 2 pacientes que fueron clasificados en estadio IV han fallecido. Los clasificados en estadios I, II y III se encuentran libres de enfermedad, con un seguimiento que alcanza un máximo de 7 años.
DiscusiónLos TCSP se caracterizan por presentar un comportamiento clínico y radiológico variado1–3, hecho que queda reflejado en nuestra serie en la que se observó desde un TCSP con histología de adenoma en un neonato con hemihipertrofia (caso 5), pasando por un tumor virilizante en un paciente menor de 5 años, con recidiva local y libre de enfermedad en el seguimiento (caso 2), hasta un TCSP no secretor en un preadolescente, de gran tamaño, invasión de la VCI, metástasis pulmonares y evolución hacia la muerte (caso 8).
Con la finalidad de unificar criterios en la valoración de estos tumores, en 1990 se desarrolló un Registro Internacional1,3,6,7.
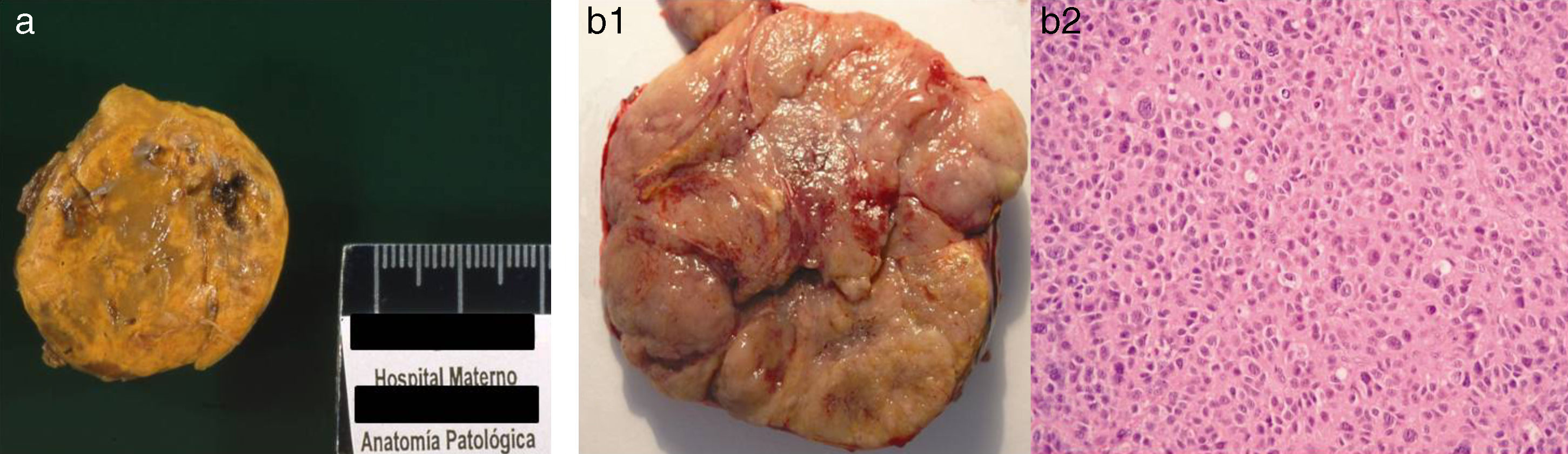
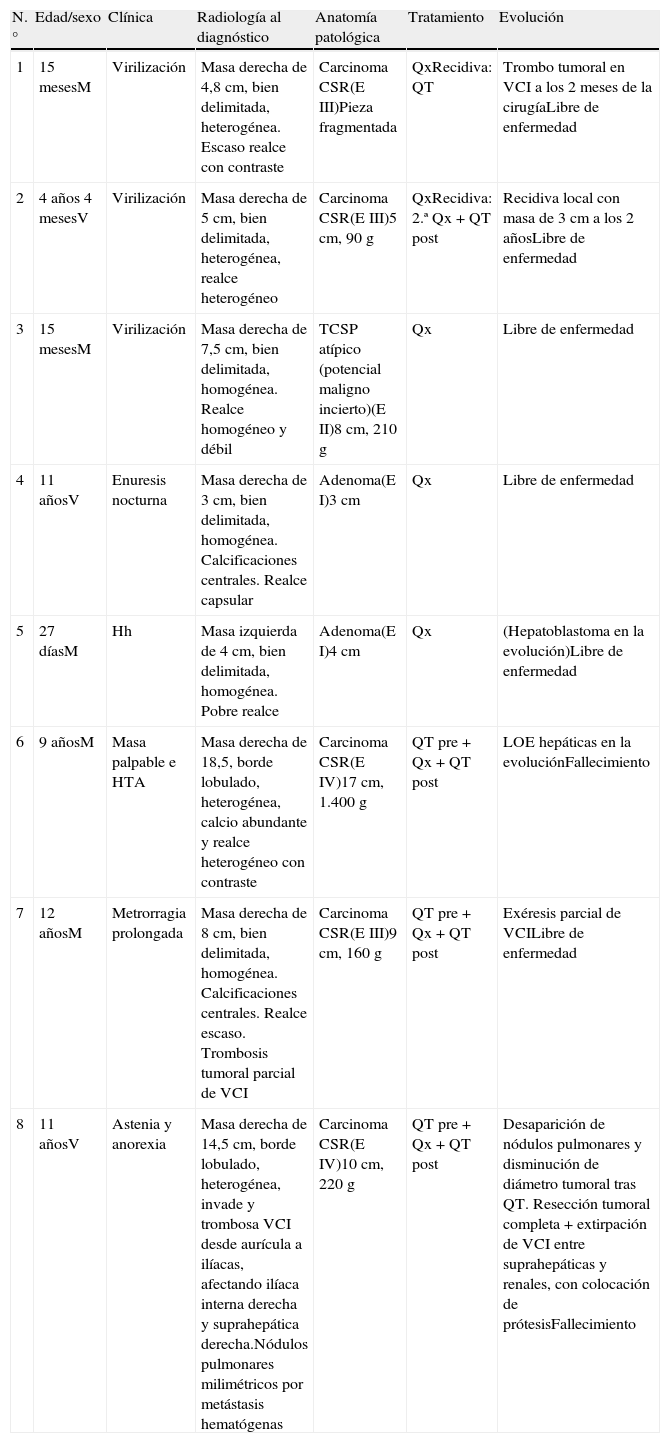
Desde el punto de vista histológico, los TCSP incluyen 2 subtipos: adenoma y carcinoma2 (fig. 5). Los adenomas representan el 10-15% de los TCSP y son predominantemente funcionantes, macroscópicamente bien delimitados, no infiltran los tejidos adyacentes, su tamaño es relativamente pequeño (< 10 cm) y su peso oscila entre 11-210 g; microscópicamente no presentan necrosis, ocasionalmente tienen hemorragia, calcificación o bandas de fibrosis. Los carcinomas macroscópicamente muestran signos indicativos de malignidad como gran tamaño, contornos lobulados, áreas de necrosis y hemorragia interna. Microscópicamente presentan atipia nuclear, pleomorfismo, formas multinucleadas, mitosis atípicas, invasión capsular y vascular1–5. Aunque adenoma y carcinoma son entidades diferentes, su distinción histológica resulta difícil1,4,5, y serán la pieza y la evolución tumoral las que muestren el diagnóstico definitivo. Por ello, en la edad pediátrica se utiliza el término «tumores corticosuprarrenales» englobando tanto tumores malignos como benignos2.
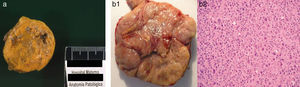
Anatomía patológica de un adenoma (caso 4) y un carcinoma (caso 7) corticosuprarrenal. a) Foto macroscópica de un adenoma, tumoración sólida bien delimitada, de pequeño tamaño (3 cm) y coloración amarillenta.
b1-b2) Foto macroscópica de un carcinoma, tumoración sólida con áreas de necrosis y hemorragia, diámetro máximo de 9cm y peso de 160g. Foto microscópica (HE, x20), en esta zona de la neoplasia destaca la atipia citológica.
Los estudios de imagen sirven para la confirmación del tumor, permiten el planteamiento quirúrgico y ayudan en la estadificación. Aportan información sobre las características de resecabilidad como el tamaño tumoral, la invasión de estructuras cercanas y la invasión-trombosis vascular (casos 1, 7 y 8)8–10. Se realiza un estudio de tórax en la valoración inicial ya que es el lugar más común de metástasis, seguido del hígado1,2,11,12.
En función de las siguientes características radiológicas se puede inicialmente plantear un subtipo histológico u otro de TCSP, con un tratamiento y pronóstico radicalmente diferentes:
- –
Tamaño tumoral: el tamaño, medido como diámetro longitudinal mayor en la radiología, es un dato con valor predictivo valorado en peso o volumen en la pieza para la estadificación, con cifras diferentes según distintos autores1,3,10,12,13. Aunque en nuestra serie hubo carcinomas con diámetros menores de 5cm, ningún adenoma presentó medidas que superaran los 5cm. Es un dato no decisivo según la literatura médica, pero sí orientativo.
- –
Límites tumorales: en las 3 técnicas de imagen suelen ser tumores de bordes bien delimitados, no infiltrantes. La morfología lobulada del tumor es, en cierto modo, indicativa de mayor agresividad al acompañar generalmente a una masa de más tamaño. Son 2 características unidas, diámetro (mayor de 10 cm) y borde lobulado, que juntas se muestran en 2 de nuestros carcinomas (casos 6 y 8) y en ninguno de los TCSP de grado I o II.
- –
Características internas: los TCSP son masas sólidas homogéneas o heterogéneas por contener necrosis, hemorragia, áreas quísticas y/o calcio. Los tumores grandes suelen presentar un área central estrellada de diferente ecogenicidad/densidad/señal causada por hemorragia y necrosis2,10,14, como fue el patrón predominante en los carcinomas de diámetro elevado de nuestra serie. Las calcificaciones son frecuentes y aparentemente independientes de su histología benigna adenomatosa o maligna carcinomatosa, y pueden encontrarse desde pequeñas inclusiones focales (caso 4, adenoma) a extensos depósitos amorfos (caso 6, carcinoma).
- –
Invasión local y adenopática: la infiltración de órganos vecinos y la diseminación linfática son datos que conllevan peor pronóstico según la literatura médica. En nuestra corta serie ningún paciente presentó estas características invasivas.
- –
Infiltración-trombosis vascular: la ecografía es la primera prueba de imagen para su valoración, además permite diferenciar mediante Doppler color trombos tumorales (vascularizados) de trombos no tumorales (avasculares)2,10,15. En nuestra serie los 3 trombos presentados eran tumorales y se presentaron en el contexto histológico de carcinoma. Es un dato indicativo de agresividad tumoral.
Otros datos, no radiológicos, que conforman el contexto tumoral y han de incluirse en la valoración conjunta de los TCSP son:
- –
La edad pediátrica de presentación es en los primeros 4-5 años, aunque existe un segundo pico durante la adolescencia1,3. La edad de nuestra serie pediátrica sigue los resultados referenciados en la literatura médica. Se ha comunicado por algunos autores que una edad inferior a 5 años se asocia a un mejor pronóstico1,2, dato que no es constatable en nuestra serie.
- –
Clínicamente suelen presentar signos y síntomas de virilización en relación con la sobreproducción de andrógenos hasta en un 90%1–3,8. Únicamente un 10,2% de los pacientes pediátricos presentan tumores no funcionantes, siendo más habitual en niños mayores3 (caso 8). El tipo de hormona secretada parece relacionarse con el pronóstico, los tumores productores de glucocorticoides tienen peor pronóstico que los que secretan únicamente andrógenos, ningún caso de nuestra serie.
- –
Asociaciones sindrómicas. Se constata en la literatura científica la asociación entre TCSP y hemihipertrofia, síndrome de Li-Fraumeni y síndrome de Beckwith Wiedemann, siendo menor la asociación con el complejo de Carney, hiperplasia suprarrenal congénita, ganglioneuroma, ganglioneuroblastoma y síndrome MEN I1,2,16,17. En nuestra serie solo se encontró una de estas asociaciones sindrómicas con hemihipertrofia (paciente 5).
La estadificación de los TCSP, modificada en varias ocasiones3,12, se basa en la premisa de que la resección completa y el tamaño tumoral son los factores principales, por lo que la imagen tiene un papel tanto en el estudio prequirúrgico (tamaño) como en el posquirúrgico (valoración de restos tumorales).
El tratamiento de elección es la cirugía1,2,9,18,19, con excelentes resultados cuando el tumor presenta un estadio bajo y se consigue una resección completa13,20. El papel de la quimioterapia y radioterapia no está evaluado sistemáticamente1,2,20. El mitotane es un isómero del insecticida DDT que induce la necrosis corticosuprarrenal1,5,9. En nuestra serie se utilizó mitotane en los casos 6 y 8, ambos en estadio IV al diagnóstico.
Respecto a los factores pronósticos, la resección completa es el indicador principal1,13,20, por ello los estudios de imagen de seguimiento son tan importantes.
En resumen, puede afirmarse que diferenciar radiológicamente entre adenoma y carcinoma es difícil en ausencia de metástasis o infiltración vascular. Un gran tamaño de la masa, la heterogeneidad lesional interna y el borde lobulado son características radiológicas que pueden inclinar la sospecha hacia carcinoma en vez de adenoma.
Dadas las alteraciones clínicas y de laboratorio que presentan los niños con TCSP, los pacientes suelen llegar ya al Servicio de Radiología con el diagnóstico de presunción de tumoración suprarrenal1,3,9. En un paciente pediátrico la suma de una tumoración suprarrenal y signos y síntomas de hiperfunción corticosuprarrenal, es diagnóstica de TCSP.
Autoría- 1.
Responsable de la integridad del estudio: MIML.
- 2.
Concepción del estudio: MIML.
- 3.
Diseño del estudio: MIML.
- 4.
Obtención de los datos: MIML, SRC.
- 5.
Análisis e interpretación de los datos: MIML, SRC, WL, LCR.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: MIML, WL.
- 8.
Redacción del trabajo: MIML.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MIML, SRC, WL, LCR, MDDP, OES.
- 10.
Aprobación de la versión final: MIML, SRC, WL, FIC, LCR, MDDP, OES.
Los autores declaran no tener ningún conflicto de intereses.