Las técnicas percutáneas y endovasculares son importantes en el tratamiento de los pacientes con hepatocarcinoma. Los diferentes métodos de ablación percutánea, especialmente indicados en tumores de hasta 2cm de diámetro, ofrecen resultados, cuanto menos, similares a los de la resección quirúrgica. Aprovechando la doble vascularización hepática y la nutrición tumoral exclusiva por la arteria se han desarrollado varias maneras de tratar, endovascularmente, al tumor. La administración intraarterial de partículas embolizantes, solas o cargadas con fármaco (quimioembolización), producirá isquemia y necrosis con excelentes resultados en pacientes con hepatocarcinoma multinodular en estadio intermedio (BCLC-B). Determinado tipo de partículas pueden ser exclusivamente vehiculantes de un agente terapéutico; cuando se les incorpora un radioisótopo facilitan la irradiación selectiva intratumoral directa (radioembolización). Esta técnica ha demostrado su eficacia en lesiones que no pueden ser tratadas con otros métodos, y debería considerarse, junto con la ablación y la quimioembolización, en los algoritmos terapéuticos del hepatocarcinoma.
Percutaneous and endovascular techniques take an important role in the therapeutic management of patients with hepatocarcinoma. Different techniques of percutaneous ablation, especially indicated in tumors up to 2cm diameter offer, at least, similar results to surgical resection. Taking advantage of double hepatic vascularization and exclusive tumor nutrition by the artery, several endovascular techniques of treating the tumor have been developed. Intra-arterial administration of embolizing particles, alone or charged with drug (chemoembolization), will produce ischemia and consequent necrosis with excellent results in selected patients. Certain types of particles may exclusively be carriers of a therapeutic agent when they incorporate a radioisotope that facilitates the direct intratumoral selective irradiation (radioembolization). This technique has demonstrated its efficacy in lesions not susceptible to be treated with other methods and should be considered, together with ablation and chemoembolization, in the therapeutic algorithms of hepatocarcinoma.
En un reciente estudio que analiza los 100 artículos radiológicos más citados en un periodo de 67 años (1945-2012), el grupo más frecuente, con 15 artículos, es la radiología intervencionista1. Tras los grandes clásicos, como son los trabajos de Seldinger (3°) y Hounsfield (4°), aparecen siete artículos (Livraghi y Solbiati) cuyo tema central es el tratamiento del hepatocarcinoma (CHC) mediante técnicas de ablación percutánea. Este es un buen ejemplo de la alta implicación, durante décadas, de la radiología intervencionista en el manejo multidisciplinario del CHC.
El hígado presenta características únicas con respecto a otras vísceras: gran plasticidad, que permite su hipertrofia/hiperplasia frente a actuaciones externas, y doble aferencia vascular. En los hígados no cirróticos, el mayor aporte sanguíneo vendrá desde la vena porta (75%), y en los tumores >5mm su vascularización dependerá, casi en exclusiva, de la arteria hepática. Esto permitirá tratar selectivamente lesiones por vía endovascular (técnicas de infusión y de embolización), manteniendo indemne el parénquima sano.
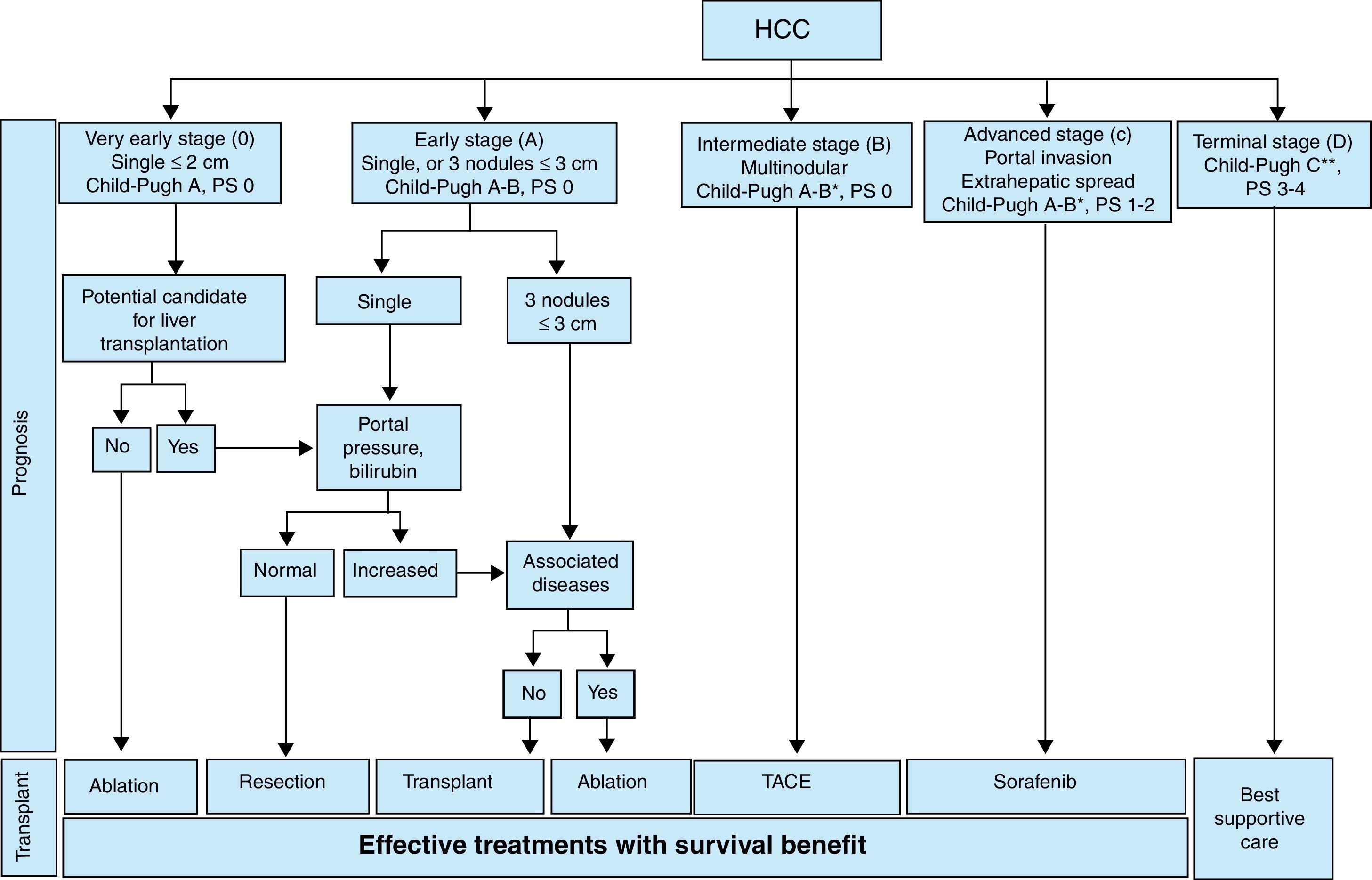
Tanto las técnicas de ablación percutánea como las endovasculares están bien representadas en las guías de actuación clínica para el CHC (Barcelona Clinic Liver Cancer, BCLC) (fig. 1). Esta guía contempla tres aspectos fundamentales: el número, el tamaño y la extensión del/de los tumor/es; la función del órgano (Clasificación de Child-Pugh); y la situación clínica (PS, performance status). Agrupa a los pacientes, dependiendo de sus características, en cinco grandes divisiones, y hace una serie de recomendaciones2.
El primer grupo es el «muy precoz» (BCLC-0) e incluye a tumores únicos, <2cm, con función hepática conservada (Child-Pugh A y PS 0). Dependiendo de que el paciente sea candidato a trasplante hepático o no, el tratamiento incluye resección quirúrgica o ablación, respectivamente. En este grupo, el trasplante hepático estará indicado en pacientes candidatos con hipertensión portal e hiperbilirrubinemia. El segundo grupo es el «precoz» (BCLC-A) e incluye a tumores únicos (cualquier tamaño) o hasta tres nódulos ≤3cm, con función hepática no deteriorada (Child-Pugh A-B y PS 0); el tratamiento de elección podrá ser la resección quirúrgica, el trasplante o la ablación. Cuando las técnicas denominadas «curativas» no pueden aplicarse, el tratamiento será el método recomendado en el siguiente grupo («migración de estadio de tratamiento»)3.
Los tumores multinodulares, que no se incluyan en BCLC-A, sin invasión portal ni enfermedad extrahepática, se denominan «intermedios» (BCLC B), y su tratamiento, ya paliativo, será la quimioembolización. Los tumores, únicos o múltiples (Child-Pugh A-B), de cualquier tamaño, que presenten invasión portal, enfermedad extrahepática o deterioro de la situación clínica (PS 1-2), se agrupan como «avanzados» (BCLC-C) y su tratamiento recomendado es el sorafenib. Por último, cuando la función hepática está muy deteriorada (Child-Pugh C), con alteración clínica grave (PS 3-4), se consideran «terminales» (BCLC-D) y su manejo contempla medidas de soporte2,3.
Ablación tumoralEl trasplante hepático es el tratamiento de elección para un nódulo solitario <5cm y para ≤3 nódulos ≤3cm, en los que no está indicado la resección, la cual solo está indicada en pacientes con un único nódulo y una función hepática muy preservada (bilirrubina normal con gradiente presión venosa ≤10mmHg o ≥100.000 plaquetas)2,3. La escasez de donantes y el largo tiempo en lista de espera conllevan la progresión tumoral, con tasas de abandono de la lista en el primer año del 25%4. En los pacientes en quienes no es posible el trasplante, la ablación percutánea constituye uno de los tratamientos de elección. Además, en candidatos en espera de trasplante, el control local del tumor (bridging) aumenta la supervivencia (86,4 meses en los tratados y 68,9 meses en los no tratados)5.
La ablación percutánea comenzó en los años 1980 inyectando etanol bajo guía por ultrasonidos6,7. Posteriormente se desarrollaron técnicas basadas en energías, como la radiofrecuencia8.
Las recomendaciones para la ablación percutánea son CHC estadio precoz en pacientes no candidatos a trasplante hepático o durante su espera en lista para trasplante9. Se describen, a continuación, algunas de las técnicas de ablación y sus principales características.
Instilación percutánea de etanolConsiste en inyectar alcohol directamente en el tumor con guía ecográfica. Por un lado, el alcohol produce una necrosis coagulativa de las células neoplásicas, y por otro, necrosis endotelial y agregación plaquetaria que provoca isquemia tumoral por trombosis. La inyección debe ser lenta y controlada.
La instilación percutánea de etanol está indicada en pacientes en estadio BCLC-0 o BCLC-A con tres nódulos <3cm, que no sean candidatos a trasplante hepático. Es posible utilizar esta técnica en nódulos de localización subcapsular y adyacentes a grandes vasos.
En tumores pequeños, la supervivencia con la instilación percutánea de etanol es similar a la lograda con la resección quirúrgica (50% a los 5 años)10,11. Sus resultados son similares a los de la radiofrecuencia en lesiones de hasta 2cm12.
Las principales desventajas son la necesidad de realizar varias sesiones y su baja eficacia en lesiones de mayor tamaño, debido a la peor difusión del alcohol en el interior del tumor10,11.
Las complicaciones menores son frecuentes e incluyen fiebre, náuseas y vómitos, y dolor abdominal. Las complicaciones graves son poco habituales.
RadiofrecuenciaEs la técnica más utilizada actualmente y está basada en el daño tisular que genera el calor producido al colocar en el tumor un electrodo, conectado a un circuito eléctrico alimentado por un generador de corriente alterna que suministra 375-500 MHz13. El circuito se cierra mediante unas paletas de dispersión colocadas habitualmente en los muslos.
El procedimiento debe realizarse con sedación o anestesia general, porque suele ser doloroso. El electrodo-aguja se coloca en el tumor percutáneamente o durante la cirugía, en general con guía ecográfica. La ecografía permite guiar la aguja en tiempo real y un buen control de la evolución del tratamiento, que debido a la ebullición del líquido intracelular se manifestará como áreas ecogénicas.
El objetivo es conseguir la ablación de todo el tumor, incluyendo 1cm de hígado sano en su periferia, de forma similar al margen quirúrgico14. En el caso de los CHC, la cápsula hace efecto horno, lo que consigue concentrar el calor y aumentar el efecto terapéutico, con eficacia superior a la instilación percutánea de etanol en tumores >2cm15. Temperaturas de 50-52°C provocan citotoxicidad, y con 60-100°C se induce una coagulación proteica que daña de manera irreversible la célula16. Las limitaciones de la radiofrecuencia son, por una parte, que la temperatura alcanzada en la lesión decrece en proporción a la distancia del electrodo, y por otra, el efecto disipador del calor que ejerce el flujo sanguíneo intrahepático en lesiones próximas a estructuras vasculares, lo que disminuye el efecto terapéutico y aumenta la probabilidad de tratamiento incompleto y de recidivas locales13,14. Este efecto disipador ocurre principalmente por vasos ≥3mm, ya que los ≤2mm suelen trombosarse con el tratamiento y dejan de interferir en la correcta transmisión de calor.
La tasa de mortalidad es baja (0,3-0,5%) y las complicaciones mayores pueden ocurrir en un 2-9% de los pacientes: hemorragia peritoneal, siembra tumoral, abscesos intrahepáticos y perforación intestinal17. Debido al riesgo de complicaciones, se recomienda no realizarla en tumores adyacentes a la vesícula biliar, las vías biliares principales, el hilio hepático o el corazón, ni en tumores subcapsulares.
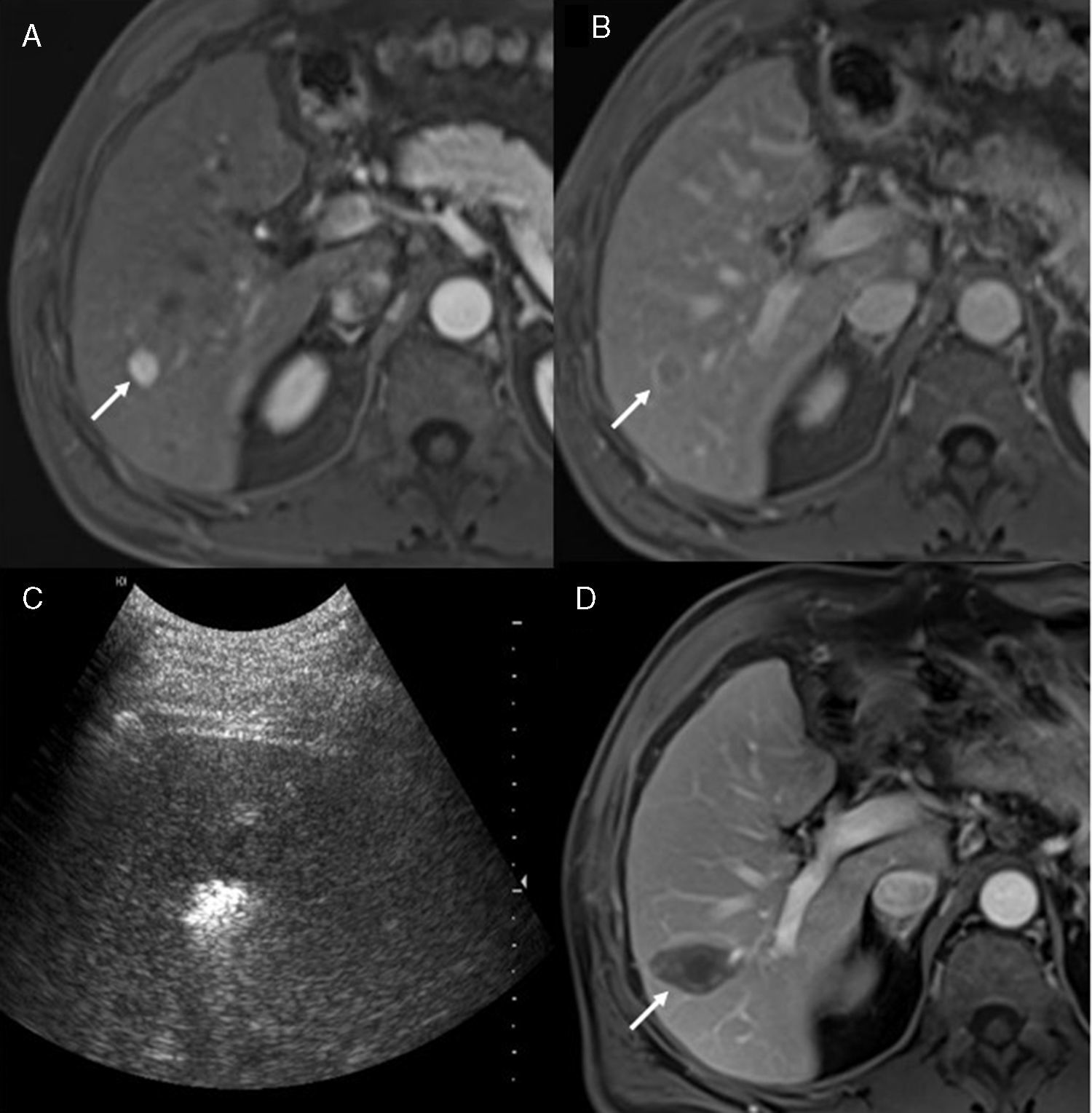
Se ha descrito un alto porcentaje de recurrencias locales (hasta el 62%) en pacientes tratados mediante radiofrecuencia como primera línea de tratamiento, siendo el tamaño tumoral el único factor de riesgo independiente. Sin embargo, la supervivencia de estos pacientes a los 5 y 10 años es del 59,7% y el 32,3%, respectivamente18. Los factores que más influyen en la supervivencia son la edad, el estadio de Child-Pugh, el tratamiento antiviral durante el seguimiento y la recaída extrahepática19. Sus resultados son similares a los obtenidos con la resección quirúrgica, aunque la radiofrecuencia presenta menor tasa de complicaciones y mayor coste-efectividad que la cirugía20–25 (fig. 2).
Varón de 65 años con cirrosis hepática por virus B (Child-Pugh A) con antecedentes (9 meses) de resección laparoscópica de un carcinoma hepatocelular en el que se detecta un nódulo en el lóbulo derecho. A) Resonancia magnética tras la administración de contraste intravenoso en secuencia T1 arterial, en la que se observa un nódulo hipervascular (flecha). B) En la secuencia de equilibrio se observa lavado de contraste en el interior del nódulo (flecha). C) Control ecográfico durante la ablación del tumor por radiofrecuencia. D) Resonancia magnética de control al mes de la ablación tumoral: T1 con contraste en fase portal en la que se observa la lesión hipointensa con ausencia de captación de contraste.
La combinación de quimioembolización arterial con radiofrecuencia ha mostrado mayor eficacia en el tratamiento del CHC y mejoría en la supervivencia, especialmente en tumores >3cm23,26.
MicroondasEl método se basa en la citotoxicidad que provoca el aumento de la temperatura causado por la fricción de las moléculas de agua tras colocar un electrodo dentro de la lesión, conectado a un generador de energía (frecuencias en el rango de 900-2450MHz). A diferencia de la radiofrecuencia, no se emplea un circuito eléctrico y pueden utilizarse varias sondas para permitir un volumen de acción mayor27. El calor terapéutico que se produce se ve menos afectado por el efecto disipador de los vasos intrahepáticos, por lo que puede ser más efectivo en lesiones cercanas a venas suprahepáticas y a la vena cava inferior.
También se puede realizar por vía percutánea, laparoscópica o durante la cirugía abierta.
Sus ventajas respecto a otras técnicas de ablación son una mayor temperatura intratumoral, un mayor volumen de ablación, el menor tiempo y que no requiere toma de tierra.
Recientemente se han publicado artículos que comparan la ablación mediante microondas con la radiofrecuencia, obteniendo resultados similares en términos de supervivencia y complicaciones28,29. En concreto, un metaanálisis publicado por Huo y Eslick30 muestra también que la radiofrecuencia y la ablación por microondas tienen una similar supervivencia global a los 5 años.
Otros métodos ablativos- 1)
Láser.El láser ha demostrado resultados similares a los de la radiofrecuencia, pero la experiencia es menor porque el procedimiento, que precisa insertar varias fibras flexibles, es más complejo y el equipamiento es más caro31.
- 2)
Ultrasonido de alta energía.Conocido como HIFU (High-Intensty Focused Ultrasound), permite focalizar de modo no invasivo alta energía en forma de ondas de ultrasonidos que aumentan focalmente la temperatura. La técnica consiste en focalizar la energía de un haz de ultrasonidos de alta frecuencia con un transductor en un volumen pequeño de tejido sin introducir ningún tipo de aguja o dispositivo en el paciente. Por su alta selectividad, los tejidos adyacentes no se dañan. El aparato utiliza imágenes de ultrasonidos o de resonancia magnética (RM) para localizar y supervisar el tratamiento.Esta técnica tiene limitaciones, ya que los equipos de HIFU no están disponibles en muchos centros, su coste es elevado y es un procedimiento largo.Hasta ahora hay muy pocos estudios que permitan demostrar beneficios de los HIFU en la supervivencia del CHC con respecto a la radiofrecuencia, aunque algunos autores consideran muy prometedor el futuro de esta técnica en casos seleccionados32.
- 3)
Crioablación.Esta técnica se empezó a utilizar antes que la radiofrecuencia para tratar percutáneamente el CHC33. La toxicidad celular se consigue mediante congelación y descongelación tras alcanzar temperaturas entre −20 y −40°C13. Ha sido menos utilizada para el CHC por su complejidad, mayor coste, calibre superior de los electrodos y potenciales complicaciones, como el sangrado y el «síndrome de crioshock»34. La tasa de recidiva tumoral local es del 5,5%, inferior que con la radiofrecuencia (17,7%) o con microondas (8,8%), posiblemente por la mejor delimitación de los bordes de ablación29,34.
- 4)
Electroporación irreversible.Esta técnica ablativa no térmica se basa en alterar el potencial eléctrico de la membrana celular aplicando corrientes eléctricas de alta intensidad13. Los impulsos eléctricos generados pueden crear irreversiblemente nanoporos en la membrana celular, que producen apoptosis celular13. En la actualidad es una técnica en investigación, usada principalmente para controlar de manera local la neoplasia de páncreas. Sus limitaciones son el elevado coste y su complejidad, puesto que precisa la introducción de varios electrodos colocados en paralelo. Para ello es necesaria la sincronización cardíaca con la emisión del pulso eléctrico, y la anestesia general con bloqueo neuromuscular, porque los impulsos eléctricos inducen contracción muscular. Está contraindicada en pacientes con arritmias cardiacas y en aquellos con prótesis metálicas próximas a la zona de tratamiento35.
Las técnicas basadas en la oclusión vascular para tratar el CHC incluyen la embolización arterial (TAE, transcatheter arterial embolization) y la quimioembolización (TACE, transcatheter arterial chemoembolization). La primera se basa en ocluir selectivamente las arterias tumorales aferentes, y la segunda consiste en una embolización arterial que asocia fármacos. Están especialmente indicadas en pacientes con CHC en estadio intermedio (BCLC-B) (2) y también con CHC único (BCLC-A) no candidatos a cirugía ni ablación, y como terapia puente a la cirugía o el trasplante36,37. Los mejores candidatos son pacientes con CHC único o CHC multinodular con función hepática relativamente preservada (Child-Pugh A o B sin ascitis), sin síntomas y sin evidencia de invasión vascular ni enfermedad a distancia.
TécnicaEs importante cateterizar superselectivamente (microcatéter) las arterias del tumor y, en la medida de lo posible, realizar una angiografía rotacional (cone-beam CT) para identificar con mayor precisión las arterias tumorales que lo irrigan.
Con la TAE, también conocida como «embolización blanda», se persigue conseguir la isquemia usando distintos agentes embolizantes, sin inyectar fármacos. Por su parte, la TACE combina el efecto isquémico con concentraciones de quimioterápico prolongadamente elevadas en el tumor. Para ello se necesita un agente vehiculante del fármaco. Dentro del término TACE se incluyen dos técnicas: TACE convencional (TACEc) y TACE con partículas (DEB-TACE).
La técnica de TACEc consiste en inyectar intraarterialmente una emulsión viscosa formada por un quimioterápico (doxorubicina o cisplatino) mezclado con Lipiodol® (Guerbet, Aulnay-sous-Bois, France), seguida de la embolización del vaso aferente tumoral con partículas fabricadas con distintos materiales (alcohol polivinílico, poliacrilamida o esponja de gelatina). El Lipiodol® es un contraste yodado, oleoso, que queda retenido selectivamente en la proximidad de las células tumorales38. La embolización del vaso tumoral tras la infusión del fármaco consigue aumentar el tiempo de permanencia de los agentes citotóxicos al disminuir la velocidad de salida de la circulación hepática. Además, la isquemia provoca la muerte celular directa y potencia la captación del fármaco dentro de las células, al impedir la función de las bombas de membrana celular metabólicamente activas que actúan para eliminar las sustancias químicas citotóxicas del citoplasma.
Como alternativa a la TACEc se desarrollaron las partículas precargadas con fármacos (DEB-TACE). Existen cuatro tipos distintos de microesferas comercializadas: DC Bead (BTG, Farnham, United Kingdom), HepaSphere (Merit Medical, South Jordan, Utah, USA), Life Pearl (Terumo European Interventional Systems, Leuven, Belgium) y Tandem (Boston Scientific, Marlborough, Massachusetts, USA). Las partículas son microesferas poliméricas de hidrogel, biocompatibles, hidrófilas y no reabsorbibles, y cada tipo tiene unas características químicas particulares39. Todas son fabricadas para poder adsorber fármacos quimioterápicos a partir de una solución y después liberarlos una vez alcanzado el lecho vascular tumoral. Con ellas se persigue minimizar la cantidad de fármaco libre y sus posibles efectos sistémicos. Las partículas están calibradas en diferentes tamaños y se seleccionan según la medida arterial y del tumor, y la existencia o no de shunts arteriovenosos. Las partículas <100 micrones son las que se recomiendan en un procedimiento estándar, porque se introducen en el tumor o quedan en la proximidad del margen tumoral40.
Las partículas cargadas deben ser mezcladas con un medio de contraste no iónico (al menos 5-10ml por 1ml de partículas). La administración debe ser muy lenta: 1ml de la mezcla en suspensión por minuto y se detendrá (endpoint) cuando se consiga la estasis parcial (nearstasis) (la columna de contraste debe lavarse cada 2-5 latidos cardiacos).
Resultados y complicacionesLa técnica óptima de embolización para tratar el CHC sigue siendo un tema de actualidad e investigación. De hecho, no existe consenso acerca del número de procedimientos que hay que realizar ni el tiempo que debe transcurrir entre ellos.
Un metaanálisis cuestiona el beneficio de la TAE y la TACE, en términos de supervivencia, en los pacientes con CHC41; no obstante, hace más de una década que se están publicando estudios que demuestran que la TAE y la TACE aumentan la supervivencia de los pacientes con CHC irresecable en comparación con el tratamiento sintomático42,43. En 2002, Llovet et al.44 fueron los primeros en demostrarlo, en 112 pacientes, con una probabilidad de supervivencia a 2 años del 50% para TAE, el 63% para TACE y el 27% para los controles. Comparando ambas técnicas, los resultados de la TACE mejoran los de la TAE, con mayor tasa de respuesta completa (26,8% y 14%), menos recurrencias (45,7% y 78,3% a los 12 meses) y más tiempo hasta la progresión (42,4 semanas vs. 36,2 semanas; p = 0,008).
Respecto a la TACE, se han publicado numerosos estudios acerca del beneficio del uso de las partículas precargadas45–47. Un ensayo clínico multicéntrico de fase II (201 pacientes) comparó el uso de DC Bead® con doxorubicina y TACEc con doxorubicina46, y demostró que DC Bead® fue menos hepatotóxico y tuvo menos efectos adversos sistémicos. Por su mayor perfil de seguridad y mejor tolerancia se han podido cargar con altas dosis de doxorubicina, con elevadas tasas de respuesta objetiva y de control de la enfermedad47. Sin embargo, un reciente estudio no encuentra diferencias significativas en términos de supervivencia global y supervivencia libre de progresión entre los grupos tratados sin y con fármacos asociados a partículas48, cuestionando su beneficio.
Si bien se ha demostrado que poseen un perfil de seguridad favorable49–54, no están exentas de producir daño local hepático. En un estudio publicado en 2016, dirigido a comparar el grado de toxicidad local hepática entre TACEc y DEB-TACE en pacientes cirróticos en estadio BCLC-B55, la incidencia de daño hepático global y lesiones biliares en el grupo tratado con DEB-TACE fue mayor56. Sin embargo, esta toxicidad local añadida no se tradujo en una menor eficacia del tratamiento, porque ambas técnicas tuvieron un grado de respuesta tumoral similar.
La embolización arterial hepática tiene una baja tasa de complicaciones. Aunque son muy poco comunes, con una incidencia <3%, se han descrito complicaciones mayores como rotura hepática o absceso hepático57.
Una importante limitación de las técnicas de embolización arterial es la alta tasa de recurrencia, hasta un 65% a los 3 años58,59, que se explica por el aumento del factor de crecimiento endotelial vascular, el cual favorece la neoangiogénesis tras la TACE. Esto ha dado lugar a una nueva línea de investigación sobre el efecto que pueden ocasionar los fármacos antiangiogénicos sistémicos combinados con las terapias locorregionales. Sin embargo, se ha publicado (SPACE trial) que la combinación de un fármaco antiangiogénico (sorafenib) con DEB-TACE no mejora el tiempo de progresión de la enfermedad ni la supervivencia con respecto a DEB-TACE en monoterapia60.
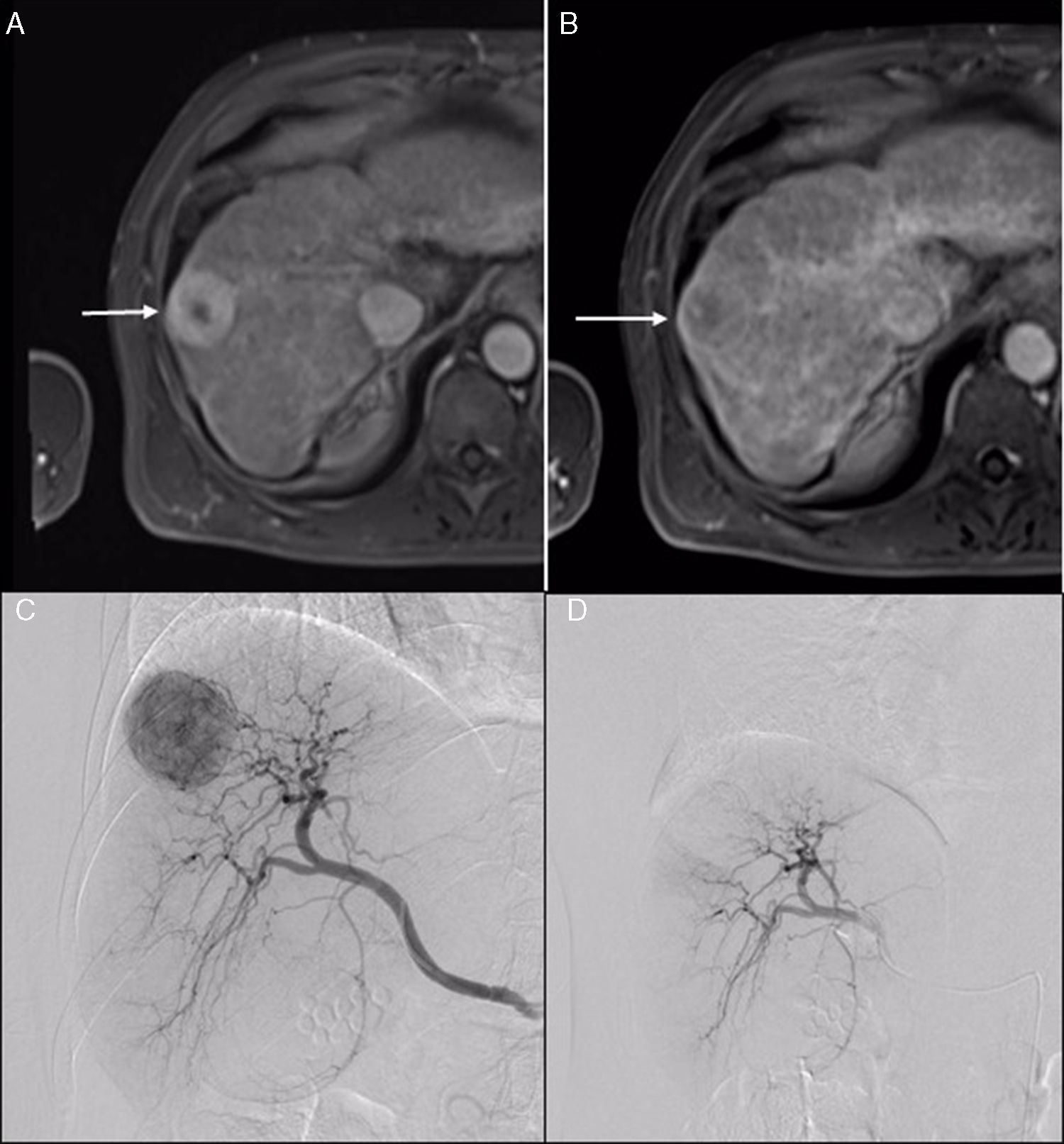
El cuadro clínico más frecuente que se produce tras la embolización arterial es el «síndrome posquimioembolización» (40% y 80% de los pacientes): dolor en el hipocondrio derecho, astenia, fiebre, náuseas y elevación de las transaminasas y de la bilirrubina61. El síndrome se explica por una citólisis por daño de los hepatocitos sanos, y no por necrosis tumoral (fig. 3).
Varón de 56 años con cirrosis hepática de etiología alcohólica (Child-Pugh A) a quien se le detecta un nódulo subcapsular de 36mm localizado en el segmento VIII, compatible con carcinoma hepatocelular. Resonancia magnética que presenta un patrón vascular característico. A) En fase arterial se observa una lesión hiperintensa (flecha). B) En fase tardía, el nódulo es hipointenso con pseudocápsula periférica hiperintensa (flecha). C) Imágenes durante la TACE con partículas de 70-120 micrones cargadas con doxorubicina: arteriografía realizada desde la arteria hepática derecha en la que se observa una lesión única e hipervascular. Cateterización superselectiva con microcatéter de la arteria tumoral aferente. D) Arteriografía superselectiva de control en la que no se observa la lesión hipervascular. El tumor se ve radioopaco porque retiene en su interior partículas precargadas mezcladas con contraste no iónico.
La radioembolización consiste en inyectar intravascularmente partículas cargadas con un radioisótopo (itrio 90 [Y90]) (Sirtex Medical Europe, Bonn, Germany; Teraspheres, BTG, Farnham, United Kingdom). El efecto terapéutico vendrá, exclusivamente, de la irradiación tumoral desde las arteriolas intratumorales y peritumorales; las partículas «embolizantes» (30μ) solo «vehicularán» el agente terapéutico (Y90). Este efecto ha sido definido como «microembolización», bien diferenciada de la «macroembolización» (quimioembolización), en la que el efecto terapéutico que se busca es, fundamentalmente, la necrosis obtenida con la isquemia del tumor62. Es por este motivo, la ausencia de isquemia, por el que la radioembolización está particularmente indicada en casos de invasión portal (estadio BCLC-C), ya que el territorio al que debería llegar sangre portal no se desvasculariza, pues no se cierra su aporte arterial63. Un efecto característico de la radioembolización consiste en la activación de mecanismos de hipertrofia/hiperplasia del lóbulo contralateral, lo que permitirá tratar el tumor y la vez «infraestadificarlo», posibilitando así la inclusión del paciente como candidato a cirugía. Este efecto («lobectomía rádica con hipertrofia del lóbulo contralateral») es, aunque algo más lento, similar al obtenido con la embolización portal en cuanto a porcentaje de crecimiento64.
TécnicaSe realiza en dos tiempos, porque la aplicación de Y90 va precedida por una simulación en la que se utilizan macroagregados de albúmina (diámetro de 10-100μ) cargados con Tc99 (MAA Tc99) para saber cuál va a ser el comportamiento de las partículas cargadas con Y90. La tendencia es que tanto la simulación como el tratamiento se hagan en el mismo día, pero actualmente la mayoría de los centros los distancian unos 10-14 días65.
La simulación agrupa varias técnicas de imagen, tanto angiográficas como de medicina nuclear. Previamente será necesario haber analizado (por tomografía computarizada [TC] o RM) la anatomía vascular del hígado, y en particular de la lesión, para conocer las variantes anatómicas y las posibles aferencias desde arterias no hepáticas. Con la angiografía se pretende analizar el detalle fino de la arquitectura vascular, tras lo cual se decidirá desde qué punto vascular se va a administrar el Y90. Además, podrá planificarse el cierre de vasos no hepáticos o arterias hepatófugas con el fin de prevenir complicaciones en territorios no deseados, y se decidirá el cierre de aquellas arterias hepatópetas para redistribuir el flujo. Una vez cumplido lo anterior, se introducirán los MAA Tc99 (200 MBq) desde el punto vascular seleccionado. Con el fin de evitar que pueda haber captación libre (no hepática) de Tc, los MAA deben de haber sido «cargados» en los 60 minutos anteriores a su introducción, recomendándose la administración oral, previa a la angiografía, de 600mg de perclorato. Las imágenes (gammagrafía o TC por emisión de fotón único) deberán adquirirse dentro de las 3 horas siguientes a la administración de los MAA. Con los estudios de medicina nuclear se pretende conocer si hay captación extrahepática de Tc99 en otras vísceras, y para el caso del pulmón, cuantificar (%) la actividad que alcanza; también la relación entre la captación del tumor (T) y del tejido sano (N).
Son varias las fórmulas con las que se calcula la actividad que se desea administrar, pero básicamente atienden a factores como la superficie corporal total, el porcentaje de paso al pulmón, el volumen de hígado que se va a tratar, los tratamientos que el paciente haya recibido y la función hepática.
Resultados y complicacionesTres series retrospectivas permitieron conocer los resultados de supervivencia de la radioembolización en los diferentes estadios del CHC66–68. Para Sangro et al.68 era de 24,4 meses para BCLC-A, 16,9 meses para BCLC-B y 10 meses para BCLC-C. El grado de función hepática influirá en la supervivencia, con 16,8 meses para Child-Pugh A y 10,3 meses para Child-Pugh B. En los pacientes Child-Pugh A con trombosis portal segmentaria, es de 16,6 meses. Un estudio retrospectivo multicéntrico en pacientes con trombosis portal ha demostrado diferencias significativas entre la supervivencia con radioembolización (8,8 meses) y con sorafenib (5,4 meses)69. Los resultados de cinco estudios prospectivos aleatorizados (SARAH, SORAMIC, STOP-HCC, YES-P y SIRveNIB) permitirán conocer más sobre la eficacia de la radioembolización en estadios BCLC-B y, sobre todo, BCLC-C. Actualmente solo hay información de dos estudios prospectivos que han comparado la radioembolización y la TACE. Un estudio en 24 pacientes con BCLC-B no demostró diferencias significativas en la progresión libre de enfermedad (TACE: 180 días; radioembolización: 216 días) ni en la supervivencia (TACE: 592 días; radioembolización: 788 días), con una incidencia menor de progresión hepática para la radioembolización, pero con mayor tasa de fallo hepático70. Un estudio retrospectivo que comparó TACE (n = 123) con radioembolización (n = 122) obtuvo datos similares de supervivencia71; otro, con 80 pacientes, obtuvo resultados significativamente mejores con la radioembolización (TACE: 30,63 meses; radioembolización: 39,24 meses)72.
Las complicaciones de la radioembolización pueden ser sistémicas, como fatiga, debida al propio efecto de la radiación, o locales, relacionadas con la irradiación excesiva de un órgano. Entre las segundas cabe destacar:
La neumonitis rádica (<1%), que aparecerá cuando el pulmón recibe más de 30Gy, relacionada con el porcentaje de shunt pulmonar (paso de partículas por conexiones tumorales arteriovenosas); si este es >20% no se deberá de realizar el procedimiento. La lesión pulmonar, de difícil tratamiento, aparecerá en el primer mes tras la radioembolización y suele tener consecuencias fatales.
Las úlceras gastrointestinales (3%), causadas por la implantación inadvertida de partículas en este territorio. De evolución tórpida, pueden sanar con tratamiento médico73.
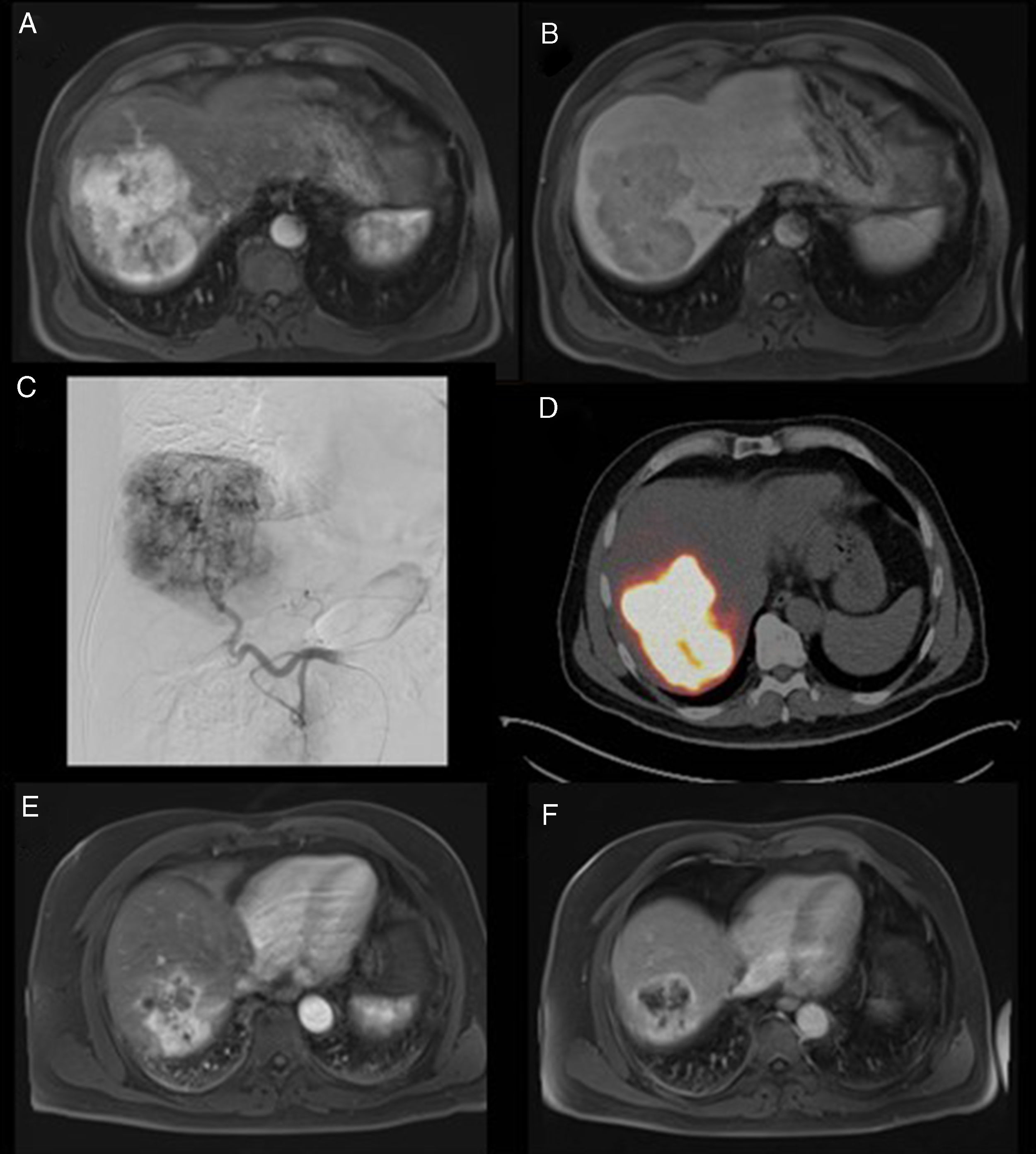
Las causadas por una irradiación excesiva del tejido hepático no tumoral (REILD, radioembolization induced liver disease) (0-20%), que consisten en ascitis e ictericia que aparecen a los 1-2 meses en ausencia de progresión de la enfermedad74,75 (fig. 4).
Paciente de 65 años, asintomático, con lesión hepática detectada en un control habitual. Estudio dinámico de resonancia magnética (RM) tras la administración de contraste paramagnético. A) En fase arterial se observa una lesión irregular localizada en el lóbulo derecho (flecha). B) En fase tardía, la lesión muestra lavado de contraste con cicatriz central. Se plantea el diagnóstico diferencial entre hiperplasia nodular focal o hepatocarcinoma. Se realizó biopsia, con resultado anatomopatológico de hepatocarcinoma moderadamente diferenciado. C) El paciente fue sometido a tratamiento de radioembolización. Arteriografía realizada desde la arteria hepática común en la que se observa una gran masa hipervascular con un único pedículo vascular de grueso calibre, desde donde se realizó la infusión de macroagregados. Tras descartar captación extrahepática y shunt hepatopulmomar elevado, se procedió a inyectar las microesferas cargadas con Y90 desde este mismo punto. D) Estudio de PET-TC en el que se observa un excelente depósito del tratamiento en la lesión tumoral. E y F) Estudio de RM tras la administración de contraste intravenoso en fase arterial y tardía, realizado a los 5 meses de la radioembolización. Se observa una clara disminución de tamaño de la lesión, con áreas de necrosis en su interior. El paciente finalmente fue sometido a una hepatectomía derecha.
- 1.
Responsable de la integridad del estudio JIB.
- 2.
Concepción del estudio: JIB.
- 3.
Diseño del estudio: JIB.
- 4.
Obtención de los datos: JIB, MPA, JM y AB.
- 5.
Análisis e interpretación de los datos: JIB, MPA, JM y AB.
- 6.
Tratamiento estadístico: JIB, MPA, JM y AB.
- 7.
Búsqueda bibliográfica: JIB, MPA, JM y AB.
- 8.
Redacción del trabajo: JIB, MPA, JM y AB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JIB.
- 10.
Aprobación de la versión final: JIB, MPA, AB y JM.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.