Radiología mamaria: Nuevos horizontes en tiempos de pandemia
Más datosLa crioablación es una técnica terapéutica que provoca destrucción celular gracias a los efectos del frío, y que puede realizarse de manera percutánea, guiada por imagen. Se trata de un procedimiento sencillo que se realiza de forma ambulatoria y con anestesia local. En la mama ha demostrado su eficacia para el tratamiento de lesiones benignas, como el fibroadenoma. Hoy en día, en las malignas se emplea fundamentalmente para reducir masa tumoral en aquellos casos en los que existe contraindicación para la cirugía. No obstante, se está investigando su utilidad en la patología mamaria maligna. Hay pruebas de que potencia la respuesta tumoral a la inmunoterapia. Asimismo, en un futuro próximo, podría ser una alternativa a la cirugía para el control local de neoplasias en estadios precoces. El objetivo de este artículo es describir nuestra experiencia en el tratamiento de lesiones de mama, tanto benignas como malignas, con crioablación con nitrógeno líquido, así como revisar sus fundamentos e indicaciones. Desde 2019 hemos tratado con esta técnica 7 lesiones benignas y 9 malignas con un resultado estético excelente y sin complicaciones significativas. Actualmente, la crioablación es un procedimiento incorporado en el protocolo de la Unidad de mama de nuestra institución.
Cryoablation is a therapeutic technique that uses very low temperatures to destroy cells; transcutaneous cryoablation can be performed under imaging guidance. This simple procedure is done on an outpatient basis with local anesthesia. Cryoablation has proven effective in the treatment of benign breast lesions, such as fibroadenomas. Nowadays, its main use in malignant breast lesions is to reduce the size of the mass in cases where surgery is contraindicated. Nevertheless, other uses in malignant breast disease are being investigated. Cryoablation can strengthen the tumor response to immunotherapy. Likewise, in the near future, it may become an alternative to surgery for the local control of early-stage neoplasms. This article aims to describe our experience using cryoablation with liquid nitrogen to treat benign and malignant breast lesions and to review the fundamentals of the technique and its indications. Since 2019 we have used cryoablation to treat 7 benign and 9 malignant lesions without significant complications, achieving excellent esthetic outcomes. Cryoablation has been incorporated into our institution's breast unit's protocol.
La crioablación es una técnica de ablación térmica percutánea que se puede realizar guiada por imagen. Su eficacia se basa en los efectos citotóxicos del frío, que provoca destrucción inmediata y tardía de las células. Se trata de un procedimiento mínimamente invasivo, que requiere únicamente anestesia local, ya que el frío contribuye a la analgesia. En la mama se realiza de forma ambulatoria y la paciente puede recuperar su vida normal casi inmediatamente. Además, el resultado estético es excelente1.
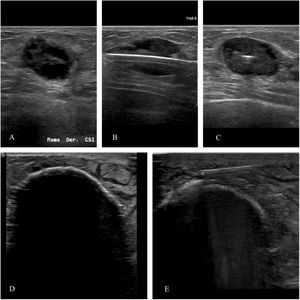
En nuestra institución, la crioablación forma parte de la cartera de servicios de la Unidad de mama desde mayo de 2019 y actualmente está incluida en su protocolo y es aceptada por todos sus miembros para el tratamiento de lesiones benignas y malignas no candidatas a cirugía. La indicación de ablación percutánea de los cánceres se establece en el comité de tumores. Se realiza con nitrógeno líquido, gas barato y fácil de almacenar, empleando el equipo IceCure (IceCure Medical, Collierville, TN). Durante el procedimiento, la criosonda se coloca por vía percutánea, guiada habitualmente por ecografía, en el centro de la masa, a lo largo de su eje mayor (fig. 1). Normalmente, se emplean dos ciclos de congelación-descongelación, cuya duración depende del tamaño y naturaleza de la lesión. Las de mayor tamaño y las malignas requieren de ciclos más largos. El objetivo es conseguir volumen de congelación, cuyos bordes son fácilmente visibles mediante imagen2, con una zona letal que abarque toda la lesión y un margen de seguridad. En el caso de lesiones próximas a la piel o al músculo pectoral se crea una barrera térmica inyectando suero salino entre la masa y la piel o el músculo para evitar necrosis de los mismos. En la primera congelación se alcanzan temperaturas de -195°C, que aumentan la osmolaridad intracelular y congelan el agua extracelular, lo que ocasiona la salida de líquido de las células y su deshidratación. Durante la fase de descongelación se produce edema y rotura celular. Además, la formación de cristales de hielo intracelulares daña los orgánulos y la membrana plasmática. La crioablación también lesiona las células tumorales provocando disfunción de las células endoteliales, formación de microtrombos, isquemia y agregación plaquetaria. La segunda congelación es necesaria porque los tejidos dañados durante la primera conducen mejor el frío aumentando así los efectos lesivos del mismo y expandiendo el área de necrosis tumoral. Es posible repetir el procedimiento en casos de recaída o ablación incompleta y no es necesario interrumpir tratamientos sistémicos como la quimioterapia. Las complicaciones son muy poco frecuentes y de poca relevancia: dolor leve, edema o tatuaje en la piel. Excepcional es la necrosis de la piel o del músculo pectoral ya comentada3.
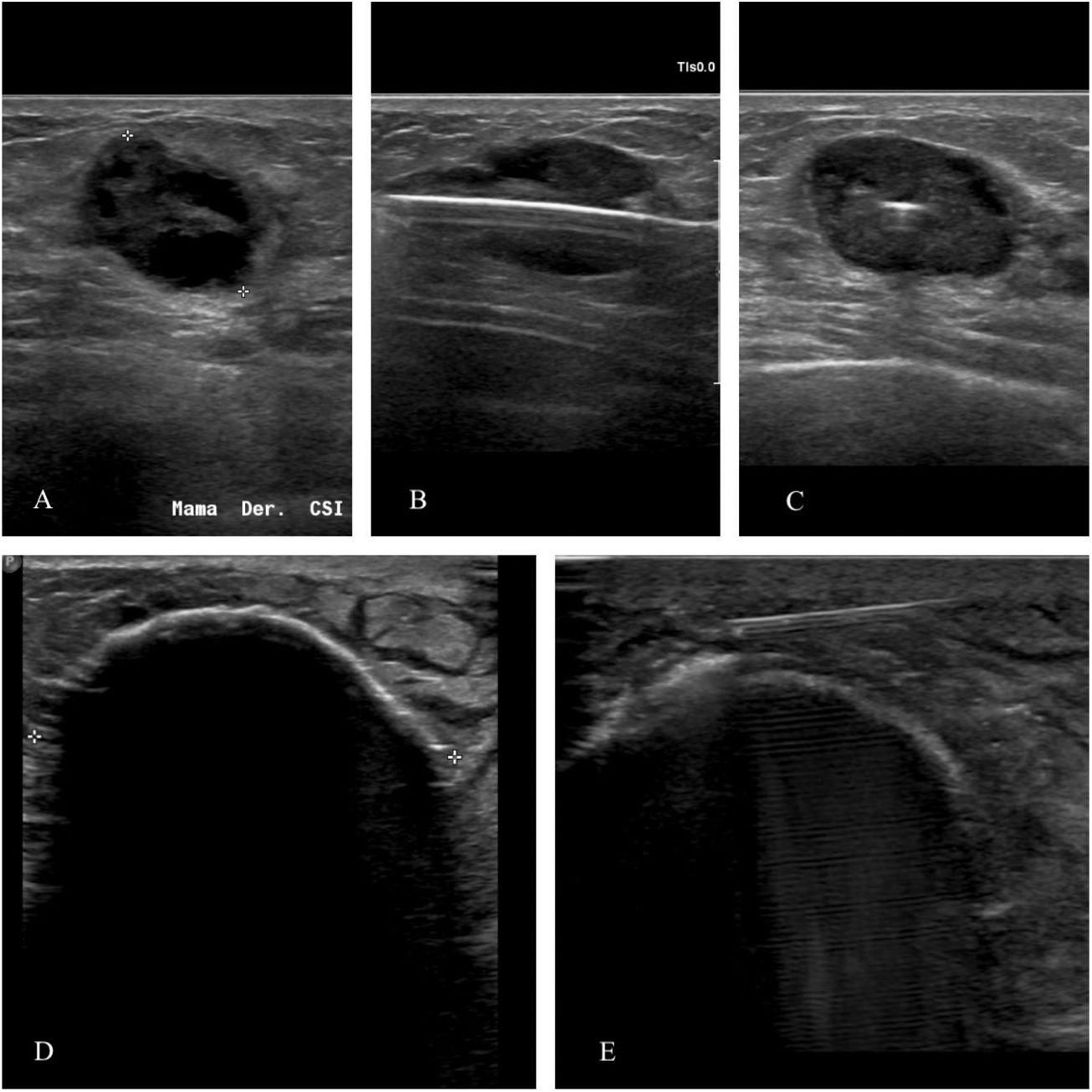
Paciente de 94 años con un tumor triple negativo (A). Se coloca la criosonda en el centro de la masa, a lo largo de su eje mayor (B y C). El objetivo es conseguir volumen de congelación con una zona letal que abarque toda la lesión y un margen de seguridad alrededor. Se forma un borde ecogénico con sombra posterior en la interfase entre el tejido congelado y el no congelado (D). En caso de lesiones próximas a la piel o al músculo pectoral se crea una barrera térmica inyectando suero salino entre la masa y la piel o el músculo (E).
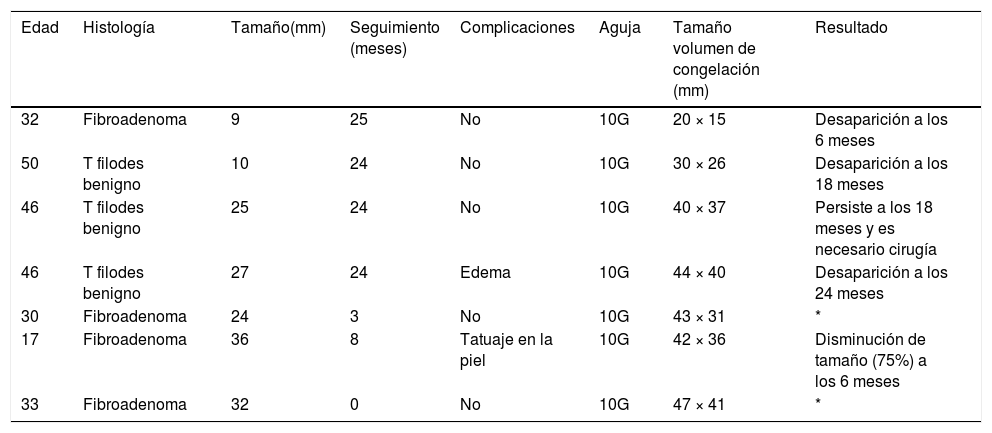
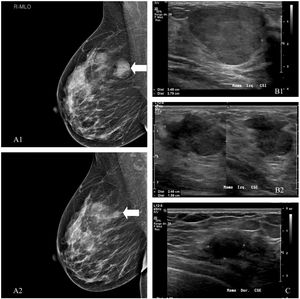
La eficacia y seguridad de la crioablación ha sido probada en lesiones benignas como el fibroadenoma. Se ha demostrado una reducción del volumen entre el 87% y el 99% a los 12 meses para lesiones de hasta 4,2 cm. La respuesta se ha visto que se relaciona con el tamaño inicial de la lesión (fig. 2). Habitualmente se emplean la mamografía y la ecografía para el seguimiento del resultado4. En nuestro centro llevamos más de 10 años extirpando por vía percutánea con un sistema de vacío las lesiones benignas de mama menores de 3 cm, incluidos los tumores filodes benignos. Desde 2019, hemos tratado con crioablación 7 lesiones benignas, 4 fibroadenomas y 3 tumores filodes benignos en mujeres de entre 17 y 50 años (mediana de 33 años). Los nódulos medían entre 9 y 36 mm (mediana de 25 mm). La mediana del tiempo de seguimiento es de 24 meses (rango 0-25 meses). Una paciente tuvo edema y engrosamiento cutáneo tras el procedimiento, que se resolvió en 2 semanas, y en otra vimos equimosis cutánea superficial a la región tratada que también desapareció espontáneamente. En dos casos aún no se ha realizado el control a los 6 meses del procedimiento; se demostró ablación completa en tres lesiones (un fibroadenoma y dos tumores filodes), y una de ellas, de 36 mm, se redujo un 75% en 6 meses. En uno de los tumores filodes benignos inicialmente vimos reducción de tamaño (aproximadamente el 50% a los 6 meses), pero el nódulo persistió sin cambios tras 24 meses de seguimiento. Después de una nueva biopsia, que demostró persistencia de células viables, se decidió exéresis quirúrgica (tabla 1). En nuestra institución indicamos crioablación para el tratamiento de lesiones benignas de 3cm o más en pacientes que requieren o desean cirugía. Continuamos tratando los nódulos de menor tamaño con el sistema de vacío, puesto que se trata de una técnica eficaz y mucho más barata.
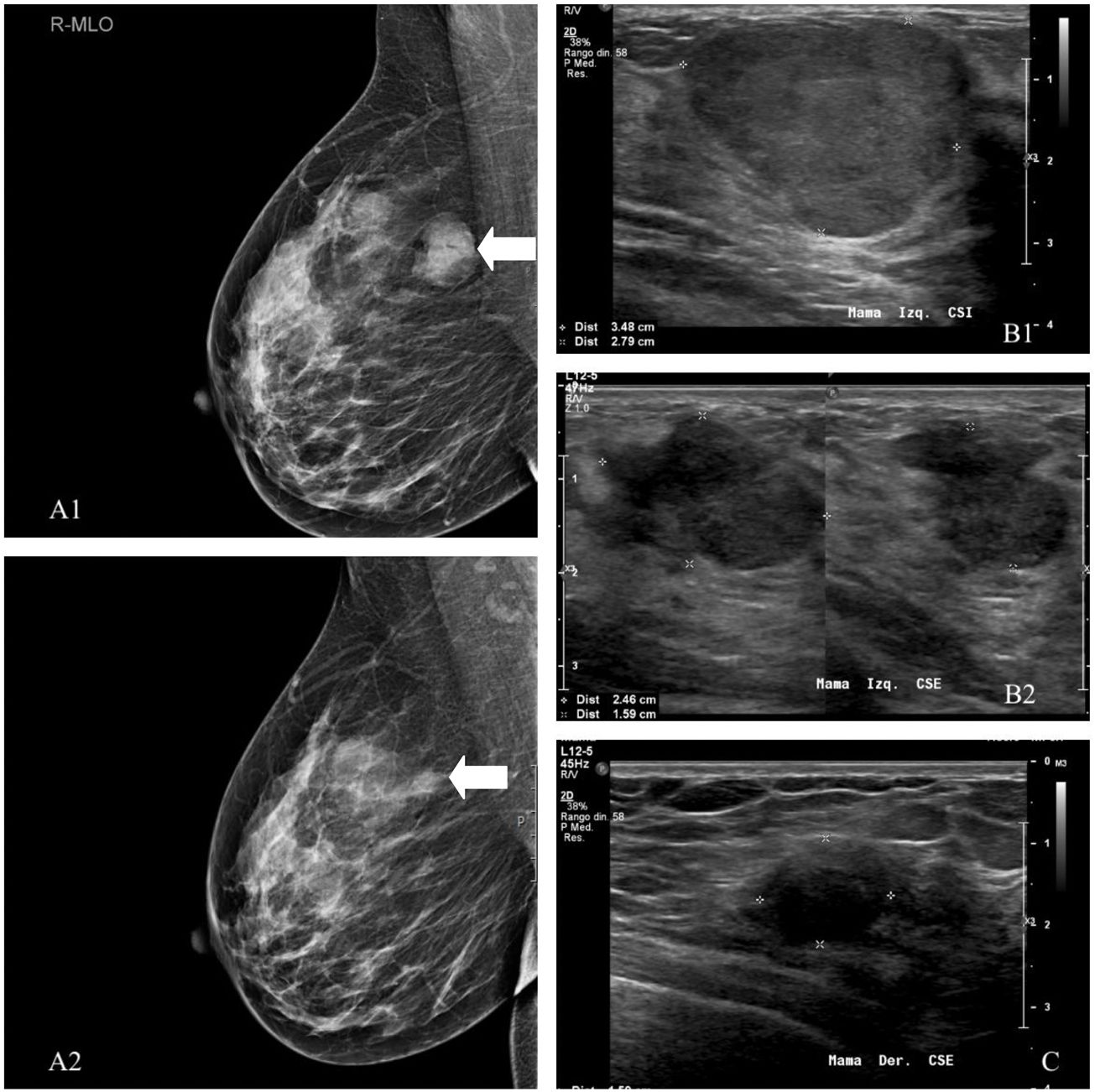
Paciente 1. A) Tras la crioablación, en la mamografía se ha descrito una ligera densidad residual sin calcificaciones, como en este caso de un tumor filodes benigno. Mostramos la mamografía inicial (A1) y la realizada a los 24 meses (A2). Pacientes 2 (B) y 3 (C). En la ecografía, a los 6 meses la mayoría de las lesiones son más pequeñas, pero a veces pueden ser ligeramente mayores o haber desaparecido completamente. El fibroadenoma residual puede mostrar una ecoestructura heterogénea, en relación con detritos, o bandas ecogénicas secundarias a necrosis coagulativa (B1: ecografía inicial y B2: estudio de control). Es posible ver una cápsula gruesa de tejido ecogénico que representa edema y hemorragia. A los 12 meses, los cambios por edema y necrosis son menos evidentes. El nódulo residual puede aparecer como una lesión sutil con bordes mal definidos y difícil de medir como el tumor filodes benigno de la imagen (C).
Lesiones benignas tratadas con crioablación en nuestro hospital
| Edad | Histología | Tamaño(mm) | Seguimiento (meses) | Complicaciones | Aguja | Tamaño volumen de congelación (mm) | Resultado |
|---|---|---|---|---|---|---|---|
| 32 | Fibroadenoma | 9 | 25 | No | 10G | 20 × 15 | Desaparición a los 6 meses |
| 50 | T filodes benigno | 10 | 24 | No | 10G | 30 × 26 | Desaparición a los 18 meses |
| 46 | T filodes benigno | 25 | 24 | No | 10G | 40 × 37 | Persiste a los 18 meses y es necesario cirugía |
| 46 | T filodes benigno | 27 | 24 | Edema | 10G | 44 × 40 | Desaparición a los 24 meses |
| 30 | Fibroadenoma | 24 | 3 | No | 10G | 43 × 31 | * |
| 17 | Fibroadenoma | 36 | 8 | Tatuaje en la piel | 10G | 42 × 36 | Disminución de tamaño (75%) a los 6 meses |
| 33 | Fibroadenoma | 32 | 0 | No | 10G | 47 × 41 | * |
T: tumor.
En 1985 se publicó el primer caso de cáncer de mama tratado con ablación con frío5. Actualmente, en lesiones malignas, la crioablación es una alternativa a la cirugía en pacientes no operables o en aquellas con metástasis para reducir carga tumoral. Sin embargo, diversos estudios evalúan la capacidad de esta técnica para lograr el control local del cáncer de mama, como alternativa a la cirugía. Un metaanálisis reciente analiza 397 tumores de mama de hasta 2 cm. Se logró ablación completa en 339 casos [85%, intervalo de confianza (IC) al 95%, 82-89%). Además, concluye que la crioablación es la técnica de ablación térmica que asocia menos complicaciones6. En la actualidad existen dos ensayos clínicos en marcha, el ICE3 (Cryoablation of Low Risk Small Breast Cancer) y el FROST (Freezing Instead of Removal Of Small Tumors), cuyo objetivo es evaluar la eficacia de la crioablación sin cirugía en el cáncer de mama, con receptores hormonales positivos y Her2 negativo, en estadios precoces y diagnosticado en mujeres de 50 o más años, y su impacto en la recidiva local o a distancia a los 5 años7,8.
Por otro lado, existe un interés creciente acerca de la respuesta inmunológica contra el tumor inducida por la crioablación. La combinación de la inmunoterapia y la ablación por frío parece proporcionar una respuesta inmunitaria más específica para las lesiones distantes9. Además, se ha documentado el efecto abscopal de la crioterapia, su valor en el tratamiento de las metástasis10.
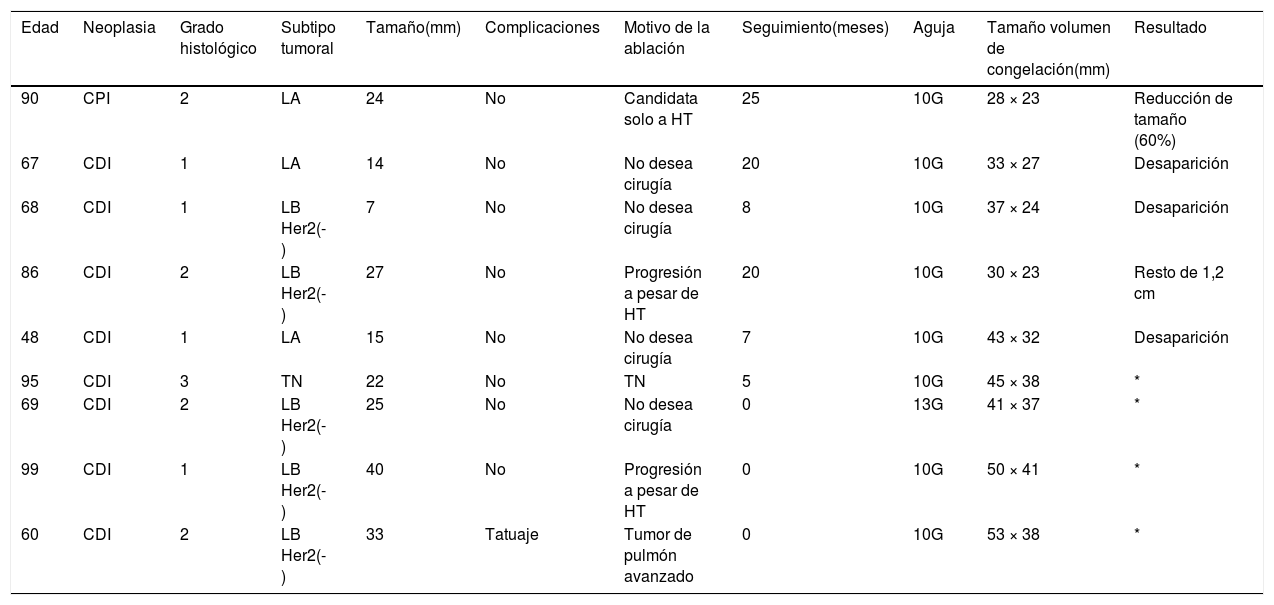
Desde 2019, hemos tratado con crioablación 9 tumores de entre 7 y 46 mm (mediana de 24 mm), diagnosticados en 6 mujeres de 48-98 años (mediana de 77,5 años). No hubo complicaciones en ningún caso. En cuatro de ellos el procedimiento se realizó hace menos de 6 meses. Los otros 5 se han seguido una mediana de 20 meses (rango 8-26 meses) con ecografía y mamografía. Se ha visto ablación completa de dos de ellos, reducción de tamaño de dos y persistencia de un resto tumoral en otra lesión (tabla 2). En la actualidad, en nuestra institución realizamos crioablación en aquellas lesiones malignas no candidatas a cirugía ni hormonoterapia y las que progresan o no responden a ese tratamiento.
Lesiones malignas de mama tratadas con crioablación en nuestro hospital
| Edad | Neoplasia | Grado histológico | Subtipo tumoral | Tamaño(mm) | Complicaciones | Motivo de la ablación | Seguimiento(meses) | Aguja | Tamaño volumen de congelación(mm) | Resultado |
|---|---|---|---|---|---|---|---|---|---|---|
| 90 | CPI | 2 | LA | 24 | No | Candidata solo a HT | 25 | 10G | 28 × 23 | Reducción de tamaño (60%) |
| 67 | CDI | 1 | LA | 14 | No | No desea cirugía | 20 | 10G | 33 × 27 | Desaparición |
| 68 | CDI | 1 | LB Her2(-) | 7 | No | No desea cirugía | 8 | 10G | 37 × 24 | Desaparición |
| 86 | CDI | 2 | LB Her2(-) | 27 | No | Progresión a pesar de HT | 20 | 10G | 30 × 23 | Resto de 1,2 cm |
| 48 | CDI | 1 | LA | 15 | No | No desea cirugía | 7 | 10G | 43 × 32 | Desaparición |
| 95 | CDI | 3 | TN | 22 | No | TN | 5 | 10G | 45 × 38 | * |
| 69 | CDI | 2 | LB Her2(-) | 25 | No | No desea cirugía | 0 | 13G | 41 × 37 | * |
| 99 | CDI | 1 | LB Her2(-) | 40 | No | Progresión a pesar de HT | 0 | 10G | 50 × 41 | * |
| 60 | CDI | 2 | LB Her2(-) | 33 | Tatuaje | Tumor de pulmón avanzado | 0 | 10G | 53 × 38 | * |
CDI: carcinoma ductal infiltrante; CPI: carcinoma papilar infiltrante; Her2: receptor 2 del factor de crecimiento epidérmico humano; HT: hormonoterapia; LA: luminal A; LB: luminal B.
La ablación térmica con frío es una técnica sencilla para un radiólogo con experiencia en procedimientos percutáneos. Sus complicaciones son poco frecuentes y leves2. Hoy en día, permite evitar quirófanos en lesiones benignas demasiado grandes para ser extirpadas con el sistema de vacío y controlar localmente neoplasias en mujeres no candidatas a cirugía. Además, está demostrando un papel importante en pacientes con tumores en estadio IV, y en un futuro no lejano permitirá el tratamiento de cánceres en estadios precoces.
Autoría- 1.
Responsable de la integridad del estudio: LGL, MVC.
- 2.
Concepción del estudio: LGL.
- 3.
Diseño del estudio: LGL.
- 4.
Obtención de los datos: LGL, MVC, ÁVA.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: LGL, TPR.
- 8.
Redacción del trabajo: LGL, TPR.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MVC.
- 10.
Aprobación de la versión final: LGL, MVC, ÁVA, TPR.
No hemos recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.