La resonancia magnética cardiaca se considera la técnica de referencia para la caracterización tisular del miocardio, como por ejemplo para la valoración del edema. En este sentido, la utilización de secuencias potenciadas en T2 permite valorar áreas de edema o de inflamación del miocardio. Sin embargo, las secuencias tradicionales presentan numerosas limitaciones y solo proporcionan una información cualitativa. Además, dependen de la referencia del miocardio remoto o del músculo esquelético, lo que representa una limitación en la detección y cuantificación del daño miocárdico difuso. El desarrollo reciente de las técnicas de mapeo miocárdico mediante resonancia magnética proporciona una valoración cuantitativa de los parámetros indicativos de edema. Estas secuencias han demostrado su superioridad sobre las secuencias tradicionales, tanto en las miocardiopatías agudas como en la patología isquémica aguda. Este artículo sintetiza el desarrollo actual de las secuencias de mapeo T2, sus aplicaciones clínicas y sus limitaciones.
Cardiac magnetic resonance imaging is considered the reference technique for characterizing myocardial tissue; for example, T2-weighted sequences make it possible to evaluate areas of edema or myocardial inflammation. However, traditional sequences have many limitations and provide only qualitative information. Moreover, traditional sequences depend on the reference to remote myocardium or skeletal muscle, which limits their ability to detect and quantify diffuse myocardial damage. Recently developed magnetic resonance myocardial mapping techniques enable quantitative assessment of parameters indicative of edema. These techniques have proven better than traditional sequences both in acute cardiomyopathy and in acute ischemic heart disease. This article synthesizes current developments in T2 mapping as well as their clinical applications and limitations.
Las características de los protones en resonancia magnética (RM) varían entre los tejidos, dependiendo de la configuración de los átomos. Estas diferencias inherentes de los tejidos pueden aprovecharse para generar diversas señales que permitan la diferenciación tisular. A este respecto, el tiempo de relajación de T2 viene determinado por el tiempo que tarda en perderse el componente transversal de la magnetización, en un campo magnético externo perfectamente homogéneo, después de un pulso de excitación. El T2 de un tejido es más corto cuando el agua se encuentra estrechamente cohesionada a grandes moléculas como el colágeno y, por el contrario, es más largo cuando el agua se encuentra libre. Las imágenes potenciadas en T2 ponen de relieve tejidos con T2 largo o condiciones en las que el edema está presente.
La aplicación de las técnicas de imagen de resonancia magnética cardiaca (RMC) potenciadas en T2ha permitido la visualización del edema miocárdico. El edema es un componente universal de la respuesta tisular a la lesión aguda y, por tanto, es un hallazgo importante para valorar la agudeza del daño tisular1. Higgins et al. demostraron, en 1983, una relación directa entre el tiempo de relajación de T2 y el contenido acuoso en un modelo canino de infarto agudo de miocardio2. El perfeccionamiento de las secuencias potenciadas en T2 (T2W), como las secuencias T2W-short tau inversion recovery (T2-STIR)3, las secuencias steady-state free precession preparadas en T2 (T2p-SSFP)4 y las secuencias ACUTE (T2-acquisition for cardiac unified T2 edema)5, han proporcionado una detección bastante precisa del edema local6. En la cardiopatía isquémica, las secuencias T2W son capaces de diferenciar entre cambios agudos y crónicos7. Asimismo, las secuencias T2W son esenciales para establecer el diagnóstico correcto de enfermedades inflamatorias del miocardio, como la miocarditis o la miocardiopatía de tako-tsubo8,9, especialmente cuando la secuencia de realce tardío con gadolinio (RTG) resulta aparentemente normal. Lamentablemente, las técnicas T2-STIR tradicionales tienen limitaciones que afectan a su capacidad diagnóstica, con aumento de los artefactos en pacientes con ritmo cardiaco irregular o con dificultades en mantener la apnea. Las variaciones de intensidad de la antena de superficie requieren métodos de normalización especializados. La señal hiperintensa debido al flujo lento altera el análisis del aumento de señal de T2 del miocardio adyacente, con lo que la interpretación de las imágenes resulta muy subjetiva. Aunque las técnicas T2p-SSFP y las ACUTE han conseguido reducir los artefactos de movimiento, un incremento global de la señal de T2 sigue siendo difícil de apreciar en cualquier imagen T2W. También se han desarrollado métodos semicuantitativos para las secuencias T2W que, por ejemplo, calculan la intensidad de señal del miocardio remoto no afectado o del músculo esquelético adyacente; sin embargo, estos métodos tienen bajo rendimiento cuando la afectación miocárdica es difusa. Además, disminuye su sensibilidad cuando existe afectación concomitante del músculo esquelético, como se ha descrito en la miocarditis9. Consecuentemente, las secuencias T2W no van a detectar el edema generalizado del miocardio, como suele suceder en casos de panmiocarditis o en el rechazo del trasplante cardiaco. Las secuencias cuantitativas de mapeo T2 desarrolladas recientemente superan estas limitaciones10.
Este artículo es el segundo de dos actualizaciones en las que se describen las nuevas técnicas de medición del tiempo de relajación T1 y T2 del tejido miocárdico, su representación en mapas paramétricos, su utilidad clínica y sus limitaciones.
Consecuencias clínicas del edemaEl edema representa una respuesta generalizada a la lesión tisular aguda, independientemente de su etiología (p. ej., mecánica, tóxica, isquémica, infecciosa) y por tanto es un objetivo diagnóstico importante para valorar el grado de agudeza de la lesión1. El término edema miocárdico se refiere tanto al edema citogénico (tumefacción de los miocitos) como al vasogénico (acumulación de fluido en el espacio intersticial). Diversas condiciones, tanto agudas como crónicas, como el infarto de miocardio11, el daño por reperfusión12, la inflamación8, la hipertensión pulmonar13, la cardioplejia14 el trasplante cardiaco15 y el rechazo al trasplante cardiaco16, se acompañan de edema (fig. 1). El edema no es solo un hallazgo inespecífico e invariable que acompaña a la lesión aguda, sino que también tiene consecuencias fisiopatológicas en sí mismo. La presencia de edema aumenta la rigidez del ventrículo izquierdo17. El incremento de la presión hidrostática puede exacerbar la necrosis por compresión capilar18. Además, el edema puede contribuir a la disfunción miocárdica tras la isquemia (aturdimiento), al desencadenamiento de arritmias12 y a la reducción de la elasticidad ventricular19. Cuando es crónico, el edema contribuye a la alteración de la estructura miocárdica y, lo que es más importante, al desarrollo de fibrosis20. La formación de fibrosis a partir del edema podría estar relacionada con cambios en la presión intramiocárdica y con el alto contenido en proteínas del edema. Sin embargo, todavía no se conoce con exactitud cómo afecta el edema a la función sistólica y diastólica, a la composición tisular a largo plazo y a la estabilidad eléctrica.
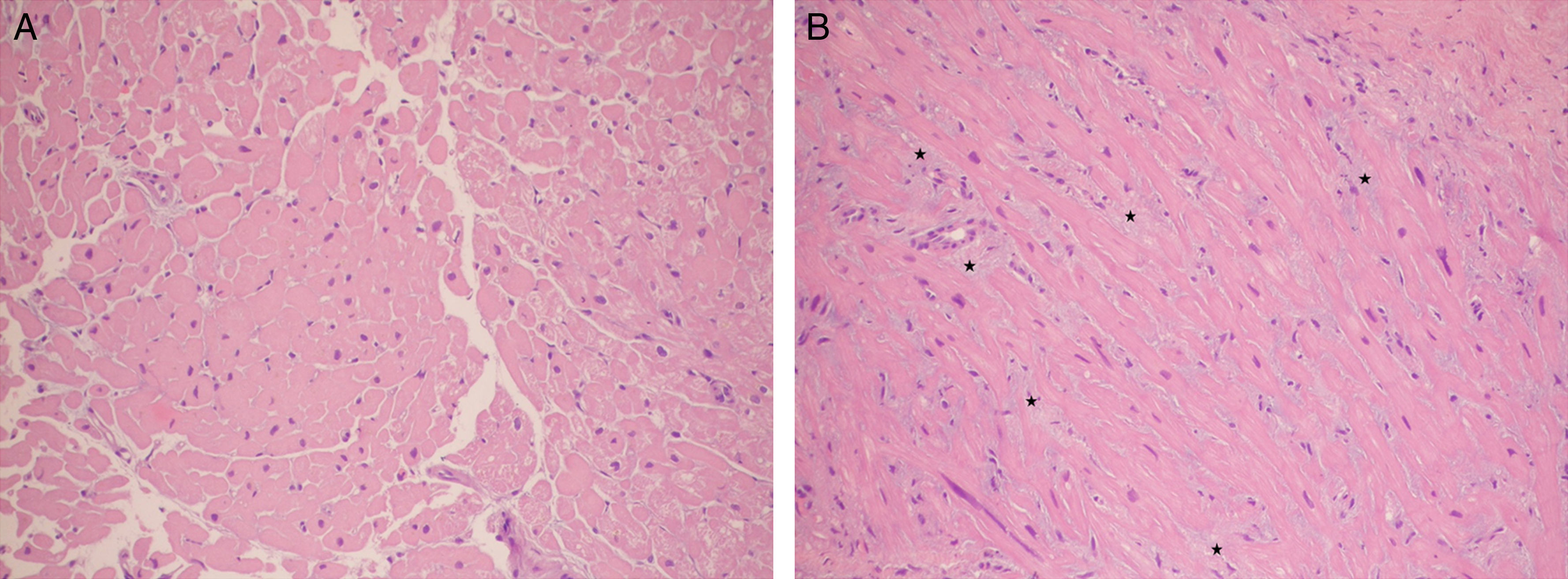
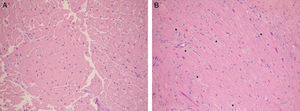
Dos muestras histológicas teñidas con hematoxilina-eosina (aumento ×200). A) Miocardio normal con fibras compactas. B) Paciente trasplantado cardiaco con rechazo agudo donde se observa edema intersticial prominente (se ven las fibras miocárdicas separadas por un material levemente azulado correspondiente al edema: estrellas).
El T2 o tiempo de relajación espín-espín se define como el tiempo requerido para que la magnetización transversal del vector alcance el 37% de su magnitud original después de su excitación inicial. El tiempo de relajación de T2 es sensible al edema y se encuentra determinado no solo por el incremento absoluto del agua miocárdica, sino también por el movimiento de moléculas de agua del espacio extracelular al intracelular (edema celular) y por la disociación de moléculas de agua de las proteínas, lo que conduce a un aumento del agua libre1. El T2 se encuentra elevado en las condiciones que cursan con un incremento del agua libre en el miocardio, como sucede en el infarto agudo2, en la miocarditis9, en la miocardiopatía inducida por estrés21 y otras miocardiopatías (miocardiopatía dilatada idiopática)22 y en el rechazo al trasplante cardiaco23. Utilizando una secuencia spin-echo se puede conseguir una imagen T2W mediante un tiempo de repetición largo comparado con el T1 del tejido (disminuyendo así la contribución del T1 en el contraste de la imagen) y con un tiempo de eco en el rango del valor de T2 del tejido de interés. Los tejidos con un T2 más largo tendrán mayor señal en una secuencia T2W; así, el agua y los tejidos con alto contenido en agua tienen valores de T2 largos y aparecen brillantes. Las técnicas spin-echo, turbo spin-echo o fast spin-echo se han empleado durante mucho tiempo para la caracterización tisular miocárdica asociada con incremento del contenido de agua. Las secuencias STIR mediante la utilización de un triple pulso de inversión, con tiempo de inversión corto y supresión grasa, mejoran la visualización del edema. Sin embargo, estas técnicas estándar T2W de sangre negra tienen diferentes limitaciones, como son: a) la inhomogeneidad de señal de intensidad del miocardio causada por el movimiento cardiaco a través de plano; b) la elevada intensidad de señal del subendocardio debido al flujo lento de la sangre, y c) la pérdida de la intensidad de señal en los segmentos laterales y posteriores relacionada con la antena de superficie24,25. Las técnicas T2p-SSFP4 y ACUTE5 superan algunas de estas deficiencias, pero continúan siendo métodos cualitativos y siguen dependiendo de la interpretación subjetiva de las imágenes. Una alternativa a las secuencias T2W es la cuantificación directa del T2 del miocardio. Mediante las técnicas paramétricas de mapeo T2 se pueden minimizar los artefactos asociados a las secuencias T2W, reducir la dependencia de los parámetros de adquisición de la imagen y evitar la interpretación subjetiva de las imágenes, pudiendo detectar con mayor facilidad diferencias sutiles del valor de T2 de los tejidos. En los últimos años se han desarrollado técnicas cuantitativas de mapeo de T2 que se realizan de forma rápida y que superan las limitaciones de las secuencias T2W10.
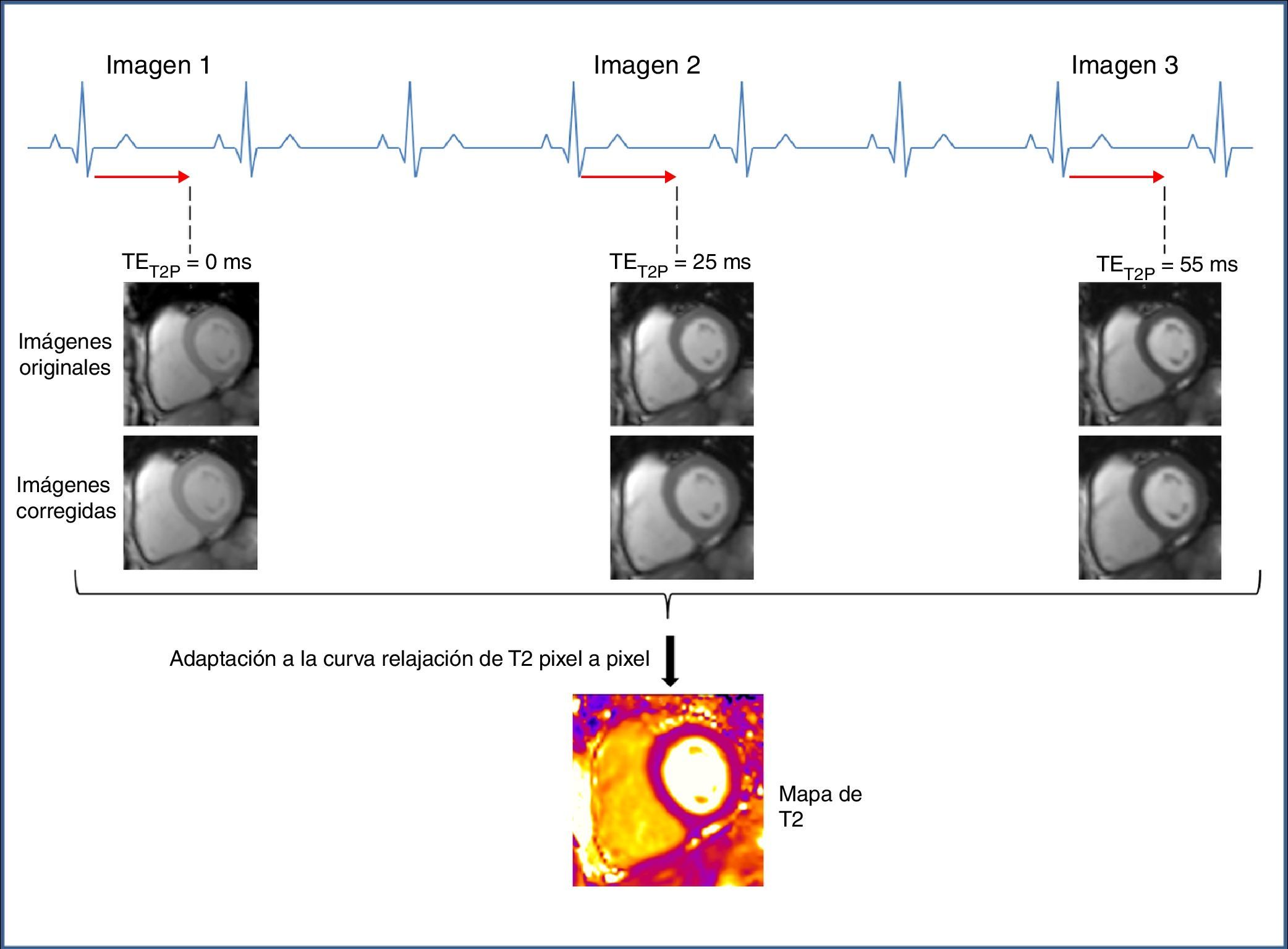
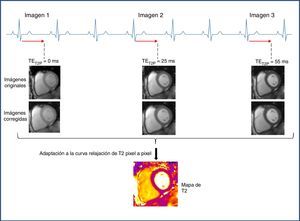
Metodología de obtención de los mapas de T2Para generar un mapa de T2 se utiliza una secuencia SSFP (también llamada TrueFISP, FFE o FIESTA según la casa comercial) para producir tres imágenes single-shot potenciadas en T2, cada una de ellas con diferente tiempo de preparación de T2 (TET2P=0ms, 24ms, 55ms)4. Las imágenes se adquieren cada 2-4 intervalos RR (dependiendo de la frecuencia cardiaca) para permitir una recuperación suficiente del T1, en la misma fase del ciclo, en una única apnea y en sucesivos latidos cardiacos4,10. El máximo TET2P se escoge basándose en el T2 esperado del miocardio, que es de aproximadamente 55 ms1. Para corregir el movimiento cardiaco y respiratorio residual entre los grupos de imágenes, se utiliza un algoritmo no rígido de corrección del movimiento26. Las imágenes obtenidas se procesan ajustando la curva de recuperación de T2 con cada píxel para producir el mapa de T2 (fig. 2).
Esquema de la adquisición de datos y de la reconstrucción de un mapa de T2. Se adquieren imágenes TrueFISP preparadas en T2 a intervalos de por lo menos 3 RR para permitir la suficiente recuperación de la magnetización entre las adquisiciones. Cada imagen se adquiere en la misma fase diastólica. Se aplica un algoritmo de corrección del movimiento. Finalmente se adapta la curva de relajación de T2 píxel a píxel asumiendo una señal de relajación de T2 monoexponencial. TET2P: tiempo de preparación de T2.
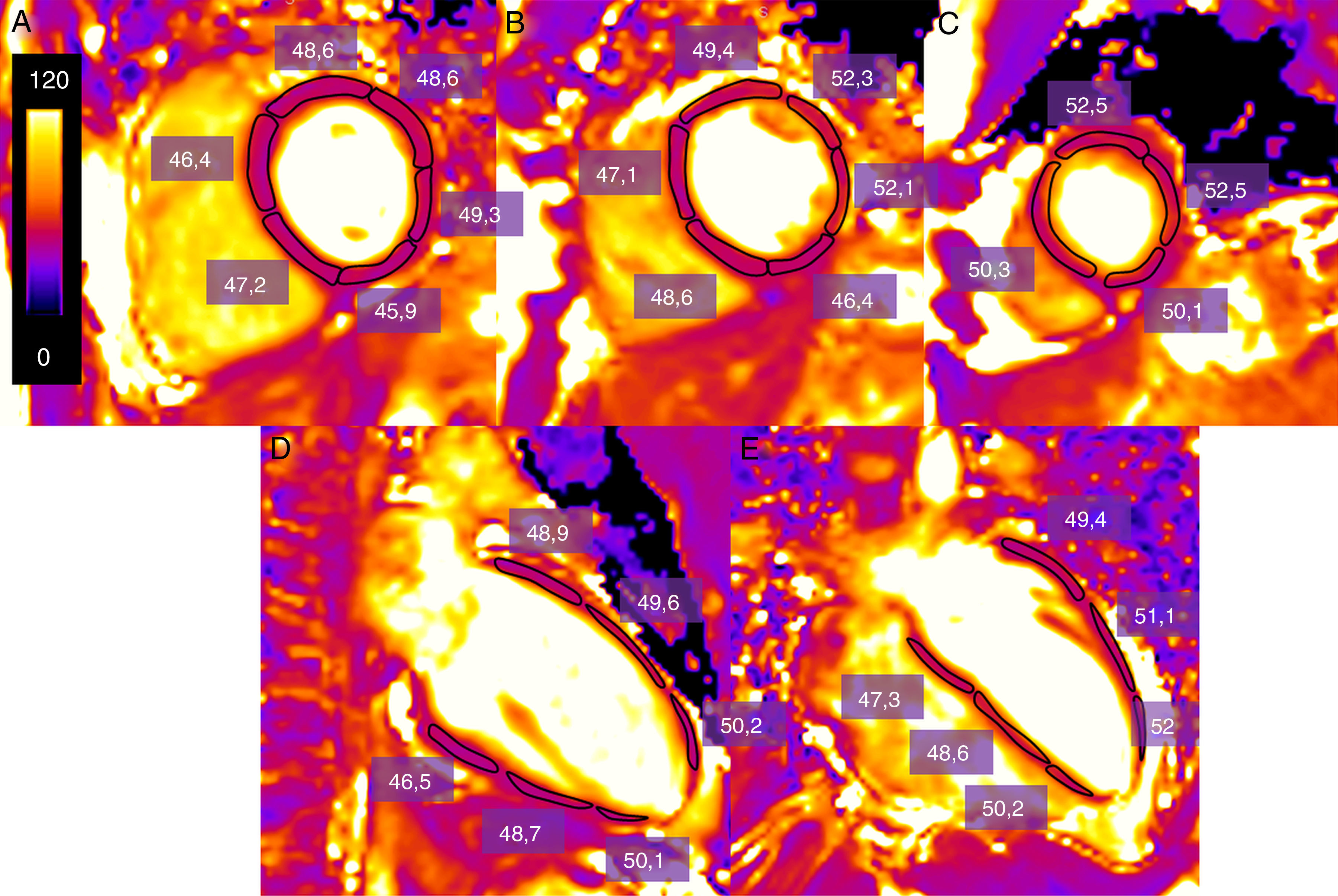
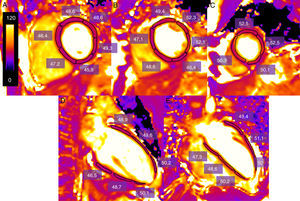
Una de las formas más utilizadas en la adquisición y posprocesado de los datos es la siguiente: los datos se adquieren en un eje corto a nivel basal, medio-ventricular y apical y en dos ejes largos (horizontal y vertical)10. Para cuantificar el valor de T2 se pueden delimitar manualmente los contornos endocárdico y epicárdico, segmentándolos, siguiendo el modelo de la American Heart Association (AHA)10, o bien dibujando regiones de interés (ROI) que incluyan cada segmento miocárdico27 (fig. 3). Las trabeculaciones y el borde epicárdico se dejan fuera de los contornos, basándose en caso de duda en las imágenes de cine para asegurarse de que no se incluye sangre o grasa epicárdica. Muchos grupos excluyen el ápex, ya que el valor de T2 es más elevado28 (probablemente debido a que la curvatura del ventrículo hace que aumente el efecto de volumen parcial). Los ejes largos pueden utilizarse para dibujar el borde miocárdico en los segmentos apicales. También se puede dibujar un ROI en el área de interés cuando no es necesaria una cuantificación global del T2.
Cálculo de la media del tiempo de T2 (enms) del ventrículo izquierdo en un voluntario sano obtenido con una secuencia SSFP potenciada en T2 en un equipo de 3T (Magnetom Trio-Tim, Siemens, Erlangen, Germany). Se dibuja una región de interés (ROI) que incluye cada segmento miocárdico, en un corte basal, medioventricular y apical, cuantificando así la media del valor de relajación de T2 (en este caso de 49.1ms) (A, B, C). En el caso de que quede artefactado algún segmento en el eje corto, se utilizan los ejes largos (D, E).
Una de las grandes limitaciones de esta secuencia es la gran variabilidad existente en el valor del T2 entre sujetos10. Entre las fuentes de error se encuentran:
- 1.
El hecho de que las diferencias del T2 entre el miocardio sano y el patológico son relativamente pequeñas, por ejemplo 13-11ms entre el núcleo del infarto/miocarditis y el miocardio remoto27,29.
- 2.
La gran dependencia entre el T2 y la frecuencia cardiaca. Con frecuencias cardiacas elevadas el valor del T2 disminuye, debido a una incompleta relajación del T1 entre cada adquisición, hallazgo que es relevante en la práctica clínica, ya que incrementos sutiles del valor de T2 pueden desaparecer en pacientes con cuadro agudo y aumento de la frecuencia cardiaca28. Este efecto puede minimizarse aumentando el número de latidos entre imágenes, lo que da más tiempo para la recuperación del T127.
- 3.
Los artefactos de fuera de resonancia y de bandas10,27,29, que afectan especialmente a la cara inferolateral, donde patologías como la miocarditis pueden presentar su principal afectación9.
- 4.
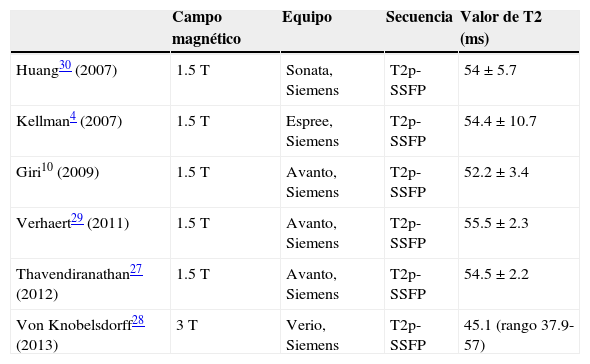
La influencia de los parámetros técnicos relacionados con la adquisición de las imágenes en el valor del T2. Por tanto, es importante obtener los valores de referencia normales para cada contexto concreto, idealmente en cada centro. La tabla 1 muestra el valor medio de T2 en sujetos sanos en diferentes estudios.
Tabla 1.Valores de referencia normales de T2 en diferentes estudios
Campo magnético Equipo Secuencia Valor de T2 (ms) Huang30 (2007) 1.5T Sonata, Siemens T2p-SSFP 54±5.7 Kellman4 (2007) 1.5T Espree, Siemens T2p-SSFP 54.4±10.7 Giri10 (2009) 1.5T Avanto, Siemens T2p-SSFP 52.2±3.4 Verhaert29 (2011) 1.5T Avanto, Siemens T2p-SSFP 55.5±2.3 Thavendiranathan27 (2012) 1.5T Avanto, Siemens T2p-SSFP 54.5±2.2 Von Knobelsdorff28 (2013) 3T Verio, Siemens T2p-SSFP 45.1 (rango 37.9-57) T2p-SSFP: secuencia steady-state free precession preparada en T2.
Los mapas de T2 han demostrado su utilidad en la evaluación de diferentes patologías cardiacas:
- 1.
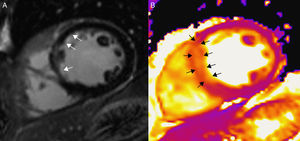
En el infarto agudo de miocardio, los mapas de T2 son un método rápido y preciso para detectar incrementos del valor de T2 resultantes del edema inducido por la isquemia miocárdica, superando las limitaciones inherentes a otras técnicas10,31. Los segmentos miocárdicos con isquemia reciente pueden cuantificarse y diferenciarse del miocardio remoto por su mayor valor de T229,31,32 (fig. 4). La reperfusión del miocardio gravemente isquémico puede causar hemorragia intramiocárdica por extravasación de hematíes a través de los capilares lesionados del endocardio. Existe una relación entre la hemorragia intramiocárdica y la obstrucción microvascular33–35, y la hemorragia afecta al tiempo de relajación de T2 debido a los efectos paramagnéticos de la desoxihemoglobina contenida en los productos de degradación de la sangre liberados durante la reperfusión, siendo este el mecanismo por el que el valor de T2 en el centro del infarto agudo se encuentra acortado en los casos en los que existe obstrucción microvascular29,31,32 (fig. 5). Dada la gran controversia existente respecto a la reproducibilidad y robustez de las secuencias convencionales T2W en la delimitación del área en riesgo y en la cuantificación del miocardio salvable36, las secuencias de mapeo T2 han suscitado gran interés en la valoración del miocardio salvable37,38 (fig. 6), proporcionando al igual que el T1 nativo, excelentes resultados en la determinación del área en riesgo29,38. Las técnicas de mapeo T1 y T2 son esencialmente equivalentes a la hora de determinar el área en riesgo. Las propiedades de relajación de T1 y T2 cambian en el mismo sentido, consecuente con el edema miocárdico que ocurre tras la isquemia/reperfusión. Estas técnicas aportan, además, la capacidad de realizar una cuantificación volumétrica del área en riesgo incluyendo todo el corazón.
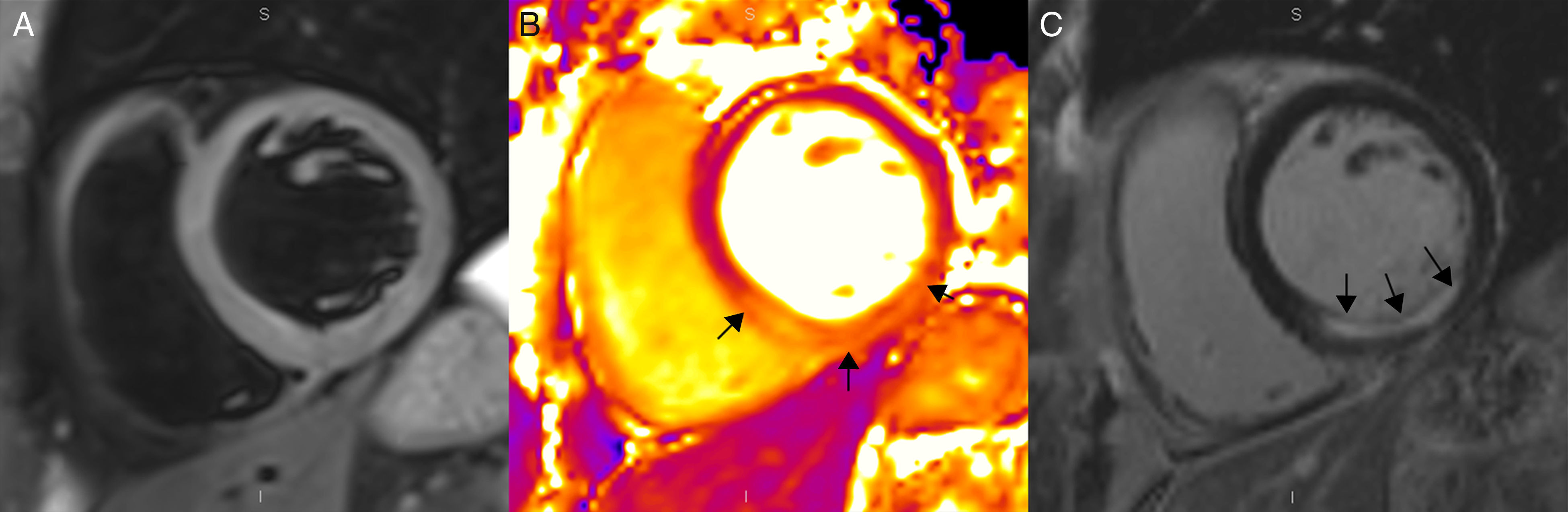
Figura 4.Resonancia magnética en un paciente con infarto agudo de miocardio inferior, en un equipo de 3T (Magnetom Trio-Tim, Siemens, Erlangen, Germany). A) Secuencia T2W-STIR en la que no se evidencia edema. B) Mapa de T2 que pone de manifiesto un valor de 61ms en los segmentos afectados (flechas) y de 47ms en el miocardio remoto (el valor normal de T2 del miocardio es de 49±3ms).C) Secuencia de realce tardío con gadolinio donde puede observarse un realce subendocárdico (flechas) correspondiente al infarto.
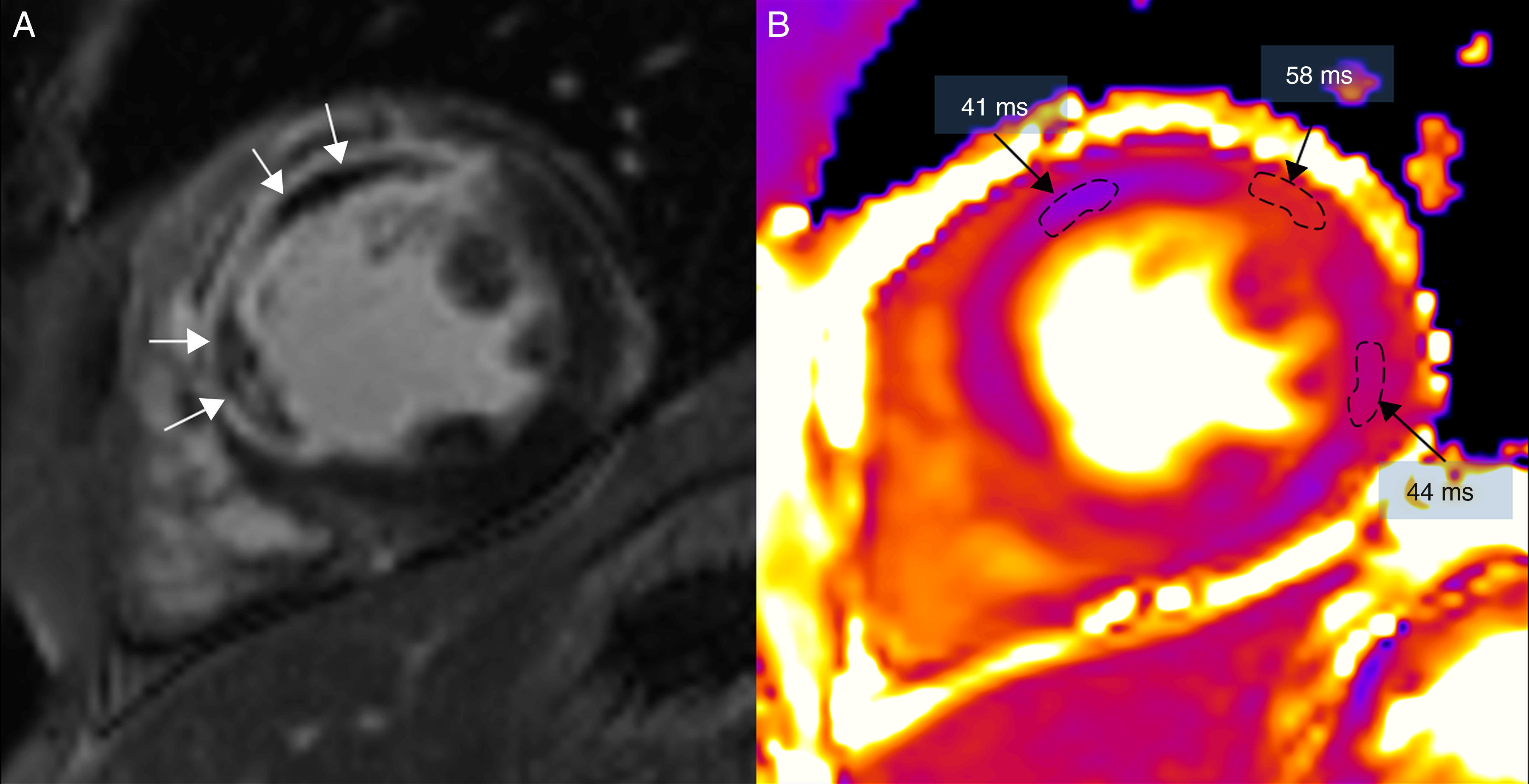
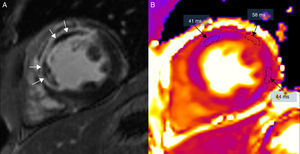
(0,34MB).Figura 5.Resonancia magnética en un paciente con extenso infarto transmural anterior y septal, en un equipo de 3T (Magnetom Trio-Tim, Siemens, Erlangen, Germany). A) Secuencia de realce tardío con gadolinio donde puede observarse la obstrucción microvascular (flechas blancas). B) Mapa de T2 donde puede observarse cómo el área de obstrucción microvascular presenta un tiempo de T2 menor (41ms) que el edema (58ms); el miocardio remoto de la cara lateral tiene un valor de T2 de 44ms (el valor normal de T2 del miocardio es de 49±3ms).
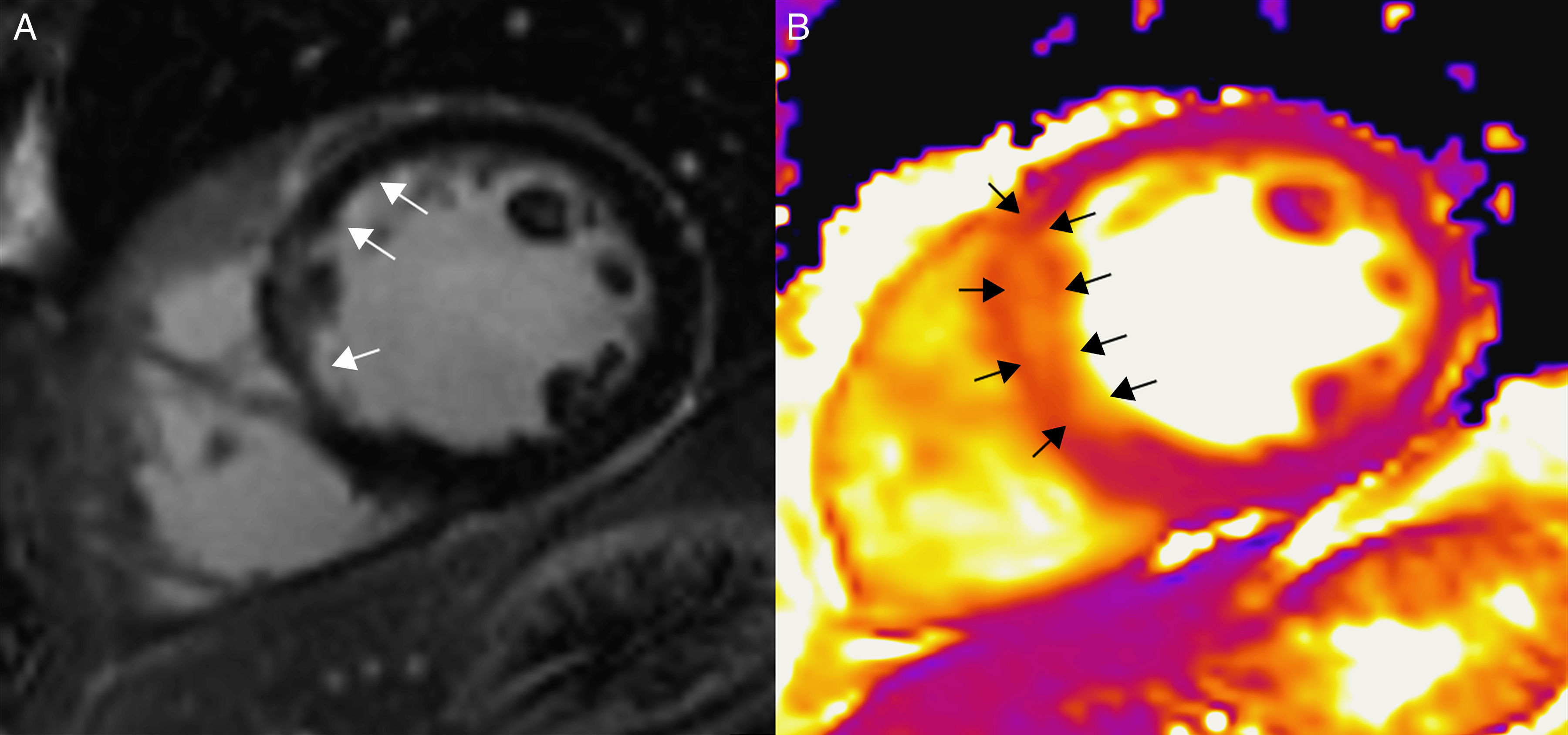
(0,43MB).Figura 6.Paciente con infarto agudo de miocardio a nivel septal, en un equipo de 3T (Magnetom Trio-Tim, Siemens, Erlangen, Germany). A) Secuencia de realce tardío con gadolinio que muestra un realce subendocárdico (flechas). B) En el mapa de T2 puede observarse cómo el área de edema (flechas) es más extensa que el infarto, lo que permite determinar el miocardio en riesgo.
(0,37MB). - 2.
En las patologías inflamatorias agudas, como la miocarditis o el tako-tsubo, las secuencias de mapeo demuestran un incremento del T2, lo que permite delimitar con precisión la extensión de la afectación miocárdica27. Los criterios actuales de RMC “Lake Louise” para el diagnóstico de miocarditis incluyen la valoración del edema miocárdico, la hiperemia y la necrosis, proporcionando gran exactitud en el diagnóstico8. Sin embargo, se basan en técnicas cualitativas, con sus limitaciones inherentes, especialmente cuando la lesión miocárdica es difusa. Diferentes estudios demuestran que las técnicas de mapeo T2 mejoran la precisión diagnóstica de la RMC ante la sospecha de miocarditis10,27,29,39. Los mapas de T2 revelan que la afectación miocárdica es más difusa que la detectada con las secuencias T2W y con el RTG27.
- 3.
El rechazo agudo del trasplante cardiaco es el factor más importante que determina la supervivencia en los primeros 12 meses tras el trasplante. El rechazo agudo se caracteriza por una serie de procesos que precipitan una respuesta inflamatoria del miocardio, produciendo edema, infiltración celular y finalmente muerte celular. En el primer año tras el trasplante es frecuente el control del rechazo mediante biopsia endomiocárdica, la cual es invasiva, costosa, sujeta a potenciales efectos secundarios y propensa al error de muestreo. La RMC se presenta como una alternativa a la biopsia en la supervisión del rechazo agudo en el primer año tras el trasplante. Las técnicas de mapeo T2 pueden cuantificar el edema miocárdico asociado al rechazo agudo y además tienen la capacidad de valorar toda la pared miocárdica. Asimismo, se ha demostrado que los valores de T2 vuelven a la normalidad varias semanas después de tratarse el episodio de rechazo agudo, lo que refleja la resolución del edema tras el tratamiento40.
- 4.
Los mapas de T2 también se han utilizado en la valoración de la sobrecarga de hierro41. Las propiedades paramagnéticas del hierro se traducen en un acortamiento tanto del T1 y el T2 como del T2*42. En un estudio reciente realizado con 136 pacientes con talasemia, se ha observado una relación lineal entre el T2 y el T2* en sujetos con sobrecarga de hierro, lo que muestra una utilidad similar para evidenciar el depósito férrico41.
Las técnicas de mapeo T2 han demostrado su utilidad clínica como método de valoración tisular cuantitativa por RMC en una variedad de enfermedades cardiacas que cursan con edema miocárdico.
Las secuencias cuantitativas de mapeo T2 son una técnica rápida que supera las limitaciones asociadas a las imágenes T2W, y proporcionan un método más seguro en la detección del edema miocárdico.
Sin embargo es necesario seguir avanzando en este campo para evaluar la aplicabilidad clínica de esta técnica en el amplio rango de condiciones que afectan al contenido de agua del miocardio de forma focal o difusa.
Autoría- 1.
Responsable de la integridad del estudio: RJPP.
- 2.
Concepción del estudio: RJPP.
- 3.
Diseño del estudio: RJPP.
- 4.
Obtención de los datos: RJPP, MSA, JTOP, SPG, MTCL, TMCR.
- 5.
Análisis e interpretación de los datos: RJPP, MSA, JTOP, SPG, MTCL, TMCR.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: RJPP.
- 8.
Redacción del trabajo: RJPP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RJPP, MSA, JTOP, SPG, MTCL, TMCR.
- 10.
Aprobación de la versión final: RJPP, MSA, JTOP, SPG, MTCL, TMCR.
Los autores declaran no tener ningún conflicto de intereses.
Justificación del exceso de autoresEste trabajo ha sido posible gracias a un proyecto FIS de caracterización tisular miocárdica mediante resonancia magnética cardiaca 3T en pacientes con mieloma afectados de amiloidosis cardiaca, del que se han derivado otros subproyectos (estudio mediante técnicas paramétricas de mapeo T1 y T2 en voluntarios sanos y en pacientes afectados de micardiopatías) en la que todos los autores que aparecen en el artículo han participado.
FinanciaciónEste estudio ha sido parcialmente financiado por una beca FIS PI12/01290 del Ministerio de Economía y Competitividad, Instituto de Salud Carlos III, España.