Analizar las características radiológicas en resonancia magnética (RM) de sarcomas uterinos (principalmente carcinosarcomas) y compararlas con las de adenocarcinomas para definir hallazgos útiles para el diagnóstico diferencial.
Material y métodosRevisamos retrospectivamente los estudios de RM de 13 pacientes con diagnóstico histológico de sarcoma uterino. Analizamos el tamaño tumoral, la señal en secuencias T1, T2, T1 con gadolinio y difusión. Comparamos los datos obtenidos con otra serie de 30 casos consecutivos de adenocarcinomas estudiados mediante RM.
ResultadosLos sarcomas presentaron un tamaño considerablemente mayor que los adenocarcinomas (p<0,001), y midieron más de 9cm en el 77% de los casos. No hubo diferencias en la estadificación tumoral según la FIGO valorada mediante RM y cirugía, y ambos tumores se diagnosticaron en estadios tempranos. La intensidad de señal en T2 fue significativamente diferente (p<0,001), y el 100% de los sarcomas heterogéneos fueron predominantemente hiperintensos en T2 respecto al miometrio. El 100% de los sarcomas presentó un realce igual o mayor que el miometrial en el estudio poscontraste, con una diferencia significativa (p<0,001) con los adenocarcinomas. En difusión no evidenciamos diferencias en los valores de ADC (apparent diffusion coefficient) en las áreas con mayor restricción, pero el mapa de ADC fue más heterogéneo en los sarcomas.
ConclusiónLos sarcomas uterinos no presentan características específicas en RM, pero algunos hallazgos pueden indicar este diagnóstico. En nuestro estudio mostraron diferencias significativas con respecto a los adenocarcinomas, presentándose como tumores de mayor tamaño, de señal hiperintensa y heterogénea en T2, y con un realce mayor o igual que el miometrial.
To analyze the MRI characteristics of uterine sarcomas (mainly carcinosarcomas) and to compare them with those of adenocarcinomas to define the findings that would be useful for the differential diagnosis.
Materials and methodsWe retrospectively reviewed the MRI studies of 13 patients with histologically diagnosed uterine sarcoma. We analyzed tumor size, signal in T2-weighted, unenhanced and gadolinium-enhanced T1-weighted, and diffusion-weighted sequences. We compared the data obtained with those of another series of 30 consecutive cases of adenocarcinomas studied with MRI.
ResultsThe sarcomas (> 9cm in 77% of cases) were considerably larger than the adenocarcinomas (p<0.001). There were no differences in FIGO staging by MRI or surgery: both tumor types were diagnosed in early stages. The signal intensity in T2-weighted images differed significantly between the two tumor types: all the sarcomas were heterogeneous and predominantly hyperintense with respect to the myometrium in T2-weighted sequences (p<0.001). In postcontrast studies, all the sarcomas showed enhancement greater than or equal to the myometrium; this finding was significantly different from the adenocarcinomas (p<0.001). In diffusion-weighted sequences, we found no significant differences in ADC values in the areas with greatest restriction, but the ADC map was more heterogeneous in the sarcomas.
ConclusionUterine sarcomas do not have specific characteristics on MRI, but some findings can indicate the diagnosis. In our study, we found significant differences between sarcomas and adenocarcinomas. Sarcomas were larger, had more hyperintense and heterogeneous signal intensity in T2-weighted sequences, and enhanced more than or at least as much as the myometrium.
Los sarcomas uterinos suponen el 2-5% de los tumores malignos uterinos1–3, y el carcinosarcoma (tumor mülleriano mixto, TMMM) es el subtipo histológico más frecuente. Son tumores muy agresivos, con peor pronóstico que los adenocarcinomas endometriales, y con una supervivencia a 5 años inferior al 35%. Presentan un patrón de diseminación y manejo distintos al adenocarcinoma1,2,4.
El tratamiento de elección sigue siendo la histerectomía con anexectomía bilateral, pero dada la elevada tasa de recidivas locales y metástasis, probablemente sean útiles la linfadenectomía y el tratamiento adyuvante. En las guías clínicas no existe consenso sobre el manejo terapéutico óptimo. Varias combinaciones de quimiorradioterapia han probado mejorar el control local del tumor, pero no han demostrado un aumento de la supervivencia global en estas pacientes5.
La diferenciación preoperatoria entre sarcomas y adenocarcinomas es importante, ya que el pronóstico y el tratamiento pueden diferir.
El propósito de nuestro estudio es analizar la semiología en resonancia magnética (RM) de nuestra serie de sarcomas uterinos y compararla con otra serie de 30 casos consecutivos de adenocarcinomas, para definir qué características pueden ser más útiles para el diagnóstico diferencial. Comparamos finalmente nuestros resultados con los descritos en la bibliografía.
Material y métodosEstudio realizado en la unidad multidisciplinar de ginecología oncológica de un hospital terciario. Recogimos datos del archivo informático de nuestro hospital contando con la aprobación del Comité Ético del mismo, que no estimó necesario recabar consentimiento expreso de las pacientes al ser un estudio retrospectivo.
Población de pacientesRevisión retrospectiva de todos los sarcomas uterinos operados en nuestro hospital en los últimos 10 años, seleccionando aquellos estudiados con RM preoperatoria, con la que obtuvimos un total de 13 casos: 8 carcinosarcomas, 2 leiomiosarcomas, 1 sarcoma endometrial, 1 sarcoma del estroma endometrial y 1 sarcoma estromal.
Revisamos los estudios de RM preoperatoria de estas pacientes y comparamos con la RM preoperatoria de 30 casos consecutivos de pacientes operadas con diagnóstico histológico de adenocarcinoma de endometrio.
Técnica de resonancia magnéticaLos estudios se hicieron en dos equipos de RM de 1,5T (Signa Advantage y Signa HDx; General Electric Healthcare, Milwaukee, WI, EE.UU.) utilizando una antena de superficie receptora de 8 canales.
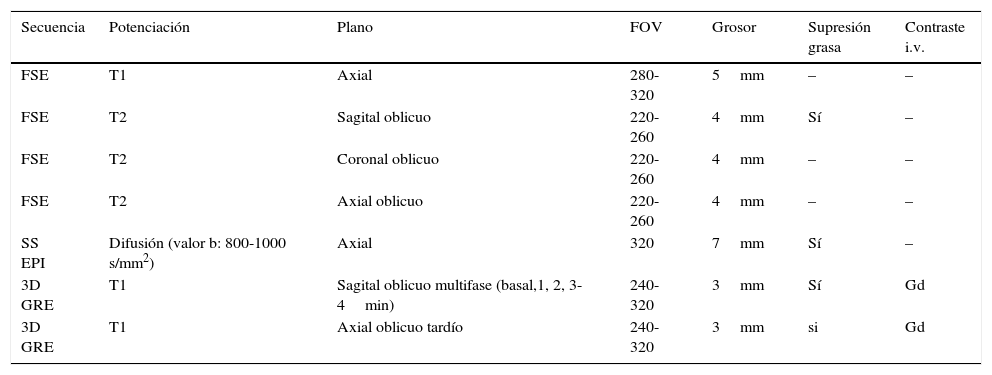
El protocolo (tabla 1) incluyó secuencias potenciadas en T1, T2 y difusión y un estudio dinámico poscontraste (Gadoterato meglumina 0,1mmol/kg. Dotarem® Guerbet, Francia).
Protocolo de resonancia magnética de pelvis en máquina de 1,5T
| Secuencia | Potenciación | Plano | FOV | Grosor | Supresión grasa | Contraste i.v. |
|---|---|---|---|---|---|---|
| FSE | T1 | Axial | 280-320 | 5mm | – | – |
| FSE | T2 | Sagital oblicuo | 220-260 | 4mm | Sí | – |
| FSE | T2 | Coronal oblicuo | 220-260 | 4mm | – | – |
| FSE | T2 | Axial oblicuo | 220-260 | 4mm | – | – |
| SS EPI | Difusión (valor b: 800-1000 s/mm2) | Axial | 320 | 7mm | Sí | – |
| 3D GRE | T1 | Sagital oblicuo multifase (basal,1, 2, 3-4min) | 240-320 | 3mm | Sí | Gd |
| 3D GRE | T1 | Axial oblicuo tardío | 240-320 | 3mm | si | Gd |
FOV: field of view; FSE: Fast Spin Eco; Gd: gadolinio; GRE: Gradient Echo; SS EPI: Single Shot Echo-Planar Imaging.
Cada RM fue revisada retrospectivamente por dos radiólogos en consenso. Las variables analizadas y recogidas fueron: edad de las pacientes, tamaño del tumor medido en tres diámetros máximos perpendiculares, estadificación en RM (clasificación FIGO 2009), intensidad de señal y características en secuencias potenciadas en difusión, en T2 y en T1, realce y características del mismo en secuencias potenciadas en T1 con gadolinio (homogéneo/heterogéneo, hipo-iso-hiperintenso, fase de mayor realce), tomando como referencia la señal y el realce del miometrio. También se recogieron la estadificación histológica posquirúrgica del tumor, la existencia de enfermedad a distancia y la presencia de ascitis o hidronefrosis.
Se comparan los estudios de RM de esta serie de sarcomas uterinos con 30 estudios consecutivos de RM de pacientes con diagnóstico histológico de adenocarcinoma de endometrio.
Análisis estadísticoEl tratamiento estadístico de los datos se hizo con ayuda de la unidad de bioestadística del hospital utilizando el programa SPSS 15.0 (SPPS INC. Chicago, IL, EE.UU.).
Se consideraron significativas las diferencias con un valor p<0,01 utilizando diferentes test estadísticos (χ2, correlación de Pearson y U de Mann-Whitney) en función de la naturaleza de las variables analizadas.
ResultadosDemografía y presentación clínicaEl motivo de consulta más frecuente en ambos grupos fue metrorragia en mujeres posmenopáusicas. Dos de los sarcomas tuvieron una presentación diferente: una mujer de 69 años que acudió por leucorrea y un diagnóstico incidental de pólipo intracavitario en una mujer de 31 años en una ecografía rutinaria. Entre los 30 adenocarcinomas, en 9 casos el diagnóstico se sospechó por ecografías de control (en 5 con antecedente de cáncer de mama) y en uno por hipermenorrea en una mujer de 47 años premenopáusica.
No encontramos diferencias significativas en la edad media de presentación: en los sarcomas uterinos fue 66 años (rango 31-79) y en los adenocarcinomas 68 años (rango 47-85).
En el seguimiento, 8 de los 13 sarcomas recidivaron antes de un año tras la cirugía.
Hallazgos en la resonancia magnéticaEl diámetro mayor de los sarcomas en el momento del diagnóstico fue de más de 9cm en el 77% de los casos (media: 9,34cm), mientras que en los adenocarcinomas la media fue de 3,34cm. Utilizando el test no paramétrico de Mann-Whitney en los tres ejes encontramos diferencias significativas entre ambos tumores (p<0,001).
No hubo diferencias en la estadificación FIGO histológica entre sarcomas y carcinomas uterinos; en ambos predominaron los estadios precoces. Comparamos en ambos grupos el estadio IA frente al resto y luego el estadio IB frente al resto, con lo que obtuvimos unos valores de p=1 para el estadio IA y p=0,453 para el IB, por lo que no hay diferencias significativas.
Al comparar la estadificación de los sarcomas mediante RM y el estadio histológico posquirúrgico, hubo algunos resultados dispares. En dos casos sugerimos en RM invasión miometrial profunda cuando histológicamente se catalogaron como IA, y en otro caso sugerimos invasión parametrial, pero histológicamente se clasificó como II. En un caso infraestadificamos la extensión tumoral en RM (IB con escaso líquido peritoneal y en cirugía se diagnosticó una carcinomatosis peritoneal, estadio IVB).
La intensidad de señal en secuencias potenciadas en T2 en el 92% de los sarcomas era heterogénea, predominantemente hiperintensa (figs. 1–3). Los adenocarcinomas presentaron señal intermedia en T2 salvo 3 de los 30 casos con señal más heterogénea (diferencia estadísticamente significativa, p<0,001 χ2).
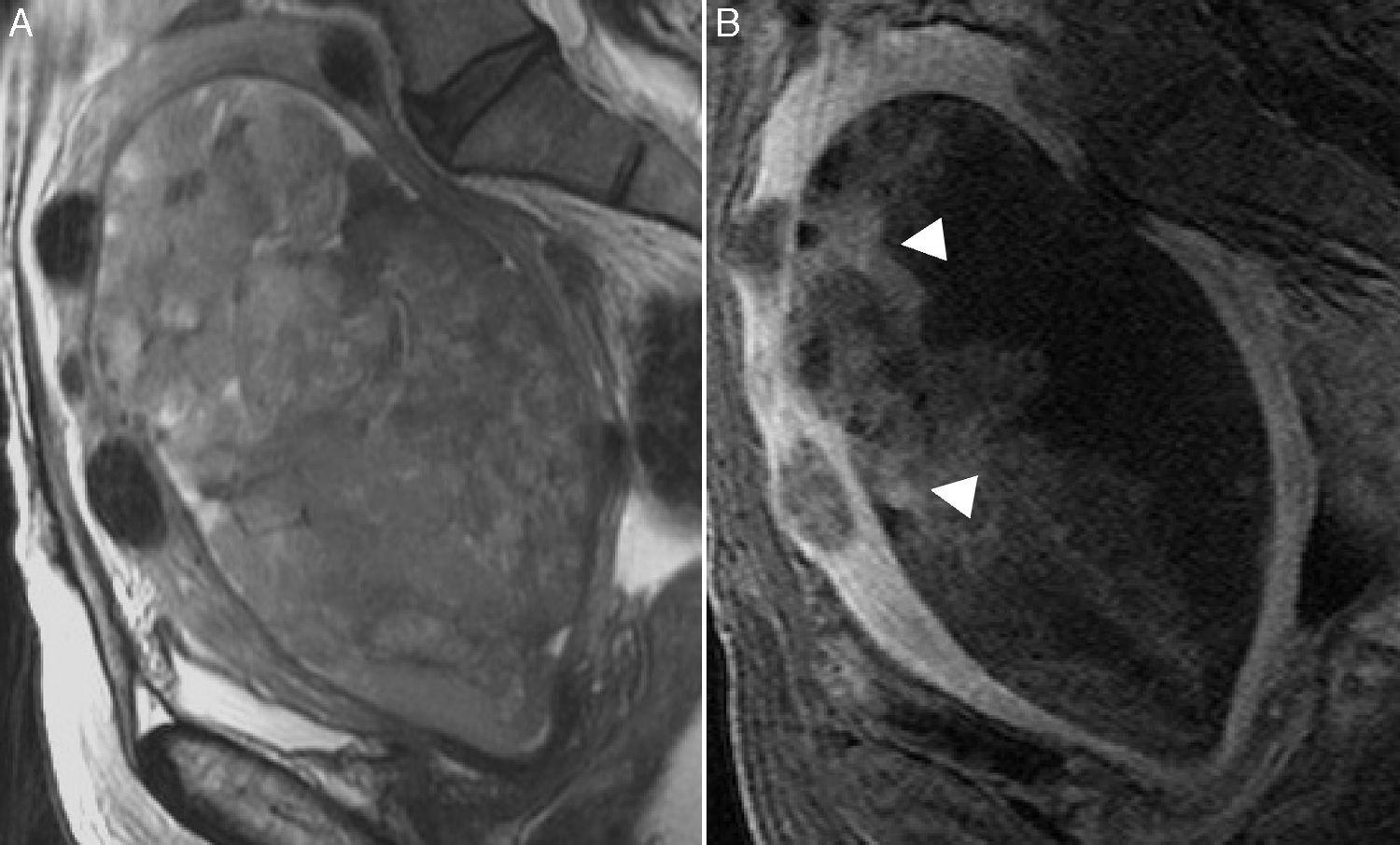
Mujer de 63 años con carcinosarcoma en estadio IA. A) Imagen sagital FSE potenciada en T2. Se observa una gran masa endometrial heterogénea con áreas hiperintensas en su interior de aspecto quístico o necrótico. B) Imagen sagital potenciada en T1 con supresión grasa y contraste de gadolinio i.v. Las áreas más captantes de la tumoración experimentan un realce similar al del miometrio (puntas de flecha).
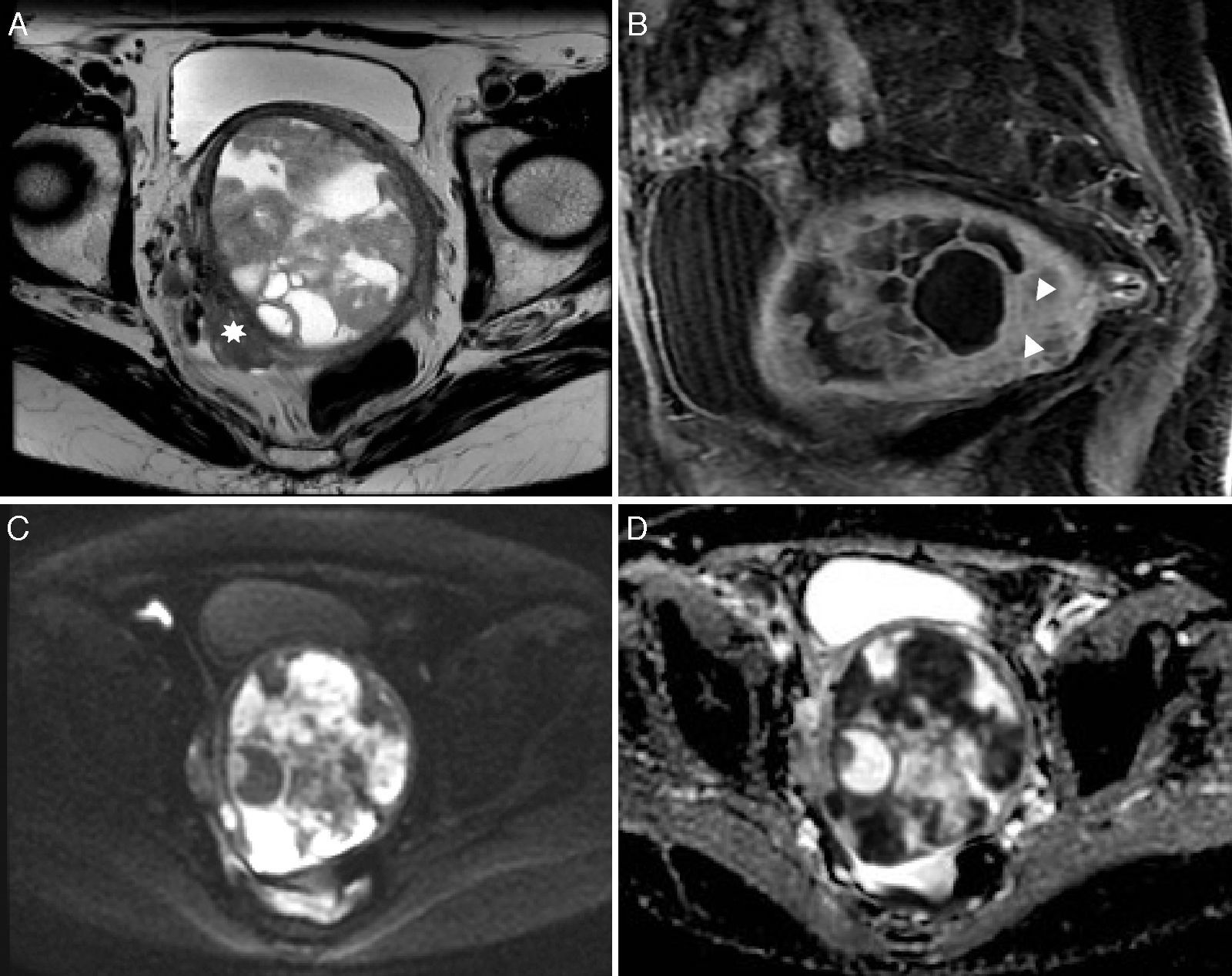
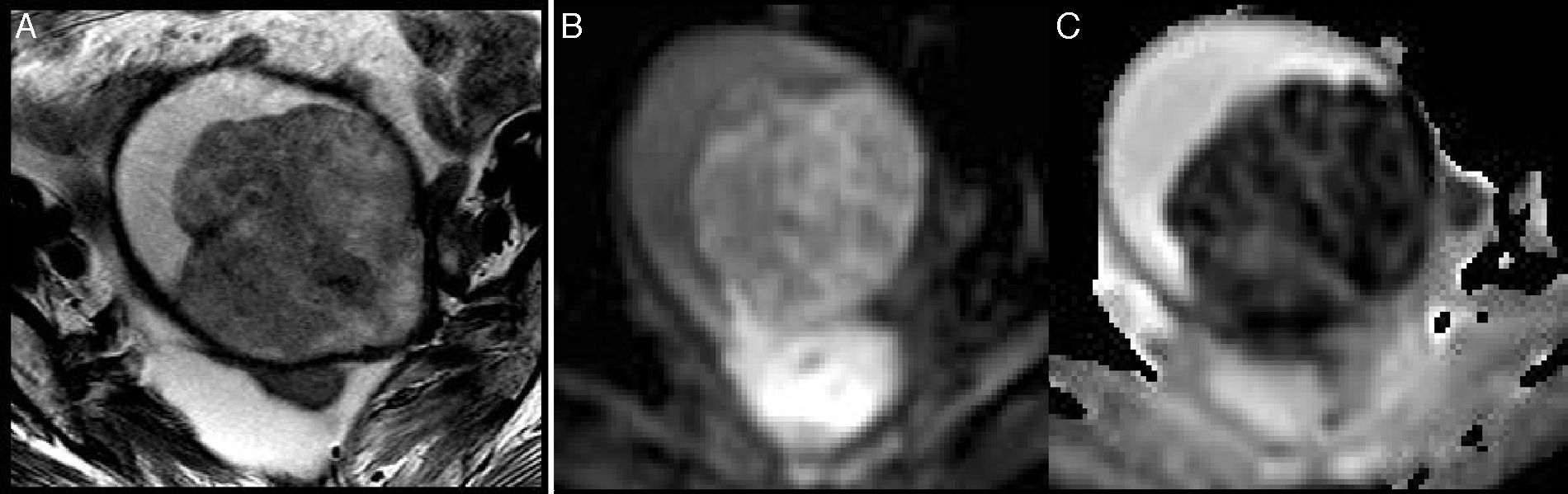
Mujer de 72 años con carcinosarcoma en estadio IIIb. A) Imagen axial FSE potenciada en T2 que muestra una gran masa endometrial heterogénea con áreas de aspecto quístico, existiendo afectación extrauterina (asterisco). B) Imagen sagital T1 FATSAT con contraste de gadolinio. La masa experimenta un realce intenso, en alguna zona similar o mayor al miometrio (puntas de flecha). C) Imagen axial potenciada en difusión con valor b 800 s/mm2. Se aprecia una gran masa intrauterina heterogénea con áreas marcadamente hiperintensas. D) Mapa paramétrico del ADC en escala de grises. Las áreas hiperintensas se muestran marcadamente hipointensas, lo que traduce restricción de la difusión. El valor mínimo de ADC era de 0,87×10−3 mm2/s.
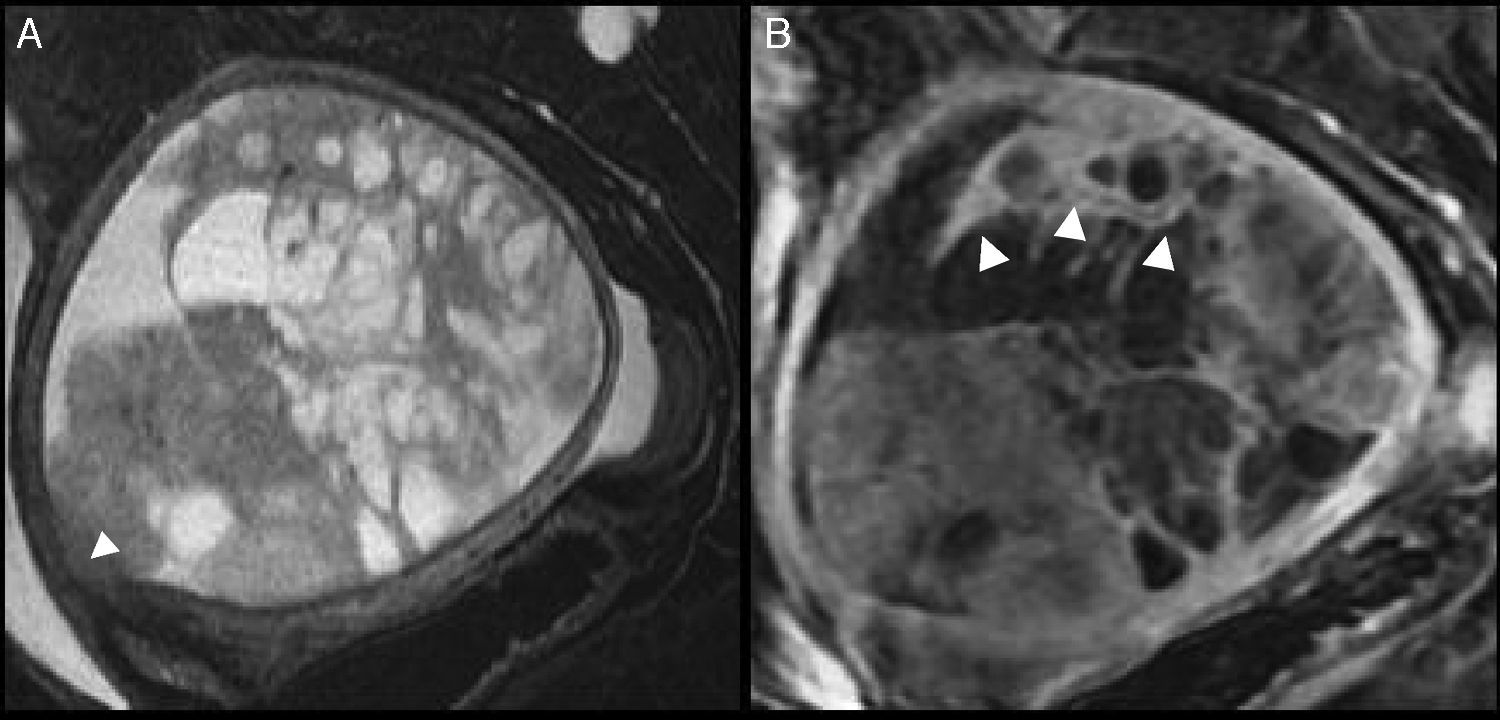
Mujer de 58 años con carcinosarcoma en estadio IA. A) Imagen sagital FSE potenciada en T2 con supresión grasa. Se observa una gran masa endometrial heterogénea con áreas hiperintensas de aspecto quístico o necrótico y otras de aspecto sólido. Condiciona adelgazamiento e infiltración focal del miometrio submucoso (punta de flecha). B) Imagen T1 con supresión grasa y contraste de gadolinio en proyección sagital. Las áreas sólidas de la tumoración realzan de manera similar y en algunas zonas más que el miometrio (puntas de flecha).
En secuencias potenciadas en T1 no hallamos diferencias significativas entre ambos grupos. El 85% de los sarcomas eran hipointensos. Solo dos mostraron una señal diferente: uno tenía señal intermedia (sarcoma del estroma endometrial) y otro era heterogéneo, predominantemente hipointenso en T1, con áreas hiperintensas (leiomiosarcoma). El 90% de los adenocarcinomas fueron hipointensos; únicamente tres presentaron señal intermedia.
En el estudio dinámico poscontraste, el 64% de los sarcomas presentó realce heterogéneo e isointenso respecto al miometrio en fases tardías; en el 36% fue un realce heterogéneo e hiperintenso (en las zonas con mayor captación) respecto al miometrio, también en fases tardías. En dos casos no se inyectó contraste. Los adenocarcinomas, por el contrario, fueron hipointensos respecto al miometrio en el estudio poscontraste (fig. 4). Para evaluar diferencias, agrupamos los patrones de realce en hipointenso frente a iso-hiperintenso respecto al miometrio, con lo que hallamos diferencias significativas en el patrón de realce entre ambos tumores (p<0,001).
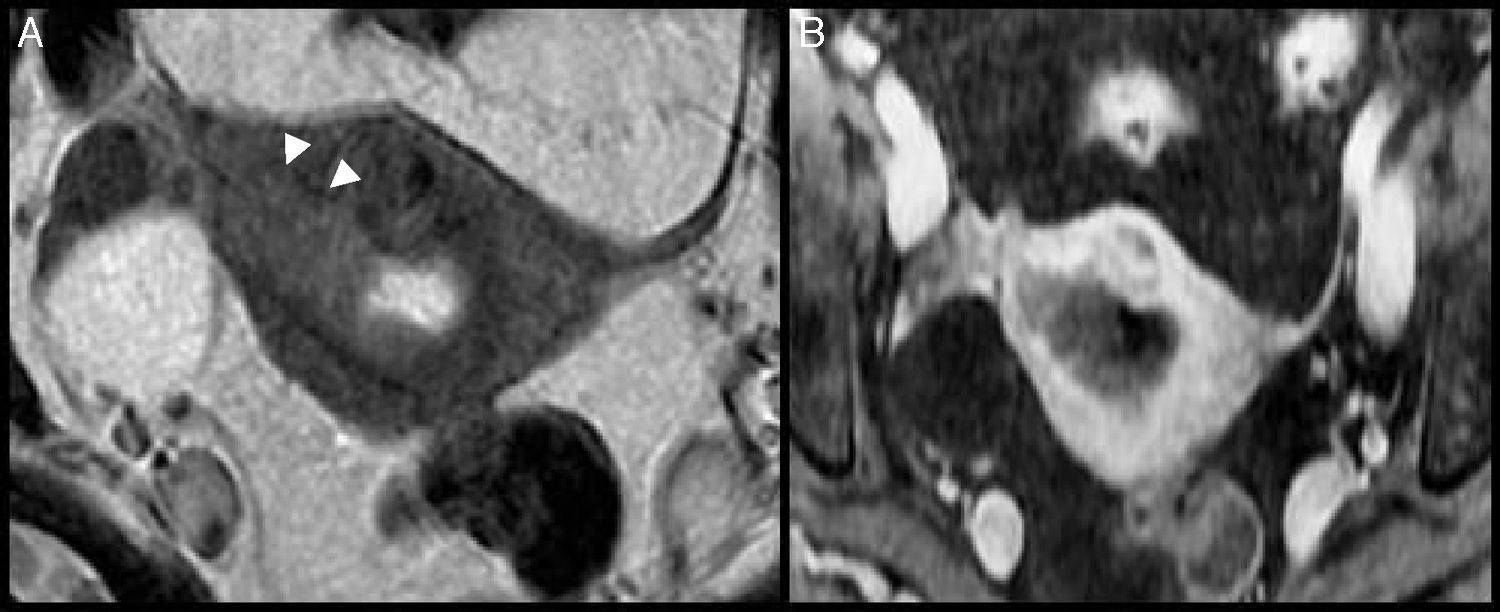
Mujer de 57 años con adenocarcinoma endometrial en estadio IB. A) Imagen coronal FSE potenciada en T2. Muestra una lesión endometrial de señal homogénea casi isointensa en T2 con el miometrio y con signos de invasión miometrial profunda (puntas de flecha). B) Imagen coronal potenciada en T1 con supresión grasa y contraste de gadolinio i.v. La tumoración realza ligeramente, aunque mucho menos que el miometrio.
También valoramos la secuencia potenciada en difusión en ambos tumores. En 14 de los 30 casos de adenocarcinoma no pudimos analizar la difusión: en dos no pudimos medir sus valores por su pequeño tamaño y en 12 porque no se adquirió esta secuencia, al igual que en 3 de los 13 sarcomas. Finalmente, revisamos la difusión en 10 sarcomas y en 16 adenocarcinomas. Los sarcomas mostraron mapas heterogéneos con valores de ADC muy dispares en la misma tumoración, identificando áreas con restricción y otras con difusión facilitada (zonas sugerentes de necrosis en las secuencias potenciadas en T2 y posconcontraste) (figs. 2 y 5). En las zonas que subjetivamente tenían mayor restricción en el mapa de ADC, los valores obtenidos (en regiones de interés de diámetro similar) mostraron una media de 0,81±0,17×10−3 mm2/s. Los adenocarcinomas presentaron mapas más homogéneos con restricción de la difusión, aunque con valores de ADC similares (media de 0,84±0,076 ×10−3 mm2/s).
Mujer de 64 años con carcinosarcoma en estadio IA. A) Imagen axial FSE potenciada en T2. Gran masa intrauterina hetetorogénea con contenido retenido en la periferia de la cavidad endometrial. B) Imagen axial potenciada en difusión con valor b 800 s/mm2. La masa es predominantemente hiperintensa en difusión. C) Mapa paramétrico del ADC en escala de grises. Las áreas tumorales de mayor señal en difusión se muestran marcadamente hipointensas en el mapa ADC, lo que traduce restricción de la difusión, mientras que el líquido no restringe.
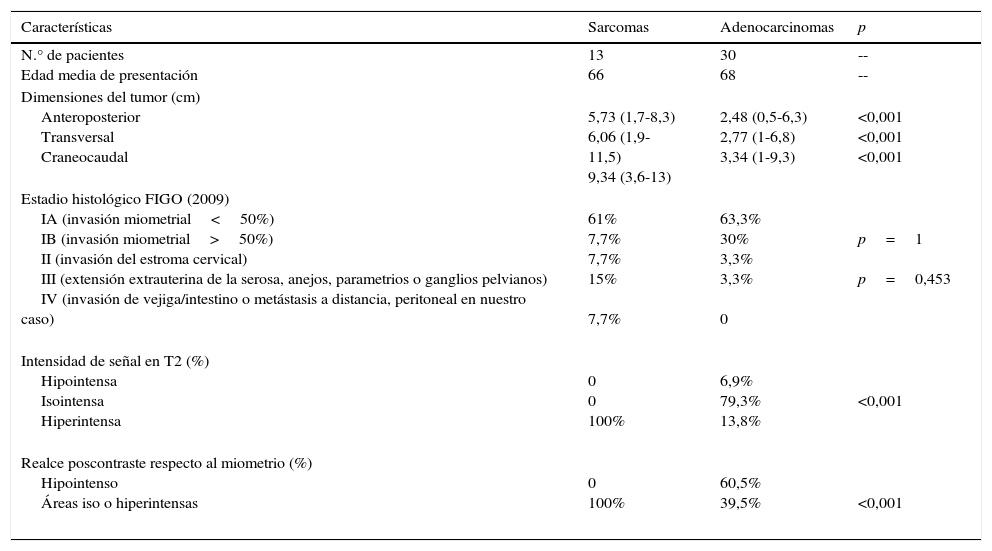
Los resultados comparativos entre sarcomas y adenocarcinomas en relación con la edad media de presentación, dimensiones tumorales, estadio FIGO histológico, señal en T2, y señal en el estudio dinámico poscontraste, se presentan en la tabla 2.
Resumen de variables analizadas comparando sarcomas y adenocarcinomas uterinos
| Características | Sarcomas | Adenocarcinomas | p |
|---|---|---|---|
| N.° de pacientes Edad media de presentación | 13 66 | 30 68 | -- -- |
| Dimensiones del tumor (cm) Anteroposterior Transversal Craneocaudal | 5,73 (1,7-8,3) 6,06 (1,9-11,5) 9,34 (3,6-13) | 2,48 (0,5-6,3) 2,77 (1-6,8) 3,34 (1-9,3) | <0,001 <0,001 <0,001 |
| Estadio histológico FIGO (2009) IA (invasión miometrial<50%) IB (invasión miometrial>50%) II (invasión del estroma cervical) III (extensión extrauterina de la serosa, anejos, parametrios o ganglios pelvianos) IV (invasión de vejiga/intestino o metástasis a distancia, peritoneal en nuestro caso) | 61% 7,7% 7,7% 15% 7,7% | 63,3% 30% 3,3% 3,3% 0 | p=1 p=0,453 |
| Intensidad de señal en T2 (%) Hipointensa Isointensa Hiperintensa | 0 0 100% | 6,9% 79,3% 13,8% | <0,001 |
| Realce poscontraste respecto al miometrio (%) Hipointenso Áreas iso o hiperintensas | 0 100% | 60,5% 39,5% | <0,001 |
Existen tres subtipos histológicos principales de sarcomas uterinos: epitelial, mesenquimatoso y mixto (mesenquimatoso+epitelial)6. Las variantes histológicas más frecuentes son carcinosarcomas (TMMM), leiomiosarcomas, sarcomas del estroma endometrial y rabdomiosarcomas. En la literatura especializada, alrededor del 50% de los sarcomas uterinos corresponden a carcinosarcomas1,2,6,7. En nuestra serie, el 61,5% de los casos fueron carcinosarcomas.
Los sarcomas uterinos generalmente se diagnostican en mujeres posmenopáusicas que consultan por metrorragias, forma similar de presentación del adenocarcinoma endometrial3,7–9. En nuestra serie, todos los sarcomas se diagnosticaron en mujeres posmenopáusicas, a excepción de una mujer de 31 años.
Estos tumores tienen peor pronóstico que los adenocarcinomas, y se ha señalado, incluso en estadios tempranos una tasa de recurrencia local del 47-64%, según las series3–5. En nuestra serie, el 61% de las pacientes tuvieron una recaída tumoral en el primer año.
Recientemente, el carcinosarcoma ha sido incluido como una forma desdiferenciada o metaplásica dentro de los adenocarcinomas endometriales, lo que ha condicionado que para ambos tumores se emplee la misma estadificación FIGO en la última revisión de 20092,3,10–13. No obstante, al presentar un comportamiento más agresivo que el adenocarcinoma endometrial, histológicamente este tumor sigue considerándose como un sarcoma según la clasificación anatomopatológica de la OMS de 20038, que no ha sido modificada.
La RM es la técnica de elección para la estadificación locorregional de neoplasias uterinas. Hay pocos estudios publicados sobre la caracterización radiológica de los sarcomas uterinos. Las series con un mayor número de casos de TMMM, como la de Bharwani et al.6 y la de Tanaka et al.14, de 51 y 17 pacientes respectivamente, describen grandes lesiones que en general no presentaron invasión miometrial profunda.
En nuestra serie, tanto los adenocarcinomas como los sarcomas se presentaron en estadios tempranos de la enfermedad, y no se hallaron diferencias estadísticamente significativas en el estadio radiológico o anatomopatológico entre ambos grupos.
Los sarcomas de nuestro estudio correspondieron en más de un 70% de los casos a masas endometriales de gran tamaño (en contraposición con los adenocarcinomas). Este rasgo se ha descrito previamente en la bibliografía como una característica común de estos tumores2,3,6–10,14–17.
En prácticamente todos los casos, los sarcomas se presentaron en forma de masas de señal heterogénea, predominantemente hiperintensas en T2 respecto al miometrio, siendo en el 85% hipointensas respecto al miometrio en secuencias potenciadas en T1. Los adenocarcinomas presentaron una señal significativamente más baja en T2, y en T1 presentaron unas características indistinguibles respecto a los sarcomas.
El realce de estos tumores tras la administración de gadolinio es variable según los resultados de diferentes series, aunque varios autores coinciden en que los sarcomas presentan un realce mayor o igual al miometrial en contraposición con los adenocarcinomas1–3,6,7,10,15,16,18. Esta variabilidad puede deberse, entre otros factores, a que estos tumores presentan histológicamente varias estirpes celulares distintas y su realce dependerá del componente predominante (epitelial, mesenquimatoso o mixto).
Pocos estudios han aportado datos sobre la RM potenciada en difusión de estos tumores, que en nuestra serie muestran áreas con gran restricción de la difusión (similar a los adenocarcinomas) y otras áreas sin restricción (probablemente correspondientes a zonas necróticas). Estos resultados pueden explicarse dada la naturaleza mixta y heterogénea de estos tumores2,3,7,18,19.
Las limitaciones de nuestro estudio incluyen su diseño retrospectivo, el tamaño muestral pequeño y pequeñas variaciones en los protocolos de RM durante el periodo en que se realizaron (10 años). La baja incidencia de estos tumores puede justificar la difícil realización de un estudio prospectivo.
La diferenciación radiológica entre los sarcomas uterinos y los adenocarcinomas endometriales constituye un reto diagnóstico, ya que no parecen presentar características totalmente específicas mediante RM. A pesar de que el diagnóstico final es histológico, generalmente tras la histerectomía (las biopsias muchas veces no representan todo el tumor), creemos que el diagnóstico puede sugerirse por algunos hallazgos que identificamos mediante RM. En nuestra serie, los TMMM se presentaron con un mayor tamaño, con una señal heterogénea e hiperintensa en secuencias potenciadas en T2, y por último mostraron un realce mayor o igual al miometrial en las secuencias con contraste, con diferencias significativas respecto a los carcinomas endometriales. En conclusión, nuestro estudio se suma a la corta literatura sobre las características por RM de estos tumores, aportando datos concordantes con la mayoría de los trabajos reseñados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: PH, RM y ES.
- 2.
Concepción del estudio: RM, PH y ES.
- 3.
Diseño del estudio: RM y PH.
- 4.
Obtención de los datos: PH y ES.
- 5.
Análisis e interpretación de los datos: PH, RM y ES.
- 6.
Tratamiento estadístico: Unidad de Estadística del Hospital Clínico San Carlos, PH.
- 7.
Búsqueda bibliográfica: PH, RM y ES.
- 8.
Redacción del trabajo: PH.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RM y ES.
- 10.
Aprobación de la versión final: PH, RM y ES.
Los autores declaran no tener ningún conflicto de intereses económicos relacionados con este artículo.