La pancreatitis del surco es un tipo poco frecuente de pancreatitis crónica que afecta al espacio comprendido entre la cabeza del páncreas, la segunda porción duodenal y el colédoco. El consumo crónico de alcohol se ha descrito como el principal factor desencadenante, cuyo resultado final es la fuga de secreciones pancreáticas al surco pancreatoduodenal, con la consecuente afectación fibroinflamatoria en dicha localización. El principal diagnóstico diferencial de la pancreatitis del surco es el adenocarcinoma de páncreas, siendo este último más frecuente.
Gracias a la disponibilidad de las diferentes técnicas de imagen, es posible identificar varios hallazgos radiológicos que permiten distinguir, a veces, ambas entidades, como son el engrosamiento duodenal o la presencia de quistes duodenales y paraduodenales (característicos de la pancreatitis del surco), aunque no existen hallazgos específicos para cada una de ellas. En ocasiones es necesario recurrir a la toma de biopsia o cirugía para establecer un diagnóstico definitivo.
El tratamiento de la pancreatitis del surco suele ser conservador, pero en casos en los que no hay mejoría de los síntomas se realizan procedimientos intervencionistas (drenaje biliar) o cirugía (duodenopancreatectomía cefálica).
Groove pancreatitis is an uncommon type of chronic pancreatitis that affects the space between the head of the pancreas, the second portion of the duodenum, and the common bile duct. The main trigger is chronic alcohol abuse, which eventually leads to leakage of pancreatic juices into the pancreaticoduodenal groove, causing inflammation and fibrosis. The main differential diagnosis is with pancreatic adenocarcinoma, which is more common than groove pancreatitis.
Different imaging techniques make it possible to identify various findings (e.g., duodenal thickening or duodenal and paraduodenal cysts, which are characteristic of groove pancreatitis) that sometimes enable differentiation between groove pancreatitis and other entities, although there are no specific findings for each of them. Sometimes biopsy or surgery is required to establish the definitive diagnosis.
The treatment of groove pancreatitis is usually conservative, but in cases in which the symptoms do not improve, interventional procedures (biliary drainage) or surgery (Whipple technique) can be done.
El surco pancreaticoduodenal (PD) es un espacio que se encuentra limitado medialmente por la cabeza del páncreas, lateralmente por la 2.ª y 3.ª porción del duodeno y con la papila mayor y menor, por la vena cava inferior en su aspecto posterior y la primera porción del duodeno en su aspecto superior. Este espacio contiene parte de la vía biliar extrahepática y del conducto pancreático principal (CPP), ganglios linfáticos y estructuras vasculares como la arteria gastroduodenal1–3.
En 1973, Becker y Bauchspeinchel introdujeron el concepto de pancreatitis paraduodenal para hacer referencia a una forma poco frecuente y localizada de pancreatitis crónica que afecta al espacio PD1,4. Posteriormente, en 1982, Stoller et al. acuñaron el término actualmente utilizado para describir esta entidad como pancreatitis del surco (PS)5, aunque también es conocida como pancreatitis paraduodenal, distrofia quística de páncreas heterotópico, mioadenomatosis, quiste periampular de la pared duodenal o hamartoma pancreático del duodeno4. En 2004, Adsay y Zamboni agruparon todas estas nomenclaturas bajo el término universal de pancreatitis del surco6. Finalmente, en 1991, Becker y Mischke diferenciaron entre la forma pura de PS, cuando solo afecta al espacio PD propiamente dicho, y la forma segmentaria, más frecuente, donde la afectación se extiende a la cabeza del páncreas2,5,7.
Debido a la anatomía compleja del espacio PD y la relación entre las estructuras que lo conforman, es difícil la diferenciación entre entidades benignas y malignas8, por lo que es importante conocer la PS y diferenciarla de otras entidades que afectan a la cabeza del páncreas, siendo la más relevante el adenocarcinoma5.
La PS es una forma inusual de pancreatitis crónica que se produce secundariamente a la formación de tejido fibroinflamatorio en la grasa del surco PD5, sin que exista necesariamente afectación del resto del páncreas, lo que dificulta su diagnóstico9. La identificación de esta entidad supone un gran reto, por lo que habitualmente se requiere toma de biopsia para conseguir un diagnóstico de certeza7.
EtiopatogeniaLa causa subyacente a esta patología no se conoce con certeza, aunque se han propuesto múltiples teorías y factores favorecedores. El consumo prolongado de alcohol parece ser el factor predisponente y desencadenante más fuerte2,6.
La PS podría desencadenarse por una obstrucción de la papila menor o del conducto pancreático accesorio de Santorini por el aumento de la viscosidad de las secreciones pancreáticas, condicionada por el tabaco y el alcohol, o por la hiperplasia de las glándulas de Brunner en la mucosa duodenal4,6,7. Otro de los mecanismos propuestos es la alteración en la secreción pancreática en la papila menor secundaria al consumo crónico de alcohol o la presencia de un páncreas heterotópico que condicionan un aumento de presión en el conducto de Santorini con la consecuente formación de seudoquistes y fuga de las secreciones pancreáticas al surco PD2,10. Al contrario de lo que ocurre con otros tipos de pancreatitis, no se ha descrito asociación con enfermedades autoinmunes ni con la presencia de colelitiasis, pero sí con la úlcera péptica7. Además, la localización específica de esta entidad en el surco PD alrededor de la papila menor sugiere que existan como factores predisponentes, aparte de las alteraciones funcionales (secundarias al alcohol y tabaco), alteraciones anatómicas como el páncreas divisum o la ausencia/estenosis del conducto de Santorini1,2.
El resultado final y común a estas posibles causas de PS es la extravasación o fuga de las enzimas proteolíticas pancreáticas activadas al surco PD que condiciona una cascada inflamatoria crónica y fibrosis11.
ClínicaLa PS suele afectar a varones en la cuarta o quinta década de la vida con historia de alcoholismo y tabaquismo, y hasta en el 50% de los casos, antecedentes de pancreatitis aguda previas. Clínicamente se puede presentar como un episodio agudo de pancreatitis con dolor abdominal posprandial, náuseas o vómitos recurrentes, pero también puede seguir un curso crónico e insidioso de meses de evolución con dolor abdominal, pérdida de peso e ictericia que puede incluso sugerir un proceso neoplásico más que una pancreatitis2,4–7,10. Existen casos excepcionales en los que la PS puede presentarse como una obstrucción gástrica y a veces provocar complicaciones graves como perforación o sangrado gastrointestinal2,10.
En los estudios de laboratorio, las enzimas pancreáticas y los marcadores tumorales no suelen encontrarse elevados (a diferencia del adenocarcinoma de páncreas [ACP] que eleva el CA 19-9) y la fosfatasa alcalina puede elevarse sin que exista obstrucción del colédoco7.
DiagnósticoEl diagnóstico de la PS se basa en la sospecha clínica y en la realización de diferentes test diagnósticos, ya que es difícil obtener un diagnóstico definitivo solamente con estudios de imagen debido a que los hallazgos no son específicos y son superponibles con otras entidades como el ACP5. Es importante conocer que la PS es mucho menos frecuente que el ACP. Algunos estudios describen incidencias inferiores al 2% en resecciones pancreáticas de pacientes con pancreatitis crónica11.
En casos de PS pura, el diagnóstico diferencial debería establecerse con el colangiocarcinoma y la pancreatitis aguda y, en cambio, en la forma segmentaria de PS, con el ACP5.
De acuerdo con Gabata et al., los estudios de imagen no son suficientes para diferenciar la PS del ACP, sobre todo en los casos en los que no existen hallazgos típicos de PS como son los quistes en la pared duodenal o en el interior de la masa fibroinflamatoria, por lo que a veces resulta necesaria la toma de biopsias5. Para muchos autores, la ecografía endoscópica es una prueba indicada para el diagnóstico porque no solo permite visualizar la afectación de las estructuras del espacio PD, como la estenosis duodenal o del CPP, sino que también permite la obtención de muestras para su estudio anatomopatológico. A veces puede ser necesaria la cirugía para establecer un diagnóstico definitivo4,5. En cuanto a las pruebas de imagen de elección, la tomografía computarizada (TC) y la resonancia magnética (RM) son las modalidades de imagen utilizadas para el diagnóstico de la PS, ya que localizan muy bien el surco PD y los cambios fibroinflamatorios11.
Hallazgos radiológicosComo la mayoría de las veces los pacientes presentan sintomatología de pancreatitis aguda, la prueba inicial suele ser una TC. Tanto la TC como la RM permiten una muy buena definición anatómica y delimitan muy bien la afectación inflamatoria en casos de PS (fig. 1). Además, dado que las lesiones pancreáticas son hipovasculares, si se realiza un estudio bifásico en el que se incluya una fase arterial con contraste, esta aporta más información que un estudio con una única fase portal, ya que de esta manera es posible identificar, además de los cambios inflamatorios, posibles lesiones en el parénquima pancreático que se visualizarán como áreas hipocaptantes. El diagnóstico diferencial de estas incluirá lesiones neoplásicas o áreas de necrosis en un contexto de pancreatitis.
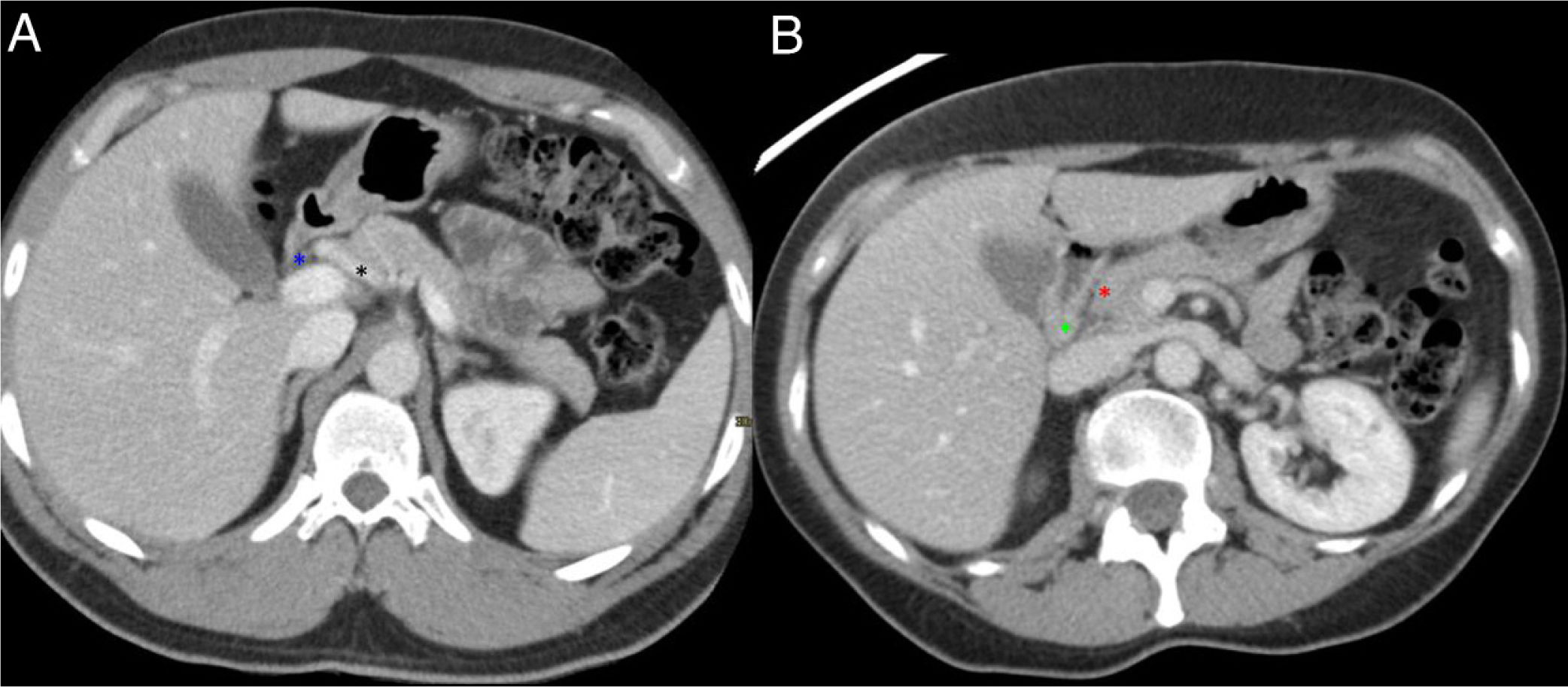
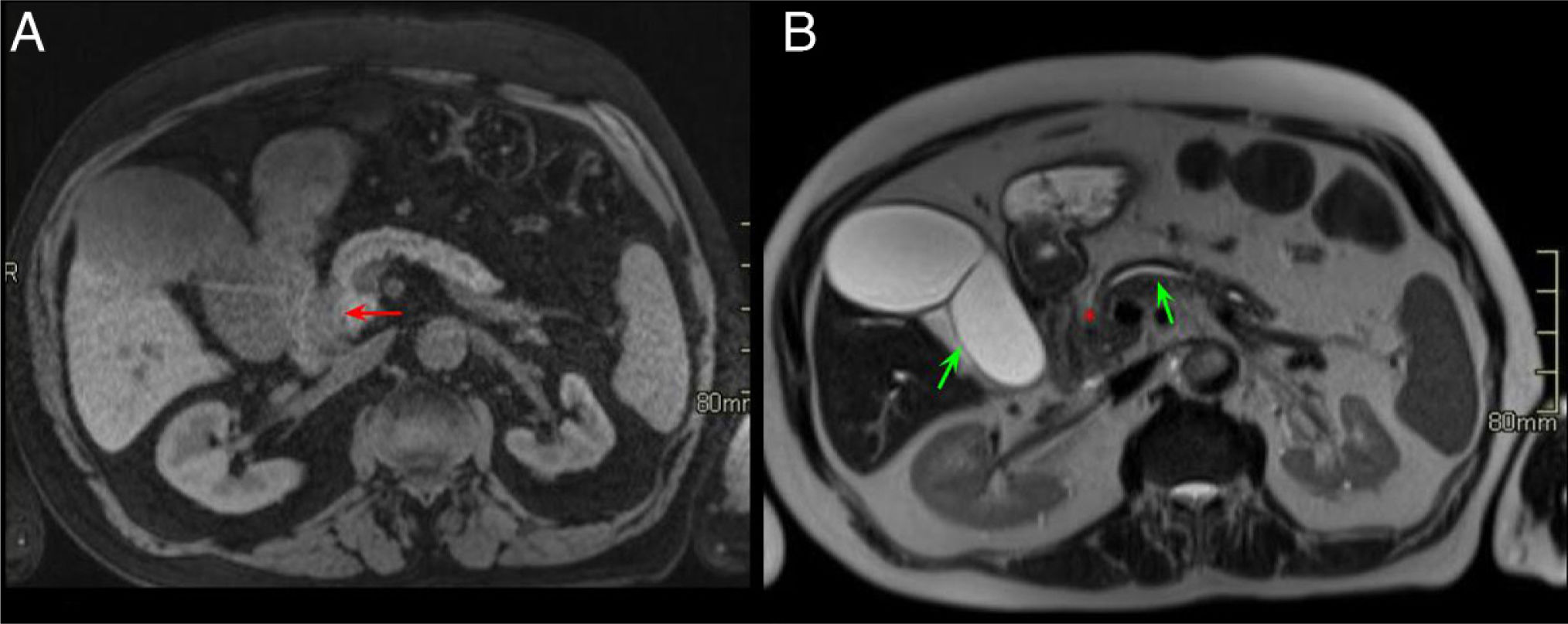
Anatomía normal del surco pancreaticoduodenal (PD). Cortes axiales del abdomen tras administración de contraste intravenoso en fase portal (A y B). Surco PD: espacio comprendido entre el colédoco (asterisco azul, A), la arteria hepática común (asterisco negro, A), la cabeza del páncreas (asterisco rojo, B) y la segunda porción duodenal (asterisco verde, B).
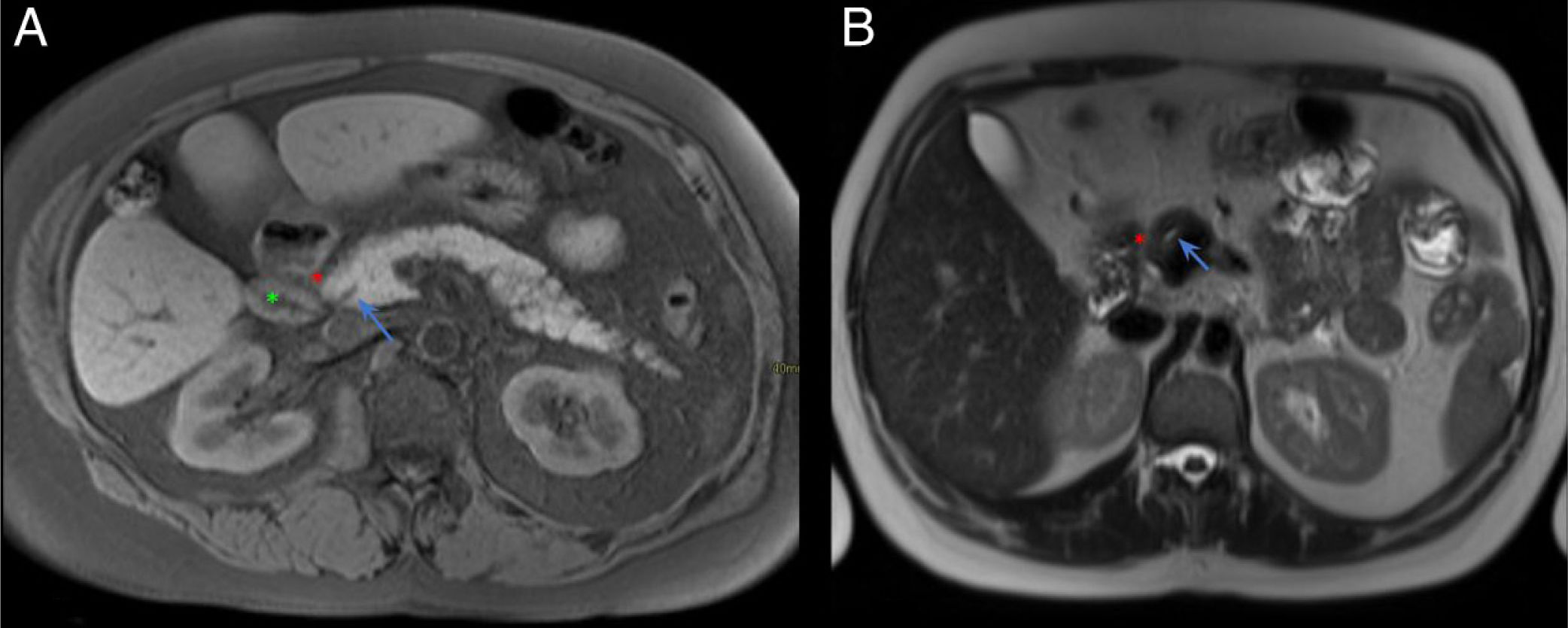
Sin embargo, la RM presenta una mejor definición anatómica, resolución de contraste y permite diferenciar mejor las lesiones quísticas de las sólidas. Además, la RM es superior a la TC para evaluar la vía biliar (fig. 2)1,4.
Para un estudio óptimo del páncreas y del espacio PD con la TC, es recomendable que el paciente se encuentre en ayunas de al menos 3 horas y que beba antes de la realización del estudio hasta 1 L de un contraste de baja densidad, como por ejemplo agua8. A continuación, se realiza un estudio trifásico: sin contraste, en fase arterial y en fase portal3,8,9.
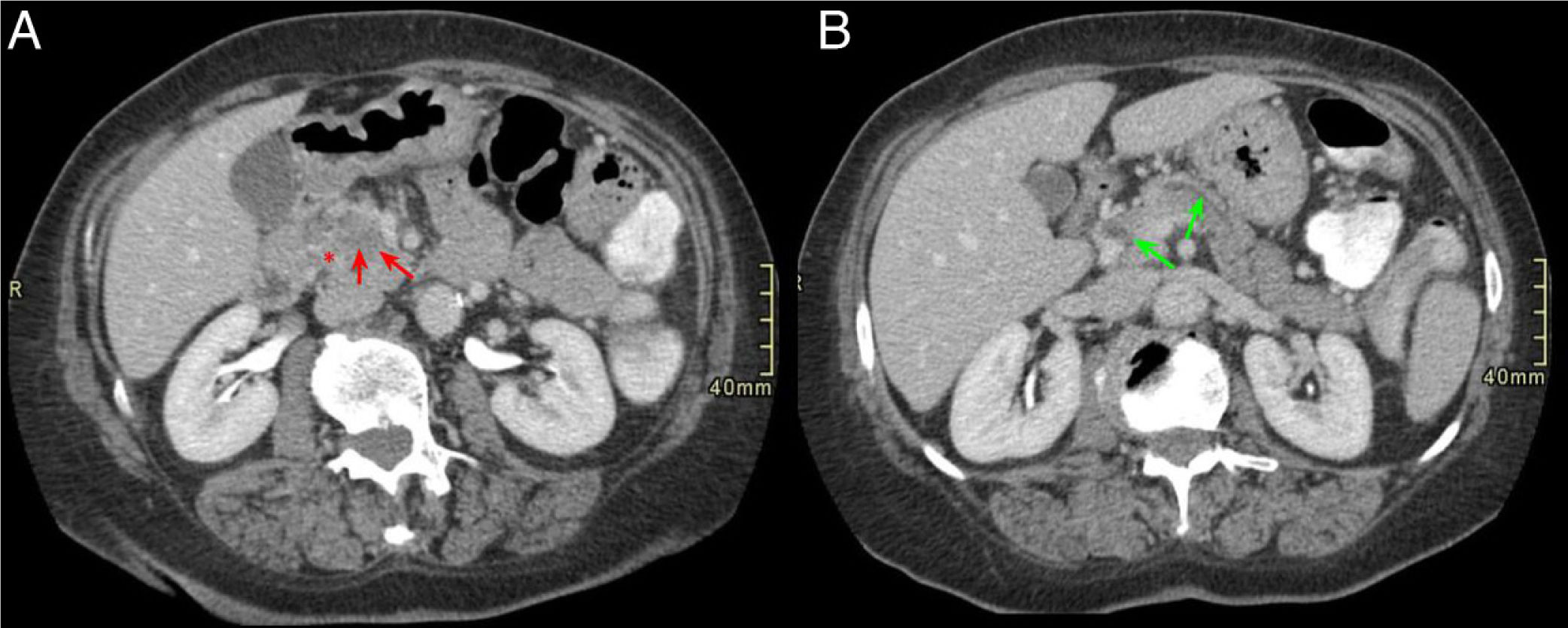
La forma pura de la PS suele presentarse en la TC como una trabeculación de la grasa que ocupa el espacio entre la cabeza del páncreas y la segunda porción duodenal, con cambios inflamatorios adyacentes o, incluso, progresar y formar una masa hipodensa de partes blandas en el seno del surco que presenta una forma curvilínea, laminar o en semiluna, hallazgo mejor visualizado en la proyección coronal (fig. 3)2,5,7,11.
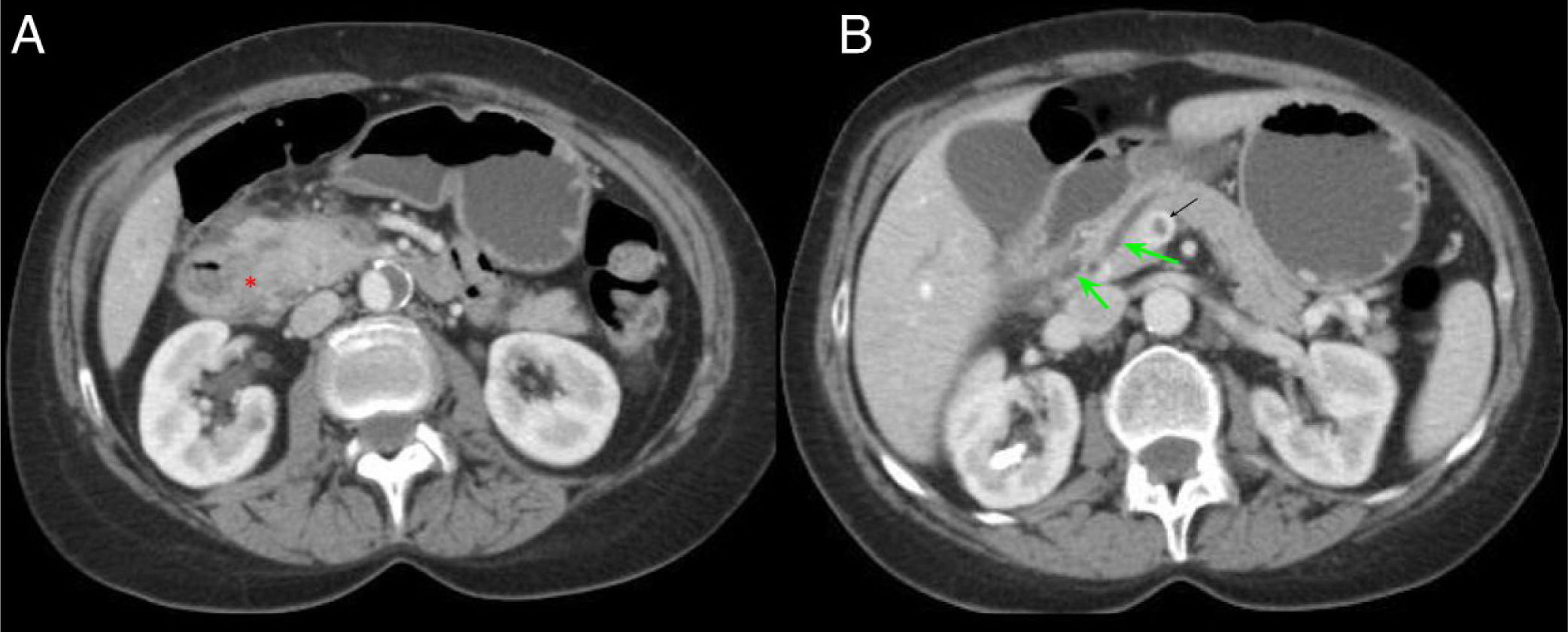
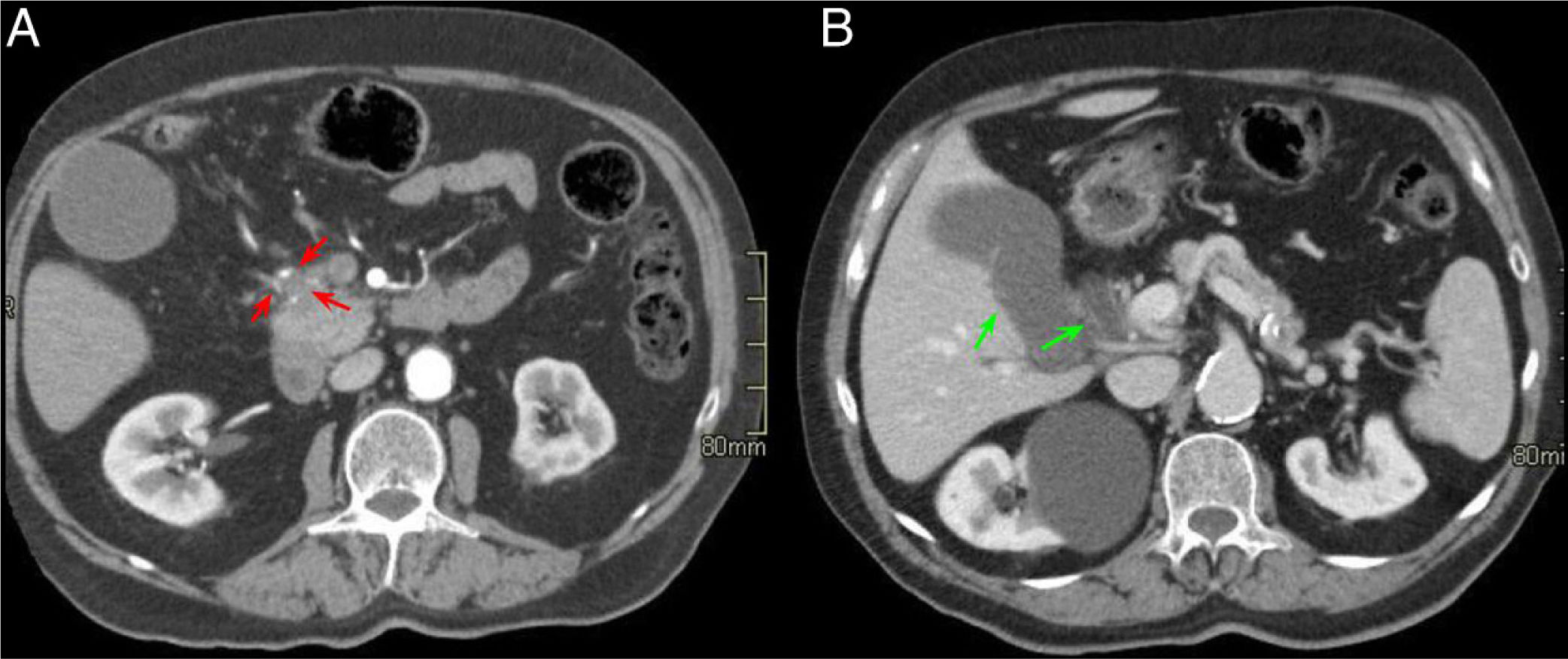
Paciente de 54 años ingresada por episodio de pancreatitis aguda. Cortes axiales del abdomen con contraste intravenoso en fase portal. A) Aumento de tamaño de la cabeza pancreática con borramiento del surco pancreaticoduodenal (asterisco rojo). B) Ectasia del conducto pancreático principal y colédoco distal (flecha verde) con defecto de repleción en la vena porta en relación con trombosis portal (flecha negra). Hallazgos en probable relación con pancreatitis del surco.
En los casos de PS en su forma segmentaria (no exclusiva del surco, sino que se extiende a la cabeza pancreática), la afectación se evidencia como una masa hipodensa en la cabeza pancreática que puede asociar en algunos casos dilatación del CPP y cierto grado de estenosis del colédoco con dilatación retrógrada de la vía biliar intra- y extrahepática1,2,7. En casos en los que se produzca estenosis del CPP, esta suele ser progresiva y regular, a diferencia de lo que ocurre en los casos de ACP donde la estenosis suele ser irregular y abrupta7. Esta masa inflamatoria en el surco PD presenta un realce tardío y progresivo tras la administración de contraste, debido a la inflamación crónica y el componente fibrótico7,10,11. Además, es frecuente que el duodeno presente cierto engrosamiento mural en su aspecto medial y formaciones quísticas en la pared del duodeno o incluso en el propio surco PD (fig. 4)3,7,10.
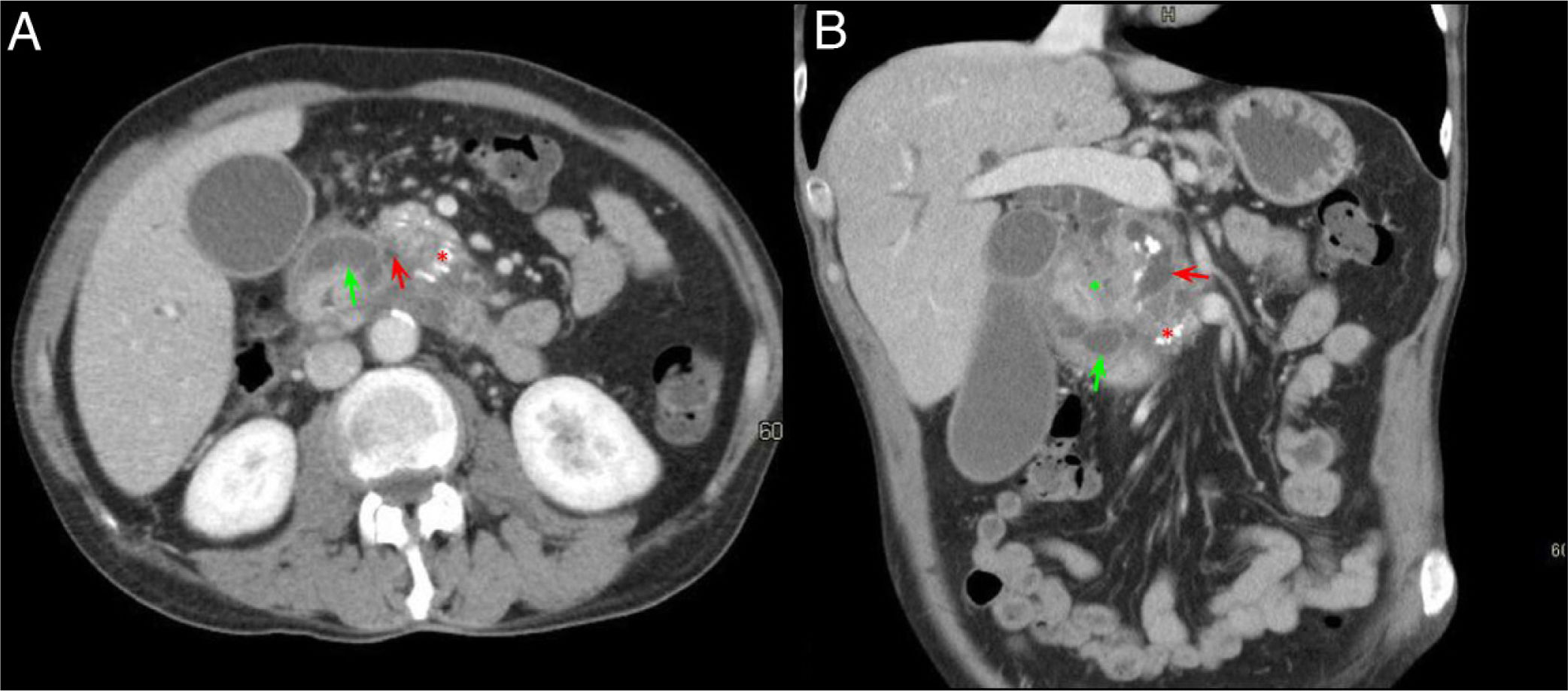
Varón de 60 años con síndrome constitucional. Corte axial (A) y coronal (B) del abdomen con contraste intravenoso en fase portal. Dilatación del conducto pancreático principal (flecha roja, A y B) y presencia de calcificaciones en la cabeza-cuerpo del páncreas (asterisco rojo, A y B), en relación con pancreatitis crónica. Ocupación del surco pancreaticoduodenal (asterisco verde, B) y engrosamiento mural duodenal con lesiones quísticas en su interior (flecha verde, A y B). Hallazgos compatibles con pancreatitis del surco.
Al ser la PS un tipo de pancreatitis crónica, el páncreas suele presentar los cambios crónicos típicos: atrofia con sustitución grasa, calcificaciones o cálculos en el interior del CPP (fig. 4)4,7,10.
Además, independientemente del subtipo de PS que exista, esta entidad no suele asociar líquido libre ni afectación inflamatoria del retroperitoneo7. Tampoco es frecuente la presencia de infiltración de estructuras vasculares ni adenopatías, hallazgo más común en casos de ACP, sino que los vasos peripancreáticos, en concreto la arteria gastroduodenal, se encuentran desplazados1,9.
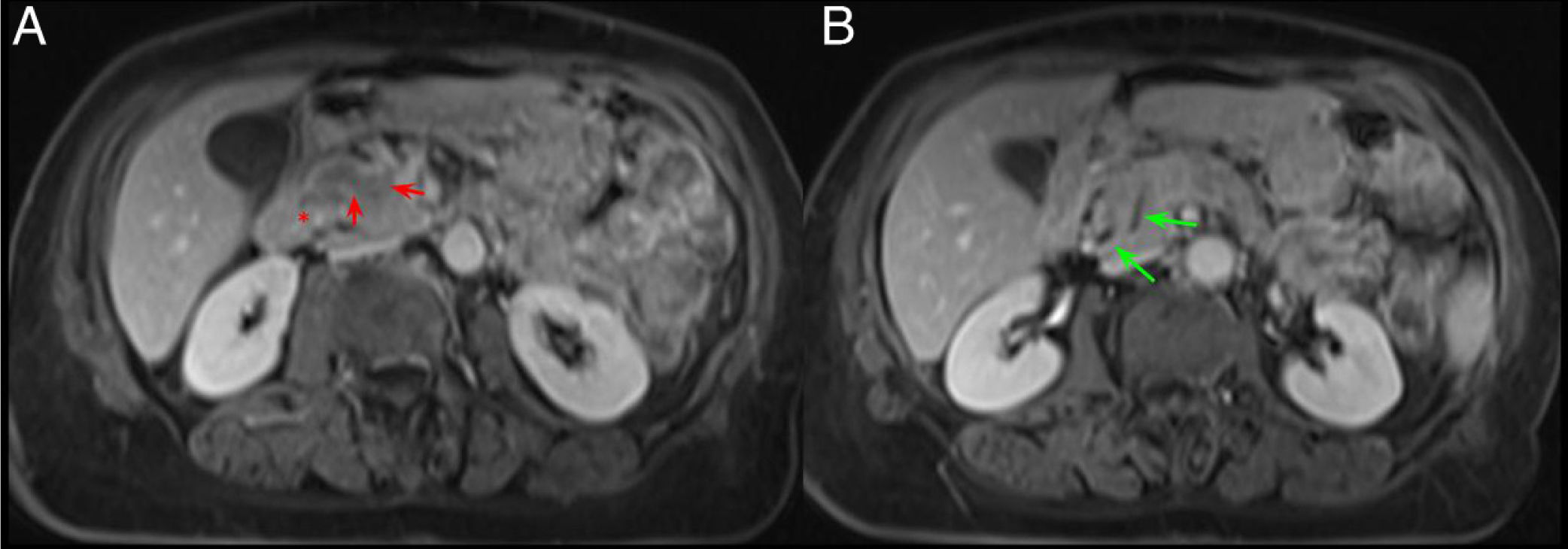
En la RM, la afectación inflamatoria laminar en el surco PD se identifica como una hipointensidad de señal en secuencias T1, con intensidad de señal heterogénea en secuencias T2 y STIR (figs. 5 y 6). Dicha afectación inflamatoria presenta un realce parcheado y progresivo tras la administración de contraste debido a su contenido fibrótico7,9. En fases agudas, la afectación inflamatoria en el surco PD suele presentar una mayor intensidad de señal en la secuencia T2 por presencia de edema y líquido que, progresivamente, se transforma en tejido fibrótico en fase subaguda/crónica y en secuencias T1 y T2 presenta una menor intensidad de señal debido a la atrofia parenquimatosa y la fibrosis. Por tanto, la secuencia T2 resulta muy útil para inferir el grado de actividad7.
Mismo caso que la figura anterior. Cortes axiales del abdomen en secuencias T2. A) Dilatación de la vía biliar intra- y extrahepática y del conducto pancreático principal en cuerpo y cola del páncreas, con afilamiento del conducto pancreático principal en la cabeza pancreática (flechas verdes). B) Lesiones hiperintensas en la pared medial del duodeno que corresponden con lesiones quísticas (flechas rojas) con borramiento del surco pancreaticoduodenal (asterisco rojo).
Varón de 48 años con historia de alcoholismo y pancreatitis aguda de repetición. Cortes axiales del abdomen en secuencias T2. A) Dilatación del conducto pancreático principal (flecha verde). B) Borramiento de los planos grasos del surco pancreaticoduodenal y pequeñas imágenes de aspecto quístico en pared duodenal (flechas rojas). Estos hallazgos, dado el antecedente del paciente, son compatibles con pancreatitis del surco.
En ambos subtipos de PS, el aspecto medial del duodeno se encuentra engrosado con múltiples quistes en el interior de su pared y en el surco, que se identifican como focos hiperintensos en secuencias T2 (figs. 5 y 6)7. Algunos autores defienden que estos quistes intramurales del duodeno son islotes pancreáticos heterotópicos o incluso ramas ductales del conducto de Santorini dilatadas1.
Las secuencias colangiográficas se utilizan para demostrar si existe afectación de las vías biliar y pancreática, que se identifican como áreas de estenosis gradual y de bordes lisos. En casos de estenosis del CPP estará localizada próxima a la ampolla de Vater7,9.
Otros hallazgos asociados a las PS son el ensanchamiento del espacio entre la ampolla y la luz duodenal, como resultado de la infiltración fibrótica del surco PD y de la pared duodenal, y la estenosis de la ampolla y del conducto hepático principal, el cual se dilatará en “forma de plátano”, lo que también podría condicionar una distensión de la vesícula biliar7.
En la ecografía, la PS se identifica en estadios tempranos como una banda hipoecoica en el surco PD que corresponde a la infiltración inflamatoria y ecogenicidad heterogénea de la cabeza del páncreas y, en algunas ocasiones, la ecografía permite visualizar pequeños quistes en el surco12. El engrosamiento duodenal se evidencia en estadios tardíos2,12.
Por tanto, ante los hallazgos de afectación inflamatoria en el surco PD (forma pura) o con extensión a la cabeza del páncreas (forma segmentaria), dilatación del CPP y de la vía biliar extrahepática, engrosamiento duodenal y formaciones quísticas en el duodeno o en el propio surco PD, se debería valorar la posibilidad de una PS como primera posibilidad.
TratamientoEl tratamiento de la PS suele ser conservador con medidas de soporte que combinan ayuno, nutrición enteral (o parenteral en casos de estenosis duodenal), somatostatina y abstinencia alcohólica y tabáquica2,7,10.
En ocasiones se produce obstrucción de la vía biliar o imposibilidad para el vaciamiento gástrico que requieren de una intervención quirúrgica.
En casos crónicos de pacientes con insuficiencia pancreática grave o clínica que no responde al tratamiento conservador se puede optar por tratamientos mínimamente invasivos como drenajes biliares por vía endoscópica (que también pueden servir como puente a la cirugía definitiva) o realizar tratamiento quirúrgico definitivo; en este caso, pancreatectomía cefálica (cirugía de Whipple)7,13.
Diagnóstico diferencialEl principal diagnóstico diferencial que debe tenerse en cuenta con la PS, y en concreto con la forma segmentaria, es el ACP, aunque hay que destacar que la PS es mucho más infrecuente que el ACP2,4. Otros diagnósticos diferenciales a tener en cuenta en casos de PS pura, aunque menos frecuentes, son neoplasias que se originan en estructuras próximas al surco PD como la neoplasia primaria duodenal, el colangiocarcinoma de colédoco distal, ampulomas o pancreatitis autoinmune1,2,9. Los ampulomas, en concreto, son difíciles de diferenciar de las PS cuando son masas de gran tamaño, aunque se presentan como masas bien definidas en la región de la papila, mientras que la PS se suele presentar como una masa de partes blandas peor definida en forma de semiluna1.
El ACP es una entidad que se desarrolla más frecuentemente en varones en la sexta década de la vida y suelen presentar una clínica progresiva e insidiosa de dolor abdominal e ictericia y con marcadores tumorales elevados4.
El engrosamiento de la pared del duodeno con estenosis luminal secundaria y quistes en su pared o en el surco son hallazgos infrecuentes en el ACP, cuya presencia haría inclinarse hacia el diagnóstico de PS. Sin embargo, la existencia de una masa hipointensa en T1 con invasión vascular, adenopatías o infiltración del retroperitoneo haría más factible el diagnóstico de ACP (figs. 7 y 8)7,9,10. Otro hallazgo que diferencia el ACP de la PS es una dilatación, tanto del CPP como del colédoco (signo del doble conducto) (figs. 9 y 10)8. El patrón de realce de estas dos entidades en estudios poscontraste es también diferente y ayuda a diferenciar ambas entidades. El ACP presenta escaso realce y de forma homogénea, mientras que la PS suele realzar de forma tardía y heterogénea7.
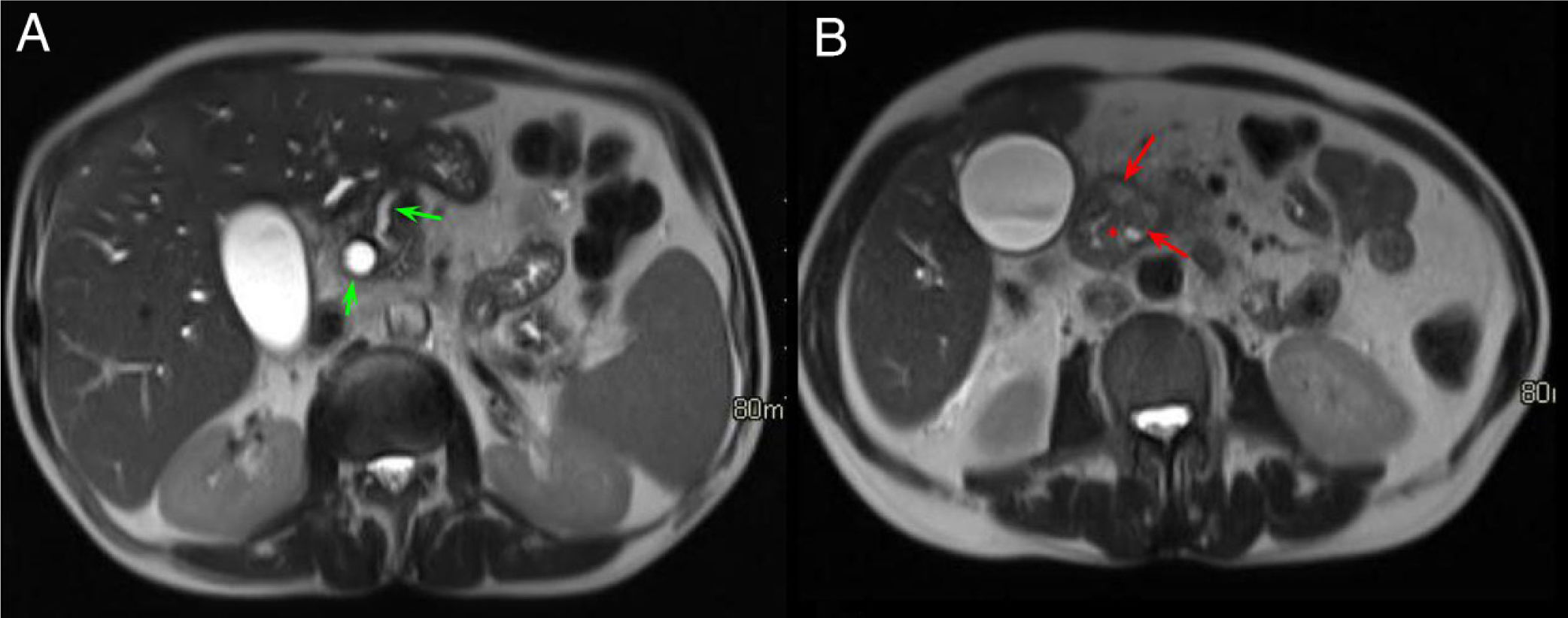
Varón de 74 años con ictericia y síndrome constitucional. Cortes axiales del abdomen con contraste intravenoso en fase arterial (A) y portal (B). Pequeña masa hipovascular en la cabeza - proceso uncinado del páncreas (flechas rojas, A) que envuelve a la arteria gastroduodenal y condiciona una dilatación de la vía biliar extrahepática e hidrops vesicular (flechas verdes, B).
Mismo caso que la figura anterior. Cortes axiales del abdomen en secuencia T1 con saturación grasa (A) y secuencias HASTE (B). Se observa en el aspecto anterior y medial del páncreas y en contacto con la 2.ª porción duodenal una masa hipointensa (flecha roja, A) identificada previamente en la tomografía computarizada con infiltración del surco pancreaticoduodenal (PD) (asterisco rojo, B). En la secuencia HASTE se observa hidrops vesicular, dilatación del CP (flecha verde en B) y ocupación del surco PD. El diagnóstico final fue de adenocarcinoma de páncreas.
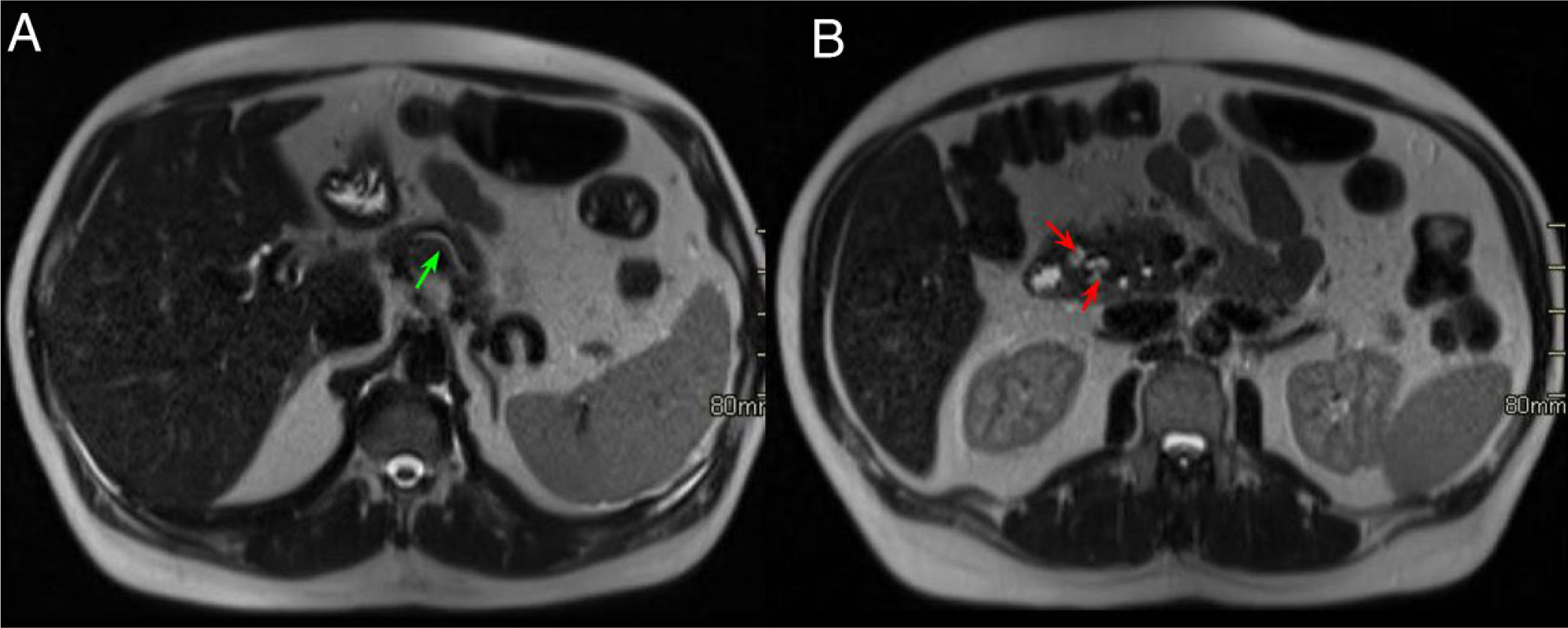
Mujer de 65 años con diarrea crónica. Cortes axiales del abdomen tras administración de CIV en fase portal (A y B). Tenue hipodensidad en la cabeza-proceso uncinado del páncreas que contacta con la vena mesentérica superior (flechas rojas, A). Dilatación de la vía biliar extrahepática y del CP (signo del doble conducto) (flechas verdes, B) y borramiento del surco pancreaticoduodenal (asterisco rojo, A). Hallazgos sugestivos de neoplasia de páncreas.
Mismo paciente de la Figura 9. Cortes axiales del abdomen en secuencia T1 FS poscontraste (VIBE). A y B) Masa hipointensa en cabeza pancreática respecto al resto del páncreas con ocupación del surco pancreaticoduodenal (flecha y asterisco rojos, A) y dilatación de vía biliar extrahepática y del CP (flechas verdes, B). El diagnóstico final fue de adenocarcinoma de páncreas.
Existen otros hallazgos radiológicos descritos que no ayudan a diferenciar la PS del ACP, como, por ejemplo, la dilatación del CPP o del colédoco, ya que, por localización anatómica, ambos se pueden ver afectados en las dos entidades2,3, aunque en casos de PS la estenosis del colédoco suele ser regular y lisa y en casos de ACP suele ser irregular y abrupta2.
En muchas ocasiones, un diagnóstico de certeza precisa de confirmación anatomopatológica7.
Para el grupo dirigido por Kalb et al. existen tres hallazgos que presentan una exactitud diagnóstica del 87,2% para el diagnóstico de pancreatitis del surco, con un valor predictivo negativo para adenocarcinoma del 92,2%. Estos hallazgos son: el engrosamiento mural del aspecto medial del duodeno, la presencia de quistes tanto en la pared del duodeno como en el surco, y la demostración de un realce tardío de la segunda porción duodenal14.
Beker et al., en su estudio retrospectivo de 53 pacientes, describieron tres signos en secuencias colangiográficas para diferenciar un ACP de una seudomasa de cabeza de páncreas, entidades diferentes con tratamientos diferentes15. El signo de la corona se identifica en casos de ACP cuando las ramas secundarias del CPP se encuentran dilatadas solo en la periferia de la masa, ya que esta las desplaza. En entidades fibroinflamatorias, las ramas secundarias dilatadas se encuentran en el interior de la masa inflamatoria15. El signo del conducto interrumpido se describe en pacientes con ACP en los que el conducto dentro de la masa neoplásica presenta una completa interrupción del mismo con dilatación proximal del CPP. Situaciones en las que el CPP se encuentra dilatado a lo largo de la masa y del páncreas, o con estenosis con/sin dilatación retrógrada, no se consideran hallazgos típicos de ACP15. Por último, describen el signo de la atracción, típico de seudomasa de páncreas, pues los procesos fibroinflamatorios tienden a causar retracción de estructuras adyacentes, no invasión de las mismas. Por eso, este signo se describe en casos inflamatorios en los que existe una atracción del colédoco hacia la masa inflamatoria con estenosis y dilatación proximal15.
ConclusiónLa PS es un subtipo poco común de PC que a su vez se subdivide en forma pura (solo afecta al surco PD) y en forma segmentaria (se extiende a la cabeza del páncreas). Su principal diagnóstico diferencial es con el ACP, siendo posible, en ocasiones, distinguirlos con el uso de las diferentes técnicas de imagen y la combinación de los diferentes hallazgos radiológicos.
Autoría- 1.
Responsable de la integridad del estudio: ABS, ICS.
- 2.
Concepción del estudio. ABS.
- 3.
Diseño del estudio: ABS, ICS.
- 4.
Obtención de datos (casos clínicos): ABS.
- 5.
Análisis e interpretación de los datos: ABS, ICS.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: ABS, ICS.
- 8.
Redacción del trabajo: ABS, ICS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ABS, ICS.
- 10.
Aprobación de la versión final: ABS, ICS.
Las autoras declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento al Dr. José Luis Fernández Cueto, facultativo especialista de la Sección de abdomen del Hospital Universitario de Getafe, por su colaboración y participación en la búsqueda de casos clínicos y revisión crítica del manuscrito.