Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosEl trasplante de páncreas es un procedimiento complejo. La cirugía es complicada y también lo son tanto el manejo clínico del páncreas trasplantado, como su estudio radiológico. El trasplante renal constituye el tratamiento de elección en la enfermedad renal en estadio terminal ya que proporciona mayor supervivencia con mejor calidad de vida que la hemodiálisis. La vida media de los injertos oscila entre los 13-24 años, habiéndose reportado una tasa de supervivencia del 90,2% de los mismos durante el primer año postrasplante.
Pancreas transplant is a complex procedure. Surgery is complicated, and so are the clinical management of the transplanted pancreas, as well as its radiological study. Kidney transplant is the treatment of choice in end-stage kidney disease since it provides longer survival with better quality of life than hemodialysis. The average life of the grafts ranges between 13-24 years, having reported a survival rate of 90.2% of them during the first year after transplantation.
El injerto renal se implanta de forma extraperitoneal en una fosa ilíaca, preferiblemente derecha, ya que la vena ilíaca se encuentra más superficial y horizontal a dicho nivel, lo que facilita el procedimiento quirúrgico.
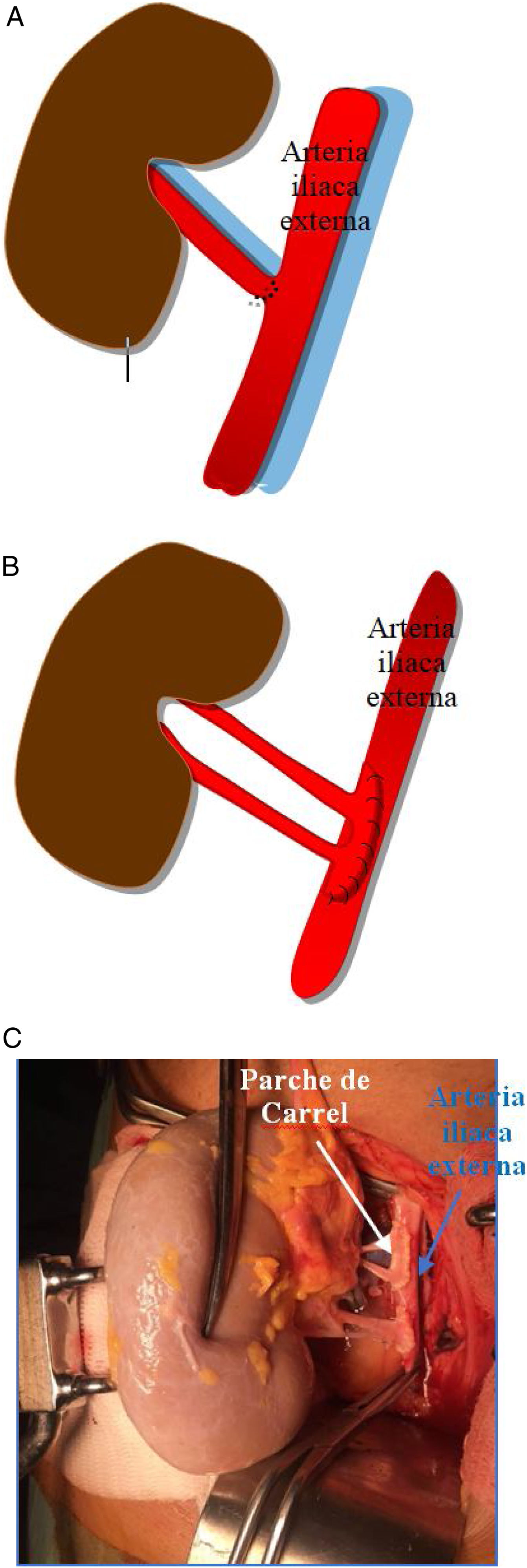
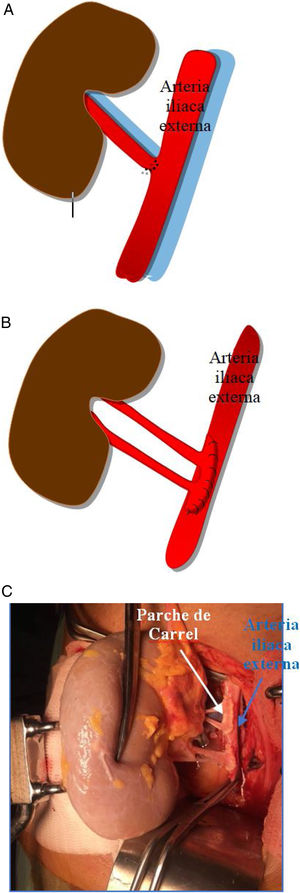
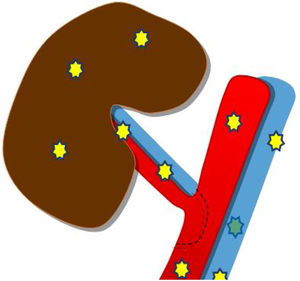
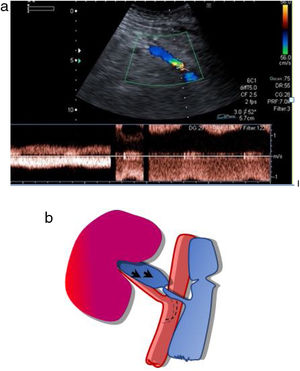
Generalmente, se realiza una anastomosis término-lateral de la arteria renal del donante a la arteria ilíaca externa del receptor (fig. 1a). Si coexisten varias arterias renales pueden anastomosarse independientemente o realizar una sutura de un pequeño parche de aorta con la desembocadura de las arterias del donante, a la arteria ilíaca externa del receptor (parche de Carrel; fig. 1b y c).
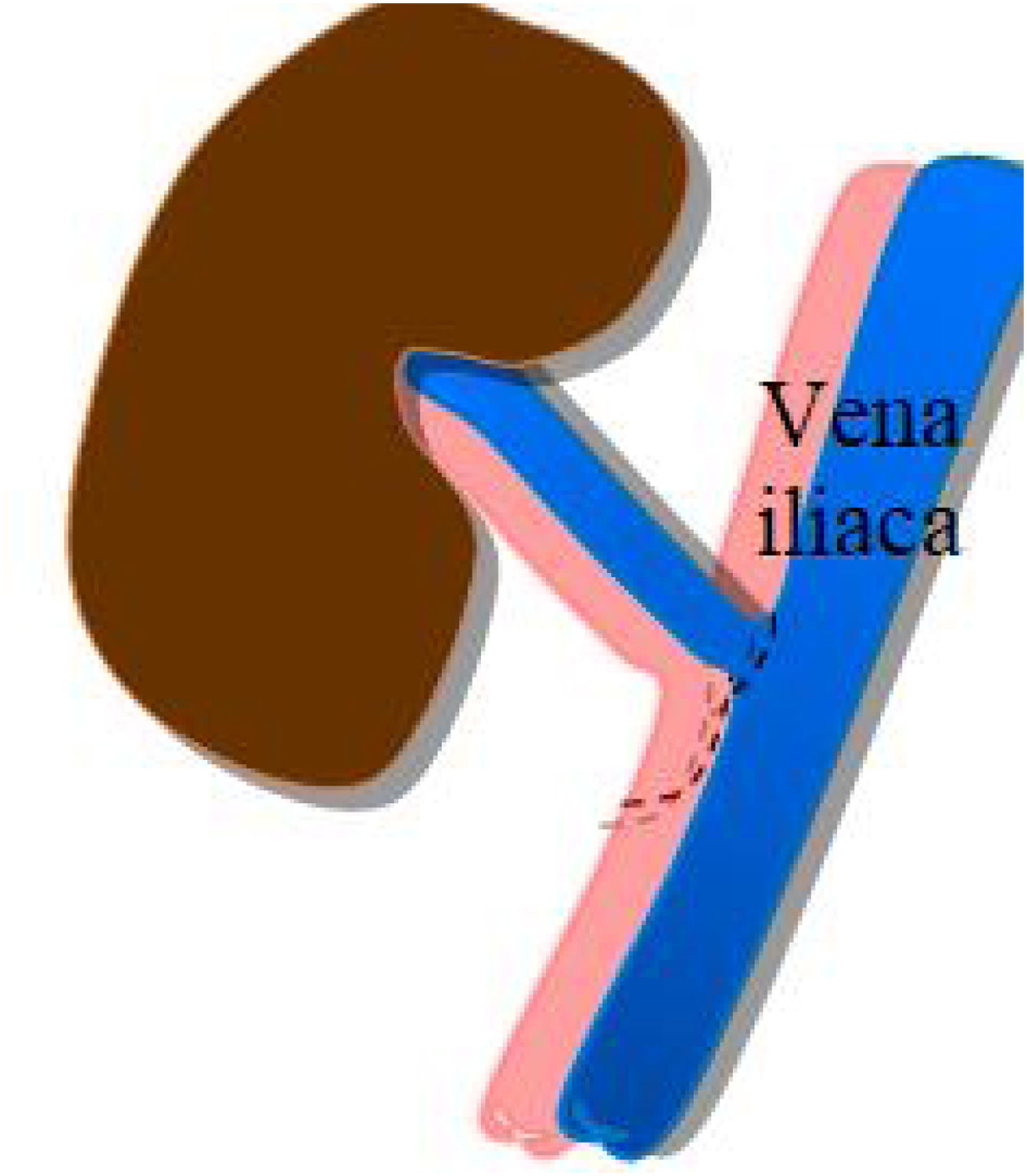
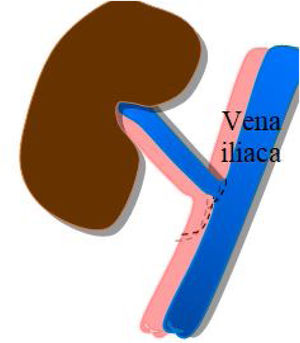
La anastomosis de la vena del injerto se realiza a la vena ilíaca externa del receptor, igualmente, de manera término-lateral (fig. 2).
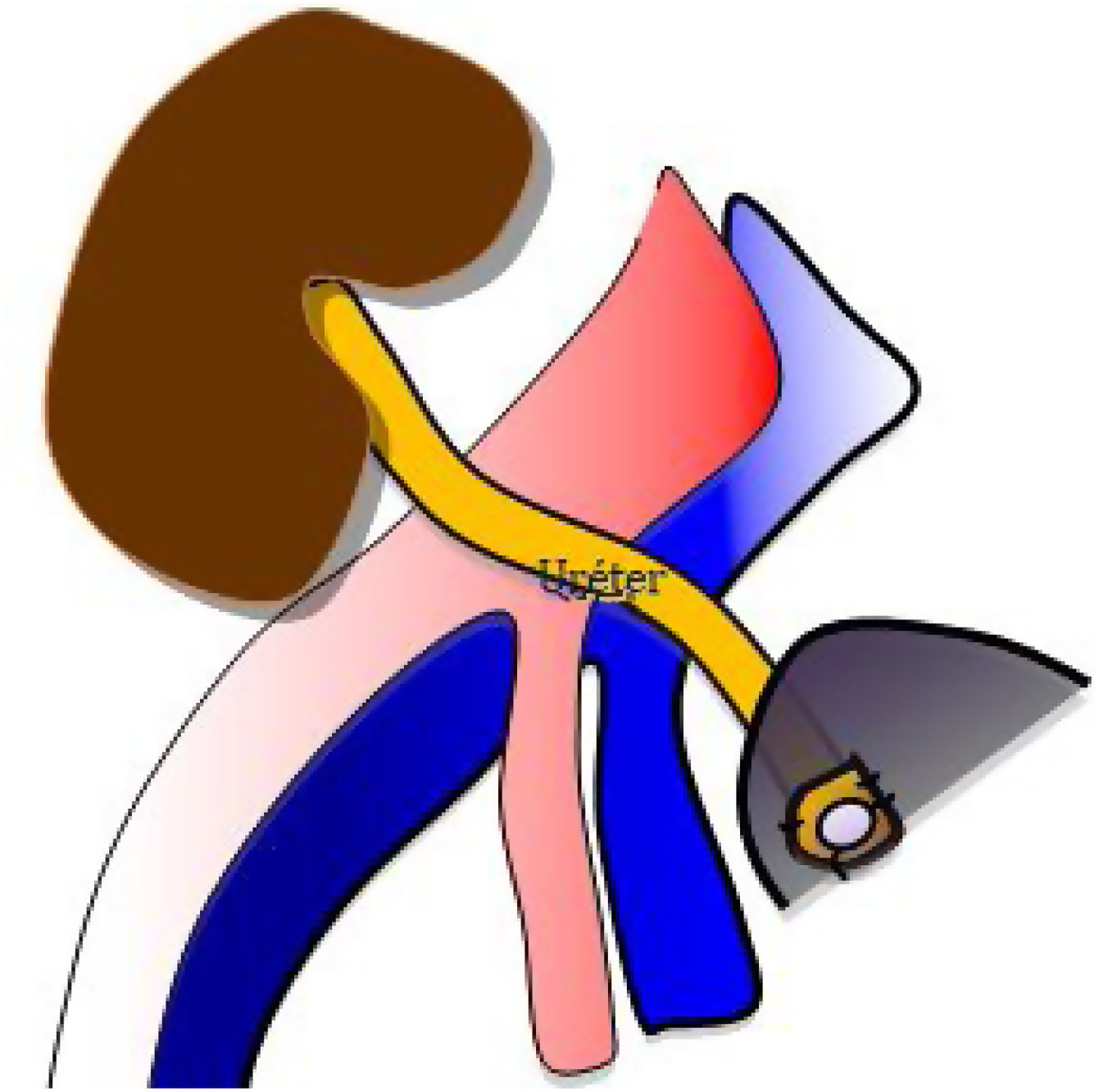
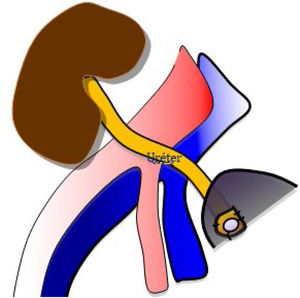
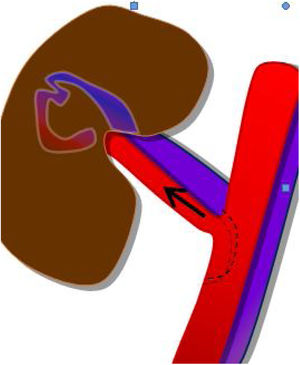
Se realiza una tercera anastomosis, que corresponde al implante del uréter del injerto renal a la vejiga del receptor (neocistostomía, fig. 3). Para minimizar posibles estenosis perisuturales se coloca un catéter tipo pigtail pieloureterovesical que se mantiene durante los primeros 15-20 días tras la cirugía.
EcografíaLa ecografía constituye la modalidad diagnóstica de elección en la valoración del trasplante renal1. Es una técnica no invasiva y repetible, y proporciona información en tiempo real sobre el injerto, así como sobre sus estructuras vasculares. Puede realizarse a pie de cama del paciente y en unidades de Reanimación sin que conlleve asociado el empleo de radiaciones ionizantes o de contrastes nefrotóxicos.
La ecografía con contraste (CEUS) aporta información complementaria sobre la perfusión del injerto, una posible enfermedad vascular asociada e incluso parece tener un papel significativo en el diagnóstico de su disfunción aguda2, por lo que es recomendable en la valoración del trasplante renal.
Actualmente no existe consenso sobre el papel de la elastografía tipo shear wave en la valoración del injerto. Publicaciones recientes sugieren que puede ser un indicador de disfunción en estadios iniciales3, previo al desarrollo de manifestaciones clínicas o alteraciones analíticas, si bien no existe una postura unánime al respecto.
De manera generalizada, se realiza una ecografía en modo B y en modo Doppler color y pulsado con sonda convex de baja frecuencia en las primeras 24-48h postrasplante, además de una CEUS. En función de la evolución clínico-analítica del paciente y los hallazgos de esta primera exploración ecográfica, se programan los siguientes controles, siempre de manera individualizada.
Protocolo de estudio. El informe radiológicoSe realiza una primera adquisición en modo B, con barridos longitudinales y axiales para valorar el tamaño, la morfología, el espesor cortical, la diferenciación corticomedular, el cribado de lesiones intraparenquimatosas y de dilatación de la vía excretora. En ausencia de patología, tanto el injerto como la vía urinaria deben presentar un aspecto ecográfico similar al de un riñón nativo sano en modo B.
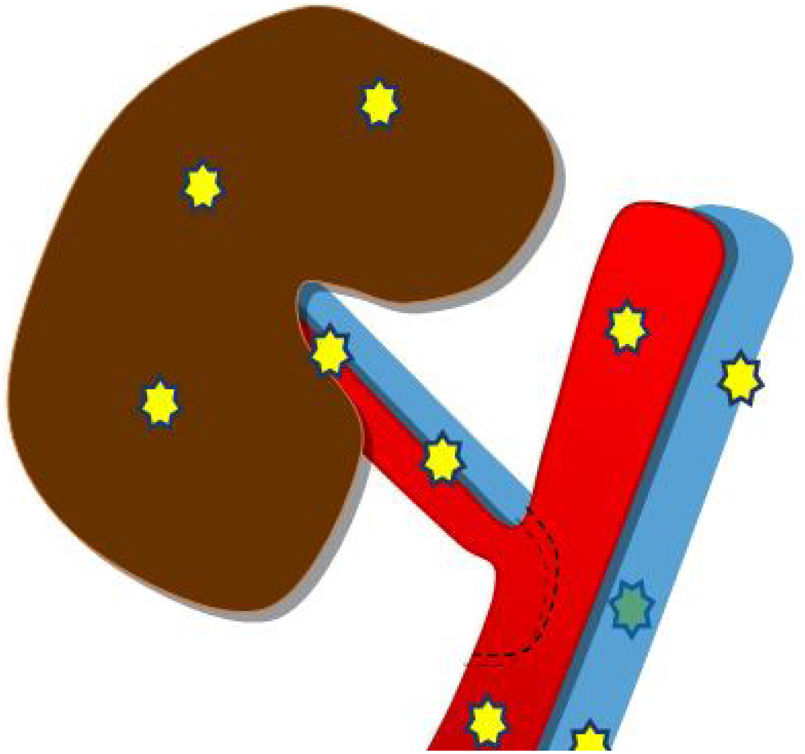
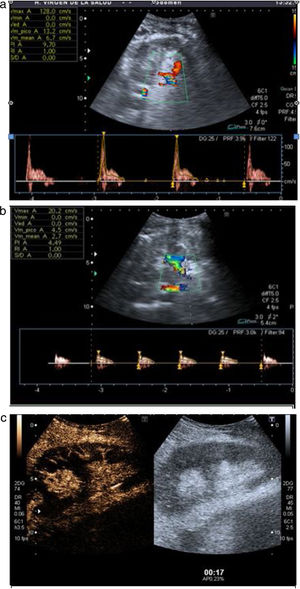
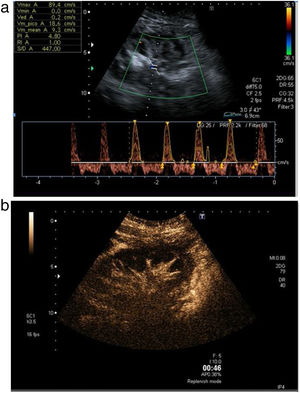
Posteriormente, se procede al estudio vascular arterial y venoso empleando el modo Doppler color y pulsado. Si la ventana acústica es favorable, se deben valorar la arteria y la vena del injerto a nivel ilíaco, extrarrenal, hiliar, interlobar superior, interpolar e inferior (fig. 4). De manera estandarizada, se recogen la velocidad picosistólica y el índice de resistencia (IR) de cada una de las arterias estudiadas4.
La arteria del injerto renal presenta un espectro en el Doppler pulsado con curvas de baja resistencia (IR <0,8) y diástole progresivamente descendente por encima de la línea de base.
A continuación, se realiza el mismo estudio Doppler color sobre la vena del injerto, la cual tiene que presentar un color invertido al arterial y mostrar flujo permanente a lo largo del ciclo cardiaco en el estudio pulsado, por debajo de la línea de base.
La valoración vesical se realiza de igual forma que en un paciente no trasplantado. Ocasionalmente, en función del material de sutura, puede objetivarse una lesión nodular de aspecto sólido a nivel de la neocistostomía, correspondiente a una reacción a cuerpo extraño.
Complicaciones del trasplante renalLas complicaciones de trasplante renal pueden clasificarse en vasculares, parenquimatosas, de la vía excretora y colecciones perirrenales.
Complicaciones vascularesAunque su incidencia oscila entre el 5-10% de las complicaciones5, constituyen una causa importante de disfunción del injerto.
La estenosis de la arteria renal es la más frecuente de ellas (entre el 1 y el 10%)6. La ecografía Doppler color muestra aliasing con un flujo turbulento de alta velocidad (> 250cm/s) en el punto de la estenosis. Distal al mismo existe caída de la velocidad igual o superior al 50%, con un espectro en parvus tardus (tiempo de aceleración mayor de 0,07 s y disminución del IR). La CEUS puede confirmar el punto exacto de la estenosis y ayudar a su cuantificación.
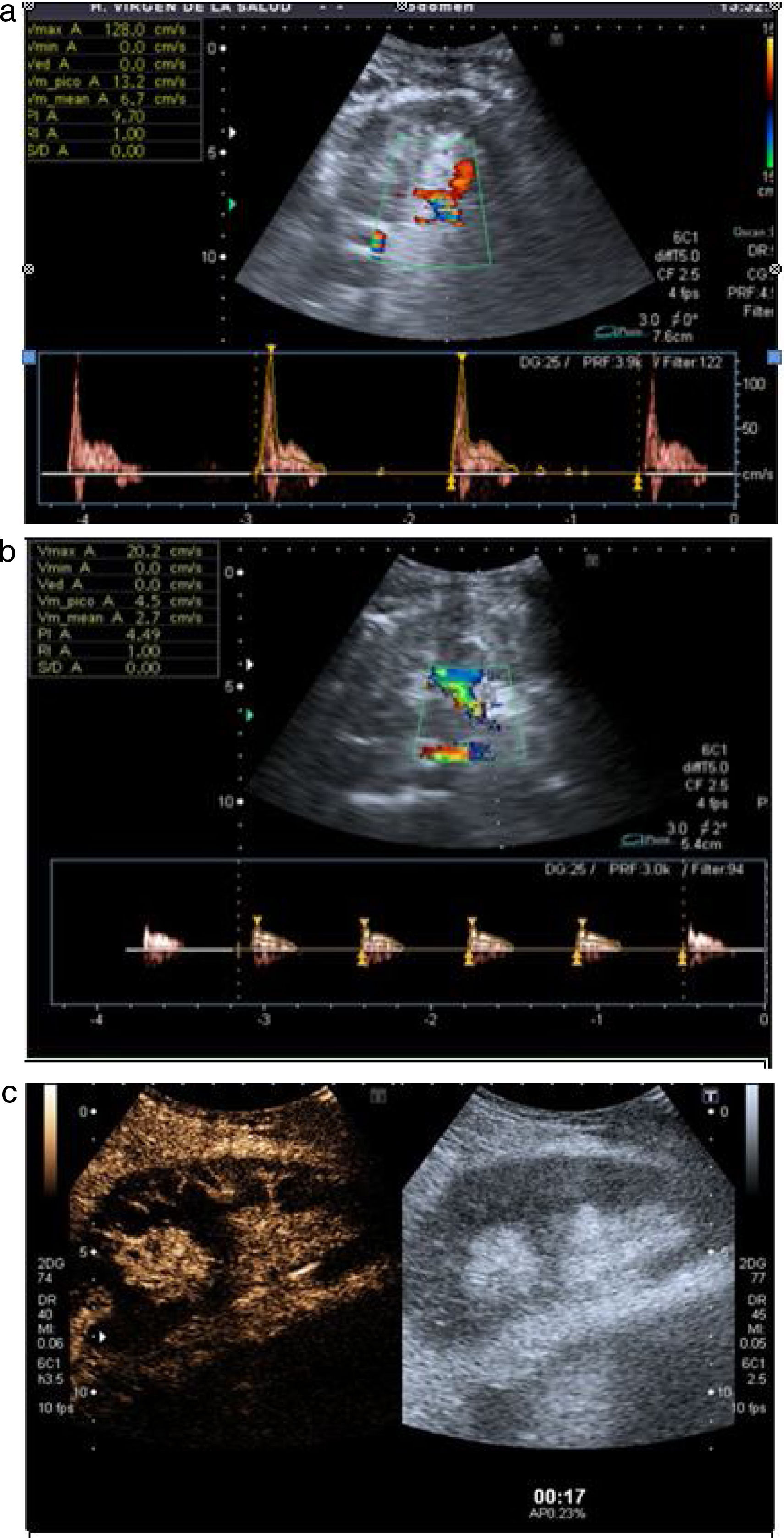
La trombosis de la arteria renal es una complicación rara (del 0,5 al 4%)7 y potencialmente grave, ya que la isquemia conduce a la pérdida del injerto. En modo B existe pérdida de la diferenciación corticomedular y disminución significativa o ausencia de flujo arterial en Doppler color e incluso en la vena si la trombosis es completa. En el estudio pulsado muestra curvas arteriales de baja velocidad, pérdida de diástole, sístole picuda y aumento del IR previo al trombo (fig. 5a). Distalmente la señal Doppler color y pulsada es prácticamente indetectable (fig. 5b). La CEUS confirma la disminución o ausencia de flujo arterial con hipoperfusión tisular generalizada (fig. 5c).
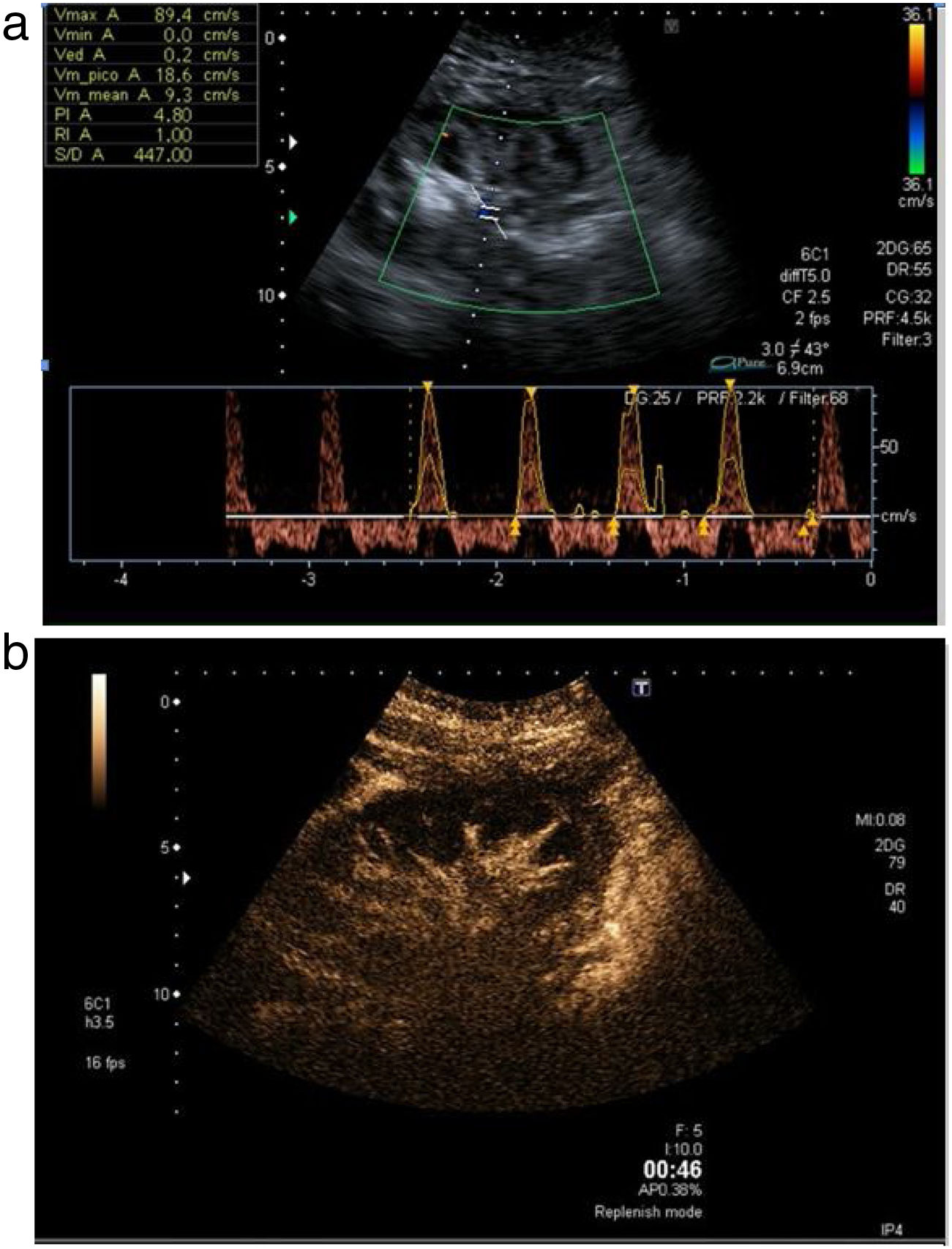
La trombosis de la vena renal es poco habitual (hasta el 5%), pero más frecuente que la de la arteria7. En modo B se objetiva un aumento del tamaño del injerto, un engrosamiento cortical y una pérdida de la diferenciación corticomedular. Existe disminución o ausencia de señal venosa en el modo Doppler color y pulsado, con aumento del IR en la arteria del injerto. En los casos muy evolucionados se objetiva un flujo arterial con diástole en vaivén (fig. 6a). La CEUS refleja una arteria permeable, hipoperfusión tisular y ausencia de visualización de la vena (fig. 6b).
Entidad muy poco frecuente8. Puede ser secundaria a fibrosis perivascular o compresión extrínseca asociada. En el modo Doppler color se aprecia aliasing en el punto estenosado, con aumento focal de la velocidad del 50% en el Doppler pulsado (fig. 7a y b). La CEUS puede confirmar el punto exacto de la estenosis y facilitar su cuantificación, al igual que en la estenosis arterial.
Fístula-arteriovenosaLa realización de procedimientos percutáneos puede conducir al desarrollo de conexiones aberrantes arteriovenosas de muy pequeño tamaño. Alrededor del 20% de las fístulas es secundaria a la biopsia. En modo B suelen pasar desapercibidas, mientras que en el modo color se aprecia un mosaico de color turbulento con reverberación posterior. En el estudio pulsado, la arteria aferente suele presentar flujo turbulento de alta velocidad, mientras que la vena eferente muestra flujo arterializado de alta velocidad9 (fig. 8).
Complicaciones de la vía excretoraLa uropatía obstructiva acontece en el 2-15% de los pacientes10. En el postoperatorio temprano puede existir leve ectasia secundaria a la denervación del uréter trasplantado. Habitualmente suele ser secundaria a colecciones adyacentes, estenosis en la neocistostomía, pionefrosis o coágulos. Ecográficamente muestran hallazgos superponibles a los de un riñón no trasplantado.
Complicaciones parenquimatosasLas complicaciones parenquimatosas constituyen una causa frecuente de disfunción aguda del injerto. Son la necrosis tubular aguda, el rechazo agudo o crónico, la nefropatía crónica del injerto, la toxicidad medicamentosa, las neoplasias y la pielonefritis11. En modo B presentan hallazgos sutiles o inespecíficos, como son el engrosamiento cortical, la pérdida de la diferenciación corticomedular o el engrosamiento urotelial leve. El estudio Doppler puede poner de manifiesto hipoperfusión tisular y aumento del IR arterial12, aunque suele ser necesario la realización de biopsia para su diagnóstico.
ColeccionesLas colecciones suelen compartir un aspecto ecográfico similar, por lo que puede llegar a ser necesario realizar una punción-aspiración para su diagnóstico.
Los linfoceles son las colecciones más frecuentes (2-20%) y aparecen entre las 4-8 semanas postrasplante, siendo anecogénicas en modo B. Los urinomas son poco habituales, obedecen a la lesión de la vía excretora y se desarrollan en el periodo precoz postrasplante. En modo B son anecogénicos y pueden contener aislados tabiques en su interior. Los hematomas clínicamente significativos acontecen en el 4-8% de los casos y en modo B pueden presentar ecos, progresivamente más significativos conforme evolucionan. El absceso puede desarrollarse sobre una colección previa o estar asociado a pielonefritis, presentando un aspecto variable quístico complejo en modo B, con septos groseros en su interior y alteración de planos grasos adyacentes13.
Informe estructurado- 1.
Ecografía modo B:
- •
Revisión de la hoja operatoria para determinar la naturaleza de la anastomosis vascular.
- •
Volumen renal.
- •
Ecoestructura.
- •
Vía excretora.
- •
Líquido perirrenal/intraabdominal. Colecciones o líquido libre, tamaño, ubicación, apariencia y facilidad para su drenaje percutáneo.
- 2.
Doppler color y espectral:
- •
Identificación de la anastomosis: arterial (Vsist máx) y venosa (V máx) y relación con las velocidades de los vasos ilíacos.
- •
Flujo de color presente dentro del parénquima renal.
- •
Si es uniforme la perfusión parenquimatosa y el IR.
- •
Identificación del flujo de color en los vasos ilíacos ipsolaterales.
- •
Áreas de flujo anormal que indiquen fístula arteriovenosa o seudoaneurisma.
- •
Evidencia de estenosis arterial o venosa.
- •
Aplicar Doppler espectral a cualquier área de flujo de color anormal.
- 3.
Estudio CEUS: en las primeras 24h.
- 4.
Complicaciones:
- •
Complicaciones vasculares:
- a.
Estenosis de la arteria-vena renal.
- b.
Fístula arteriovenosa y seudoaneurismas.
- c.
Trombosis de la vena o arteria renal.
- •
Complicaciones urológicas-colecciones.
- •
Colecciones perirrenales:
- a.
Hematoma.
- b.
Linfocele.
- c.
Urinoma.
- d.
Absceso.
- •
Obstrucción.
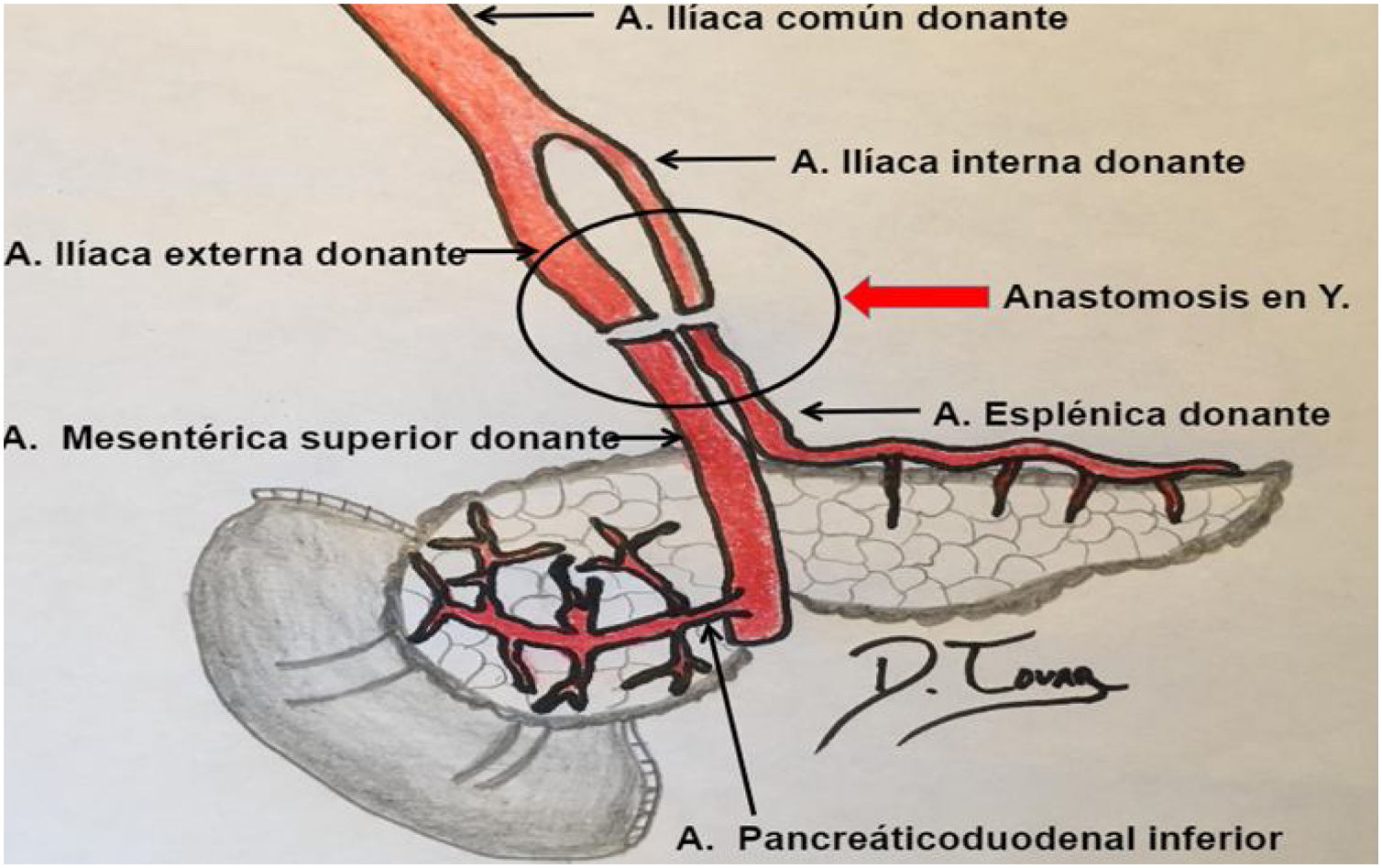
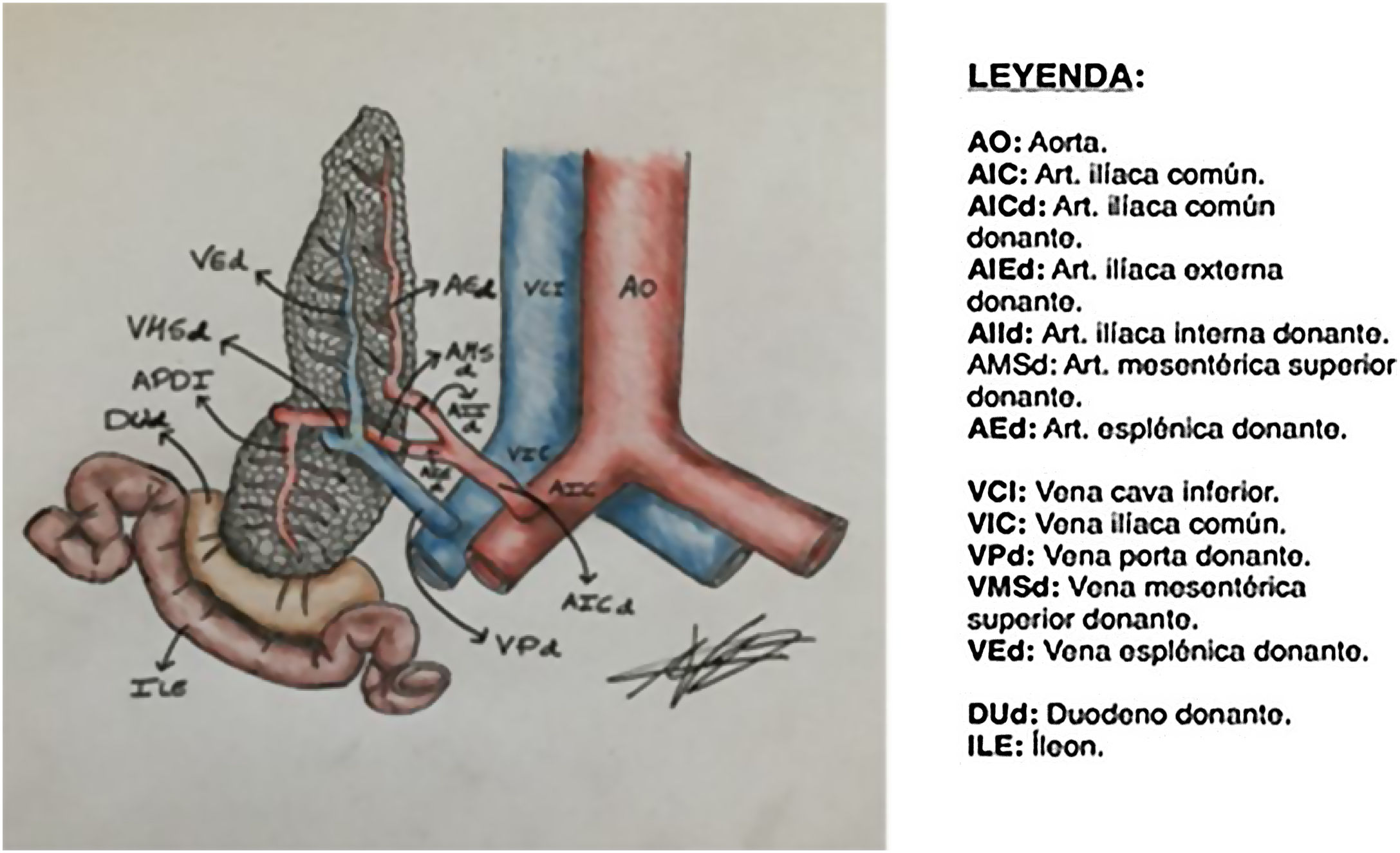
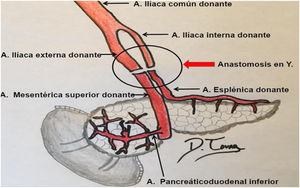
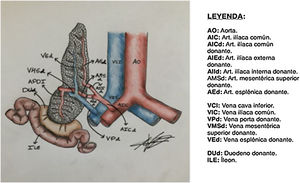
Para poder realizar un estudio radiológico correcto e interpretar adecuadamente las imágenes es fundamental estar familiarizado con la técnica quirúrgica, la cual ha ido variando a lo largo de los años. Desde la década de los 90, la técnica más empleada consiste en colocar el injerto en la fosa ilíaca (habitualmente derecha, si se trata de un trasplante simultáneo de riñón y páncreas). Al realizar la extracción del páncreas del donante, se liga el extremo distal de las venas esplénica y mesentérica para separar el páncreas del bazo y del intestino, respectivamente. La vena porta del injerto resultante de la unión fisiológica de las venas esplénica y mesentérica se anastomosa directamente a la vena ilíaca. La arteria del injerto se anastomosa a la arteria ilíaca, pero se requiere primero realizar una reconstrucción arterial para unir las arterias esplénica y mesentérica del donante. La utilizada con más frecuencia es la reconstrucción en «Y». Finalmente, para drenar las secreciones exocrinas pancreáticas, el duodeno del donante se anastomosa con un asa intestinal14,15 (figs. 9 y 10).
En los últimos años, en algunos centros se ha comenzado a colocar el injerto en situación retroperitoneal16,17, realizando una duodeno-duodenostomía para las secreciones exocrinas. Se consigue así una secreción más fisiológica que en el drenaje entérico y una disminución de la distancia entre la anastomosis vascular y la entérica, lo que contribuye a disminuir las complicaciones. Con esta técnica, el páncreas queda situado verticalmente por detrás del colon ascendente, con la cabeza pancreática en situación craneal.
ComplicacionesDebido a la complejidad de la cirugía, la posibilidad de que aparezcan complicaciones es alta. Las más frecuentes son:
Vasculares- •
Trombosis de las venas del injerto: es la complicación vascular más frecuente debido a que las venas esplénica y mesentérica tienen flujo lento puesto que, originariamente en el donante, llevaban también la sangre procedente del bazo e intestino, respectivamente, mientras que una vez realizado el trasplante solo transporta la sangre procedente del páncreas. Lo más frecuente es que sean trombos parciales y asintomáticos. Si se diagnostican pronto se puede intentar su recanalización18, aunque si los trombos son pequeños el tratamiento suele ser conservador, con heparina. Las trombosis completas pueden provocar la disfunción y la pérdida del injerto, pero a veces se forman rápidamente colaterales, que pueden ser suficientes para preservar la función pancreática19.
- •
Complicaciones arteriales: son menos frecuentes. La principal es la trombosis, que provoca la necrosis y la pérdida del injerto. Otras complicaciones arteriales menos frecuentes son los seudoaneurismas o las fístulas arterio-venosas.
- •
Dehiscencia de la sutura duodenal, que puede provocar un cuadro de abdomen agudo.
- •
Sangrado posquirúrgico.
- •
Pancreatitis. La manifestación clínica y radiológica es superponible a la pancreatitis del páncreas nativo.
- •
Sobreinfección y formación de abscesos peripancreáticos. El manejo suele ser conservador con antibióticos y colocación de drenaje.
- •
Fístula pancreática, con formación de colecciones por acúmulo de líquido pancreático.
- •
Rechazo agudo y crónico.
- •
Síndrome linfoproliferativo postrasplante. Es muy poco frecuente, pero puede aparecer tras el trasplante pancreático al igual que tras el trasplante de otros órganos.
Para evitar la pérdida del injerto es fundamental detectar precozmente estas complicaciones y tratarlas lo antes posible. Dado que la incidencia de las complicaciones quirúrgicas es máxima en los primeros días, es importante realizar una ecografía Doppler de control a las 24-48h del trasplante, aunque no haya sospecha clínica de complicaciones. En esta ecografía hay que intentar ver todo el parénquima pancreático, comprobar la permeabilidad de los vasos y descartar la presencia de colecciones peripancreáticas. Además de esta ecografía rutinaria, siempre que se sospeche una complicación será preciso realizar una prueba de imagen. Es recomendable realizar siempre en primer lugar una ecografía, por su inocuidad y accesibilidad, pero si esta no es concluyente o no se ha podido explorar el injerto en su totalidad o bien la sospecha clínica es muy alta y la ecografía no detecta alteraciones, es necesario realizar una TC.
Exploración ecográficaLa exploración ecográfica del injerto pancreático es difícil y es necesaria cierta experiencia para reconocer adecuadamente todas las estructuras. La exploración ecográfica de un páncreas trasplantado debe incluir siempre:
- •
Estudio del parénquima pancreático en modo B: el injerto pancreático normal es homogéneo y muestra una ecogenicidad similar a un páncreas nativo. La dificultad fundamental para su exploración es la interposición del gas de las asas intestinales o del colon ascendente (en el caso de la colocación en situación retroperitoneal). En el primer caso, suele ser útil realizar compresiones con el mismo transductor para separar las asas y abrir una ventana acústica. En el segundo caso puede ser de ayuda la colocación del paciente en decúbito lateral izquierdo e intentar ver el páncreas (fundamentalmente la cabeza pancreática) desde un abordaje lateral al colon.
- •
Estudio de la permeabilidad de los vasos:
- a.
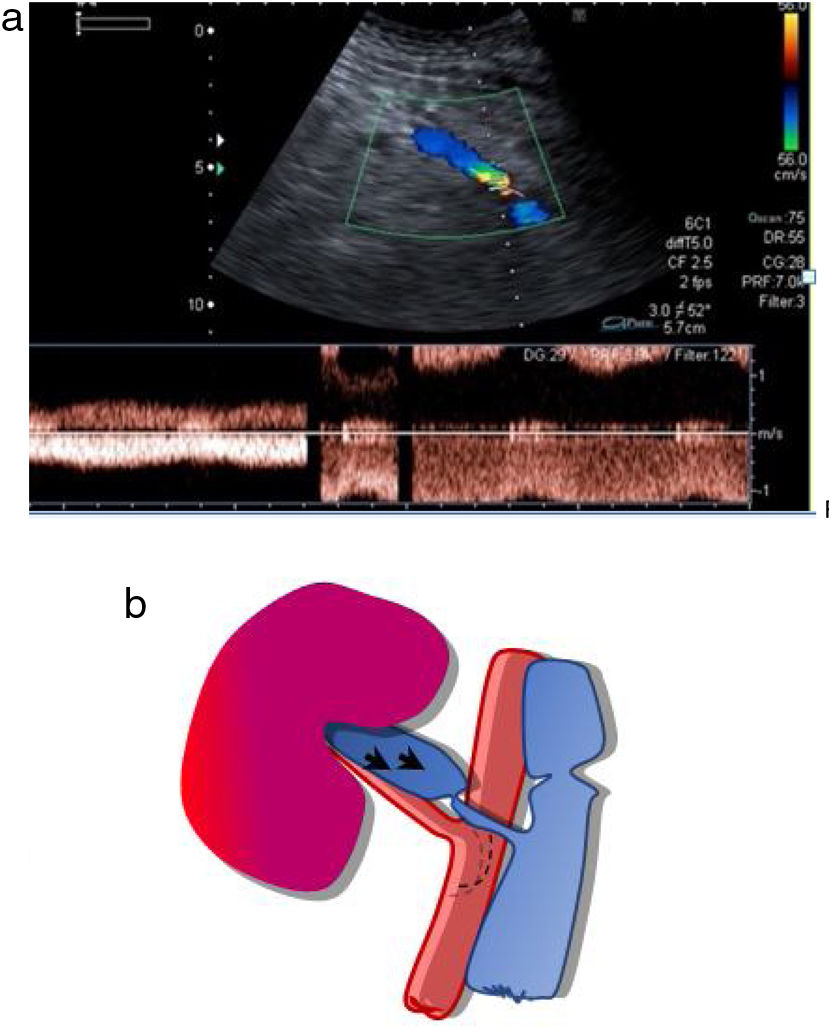
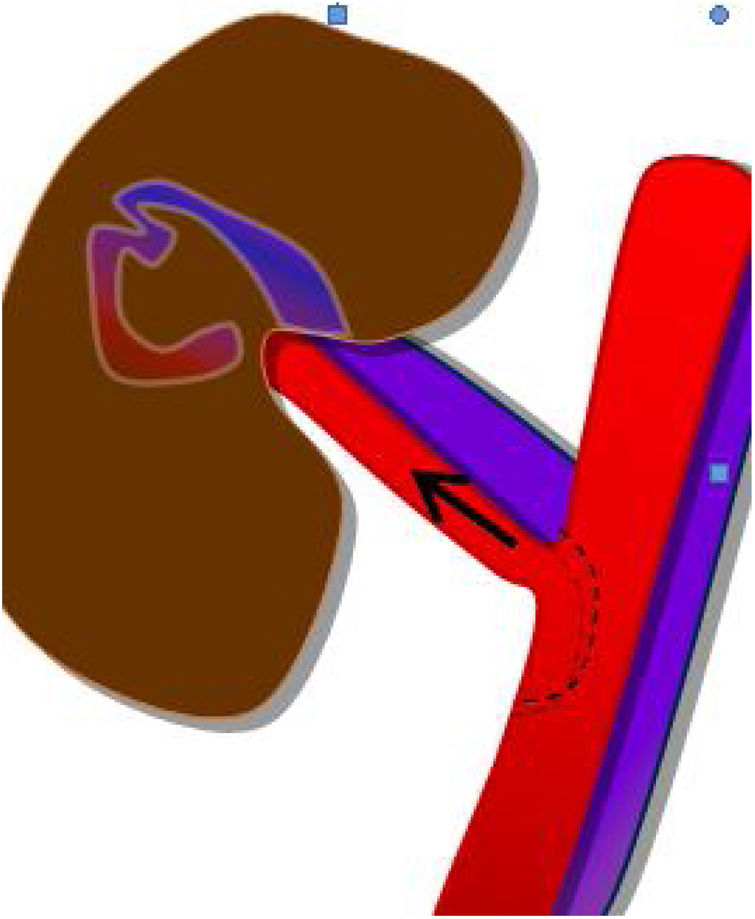
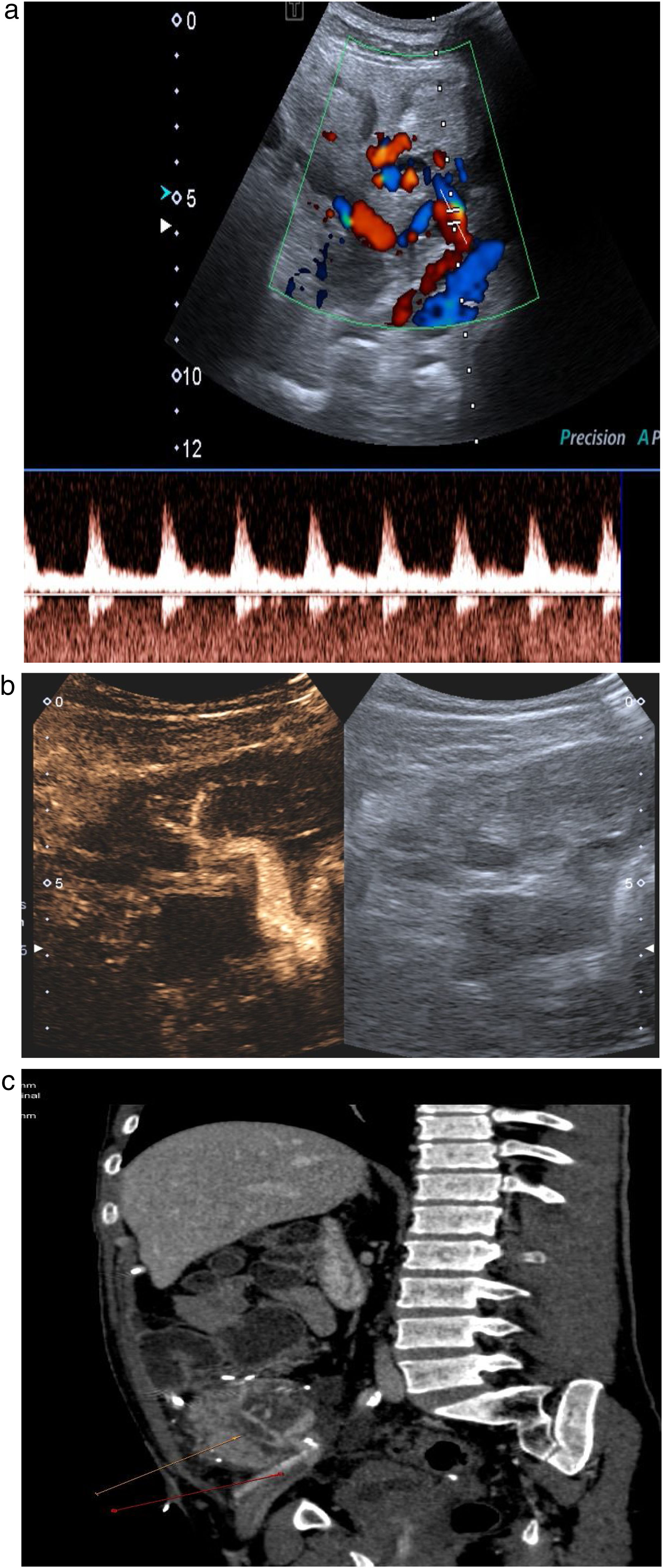
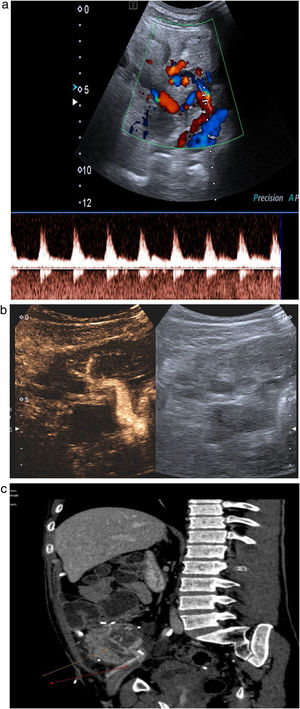
Estudio venoso. Es necesario comprobar la permeabilidad de las venas esplénica, mesentérica y porta, y seguirlas en todo su trayecto, ya que la presencia de trombos parciales es frecuente. La vena esplénica recoge el drenaje venoso del cuerpo y la cola pancreáticos, mientras que la mesentérica recoge sangre de la cabeza pancreática. Como el extremo distal de ambas se liga, es frecuente encontrar pequeños trombos en ambos muñones venosos, que no tienen trascendencia. Los trombos a veces son muy hipoecoicos y difíciles de identificar, por lo que es necesario comprobar siempre la permeabilidad del vaso con el Doppler color. El estudio Doppler de la vena esplénica es más difícil que el de la mesentérica puesto que además de ser una vena de muy bajo flujo, suele presentar un ángulo subóptimo para el estudio Doppler, ya que, por la disposición del páncreas, suele ser próximo a los 90 grados. En los casos en que no se consiga rellenar el vaso con el Doppler a pesar de optimizar todos los parámetros (baja frecuencia, baja escala), el contraste ecográfico es de gran ayuda para confirmar la permeabilidad o detectar trombos18,19 (fig. 11a-c).
Figura 11.Trombosis venosa. A) La ecografía espectral del trasplante de páncreas revela la inversión del flujo diastólico en una arteria intrapancreática. No se pudieron identificar formas de onda venosa durante todo el trasplante. B) Trombosis venosa parcial con CEUS: solo se visualizan la vena mesentérica, pero sin porta, y la vena esplénica. C) Confirmación con TC: las flechas señalan trombosis venosa parcial.
- b.
Estudio arterial. Es importante estudiar la permeabilidad de la arteria a nivel de la anastomosis con la arteria ilíaca y en todo su trayecto. Como el flujo es de mayor velocidad que el de la vena, no suele haber problemas para confirmar su permeabilidad con el Doppler color.
- •
Descartar colecciones peripancreáticas. Toda exploración ecográfica de un páncreas trasplantado debe incluir un estudio de todo el abdomen, especialmente de la zona que rodea al páncreas, para descartar complicaciones. Estas pueden ser debidas a diferentes causas:
- a.
Hematomas posquirúrgicos.
- b.
Dehiscencia de suturas.
- c.
Fístula pancreática.
- d.
Pancreatitis aguda.
- e.
Abscesos.
En general, para el estudio de colecciones es recomendable realizar una TC, ya que muchas veces en la ecografía las colecciones quedan ocultas entre las asas intestinales y pasan desapercibidas. En el caso de que no sea posible realizar un TC, la CEUS puede ser de ayuda puesto que la grasa mesentérica, el páncreas y las paredes intestinales captan contraste, delimitando muy bien las colecciones como áreas hipocaptantes.
Exploración con TCAl elaborar el informe radiológico hay que prestar especial atención en incluir en el informe los siguientes aspectos:
- •
Parénquima pancreático: es importante determinar si presenta una captación homogénea o, por el contrario, presenta áreas de hipoperfusión por complicaciones vasculares o bien en el contexto de una pancreatitis del injerto.
- •
Permeabilidad vascular. Al igual que en el estudio ecográfico, hay que valorar los vasos venosos y arteriales para descartar trombosis. En caso de permeabilidad, es importante hacerlo constar en el informe explícitamente.
- •
Presencia de colecciones peripancreáticas. Incluir en el informe una descripción de su aspecto, localización y tamaño.
- •
Valoración del duodeno del donante y de la anastomosis duodeno-entérica o duodeno-duodenal. Es necesario comprobar que el duodeno del donante capta contraste adecuadamente y que no presenta las paredes engrosadas. Es importante estar alerta a signos que hagan sospechar dehiscencia de sutura como burbujas de neumoperitoneo o colecciones adyacentes a la anastomosis. Estudio general de todo el abdomen en busca de cualquier otra complicación.
El rechazo del injerto pancreático es también una complicación frecuente, pero de difícil diagnóstico, ya que la repercusión clínica es inespecífica y no tiene traducción en las pruebas de imagen. Para establecer el diagnóstico se puede realizar una biopsia del injerto pancreático, que puede ser guiado por ecografía o bien guiado mediante TC20-22. La biopsia guiada por ecografía tiene la ventaja sobre la TC de que a veces es posible separar las asas intestinales comprimiendo con el mismo transductor, permitiendo llegar así a algunos injertos inaccesibles mediante guía con TC. Por otra parte, la TC tiene la ventaja sobre la guía ecográfica de que permite realizar la biopsia por abordaje posterior con el paciente en decúbito prono con mejor visibilidad que la guía ecográfica. Por ello, la elección de una técnica u otro dependerá de cada caso y también de la experiencia del radiólogo con cada una de estas técnicas.
Informe estructurado- 1.
Ecografía modo B:
- •
Revisión de la hoja operatoria para determinar la naturaleza de la anastomosis vascular y para determinar su lugar de drenaje.
- •
Colecciones o líquido libre, tamaño, ubicación, apariencia y facilidad para su drenaje percutáneo.
- •
Evaluar la ecoestructura del parénquima pancreático.
- •
Visualización del calibre del conducto pancreático principal.
- 2.
Color Doppler:
- •
Flujo de color presente dentro del parénquima pancreático.
- •
Si es uniforme la perfusión.
- •
Identificación de las anastomosis arterial y venosa.
- •
Identificación de flujo en la arteria y vena esplénicas.
- •
Identificación del flujo de color en los vasos ilíacos ipsolaterales.
- •
Áreas de flujo anormal que indiquen fístula arteriovenosa o seudoaneurisma.
- 3.
Doppler espectral:
- •
Ondas arteriales y venosas, morfología y normalidad.
- •
Cuantificación de la Vsist máx en la arteria esplénica cerca de la anastomosis y la arteria ilíaca.
- •
Pico sistólico en la anastomosis y en la arteria ilíaca.
- •
Evidencia de estenosis en la anastomosis arterial.
- •
Vmáx en la vena esplénica cerca de la anastomosis y de la vena ilíaca.
- •
Evidencia de estenosis venosa.
- •
Aplicar Doppler espectral a cualquier área de flujo de color anormal.
- •
Valoración de fístula arteriovenosa o seudoaneurisma.
- 4.
Estudio CEUS: en las primeras 24h.
- 5.
Estudio TC si precisa.
- 6.
Complicaciones vasculares:
- •
Trombosis de las venas del injerto.
- •
Complicaciones arteriales.
- 7.
Otras complicaciones:
- •
Dehiscencia de la sutura duodenal.
- •
Sangrado posquirúrgico.
- •
Pancreatitis.
- •
Sobreinfección y formación de abscesos peripancreáticos.
- •
Fístula pancreática, con formación de colecciones por acúmulo de líquido pancreático.
- •
Rechazo agudo y crónico.
- •
Síndrome linfoproliferativo postrasplante.
- 1.
Responsable de la integridad del estudio: JAJL, MAGC, CGR
- 2.
Concepción del estudio: JAJL, MAGC, CGR
- 3.
Diseño del estudio: JAJL, MAGC, CGR
- 4.
Obtención de los datos: JAJL, MAGC, CGR
- 5.
Análisis e interpretación de los datos: JAJL, MAGC, CGR
- 6.
Tratamiento estadístico: JAJL, MAGC, CGR
- 7.
Búsqueda bibliográfica: JAJL, MAGC, CGR
- 8.
Redacción del trabajo: JAJL,
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JAJL,
- 10.
Aprobación de la versión final: JAJL
Los autores declaran no tener ningún conflicto de intereses.