La arteria cerebral media es uno de los principales vasos intracraneales y el más implicado en la patología cerebrovascular isquémica, la cual constituye un importante volumen de nuestras exploraciones. Con las últimas actualizaciones en el manejo del ictus isquémico (que implican tratamiento intravascular sobre vasos cada vez más distales y en un espectro de pacientes cada vez más amplio) se hace más importante conocer al detalle la anatomía vascular cerebral, para poder establecer diagnósticos rápidos y certeros y mejorar así el pronóstico de los pacientes. Por ello, realizamos este repaso anatómico de la arteria cerebral media, revisando sus segmentos y límites anatómicos, sus patrones de ramificación y sus variantes anatómicas. A su vez, proporcionamos una herramienta radiológica basada en la correlación entre la angio-TC y la TC perfusión para facilitar la identificación de los puntos de oclusión dentro del árbol vascular de la arteria cerebral media teniendo en cuenta sus diferentes variantes.
The middle cerebral artery (MCA) is one of the principal intracranial vessels. It is also the one that is most often involved in ischemic cerebrovascular disease, which accounts for a significant volume of brain imaging tests. With recent updates in the management of ischemic stroke (including intravascular treatment in increasingly distal vessels and in an increasingly widening spectrum of patients), it is becoming more important to know the details of the cerebral vascular anatomy to reach accurate diagnoses quickly and thereby improve patients’ prognoses. For these reasons, we present this anatomic review of the MCA, reviewing its segments and anatomic limits, its branching patterns, and its anatomic variants. We also provide a radiologic tool based on correlations between CT angiography and perfusion CT to facilitate the identification of the points of occlusion within the branches of the MCA, taking into account its different variants.
La arteria cerebral media (ACM) es, junto con la arteria cerebral anterior, una de las ramas terminales de la arteria carótida interna, y se encarga de la irrigación de la mayor parte de los hemisferios cerebrales. Por ello es el vaso que se ve afectado en la mayoría de los eventos isquémicos cerebrales1, los cuales suponen un gran número de urgencias radiológicas en nuestro medio. El manejo del ictus en estos últimos años está cambiando. En la última guía de la American Heart Association/American Stroke Association2 se recogen las actualizaciones del tratamiento endovascular en el ictus, que incluyen como novedades respecto a las guías previas: el empleo de trombectomía mecánica hasta las primeras 24 horas del inicio de los síntomas en determinados pacientes [aquellos que presentan oclusión de gran vaso, missmatch en las pruebas de imagen (perfusión/difusión) y unas características clínicas determinadas3,4] y, por otro lado, el empleo de técnicas endovasculares en oclusiones hasta de segmento M3 de la ACM en determinados pacientes.
Todo ello exige al radiólogo tener una idea clara y precisa de la anatomía vascular, para que cuando esté en la urgencia y se enfrente al diagnóstico de un evento isquémico cerebral pueda determinar de forma rápida y certera el lugar de oclusión dentro del árbol vascular, sobre el cual, probablemente, se procederá a realizar una trombectomía mecánica en los próximos instantes, contribuyendo a la rapidez del circuito diagnóstico-terapéutico y a la optimización del pronóstico del paciente. Para ello, además de realizar un repaso anatómico de la ACM con sus posibles variantes anatómicas y anomalías, exponemos una herramienta radiológica basada en la correlación de la perfusión y la angio-TC para facilitar la localización de la obstrucción en la rama afectada durante el diagnóstico de un evento isquémico cerebral.
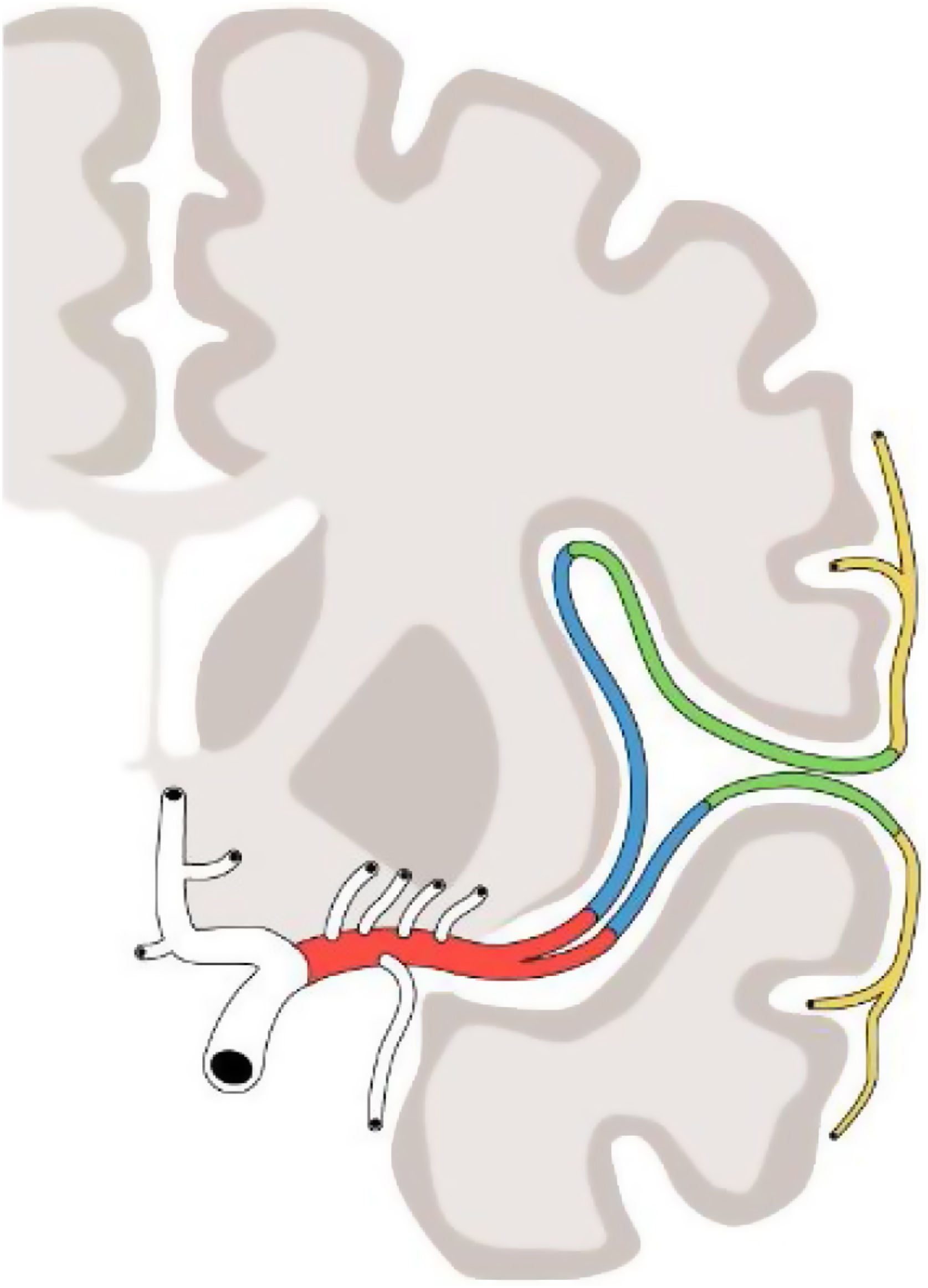
ACM: segmentosLa terminología anatómica clásica establece dos segmentos de la ACM (M1 y M2) cuyo límite lo marca la bifurcación del tronco principal5. En la práctica, sin embargo, para el abordaje quirúrgico y radiológico se diferencian cuatro segmentos (M1, M2, M3, M4), descritos a principios de los años 80 del pasado siglo por Gibo et al.6, determinados por la distribución espacial en la que se dispone su tronco principal y sucesivas ramas (fig. 1):
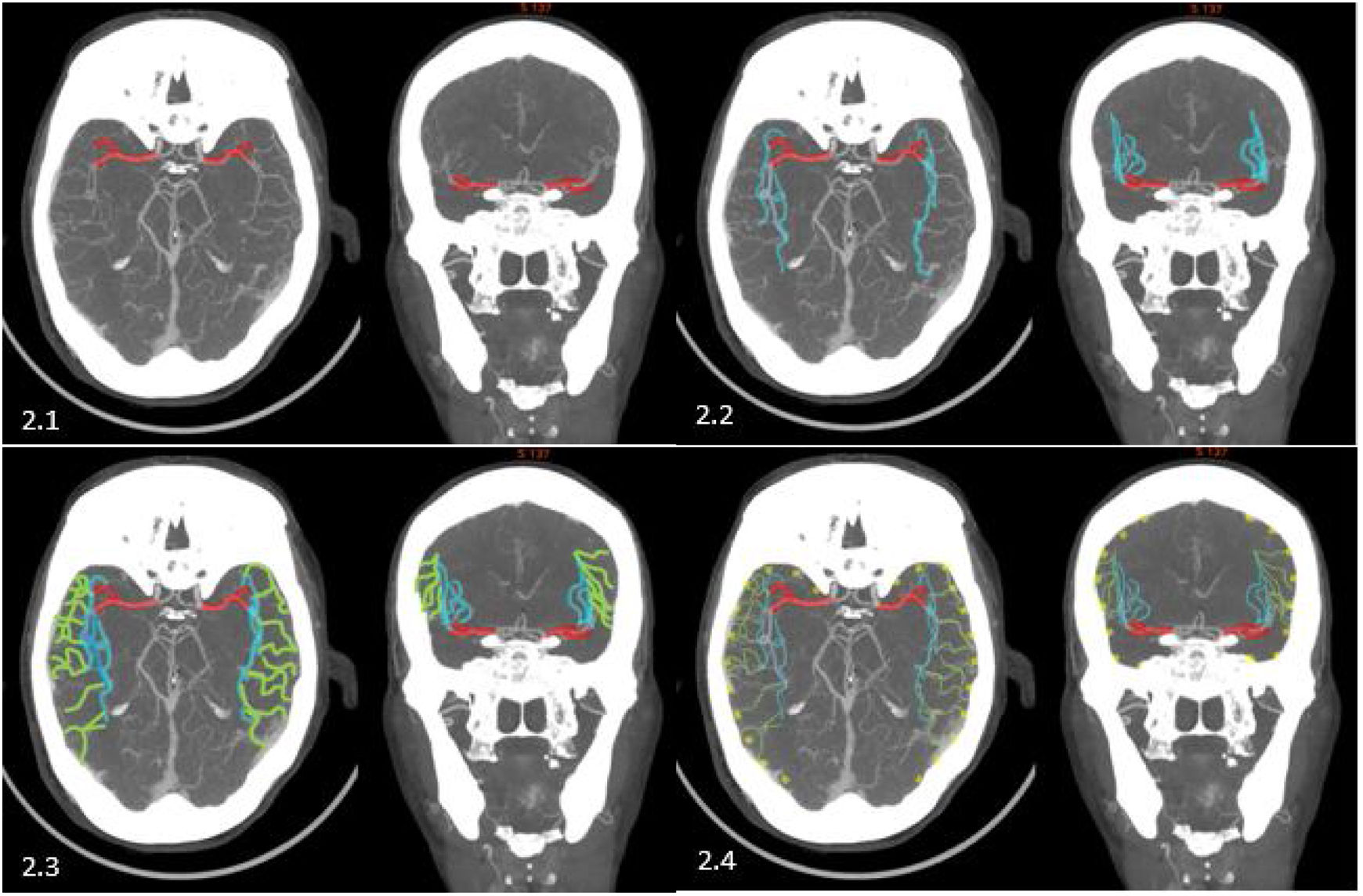
• M1: segmento horizontal o esfenoidal. Se origina en la bifurcación de la arteria carótida interna y discurre lateralmente en un plano axial, bajo la sustancia perforada anterior y paralelo al ala del esfenoides, hacia la cisura de Silvio. A lo largo de su trayecto puede dividirse en dos o varios troncos, lo cual establece dos porciones de M1: el segmento M1 prebifurcación y el segmento M1 posbifucarción (constituido por los segmentos horizontales de cada uno de los dos o más troncos correspondientes en cada caso). Cuando los troncos del segmento posbifurcación llegan al limen de la ínsula realizan un giro de 90°, que se conoce como genu o rodilla, terminando el segmento M1 (fig. 2.1).
• M2: segmento insular. Se origina en la rodilla de los troncos principales de la ACM y se conforma por estos y sus sucesivas ramificaciones que circulan sobre la ínsula, a lo largo de la cisura de Silvio, en un plano vertical hasta la parte más distal del surco circular insular. Aquí realizan otro giro, esta vez más acusado, en horquilla, para rodear los opérculos, donde empieza el segmento M3 (fig. 2.2).
• M3: segmentos operculares: desde la parte más distal del surco circular, las ramas se dirigen a lo largo de los opérculos frontoparietal y temporal hacia el borde más lateral/superficial de la cisura de Silvio, donde empezarán los segmentos M4 (fig. 2.3).
• M4: segmentos corticales. Desde el borde lateral/superficial de la cisura de Silvio las ramas vuelven a girar para abandonar el borde y dirigirse superior o inferiormente por la superficie cortical hasta su final, constituyendo estas los segmentos M4 (fig. 2.4).
ACM: ramasLa ACM presenta dos grupos de ramas: las arterias perforantes, o lenticuloestriadas, y las arterias corticales7.
Las arterias perforantes son vasos de calibre muy fino que emergen en número variable, entre 8 y 20, en su mayoría a lo largo del segmento M1 de la ACM y algunas de ellas también desde la arteria cerebral anterior. Su reducido calibre hace que sea difícil su completa definición mediante técnicas angiográficas. Estas ramas se dirigen superiormente a través de la sustancia perforada anterior para irrigar los ganglios de la base y estructuras profundas del cerebro. Se dividen en un grupo medial y otro lateral, en función de si se forman antes o después de la división del tronco principal de la ACM. Las mediales irrigan principalmente el núcleo lenticular, parte del núcleo caudado y cápsula interna; y las laterales ascienden más superiormente irrigando la cápsula externa y el núcleo caudado8.
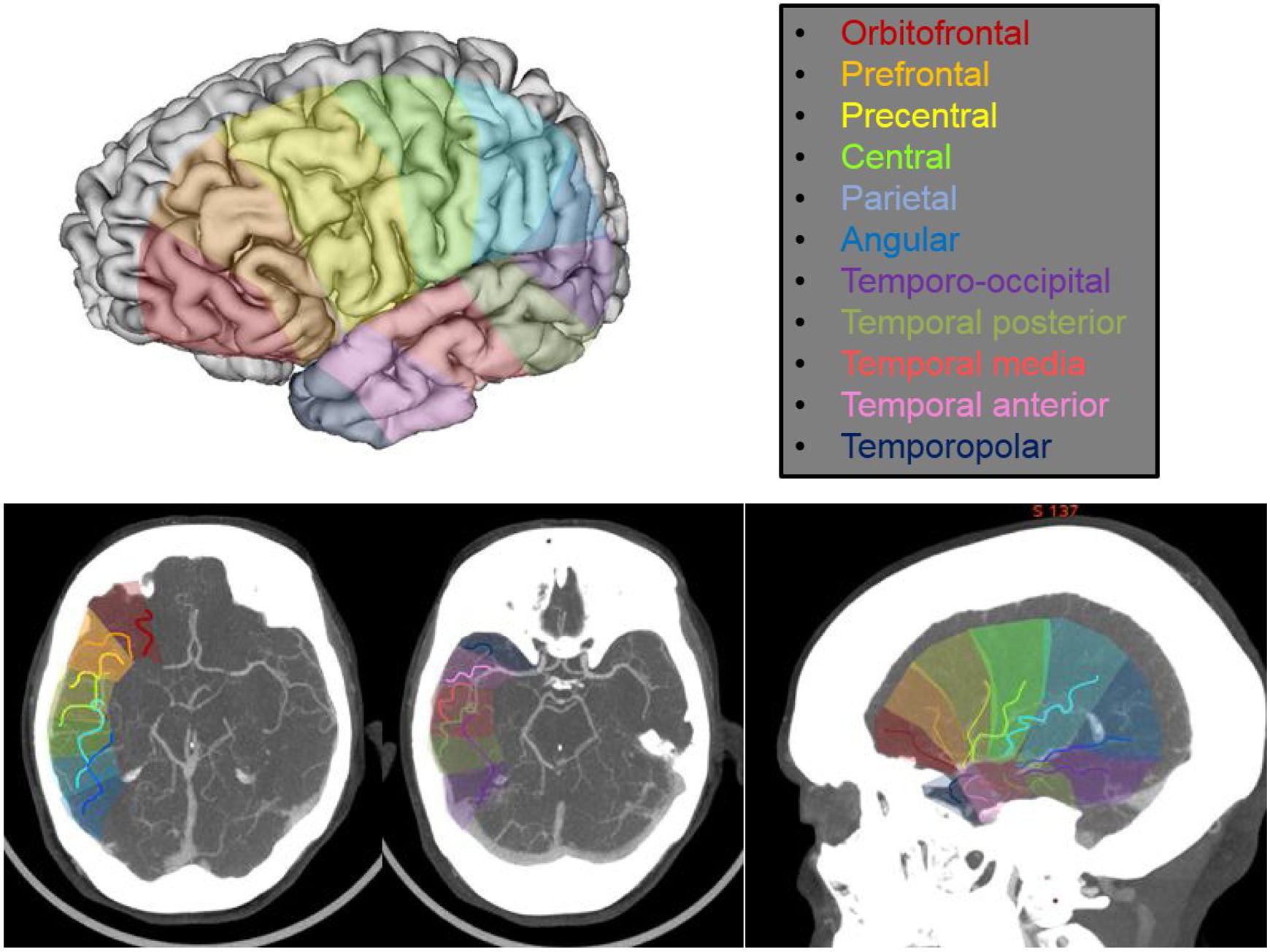
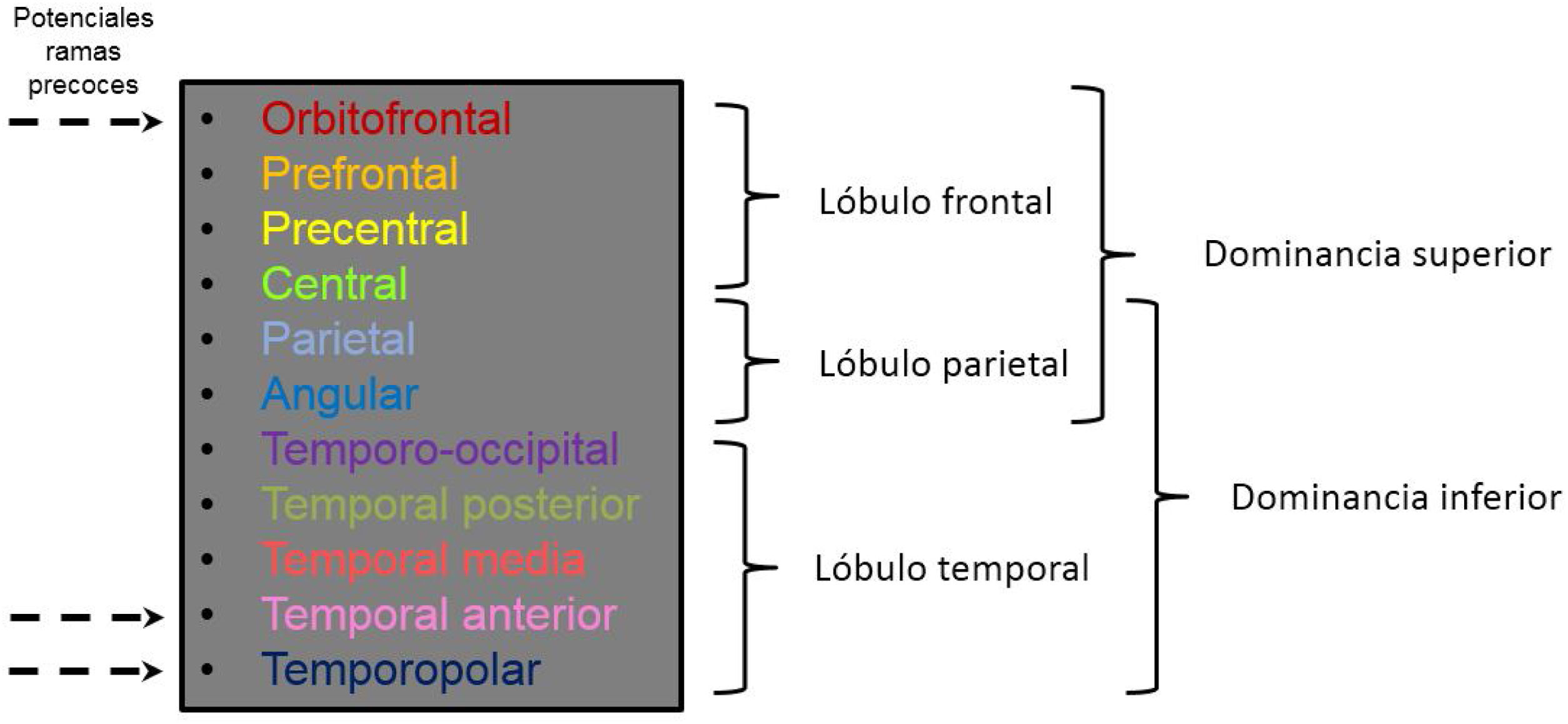
Las arterias corticales son las ramas que emergen a lo largo de la ACM para irrigar los distintos territorios corticales. Se trata de vasos de un calibre ya más considerable, que permite su correcta valoración independiente por técnicas de imagen angiográficas habituales. El número de estas ramas también es variable, así como su patrón de emergencia desde la ACM, dando lugar a una amplia variabilidad anatómica. Lo habitual es tener entre 10 y 12 ramas corticales, siendo las más comunes las siguientes: orbitofrontal, prefrontal, precentral, central, parietal anterior, parietal posterior, angular, temporopolar, temporal anterior, temporal media, temporal posterior y temporooccipital6 (fig. 3).
Imagen en 3D cerebral con los territorios de irrigación correspondientes a cada una de las ramas corticales y representación de la disposición espacial/anatómica aproximada de las distintas ramas corticales en cortes axiales y sagitales de tomografía computarizada con sus territorios de irrigación correspondientes.
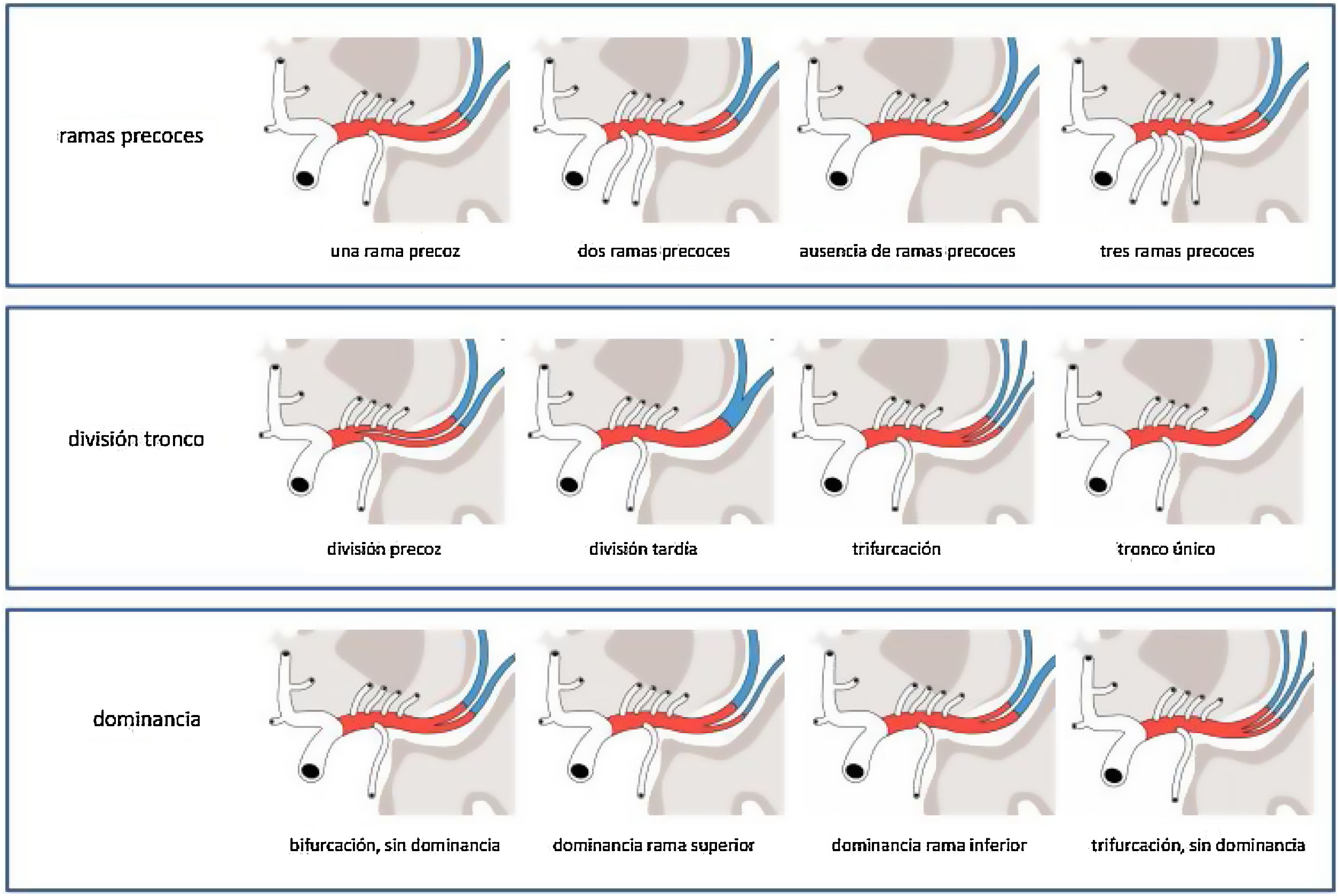
La variabilidad en los patrones de ramificación vendrá determinada por tres factores principales: la presencia de ramas precoces, la división del tronco principal de la ACM y la dominancia de los troncos6 (fig. 4).
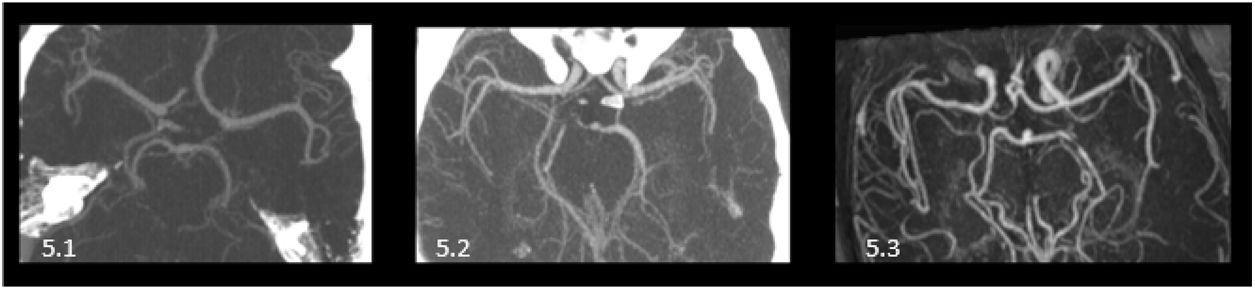
Ramas precoces o tempranasLa mayoría de las ramas corticales emergen de la ACM una vez que se ha dividido su tronco principal, a lo largo de esas divisiones o a partir de otras ramas corticales. Pero existe también la posibilidad de presentar ramas corticales que se formen previas a la división, emergiendo del segmento M1 prebifurcación, son las denominadas ramas precoces. Estas ramas precoces pueden ser temporales o frontales, apareciendo como tales las arterias temporopolar, temporal anterior u orbitofrontal. La variante más habitual es la presencia de una de estas ramas precoces, generalmente una rama precoz temporal9. Las siguientes variantes por orden de frecuencia serían: presentar dos ramas precoces, seguida de no presentar ninguna y, por último, como situación menos frecuente, tener tres de estas ramas precoces10 (fig. 5).
División del tronco principalEl tronco principal de la ACM se divide en troncos más pequeños, generalmente a lo largo su segmento M1. La localización de esta división da lugar a variantes, pudiendo ser una división precoz, cuando se produce muy cerca de la formación de la ACM, con un segmento prebifurcación muy corto (generalmente menor de 5 mm), o una división tardía, cuando se observa a nivel proximal del segmento M2.
En cuanto a la división en sí misma también se presentan diferentes supuestos. Lo más habitual es que esta división dé lugar a dos troncos, es decir una bifurcación (en torno a un 70% de los casos), formándose un tronco anterosuperior y otro posteroinferior11,12.
El siguiente caso en frecuencia sería una trifurcación (en un 20% de los casos aproximadamente), con la formación de un tronco superior, uno intermedio y uno inferior11,12.
También se recogen en la literatura médica opciones menos frecuentes, como la división en múltiples troncos o incluso la ausencia de divisiones con un tronco único de la ACM (ambos supuestos en menos de un 10% de los casos)12,13 (fig. 6).
Dominancia de las divisionesLa dominancia de una división viene determinada por su irrigación de un mayor territorio cerebral, basándose en que de ella emergen un mayor número de ramas corticales. Lo que es lo mismo, algunas ramas corticales se formarán en una u otra división en función de la dominancia.
Partiendo del caso más habitual, una bifurcación, las ramas temporales se van a formar en la división inferior y las ramas frontales en la división superior. Las ramas parietales, en cambio, pueden emerger del tronco superior, del inferior o repartirse entre ambos, lo cual vendrá determinado por una dominancia de la división anterosuperior en el primer caso, de la posteroinferior en el segundo o de una ausencia de dominancia en el último6.
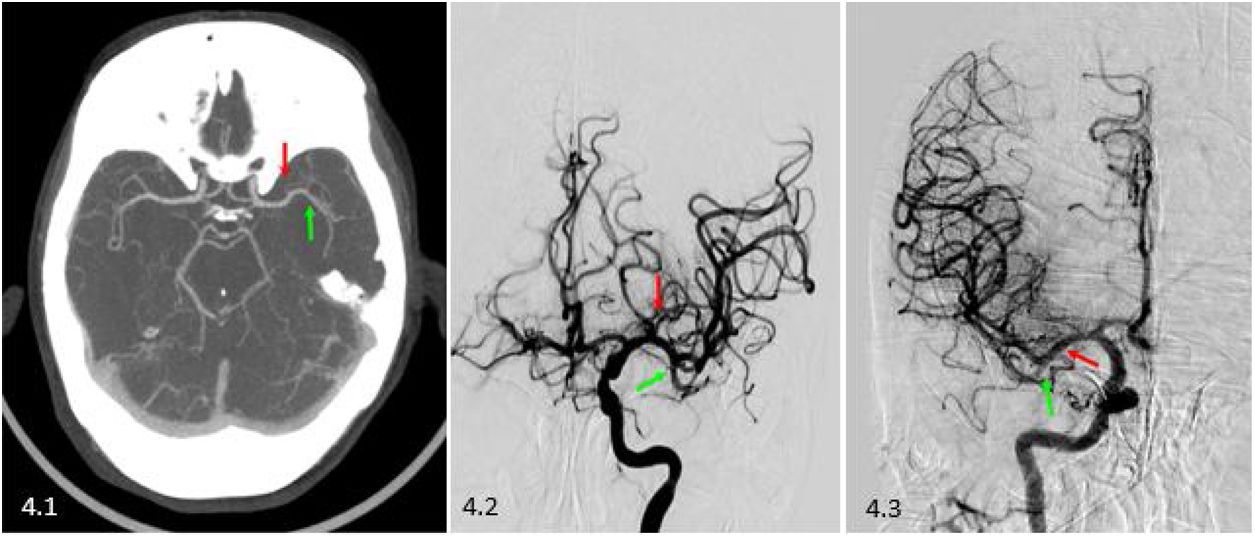
En el caso de una trifurcación, en general las ramas temporales se forman de la división inferior, las parietales de la media y las frontales de la superior. Si alguna de las divisiones se manifiesta como dominante, implica que de ella emergerá además alguna rama de un territorio adyacente que no se forma en su división correspondiente11 (figs. 7 y 8).
Esquema de los supuestos más habituales en relación con la dominancia de las divisiones de la arteria cerebral media, con el territorio irrigado correspondiente a cada una de las divisiones. 6.1) No dominancia (las ramas que irrigan el lóbulo parietal surgen de las dos divisiones). 6.2) Dominancia anterosuperior (la irrigación del lóbulo parietal proviene, junto con la del lóbulo frontal, de la ramificación anterosuperior). 6.3) Dominancia posteroinferior (la irrigación del lóbulo parietal proviene, junto con la del lóbulo temporal, de la ramificación posteroinferior). 6.4) Trifurcación sin dominancia (cada lóbulo está irrigado por una de las tres divisiones).
Las anomalías en la ACM son menos frecuentes que en las otras grandes arterias intracraneales. Se deben a la alteración en la fusión de las redes vasculares primitivas. Se consideran como tales: la ACM accesoria, la duplicación de la ACM y, mucho menos frecuentes, el origen duplicado de la ACM, y la ACM fenestrada13.
Se denomina ACM accesoria a la formación de un tronco adicional paralelo a la ACM principal que se origina distal a este, a partir de la arteria cerebral anterior, e irriga la porción anterior del lóbulo frontal. Se considera una duplicación de la ACM cuando se forma un tronco adicional a la ACM principal pero proximal a este, emergiendo ambos de la arteria carótida interna, irrigando el primero la porción anterior del lóbulo temporal14.
Se considera un origen duplicado de la ACM cuando persiste la porción proximal de una ACM accesoria o de una ACM duplicada que se fusiona distalmente con la ACM principal. Hablamos de ACM fenestrada cuando hay un defecto de fusión en el tronco principal de la ACM después de su origen, de manera que emerge como tronco único, se ramifica y vuelve a fusionarse15.
Herramienta anátomo-radiológica basada en la angio-TC y la TC perfusiónEn la práctica clínica podemos apoyarnos en la TC perfusión para localizar de forma rápida la rama afectada en un infarto cerebral, si no somos capaces de identificarla en primera instancia con la angio-TC16. Mediante esta técnica se definen las áreas de parénquima que se han afectado en un evento isquémico. Por tanto, si conocemos la anatomía de la ACM con sus ramas y correspondientes territorios de irrigación, observando el parénquima isquémico en la TC perfusión de nuestro caso problema podremos intuir qué rama o ramas se han afectado. A su vez, si conocemos las variantes anatómicas de la ACM podremos extrapolar cuáles serían los posibles puntos de obstrucción dentro de las posibilidades de árbol vascular de ACM y confirmar cuál será en nuestro caso en la angio-TC17. En las figuras asociadas podemos ver casos reales aplicados (figs. 9 y 10).
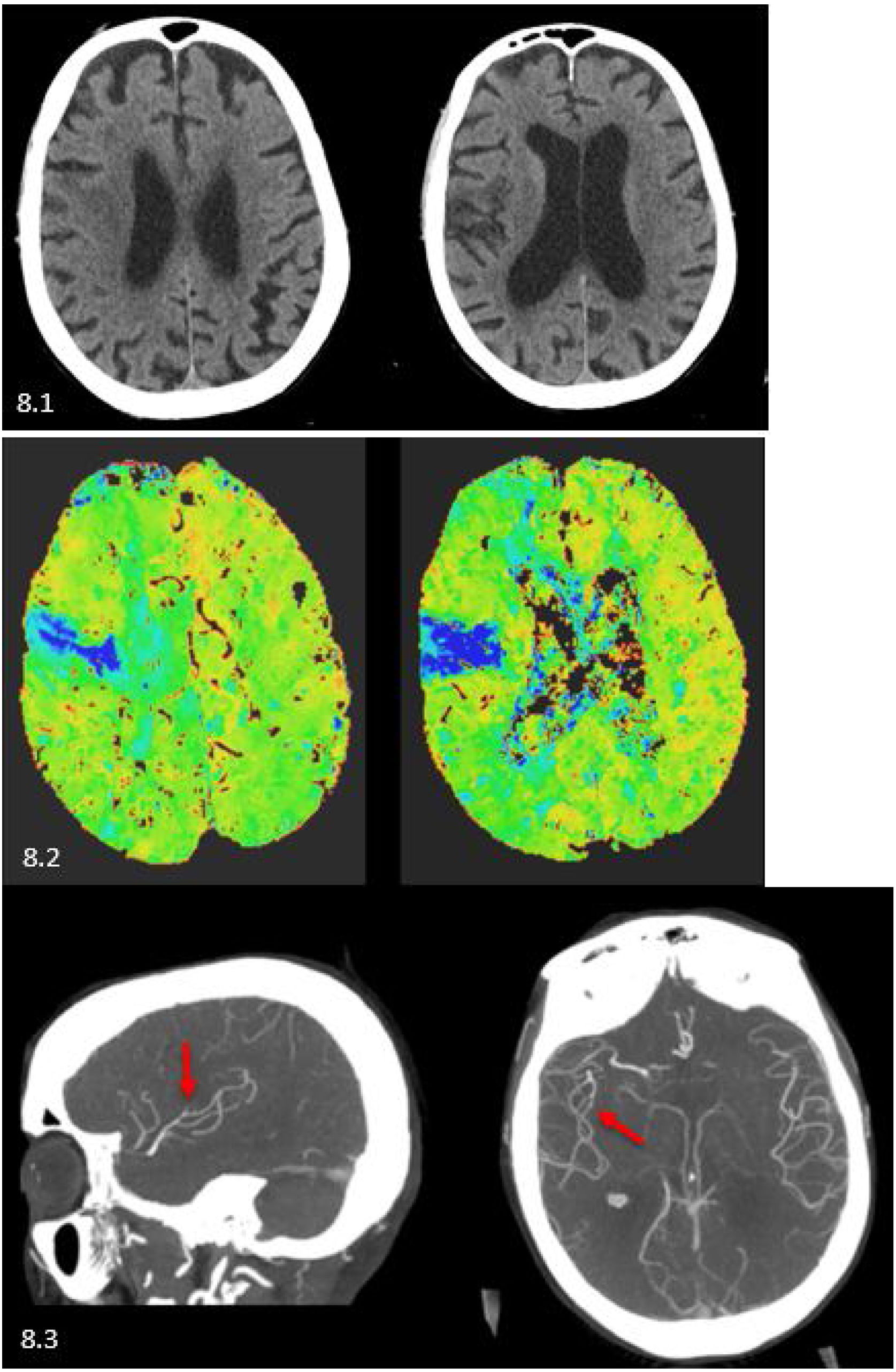
Caso 1: varón de 87 años con ictus PACI derecho. 8.1) Tomografía computarizada (TC) basal con hipodensidad en áreas M2 y M5 izquierdas, ASPECTS 8. 8.2) TC perfusión (mapa de Tmáx) con retraso de tiempos en el área corticosubcortical correspondiente a rama precentral izquierda. 8.3) Angio-TC en cortes axial y sagital: se observa stop de opacificación a nivel de la rama precentral izquierda (flecha roja).
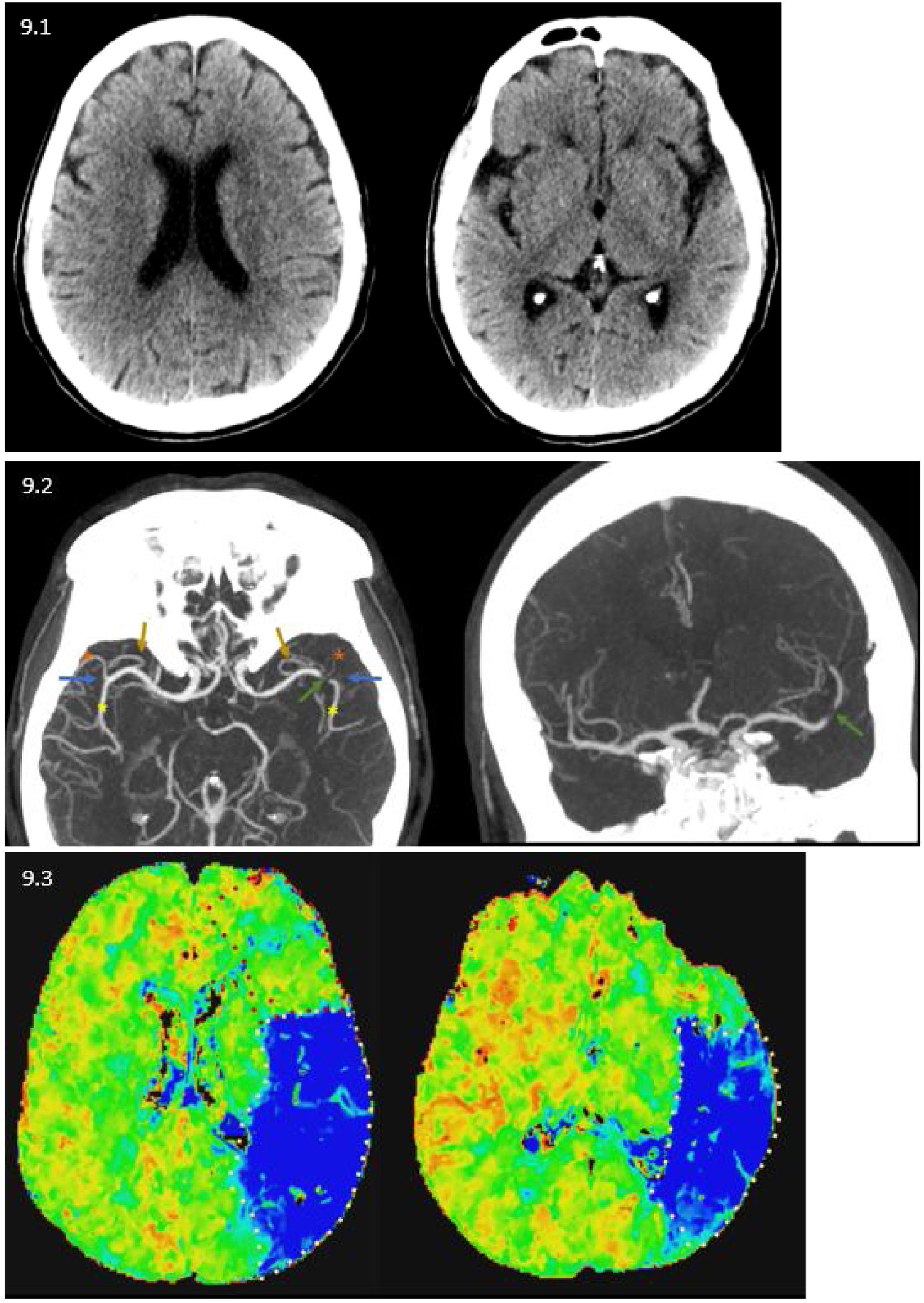
Caso 2: varón de 69 años con ictus TACI izquierdo. 9.1) Tomografía computarizada (TC) basal sin alteraciones, ASPECTS 10. 9.2) Angio-TC donde se observa bifurcación de los troncos de ambas arterias cerebrales medias (ACM) (flechas azules) con sus divisiones anteroinferior (asterisco rojo) y posterosuperior (asterisco amarillo) apreciando una dominancia de esta última dado su mayor calibre respecto a la primera. A su vez, presentan ambas ACM sendas ramas precoces (flechas marrones). Se observa defecto de repleción a nivel aproximado de la bifurcación de la ACM izquierda (flecha verde). 9.3) TC perfusión (mapa de Tmáx), retraso de tiempos en regiones parietal y temporal media y posterior, lo cual implica que ha habido afectación tan solo de la división dominante, posteroinferior, de la ACM izquierda.
Para concluir, queremos remarcar cómo se está haciendo posible el tratamiento endovascular del ictus isquémico en ramas cada más distales, lo cual implica que los radiólogos en la urgencia deban conocer de forma detallada la anatomía vascular cerebral para poder identificar la rama ocluida de forma precisa rápidamente, contribuyendo, además de a un diagnóstico certero, a facilitar la planificación del tratamiento.
Autoría- 1.
Responsable de la integridad del estudio: SMM, MPP.
- 2.
Concepción del estudio: SMM, MPP
- 3.
Diseño del estudio: SMM, MPP
- 4.
Obtención de los datos: SMM, MPP.
- 5.
Análisis e interpretación de los datos: SMM, MPP.
- 6.
Tratamiento estadístico:
- 7.
Búsqueda bibliográfica:
- 8.
Redacción del trabajo: SMM, MPP
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SMM, MPP, SGO, JCF.
- 10.
Aprobación de la versión final: SMM, MPP, SGO, JCF.
Refreshing Middle Cerebral Artery anatomy in Stroke thrombectomy Era: A CT-Angiography and Perfusion-CT Radiologic Tool
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.