El carcinoma de células renales es la octava neoplasia maligna más frecuente en el adulto y la más frecuente del riñón. Es, por tanto, una enfermedad muy común para el radiólogo. El objetivo de esta revisión es hacer una aproximación general a las diferentes técnicas de imagen utilizadas para diagnosticar, caracterizar y ayudar a planificar el tratamiento del carcinoma de células renales, así como hacer consideraciones básicas sobre la estadificación, el tratamiento percutáneo guiado con técnicas de imagen y el seguimiento en las situaciones clínicas más habituales.
Renal cell carcinoma is the eighth most common malignancy in adults and the most common malignancy in the kidney. It is thus a very common disease for radiologists. This review aims to provide a general overview of the imaging techniques used to diagnose, characterize, and help plan the treatment of renal cell carcinoma as well as to review basic aspects related to staging, imaging-guided percutaneous treatment, and follow-up in the most common clinical scenarios.
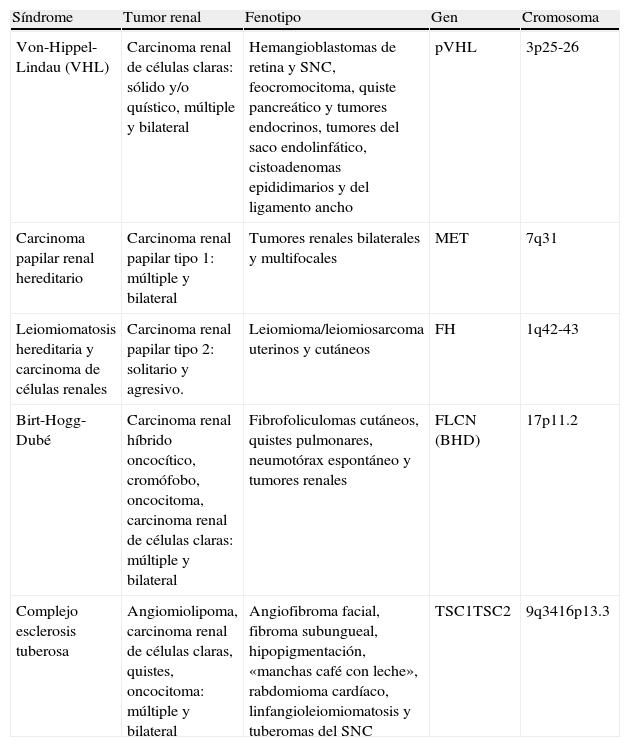
El carcinoma de células renales (CCR) es la octava neoplasia maligna más frecuente en el adulto1 y la neoplasia renal más frecuente, lo que representa, aproximadamente, el 90% de las neoplasias malignas renales2. Es una enfermedad heterogénea, con múltiples subtipos que tienen diferentes expresiones clínicas, anatomopatológicas y citogenéticas3, y distintas respuestas terapéuticas4. El carcinoma de células claras es el subtipo más frecuente (65-70%), seguido por los subtipos papilar (15-20%), cromófobo (6-11%) y otros subtipos (5%) como los síndromes de cáncer renal hereditario (tabla 1) y otros menores5,6. El cáncer renal hereditario más frecuente se asocia a la enfermedad de von-Hippel-Lindau (VHL), en la que el riesgo de aparición es de un 40-60% alrededor de la cuarta década de la vida, tanto en forma sólida como quística6.
Principales síndromes de cáncer renal hereditario
| Síndrome | Tumor renal | Fenotipo | Gen | Cromosoma |
| Von-Hippel-Lindau (VHL) | Carcinoma renal de células claras: sólido y/o quístico, múltiple y bilateral | Hemangioblastomas de retina y SNC, feocromocitoma, quiste pancreático y tumores endocrinos, tumores del saco endolinfático, cistoadenomas epididimarios y del ligamento ancho | pVHL | 3p25-26 |
| Carcinoma papilar renal hereditario | Carcinoma renal papilar tipo 1: múltiple y bilateral | Tumores renales bilaterales y multifocales | MET | 7q31 |
| Leiomiomatosis hereditaria y carcinoma de células renales | Carcinoma renal papilar tipo 2: solitario y agresivo. | Leiomioma/leiomiosarcoma uterinos y cutáneos | FH | 1q42-43 |
| Birt-Hogg-Dubé | Carcinoma renal híbrido oncocítico, cromófobo, oncocitoma, carcinoma renal de células claras: múltiple y bilateral | Fibrofoliculomas cutáneos, quistes pulmonares, neumotórax espontáneo y tumores renales | FLCN (BHD) | 17p11.2 |
| Complejo esclerosis tuberosa | Angiomiolipoma, carcinoma renal de células claras, quistes, oncocitoma: múltiple y bilateral | Angiofibroma facial, fibroma subungueal, hipopigmentación, «manchas café con leche», rabdomioma cardíaco, linfangioleiomiomatosis y tuberomas del SNC | TSC1TSC2 | 9q3416p13.3 |
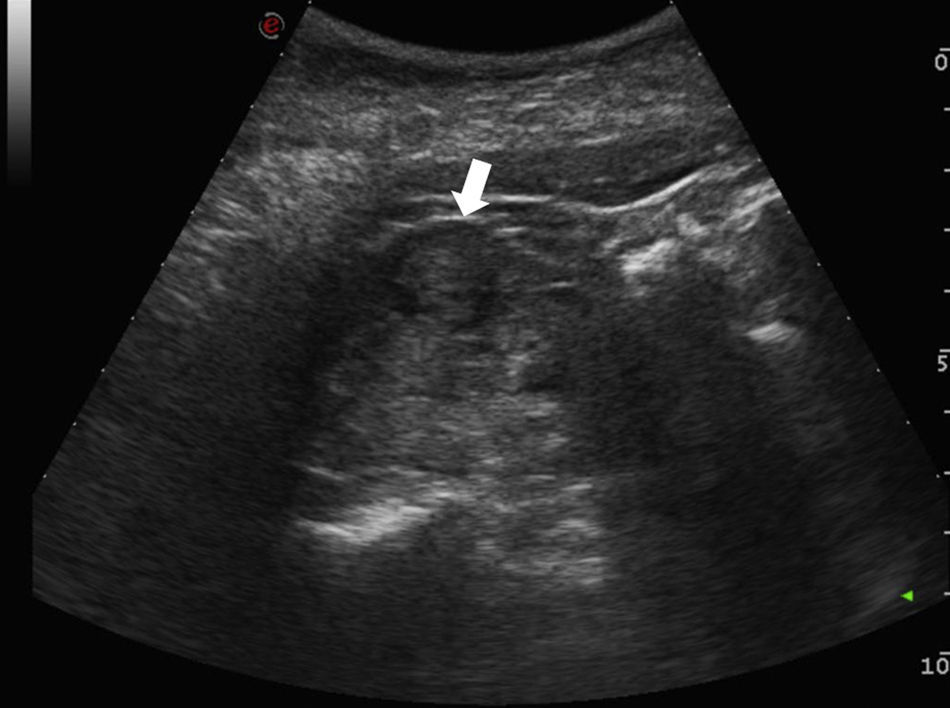
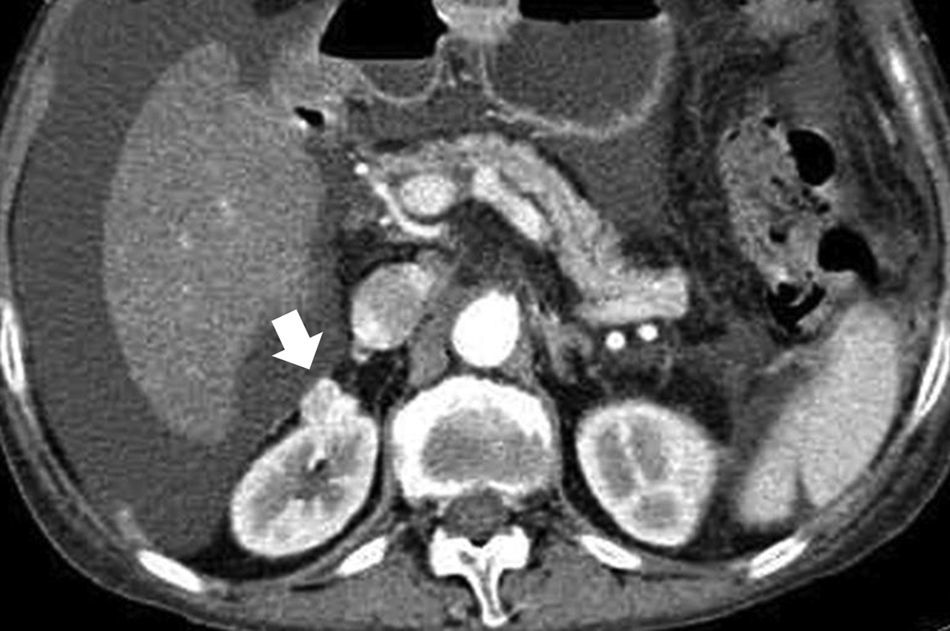
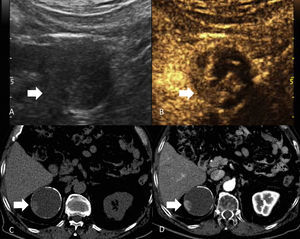
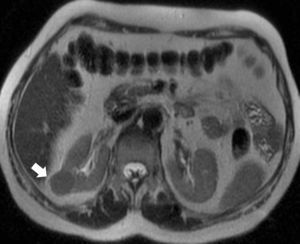
La incidencia del CCR está aumentando debido al uso generalizado de la ecografía abdominal y la tomografía computarizada7. Hoy en día lo más habitual es detectarlo incidentalmente (fig. 1). Cualquier lesión renal sólida en la ecografía, o lesión que realza en la tomografía computarizada (TC) o en la resonancia magnética (RM), tiene una alta probabilidad de ser maligna8–10, tanto más cuanto mayor es la lesión. Los nódulos inferiores a 1cm tienen una probabilidad de aproximadamente un 53,7%, y los nódulos mayores de 7cm de hasta un 93,7%11. Aun así, un 20-30% de los CCR se diagnostican en estadios avanzados12.
Nuestro objetivo es revisar las diferentes técnicas de imagen utilizadas para diagnosticar, caracterizar y planificar el tratamiento del CCR, así como hacer consideraciones básicas sobre la estadificación y seguimiento en los escenarios clínicos más habituales.
Técnicas de estudio radiológicoEl papel del radiólogo en el CCR es fundamental en cada fase del proceso. La TCMD, con su resolución espacial, y la RM, con su resolución tisular, son las técnicas radiológicas fundamentales para detectar y localizar el CCR, definir las características anatómicas de su entorno, estadificarlo, planificar el tratamiento y seguir su evolución13.
La TCMD suele ser la técnica de elección por su disponibilidad, y porque permite hacer estudios multifásicos rápidos con un alto grado de definición de las estructuras abdominales, con reconstrucciones multiplanares y en 3D, con muy pocos artefactos. La RM es más costosa, menos disponible y más susceptible a los artefactos. Sin embargo, tiene ventajas porque no necesita contraste yodado, no irradia, permite un estudio multifásico y multiplanar, detecta mejor la grasa intratumoral y la hemorragia intraquística, caracteriza mejor los quistes complejos, y es excelente para detectar y definir la extensión de la trombosis tumoral en las venas renales y la cava inferior14,15.
La sensibilidad de la ecografía para detectar nódulos corticales es menor que la de la TCMD y RM, especialmente cuando son pequeños. Es especialmente útil para establecer rápidamente la naturaleza sólida o quística del tumor sin irradiación, es accesible e independiente de la función renal. Con contraste ecográfico es muy sensible para detectar pequeñas zonas de captación y permite caracterizar lesiones quísticas complejas16.
La radiografía de tórax es suficiente para estadificar a pacientes de bajo riesgo (tumores menores de 3cm). La TCMD torácica se reserva para los de alto riesgo (tumores mayores de 3cm)17. El estudio cerebral (TCMD/RM) y la gammagrafía ósea se harán cuando la historia clínica o la exploración física lo aconsejen17.
La tomografía por emisión de positrones (PET)-18 FDG y la PET-18 FDG/TC no están recomendadas sistemáticamente, porque la eliminación del radiotrazador es renal18. Sin embargo, son útiles para detectar las metástasis19 y se están evaluando en ensayos clínicos para valorar la respuesta a tratamientos sistémicos. La radiografía simple de abdomen y la urografía intravenosa apenas tienen papel salvo por la posibilidad de detectar incidentalmente lesiones sospechosas. La angiografía diagnóstica tampoco forma parte del estudio habitual del CCR dado que la TCMD permite obtener mapas vasculares arteriales y venosos con un alto nivel de detalle.
El papel de la punción-aspiración o biopsia de las masas renales, ya sea mediante ecografía, TC y, en menor medida, RM, ha estado hasta ahora limitado por la precisión diagnóstica relativamente alta de la TC y la RM, el alto porcentaje de falsos negativos y sus complicaciones potenciales20,21. Estos factores acotaban sus indicaciones a pacientes con sospecha de metástasis renales, absceso o linfoma, pacientes con CCR que comenzaban con enfermedad metastásica, o en lesiones no resecables20. En los últimos años se ha replanteado su papel y se emplea más debido a que aproximadamente un 20% de las masas renales en estadio T1 son benignas, a la mejora progresiva de la seguridad y precisión de las técnicas de biopsia (con porcentajes de falsos positivos no superiores al 1% y de complicaciones sintomáticas inferiores al 2%), y al aumento de las opciones terapéuticas disponibles para tratar tumores en estadio T122,23. Aún así, el porcentaje de biopsias con resultados no concluyentes es de aproximadamente un 30%24. La diseminación tumoral por el trayecto de la aguja de biopsia es extremadamente infrecuente23.
Para evaluar una masa renal mediante TCMD y RM se necesita un protocolo de estudio específico13,25 de 4 fases:
- 1)
Fase basal. Antes de inyectar contraste intravenoso, útil para detectar calcificaciones, además de ser la base para comparar posteriormente el grado de realce de una lesión en unidades Hounsfield (UH).
- 2)
Fase corticomedular. Aproximadamente a los 35s después de inyectar contraste intravenoso. Proporciona el mejor detalle vascular, el grado de realce de la lesión y permite identificar metástasis hipervasculares.
- 3)
Fase nefrográfica. Aproximadamente entre 80-100s, óptima para detectar y caracterizar masas renales, especialmente las pequeñas13,26.
- 4)
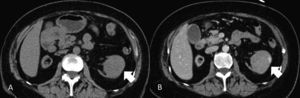
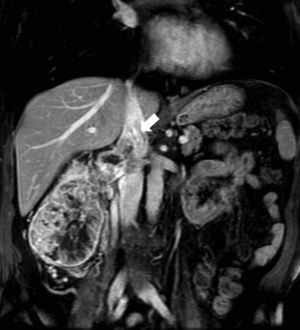
Fase excretora. A partir de los 3min. Permite definir la relación de la lesión con el sistema colector, lo que es especialmente útil para planificar una intervención quirúrgica conservadora (fig. 2).
Figura 2.A) TCMD en fase nefrográfica. Carcinoma de células renales de células claras confinado en la corteza renal izquierda (flecha) y tributario de nefrectomía parcial por laparoscopia. B) TCMD en fase excretora en el mismo paciente. Existe una doble vía excretora izquierda (flecha) que alerta al urólogo para así poder identificar y disecar los 2 uréteres antes de abrir la fascia de Gerota.
(0,1MB).
Se considera que una lesión renal capta en la TCMD cuando tras inyectar contraste intravenoso aumenta al menos 20UH respecto a la fase basal; valores entre 10 y 19UH se consideran indeterminados, y valores menores de 10UH indican que no hay captación27.
Con RM, el protocolo recomendado tiene al menos 5 secuencias13: coronal T2 single-shot turbo spin eco (SE) como localizador; axial T2 eco de gradiente (GE) y SE, distingue quistes renales simples de otro tipo de lesiones; axial T1 GE en fase y en fase opuesta (TE 4,6ms/2,3ms), muy útil para detectar grasa microscópica; axial T1 gradiente y con supresión grasa en estudio dinámico con adquisiciones en fase basal, corticomedular y nefrográfica tras inyectar 0,1mmol/kg de gadolinio intravenoso, con un esquema similar al de la TCMD; coronal T1 3D GE y supresión grasa tras la serie multifásica, para ver las venas renales y si hay trombos en la vena renal y la cava inferior13,28. Actualmente se añade el estudio de difusión con al menos 2 valores b (de 0 y 800s/mm2) para intentar diferenciar los subtipos del CCR28. No está establecida una forma universal de determinar el grado de realce de una lesión mediante RM en el estudio dinámico. Puede aplicarse un criterio cualitativo, técnicas de sustracción o cálculo de porcentajes de realce utilizando unidades de señal arbitrarias29.
Diagnóstico y caracterizaciónUna vez detectada una masa renal lo primero que debe establecerse es si corresponde a un seudotumor, ya sea por estructuras anatómica (columna de Bertin hipertrófica, giba cortical), un proceso inflamatorio (pielonefritis focal, absceso crónico), estructuras vasculares (aneurismas de arterias renales, fístula arteriovenosa) o una secuela postraumática27,30. Una vez excluido el seudotumor, debe establecerse si la masa es quística o sólida y en ambos casos intentar determinar si es benigna o maligna27,30.
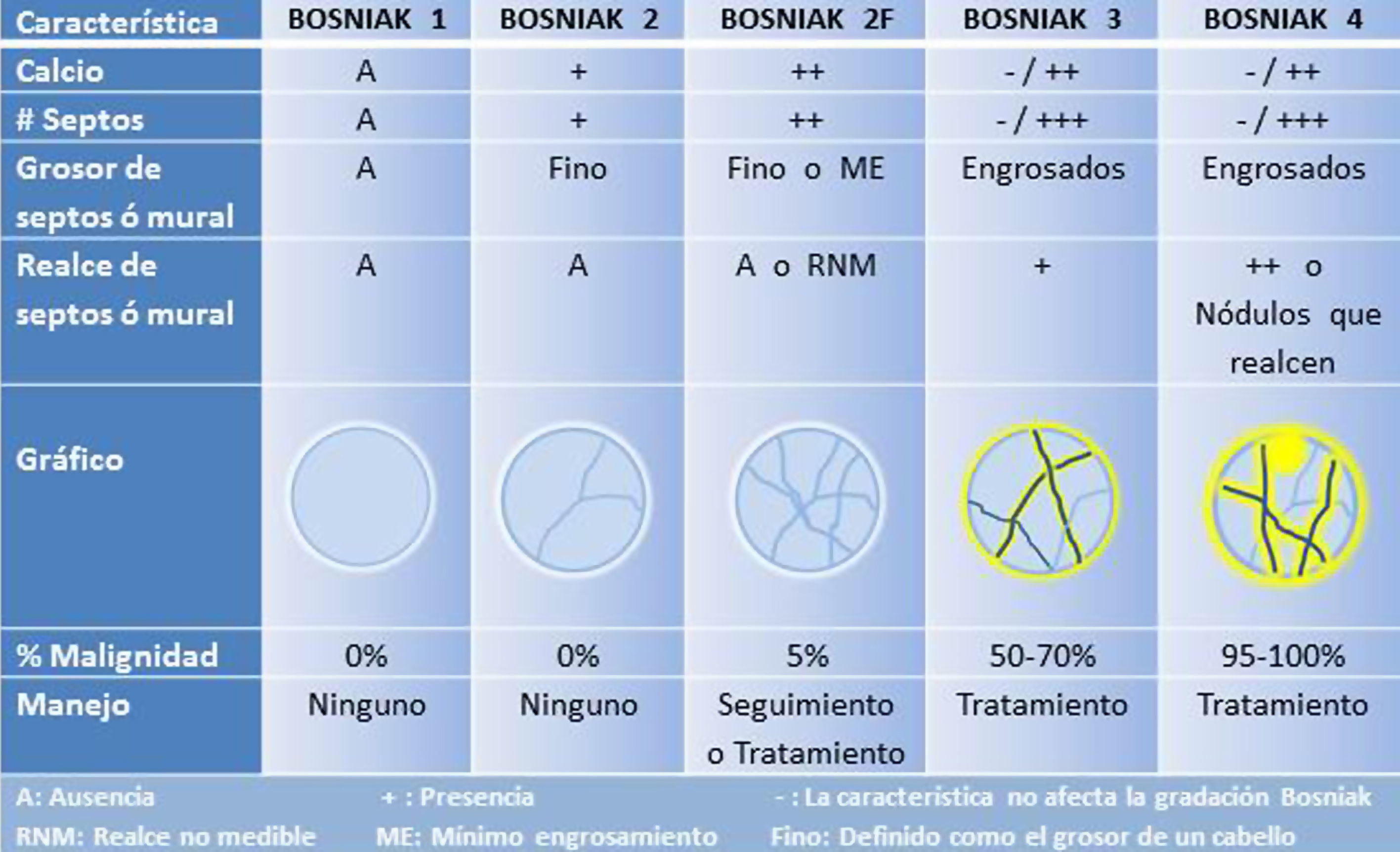
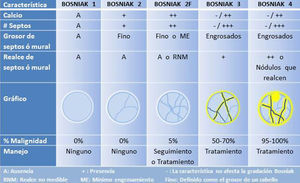
Aproximadamente un 15% de los CCR son quísticos y frecuentemente tienen unas características que se solapan con los quistes complejos benignos31. La clasificación más útil para evaluar las formas quísticas complejas sigue siendo la de Bosniak32,33, que relaciona la probabilidad de malignidad de una lesión con una serie de características como son los septos, el grosor de los septos y las paredes, calcificaciones, nódulos y realce septal/mural/nodular. Fue ideada originalmente para la TC pero es adaptable a la RM34 y a la ecografía con contraste16. Tiene 5 categorías, con una probabilidad creciente de corresponder a una lesión maligna32,33 (fig. 3):
- -
Bosniak 1. Corresponde al quiste simple, con mucho la masa renal más frecuente, con una probabilidad cero de ser maligna. De pared fina imperceptible, sin septos, de densidad agua homogénea (valores cercanos a 0 UH), sin calcio ni componente sólido, no realza tras contraste intravenoso. No requiere seguimiento.
- -
Bosniak 2. Puede contener unos pocos septos finos (menores de 1mm) que no realzan o que apenas lo hacen, de una forma no medible; puede haber calcio fino o mínimamente grueso, tanto en los septos como en la pared. Los nódulos hiperdensos homogéneos menores o iguales a 3cm, bien definidos y que no realzan quedan incluidos en esta categoría. Tiene una probabilidad cero de ser maligno.
- -
Bosniak 2F. La «F» indica la necesidad de seguirlos (follow-up), ya que tienen un 5% de probabilidad de ser malignos. Contiene múltiples septos finos sin o con mínimo realce, septos y pared mínimamente engrosados que pueden tener un realce discreto, calcio grueso/nodular sin realce y ausencia de nódulos. Los nódulos hiperdensos mayores de 3cm que no realzan y son completamente intrarrenales se incluyen en esta categoría. Los quistes Bosniak 2F se consideran benignos pero requieren seguimiento para confirmar que son estables.
- -
Bosniak 3. Se trata ya de una lesión indeterminada que tiene hasta un 50-70% de probabilidades de ser maligna y que, en general, requiere un tratamiento quirúrgico. Contiene septos/paredes engrosados (mayor de 1mm), irregulares y que realzan de forma medible.
- -
Bosniak 4. Tiene un 95-100% de probabilidades de ser maligno y, por tanto, requiere tratamiento. Tiene un componente nodular sólido que realza, independientemente del componente septal o mural (fig. 4).
La clasificación no incluye el tamaño de una lesión quística, ya que este no es un buen predictor de malignidad. No obstante, la gran mayoría de los quistes renales menores de 1cm son benignos32,33.
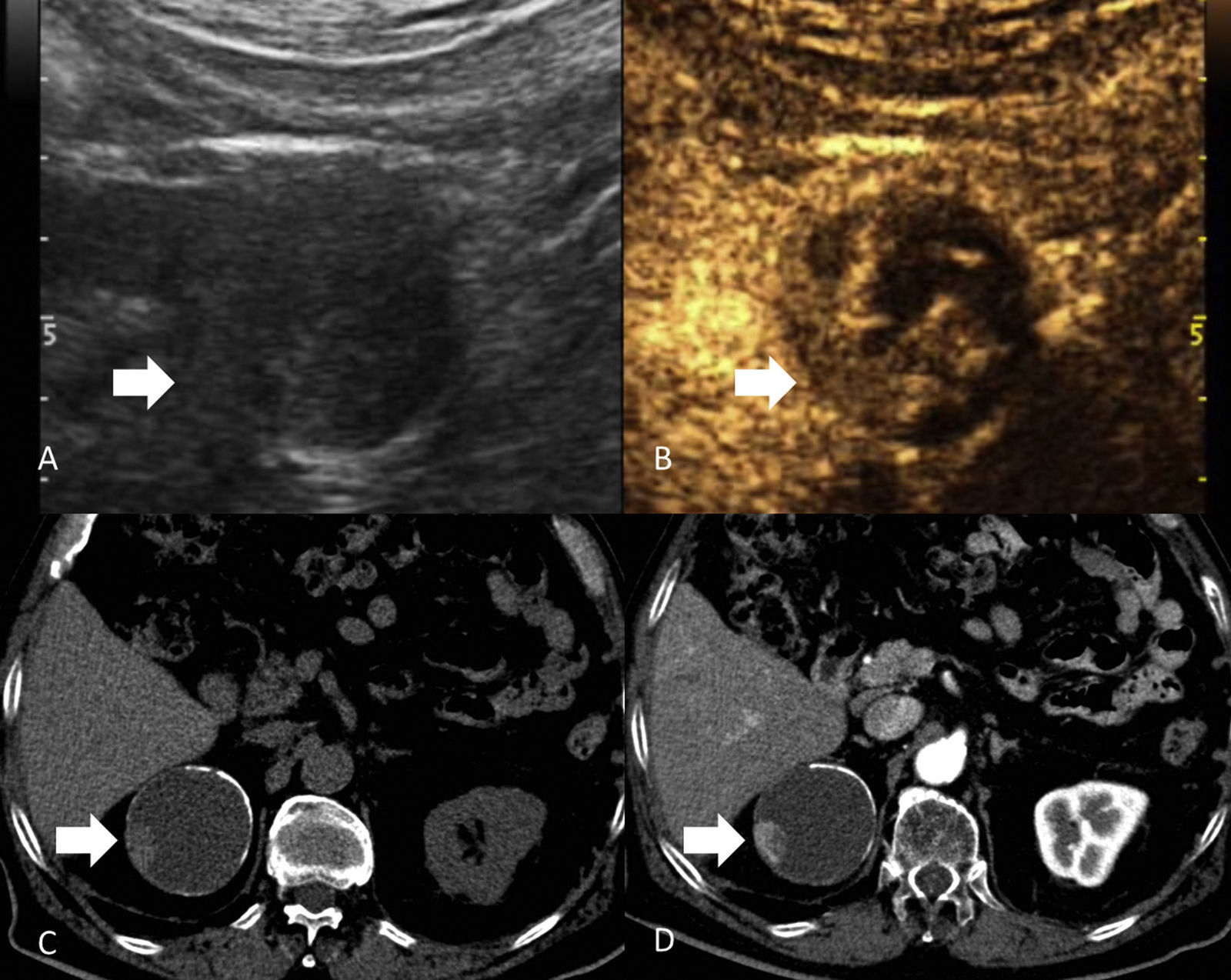
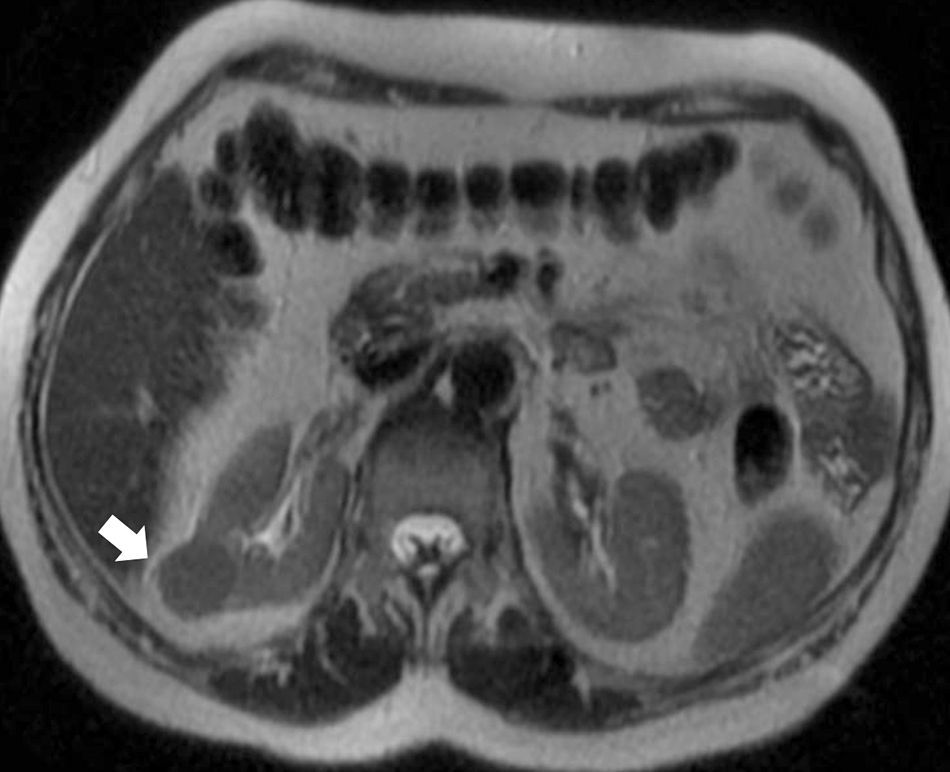
La mayoría de los tumores sólidos renales en el adulto son CCR, y la forma de presentación más frecuente del CCR es la de un nódulo sólido cortical que realza tras inyectar contraste y que posteriormente lava35 (fig. 5). No obstante, hasta un 20% de los nódulos renales que realzan son benignos y el tamaño per se no es un criterio útil para decidir el tratamiento35. La mayor parte de las lesiones benignas diagnosticadas en las piezas quirúrgicas inicialmente valoradas como CCR son angiomiolipomas con muy poca grasa y oncocitomas36. Al detectar un nódulo sólido renal lo primero es determinar si la lesión contiene grasa y así descartar un angiomiolipoma35–37. Si no se detecta grasa con TCMD o RM (la ecografía no es sensible) lo más probable es que se trate de un CCR (células claras, papilar, cromófobo), una lesión benigna como el angiomiolipoma con muy poca grasa (5% de los angiomiolipomas) (fig. 6) o un oncocitoma30. Las lesiones sólidas benignas o malignas y sin grasa macroscópica (agotadas las técnicas radiológicas para el diagnóstico del angiomiolipoma) son indiferenciables14.
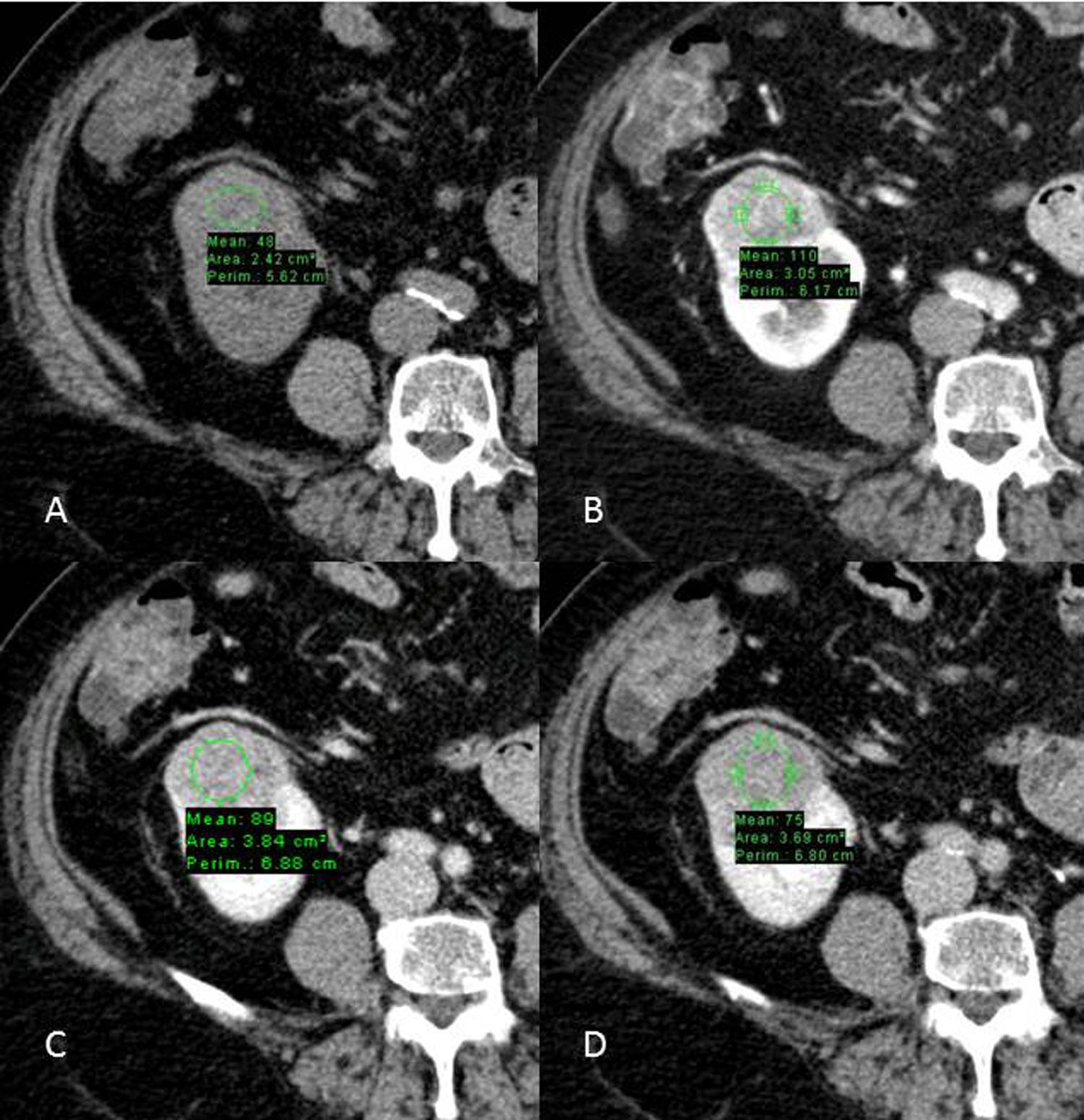
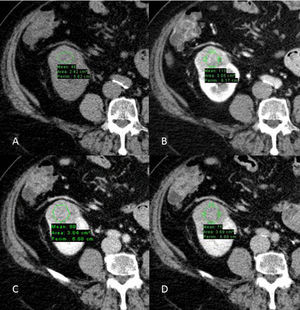
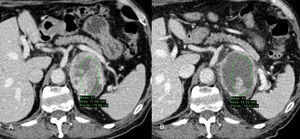
Carcinoma de células renales de células claras en estudio multifásico TCMD. A) Fase basal: nódulo sólido cortical renal derecho con unos valores de 48UH; B) fase corticomedular: el nódulo realza y alcanza unos valores máximos de hasta 110UH; C) fase nefrográfica: los valores UH descienden hasta 89; D) fase excretora: los valores UH descienden hasta 75.
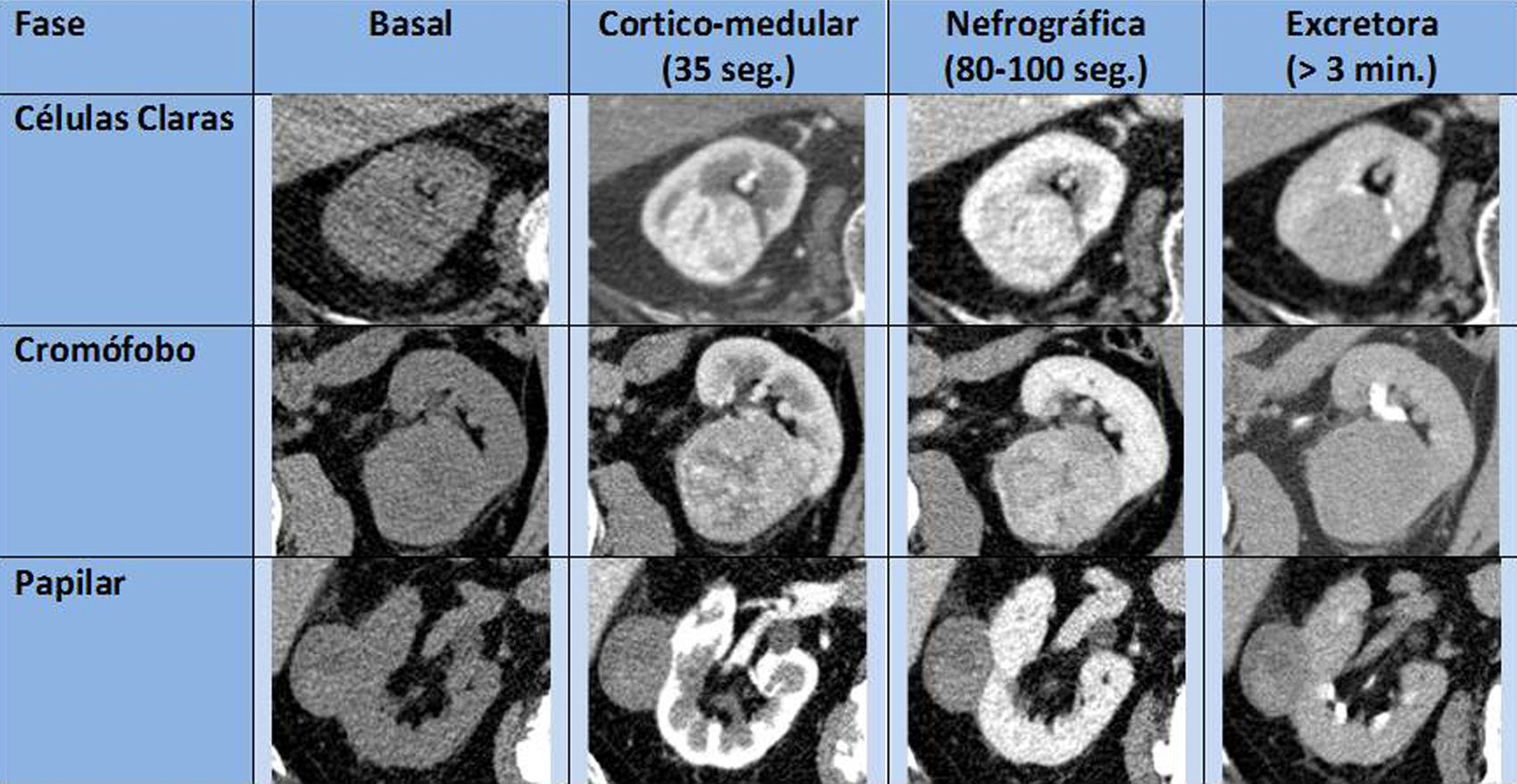
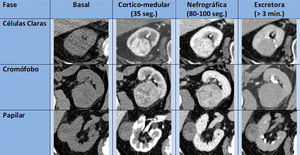
Igualmente, en cuanto a los diferentes subtipos de CCR, y si bien existen unas características morfológicas, de realce por TCMD y de señal RM, que pueden señalar a alguno de ellos, puede ser muy difícil determinarlos a priori (fig. 7). No obstante, pueden definirse una serie de características orientativas de algunos subtipos:
- -
El CCR de células claras típicamente muestra un marcado realce en fase corticomedular tanto en la TCMD como en la RM, probablemente debido a la inactivación del gen supresor VHL con la consiguiente producción de factores de crecimiento vascular5,38. Puede contener cambios quísticos en aproximadamente un 15% de los casos y calcificaciones en un 10-15%. Su señal T1 suele ser hipo-isointensa, y en T2 es habitualmente hiperintenso. Puede contener focos microscópicos lipídicos que hacen caer la señal en la fase opuesta GE T1. La multicentricidad y bilateralidad es poco frecuente (menor del 5%), mayoritariamente en los casos esporádicos.
- -
El CCR papilar típicamente es hipovascular y homogéneo, con un grado de realce corticomedular notablemente menor que el de células claras. Si el tumor es grande también puede mostrar degeneración quística, necrosis, calcificaciones, cambios hemorrágicos y, excepcionalmente, grasa macroscópica por macrófagos cargados de colesterol39. Normalmente tiene una señal T2 hipointensa. La presentación bilateral y multifocal es más frecuente que en el resto de los subtipos, especialmente en las formas hereditarias40.
- -
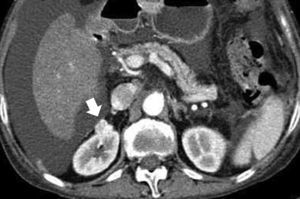
El CCR cromófobo suele tener un realce homogéneo de intensidad moderada, y puede presentar una cicatriz central, hallazgo clásicamente asociado al oncocitoma, aunque no es de extrañar dado que ambos tumores comparten características ontogénicas. Su señal T2 puede ser hipointensa, al igual que el papilar y los angiomiolipomas pobres en grasa29,40 (fig. 8).
- -
Otras formas menos frecuentes son el CCR quístico multilocular, de componente quístico con múltiples septos de tamaño variable que pueden calcificar; el carcinoma renal de túbulos colectores, cuando es pequeño tiene el epicentro en la medular renal, si bien al crecer suele ser indistinguible del resto aunque tiene una tendencia a desarrollar patrones infiltrativos5,41. El carcinoma medular renal, casi exclusivo de la anemia falciforme, se manifiesta como una lesión infiltrativa heterogénea medular renal, típicamente asociado a caliectasia y con rápida tendencia a las metástasis linfohematógenas. El carcinoma renal tubular mucinoso y de células fusiformes (fig. 9) ha sido incluido recientemente como subtipo de CCR y no presenta una característica radiológica específica diferencial42.
Existen además otras formas no habituales de presentación del CCR como la metástasis adrenal ipsilateral a partir de un pequeño nódulo cortical, un nódulo cortical asociado a una masa abdominal por linfoma, una adenopatía metastásica paraaórtica sin nódulo renal reconocible, un riñón no funcionante por infiltración difusa por tumor que ocluye la vena renal y una fístula arteriovenosa originada por el CCR43.
Una vez diagnosticado un CCR, es fundamental estadificarlo adecuadamente ya que el estadio es el factor individual más determinante en el pronóstico del paciente.
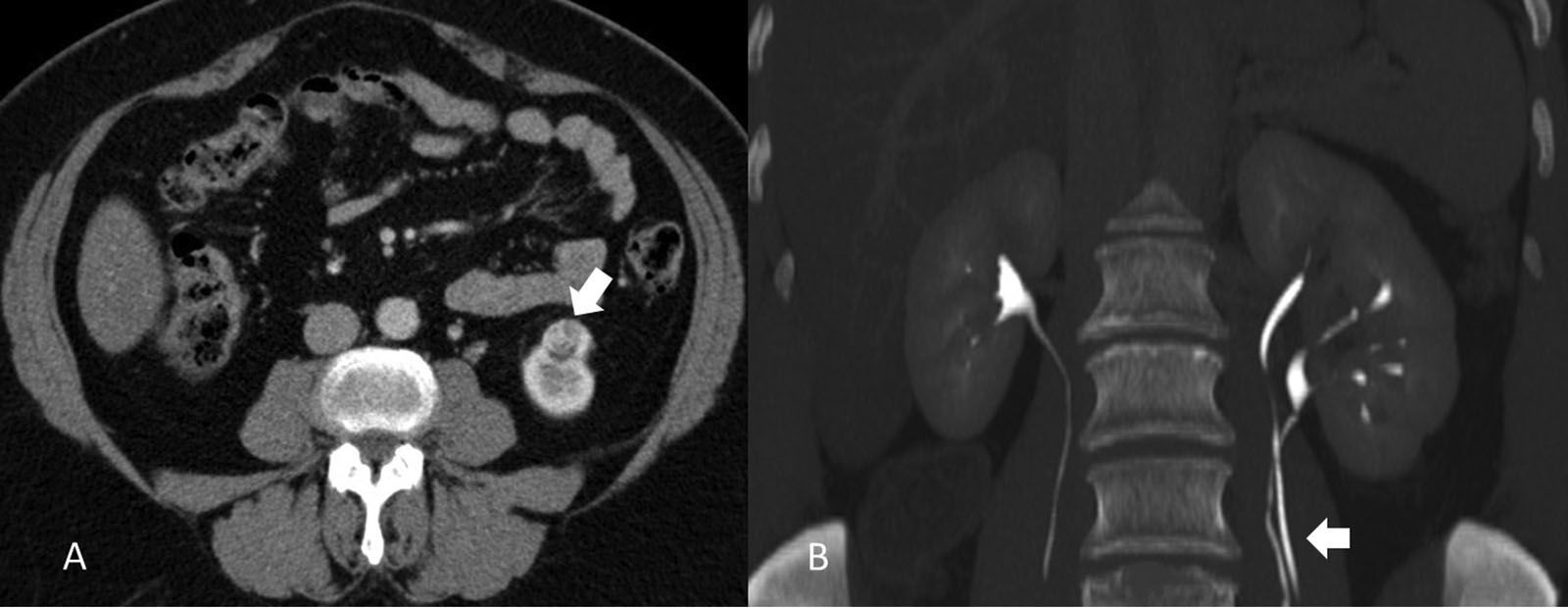
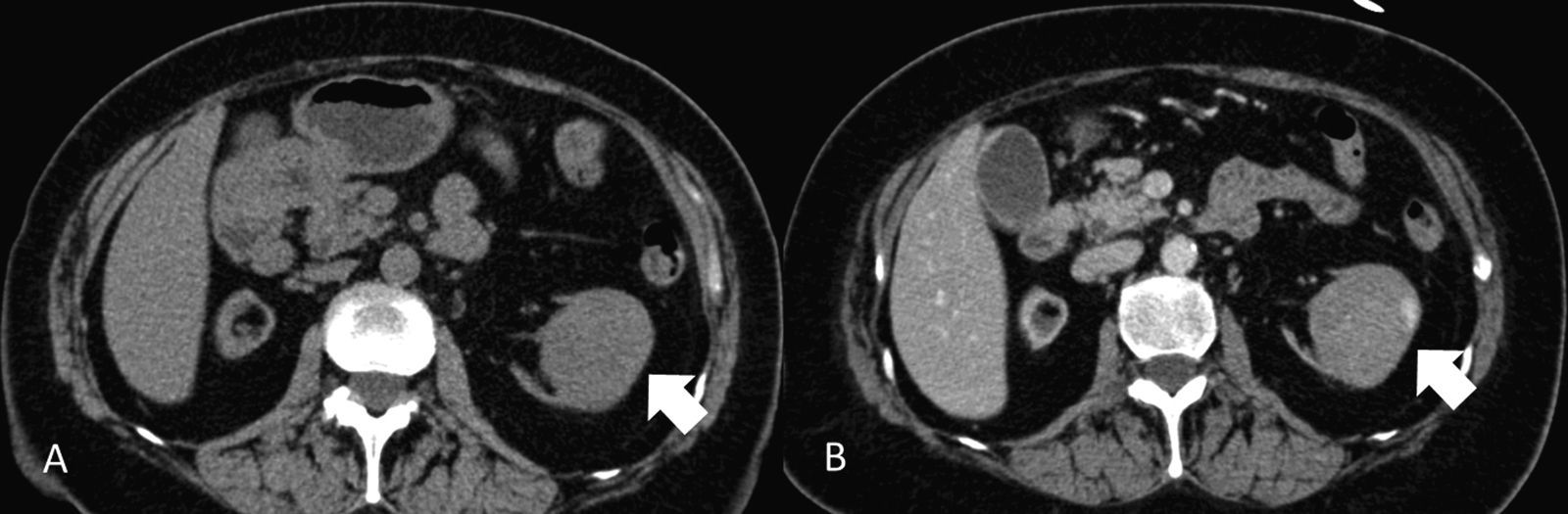
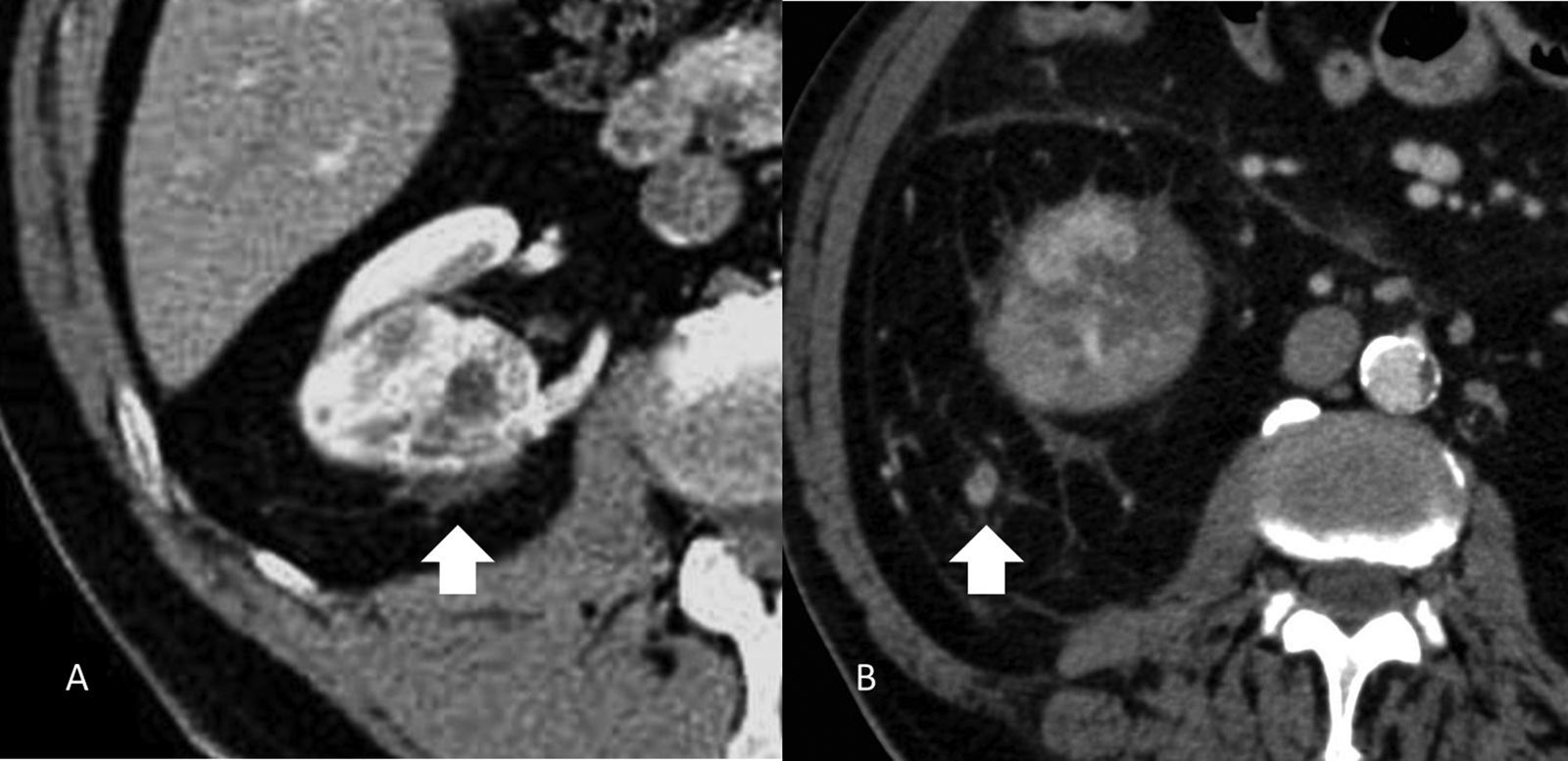
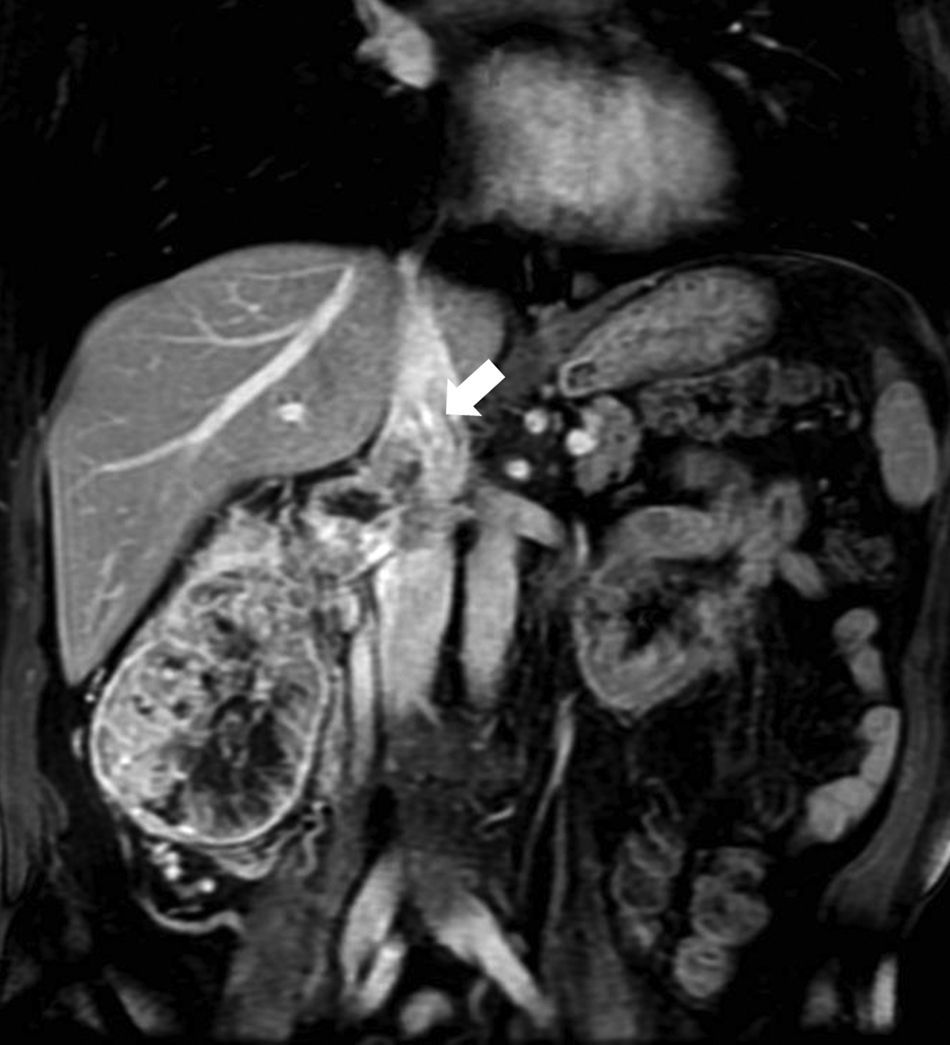
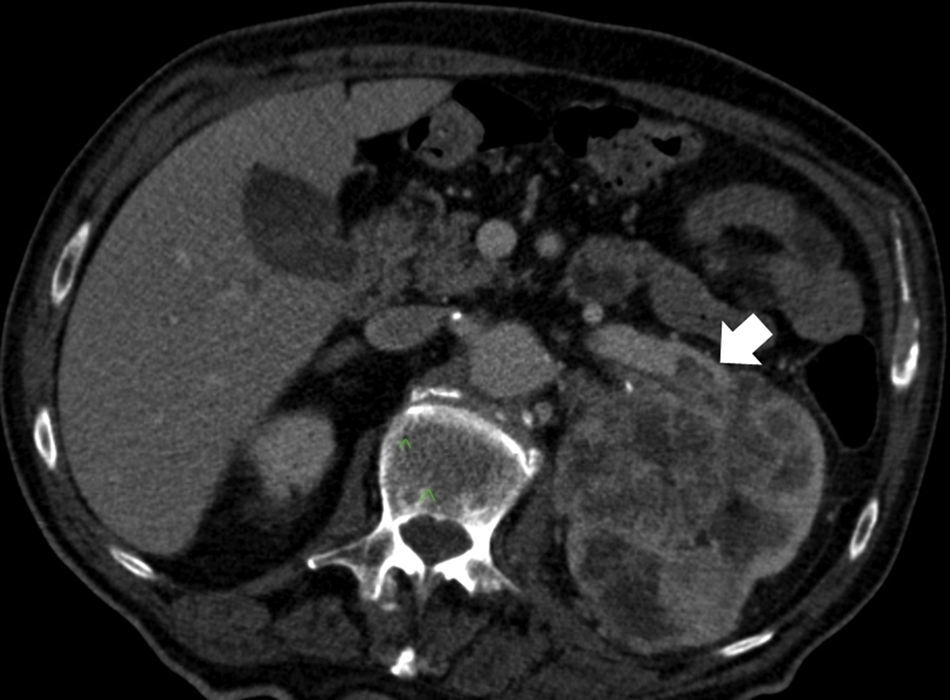
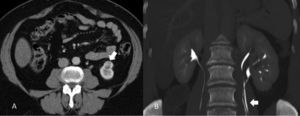
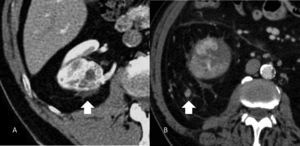
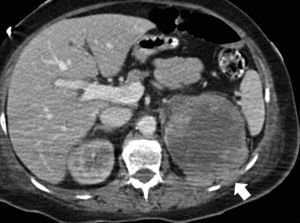
EstadificaciónEl sistema recomendado es el TNM de 2010 (UICC/AJCC)44 (tabla 2), que es el más utilizado. Proporciona un lenguaje común entre especialistas para definir la situación individual de cada paciente en términos de estadificación, y establecer el tratamiento a seguir y su pronóstico. Pueden considerarse 3 escenarios principales: a) Enfermedad localizable tratable quirúrgicamente (T1-T2). El tumor está confinado dentro la cápsula renal, con un diámetro de hasta 4cm (T1a), 4-7cm (T1b), 7-10cm (T2a), o mayor de 10cm (T2b). Dado que en los tumores T1 están indicadas tanto la nefrectomía parcial como las técnicas de tratamiento percutáneo45,46, y también en los tumores T2, si cumplen ciertas condiciones (riñón único, insuficiencia renal previa), es importante definir una serie de parámetros nefrométricos que ayuden a identificar los tumores que necesitarán unos tiempos de isquemia templada prolongados. Estos parámetros son la escala de nefrometría R.E.N.A.L., escala Padua o el índice C47–49. Cada una de ellas utiliza parámetros morfológicos relativamente similares como son la localización polar, localización anterior o posterior, radio tumoral, componente exo/endofítico y relación del tumor con el seno renal y sistema colector. b) Enfermedad localmente invasiva (T3-4 N1). Una de las mayores limitaciones en la estadificación del CCR radica en la dificultad de identificar correctamente la enfermedad T3a por la invasión de la grasa perirrenal y el seno renal. La trabeculación de la grasa perirrenal no es exclusiva de la infiltración tumoral ya que cambios inflamatorios, ingurgitación vascular o edema pueden verse de forma muy similar (fig. 10). No obstante, no está demostrado que este hallazgo modifique la estrategia quirúrgica18. La extensión vascular del tumor (T3b-c) es un predictor de morbilidad perioperatoria y de mortalidad. Si bien la RM se ha considerado la técnica de elección para detectar el trombo venoso tumoral/no tumoral y su extensión, la TCMD ha demostrado ser una técnica igualmente efectiva50. Debe definirse si la extensión del trombo alcanza la vena cava inferior por debajo del diafragma (T3b) (fig. 11), o si sobrepasa el diafragma (T3c). También debe definirse la relación del trombo con la vena renal (fig. 12), venas suprahepáticas y diafragma, ya que de ello dependerá el abordaje quirúrgico. La extensión a estructuras adyacentes más allá de la fascia perirrenal o a la glándula suprarrenal ipsilateral (T4) confiere peor pronóstico. Factores predisponentes de afectación suprarrenal ipsilateral son: tamaño tumoral mayor de 5,5cm, categoría T3 o superior, tumor en el polo renal superior y enfermedad metastásica linfática o a distancia51. Si en la TC la glándula suprarrenal es normal, no se extirpa en ningún caso. Una de las dificultades para establecer qué pacientes deben ser intervenidos quirúrgicamente radica en la tendencia de la TC y RM a sobreestimar la extensión tumoral más allá de la fascia de Gerota. Hay estudios que atribuyen a la TCMD una precisión diagnóstica de un 95%52,53. La pérdida de planos o la irregularidad entre el tumor y estructuras vecinas no siempre implican infiltración tumoral por contigüidad. La diseminación perirrenal será sospechada cuando la grasa perirrenal se vea trabeculada, si hay nódulos sólidos perirrenales, engrosamiento de la fascia de Gerota o cambios en la densidad/señal de las estructuras vecinas (fig. 13).
Clasificación TNM del carcinoma renal (7.a edición, 2010)
| Categoría | Característica |
| Tumor (T) | |
| T0 | Sin evidencia de tumor primario |
| T1 | Tumor≤7cm en diámetro máximo, limitado al riñón |
| T1a | Tumor≤4cm en diámetro máximo, limitado al riñón |
| T1b | Tumor>4cm pero≤7cm en diámetro máximo, limitado al riñón |
| T2 | Tumor>7cm en diámetro máximo, limitado al riñón |
| T2a | Tumor>7cm pero≤10cm en diámetro máximo, limitado al riñón |
| T2b | Tumor>10cm en diámetro máximo, limitado al riñón |
| T3 | Tumor que se extiende a las venas renales principales o tejidos perirrenales pero no a la glándula suprarrenal ipsilateral y no atraviesa la fascia de Gerota |
| T3a | Tumor que se extiende a las venas renales principales o invade la grasa perirrenal o hiliar, pero sin atravesar la fascia de Gerota |
| T3b | Tumor que se extiende a la vena cava inferior por debajo del diafragma |
| T3c | Tumor que se extiende a la vena cava inferior por encima del diafragma o invade su pared |
| T4 | Tumor que atraviesa la fascia de Gerota incluyendo la glándula suprarrenal ipsilateral |
| Tx | Tumor primario no evaluable |
| Nódulo linfático (N) | |
| N0 | No se demuestran metástasis ganglionares regionales |
| N1 | Metástasis en ganglio(s) linfático(s) regional(es) |
| Nx | No se pueden evaluar los ganglios linfáticos regionales |
| Metástasis (M) | |
| M0 | No hay metástasis a distancia |
| M1 | Metástasis a distancia |
| Mx | No se pueden evaluar las metástasis a distancia |
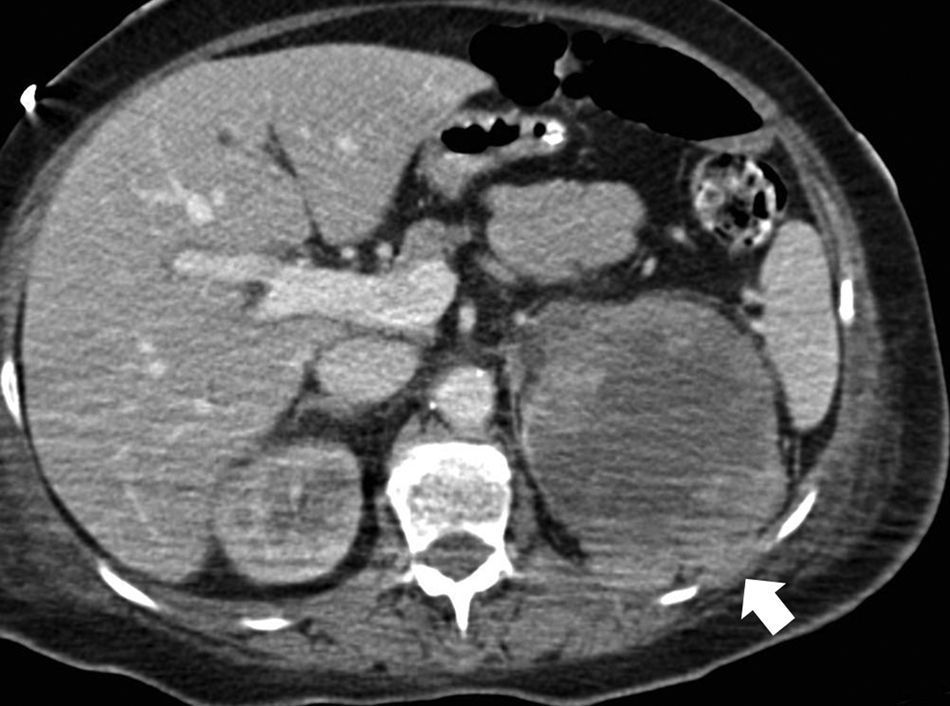
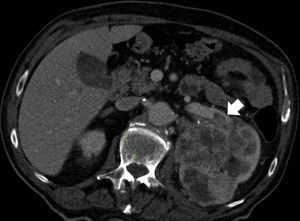
Estadificación T3. A) Falso T3: el plano graso perirrenal posterior a un nódulo (carcinoma de células renales) presenta septos con líquido que sugieren infiltración (flecha). Se determinó prequirúrgicamente que correspondía a un T3 pero el estudio patológico no demostró infiltración tumoral perirrenal. B) Nódulo sólido tumoral (flecha) en la grasa perirrenal derecha confirmando un T3.
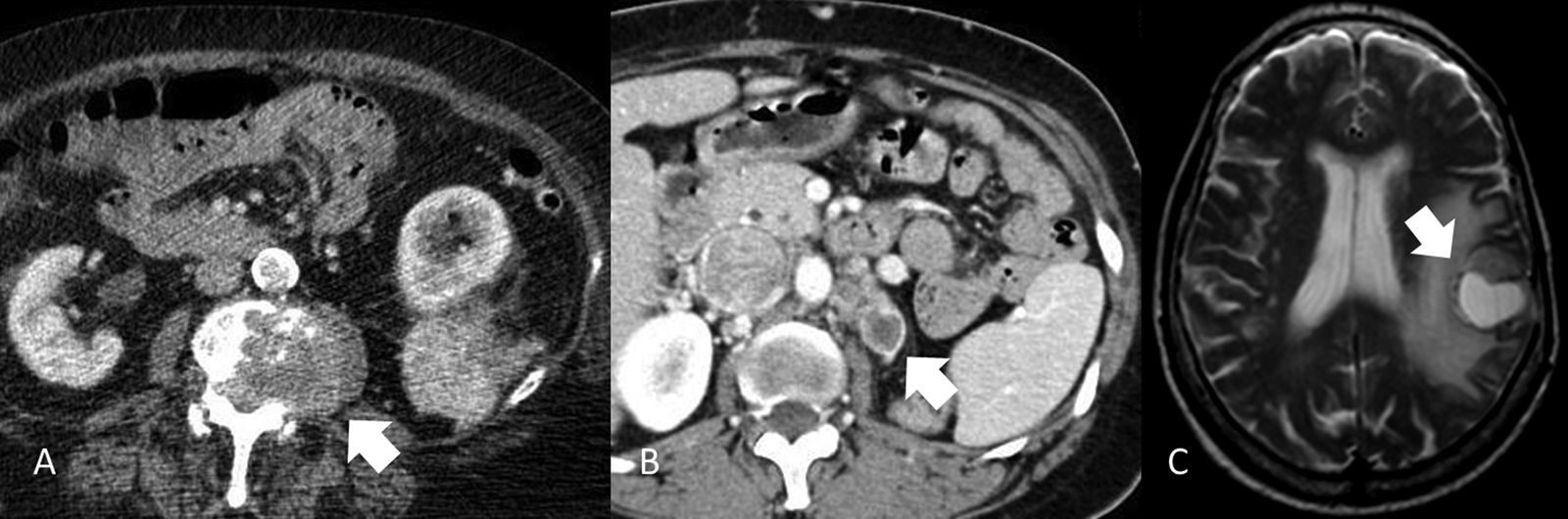
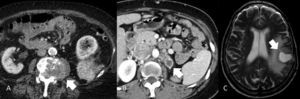
Determinar la afectación ganglionar metastásica tiene las mismas limitaciones que con otros tumores. Utilizar como valor de corte 1cm en el eje corto del ganglio tiene una precisión diagnóstica aproximada del 83%54,55, ya que no es infrecuente que ganglios menores contengan focos metastásicos y ganglios mayores tengan una naturaleza inflamatoria reactiva. Los ganglios regionales deben buscarse en el hilio renal y en torno a la cava (paracaval, precaval, retrocaval), interaortocava y aorta (paraaórticos, preaórticos, retroaórticos). c) Enfermedad metastásica. Si bien el CCR puede metastatizar en cualquier órgano, los más comúnmente afectados son el pulmón (50-60%), hueso (30-40%), hígado (30-40%), suprarrenal, riñón contralateral, retroperitoneo y cerebro (cada uno un 5%) (fig. 14). En el 85% de los casos se manifestarán en los 3 primeros años tras la resección12,56.
Metástasis de carcinoma de células renales. A) Metástasis ósea vertebral con extensión al canal (flecha). B) Metástasis suprarrenal izquierda (flecha), existe también trombosis tumoral en la vena cava inferior. C) Metástasis cerebral. RM (T2 FSE). Masa intraaxial sólido-quística (flecha) con edema asociado.
En los últimos años se ha producido un cambio de paradigma en el tratamiento del CCR. Las terapias de preservación de nefronas (nephron sparing therapies) han aumentado notablemente, ya que se ha constatado que las cifras de supervivencia a los 5 años de los pacientes tratados con nefrectomía parcial son muy similares a las de la nefrectomía radical57,58. En consecuencia, se han desarrollado terapias mínimamente invasivas, como las técnicas de termoablación renal, con el objetivo de preservar al máximo la función renal, reducir las complicaciones, el dolor, el tiempo del procedimiento y la duración de la estancia hospitalaria. Inicialmente fueron técnicas laparoscópicas pero actualmente, y en un notable porcentaje de casos, se realizan por vía percutánea, guiadas por ecografía, TC o RM. Las 2 técnicas ablativas más aceptadas y disponibles actualmente son la ablación por radiofrecuencia y la crioablación. Hay controversia respecto a cuál de ellas es superior. Ambas muestran resultados prometedores aunque será necesario disponer de los resultados de estudios a largo plazo para compararlas con las técnicas quirúrgicas59,60. Otras técnicas como los ultrasonidos de alta intensidad, la ablación por microondas y la electroporación están iniciando su desarrollo.
El objetivo de la radiofrecuencia y la crioablación es el mismo. Ambas lesionan letalmente las células tumorales sin dejar tejido tumoral viable, ocasionando el menor daño posible sobre las estructuras sanas adyacentes. Igualmente, necesitan una adecuada planificación radiológica del procedimiento, localizar y definir la lesión, colocar la aguja de tratamiento, monitorizar la ablación y determinar el momento de acabar61,62. La ablación por radiofrecuencia produce una necrosis coagulativa aplicando una corriente alternante que hace que el electrodo genere calor. La crioablación crea cristales de hielo intra/extracelulares aplicando temperaturas muy bajas (-19 a -40°C) que producen deshidratación y rotura celular. La crioablación permite tratar lesiones próximas a la vía urinaria porque el riesgo de generar fibrosis ureteral es menor que con la radiofrecuencia, aunque el riesgo de sangrado es mayor porque no cauteriza los vasos61.
Para obtener resultados curativos no debe haber enfermedad más allá de la fascia de Gerota ni adenopatías (T1-T3a). Los mejores predictores de necrosis completa tras una única sesión de radiofrecuencia o crioablación son un tamaño tumoral menor o igual a 3cm y una localización no central46.
Aunque existen unas indicaciones establecidas, la rápida mejora de la efectividad y seguridad de estas técnicas las convierten en la primera opción de tratamiento en los tumores T1a, siempre que sean accesibles. Están también indicadas en pacientes con riesgo de deterioro de la función renal (riñón funcionante único, antecedente de nefrectomía parcial o total, tumor en injerto renal), comorbilidad con alto riesgo quirúrgico, tumores renales múltiples y en pacientes con alto riesgo de desarrollar nuevos tumores renales como en las formas familiares. También están indicadas como medida paliativa para mantener la función renal en pacientes con CCR metastásico, tumores con hematuria que precise transfusiones mantenidas y en aquellos pacientes que voluntariamente prefieran esta opción antes que la quirúrgica46.
Las contraindicaciones absolutas a las técnicas de ablación son la coagulopatía no corregible y la inestabilidad aguda como en la sepsis45,46.
SeguimientoEl seguimiento radiológico es fundamental en el manejo del CCR y tiene como objetivo detectar la recurrencia local y las metástasis, y monitorizar la respuesta a la terapia sistémica. No obstante, no se puede considerar el uso de un único protocolo de seguimiento, ya que existen situaciones clínicas diferentes para las que hay estrategias de estudio distintas; de hecho, no hay todavía un consenso en los tiempo ni frecuencias de los estudios de seguimiento en un mismo escenario12. Existen, sin embargo, consideraciones que son generalmente aceptadas: a) la TCMD de abdomen y tórax es la modalidad más utilizada; b) la RM puede ser una alternativa razonable a la TCMD de abdomen; c) en cualquiera de las 2 modalidades es necesario usar contraste intravenoso para estudiar el abdomen; y d) el seguimiento debe ser más intensivo durante los primeros 3 años, ya que es el período más probable en que aparezcan la recidiva local y las metástasis, especialmente en pacientes en estadios más avanzados, y en los subtipos más agresivos como las formas sarcomatoide, medular y carcinoma de los túbulos colectores12. La guía de la European Association of Urology propone este algoritmo de seguimiento45 (tabla 3). Pueden definirse 5 escenarios principales de seguimiento: a) Después de la nefrectomía. El tipo de seguimiento dependerá fundamentalmente de si la resección ha sido completa o parcial. Una resección completa en un T1N0M0 tiene un riesgo de recidiva muy bajo y hay grupos que no recomiendan seguirlos. Incluso una nefrectomía parcial con márgenes microscópicos positivos en tumores localizados no implica un riesgo de recidiva local ni de metástasis alto63, por lo que no es necesario un seguimiento radiológico intensivo siempre que los datos clínicos y analíticos no alerten. No está establecido el seguimiento óseo ni cerebral de forma rutinaria, y, probablemente por ello, la enfermedad metastásica en estas localizaciones comienza con síntomas64. b) Después del tratamiento ablativo. El seguimiento aquí parte de una premisa fundamental que lo diferencia de la nefrectomía, y es que no existe información de cuál es el estado de los márgenes de la lesión una vez finalizado el procedimiento. La negatividad de los márgenes se asume a partir de los factores técnicos de la intervención y, por tanto, es muy difícil estratificar el riesgo del paciente. La probabilidad de que exista tumor viable en los márgenes de la lesión tratada es mayor que tras una nefrectomía parcial y, por tanto, se asumirá que es necesario vigilar de cerca65,66. Tienen que hacerse controles precoces, porque la mayoría de fracasos terapéuticos pueden ya reconocerse en los primeros 3 meses tras el procedimiento67. c) Después del tratamiento sistémico en el CCR con metástasis. La introducción de agentes inhibidores de la tirosin-cinasa y mTOR para tratar el CCR ha puesto en evidencia la necesidad de buscar mejores alternativas a los criterios de respuesta RECIST. Estos criterios no tienen en cuenta la disminución de la atenuación tumoral derivada del efecto antiangiogénico de los inhibidores (fig. 15), y consideran como respuesta objetiva la reducción del 30% en la suma de los diámetros mayores de las lesiones diana, cuando se ha comprobado que en los tratamientos antiangiogénicos del carcinoma renal metastásico raramente se consiguen reducciones de tamaño del 30%, incluso en pacientes con buena respuesta al tratamiento. Existen en la bibliografía varias propuestas para evaluar los cambios radiológicos precoces al tratamiento con antiangiogénicos68–71 (tabla 4). Un estudio retrospectivo comparativo entre reducción de tamaño, densidad tumoral y criterios de Choi, concluyó que el mejor predictor actual de respuesta precoz al tratamiento es una reducción igual o mayor a un 10% en la suma de los diámetros mayores de las lesiones diana72. En el protocolo de seguimiento del CCR con tratamiento antiangiogénico es aconsejable realizar una fase arterial además de la nefrográfica para detectar y monitorizar la respuesta de las metástasis hipervasculares73. d) Síndromes hereditarios y familiares. El problema en este grupo está en el riesgo que tienen de desarrollar tumores renales de forma recurrente a lo largo de toda su vida, que varía según el síndrome. Esto implica un seguimiento durante toda su vida en el que habrá que minimizar la exposición a la radiación utilizando preferentemente la RM. En la enfermedad de VHL no es posible aplicar los criterios de Bosniak porque cualquier quiste renal, por inocuo que parezca, tiene potencial maligno y debe ser seguido6,12. e) Vigilancia activa. Cada vez es más frecuente recomendar un seguimiento activo de pequeñas masas renales en pacientes de edad avanzada y pacientes con importante comorbilidad, aunque tampoco existe un consenso en el tipo y frecuencia de seguimiento12.
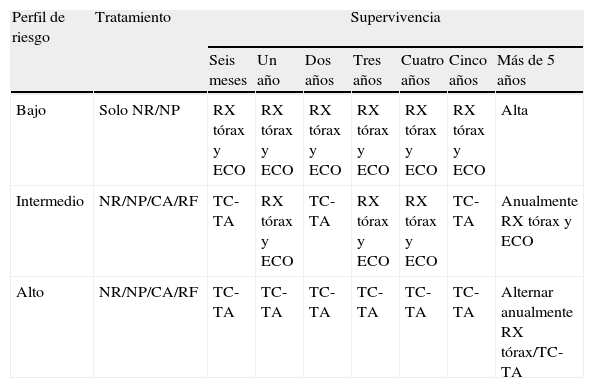
Algoritmo propuesto por la European Association of Urology para el seguimiento radiológico del carcinoma de células renales
| Perfil de riesgo | Tratamiento | Supervivencia | ||||||
| Seis meses | Un año | Dos años | Tres años | Cuatro años | Cinco años | Más de 5 años | ||
| Bajo | Solo NR/NP | RX tórax y ECO | RX tórax y ECO | RX tórax y ECO | RX tórax y ECO | RX tórax y ECO | RX tórax y ECO | Alta |
| Intermedio | NR/NP/CA/RF | TC-TA | RX tórax y ECO | TC-TA | RX tórax y ECO | RX tórax y ECO | TC-TA | Anualmente RX tórax y ECO |
| Alto | NR/NP/CA/RF | TC-TA | TC-TA | TC-TA | TC-TA | TC-TA | TC-TA | Alternar anualmente RX tórax/TC-TA |
CA: crioablación; CCR: carcinoma de células renales; ECO: ecografía renovesical; NP: nefrectomía parcial; NR: nefrectomía radical; RF: radiofrecuencia; RX tórax: radiografía de tórax; TC–TA: tomografía computarizada toracoabdominal.
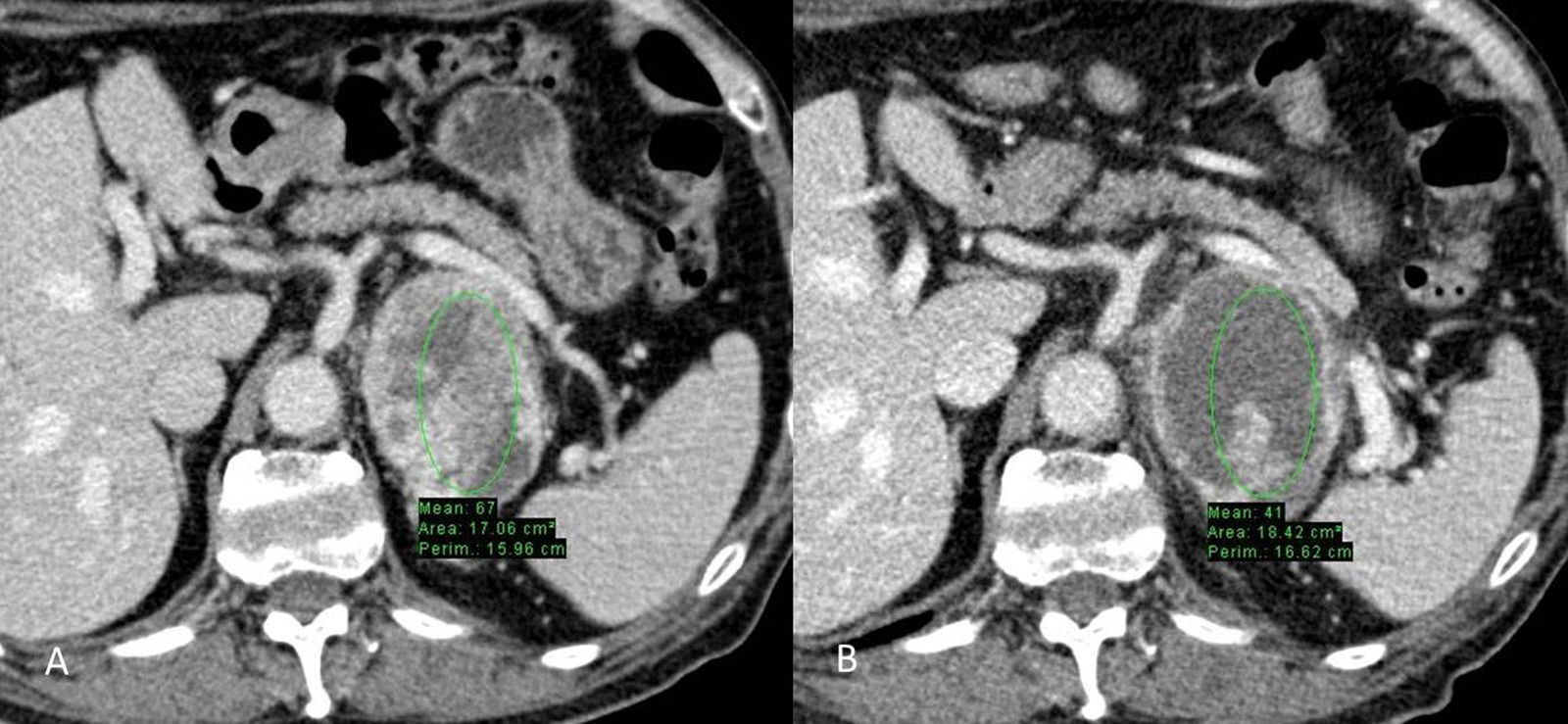
Carcinoma de células renales metastásico tratado con inhibidor de la tirosin-cinasa. A) Metástasis suprarrenal izquierda en estudio de base antes de iniciar tratamiento con sunitinib. El valor UH medio del ROI en la lesión es de 67. B) Tres meses después de iniciado el tratamiento el valor UH medio del ROI es de 41. Los diámetros de la masa no se han modificado.
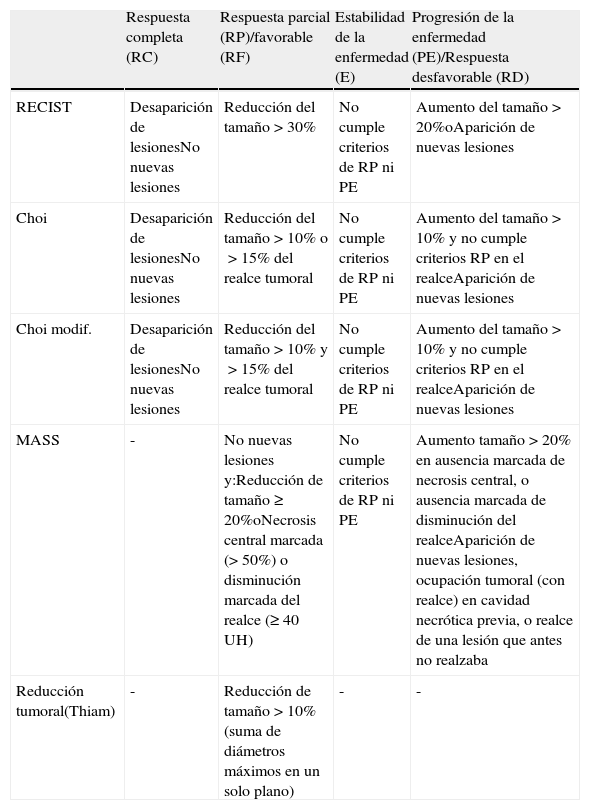
Criterios de evaluación de respuesta radiológica al tratamiento con antiangiogénicos
| Respuesta completa (RC) | Respuesta parcial (RP)/favorable (RF) | Estabilidad de la enfermedad (E) | Progresión de la enfermedad (PE)/Respuesta desfavorable (RD) | |
| RECIST | Desaparición de lesionesNo nuevas lesiones | Reducción del tamaño>30% | No cumple criterios de RP ni PE | Aumento del tamaño>20%oAparición de nuevas lesiones |
| Choi | Desaparición de lesionesNo nuevas lesiones | Reducción del tamaño>10% o>15% del realce tumoral | No cumple criterios de RP ni PE | Aumento del tamaño>10% y no cumple criterios RP en el realceAparición de nuevas lesiones |
| Choi modif. | Desaparición de lesionesNo nuevas lesiones | Reducción del tamaño>10% y>15% del realce tumoral | No cumple criterios de RP ni PE | Aumento del tamaño>10% y no cumple criterios RP en el realceAparición de nuevas lesiones |
| MASS | - | No nuevas lesiones y:Reducción de tamaño≥20%oNecrosis central marcada (>50%) o disminución marcada del realce (≥40UH) | No cumple criterios de RP ni PE | Aumento tamaño>20% en ausencia marcada de necrosis central, o ausencia marcada de disminución del realceAparición de nuevas lesiones, ocupación tumoral (con realce) en cavidad necrótica previa, o realce de una lesión que antes no realzaba |
| Reducción tumoral(Thiam) | - | Reducción de tamaño>10% (suma de diámetros máximos en un solo plano) | - | - |
MASS: Morphology, Attenuation, Size and Structure.
El CCR es la neoplasia renal más frecuente, con una incidencia cada vez mayor debido al uso generalizado de la ecografía abdominal y tomografía computarizada. La radiología tiene un papel fundamental para detectarlo y localizarlo, definir las relaciones anatómicas, caracterizarlo, estadificarlo, tratarlo y seguirlo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsables de la integridad del estudio: FB y MB.
- 2.
Concepción del estudio: FB y MB.
- 3.
Diseño del estudio: FB y MB.
- 4.
Obtención de los datos: FB y MB.
- 5.
Análisis e interpretación de los datos: FB y MB.
- 6.
Tratamiento estadístico: No aplicable.
- 7.
Búsqueda bibliográfica: FB y MB.
- 8.
Redacción del trabajo: FB y MB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MB.
- 10.
Aprobación de la versión final: FB y MB.
Los autores declaran no tener ningún conflicto de intereses.