Nuestro objetivo era contribuir al pequeño pero creciente conjunto de datos sobre la eficacia de la proloterapia con glucosa hiperosmolar intratendinosa en el tendón de Aquiles guiada por ecografía e introducir un paso previo nuevo de hidrodisección del paratendón con lidocaína en pacientes con tendinosis aquílea crónica resistente a la fisioterapia.
MétodosLlevamos a cabo un estudio observacional longitudinal en 27 pacientes consecutivos con diagnóstico de tendinosis aquílea en los que el tratamiento conservador, es decir, fisioterapia o terapia con ondas de choque, había sido ineficaz. A la anestesia e hidrodisección del paratendón con lidocaína al 2% le siguieron inyecciones intratendinosas guiadas por ecografía de glucosa al 25% cada 5 semanas. Se utilizó la escala visual analógica (EVA) para evaluar el dolor en reposo, en las actividades de la vida diaria y después de ejercicio moderado, al inicio y al final del tratamiento. Además, el grosor y la vascularización del tendón se registraron en la consulta de inicio y final del tratamiento. La eficacia se estimó a partir de la puntuación y de la reducción del dolor relativo utilizando un intervalo de confianza (IC) del 95%. Se aplicaron la prueba de Wilcoxon no paramétrica y un modelo lineal general para medidas repetidas. La significación estadística se estableció en p<0,05.
ResultadosSe necesitó una media de 5 (1-11) consultas para administrar inyecciones. Las puntuaciones del dolor disminuyeron significativamente en los 3 casos (p <0,001). Las reducciones relativas fueron de un 75% para el dolor en reposo (IC del 95 %, 61-93%), un 69% para el dolor con las actividades de la vida diaria (IC del 95 %) y un 70 % para el dolor después de ejercicio moderado (IC del 95%; 57-84%). La neovascularización del tendón se redujo significativamente (p <0,001). No observamos cambios significativos en el grosor del tendón (p=0,083).
ConclusionesEl tratamiento de la tendinosis aquílea con hidrodisección con lidocaína del paratendón y proloterapia posterior con solución glucosada hiperosmolar es seguro, eficaz, barato y prácticamente indoloro, manteniéndose los resultados a lo largo del tiempo.
Our aim was to add to the small but growing body of evidence on the effectiveness of ultrasound-guided Achilles intratendinous hyperosmolar dextrose prolotherapy and introduce a novel, preceding step of paratenon hydrodissection with lidocaine in patients with chronic Achilles tendinosis resistant to rehabilitation therapy.
MethodsWe conducted a longitudinal, observational study on 27 consecutive patients diagnosed with Achilles tendinosis, in whom conservative treatment, ie, physiotherapy or shock wave therapy, had failed. A 2% lidocaine paratenon anesthesia and hydrodissection was followed by ultrasound-guided, intratendinous injections of 25% glucose every 5 weeks. Visual analogue scales (VAS) were used for pain assessment at rest, for activities of daily living, and after moderate exercise at the begining and at the end of the treatment. Moreover, tendon thickness and vascularisation were recorded at baseline and final treatment consultation. Effectiveness was estimated from scoring and relative pain reduction using a 95% CI. The non-parametric Wilcoxon test and a general linear model for repeated measures were applied. Statistical significance was established as p<0.05.
ResultsA median of 5 (1-11) injection consultations per patient were required. Pain scores decreased significantly in all three conditions (p<0.001). Relative reductions were 75% in pain at rest (95% CI;61-93%), 69% in pain with daily living activities (95% CI; 55-83%), and 70% in pain after moderate exercise (95% CI; 57-84%). Tendon neo-vascularisation was significantly reduced (p<0.001). We did not observe significant changes in tendon thickness (p=0.083).
ConclusionsAchilles tendinosis treatment with paratenon lidocaine hydrodissection and subsequent prolotherapy with hyperosmolar glucose solution is safe, effective, inexpensive, and virtually painless with results maintained over time.
La tendinosis aquílea afecta tanto a la población sedentaria como a la que hace ejercicio. En los deportes en los que correr es un elemento fundamental este es un problema importante1. En la población sedentaria, la incidencia acumulada de tendinosis a lo largo de la vida es del 5,9%, subiendo hasta el 50% en los deportistas de élite2. Se estima que hasta el 29% de las tendinopatías aquíleas precisarán tratamiento quirúrgico y que hasta el 31% de esos pacientes ya no practicarán deporte3,4. El dolor en las tendinopatías ha sido objeto de debate. Los estudios más recientes apuntan a que la neovascularización y la neoinervación son, en última estancia, sus factores desencadenantes5–8. Existe una gran correlación entre las áreas con hiperemia intratendinosa, confirmada mediante ecografía Doppler, y las zonas de dolor máximo indicadas por los pacientes8. La tendinosis aquílea se puede clasificar según la región anatómica afectada, es decir, la tendinosis en la parte media (a 2-6cm de la inserción ósea) y la tendinosis insercional. La primera tiene una mayor prevalencia y supone el 66% de todas las lesiones9. Los pacientes con tendinosis aquílea refieren con frecuencia que han sufrido varias recaídas a lo largo de su vida, cada vez con mayor dolor y mayores dificultades para controlarlo. Precisamente este mecanismo de daño, consolidación y nuevo daño al reanudar la actividad física diaria favorece la lesión y, de este modo, contribuye a la degradación de la matriz extracelular y a los cambios en la composición del colágeno de la fibra tendinosa, lo que provoca una afectación biomecánica del tejido.
Si bien, en la actualidad, el ejercicio excéntrico es el tratamiento fisioterápico de primera línea de la tendinosis aquílea10, esta opción no basta en un número de casos nada despreciable. Recientemente, ha surgido una variedad de tratamientos percutáneos y extracorpóreos, como la terapia con ondas de choque, el tratamiento de infiltración con factores de crecimiento plaquetario o células madre y la proloterapia tendinosa del tendón de Aquiles con solución glucosada hiperosmolar. Esta última se ha validado11,12, pero, según los propios autores, aún requiere un mayor conjunto de datos para confirmar los resultados prometedores y, al parecer, duraderos. El objetivo de este estudio era evaluar el tratamiento de la tendinosis aquílea con proloterapia intratendinosa con glucosa al 25%, precedida por hidrodisección del paratendón guiada por ecografía con lidocaína al 2% en pacientes con tendinosis aquílea crónica, resistente a la fisioterapia, para proporcionar datos indicativos de la eficacia a largo plazo de esta técnica e introducir un paso complementario de alivio del dolor.
MétodosSe trató de un estudio observacional longitudinal (serie de casos) llevado a cabo en 27 pacientes consecutivos con diagnóstico de tendinosis aquílea en el Hospital Universitario Nuestra Señora de Candelaria (HUNSC), en Tenerife, en los que el tratamiento conservador había sido ineficaz. El estudio recibió la autorización del Comité de Ética de la Investigación con medicamentos (ABB-LID 2019-01) y se realizó de conformidad con la Declaración de Helsinki.
ParticipantesLos 27 pacientes incluidos (15 varones y 12 mujeres), con edades comprendidas entre los 25 y 70 años, llevaban presentando tendinosis aquílea desde hacía más de 3 meses (duración media de 28 meses, intervalo 3-120 meses) con resultados insatisfactorios del tratamiento con una o más de las siguientes técnicas de fisioterapia: ejercicio excéntrico (n=17), terapia con ondas de choque (n=9) y electrólisis percutánea intratisular (n=2). Los criterios de exclusión fueron la presencia de tendinosis calcificada insercional (tendinosis irreversible) y grandes roturas intrasustancia o en la inserción tendinosa. Los pacientes se sometieron a anestesia e hidrodisección del paratendón con lidocaína al 2%, seguida de inyecciones guidas por ultrasonido con una solución glucosada al 25%, es decir, hiperosmolar, en los focos tendinosos cada 5 semanas.
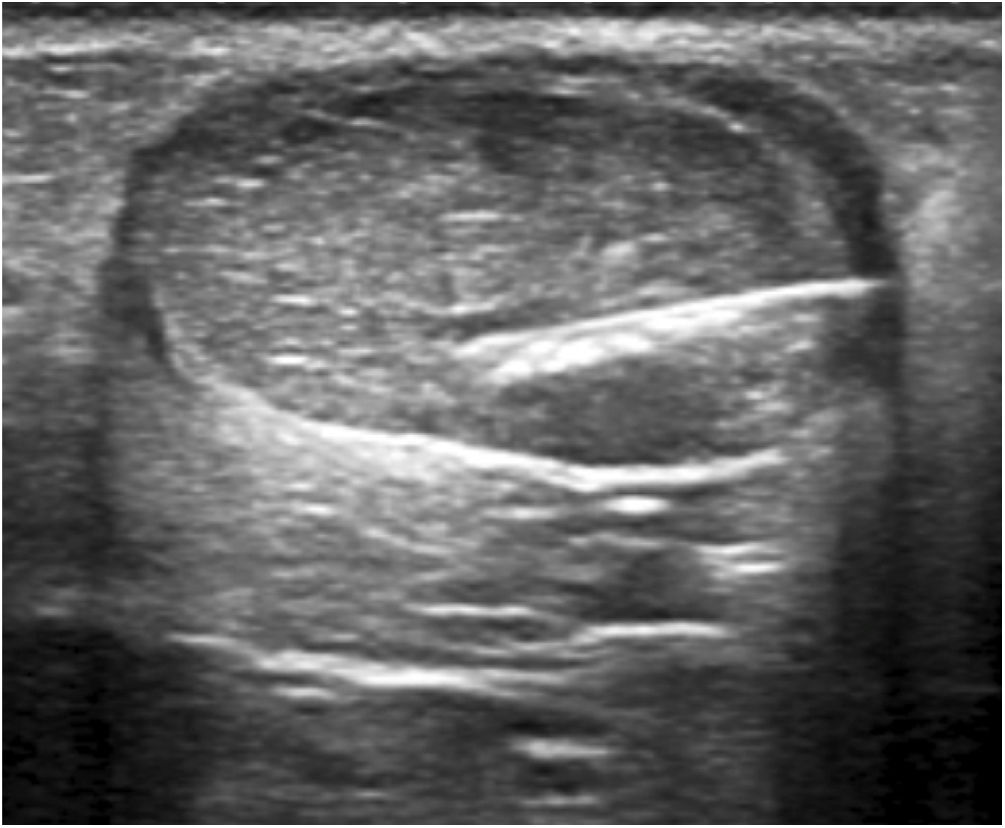
Ecografía: técnica y aplicaciónEstudio ecográficoLos estudios ecográficos de diagnóstico, así como el procedimiento intervencionista percutáneo, estuvieron a cargo de 3 radiólogos con entre 9 y 20 años de experiencia profesional en radiología osteomuscular. La técnica se realizó con los pacientes en decúbito prono, con los pies colgando por el extremo de una mesa equipada con un elevador hidráulico para el ajuste correcto de la altura. Se utilizaron un equipo Toshiba Aplio XG de gama alta (Toshiba Medical Systems, Japón) y transductores lineales de 7 a 14MHz, agujas de calibre 27, jeringuillas con conexión Luer de 10ml, guantes estériles, una funda estéril para la sonda ecográfica, así como material para crear un campo estéril. En primer lugar, se realizó una exploración axial y longitudinal del tendón, manteniendo la sonda paralela a las fibras en el eje longitudinal y perpendicular al eje transversal para evitar artefactos por anisotropía. A continuación, se determinaron la neovascularización, las calcificaciones, los focos tendinosos y el grosor máximo de cada tendón al inicio y después de cada una de las intervenciones.
El grosor máximo del tendón (en milímetros) se determinó en el eje anteroposterior (AP) máximo. Solo 2 de los 27 tendones de Aquiles tratados presentaron tendinosis insercional; los otros 25 correspondieron a tendinosis en la parte media.
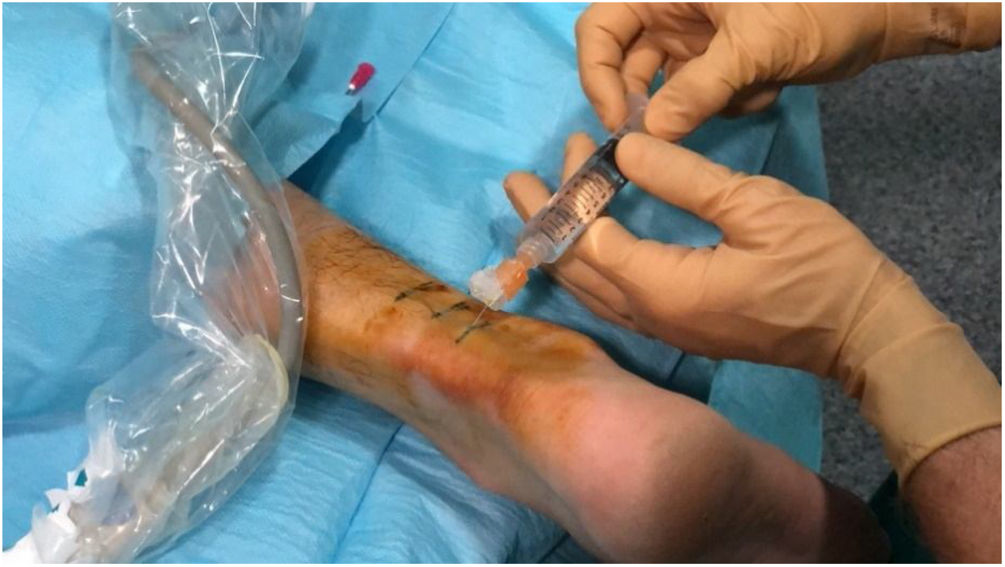
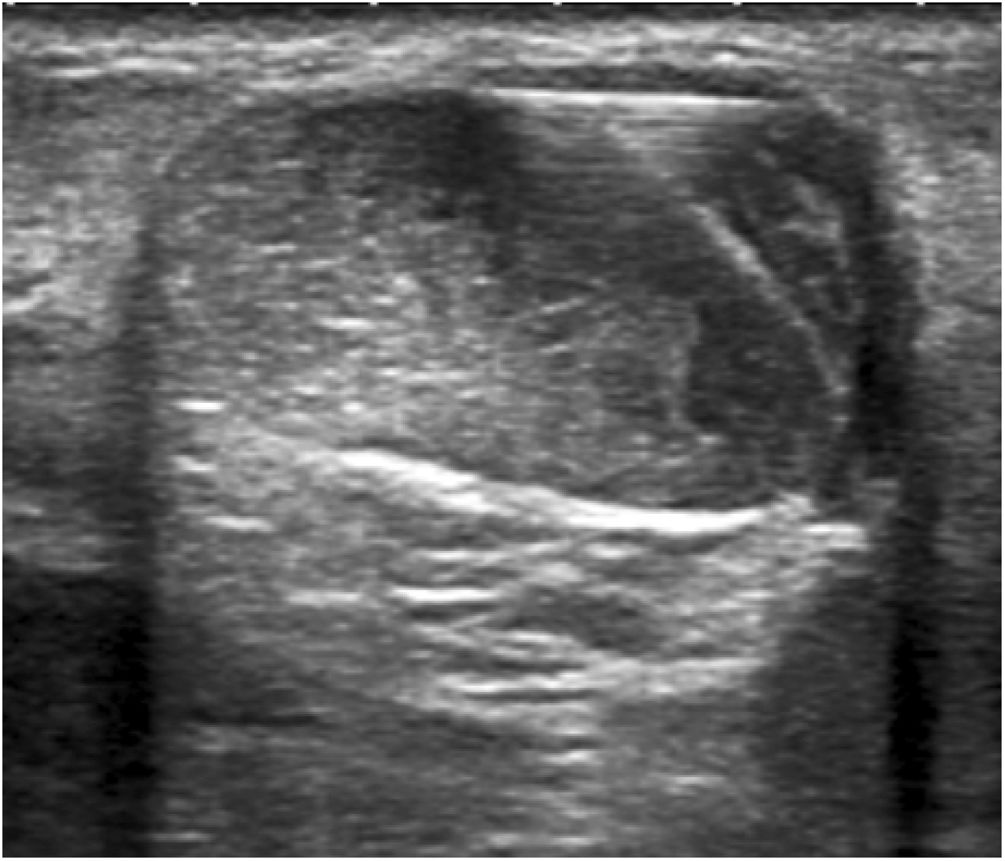
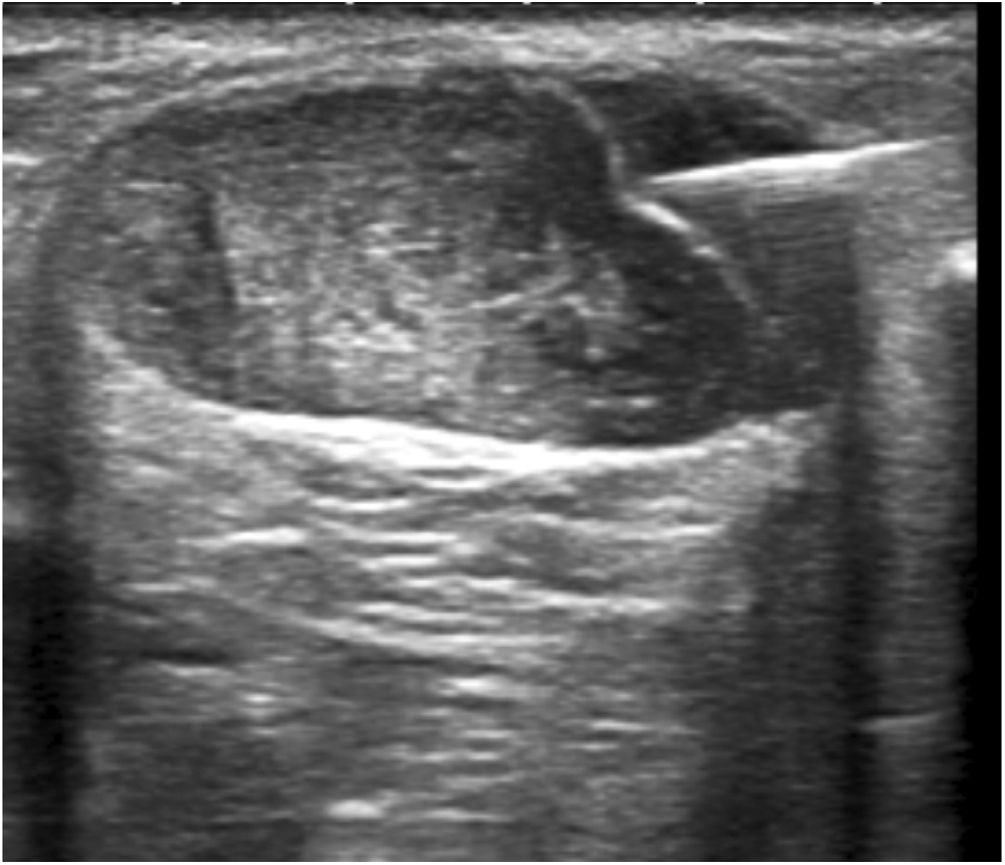
Hidrodisección del paratendón con lidocaína al 2%Los focos tendinosos se localizaron como áreas hipoecoicas de márgenes poco definidos, con o sin hiperemia asociada, confirmándose así las zonas causantes de dolor a la palpación. Estas áreas se marcaron en la piel y se creó una pequeña ampolla de lidocaína al 2% por vía cutánea (subcutánea sin la guía ecográfica). A continuación, se aplicaron medidas asépticas, es decir, se proporciona una funda estéril para el cable de la sonda, así como un campo estéril alrededor de la zona del tendón de Aquiles y en la mesa de exploración. Tras desinfectar la piel con povidona yodada, se inició la hidrodisección del paratendón con lidocaína al 2%. Con la misma jeringuilla de 10ml con conexión Luer utilizada para crear la ampolla y con un control ecográfico estricto, se separó el paratendón del tejido adiposo subcutáneo adyacente para romper las adherencias, destruyendo mecánicamente los nuevos vasos y nervios que podían haberse formado en el proceso de degeneración del tendón y, por último, se provocó un bloqueo anestésico para evitar el dolor durante todo el procedimiento. Para que la hidrodisección fuera eficaz se necesitaron 10 ml de lidocaína al 2% (figs. 1-3).
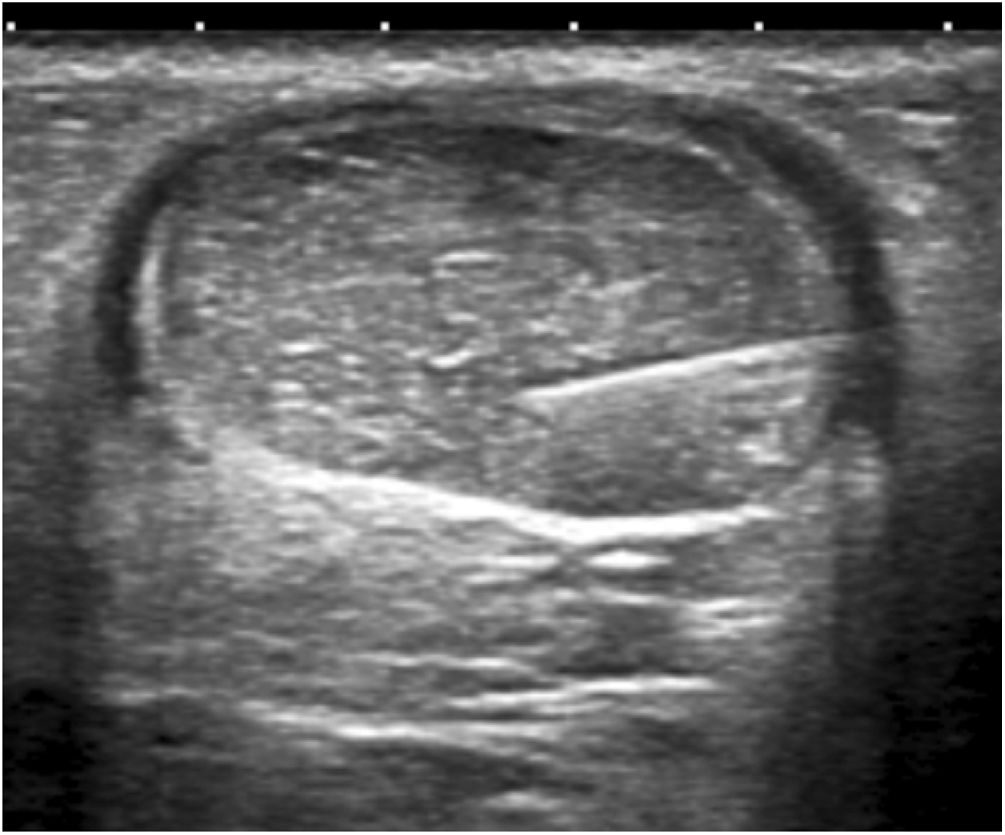
A continuación, los focos hipoecoicos de tendinosis o degeneración del colágeno se infiltraron con solución glucosada al 25%, mezclando 1ml de lidocaína al 2% (20mg/ml) con 1ml de solución glucosada al 50% (25mg/50ml) en una jeringuilla de 10ml con conexión Luer. Se purgó el aire presente en la jeringuilla para evitar artefactos en el campo visual. Cada tratamiento consistió en infiltrar todos los focos hipoecoicos identificados mediante una técnica de punción en paralelo al transductor o una técnica de manos libres (figs. 4 y 5). La cantidad total de solución administrada dependía del número de focos, la resistencia o la presión intratendinosa, y la distribución de la solución dentro del tendón y hacia el peritendón. Se trataron en cada paciente de uno a 3 focos tendinosos de media en cada procedimiento.
Al final del procedimiento, se comprobó en el tendón la distribución del líquido y la extravasación de la solución irritante al peritendón. Cuando había una extravasación considerable, se inyectaba una cantidad específica de betametasona (0,5ml) en esta área para evitar la aparición de paratendonitis, una posible complicación del procedimiento.
Los pacientes recibieron las pautas que debían seguir en las semanas siguientes posteriores al procedimiento. Estas pautas consistieron en evitar los fármacos antiinflamatorios no esteroideos, especialmente durante las primeras 72h, y recomendar la administración de paracetamol en una dosis de 1g cada 8h como único analgésico permitido si presentaban dolor, puesto que este no inhibe la ciclooxigenasa 2, a diferencia de los fármacos antiinflamatorios no esteroideos. Asimismo, se pidió a los pacientes que no realizaran ejercicio de carga axial durante por lo menos 72h después del procedimiento. Pasado este tiempo, podían reanudar su actividad física habitual, incluido su ejercicio excéntrico ordinario, con la supervisión de un profesional.
A los 24 meses del tratamiento final se hizo un breve seguimiento por teléfono o WhatsApp, preguntando a los pacientes por su nivel actual de dolor. Se incluyó una evaluación mediante la escala visual analógica (EVA) en esas entrevistas, utilizando WhatsApp.
Evaluación del dolorSe aplicó una EVA del 0 al 100 para evaluar el dolor en la consulta de tratamiento inicial y final. Se registró el dolor en reposo (EVA1), con actividades de la vida diaria (EVA2) y durante o inmediatamente después de ejercicio moderado (EVA3) al inicio y tras el tratamiento final13. Las variaciones se evaluaron: a) como puntuaciones finales de la EVA1, EVA2 y EVA3, y b) como porcentajes de las variaciones individuales con respecto a las puntuaciones iniciales.
Evaluación de la vascularizaciónPara determinar la progresión de la neovascularización del tendón, se aplicó un sistema de clasificación: grado 0 (es decir, ausencia de neovascularización), grado 1 (es decir, neovascularización leve con 1-2 vasos introduciéndose en el tendón), grado 2 (es decir, neovascularización moderada con 3-4 vasos) y grado 3 (es decir, neovascularización intensa con más de 4 vasos). Por tanto, los grados iniciales se denominaron Gi0, Gi1, Gi2 y Gi3, mientras que los grados finales fueron Gf0, Gf1, Gf2 y Gf3.
Análisis estadísticoLos datos correspondientes a las variables cualitativas se resumieron como frecuencias, y como media±desviación estándar y mediana (percentiles 25 y 75 [P25, P75]) para las variables numéricas.
La eficacia del tratamiento se estimó aplicando un intervalo de confianza (IC) del 95%, teniendo en cuenta las puntuaciones y la disminución relativa con respecto al dolor inicial. Las comparaciones entre las puntuaciones de la EVA iniciales y finales y las variaciones en el grosor y la vascularización del tendón se exploraron mediante la prueba de Wilcoxon no paramétrica para datos emparejados y un modelo lineal general para mediciones repetidas, cuando procedía.
La significación estadística se estableció en p <0,05. Todos los análisis se efectuaron con el programa informático SPSS/PC (V.24.0 para Windows; SPSS, Inc., Chicago, IL, EE. UU.) y EPIDAT (V.3.0, Consellería de Sanidade Xunta de Galicia y Organización Panamericana de la Salud).
Participación pública y de los pacientesEn el diseño, la realización y la interpretación de este estudio no participaron miembros del público ni pacientes.
ResultadosEsta serie de casos prospectivos incluyó a 27 pacientes consecutivos, con una media de edad de 25 años, que presentaban tendinosis aquílea resistente al tratamiento convencional con ejercicio excéntrico, terapia con ondas de choque o electrólisis percutánea intratisular. Su afección dominante (91%) era tendinosis en la parte media, frente a solo 2 casos de tendinosis insercional. Para lograr un resultado satisfactorio, es decir, una EVA <3, era necesario repetir el tratamiento percutáneo cada 5-6 semanas y una media de 5 sesiones de tratamiento (1-11), es decir, 25-30 semanas de tratamiento de media.
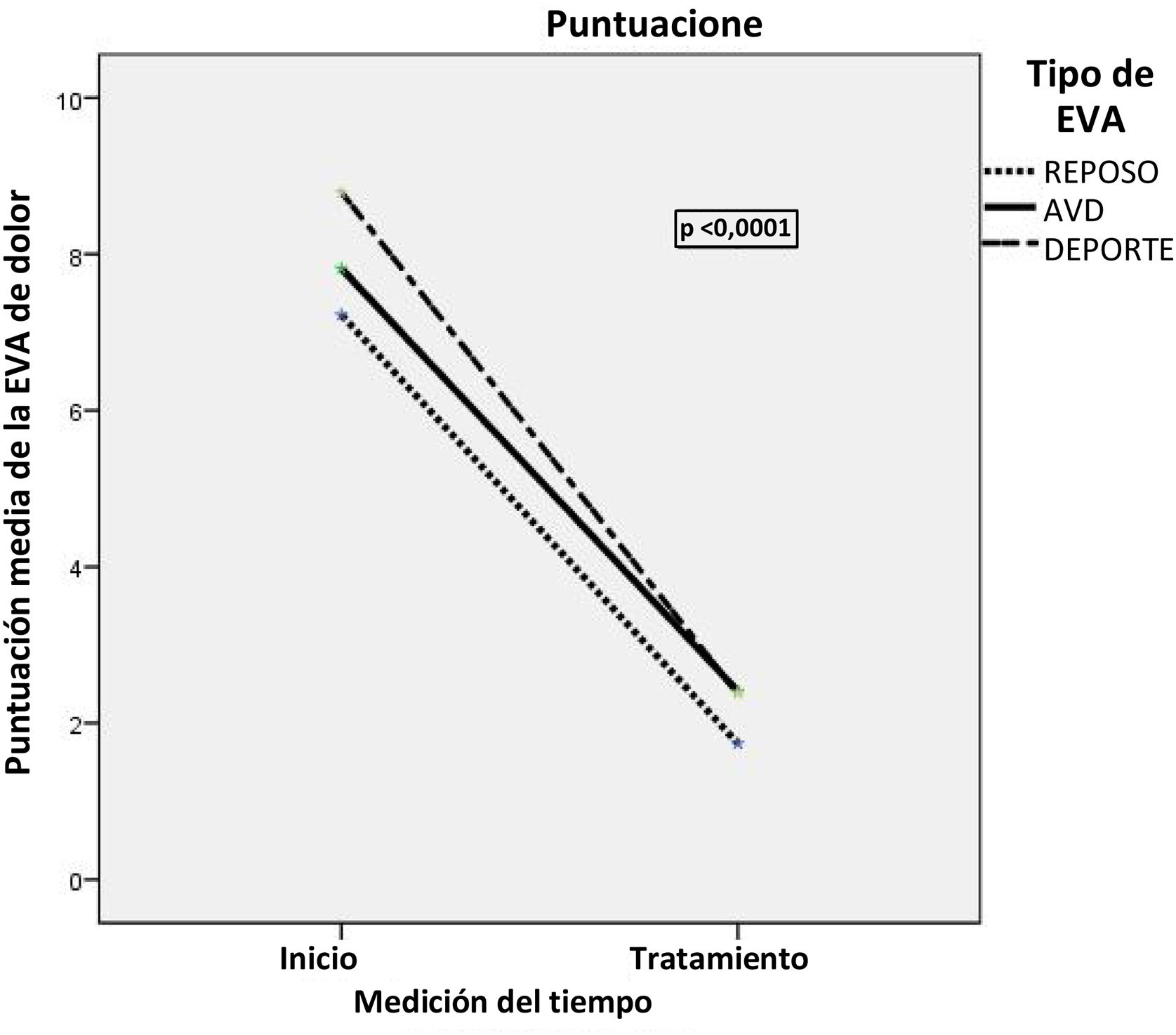
En el momento de la inclusión, los pacientes comunicaron puntuaciones medias de 67, 76 y 86 en la EVA1, la EVA2 y la EVA3, respectivamente. Después de completar la proloterapia, se observó una disminución estadísticamente significativa (p <0,0001) en las 3 puntuaciones de dolor. La disminución relativa comparada con la puntuación inicial en reposo fue del 75% en la EVA1 (IC del 95%, 61-93%), el 69% en la EVA2 (IC del 95%, 55-83%) y el 70% en la EVA3 (IC del 95%, 57-84%). Solo 2 pacientes no notificaron ninguna variación con respecto a las puntuaciones iniciales de dolor. Los datos estadísticos que describen la disminución del dolor (media, mediana y valores de p) en los 3 casos se exponen en la tabla 1 y la figura 6.
Escala visual analógica (EVA) en la consulta de inicio y de final del tratamiento
| Inicio | Final | Valor de p | |
|---|---|---|---|
| EVA1, media±DE,mediana (P25; P75) | 72,22±24,2380 (60; 90) | 17,41±25,360 (0; 30) | <0,001 |
| EVA2, media±DE,mediana (P25; P75) | 78,15±6,1880 (70; 90) | 24,70±28,1810 (0; 30) | <0,001 |
| EVA3, media±DE,mediana (P25; P75) | 87,78±10,8690 (80; 100) | 25,55±30,8010 (7,5; 40) | <0,001 |
Valor de p* según la prueba de Wilcoxon para datos no emparejados.
DE: desviación estándar; EVA1: dolor en reposo; EVA2: dolor con las actividades de la vida diaria; EVA3: dolor durante o inmediatamente después de ejercicio moderado.
Valor de p* según la prueba de Wilcoxon para datos no emparejados
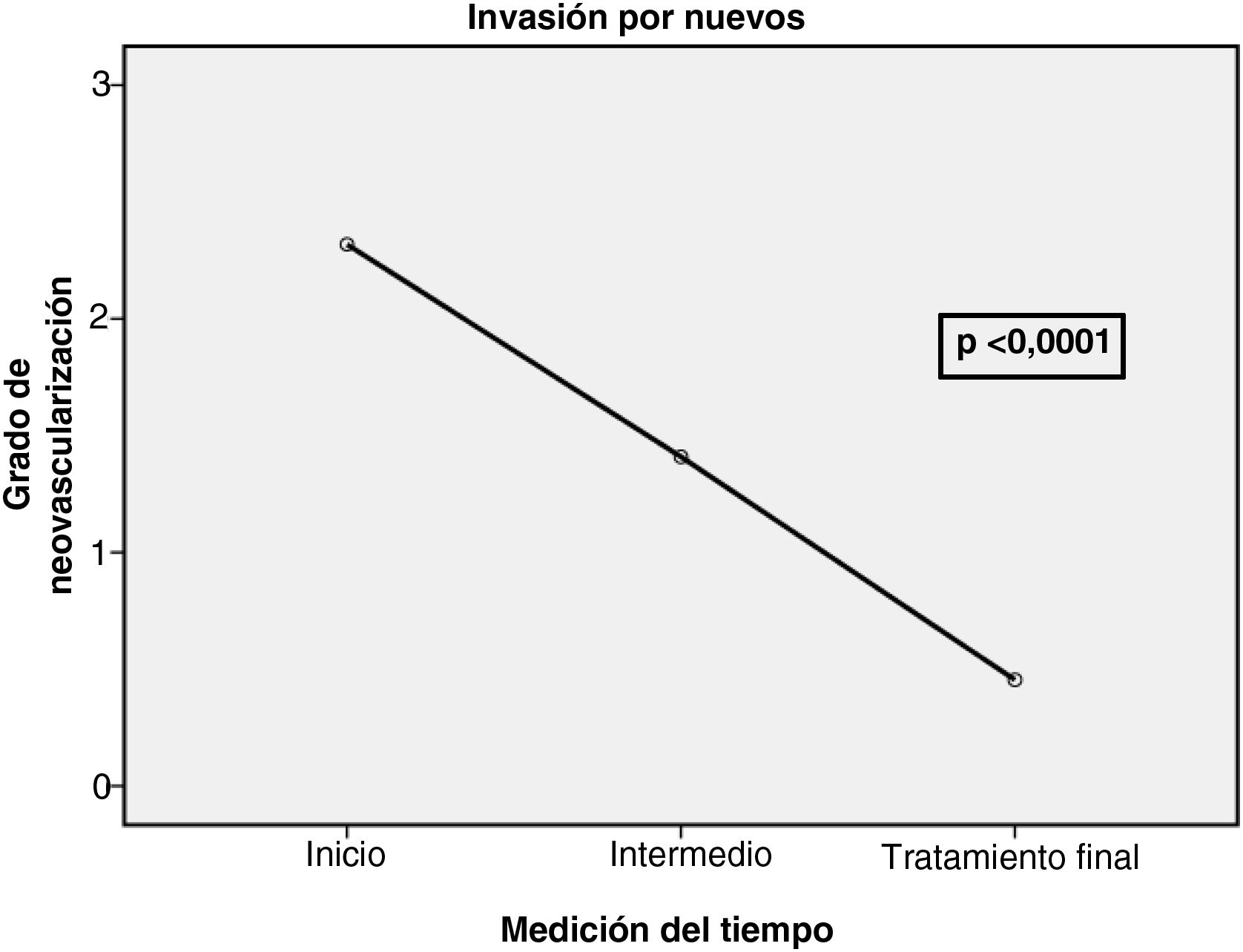
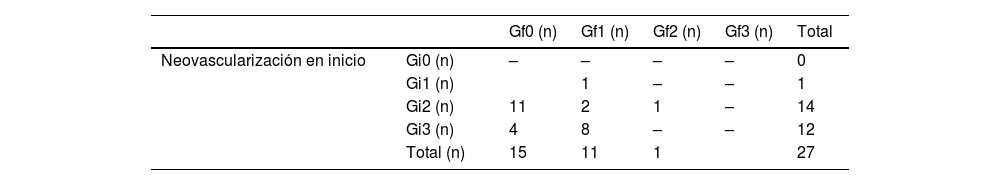
Durante el transcurso del tratamiento, los vasos visibles en los focos hipoecoicos disminuyeron en toda la capa tendinosa; la neovascularización del tendón reflejó una disminución estadísticamente significativa (p <0,001) (fig. 7). Se observó una mejoría individual en cada paciente. La vascularización inicial se clasificó como Gi1 en un paciente, Gi2 en 14 pacientes y Gi3 en 13 pacientes. Hay que destacar que el 78,6% de los tendones tratados cambiaron de un grado de vascularización Gi2 a Gf0 y el 100 % con Gi3 pasó a Gf1. Solo el paciente que comenzó con Gi2 mantuvo este grado (Gf2). Por tanto, al final del tratamiento, el 96% de los tendones se clasificaron como de grado 0 o de grado 1 según la escala de vascularización (tabla 2) (fig. 7).
Grado de vascularidad al inicio y en la consulta final del tratamiento. Neovascularización al final del tratamiento
| Gf0 (n) | Gf1 (n) | Gf2 (n) | Gf3 (n) | Total | ||
|---|---|---|---|---|---|---|
| Neovascularización en inicio | Gi0 (n) | – | – | – | – | 0 |
| Gi1 (n) | 1 | – | – | 1 | ||
| Gi2 (n) | 11 | 2 | 1 | – | 14 | |
| Gi3 (n) | 4 | 8 | – | – | 12 | |
| Total (n) | 15 | 11 | 1 | 27 |
Grados de neovascularización al inicio: Gi0, grado 0; Gi1, grado 1; Gi2, grado 2; Gi3, grado 3; grados de neovascularización al final del tratamiento: Gf0, grado 0; Gf1, grado 1; Gf2, grado 2; Gf3, grado 3; n, frecuencia absoluta; valor de p* según prueba de Wilcoxon de datos no emparejados.
Valor de p según prueba de Wilcoxon de datos no emparejados.
Valor de p <0,001.
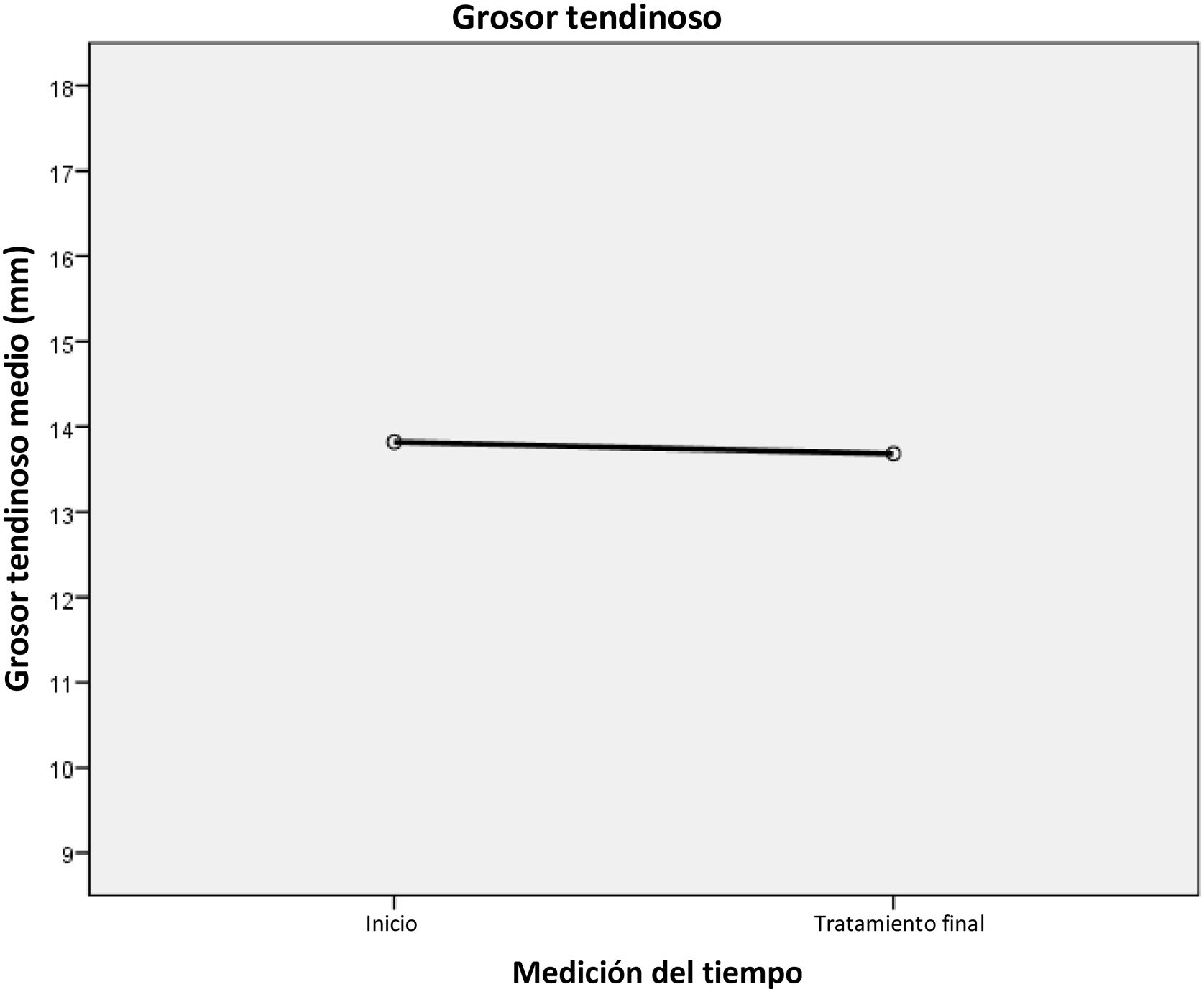
No observamos variaciones significativas en el grosor del tendón, ni entre las medias inicial y final (13,82mm, 13,68mm; p=0,083) ni en las medias (percentiles P25, P27; p=0,083) de los valores en el eje AP máximo final (13,5; 12; 15,25) (tabla 3) (fig. 8).
No se observaron efectos adversos ni complicaciones durante el procedimiento ni con posterioridad.
DiscusiónEl objetivo de este estudio era contribuir estadísticamente al escaso pero creciente grado de evidencia sobre la tendinosis y su posible tratamiento. Nuestro trabajo confirma los datos, obtenidos por Maxwell y Ryan11 y Ryan y Wong12, que representan la mayor serie sobre el tratamiento y el seguimiento de la tendinosis aquílea publicados hasta la fecha y proporcionan una referencia excelente con la que comparar nuestros resultados.
Reducir el dolor intenso en los pacientes con tendinosis aquílea, no solo al realizar ejercicio moderado, sino también en sus actividades diarias e incluso en reposo, es el objetivo de los tratamientos convencionales, que hasta la fecha se han aplicado con un éxito dudoso. Hoy en día, el ejercicio excéntrico (caída del talón) es la fisioterapia de referencia para la tendinosis aquílea, incluida en diversas guías y validada internacionalmente10. Cuando esta opción no basta para aliviar el dolor del paciente, pueden utilizarse diferentes tratamientos percutáneos y extracorpóreos publicados recientemente, como terapia con ondas de choque, punción con aguja seca, inyecciones de alto volumen, tratamiento con factores de crecimiento plaquetario y proloterapia con glucosa hiperosmolar11–16. Nuestro método de tratamiento percutáneo guiado por ecografía engloba la hidrodisección del paratendón con lidocaína al 2% y proloterapia intratendinosa con glucosa al 25% y, en estas condiciones, dio lugar a resultados prometedores. Además, combinó 2 de los métodos de tratamiento percutáneo descritos en un solo procedimiento, es decir, la hidrodisección de alto volumen del paratendón y la proloterapia con una solución glucosada hiperosmolar. Conviene destacar que nuestro estudio describe por primera vez la hidrodisección del paratendón con lidocaína al 2%, cumpliendo un doble propósito. Por un lado, se anestesia el tendón de modo que el paciente no experimenta ningún dolor durante el procedimiento. Es importante destacar que el dolor es uno de los inconvenientes atribuidos a la proloterapia y a los tratamientos de los tendones en general. Por otro lado, es más probable que los nuevos vasos que penetran en el paratendón se destruyan si se utiliza el mayor volumen posible.
Es sabido que el dolor es un síntoma subjetivo. Al utilizar la misma EVA para la evaluación del dolor que otros autores, pudimos comparar resultados13. Los 3 valores medios iniciales (la EVA1, la EVA2 y la EVA3) fueron algo más altos en nuestros pacientes que en las 2 series publicadas con anterioridad11,12. Después de completar la proloterapia, el dolor había disminuido considerablemente y a puntuaciones finales similares en los 3 casos, lo que también se refleja en la disminución relativa. Además, la reducción relativa máxima del dolor en reposo se asemejaba a los datos de Maxwell y Ryan. en su serie de 36 casos11.
La variación media en el grosor del tendón de 0,1mm al final del tratamiento no fue significativa, de forma análoga a la disminución media de 0,6mm observada en la serie de Maxwell y Ryan11 y de 0,3mm en los 108 tendones tratados de la serie de Ryan y Wong12.
Los estudios actuales sobre tendinopatías y su tratamiento apropiado se han centrado en la neovascularización concurrente como probable fuente de dolor17. Por definición, los tendones son prácticamente avasculares y, por lo tanto, proclives a hipoxemia, que puede originar una reparación inadecuada en condiciones de estrés agudo o crónico. En los estudios de microdiálisis se ha demostrado que, en caso de tendinosis, el lactato persiste en reposo, lo que sugiere hipoxia en la tendinopatía incluso después del estrés físico18. En un trabajo reciente, Järvinen19 explicó la paradoja de la hipoxemia a pesar de una extensa neovascularización en la tendinosis basándose en la teoría de la hiperpermeabilidad. Básicamente, este autor señala que la neovascularización tendinosa estimulada por hipoxia y su secreción consiguiente de factores de crecimiento vascular darían lugar a vasos hiperpermeables, debido, con toda probabilidad, a una luminización alterada, es decir, la integridad estructural de las células endoteliales y los pericitos en la pared del vaso. Esto, a su vez, ocasionaría una perfusión tisular deficiente y la desaparición de exudados ricos en fibrina en el tejido extraluminal, dando lugar así a la degeneración fibrinoide del tendón19. Los avances más recientes en genética y biología vascular han identificado genes responsables de una luminización y estabilización vascular adecuadas, entre ellos el gen R-Ras20. La falta de expresión de R-Ras es la causante de la formación de nuevos vasos sanguíneos hiperpermeables en diferentes enfermedades, como la retinopatía, el cáncer y, por supuesto, la isquemia osteomuscular. En cambio, el restablecimiento de la actividad del gen R-Ras en células endoteliales de ratón revierte el fenómeno de hipoxemia20, lo que inaugura un campo completamente nuevo e inexplorado en el tratamiento de esta patología.
En nuestra serie de casos, así como en los publicados por Maxwell y Ryan11 y Ryan y Wong12, la vascularización inicial de grado 2 era predominante (59%), seguida de la de grado 3 en el 35% de los tendones. Nos gustaría resaltar que, para el final del tratamiento, el 100% de los tendones eran de grado 0 o grado 1, lo que supone un descenso significativo expuesto individualmente en la tabla 3. La disminución media en la vascularización tendinosa en los estudios antedichos fue también significativa, si bien no se indicaron las variaciones individuales; no obstante, con toda probabilidad, ninguno de los tendones habrá empeorado.
Limitaciones y fortalezasUna limitación concreta de nuestro estudio es la falta de uno o más grupos de control con otros tratamientos —a diferencia de los trabajos antedichos11,12— que permitieran la comparación. No hay ensayos clínicos que evalúen el uso de glucosa al 25% frente a placebo o en los que los pacientes estén en condiciones de enmascaramiento para la evaluación del dolor antes y después del tratamiento, habida cuenta de la subjetividad de la percepción del dolor. En este sentido, nuestro estudio proporciona datos objetivos basados en la ecografía de una disminución significativa en la formación de nuevos vasos sanguíneos defectuosos, que perpetuarían la inflamación y afectarían estructuralmente a los tejidos, y que parecen relacionarse con el dolor17. Todos nuestros pacientes habían recibido otros tratamientos sin éxito y presentaban un grado elevado de dolor y un nivel elevado de neovascularización. Como Maxwell y Ryan11 mencionaron en sus conclusiones: «... se necesitan más estudios clínicos que comparen las inyecciones de glucosa hiperosmolar con otros tratamientos y con la ausencia de tratamiento».
La tendinosis aquílea es un problema de salud que afecta tanto a los deportistas como a las personas sedentarias. Se desconoce su incidencia real. Permanecer de pie durante un tiempo prolongado soportando todo el peso corporal, así como los deportes basados en correr, son factores de riesgo reconocidos de esta patología. La tendinosis aquílea es un desafío para los profesionales sanitarios, pues todavía hay muy poca información disponible sobre su etiopatogenia y su tratamiento adecuado.
La proloterapia intratendinosa del telón de Aquiles con una solución glucosada hiperosmolar es un método terapéutico barato, seguro y duradero, validado con la mayor serie de casos (108 tendones de Aquiles) en este campo hasta la fecha12. El dolor causado por las inyecciones de la solución irritante hipertónica en el tendón de Aquiles durante la proloterapia quizá sea el factor más limitante para su uso habitual. Teniendo en cuenta esto último y los tratamientos de alto volumen con solución fisiológica descritos por Chan et al.14, decidimos incorporar un nuevo paso previo de anestesia e hidrodisección del paratendón con lidocaína al 2% en la técnica descrita originalmente11,12. Esto nos permitió llevar a cabo la infiltración indolora del tendón de Aquiles con una solución salina y, además, romper las posibles adherencias, neovascularización y neoinervación que irrigan e inervan los focos tendinosos hipoecoicos, contribuyendo de este modo al resultado de la propia proloterapia.
Los cambios histopatológicos que acompañan a la proloterapia fueron propuestos por Banks21 en 1991. El autor ha propuesto 4 mecanismos básicos para propiciar la reparación y recuperación del tejido dañado: 1) la solución inyectada causaría deshidratación de las células inducida por la osmolaridad y, en consecuencia, una reacción inflamatoria local; 2) los restos celulares atraerían granulocitos, que, a su vez, secretarían factores humorales y, de este modo, ocasionarían la infiltración de macrófagos; 3) los macrófagos fagocitarían los restos celulares y segregarían factores de crecimiento que atraerían y activarían los fibroblastos, y 4) finalmente, los fibroblastos producirían colágeno, obteniéndose entonces un tejido conectivo en el tendón reorganizado y más resistentes que antes de la infiltración. No obstante, somos conscientes de los resultados discordantes obtenidos en estudios en animales sobre la densidad, viabilidad y reclutamiento de proteoblastos o sobre vascularización del tendón después de la administración de la proloterapia, por lo que se necesitan más estudios sobre los mecanismos histopatológicos.
En nuestro estudio, pudimos confirmar la mayor resistencia del tendón con cada administración de solución hiperosmolar, lo que parece confirmar el último punto propuesto por Banks. La resonancia magnética funcional con mapas de relajación en T2 antes, durante y después de la proloterapia podría ayudar a confirmar esta hipótesis, lo que es un estímulo para las investigaciones futuras.
Asimismo, hemos observado una disminución continua por toda la capa tendinosa en el número de vasos visibles en los focos hipoecoicos. Esta disminución progresiva se reflejó en la reducción del dolor determinada por los grados de la EVA (fig. 6). Nuestra observación favorece la hipótesis de que el dolor habitualmente descrito puede deberse en gran medida a la neoinervación que acompaña a la neovascularización17.
La punción seca guiada por ecografía, también conocida como tenotomía percutánea, es una técnica que se ha realizado con buenos resultados en los últimos años15,16, lo que ha suscitado un debate sobre la necesidad de añadir soluciones irritantes o hipertónicas al tratamiento percutáneo. Se precisan más estudios para comparar ambos métodos y aclarar esta cuestión. Creemos que en dicho estudio deberían incluirse otros tratamientos percutáneos, como la terapia con ondas de choque y la infiltración de plasma rico en plaquetas.
De forma alternativa, estabilizar los nuevos vasos sanguíneos malformados y dañados durante la hipoxemia inducida por estrés y, de este modo, revertir el fenómeno de hipoxia, podría ser el abordaje terapéutico definitivo en esta patología. Los avances en biología vascular y tratamientos relacionados en un futuro próximo podrán finalmente resolver estas cuestiones.
ConclusiónEl tratamiento percutáneo de la tendinosis aquílea que combina anestesia e hidrodisección del paratendón con proloterapia posterior con una solución glucosada hiperosmolar es una técnica segura, barata y prácticamente indolora. Da lugar a una reducción progresiva de nuevos vasos sanguíneos por toda la capa tendinosa, así como a una disminución significativa de la percepción del dolor en reposo, con la actividad física diaria y durante el ejercicio moderado, que se mantienen con el tiempo.
¿Cuáles son los resultados?Puede lograrse una disminución de la neovascularización en la tendinosis con proloterapia percutánea.
La hidrodisección con lidocaína del paratendón garantiza un procedimiento percutáneo asintomático y libera cualquier posible adherencia tisular.
La disminución de la neovascularización conseguida fue proporcional a la disminución de la intensidad del dolor evaluada mediante escalas visuales análogas.
Los efectos de la proloterapia persistieron en el tiempo con un seguimiento de 24 meses.
¿Cómo podría influir en la práctica clínica en el futuro?El tratamiento percutáneo de la tendinosis guiado por ecografía con hidrodisección del paratendón con lidocaína seguida de infiltración de glucosa en los focos hipoecoicos es un método disponible y barato que al parecer tiene unos excelentes resultados a largo plazo.
FinanciaciónEsta investigación no ha recibido ninguna subvención específica de organismos de financiación de los sectores público, comercial o sin ánimo de lucro.
Autoría- 1.
Responsable de la integridad del estudio: ABB.
- 2.
Concepción del estudio: ABB.
- 3.
Diseño del estudio: ABB.
- 4.
Adquisición de datos: ABB, MLNM, PMG y ACL.
- 5.
Análisis e interpretación de los datos: LIPM.
- 6.
Procesamiento estadístico: LIPM.
- 7.
Búsqueda bibliográfica: ABB.
- 8.
Redacción del artículo: ABB.
Los autores declaran no tener ningún conflicto de intereses.
Sin la inestimable ayuda y paciencia de Juana María González Acosta, graduada en enfermería (DUE) en el Servicio de Radiología del HUNSC, Tenerife, este estudio no habría sido posible.