Demostrar la viabilidad de las secuencias cine de resonancia magnética cardiaca (RMC) aceleradas mediante detección comprimida o compressed sensing (CS) en la evaluación de la anatomía, el volumen y la función ventriculares; y presentar un protocolo de RMC rápida que mejore la eficacia de la exploración.
MétodosEstudio prospectivo de pacientes consecutivos con indicación de RMC a los que se les realizó una secuencia cine del eje corto (EC) con CS en comparación con una secuencia cine de EC convencional. Se analizaron la fracción de eyección (FE), el volumen telediastólico (VTD), el volumen sistólico (VS) y el grosor miocárdico. La lectura de las imágenes se llevó a cabo por dos observadores independientes cegados. Se calculó la concordancia intra- e interobservador para todas las mediciones. También se evaluó la calidad de la imagen de las secuencias cine convencionales y con CS.
ResultadosSe incluyeron un total de 50 pacientes, 22 mujeres (44%) con una edad media de 57,3± 13,2 años. La FE ventricular izquierda media fue del 59,1%±10,4% con las secuencias steady-state free precession (SSPF), precesión libre de estado estacionario de referencia, frente al 58,7%±10,6% con CS; y la FE ventricular derecha con imágenes convencionales fue del 59,3%±5,7%, frente al 59,5%±6,1% con CS. Las medias del VTD ventricular izquierdo para las secuencias convencionales y con CS fueron de 166,8 y 165,1 ml, respectivamente; para el VS ventricular izquierdo fue de 94,5 frente a 92,6 ml; para el VTD ventricular derecho fue de 159,3 frente a 156,4 ml; y para el VS ventricular derecho fue de 93,6 frente a 91,2 ml, respectivamente. Se obtuvieron excelentes correlaciones intra- e interobservador para todos los parámetros (coeficiente de correlación intraclase entre 0,932 y 0,99; IC: 95%). Tampoco hubo diferencias significativas en el grosor ventricular (12,9±2,9 mm frente a 12,7±3,1 mm) (p<0,001). El tiempo medio de la exploración EC con CS fue de <40 s frente a los 6-8 min de una EC convencional. La duración media del estudio completo fue de 15±3 min.
ConclusionesLas secuencias cine CS son viables para evaluar la función biventricular, el volumen y la anatomía, lo que permite protocolos rápidos de RMC.
To demonstrate the feasibility of cardiac magnetic resonance (CMR) cine sequences with compressed-sensing (CS) acceleration in the assessment of ventricular anatomy, volume, and function; and to present a fast CRM protocol that improves scan efficiency.
MethodsProspective study of consecutive patients with indication for CMR who underwent CS short-axis (SA) cine imaging compared with conventional SA cine imaging. We analysed ejection fraction (EF), end-diastolic volume (EDV), stroke volume (SV), and myocardial thickness. Two blinded independent observers performed the reading. Inter- and intraobserver agreement was calculated for all the measurements. Image quality of conventional and CS cine sequences was also assessed.
ResultsA total of 50 patients were included, 22 women (44%) with a mean age of 57.3±13.2 years. Mean left ventricular EF was 59.1%±10.4% with the reference steady-state free precession sequences, versus 58.7%±10.6% with CS; and right ventricular EF with conventional imaging was 59.3%±5.7%, versus 59.5%±6.1% with CS. Mean left ventricular EDV for conventional sequences and CS were 166.8 and 165.1ml respectively; left ventricular SV was 94.5 versus 92.6ml; right ventricular EDV was 159.3 versus 156.4 ml; and right ventricular SV was 93.6 versus 91.2ml, respectively. Excellent intra and interobserver correlations were obtained for all parameters (Intraclass correlation coefficient between 0.932 and 0.99; CI: 95%). There were also no significant differences in ventricular thickness (12.9±2.9mm vs. 12.7±3.1mm) (p<.001). The mean time of CS SA was <40 sec versus 6-8 min for the conventional SA. The mean duration of the complete study was 15±3 min.
ConclusionsCine CS sequences are feasible for assessing biventricular function, volume, and anatomy, enabling fast CMR protocols.
La resonancia magnética cardiaca (RMC) es la técnica de imagen de elección para evaluar la anatomía, la función y las características tisulares del corazón en un solo estudio1,2. Debido a sus numerosas ventajas —entre ellas, la ausencia de radiación ionizante, su capacidad multiplanar con amplios campos de visión y la posibilidad de caracterizar el miocardio entero de forma no invasiva—, es el método de referencia recomendado en las guías de las distintas sociedades de cardiología para evaluar escenarios clínicos cada vez más variados y complejos3–6. La RMC ha demostrado su utilidad clínica para la evaluación de la insuficiencia cardiaca, las miocardiopatías, las arritmias ventriculares, la miocarditis o el infarto de miocardio7–9.
Muchas de las secuencias de RMC que han aparecido en los últimos años se han incorporado de forma consecutiva a los protocolos rutinarios para el estudio de pacientes con patología cardiovascular. Esto ha hecho que, a pesar de la disponibilidad de avances técnicos que aceleran la adquisición y mejoran la calidad de las imágenes de RMC, los tiempos de exploración sigan siendo a menudo largos y perpetúen la idea de que la RMC es una herramienta de diagnóstico cara e inaccesible8,9.
Sin embargo, dado el aumento de las indicaciones clínicas de esta técnica y la implicación capital que sus resultados pueden tener en el manejo de los pacientes, se espera un aumento considerable del número de RMC a realizar, por lo que es recomendable dedicar esfuerzos a simplificar y agilizar los protocolos de estudio que también mantengan una precisión diagnóstica óptima10–13.
Una de las técnicas de aceleración más recientes para las secuencias de RMC es la detección comprimida o compressed sensing (CS), basada en el submuestreo aleatorizado del espacio k, junto con un algoritmo de reducción del ruido que emplea representación dispersa en un proceso de reconstrucción iterativo no lineal. El objetivo del CS es reducir significativamente el tiempo de adquisición afectando lo mínimo a la calidad de la imagen. Esta técnica está disponible en muchos de los equipos convencionales de última generación14–16.
Por lo tanto, los objetivos de este estudio fueron evaluar la viabilidad de las secuencias cine con aceleración CS en la evaluación de la función, el volumen y la anatomía de ambos ventrículos en comparación con las secuencias convencionales; y, por otro lado, presentar un protocolo rápido, ajustado a las directrices de la práctica clínica, que permita un diagnóstico cardiovascular óptimo y mejore la eficacia de las exploraciones y la accesibilidad de los pacientes a la RMC.
MétodosPacientesSe realizó un estudio observacional prospectivo, con selección consecutiva de pacientes remitidos a nuestro centro para RMC con contraste intravenoso (IV) por indicación clínica, entre enero de 2021 y marzo de 2021. Todos los pacientes firmaron un formulario de doble consentimiento aceptando someterse a la RMC y a ser incluidos en el estudio. Se obtuvo el consentimiento para la investigación del Comité de Ética local (ciego para mantener el anonimato). Se incluyó en el estudio a un total de 61 pacientes, 11 de los cuales presentaban algún criterio de exclusión.
Los criterios de exclusión fueron la detección de arritmias en el vectocardiograma que impidieron la adquisición retrospectiva de imágenes (4 pacientes), cualquier contraindicación para la RMC (3 pacientes), la falta de colaboración del paciente para mantener las apneas, que requirió secuencias de RMC con respiración libre (2 pacientes), o cardiopatías congénitas complejas que modificaron sustancialmente la orientación del eje del cine (2 pacientes). La cohorte final de 50 pacientes con su diagnóstico clínico se resume en la figura 1.
Adquisición de imágenesTodas las exploraciones se realizaron en dos equipos de RM de 1,5 T con las mismas características técnicas (MAGNETOM Sola, Siemens AG, Erlangen, Alemania), con una bobina de disposición en fase de 30 canales, con registro vectocardiográfico a través de electrodos cutáneos. El protocolo de adquisición de imágenes se basó en las recomendaciones de la SCMR [6] e incluyó sistemáticamente exploraciones con secuencias SSFP y un mapeo T1 nativo (eje corto y eje de cuatro cámaras) antes del contraste IV. Tras la administración de contraste IV de una dosis total de 0,15 mmol/kg de gadolinio (Dotarem, Bayer Pharma AG, Alemania), se adquirieron secuencias cartesianas en cine SSFP funcional 2D del eje largo (EL), sincronizadas con el movimiento cardiaco de forma retrospectiva (planos de 2, 3 y 4 cámaras). Se obtuvo una adquisición del eje corto (EC) de la base hasta el ápex para cubrir todo el volumen de ambos ventrículos con aceleración CS, secuencia cartesiana de multisección con sincronización retrospectiva, durante dos respiraciones contenidas al final de la espiración y con un ciclo cardiaco completo cubierto. La duración de la adquisición fue de 3 intervalos R-R por sección, de los cuales el primer latido se utilizó para la preparación de la señal para alcanzar el estado estacionario, y los otros dos, para la obtención de datos. Con el objetivo de facilitar la reproducibilidad, no se modificaron los ajustes originales de CS proporcionados por el proveedor del equipo, atendiendo a parámetros fijos y entrelazados.
A continuación, se realizaron secuencias SSFP 2D de inversión-recuperación corregida a la fase o phase-sensitive inversion recovery (PSIR) con realce tardío de gadolinio (RTG) en EC y EL; seguidas de un mapeo T1 posgadolinio para el cálculo del volumen extracelular17,18.
Por último, se realizó una adquisición del EC en secuencias cine convencionales multisección 2D SSFP base-ápex de una apnea de fin de espiración por sección, una secuencia cartesiana con sincronización retrospectiva, que sirvió como patrón para comparar las secuencias aceleradas (fig. 2).
Protocolo de RMC rápida (excluidas las secuencias convencionales utilizadas como patrón de referencia para esta investigación). Tras las exploraciones y el mapeo T1 nativo, se inyecta el contraste intravenoso (CIV) y se realiza una steady state free precession (SSFP) equilibrada de cine de eje largo (EL): vistas de dos cámaras 2C), tres cámaras 3C) y cuatro cámaras 4C); y la adquisición de eje corto (EC) con aceleración por compressed sensing (CS). El siguiente paso es la adquisición de las secuencias con realce tardío de gadolinio (RTG) con imágenes de inversión-recuperación corregido a la fase (PSIR), con corrección de movimiento (MoCo), y finalmente el mapeo T1 posgadolinio (Gd). Las medias del tiempo total del estudio y del número de apneas se indican en la parte inferior.
La aceleración CS solo se utilizó en el lote de cine del EC, lo que permitió reducir significativamente el tiempo y el número de apneas. Los cines únicos del eje largo se realizaron mediante adquisición convencional, ya que el CS no disminuiría el número de apneas y la fase de equilibrio para la obtención de imágenes con RTG requiere al menos 5-6 minutos.
Las características técnicas de las secuencias CS y convencionales se resumen en la tabla 1.
Parámetros técnicos de las secuencias SSFP de referencia y las secuencias aceleradas con CS para la adquisición de imágenes cine del eje corto ventricular
| SSFP de referencia | SSFP con CS | |
|---|---|---|
| TR (ms) | 35,3 | 48,8 |
| TE (ms) | 1,2 | 1,3 |
| Ángulo de giro (°) | 42-64 | 50-62 |
| CDV (mm2) | 360 x 320 | 360 x 320 |
| Matriz (píxeles2) | 304 x 221 | 304 x 221 |
| Resolución espacial (mm2) | 1,2 x 1,2 | 1,2 x 1,2 |
| Resolución temporal (ms) | 36 | 38 |
| Grosor/intervalo (mm) | 7/2 | 7/2 |
| Ancho de banda (Hz/píxel) | 965 | 970 |
| Segmentos | 16 | 16 |
| Fases cardiacas | 25 | 25 |
| Ciclo cardiaco/corte | 10 | 3 |
| Factor de aceleración | 2(Imágenes en paralelo) | 8(Factor de CS) |
| Duración (minutos) | 6-8 | <1 |
| Apneas | 12-15 | 2 |
CDV: campo de visión; CS: compressed sensing (detección comprimida); DE: desviación estándar; SSFP: steady-state free precession (precesión libre equilibrada de estado estacionario); TC: tiempo de eco; TR: tiempo de repetición.
Las imágenes fueron evaluadas por dos observadores ciegos al diagnóstico, con experiencia en RMC (7 y 10 años de lectura de RMC, respectivamente). El primer observador analizó las imágenes de las secuencias convencional y acelerada con CS, con una separación de una semana entre ambas lecturas para evitar el sesgo de memoria. El segundo observador evaluó de forma independiente las imágenes aceleradas con CS. Ambos lectores llevaron a cabo el posprocesamiento de las imágenes utilizando un software específico (QMass MR 7.5, Medis, Países Bajos) que delimita automáticamente los contornos miocárdicos de cada imagen cine, con un ajuste manual posterior19. Se registraron los valores cuantitativos de la fracción de eyección, el volumen telediastólico y el volumen sistólico de ambos ventrículos. Los dos observadores cuantificaron el grosor máximo del miocardio del VI en el fin de la diástole tanto en las secuencias cine EC convencionales como en las aceleradas.
También se recogieron las características clínicas de los pacientes.
La calidad de las imágenes cine se evaluó subjetivamente en una escala de 4 puntos, de forma independiente entre los dos lectores, tanto para la SSFP estándar como para la CS: 1) mala (no válida para el diagnóstico clínico); 2) regular (útil para el diagnóstico clínico, pero con artefactos leves-moderados); 3) buena (válida para el diagnóstico clínico, sin artefactos, pero con una resolución espacial o una relación señal/ruido discretas); 4) muy buena (imagen de calidad óptima).
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar. Las características cualitativas basales se expresan como frecuencia (%). La concordancia entre las mediciones de las secuencias acelerada y convencional se evaluó mediante el coeficiente de correlación intraclase (CCI), los gráficos de Bland-Altman y el análisis de regresión lineal. La concordancia se consideró mala, moderada, buena o excelente para un CCI <0,50, 0,50 a 0,75, 0,75 a 0,90 y>0,90, respectivamente. Para el análisis de Bland-Altman, no se asumió ningún sesgo sistemático significativo si el IC del 95% para la diferencia media entre mediciones contenía el valor 0. La concordancia entre los lectores en cuanto a la calidad subjetiva de la imagen se analizó mediante kappa ponderado con el nivel de concordancia siguiente: κ<0 deficiente; κ=0,01-0,2 leve; κ=0,21-0,4 regular; κ=0,41-0,6 moderado, κ=0,61-0,8 sustancial; κ>0,81 casi excelente. Se utilizó la prueba t de Student para comparar las medias de los parámetros cuantitativos; la significación estadística se fijó en p<0,05. Todos los análisis estadísticos y gráficos se generaron utilizando R (versión 4.1.2: lenguaje y entorno de computación estadística. R Foundation for Statistical Computing, Viena, Austria).
ResultadosPoblación del estudioDe los 50 individuos finales, 22 eran mujeres (44%), con una edad media de 57,3±13,2 años. Las características clínicas de los pacientes se resumen en la tabla 2.
Precisión del CS en la evaluación de la anatomía, el volumen y la función ventricularesConsiderando la SSFP cine convencional como método de referencia estándar, no se observaron diferencias significativas con respecto a la FE, el VTD o el VS de ambos ventrículos, en comparación con el CS. La FEVI media fue del 59,1%±10,4% con las secuencias de referencia, frente al 58,7%±10,6% con CS; y la FEVD fue del 59,3%±5,7% y del 59,5%±6,1%, respectivamente, con un CCI excelente (0,983-0,99 y 0,934-0,964; IC: 95%). Las medias de VTDVI, VSVI, VTDVD y VSVD fueron de 166,8/165,1, 94,5/92,6, 159,3/156,4 y 93,6/91,2 ml, para convencionales/CS, respectivamente; y las medias de VSVI/m2, VTDVI/m2, VTDVD/m2 y VTSVD/m2 fueron de 86,4/85,5, 49/48, 82,6/81 y 48,5/47,3 ml/m2, respectivamente (CCI: 0,98-0,99; 0,95-0,98; 0,932-0,978; 0,971-0,982; IC: 95%).
Tampoco hubo diferencias significativas en el grosor ventricular, que fue de 12,9±2,9 mm y de 12,7±3,1 mm, con las secuencias de referencia y con CS (p<0,001). Los resultados numéricos se resumen en la tabla 3.
Morfología y parámetros funcionales evaluados mediante secuencias SSFP de referencia y secuencias aceleradas con CS
| Parámetro | SSFP de referencia | SSFP con CSObservador 1 | SSFP con CSObservador 2 | Concordancia media (CCI)IC: 95% | |
|---|---|---|---|---|---|
| Intraobservador | Interobservador | ||||
| FEVI (%) | 59,1 | 60,3 | 57,2 | 0,983 | 0,99 |
| VTDVI (ml) | 166,8 | 162,8 | 170,3 | 0,995 | 0,98 |
| VTDVI/m2 (ml/m2) | 86,4 | 84,4 | 88,2 | 0,995 | 0,98 |
| VSVI (ml) | 94,5 | 90,6 | 95,3 | 0,983 | 0,987 |
| VTSVI/m2 (ml/m2) | 49 | 47 | 49,4 | 0,983 | 0,987 |
| FEVD (%) | 59,3 | 61,9 | 58,4 | 0,94 | 0,944 |
| VTDVD (ml) | 159,3 | 157,3 | 155,2 | 0,954 | 0,932 |
| VTDVD/m2 (ml/m2) | 82,5 | 81,5 | 80,4 | 0,954 | 0,932 |
| VSVD (ml) | 93,6 | 89,1 | 92,9 | 0,979 | 0,986 |
| VTSVD/m2 (ml/m2) | 48,5 | 46,2 | 48,1 | 0,979 | 0,986 |
| Grosor (mm) | 12,9 | 12,8 | 12,6 | 0,981 | 0,988 |
CCI: coeficiente de correlación intraclase; CS: compressed sensing (detección comprimida); FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; SSFP: steady-state free precession; VSVD: volumen sistólico del ventrículo derecho; VSVI: volumen sistólico del ventrículo izquierdo; VTDVD: volumen telediastólico del ventrículo derecho; VTDVI: volumen telediastólico del ventrículo izquierdo.
El análisis de Bland-Altman y la regresión lineal, tanto intraobservador como interobservador, mostraron una correlación excelente para todos los parámetros (figs. 3 y 4.
Gráficos de correlación de Bland y Altman de la cuantificación entre los valores medios del CS de los dos observadores y el SSFP convencional como referencia, respecto a los siguientes datos: fracción de eyección del ventrículo izquierdo (FEVI), fracción de eyección del ventrículo derecho (FEVD), volumen telediastólico del ventrículo izquierdo (VTDVI), volumen sistólico del ventrículo izquierdo (VSVI), volumen telediastólico del ventrículo derecho (VTDVD) y volumen sistólico del ventrículo derecho (VSVD).
Gráficos de regresión lineal para el análisis de la correlación de la cuantificación entre los valores medios del CS de los dos observadores y el SSFP convencional como referencia, con intervalos de confianza (IC), respecto a los siguientes datos: fracción de eyección del ventrículo izquierdo (FEVI), fracción de eyección del ventrículo derecho (FEVD), volumen telediastólico del ventrículo izquierdo (VTDVI), volumen sistólico del ventrículo izquierdo (VSVI), volumen telediastólico del ventrículo derecho (VTDVD) y volumen sistólico del ventrículo derecho (VSVD).
La duración media de las imágenes cine del EC con CS fue inferior a 40 segundos en dos apneas; en cambio, en las secuencias convencionales la adquisición duró entre 6 y 8 minutos, en 12-15 apneas (una apnea por corte, para incluir todo el volumen ventricular).
La duración media de adquisición del estudio, excluidas las secuencias convencionales utilizadas como método de referencia estándar, fue de 15±3 minutos.
Se utilizó una media de 12±2 apneas para completar el estudio, incluidas las secuencias de exploración iniciales, sin tener en cuenta las secuencias de referencia convencionales.
Todas las adquisiciones realizadas con ambas secuencias se calificaron como diagnósticas. La calidad media de las imágenes fue buena, con una media de 3,2 para el cine CS y de 3,4 para el cine convencional, sin diferencias estadísticamente significativas (p=0,34). En cuanto al SSFP convencional: el 22% de los pacientes recibieron una calificación de 4, el 62%, de 3 y el 16%, de 2. En cuanto a las imágenes cine con CS: el 19% recibieron una calificación de 4, el 59%, de 3 y el 22%, de 2. La concordancia entre lectores respecto a la calidad subjetiva de la imagen fue casi excelente para ambas técnicas (SSFP convencional κ=0,842, CS κ=0,857) (fig. 5).
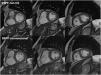
Ejemplo de imágenes de precesión libre en estado estacionario (SSFP) en cine con secuencias compressed sensing (CS) en fin de diástole (fila superior) en eje corto basal, medio y apical (de izquierda a derecha), frente a imágenes homólogas SSFP convencionales (fila inferior). Nótese que la resolución espacial, la resolución de contraste y la calidad de imagen de ambas filas son similares.
Se repitieron una media de 1,3 apneas por estudio por artefactos respiratorios en la exploración SSFP convencional, frente a 0,4 apneas en la exploración CS (p<0,001).
DiscusiónNuestro estudio demuestra la viabilidad de las secuencias cine con aceleración CS para evaluar la anatomía, la función y el volumen ventriculares en la práctica clínica, mostrando resultados similares a los de las secuencias convencionales, con una elevada concordancia intraobservador e interobservador. Las imágenes CS muestran una buena calidad, similar a la de las secuencias convencionales. Estas secuencias aceleradas facilitan el desarrollo de protocolos rápidos de RMC que pueden mejorar la disponibilidad de los equipos y reducir costes.
Nuestra estrategia está en consonancia con los recientes esfuerzos de diferentes sociedades y grupos de imagen cardiaca por simplificar los estudios de RMC y hacer de esta modalidad de imagen un pilar central y generalizado del diagnóstico de los pacientes con patología cardiovascular12,20–22.
Nuestros hallazgos son coherentes con trabajos recientes sobre técnicas de aceleración con CS para la evaluación ventricular16,23–27. Todos ellos avalan la utilidad de estas adquisiciones tras obtener resultados con una buena reproducibilidad y una calidad de imagen similar a la nuestra. En concreto, Vermersch et al., hallaron que las secuencias CS en tiempo real proporcionan mediciones fiables tanto del ventrículo izquierdo como del derecho con una alta fiabilidad interobservador e intraobservador16.
Además, a diferencia de algunos estudios de investigación anteriores que evaluaban estas secuencias, empleamos una adquisición retrospectiva sin tiempo real, que reproduce y se asemeja al esquema de nuestras secuencias SSFP convencionales utilizadas habitualmente en la práctica clínica.
Sin embargo, no basta con disponer de adquisiciones de imágenes rápidas y de alta calidad. También es necesario integrarlas en protocolos estandarizados y homogéneos que permitan realizar exámenes eficaces. Hasta donde sabemos, este es el primer estudio que describe un protocolo de RMC rápida con introducción temprana de contraste IV y adquisición de secuencias cine en el intervalo de tiempo hasta el estado de equilibrio necesario para la evaluación del RTG. Mejorar la accesibilidad a la RMC implica no solo disponer de secuencias rápidas, sino también desarrollar protocolos que aprovechen esa velocidad.
Nuestro estudio evalúa la aceleración CS con una adquisición retrospectiva en pacientes de la práctica clínica diaria, con un escáner de 1,5 T y con imágenes de reconstrucción casi en tiempo real que no interfieren con el flujo de trabajo normal. Esto significa que no es necesario un cambio de paradigma para implantar secuencias con aceleración, sino que, con equipos convencionales, una RMC estándar puede completarse en unos 15 minutos.
Las secuencias cine CS evitan la necesidad de una apnea de unos 8-15 segundos por corte, multiplicada por unos 12-15 cortes para cubrir todo el volumen ventricular; en nuestro caso requirió únicamente dos apneas.
Además, el uso de la aceleración CS en las secuencias reduce la variabilidad temporal al principio de las secuencias RTG. Esto simplifica la necesidad de calcular el tiempo de inversión óptimo (Look-Locker), lo que permite anular de forma satisfactoria la señal miocárdica en la mayoría de los estudios que utilizan un tiempo de inversión predefinido. Utilizamos secuencias 2D RTG PSIR SSFP con corrección de movimiento o motion-corrected (MoCo), que amortiguan la heterogeneidad de la saturación miocárdica hasta desviaciones de 100 ms del tiempo de inversión óptimo y se adquieren en respiración libre, evitando los artefactos respiratorios debidos a la fatiga del paciente al final de la prueba28–30.
Aunque no hemos comparado la precisión en el cálculo del volumen auricular, como han hecho recientemente Altmann et al.31, suponemos que nuestros resultados podrían ser extrapolables, debido a la buena calidad de imagen y a la concordancia interobservador, en caso de que se requiera su cuantificación con secuencias CS aceleradas.
Este estudio tiene limitaciones. En primer lugar, utilizamos secuencias 2D que requieren una planificación precisa del eje cardiaco, y es posible que pronto se generalice el uso de secuencias 3D, si bien esta adquisición volumétrica apenas está extendida en la práctica clínica por el momento. Este dato avala la idea de que se puedan aplicar sin gran esfuerzo protocolos rápidos como el que presentamos en muchos centros de RMC. En segundo lugar, se excluyó a los pacientes arrítmicos y no cooperativos debido a la adquisición retrospectiva de nuestras secuencias de cine CS, pero se dispone de adquisiciones prospectivas y en tiempo real con CS que pueden ser útiles en estos pacientes y podrían evaluarse en futuros estudios. En tercer lugar, solo evaluamos la aceleración CS para la adquisición del EC, pero puede ser útil para secuencias cine de eje largo y con RTG en las circunstancias adecuadas.
En conclusión, nuestros resultados demuestran la viabilidad de las secuencias cine SSFP aceleradas con CS para evaluar con precisión la función, el volumen y la anatomía de ambos ventrículos, de forma comparable a las secuencias convencionales y con una alta calidad de imagen. También demuestran la posibilidad de incluir estas secuencias aceleradas en protocolos rápidos que mejoren la disponibilidad de la RMC y faciliten la accesibilidad y comodidad del paciente.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Autoría/colaboradoresROP: concepción, diseño, adquisición de datos, análisis e interpretación, redacción, aprobación definitiva.
NHA: concepción, diseño, revisión crítica, aprobación definitiva.
ACA: concepción, redacción y revisión crítica, aprobación definitiva.
DZS: concepción, adquisición de datos, interpretación y revisión crítica, aprobación definitiva.
SPF: análisis estadístico y revisión crítica, aprobación definitiva.
CDS: redacción y revisión crítica, aprobación definitiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Muchas gracias a todo el grupo de enfermeras, técnicos de imagen, asistentes y secretarias de la unidad de RM de Osatek Deusto, sin los cuales este trabajo no hubiese podido llevarse a cabo.