El plasma rico en plaquetas (PRP) es un preparado con fines terapéuticos cada vez más aceptado en diversas patologías musculoesqueléticas, debido a su teórico potencial para reparar tejidos con baja capacidad curativa. Se han realizado diversos ensayos clínicos aleatorizados que investigan la capacidad del PRP para la reparación de tendones, ligamentos, músculos y cartílago. Hasta la fecha existe evidencia 1A que apoya su uso para la epicondilitis lateral, la osteoartritis de rodilla, la fascitis plantar y tendinopatías del manguito rotador, y evidencia 1B en la tendinopatía del tendón rotuliano y la osteoartritis de cadera. Estudios retrospectivos, de cohortes y series de casos describen resultados prometedores del PRP para el tratamiento de otras patologías musculoesqueléticas.
Al ser sus efectos secundarios menores que los de los grupos controles hacen que sea un tratamiento considerado como prácticamente inocuo y cada vez más usado. Son necesarios nuevos ensayos clínicos aleatorizados para establecer futuras indicaciones y confirmar su efectividad y seguridad.
Platelet-rich plasma (PRP) is a preparation for therapeutic purposes that is increasingly accepted for various musculoskeletal disorders, due to its theoretical potential to repair tissues with poor healing capacity. Several randomised clinical trials have investigated the capacity of PRP to repair tendons, ligaments, muscles and cartilage, and to date there is level 1a evidence to support its use for lateral epicondylitis, osteoarthritis of the knee, plantar fasciitis and rotator cuff tendinopathy; and level 1b for patellar tendinopathy and osteoarthritis of the hip. Retrospective cohort studies and case series describe promising results with PRP for treating other musculoskeletal disorders.
Since its side effects are fewer than those of the control groups, the treatment is considered practically harmless and is being increasingly used. Further randomised clinical trials are necessary to establish future indications, and to confirm effectiveness and safety.
El plasma rico en plaquetas (PRP) es un preparado con fines terapéuticos cada vez más aceptado para el tratamiento de diversas patologías musculoesqueléticas debido a su teórico potencial para reparar tejidos con baja capacidad curativa1 y a su aparente inocuidad.
Desde sus comienzos en las décadas de 1980 y 1990 con sus aplicaciones en cirugía cardíaca y maxilofacial2, ha experimentado un gran auge en los últimos años debido a su uso en el mundo de la práctica deportiva de alto nivel para el tratamiento de lesiones tendinosas, musculares, ligamentosas y cartilaginosas1–3.
El PRP se define como una preparación de plasma con concentración de plaquetas mayor que la que se encuentra en el torrente sanguíneo de una persona sana (200.000 por microlitro)1,4,5 y que por lo general se ha definido como cinco veces mayor6. La función de las plaquetas es la de ser iniciadoras de la cascada inflamatoria que permita la presencia de factores de crecimiento tisulares que medien la reparación del tejido.
Revisaremos los fundamentos biológicos del PRP, sus aplicaciones en la patología musculoesquelética y sus evidencias actuales.
Revisión Del TemaFundamento del plasma rico en plaquetasPor lo general, el proceso de reparación de un tejido pasa por tres fases: inflamación, proliferación y remodelado. La progresión dentro de estas fases está mediada por citocinas y factores de crecimiento. En algunos tejidos, como los ligamentos o tendones, el proceso reparativo es muy lento por el limitado aporte sanguíneo que presentan y por su bajo recambio celular6.
La función del PRP se debe a la presencia de factores de crecimiento y citocinas localizados en el interior de los gránulos alfa de las plaquetas, los cuales actúan en el proceso de reparación del tejido y pueden ser administrados de forma local en tejidos con limitado aporte sanguíneo1–3.
Además de las plaquetas, el PRP contiene otros componentes como los leucocitos. Aunque tienen un papel en la reparación del tejido y disminuyen el riesgo de infección local, presentan agentes inflamatorios e inmunológicos que pueden ser contraproducentes. Estudios in vitro han demostrado la existencia de un ambiente inflamatorio, con el uso de altas concentraciones de elementos de la serie blanca, que va en detrimento del proceso de curación1,2,7–10.
El PRP, con centrifugaciones adecuadas, no debe contener hematíes. Durante la fase de estrés oxidativo, el hierro contenido en el grupo hemo puede generar radicales libres que induzcan daño celular. Esta premisa sugiere que debería evitarse o reducirse la presencia de eritrocitos en las preparaciones de PRP2,8,11–13.
Preparación del plasma rico en plaquetasClásicamente se obtiene tras la centrifugación (y de forma menos frecuente tras plasmaféresis) de sangre autóloga obtenida del torrente sanguíneo del paciente tras extracción venosa en volúmenes variables y con presencia de anticoagulante en la jeringa o en el sistema de extracción. La preparación puede realizarse en el laboratorio, en la sala de operaciones, en sala clínica o de radiología, con una centrifugadora adecuada14,15.
Los distintos protocolos de preparación del PRP son algunas de las razones que puede explicar la variabilidad de resultados obtenidos en los distintos ensayos clínicos. Una revisión sistemática reciente de Chahla et al.14, con el fin de estandarizar la preparación del plasma, evidenció una mediana de 51 ml de sangre extraída del placiente, en todos los casos con anticoagulante (mayoritariamente una solución de citrato dextrosa). Se emplearon hasta 24 dispositivos comercializados de centrifugación o plasmaféresis y los más usados fueron los kits de centrifugación GPS (Biomet®) y Magellan Autologous Platelet Separator System (Arteriocyte®), los cuales están incluidos entre los de alto rendimiento por su mayor concentración de plaquetas16. En la mayoría de los artículos se describió una única centrifugación a 3200rpm durante 15 minutos. Cuando se realizó una segunda centrifugación, la mediana fue de 3300rpm durante 10 minutos.
Otro trabajo reciente15, que comparaba distintos métodos de centrifugación a temperatura ambiente, estableció que a pesar de no existir diferencias estadísticamente significativas en la cantidad de componentes del plasma, las muestras que fueron centrifugadas dos veces consecutivas a 160 xg (fuerza g o centrífuga) durante 10 minutos y 250 xg durante 15 minutos, con extracción de la capa leucocitaria, mostraron plaquetas y factores de crecimiento con mejor preservación de sus funciones y condiciones.
Parecen, por tanto, factores determinantes de la mayor calidad del plasma el número de centrifugaciones (la tendencia actual parece ser de dos consecutivas), altas revoluciones (al menos 3200rpm) y altas fuerzas g (rpm por el radio del rotor en milímetros).
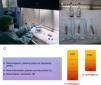
Tras la centrifugación en torno a 3200rpm durante 15 minutos, la sangre extraída se separa en tres niveles2,3. Tras desechar el nivel inferior, una segunda centrifugación obtendrá un plasma más concentrado en una cantidad de aproximadamente el 10% de la extracción inicial (2-3 ml) (fig. 1).
A) Una vez realizada la segunda centrifugación, se procede a la obtención del plasma rico en plaquetas (PRP) en condiciones de esterilidad. B) Después, se introduce en jeringas para su posterior administración y queda preparado para su inyección en bolsas estériles. C) Esquema de obtención del PRP a partir del plasma pobre en plaquetas (PPP), tras dos centrifugaciones.
Una vez obtenido el plasma, puede activarse con sustancias como el cloruro cálcico o la trombina, según su utilidad futura. Cuando se destina a tratar lesiones de partes blandas, la mayoría de los autores no consideran necesaria la activación, debido a que esta se produce in situ al contacto con el colágeno tendinoso (en especial tras la fenestración del tendón con la aguja) o con el propio coágulo de la rotura fibrilar. Se prefiere la forma activada cuando se administra intraarticular o como osteointegrador. En este último caso, además, facilita su aplicación, pues la activación le confiere más consistencia2,3.
En caso de no utilizarse en el momento de la preparación, el PRP puede mantenerse congelado en un medio estéril hasta su uso.
La literatura científica, a pesar del bajo consenso, sugiere como requisitos básicos2,17:
- •
Plaquetas en concentración 4-6 veces superior a la de la sangre.
- •
Leucocitos ausentes o por debajo de 1000/ml.
- •
Eritrocitos igual o menor de 1000/ml.
En los últimos años ha tenido un gran auge el uso del PRP y hemoderivados para el tratamiento de lesiones deportivas musculares, tendinosas y ligamentosas.
Una revisión Cochrane de 201417, que incluía estudios controlados aleatorizados, reveló baja evidencia en la mejora del dolor y la función. En general, los resultados únicamente mostraron una leve mejoría del dolor a corto plazo sin beneficio en la función. Fueron estudios poco comparables debido a su heterogeneidad y con dificultad para obtener conclusiones claras.
Otros estudios no aleatorizados ni controlados han mostrado disparidad de resultados.
Las indicaciones más antiguas con evidencia en ensayos clínicos aleatorizados son la epicondilitis y la osteoartritis de rodilla. Recientemente se han sumado como nuevas indicaciones con suficiente evidencia: la fascitis plantar, la tendinopatía del manguito de los rotadores, la del tendón rotuliano y la osteoartritis de cadera (tabla 1)18–23.
Evidencias relevantes de las indicaciones actuales. Prefiero no añadirlo yo ya que no sé el formato de letra
| Autor, revista y año | Patología | Estudio | Muestra | Técnica de inyección | Dosis de PRP | Conclusiones |
|---|---|---|---|---|---|---|
| Peerboms JC. Am J Sports Med. 2010 | Epicondilitis | Ensayo clínico aleatorizado, controlado con corticoide | 100 (51 PRP y 49 corticoides) | Sin guía de imagen. Inyección peritendón e intratendón tras perforaciones (5) | 3ml (1 dosis) | PRP superior a corticoide en mejoría del dolor. Efecto del corticoide más inmediato |
| Dragoo JL. Am J Sports Med. 2014 | Tendinopatía rotuliana | Ensayo clínico aleatorizado, doble ciego, controlado con punción seca | 23 (13 punción seca y 10 PRP) | Ecográfica. Inyección intratendón tras perforaciones (10) | 6ml (PRP rico en leucocitos) (1 dosis) | PRP+terapia física es superior a la punción seca más terapia física a las 12 semanas. A largo plazo, sin diferencias |
| Shams A. Eur Orthop Surg Traumatol. 2016 | Rotura parcial del manguito de los rotadores | Ensayo clínico aleatorizado controlado con corticoide | 40 (20 PRP y 20 corticoides) | Sin guía de imagen. No se describe la técnica de inyección | 2-2,5ml (1 dosis) | Mejoría del dolor comparable al corticoide incluso superior a los 3 meses |
| Monto RR. Foot Ankle Int. 2014 | Fascitis plantar grave | Ensayo clínico aleatorizado controlado con corticoide | 40 (20 PRP y 20 corticoides) | Guía ecográfica. Inyección intrafascial | 3ml (1 dosis) | Superioridad del PRP frente al corticoide en mejoría del dolor y duración del efecto |
| Kon E. Arthroscopy. 2011 | Osteoartritis de rodilla | Ensayo clínico multicéntrico, aleatorización según centro, controlado con ácido hialurónico | 150 (50 PRP, 50 ácido hialurónico de alto peso molecular y 50 de bajo peso molecular | Sin guía de imagen. Inyección intraarticular | 5ml (3 dosis, una cada dos semanas) | Más eficacia del PRP frente al ácido hialurónico en términos de disminución del dolor y recuperación de la función articular |
| Dallari D. Am J Sports. 2016 | Osteoartritis de cadera | Ensayo clínico, aleatorizado, controlado con corticoide | 111 (44 PRP, 36 ácido hialurónico y 31 ácido hialurónico+PRP) | Guía ecográfica. Inyección intraarticular | 5ml (3 dosis, una por semana) | Superioridad del PRP en mejoría del dolor y la función frente al ácido hialurónico. La combinación de ambos no aportó más beneficio |
Desarrollaremos dichas evidencias en el apartado de patología.
ContraindicacionesA pesar de su teórica inocuidad, deben tenerse en cuenta algunas contraindicaciones antes de administrar PRP. No debe administrarse en pacientes con1–5,17:
- •
Infección activa.
- •
Uso de anticoagulantes y antiagregantes plaquetarios.
- •
Discrasias sanguíneas.
- •
Toma de inmunosupresores sistémicos.
Deben realizarse técnicas de imagen antes del procedimiento para confirmar el diagnóstico, y es muy recomendable usarlas, en especial la ecografía, como guía de punción. Puede ser también de utilidad la realización de un test previo, con infiltración de anestésico o anestésico con corticoide en el área sintomática para establecer de forma más precisa la indicación1,2.
En medicina deportiva se han planteado algunas indicaciones para su uso en tendinopatías y osteoartritis24:
- •
Duración del dolor mayor de 3 a 6 meses con intensidad superior a 4 en la escala visual analógica (EVA) de 0-10.
- •
Datos clínicos, imagen y procedimientos diagnósticos que confirmen la tendinopatía u osteoartritis.
- •
Síntomas resistentes a terapias conservadoras (modificación de la actividad, antiinflamatorios no esteroideos [AINE] y terapias físicas).
- •
Que el objetivo del paciente sea evitar la cirugía.
- •
Acortar el tiempo de vuelta a la actividad física.
- •
Disposición del paciente a varias inyecciones durante al menos 6 semanas.
Serán los siguientes:
- •
Consentimiento informado: en el que se informará de los riesgos (infección, hemorragia, lesiones tisulares), beneficios, tratamientos alternativos, etc.
- •
Medidas de asepsia: las comunes a procedimientos intervencionistas percutáneos guiados con ecografía.
- •
Informar de la posibilidad de aumento del dolor durante los primeros días tras el procedimiento. Especialmente en el caso de su aplicación en tendones y fascias, ya que se realizarán perforaciones de estos.
- •
Terapia física antes y después de la punción, ya que mejora el pronóstico.
- •
Evitar, en la medida de lo posible, los AINE durante 2 a 6 semanas tras el procedimiento, para que no interfieran en el proceso inflamatorio (se puede usar paracetamol como alternativa).
- •
El mejor momento para administrar PRP es entre 3 y 6 meses del inicio del dolor, con inyecciones repetidas en intervalos de 2 a 8 semanas.
- •
Hasta la fecha, los estudios realizados revelan resultados dispares entre la inyección única y múltiples inyecciones25,26. Algunos de los estudios de mayor relevancia indican la realización de una única inyección en tendinopatías y fascitis y tres inyecciones en osteoartritis (tabla 1).
Además de la ya mencionada osteoartritis de rodilla, existen otras entidades muy comunes en la práctica deportiva que pueden beneficiarse del uso del PRP, con mayor o menor evidencia científica hasta la fecha.
EpicondilitisEl codo de tenista es la patología en la que más se ha usado el PRP, con evidencia en la actualidad para su uso1,2,17,18,24. Estudios aleatorizados y controlados han demostrado su eficacia para mejorar la funcionabilidad, el dolor y la apariencia del tendón en técnicas de imagen frente a la inyección de esteroides, si bien en otros estudios la disminución del dolor a corto plazo ha sido mayor con los corticoides18,27–31. Algunos trabajos no encuentran diferencias significativas entre el uso del PRP y el suero salino32.
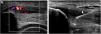
En las técnicas de imagen se aprecia engrosamiento del tendón común extensor, con hipoecogenicidad en ecografía e hiperintensidad de señal en resonancia magnética, disrupción fibrilar y neovascularidad en Doppler color. La imagen antes del tratamiento ayudará a confirmar el diagnóstico clínico y a establecer los hallazgos basales para monitorizar el tratamiento. La guía ecográfica permite alcanzar con más precisión la diana terapéutica1 (fig. 2).
Tendinopatía del tendón de AquilesEl fundamento para su aplicación es la tendencia a la cronicidad tras la aplicación de tratamientos no quirúrgicos. Los resultados en el tratamiento con PRP son variables:
- •
Varios estudios de series de casos, estudios piloto y estudios retrospectivos han demostrado resultados prometedores con mejora de la funcionalidad a los 4 años33–37.
- •
Otros estudios aleatorizados y controlados como los de De Vos et al. y Krogh et al., en los que se compara PRP frente a suero salino, no muestran una superioridad del plasma estadísticamente significativa38,39.
El PRP puede considerarse, por tanto, como un tratamiento de segunda línea en la tendinopatía del tendón de Aquiles tras el fracaso de los tratamientos conservadores40,41 (fig. 3).
Tendinopatía del tendón rotulianoHasta hace poco no existían estudios aleatorizados y controlados de calidad para indicar su uso sobre las terapias conservadoras, aunque podría utilizarse en casos resistentes al tratamiento42,43.
Un ensayo19 y un metanálisis reciente44 de ensayos aleatorizados determina que, aunque con evidencia limitada, el PRP es superior a otros tratamientos no quirúrgicos en la tendinopatía del tendón rotuliano (fig. 4).
Tendinopatía del manguito de los rotadoresAunque existen estudios con resultados dispares, cada vez existe más evidencia para su uso. Un metanálisis reciente de 201845 concluye que el PRP mejora la tasa de curación, niveles de dolor y función del hombro. Otros trabajos también muy recientes, consistentes en revisiones sistemáticas y metanálisis de ensayos clínicos46,47, presentan resultados favorables del PRP y necesidad de realizar futuros trabajos para evaluar el resto de hemoderivados.
Otras tendinopatíasNo existe evidencia en el tratamiento de otras tendinopatías, si bien es posible usarlo en casos resistentes a otros tratamientos como en la tendinopatía proximal de los isquiotibiales48 (fig. 5) o en la tendinopatía del tendón distal del bíceps49.
A) Tendinopatía del bíceps femoral/semitendinoso (flecha) resistente a todas las terapias conservadoras empleadas. B) Se administraron tres tandas de plasma rico en plaquetas intratendinoso con aguja espinal (flecha) con escasa mejoría del dolor en escala visual analógica, aunque mayor que con otros tratamientos.
En la actualidad no existe un tratamiento uniforme para la fascitis plantar, de ahí el gran número de trabajos existentes que evalúan el PRP para su tratamiento. La primera referencia del uso de PRP en la fascitis plantar data de 2004 y se trata del primer trabajo en el que se aplicó para el tratamiento de algún tipo de tendinopatía50.
Estudios posteriores han demostrado sus beneficios en la mejora del dolor, homogeneidad de la fascia y función:
- •
Dos trabajos de 2012, uno de Aksahin et al. (en el que se comparó el PRP y corticoides) y otro de Ragab et al. (sin grupo control), demostraron la utilidad del PRP (no superior a los corticoides), y recomendaron su uso dada la ausencia de efectos adversos51,52.
- •
Say et al.53 y Monto et al.21, con ensayos clínicos de 2014, controlados y aleatorizados, demostraron mayor efectividad del PRP que los corticoides en la mejoría del dolor y función de forma estadísticamente significativa.
- •
El estudio de Mahindra et al. de 2016 demostró que el PRP es tanto o más útil que los corticoides en comparación con el suero fisiológico evaluando el dolor y función a los 3 meses54.
- •
En el estudio de Acosta-Olivo et al., de 2016, controlado y aleatorizado, el PRP no mostró diferencias con corticoides55.
- •
El ensayo clínico de Vahdatpour et al., de 2016, que comparaba PRP y corticoides, mostró superioridad de manera significativa en el grupo de PRP con mejoría del dolor y la función, aunque sin diferencias en la ecografía de control56.
- •
La revisión sistemática de Chiew et al., de 2016, concluye que el PRP podría suponer una alternativa eficaz a las terapias conservadoras, sin evidencia de complicaciones ni efectos secundarios57.
- •
Los dos metanálisis y revisiones sistemáticas más recientes de 2017 concluyen que el PRP es superior a los corticoides, especialmente en la mejora del dolor a largo plazo58,59.
Es posible concluir, dada la existencia de varios ensayos clínicos que lo corroboran, la superioridad del PRP frente a los corticoides en el tratamiento de la fascitis plantar con un nivel de evidencia científica 1A. Por tanto, ante un fracaso de los tratamientos conservadores, puede optarse directamente por el PRP anteponiéndolo a los corticoides.
MúsculosBubnov et al. demostraron, de forma estadísticamente significativa, la utilidad de la inyección ecoguiada de PRP en lesiones musculares de los isquiosurales con mejoría en el dolor y la recuperación frente al grupo control60. Otros estudios más completos en isquiosurales, como el de Hamilton et al. y Guillodo et al., no mostraron beneficio61,62. El trabajo más reciente63 se trata de un ensayo clínico aleatorizado que compara la efectividad del PRP más rehabilitación frente a rehabilitación, en el tratamiento de roturas fibrilares musculares en atletas, con resultado favorable al grupo del PRP de forma estadísticamente significativa en términos de acortamiento de la convalecencia y vuelta a la actividad deportiva.
CartílagoVarios ensayos clínicos ya han demostrado la eficacia del PRP en la mejora funcional de la osteoartritis de rodilla22. Un metanálisis de 2017, de Dai et al., establece resultados favorables con la inyección intraarticular en rodilla de PRP frente a ácido hialurónico y suero salino (nivel de evidencia 1A)64. Otro metanálisis de 2017, de Shen et al., refiere que “las inyecciones intraarticulares de PRP probablemente son más eficaces en términos de mejora del dolor y de la función referida por el paciente a los 3, 6 y 12 meses, frente al placebo (suero salino), ozono, ácido hialurónico y corticoides”65.
En otras articulaciones como la cadera, la evidencia es más reciente, y existen ya ensayos clínicos, aunque no metanálisis, que demuestran la superioridad de la inyección intraarticular del PRP frente al ácido hialurónico23 en la mejoría del dolor y la función.
Además de las inyecciones intraarticulares, existen trabajos recientes, como los de Sánchez et al.66 y Fiz et al.67, en los que se investiga la infiltración intraósea del PRP en casos de osteoartritis graves de rodilla y cadera, los cuales, si bien no permiten establecer su indicación como tratamiento habitual, sí describen nuevas aplicaciones del PRP de forma combinada intraarticular e intraósea, aunque serán necesarios nuevos estudios que confirmen los beneficios de su administración.
Lesiones osteocondralesLa revisión de 2018 de Elghawy et al.68 refiere únicamente siete trabajos que evalúan la utilidad del PRP en este tipo de lesiones, y solo uno de ellos69 con abordaje percutáneo comparado con ácido hialurónico. No existe evidencia para su aplicación percutánea, por lo que deben administrarse en cualquier caso en su forma activada (más densa) para que el PRP quede en el foco de la aplicación (fig. 6).
Otras aplicacionesSi bien no hay gran evidencia para su uso, ya existen algunos ensayos clínicos de la aplicación percutánea de PRP para el tratamiento de roturas intrasustancia meniscales o en el síndrome facetario lumbar con su administración intraarticular70,71.
La administración de PRP en la plastia de ligamento cruzado anterior no es una técnica novedosa, ya que existen ensayos clínicos que datan de 200972; no obstante, revisiones sistemáticas recientes73 indican que puede ayudar a la maduración del injerto.
Técnica de inyecciónLa tendencia actual es a aplicar el PRP con guía de imagen, especialmente ecográfica. En articulaciones como la rodilla y la cadera debe administrarse de forma activada, y la técnica de inyección es similar a la de cualquier punción intraarticular. La cantidad de PRP a administrar, según los estudios de mayor relevancia, son 3 dosis de 5 ml cada una a intervalos de entre 1 y 2 semanas22,23. En otras estructuras como tendones y fascias se administra por lo general una sola dosis de 3 ml18–21.
En nuestro centro, en el caso de la administración de plasma no articular, tras las condiciones propias de asepsia de todo procedimiento ecoguiado, realizamos una infiltración local anestésica con mepivacaína al 2% a nivel peritendinoso o perifascial (4-5 ml). En algunos casos, como las inyecciones de la fascia plantar, es posible realizar un bloqueo anestésico del nervio tibial posterior. Posteriormente, con agujas de calibre 21-23 G introducimos aproximadamente 1 ml de PRP peritendinoso, para posteriormente realizar entre 4 y 5 punciones del tendón con el fin de estimular el proceso reparativo y activar el PRP con el colágeno tendinoso o con el coágulo resultante de la propia fenestración del tendón. Finalmente, introducimos el resto del plasma intratendinoso y profundo al tendón.
Cuidados postinyecciónExiste una guía publicada por el centro médico académico de la Universidad de Wisconsin donde se establecen una serie de recomendaciones tras la inyección de PRP intratendinoso desde el primer día hasta las 6-8 semanas posprocedimiento74. Como resumen cabe destacar:
- •
Inmovilización del tendón afectado con vendaje o cabestrillo en los días 0-3 y analgesia evitando AINE durante aproximadamente 2-6 semanas.
- •
Aumentar de forma progresiva la actividad física.
El PRP es preparado con fines terapéuticos para la reparación de tejidos con bajo aporte sanguíneo. En la actualidad existe evidencia 1A (revisiones sistemáticas de ensayos clínicos controlados) para el uso de PRP en la osteoartritis de rodilla, epicondilitis, tendinopatía del manguito de los rotadores y fascitis plantar; y evidencia 1B para la tendinopatía de tendón rotuliano y la osteoartritis de cadera. Las técnicas de imagen son indispensables como paso previo para establecer el diagnóstico, valorar el estado basal, y como guía de punción y seguimiento.
Serán necesarios más estudios de calidad para establecer nuevas indicaciones.
Autoría- 1.
Responsable de la integridad del estudio: AMM
- 2.
Concepción del estudio: AMM, FRS y JGE.
- 3.
Diseño del estudio: AMM, FRS y JGE.
- 4.
Obtención de los datos: AMM, FRS y JGE.
- 5.
Búsqueda bibliográfica: AMM, FRS y JGE.
- 6.
Redacción del trabajo: AMM, FRS y JGE.
- 7.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AMM, FRS y JGE.
- 8.
Aprobación de la versión final: AMM, FRS y JGE.
Los autores declaran no tener ningún conflicto de intereses.