La neurocisticercosis es una parasitosis humana causada por las larvas de la Taenia solium, que es la que con mayor frecuencia afecta el sistema nervioso central. Esta infección es endémica en prácticamente todos los países en vías de desarrollo, pero debido a la globalización y a las migraciones humanas su frecuencia ha aumentado en países desarrollados como los de Europa Occidental.
Las manifestaciones clínicas más frecuentes son la epilepsia, signos neurológicos focales e hipertensión intracraneal.
Los hallazgos radiológicos dependen del estadio larvario de la Taenia solium, número y localización de los parásitos (parenquimatosa, subaracnoidea e intraventricular), así como de la respuesta inmune del huésped (edema, gliosis, aracnoiditis) y del desarrollo de lesiones secundarias (arteritis, infartos o hidrocefalia).
El diagnóstico de esta parasitosis debe establecerse en función de los hallazgos clínicos y radiológicos, especialmente en un contexto epidemiológico adecuado, con apoyo de la serología.
Neurocysticercosis, caused by the larvae of Taenia solium, is the parasitic infection that most commonly involves the central nervous system in humans. Neurocysticercosis is endemic in practically all developing countries, and owing to globalization and immigration it is becoming more common in developed countries like those in western Europe.
The most common clinical manifestations are epilepsy, focal neurologic signs, and intracranial hypertension.
The imaging findings depend on the larval stage of Taenia solium, on the number and location of the parasites (parenchymal, subarachnoid, or intraventricular), as well as on the host's immune response (edema, gliosis, arachnoiditis) and on the development of secondary lesions (arteritis, infarcts, or hydrocephalus).
The diagnosis of this parasitosis must be established on the basis of the clinical and radiological findings, especially in the appropriate epidemiological context, with the help of serological tests.
La cisticercosis es una enfermedad parasitaria causada por la larva de la Taenia solium. La enfermedad se desarrolla en los seres humanos después de la ingestión de huevos procedentes de las heces de un portador de la tenia (contaminación fecal-oral)1–3. La infección puede afectar cualquier órgano, pero los más frecuentemente comprometidos son el sistema nervioso central (parénquima, espacios subaracnoideos, ventrículos y la médula espinal), los ojos y los músculos1.
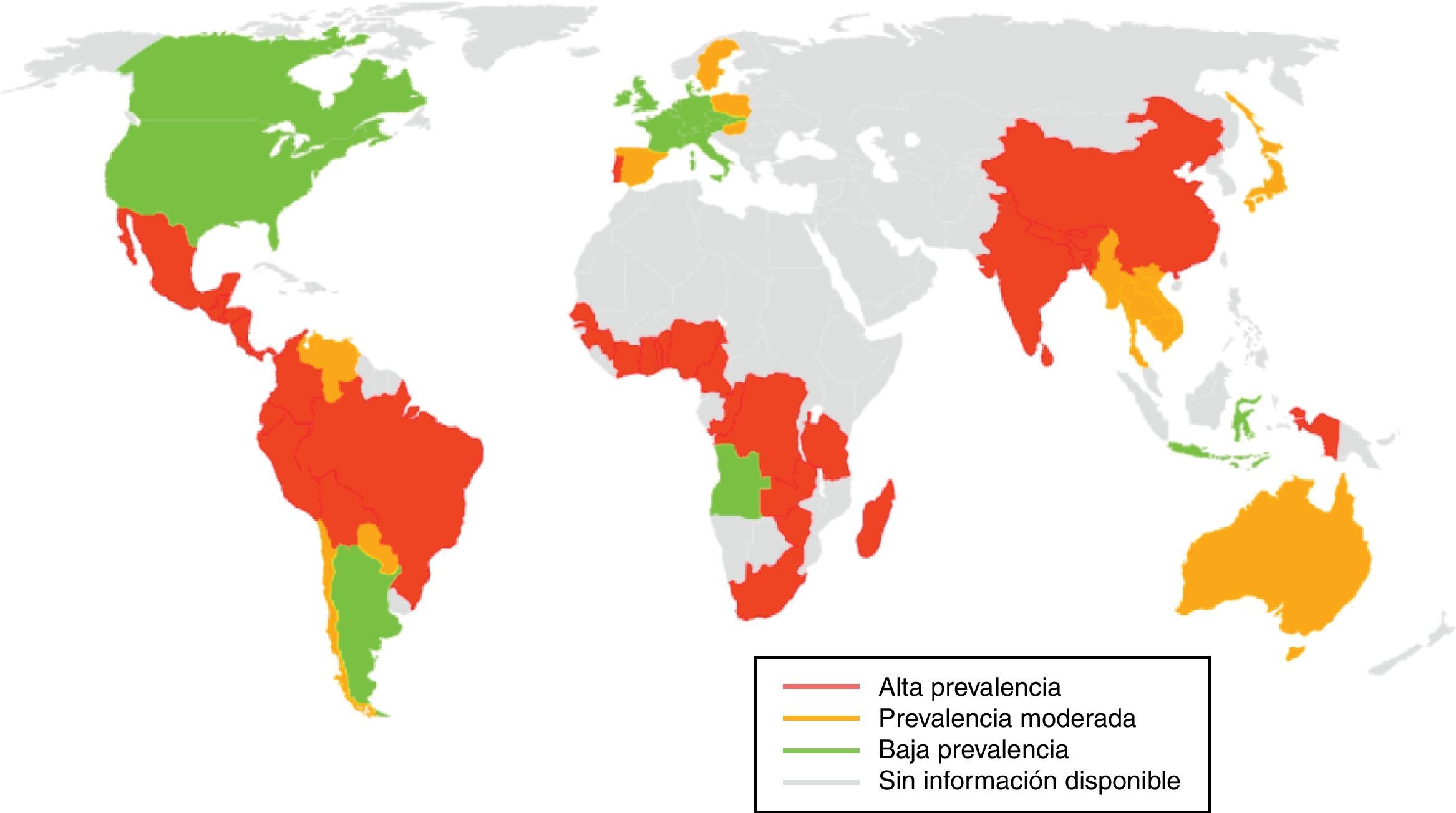
La cisticercosis es endémica en prácticamente todos los países en vías de desarrollo (Latinoamérica, Sudeste Asiático y África) con excepción de los países musulmanes, que no consumen cerdo (fig. 1). En los últimos años la incidencia de esta infección ha aumentado en los países desarrollados debido a la inmigración proveniente de las áreas endémicas2,3.
Epidemiología. La cisticercosis es endémica, principalmente en África, Asia y Sudamérica, favorecida por pobres condiciones socio-económicas (Fuente: modificado de Román et al.6).
En la actualidad, la neurocisticercosis representa la enfermedad parasitaria más frecuente del sistema nervioso central humano, es la causa más común de epilepsia adquirida en las zonas endémicas y un importante problema de salud pública en todo el mundo1–4. En 1993, el Grupo de Trabajo Internacional para la Erradicación de Enfermedades declaró a la cisticercosis como una entidad potencialmente erradicable, por lo que propuso que la neurocisticercosis fuese una enfermedad notificable5,6.
El objetivo de este artículo es actualizar los aspectos más importantes del diagnóstico radiológico de la neurocisticercosis, y, además, describir las características etiopatogénicas, la presentación clínica y el diagnóstico diferencial. También se hace una breve reseña sobre el tratamiento recomendado.
EtiopatogeniaLa Taenia solium es una de las 8 especies de cestodos que infectan a los humanos. Está compuesta por un escólex y un cuerpo con cientos de proglótides. El ciclo de vida de este parásito tiene 3 fases: huevo, larva y adulto1. El embrión hexacanto (quistes de larvas de paredes delgadas) mide 10-20mm de largo y contiene un escólex invaginado (cabeza de la larva). El quiste, que tiene una pared rica en glicoproteínas, contiene un líquido claro en esta etapa, que se enturbia tras la muerte del parásito1.
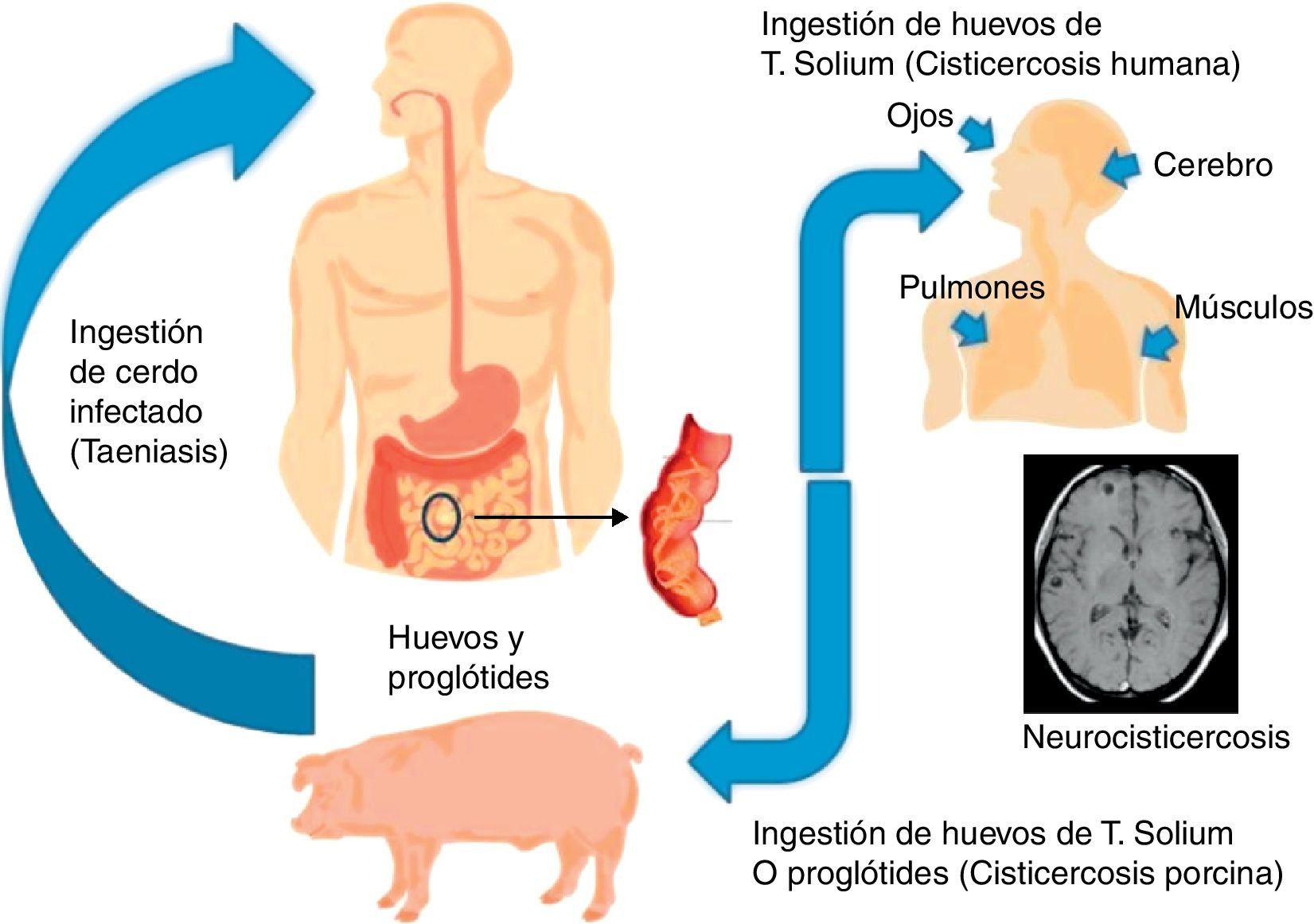
La Taenia adulta mide de 2 a 4 metros y vive en el intestino delgado de los humanos donde se adhiere a su pared mediante un escólex1–3. Diariamente, algunas proglótides cargadas con miles de huevecillos son expulsadas por las heces, y contaminan el agua y la tierra2. La siguiente etapa del ciclo de esta infección es la ingesta de estos huevecillos por los cerdos, que una vez alcanzan el intestino se transforman en oncosferas que entran en la circulación sanguínea para finalmente alojarse en los tejidos donde se transforman en larvas. La ingesta por los seres humanos de carne de cerdo contaminada, cruda o mal cocinada, permite que las larvas alcancen el intestino delgado, los escólex se adhieran a la pared intestinal y comiencen a formar proglótides. Finalmente, los humanos desarrollan cisticercosis cuando se convierten en huéspedes intermediarios de la Taenia solium al ingerir sus huevecillos1,2 (fig. 2).
Ciclo de vida de la Taenia solium. El ciclo comienza cuando se ingiere carne mal cocida o cruda con las larvas, estas alcanzan el intestino delgado y se adhieren a su pared. Diariamente, proglótides llenas de huevecillos son expulsadas por las heces y contaminan el agua y la tierra. Los animales como el cerdo consumen alimentos infectados por los huevecillos y en su intestino se terminan de desarrollar. Luego por medio de la sangre, llegan a los músculos del animal donde se transforman en larvas. Cuando esta carne es ingerida y no es cocida correctamente o bien se consume cruda, el hombre come los cisticercos y comienza nuevamente el ciclo de vida. Finalmente los humanos desarrollan cisticercosis cuando se convierten en huéspedes intermediarios de la Taenia solium al ingerir sus huevecillos.
La principal forma de contagio humano es la contaminación fecal-oral, a partir de individuos portadores de la Tenia. El hombre es el único huésped definitivo de la Taenia solium, mientras que tanto el hombre como el cerdo pueden ser huéspedes intermediarios1–3.
Formas de infección del cisticercoLos seres humanos pueden desarrollar 2 formas de la enfermedad: la teniasis y la cisticercosis. La teniasis es adquirida a través del consumo de carne de cerdo infectada con quistes, mientras que la cisticercosis se adquiere por la ingestión de huevos presentes en las heces de un portador de la Taenia.
En la teniasis la ingestión de tejidos infectados con larvas permite la formación del parásito adulto en el intestino del huésped definitivo (es decir, en los seres humanos) donde se producen y se descargan los huevos perpetuando el ciclo1.
Por el contrario, la cisticercosis se desarrolla por medio de contaminación fecal-oral. Los embriones infectados, nacidos de la ingestión de huevos, llegan a la circulación sistémica después de cruzar activamente la mucosa intestinal, aunque algunos se eliminan por el hígado1.
Los quistes se alojan en los capilares, principalmente del tejido muscular y cerebral, donde se convierten en quistes inmaduros y, hasta 3 meses después, en quistes con larvas. Estos quistes quedan protegidos frente al sistema inmunitario del huésped por la barrera hematoencefálica, por lo que no se produce respuesta inflamatoria, siempre y cuando la pared del quiste permanezca intacta7.
Cuando el parásito muere, ya sea de forma natural o como resultado de la terapia farmacológica, sobreviene una respuesta inflamatoria con desarrollo de edema seguida de calcificación1,7.
De esta manera, la Taenia solium puede causar enfermedad por cualquiera de los 3 mecanismos principales1,8:
- 1.
La presencia del parásito por sí mismo (efecto de masa u obstrucción).
- 2.
Por la respuesta inflamatoria (edema).
- 3.
Como consecuencia del desarrollo de secuelas (fibrosis, granulomas y calcificaciones).
La neurocisticercosis es una enfermedad pleomórfica debida a diferencias individuales en número, localización, tamaño y etapa de los parásitos, así como al grado de respuesta inflamatoria del huésped1,2,7,9.
La mayoría de los pacientes sintomáticos se presentan entre los 15-40 años de edad, sin predilección por el sexo o la raza1.
Los hallazgos clínicos más frecuentes incluyen la epilepsia, la hipertensión intracraneal, la encefalitis y la meningitis.
La epilepsia es la manifestación clínica más frecuente, presente en más del 70% de los casos. En las regiones endémicas la neurocisticercosis es la causa más frecuente de epilepsia de inicio tardío. Las crisis epilépticas son secundarias a la inflamación perilesional por la degeneración quística, aunque los infartos y vasculitis también pueden actuar como factores predisponentes. Los granulomas calcificados también pueden causar esta manifestación clínica1,8,10,11.
Las manifestaciones clínicas suelen tener un inicio lentamente progresivo, aunque también pueden aparecer de forma súbita, como en el caso de los infartos cerebrales secundarios a vasculitis2,12.
La hipertensión intracraneal se produce por 2 mecanismos: 1) hidrocefalia obstructiva por quistes intraventriculares, aracnoiditis o ependimitis granular; y 2) efecto de masa en los casos de quistes muy grandes1,2,13. Los pacientes con neurocisticercosis del IV ventrículo pueden presentar oclusión transitoria del acueducto de Silvio. Los síntomas y signos que esto produce se han agrupado en el denominado síndrome de Bruns, el cual se produce por una lesión móvil intraventricular generando una hidrocefalia obstructiva intermitente. Este síndrome se caracteriza por cefalea, papiledema y pérdida del conocimiento, con una recuperación rápida provocada por movimientos rotatorios de la cabeza9.
La encefalitis por cisticerco ocurre como consecuencia de una intensa reacción inflamatoria del huésped ante la invasión masiva de cisticercos del parénquima cerebral. Es más frecuente en mujeres jóvenes y niños, y se manifiesta con alteración de la conciencia, convulsiones, alteraciones visuales, cefaleas, vómitos y edema de papila1,13.
La invasión de los espacios subaracnoideos puede causar engrosamiento de las leptomeninges, si bien no suelen existir signos de irritación meníngea1. Cuando el engrosamiento leptomeníngeo afecta a la base del cráneo y la cara ventral del tronco cerebral, puede atrapar el quiasma óptico y los nervios craneales, provocando su parálisis o disfunción.
Hasta un 3-4% de los casos de neurocisticercosis pueden manifestarse como ictus, con una prevalencia del 3,4%14. Estos pueden corresponder a infartos lacunares o territoriales, ataques isquémicos transitorios y hemorragias cerebrales. Estas complicaciones pueden producirse por diferentes mecanismos, que incluyen la estenosis luminal debido al engrosamiento subintimal, el vasoespasmo debido a la arteritis de vasos perforantes y de mediano calibre, pseudoaneurismas inflamatorios y trombosis1,14–16.
El síndrome mesencefálico progresivo se produce como consecuencia de múltiples infartos que afectan el mesencéfalo y tálamo secundarios a la oclusión de las arterias perforantes con origen en la arteria basilar. Estos pacientes suelen tener una historia de hidrocefalia derivada secundaria a leptomeningitis difusa, con deterioro neurológico, somnolencia, paraparesia, alteración de la mirada vertical, pupilas fijas y dilatadas e incontinencia urinaria1,12.
El compromiso raquimedular se observa únicamente en un 1,5% de los casos. Con menor frecuencia, la leptomeningitis espinal puede manifestarse con radiculalgia asociada a debilidad muscular. La forma más común es la intradural-extramedular que se manifiesta habitualmente por un síndrome de sección medular17,18.
ClasificaciónEl cisticerco penetra en el sistema nervioso central a través del flujo sanguíneo, invadiendo inicialmente el espacio subaracnoideo, posteriormente el córtex cerebral y la unión córtico-yuxtacortical. Su aspecto macroscópico varía dependiendo de la localización en el neuroeje y del estadio de la enfermedad. Pueden coexistir diferentes estadios de evolución y localizaciones en un mismo paciente19.
La neurocisticercosis se puede clasificar basándose en la topografía y en el estadio evolutivo de las lesiones. En relación con la topografía, tradicionalmente se ha clasificado en cisticercos subaracnoideos, parenquimatosos, ventriculares y espinales, mientras que respecto al estadio evolutivo se clasifica en estadio no quístico, vesicular, vesicular-coloidal, nodular-granulomatoso y nodular-calcificado.
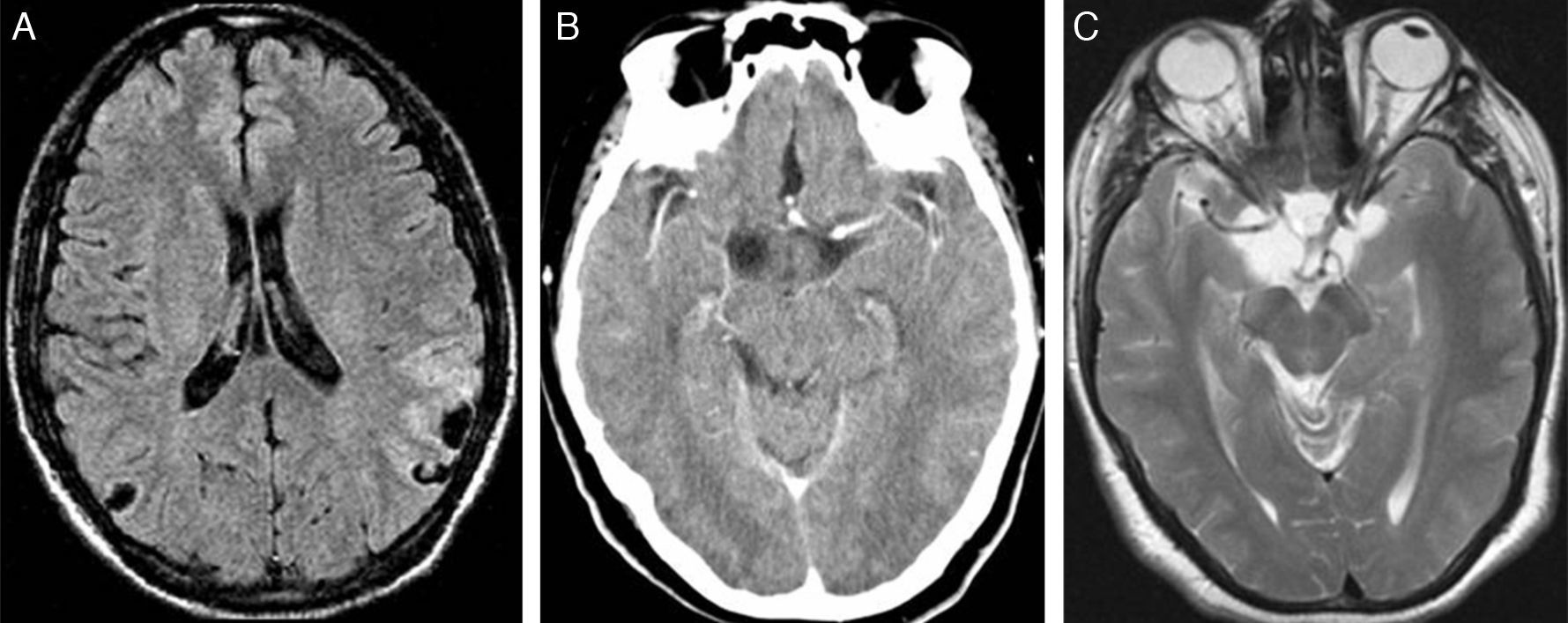
Clasificación topográficaCisticercos subaracnoideosLa localización subaracnoidea de la neurocisticercosis es la más frecuente. El parásito alcanza por vía hematógena las cisternas basales, espacios subaracnoideos y meninges, desencadenando una intensa reacción inflamatoria perilesional. Esta reacción inflamatoria puede afectar las leptomeninges en la base del cráneo y extenderse hasta el agujero magno, produciendo una leptomeningitis basilar que engloba nervios y arterias craneales. También se afectan los agujeros de Luschka y Magendie con hidrocefalia. Los cisticercos subaracnoideos pueden ser pequeños si se localizan en la profundidad de los surcos corticales o pueden alcanzar tamaños mayores de 5cm si están en las cisuras de Silvio o en las cisternas basales (fig. 3). Esta localización facilita una degeneración hidrópica por entrada continua de líquido cefalorraquídeo al interior de la vesícula. En esta situación puede producirse una falta de formación del pro-escólex o degeneración del escólex, forma denominada racemosa4,19.
Cisticercos subaracnoideos. Estudio de RM mediante secuencia FLAIR en el plano transversal (A), en la que se observan pequeños quistes en la profundidad de los surcos cerebrales biparietales. Lesiones quísticas en las cisternas basales. La TC con contraste (B) y la secuencia de RM potenciada en T2 (C), ambas en el plano transversal, muestran la ocupación de las cisternas basales por lesiones quísticas cuyo contenido es similar al líquido cefalorraquídeo.
La afección parenquimatosa es la segunda en frecuencia tras la aracnoidea. Los quistes se localizan preferentemente en la corteza cerebral y en los ganglios basales donde hay mayor irrigación vascular (fig. 4). Estos quistes son generalmente pequeños y raramente miden más de 10mm de diámetro, ya que la presión que ejerce el parénquima cerebral impide su crecimiento4. Las formas parenquimatosas incluyen diferentes fases evolutivas que van desde quistes viables (quistes con escólex) hasta sus fases evolutivas finales con calcificaciones.
Cisticercos parenquimatosos. TC con contraste (A) y RM con secuencias potenciadas en T2 (B) y T1 con gadolinio en el plano transversal (C). Se ven pequeñas lesiones quísticas corticales frontales derechas, con mínimo edema perilesional, realce anular y escólex visible en su interior (flecha).
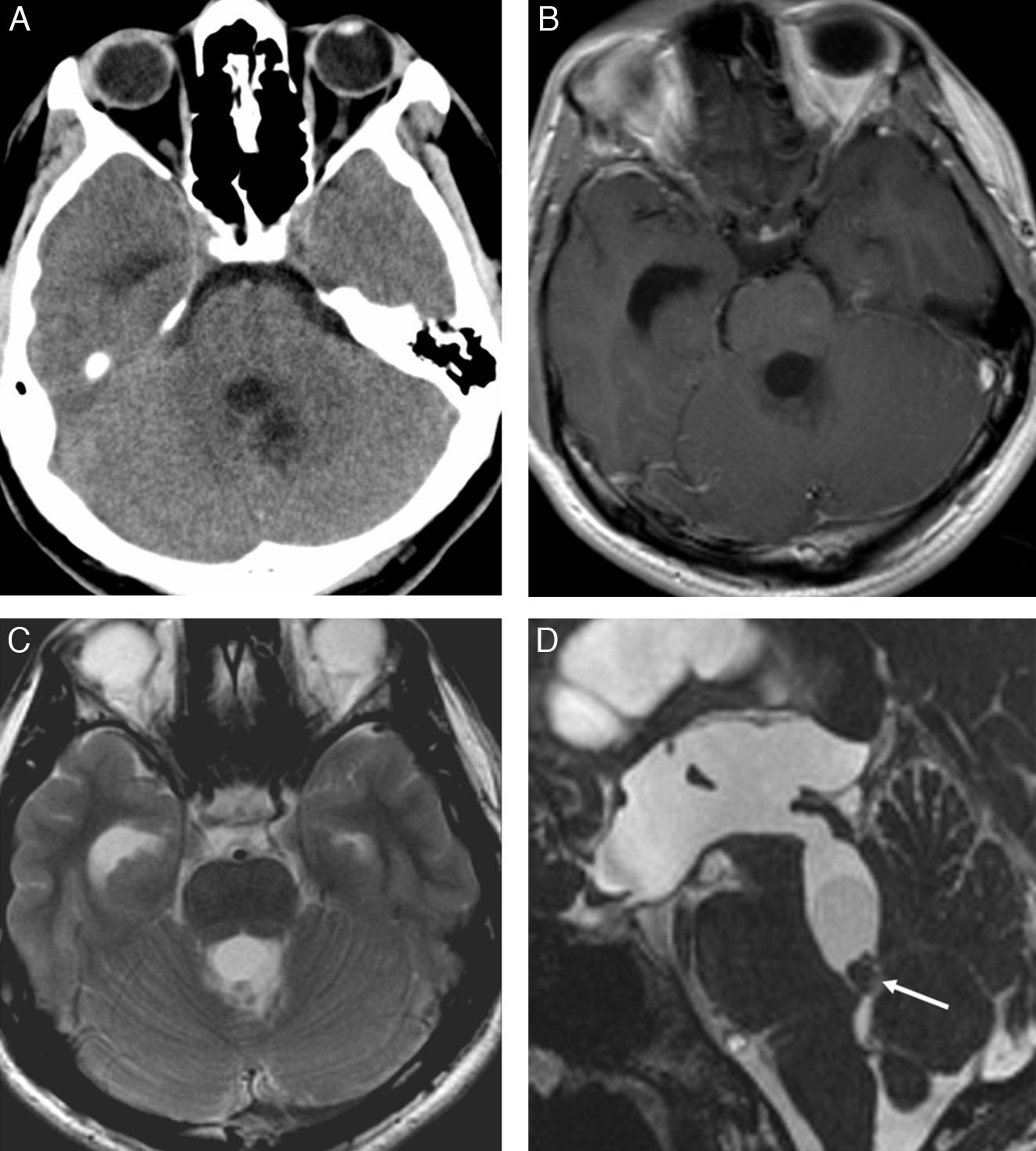
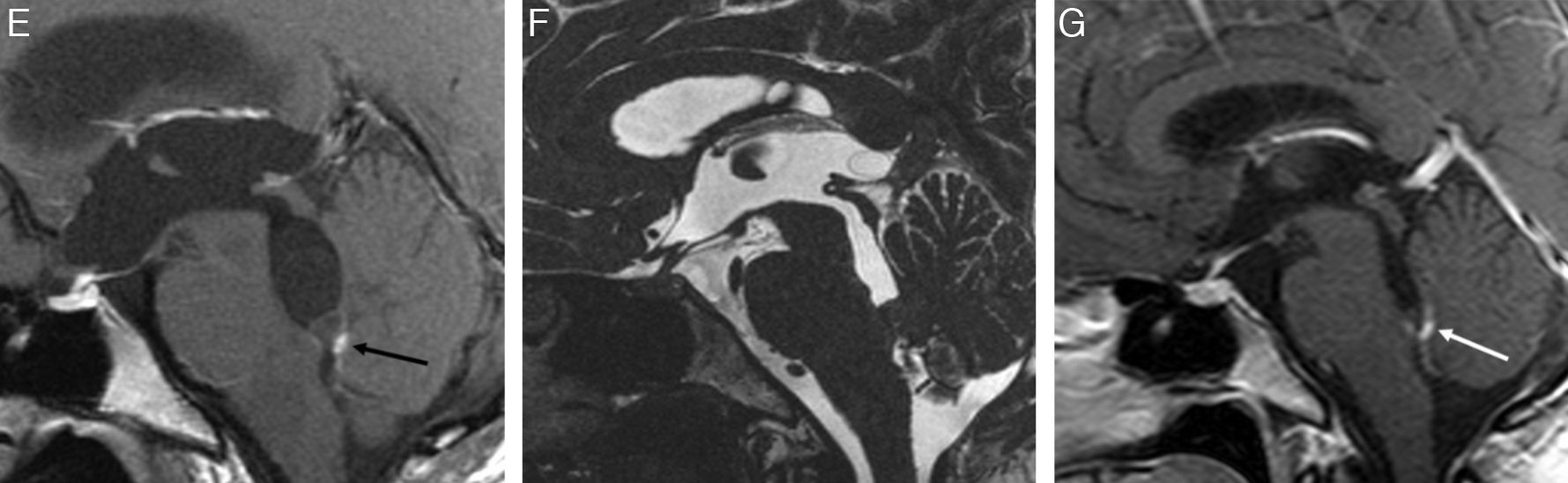
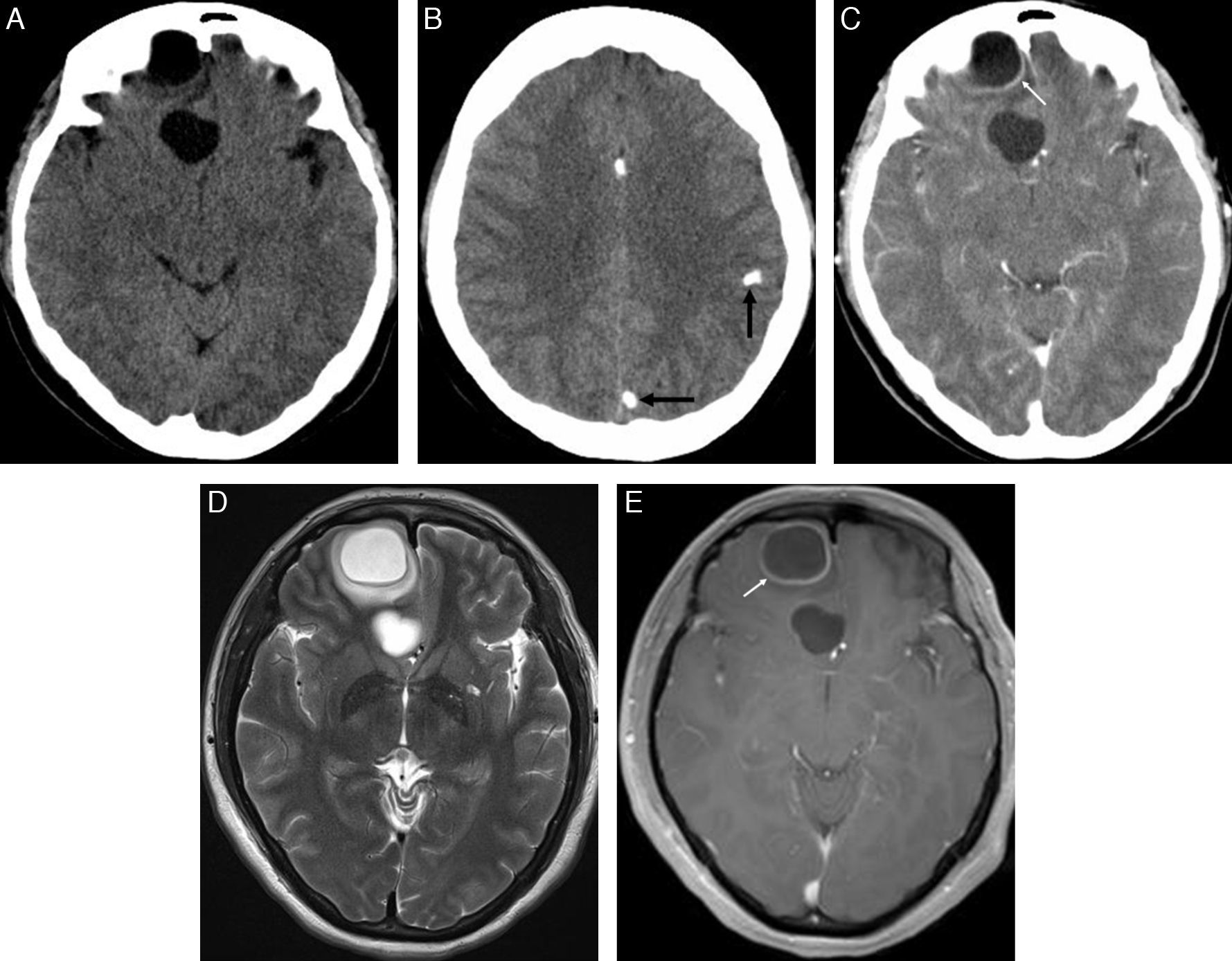
Los cisticercos intraventriculares representan menos del 33% de todos los casos de neurocisticercosis. Los quistes pueden adoptar tamaños variables y generalmente son únicos. El IV ventrículo es el más afectado (50%), seguido de los ventrículos laterales (35%) y, menos frecuentemente, el III ventrículo (10%) y el acueducto de Silvio (5%)1,20–22 (fig. 5). Los parásitos pueden estar adheridos a la capa ependimaria produciendo ventriculitis (ependimitis granular y gliosis subependimaria) o encontrarse flotando libremente en las cavidades ventriculares ocasionando obstrucción del líquido cefalorraquídeo. Cuando la obstrucción es continua, produce hidrocefalia, y cuando es intermitente, puede dar lugar al síndrome de Bruns.
Cisticerco intraventricular. Estudio de TC sin contraste (A), que muestra una lesión quística en el IV ventrículo. Imágenes de RM potenciadas en T1 con gadolinio (B) y en T2 (C) en el plano axial, así como secuencias en T2 de alta resolución (D) y T1 con gadolinio (E) en el plano sagital, que muestran una lesión quística intraventricular obstruyendo el IV ventrículo, con un nódulo mural inferior que realza con el gadolinio (flecha). Control de RM posterior al tratamiento anticesticida (F y G), que muestra disminución del tamaño de la lesión intraventricular, a la vez que persiste una mínima captación de gadolinio en el margen inferior del IV ventrículo (flecha). (Cortesía del Dr. Antoni Rovira, Corporació Sanitària Parc Taulí, Sabadell).
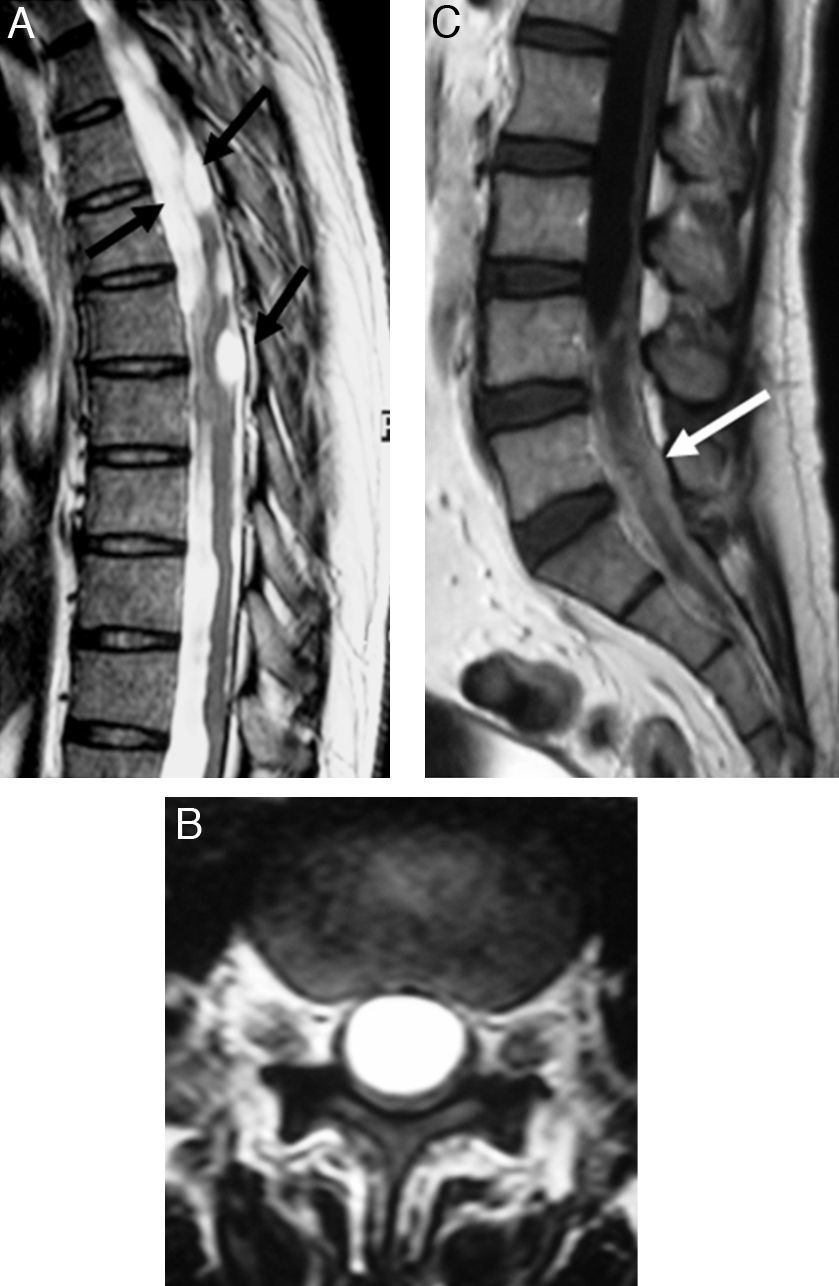
Los cisticercos espinales son excepcionales (1-3% de los casos). Se localizan en el espacio subaracnoideo que rodea la médula por diseminación de la larva a través del líquido cefalorraquídeo (fig. 6). Aún mas infrecuentes (menos del 1%) son las lesiones espinales intramedulares, que, en la mayoría de los casos, se localizan en su segmento dorsal23. El aspecto macroscópico de los cisticercos espinales es similar al de los quistes localizados en el cerebro20. Los quistes leptomeníngeos pueden moverse libremente en el espacio subaracnoideo y cambiar de posición durante el examen con los movimientos del paciente.
Afectación espinal por cisticercosis. Estudio de RM mediante secuencias potenciadas en T2 en el plano sagital de la columna dorsal (A), T2 axial de la columna lumbar (B) y T1 sagital con gadolinio de la columna lumbar (C), con múltiples quistes de diferentes tamaños, intradurales, intramedulares y extramedulares (flechas), que se localizan a lo largo del canal raquídeo en su segmento dorsal-lumbar, con reacción inflamatoria leptomeníngea asociada (flecha). (Cortesía de la Dra. Piedad Urueña, Instituto Neurológico de Antioquia, Medellín, Colombia).
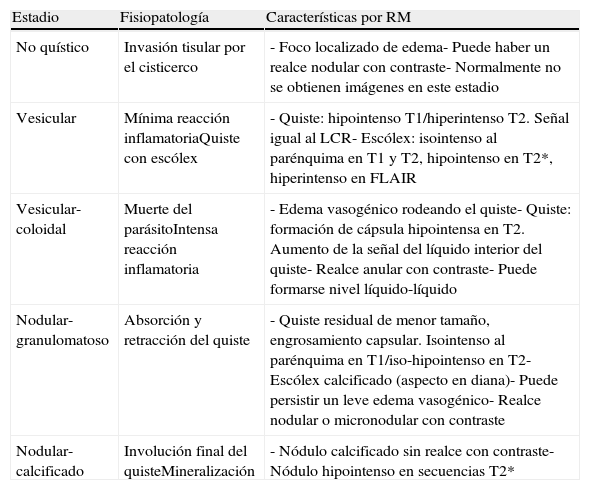
Según la fase evolutiva y los hallazgos radiológicos, la neurocisticercosis se divide en 5 estadios: no quístico, vesicular, vesicular-coloidal, nodular-granulomatoso y nodular-calcificado1 (tabla 1).
Estadios evolutivos de la neurocisticercosis
| Estadio | Fisiopatología | Características por RM |
| No quístico | Invasión tisular por el cisticerco | - Foco localizado de edema- Puede haber un realce nodular con contraste- Normalmente no se obtienen imágenes en este estadio |
| Vesicular | Mínima reacción inflamatoriaQuiste con escólex | - Quiste: hipointenso T1/hiperintenso T2. Señal igual al LCR- Escólex: isointenso al parénquima en T1 y T2, hipointenso en T2*, hiperintenso en FLAIR |
| Vesicular-coloidal | Muerte del parásitoIntensa reacción inflamatoria | - Edema vasogénico rodeando el quiste- Quiste: formación de cápsula hipointensa en T2. Aumento de la señal del líquido interior del quiste- Realce anular con contraste- Puede formarse nivel líquido-líquido |
| Nodular-granulomatoso | Absorción y retracción del quiste | - Quiste residual de menor tamaño, engrosamiento capsular. Isointenso al parénquima en T1/iso-hipointenso en T2- Escólex calcificado (aspecto en diana)- Puede persistir un leve edema vasogénico- Realce nodular o micronodular con contraste |
| Nodular-calcificado | Involución final del quisteMineralización | - Nódulo calcificado sin realce con contraste- Nódulo hipointenso en secuencias T2* |
LCR: líquido cefalorraquídeo.
Representa la invasión tisular por el cisticerco. Normalmente esta fase es asintomática, por lo cual generalmente no se obtienen estudios radiológicos. Si se realizan, se manifiesta como un foco localizado de edema, que puede asociarse a un realce nodular tras la administración de contraste, tanto en la TC como en la RM23.
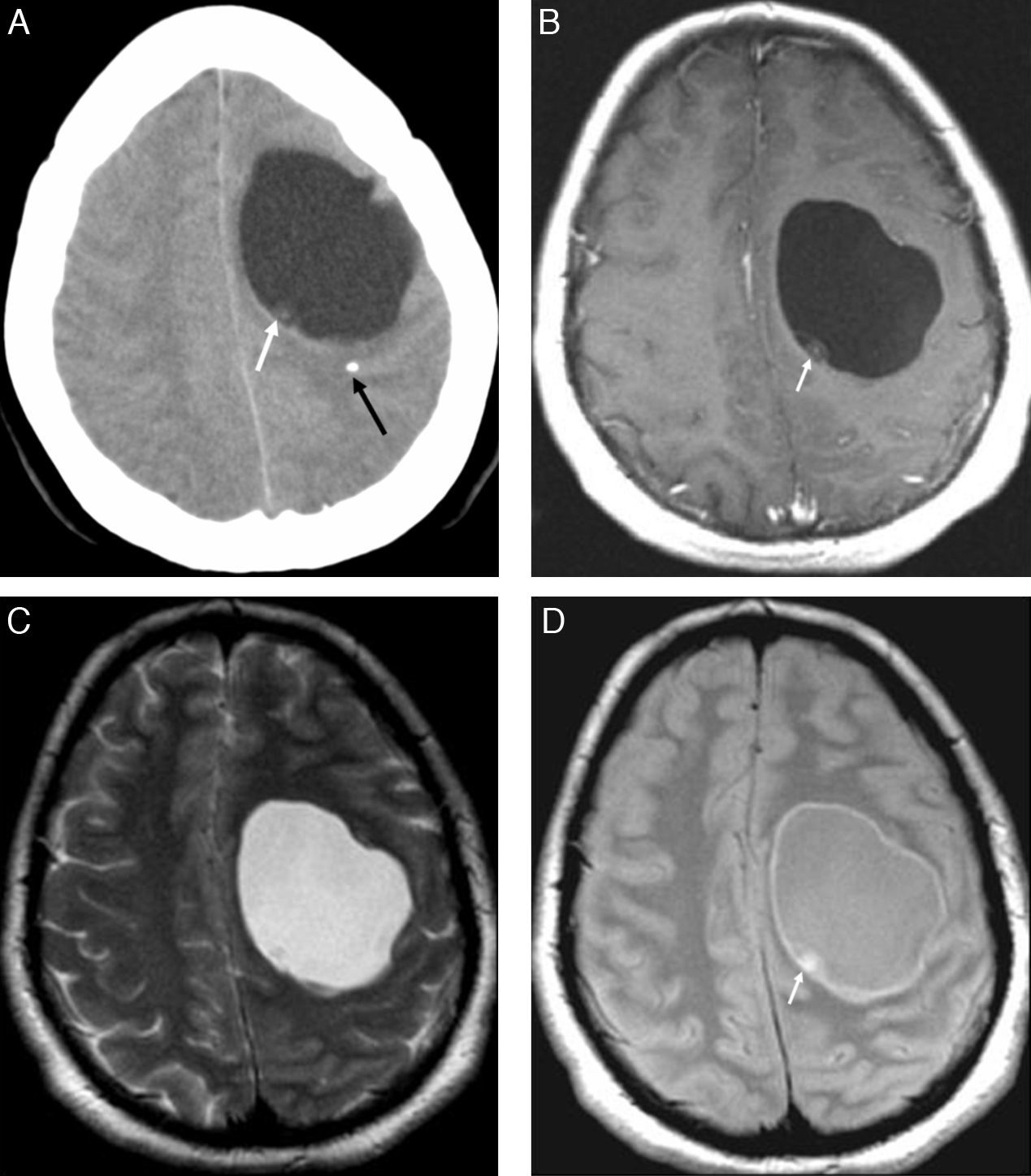
Estadio vesicularEl huésped presenta tolerancia inmune, por lo que solo hay una mínima reacción inflamatoria. El cisticerco se observa como un quiste redondeado con una cápsula fina que rodea a una larva viable y a su vesícula ocupada por líquido. En los estudios de RM el quiste tiene señal idéntica a la del líquido cefalorraquídeo, mide 5-20mm, y presenta un nódulo mural de 2-4mm que corresponde al escólex. Este aparece isointenso con respecto al parénquima cerebral en todas las secuencias y muestra realce con el contraste intravenoso24. El quiste frecuentemente se sitúa en la unión córtico-yuxtacortical o en los ganglios basales, cerebelo, mesencéfalo, cisternas o sistema ventricular (fig. 7).
Estadio vesicular. TC sin contraste (A) que muestra el escólex no calcificado (flecha blanca) y, adyacente al quiste, una pequeña calcificación parenquimatosa, estadio nodular-calcificado (flecha negra). RM: secuencias axiales potenciadas en T1 con gadolinio (B), T2 (C) y densidad de protones (D). La señal y la densidad del quiste son similares a las del líquido cefalorraquídeo. El escólex es hiperintenso en la secuencia de densidad de protones (flecha blanca) y no realza tras administrar medio de contraste intravenoso. No se observa reacción inflamatoria.
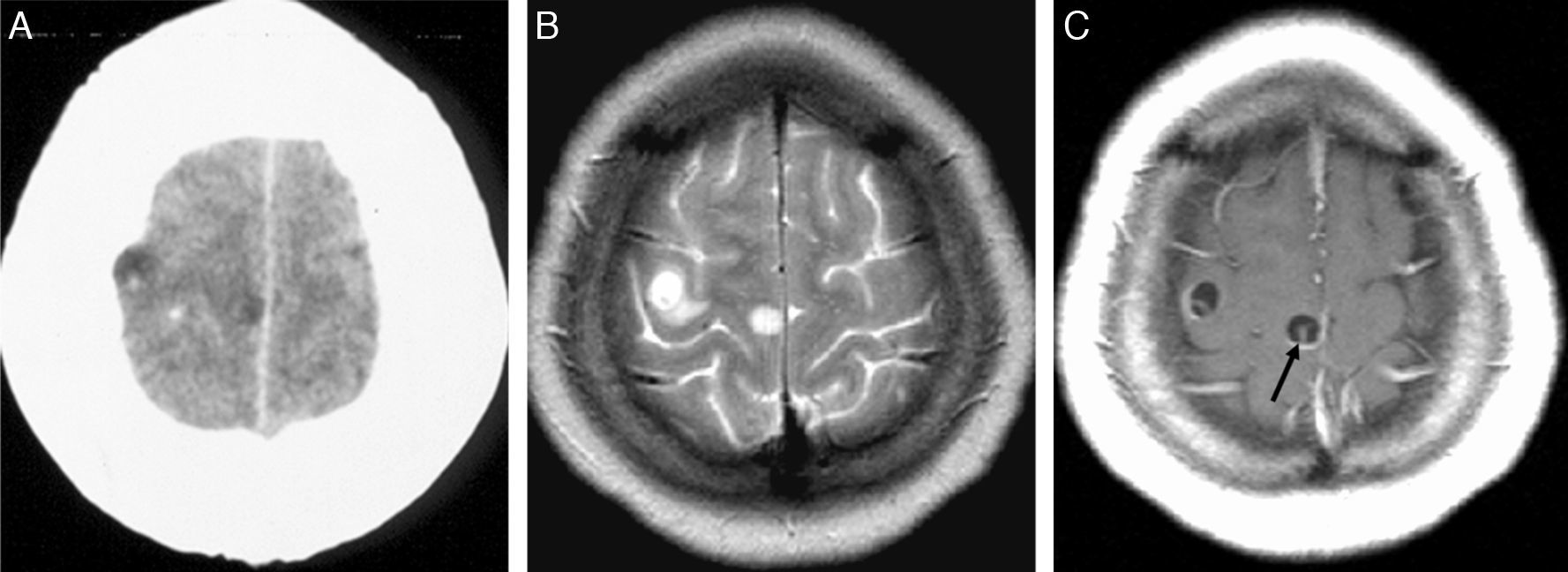
Este estadio se caracteriza por la muerte del parásito, que desencadena una reacción inflamatoria por liberación de productos metabólicos. Esta reacción inflamatoria condiciona un intenso edema perilesional y la formación de una cápsula que es hipointensa en las secuencias ponderadas en T21–7. Tras la administración de contraste se observa un realce anular de la pared en 2/3 de los casos. Como consecuencia de la muerte del escólex hay un aumento de la atenuación en la TC, y un aumento de la señal en secuencias de RM. Puede también observarse un nivel líquido-líquido. En este estadio el quiste comienza a retraerse (fig. 8).
Estadio vesicular-coloidal. TC sin contraste (A y B) y post-contraste (C), que muestra dos lesiones quísticas extraparenquimatosas en el lóbulo frontal derecho, que presentan realce anular tras la administración intravenosa de contraste (flecha blanca). En los cortes de la convexidad se observan nódulos calcificados (flechas negras). Imágenes de RM de una secuencia en el plano transversal potenciada en T2 (D) y secuencia potenciada en T1 con gadolinio en el mismo plano (E), en las que se aprecian 2 lesiones, la más anterior se encuentra en estadio vesicular-coloidal y la posterior en estadio vesicular. La lesión en estadio vesicular-coloidal presenta un halo periférico hipointenso en T2 y edema periférico perilesional. Tras administrar medio de contraste se observa un realce anular.
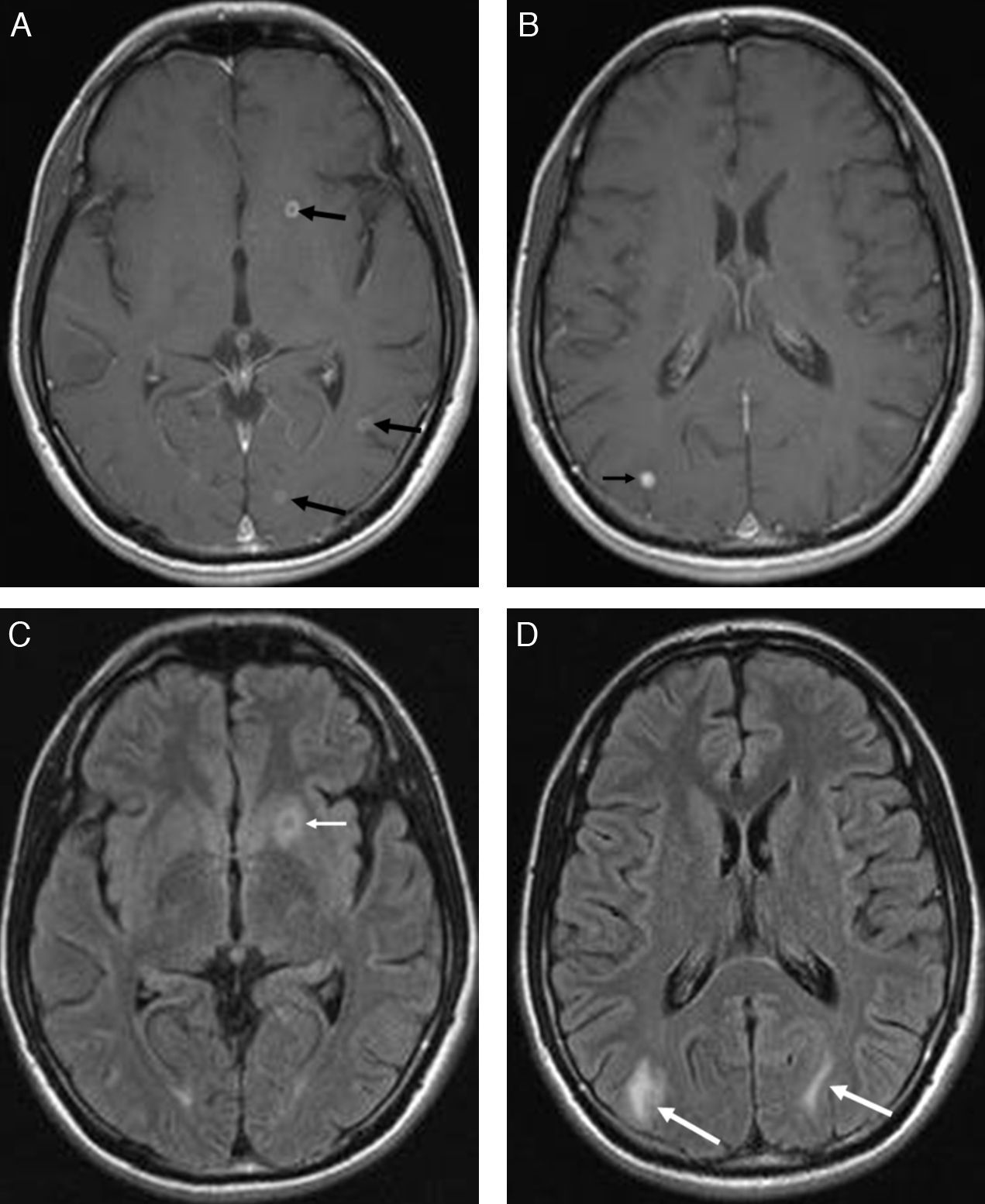
En este estadio la absorción del líquido del quiste hace que este se retraiga, que su cápsula se vuelva más gruesa y que el escólex se calcifique. La TC muestra un quiste isodenso con un escólex calcificado hiperdenso. Aún hay edema periférico y realce con el contraste intravenoso. El quiste residual es isointenso en T1 en relación con el parénquima cerebral e iso a hipointenso en T2. En este estadio es frecuente observar un realce nodular o micronodular, lo que sugiere un granuloma. A veces se observa un aspecto en diana o en ojo de buey, con el escólex calcificado en el centro de la lesión (fig. 9).
Estadio nodular-granulomatoso. RM: secuencias axiales potenciadas en T1 con gadolinio (A y B) y FLAIR (C y D). Se identifican pequeñas lesiones hipercaptantes nodulares y en anillo, de localización ganglio basal izquierda, temporal posterior izquierda y occipital bilateral (flechas negras), que se acompañan de edema vasogénico (flechas blancas).
Corresponde a la involución final del quiste. La lesión granulomatosa se ha contraído hasta una fracción de su tamaño inicial y está completamente mineralizada. En la TC es característico observar un nódulo calcificado sin efecto de masa ni captación de contraste. Sin embargo, en algunos casos puede verse un realce persistente de algún nódulo calcificado. Se especula que estas lesiones tienen un factor de riesgo adicional para crisis epilépticas después del tratamiento. En los estudios de RM estas lesiones aparecen como nódulos pequeños hipointensos en secuencias ponderadas en T2 y T2* (fig. 10). En este estadio el diagnóstico diferencial debe incluir los cavernomas.
La combinación de varios estadios de evolución y tipos de localización de la enfermedad en un mismo paciente es frecuente en la neurocisticercosis.
DiagnósticoEl diagnóstico de la neurocisticercosis puede ser complicado debido a que frecuentemente resulta imposible demostrar la infección por Taenia solium. El diagnóstico por lo tanto está basado en la combinación de datos epidemiológicos, clínicos, radiológicos e inmunológicos (pruebas de detección de anticuerpos anticisticerco en sangre y líquido cefalorraquídeo).
En el año 2000, un grupo de expertos propusieron una serie de criterios diagnósticos basados en 4 categorías25:
- 1.
Criterios absolutos: permiten un diagnóstico inequívoco de la neurocisticercosis:
- –
Histología del cisticerco en la biopsia cerebral o medular.
- –
TC o RM con lesiones quísticas e imágenes de escólex en el interior.
- –
Visualización directa de parásitos subretinianos en el fondo de ojo.
- –
- 2.
Criterios mayores: sugieren el diagnóstico, pero no confirman la enfermedad:
- –
Neuroimagen con lesiones altamente sugestivas de neurocisticercosis.
- –
Identificación de anticuerpos anticisticerco en sangre mediante EITB (Enzyme-linked immunoelectrotransfer blot assay) usando extractos purificados de antígenos de Taenia solium.
- –
Resolución de lesiones quísticas intracraneales después de tratamiento con albendazol o praziquantel.
- –
Resolución espontánea de pequeñas lesiones que captan en anillo (<20mm) en pacientes con crisis epilépticas, sin otros síntomas.
- –
- 3.
Criterios menores: son frecuentes pero no son específicos de la enfermedad:
- –
Lesiones compatibles con neurocisticercosis en estudios de neuroimagen.
- –
Manifestaciones clínicas sugestivas de neurocisticercosis, tales como crisis epilépticas, signos neurológicos focales, hipertensión intracraneal y demencia.
- –
Prueba de ELISA (Enzymme-linked immunosorbent assay) positiva en LCR para la detección de anticuerpos anticisticerco o antígenos anticisticerco.
- –
Evidencia de cisticercosis por fuera del SNC.
- –
- 4.
Criterios epidemiológicos: se refieren a la evidencia circunstancial a favor del diagnóstico de neurocisticercosis:
- –
Evidencia de contacto con un cohabitante infectado por Taenia solium.
- –
Individuos que vivan o hayan residido en países donde la neurocisticercosis es endémica.
- –
Historia de viajes frecuentes a áreas endémicas para neurocisticercosis.
- –
La interpretación de estos criterios permite 2 grados de certeza diagnóstica:
- 1.
Diagnóstico definitivo, en pacientes que tienen un criterio absoluto, o en aquellos que tienen 2 criterios mayores, un criterio menor y un criterio epidemiológico.
- 2.
Diagnóstico probable, en pacientes que tienen un criterio mayor y 2 menores, y en aquellos que tienen un criterio mayor, un criterio menor y un criterio epidemiológico. También en los casos en los que se tienen 3 criterios menores y un epidemiológico.
Los hallazgos en la TC se basan en la identificación de una lesión quística bien definida situada en la unión córtico-yuxtacortical, ganglios basales, cerebelo, mesencéfalo, cisternas o sistema ventricular. Esta lesión puede tener un mínimo realce tras la administración de medio de contraste, y un nódulo mural con realce, que correspondería al escólex. Las lesiones crónicas de la neurocisticercosis se presentan como calcificaciones, fácilmente vistas por este método diagnóstico.
En términos generales, la RM es más sensible que la TC para el diagnóstico de la enfermedad ya que permite identificar un mayor número de lesiones, clasificar los distintos estadios de la neurocisticercosis, y determinar el grado de respuesta inflamatoria (edema perilesional y ruptura de la barrera hematoencefálica). Las secuencias de RM ponderadas en T1 y T2 identifican el quiste del neurocisticerco, cuya señal en el estadio vesicular es idéntica a la del líquido cefalorraquídeo. Las secuencias de difusión logran demostrar el comportamiento líquido del interior de las lesiones, diferenciándolas de los abscesos. En el estadio vesicular-coloidal (muerte del parásito), el contenido proteico del quiste aumenta, y también lo hace su señal en las secuencias básicas de resonancia. En este estadio es posible ver además la formación de una cápsula hipointensa en secuencias ponderadas en T2. La hipointensidad de la cápsula es explicada por la presencia de radicales libres, producto de la actividad macrofágica, hallazgo que sin embargo no es específico ya que también se identifica en la fase de encapsulación temprana de los abscesos parenquimatosos.
De los múltiples hallazgos radiológicos que se pueden encontrar en la neurocisticercosis, la presencia del escólex dentro de la lesión quística es considerada patognomónica26. La búsqueda del escólex en las diferentes secuencias es por lo tanto un objetivo primordial. En las secuencias ponderadas en T1 y T2, el escólex es visualizado como un nódulo isointenso en relación con el parénquima cerebral, mientras que en las secuencias T2* el nódulo es leve a moderadamente hipointenso. Las secuencias de densidad de protones y FLAIR son las de mayor sensibilidad para determinar la presencia o no de escólex27. En estas secuencias el escólex se observa como un foco de hiperseñal excéntrica en el quiste.
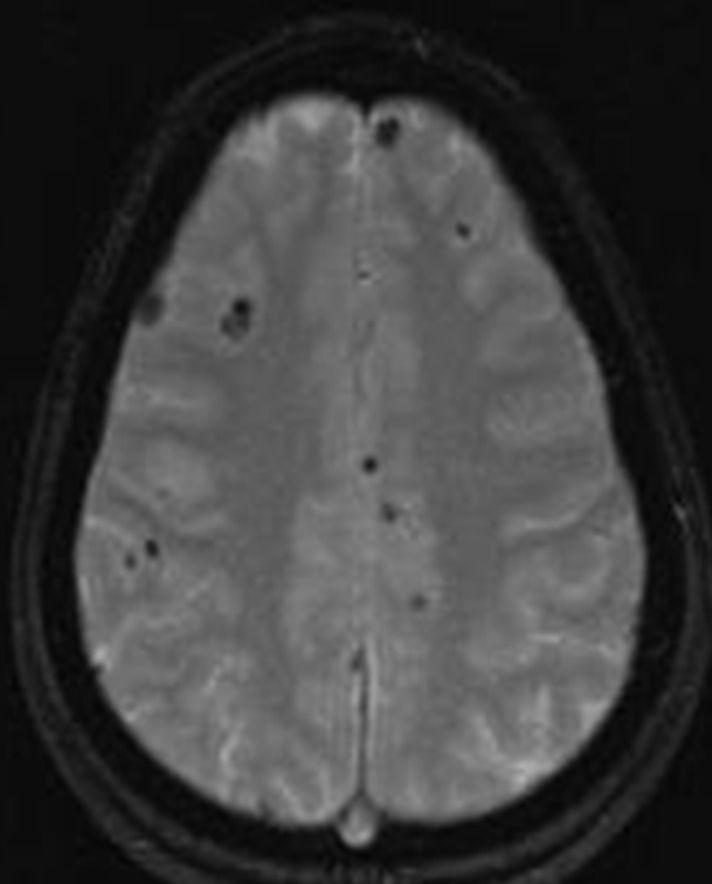
Clásicamente se ha considerado como una limitación de la RM su baja sensibilidad y especificidad en comparación con la TC para determinar la presencia de calcio. La detección de pequeñas calcificaciones parenquimatosas cerebrales es un hallazgo que puede orientar el diagnóstico de neurocisticercosis (estadio nodular-calcificado). En la actualidad, el uso de mayores campos magnéticos en RM y nuevas secuencias como la de susceptibilidad magnética contrarrestan esta deficiencia. El registro de señal en esta secuencia permite reconstruir a partir de los datos brutos 2 tipos de imágenes, las imágenes en magnitud y las de fase28. Las imágenes de magnitud muestran con claridad todas aquellas lesiones que tengan susceptibilidad magnética, pero no permiten diferenciar una microhemorragia de una calcificación. En cambio, las secuencias de fase pueden tener importancia para distinguirlas29. El procesado de imágenes de fase evidencia una fase negativa (hipointensa) para las sustancias paramagnéticas, mientras que es positiva para las diamagnéticas (hiperintensa). Las calcificaciones son consideradas sustancias diamagnéticas, por lo tanto aparecen con una señal de intensidad opuesta en las imágenes de filtrado de fase (hiperintensa). La comparación de las secuencias de filtrado de fase con la secuencias de magnitud ayudan a determinar la presencia de calcificaciones y diferenciarlas de las microhemorragias crónicas29. Con esta secuencia se evidencian nódulos pequeños marcadamente hipointensos en el parénquima cerebral, indistinguibles en ocasiones de los cavernomas.
El uso de medio de contraste identifica lesiones con realce nodular en los estadios no quístico y granulomatoso, y un realce anular de la pared del quiste en el estadio vesicular-coloidal. La obtención de las secuencias T1 en fases tardías tras la administración de contraste incrementa la sensibilidad en la detección de lesiones27.
Diagnóstico diferencialEl diagnóstico diferencial de la neurocisticercosis en regiones endémicas puede ser extremadamente difícil, debido a la coexistencia de tuberculosis y a otras infecciones parasitarias26. Las lesiones anulares parenquimatosas (únicas o múltiples) del sistema nervioso central no son específicas de la neurocisticercosis y representan un problema diagnóstico ya que la serología es frecuentemente negativa. Se debe realizar un diagnóstico diferencial en el estadio vesicular-coloidal con los tuberculomas, los abscesos piógenos, la toxoplasmosis, la neurosífilis, la hidatidosis, y las neoplasias primarias o secundarias, mientras que en el estadio nodular-calcificado se debe realizar con los cavernomas y la microangiopatía amiloide1.
Las presentaciones atípicas de la neurocisticercosis pueden simular otras enfermedades neurológicas. Cuando se presenta una aracnoiditis basilar el diagnóstico diferencial incluye la meningitis carcinomatosa, las enfermedades granulomatosas como la sarcoidosis, la tuberculosis y la meningitis fúngica. En los casos de neurocisticercosis espinal, el diagnóstico diferencial incluye los ependimomas, los astrocitomas quísticos, las cavidades siringomiélicas, así como los quistes hidatídicos y los quistes congénitos (aracnoideo y dermoide)1.
TratamientoEl tratamiento de la neurocisticercosis es controvertido y depende del número, localización, viabilidad del parásito y la aparición de complicaciones. El tratamiento médico se considera de primera elección, exceptuando los casos de hipertensión intracraneal grave que requieran cirugía. La utilización de fármacos cesticidas depende más del área geográfica y de la experiencia personal, que de la existencia de protocolos consensuados. La terapia cesticida genera por sí misma una respuesta inflamatoria que aumenta el edema cerebral y puede provocar una hipertensión intracraneal. En general, el tratamiento está basado en fármacos antiepilépticos, agentes anticesticidas (p. ej. albendazol y praziquantel), corticoesteroides y otros inmunosupresores o agentes antiinflamatorios usados para el control de la grave respuesta inflamatoria del huésped1–4.
ConclusiónDebido al fenómeno migratorio registrado en España durante la última década, la neurocisticercosis ha dejado de ser una infección excepcional en este país. Al ser la enfermedad parasitaria más importante del sistema nervioso central y la causa más frecuente de epilepsia adquirida en los países en desarrollo, debemos familiarizarnos con los diferentes hallazgos radiológicos de la enfermedad y tenerla en cuenta dentro del diagnóstico diferencial de lesiones intracraneales múltiples, particularmente en pacientes procedentes de áreas endémicas.
Autorías- 1.
Responsable de la integridad del estudio: SSE, LFV y ARC.
- 2.
Concepción del estudio: SSE, LFV y ARC.
- 3.
Diseño del estudio: SSE y ARC.
- 4.
Obtención de los datos: SSE, SSM y CAA.
- 5.
Análisis e interpretación de los datos: SSE.
- 6.
Búsqueda bibliográfica: SSE, LFV y ARC.
- 7.
Redacción del trabajo: SSE, LFV y ARC.
- 8.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SSM, CAA y LFV.
- 9.
Aprobación de la versión final: SSE, ARC, LFV, CAA y SSM.
- 10.
Todos los autores han leído la versión final del manuscrito y han dado su aprobación.
Los autores declaran no tener ningún conflicto de intereses.