Suplemento “Patología Intersticial Pulmonar”
Más datosLa neumonía organizada es un patrón patológico inespecífico de respuesta al daño pulmonar que puede ser idiopático o secundario a numerosos procesos médicos, los más frecuentes, las infecciones, las enfermedades del tejido conectivo y la toxicidad farmacológica.
Aunque no existe una definición estricta del patrón radiológico de neumonía organizada como en otras neumonías intersticiales idiopáticas, se puede considerar que el patrón característico de esta enfermedad consiste en la presencia de consolidaciones pulmonares y opacidades de atenuación en vidrio deslustrado bilaterales parcheadas de distribución peribronquial y subpleural. Además, en los estudios evolutivos de la enfermedad son características la respuesta a corticoides de estas lesiones, su carácter migratorio sin o con tratamiento y su tendencia a recaer al disminuir o retirar el tratamiento.
Son también manifestaciones de la neumonía organizada los nódulos de morfología y tamaño variable, las masas solitarias, los nódulos con apariencia de «halo invertido», el patrón perilobulillar y las bandas parenquimatosas.
Organizing pneumonia is a non-specific pathologic pattern of response to lung damage. It can be idiopathic, or it can occur secondary to various medical processes, most commonly infections, connective tissue disease, and pharmacological toxicity.
Although there is no strict definition of the radiological pattern of organizing pneumonia as in other idiopathic interstitial pneumonias, the characteristic pattern of this disease could be considered to include patchy consolidations and ground-glass opacities in the peribronchial and subpleural areas of both lungs. Moreover, follow-up examinations show that these lesions respond to treatment with corticoids, migrate with or without treatment, and tend to recur when treatment is decreased or withdrawn.
Other manifestations of organizing pneumonia include nodules of different sizes and shapes, solitary masses, nodules with the reversed halo sign, a perilobular pattern, and parenchymal bands.
La neumonía organizada (NO), antes denominada bronquiolitis obliterante con neumonía organizada1, es un patrón patológico inespecífico de respuesta del pulmón a diferentes procesos médicos, como las infecciones, las enfermedades del tejido conectivo, la toxicidad por fármacos y la radioterapia, entre otros que se detallan en la tabla 12–13. En su forma idiopática, la NO criptogenética (NOC) está incluida en la clasificación de las neumonías intersticiales idiopáticas3,4. Además, la NO puede ser el patrón histológico presente en las exacerbaciones de otras neumonías intersticiales, especialmente en la neumonía intersticial usual (NIU)14.
Causas de neumonía organizada
| Infección (bacteriana, vírica, parasitaria, fúngica) |
| Fármacos (inmunoterapia, amiodarona, nitrofurantoina, metotrexato, etc.) |
| Enfermedad del colágeno |
| Asociadas a otras enfermedades intersticiales (neumonía eosinófila, neumonitis por hipersensibilidad, neumonía intersticial usual, neumonía intersticial no específica) |
| Neoplasias hematológicas (leucemia, linfoma) |
| Trasplante (pulmonar, hepático, médula ósea) |
| Radioterapia |
| Inmunodeficiencia común variable |
| Enfermedad inflamatoria intestinal (Crohn, colitis ulcerosa) |
| Aspiración |
| Inhalación |
| Reacción a procesos pulmonares (absceso, neoplasia, hemorragia alveolar, obstrucción de vía aérea) |
Aunque se acepta que puede estar infradiagnosticada, en un registro español de enfermedades intersticiales ocupaba el tercer lugar, tras la fibrosis pulmonar idiopática y la sarcoidosis15, si bien su forma secundaria puede ser mucho más frecuente16.
En esta revisión repasaremos los hallazgos patológicos y las diversas formas de presentación clínica y radiológica de la NO, así como su manejo terapéutico, con especial énfasis en las manifestaciones radiológicas.
Presentación clínica, diagnóstico y manejo de la neumonía organizadaLa presentación clínica y radiológica de la NO puede ser muy variada e incluye desde cuadros indistinguibles de un proceso neumónico hasta nódulos pulmonares solitarios en pacientes asintomáticos. La edad media de los pacientes está en torno a 50-60 años2. La mayor parte de los pacientes presentan un cuadro clínico caracterizado por tos no productiva y disnea acompañados de fiebre y, a veces, un cuadro gripal1 de presentación habitualmente subaguda, de entre 4 y 6 semanas de duración5, aunque puede llegar a durar meses1. A menudo se sospecha ante un cuadro clínico-radiológico de neumonía que no responde a antibióticos. Desde las primeras descripciones de la enfermedad, se destacan 2 características típicas en el curso de la misma: la respuesta a los corticoides y la alta tasa de recaídas cuando se disminuye la dosis o se suspenden1–3,8,17. La regresión espontánea y el carácter migratorio de las lesiones pulmonares son también características13,18.
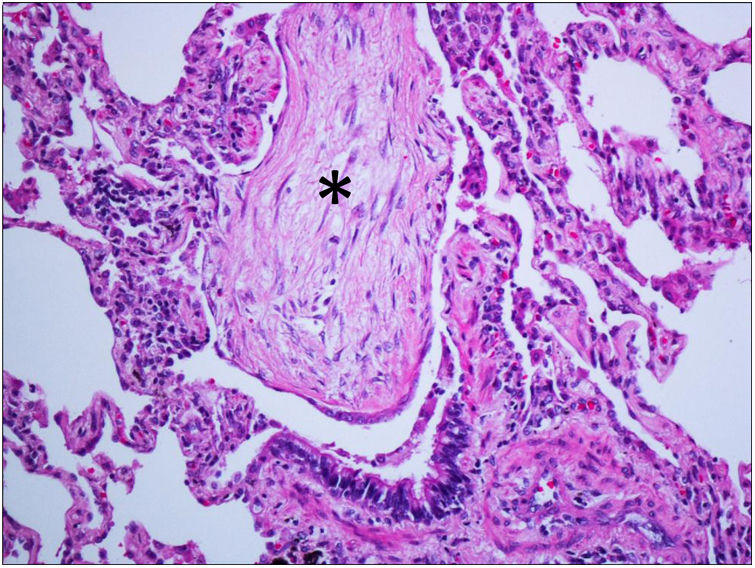
Fisiopatológicamente, la organización, caracterizada por la proliferación fibroblástica, es una respuesta frecuente al daño pulmonar de diferentes causas y sus manifestaciones patológicas y radiológicas dependen del grado del daño y de la respuesta reparativa asociada, adoptando diferentes patrones, como el daño alveolar difuso, la NO fibrinosa aguda y la NO. La presencia de membranas hialinas y de «bolas de fibrina» en los espacios aéreos, respectivamente, son los rasgos patológicos distintivos de las 2 primeras entidades19. El patrón patológico de NO se caracteriza por la presencia de focos fibroblásticos en el espacio aéreo afectando a alvéolos, conductos alveolares y bronquiolos, típicamente con conservación de la arquitectura pulmonar y con escasa inflamación intersticial. Las yemas fibroblásticas creciendo en los espacios aéreos, llamados cuerpos de Masson, son un rasgo distintivo de la enfermedad (fig. 1). Su presencia en la luz bronquiolar motivó la denominación original de «bronquiolitis obliterante con NO», que se desechó por prestarse a confusión con la bronquiolitis obliterante (ahora denominada bronquiolitis constrictiva). La presencia de otros hallazgos, como inflamación intersticial prominente, granulomas, metaplasia peribronquiolar, agregados linfoides, vasculitis, fibrosis intersticial o panalización, obligan a considerar alternativas diagnósticas. Hay que tener en cuenta, además, que la NO puede aparecer junto a neoplasias20 o granulomas19 y, ocasionalmente, en el seno de otras entidades patológicas, algunas de las cuales representan un importante diagnóstico diferencial clínico-radiológico de la NO, como la neumonía eosinófila21 o la neumonía intersticial no específica (NINE), en la que más de la mitad de los casos presentan focos de NO22. De hecho, en un estudio llevado a cabo por un panel de expertos22, cuando los datos clínico-radiológicos apoyaban la sospecha de NO, se favoreció este diagnóstico frente al de NINE idiopática, independientemente de que el patrón histológico fuera de esta última. Además, se describe un patrón de superposición de NO con NINE en el que hay focos generalizados de NO con preservación de la arquitectura pulmonar, que se acompañan de inflamación intersticial difusa o fibrosis espacialmente alejada de esos focos de organización22,23.
En la mayoría de los casos, los cambios patológicos de la NO son reversibles por completo, lo que la diferencia de otras enfermedades fibrosantes progresivas.
El diagnóstico de la NO puede establecerse sin necesidad de confirmación patológica2,24, ante la presencia de un cuadro clínico-radiológico compatible, especialmente si existe alguna de las condiciones asociadas descritas en la tabla 1. El lavado broncoalveolar puede ayudar a establecer el diagnóstico, sobre todo por descartar enfermedades como infecciones y la neumonía eosinófila. Cuando la biopsia es necesaria, pueden ser diagnósticas las muestras obtenidas mediante biopsia transbronquial y percutánea2.
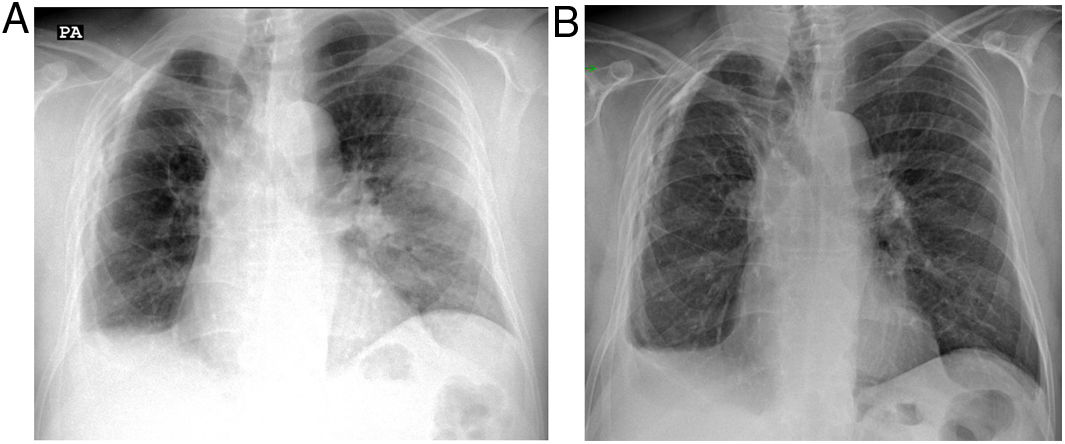
El tratamiento de la NO se basa en corticoides a altas dosis, que en la mayoría de los pacientes condicionan una rápida mejoría de los síntomas, seguidos de la resolución radiológica2,16. Precisamente, esta respuesta al tratamiento apoya la sospecha diagnóstica en aquellos casos diagnosticados sin confirmación histológica (fig. 2). Las recaídas, con reaparición de los síntomas y empeoramiento radiológico al descender la dosis o finalizar los corticoides, pueden ocurrir hasta en cerca del 60% de los casos de NOC16,17, representando un dato de valor diagnóstico que aparece solo en unas pocas enfermedades, como la neumonía eosinófila, las vasculitis y la hemorragia alveolar25.
Paciente con antecedente de neumonía organizada que acude por un cuadro clínico sospechoso con tos seca, disnea y fiebre. a) La radiografía muestra una consolidación periférica en el pulmón izquierdo compatible en el contexto clínico con neumonía organizada. En el lado derecho se aprecia pérdida de volumen con pinzamiento del seno costofrénico y paquipleuritis calcificada. b) Una semana después, tras tratamiento con corticoides, la radiografía de tórax muestra resolución casi completa de las alteraciones del pulmón izquierdo.
Las manifestaciones radiológicas de la NO, al igual que las clínicas, pueden ser variadas. No obstante, aunque el patrón de NO, como el de otras enfermedades intersticiales, no está tan bien definido con base en unos criterios como el de la NIU, se acepta que el patrón que se puede considerar característico de esta enfermedad consiste en la presencia de consolidaciones pulmonares parcheadas de distribución peribronquial y subpleural, lo que puede ocurrir en el 60-80% de los casos4,5,25,26. En un estudio que valoraba la rentabilidad diagnóstica de la tomografía computarizada (TC) para diagnosticar una serie de neumonías intersticiales idiopáticas, la NOC fue la que en un mayor porcentaje se diagnosticó correctamente, en un 79% de los casos27. El carácter migratorio, a veces incluso sin tratamiento28, junto a la respuesta a corticoides16 acabarían de conformar el cuadro radiológico «típico» de la NO. Además, la apariencia de algunas lesiones formando bandas curvilíneas o en forma de «halo invertido» y con «patrón perilobulillar» son diversas características radiológicas que típicamente se han asociado a la NO29–32. Otros hallazgos, como el vidrio deslustrado, los nódulos o la afectación reticular, aunque más inespecíficos, son también manifestaciones de la enfermedad16.
A continuación, se repasarán algunos de los hallazgos radiológicos de la NO.
ConsolidaciónEs el hallazgo más característico de la enfermedad y, junto con las opacidades en vidrio deslustrado, el más frecuente. Alrededor del 75% de los casos de NOC se presentan como consolidaciones multifocales, generalmente periféricas, que migran a lo largo de semanas25.
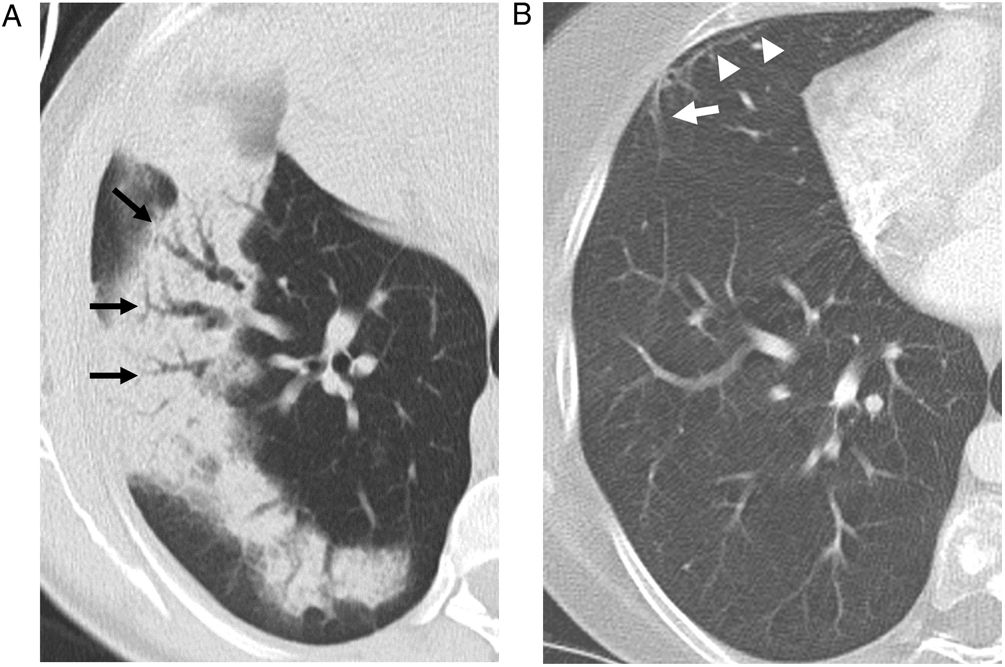
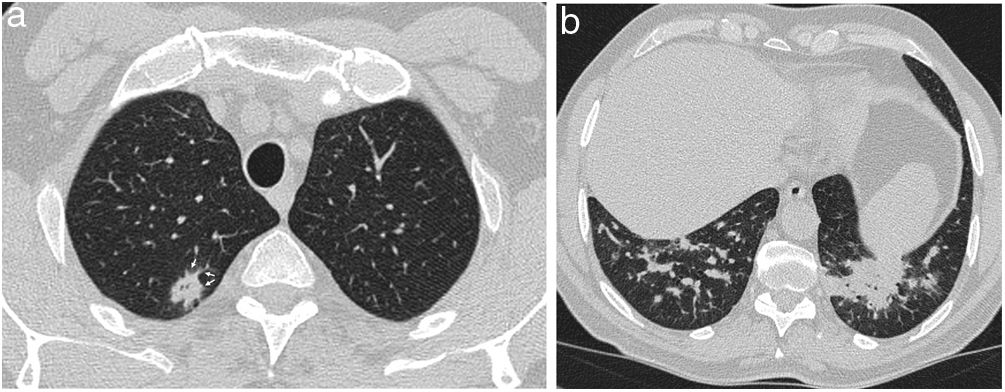
Puede ser visible en la radiografía de tórax en forma de opacidades parcheadas bilaterales de densidad variable1,2,33. En la TC, los focos de consolidación suelen ser parcheados, bilaterales y asimétricos, con tendencia a mostrar una distribución predominantemente periférica subpleural, y a veces peribroncovascular (fig. 3), describiéndose un ligero predominio en las regiones inferiores de los pulmones16,29–31,33,34. El broncograma aéreo es frecuente, a veces mostrando una leve dilatación bronquial31,33–36, que suele desaparecer con la resolución de la consolidación (fig. 4).
Mujer de 51 años tratada con radioterapia 6 meses antes con neumonía organizada confirmada histológicamente. a) La TC muestra consolidación en lóbulo inferior derecho con dilataciones bronquiales (flechas). Un control de TC 2 meses después (b), tras tratamiento, muestra resolución completa de la consolidación y normalización del calibre bronquial. En ese momento, es visible en el lóbulo medio una pequeña banda parenquimatosa (flecha) asociada a una línea subpleural (cabezas de flecha).
La presencia de consolidación en la TC inicial se ha asociado a mayor porcentaje de resolución de las alteraciones de NO32; sin embargo, en pacientes con NO secundaria a enfermedad del colágeno, un mayor porcentaje de consolidación se asocia también a mayor recurrencia37.
Vidrio deslustradoEn algunas series de NO es el hallazgo más frecuente16,30,38, aunque habitualmente forma parte de un patrón mixto en combinación con la consolidación16,31,33,34 (fig. 5). Histopatológicamente, las opacidades en vidrio deslustrado se corresponden con áreas de inflamación de los septos alveolares y descamación celular intraalveolar con pequeñas cantidades de tejido de granulación en los espacios aéreos terminales34. Estas opacidades pueden aparecer como evolución de los focos de consolidación25,39.
Neumonía organizada criptogenética recidivante. Corte de TC de las bases pulmonares mostrando opacidades en vidrio deslustrado bilaterales con signo del halo invertido, con una zona externa lineal más densa (flechas blancas) y un área interna en vidrio deslustrado. Además, hay una banda de consolidación peribronquial (flecha negra).
La asociación de opacidades en vidrio deslustrado con engrosamiento septal adoptando un patrón en «empedrado» es rara en la NO40.
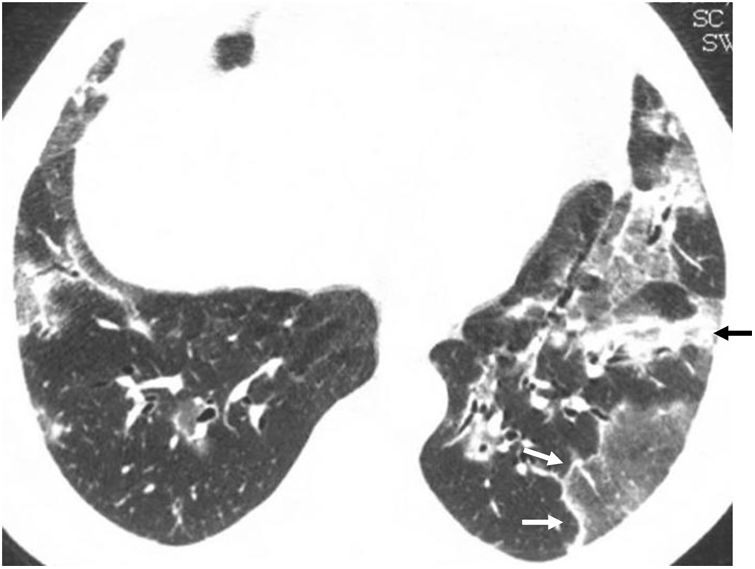
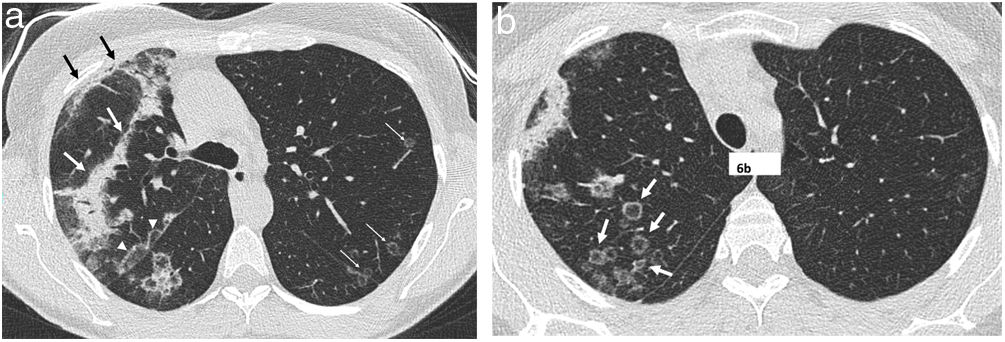
Signo del halo invertidoEl signo del halo invertido también es llamado del «atolón»41,42 o signo del «corro de brujas», aunque se prefiere el primer término43,44. Se define como una zona de atenuación en vidrio deslustrado rodeada de un halo de consolidación más o menos completo (fig. 6), a veces de morfología más semilunar o lineal (fig. 5). Patológicamente, se ha explicado por la presencia de inflamación de septos alveolares centralmente, mientras que la zona más densa periférica corresponde a la NO con tejido de granulación en los espacios aéreos45. Aunque inicialmente se describió como característico de la NO, presente en el 19% de los casos30, posteriormente se ha descrito en numerosas entidades que incluyen infecciones (entre ellas, la tuberculosis o la mucormicosis), infarto pulmonar, vasculitis como la granulomatosis con poliangitis, sarcoidosis e incluso neoplasias como la granulomatosis linfomatoide o las neoplasias tratadas con radiofrecuencia o radioterapia46,47. La presencia de nodularidad en el halo que aparece en la tuberculosis se ha descrito como diferenciadora del halo de la NOC48. En el caso de las infecciones fúngicas invasivas, el halo invertido presenta un anillo externo más grueso, se acompaña de reticulación en su interior y de derrame pleural frente a la NO de otra etiología49.
Patrón perilobulillarEl patrón perilobulillar se describió inicialmente como una forma de afectación de las estructuras que forman el límite del lobulillo pulmonar secundario en relación con los septos interlobulillares50,51. Se define como la presencia de opacidades mal definidas de distribución poligonal o formando arcos, que frecuentemente se localizan en la periferia del pulmón, junto a la pleura, y rodeadas de pulmón aireado (figs. 6 y 7). Inicialmente se describió hasta en el 57% de los enfermos con NO29, siempre en pacientes que además presentaban focos de consolidación.
Mujer de 51 años con antecedente de cáncer de mama derecha tratado con cirugía conservadora y radioterapia que presenta neumonía organizada 6 meses después de finalizar el tratamiento. a) Corte axial de TC que muestra una banda de consolidación subpleural anterior en relación con neumonitis por radioterapia (flechas negras) y separada de esta por tejido pulmonar sano; se observa otra banda de consolidación (flechas blancas). Son también visibles un patrón perilobulillar en forma de arcada subpleural junto a la cisura mayor derecha (cabezas de flecha blancas) y varios nódulos con apariencia de halo invertido en pulmón izquierdo (flechas blancas finas). En un corte superior (b) se aprecian numerosas opacidades nodulares con halo invertido en el lóbulo superior derecho (flechas).
Neumonía organizada criptogenética. a) Patrón perilobulillar (flechas) con opacidades pulmonares de grosor variable formando arcos de base pleural, rodeados de pulmón normal y con algunos focos consolidativos. El control 6 meses después (b) muestra una clara línea subpleural residual en el lóbulo inferior derecho (flechas).
La presentación en forma de nódulos (fig. 8a) o masas (fig. 8b) puede acompañar a otros hallazgos de NO o ser la única manifestación de la enfermedad. Pueden ser múltiples o únicos, en cuyo caso se denomina NO focal52,53 y plantea diagnóstico diferencial con lesiones neoplásicas, especialmente cuando los pacientes están asintomáticos, lo que se describe hasta en el 38% en una serie52. La presentación en forma de NO focal se asocia a buen pronóstico23.
Neumonía organizada en paciente con antecedente de linfoma en remisión desde hace 3 años. a) Nódulo en lóbulo superior derecho con broncograma aéreo y bordes algo espiculados con espículas de morfología arciforme hacia el nódulo (flechas). b) Nódulos de pequeño tamaño en lóbulo inferior derecho y consolidación irregular en lóbulo inferior izquierdo.
El tamaño de los nódulos es variable. Los de menor tamaño pueden ser milimétricos y mal definidos, en forma de nódulos de espacio aéreo, aunque también pueden presentarse como lesiones nodulares mejor definidas y de contornos lisos36. En cuanto a los nódulos de mayor tamaño y las masas pulmonares, pueden superar los 5cm y suelen tener unos bordes irregulares, de morfología poligonal53 y con broncograma aéreo (fig. 8a y b), ocasionalmente con contornos espiculados y colas pleurales, y a veces se acompañan de halo en vidrio deslustrado54. En nuestra experiencia, las espículas muestran a veces un aspecto arciforme hacia el nódulo a diferencia de las tumorales que irradian desde la lesión (fig. 8a). Ocasionalmente, pueden cavitar52–54.
En una serie31, la presentación nodular fue más frecuente en pacientes inmunodeprimidos, en los que puede plantear diagnóstico diferencial con enfermedad fúngica invasiva. En enfermos inmunocompetentes, en cambio, el diagnóstico diferencial se debe establecer con la neoplasia primaria pulmonar multifocal, las metástasis, el linfoma y las vasculitis. La presencia de nódulos asociada a otros hallazgos adquiere valor diagnóstico para diferenciar la NO de enfermedades radiológicamente similares, como la neumonía eosinófila crónica21 y la neumonía intersticial aguda55, en las que son menos frecuentes.
Bandas parenquimatosas y líneas subpleuralesLas opacidades lineales en la NO pueden manifestarse en forma de bandas parenquimatosas, que a veces irradian desde la zona central del pulmón a lo largo de los bronquios, o como líneas subpleurales paralelas a las superficies pleurales56. La mayoría de las veces son una parte de los hallazgos de NO, pero en ocasiones son su única manifestación o el resultado de la evolución de lesiones de mayor entidad (figs. 4b y 7b).
Otras manifestaciones radiológicas de la neumonía organizadaLa afectación reticular como hallazgo predominante es rara25.
Aunque el derrame pleural es infrecuente en la NO, algunos estudios lo encuentran en más del 20% de las NOC21, e incluso se describe en hasta el 60% de las NO secundarias20, posiblemente en relación con la enfermedad causante de la NO.
En cuanto a las adenopatías, en un estudio que compara la frecuencia de adenopatías en una serie de pacientes con neumonías intersticiales idiopáticas, estas eran menos frecuentes en la NOC que en el resto de las enfermedades57, si bien se encuentran en un 20-40%30,31,53,57.
Evolución de la neumonía organizadaComo se ha dicho anteriormente, tanto la buena respuesta a los corticoides como las recaídas son frecuentes en la NO1,3,8,17. La regresión espontánea sin tratamiento puede ser relativamente frecuente en la NOC, hasta en más del 40% en una serie de pacientes con lesiones bilaterales que no se habían resecado por completo16, mientras que, en esta misma serie, la recaída al descender o finalizar la terapia con corticoides ocurrió en el 66% de los pacientes.
Hemos descrito una forma característica de recaída en enfermos con patrón radiológico de NO llamado «signo de la recaída en negativo» en el que las nuevas lesiones aparecen en la periferia de las zonas previamente afectadas, dejando el pulmón previamente afectado como áreas de pulmón normal, en lo que parece un negativo de la presentación inicial (fig. 9)58.
Varón de 53 años con neoplasia pulmonar en el lóbulo superior derecho tratada con radioterapia y posteriormente con nivolumab. Seis meses después presentó disnea e hipoxemia y la TC (a) muestra una opacidad nodular con halo invertido (flechas blancas) y una pequeña opacidad subpleural (flecha negra) en el lóbulo inferior izquierdo. El paciente fue tratado con corticoides y durante el descenso de la dosis de los mismos, a las 10 semanas de la TC previa, los síntomas reaparecieron. La TC (b) muestra consolidación en el lóbulo inferior izquierdo que deja respetadas «en negativo» las zonas donde se situaban la opacidad nodular (flechas blancas) y subpleural (flecha negra).
La respuesta puede ser completa, con desaparición de las lesiones o con mínimas lesiones residuales en forma de sutiles opacidades en vidrio deslustrado o líneas subpleurales (fig. 7 b), evolución que se asocia a la presencia de consolidación en los estudios iniciales32 y a la NO focal23. Sin embargo, algunas series describen un elevado porcentaje (mayor del 70%) de lesiones residuales en la TC, cuyas características sugieren un patrón de NINE fibrótica38,59. Esta evolución a lesiones fibróticas puede verse en enfermedades reumáticas y, en concreto, en el síndrome antisintetasa (fig. 10)7,60.
Mujer de 60 años que acude por fiebre, disnea, tos y dolor torácico. La TC muestra consolidación del lóbulo superior derecho (a) y opacidades en vidrio deslustrado basales y patrón perilobulillar (flechas) en el lóbulo inferior izquierdo (b). Se descartó infección y ante los hallazgos se sospechó neumonía organizada criptogenética que se trató con corticoides. En la evolución la paciente mostró anticuerpos anti Jo-1 positivos y la TC realizada 6 meses después (c, d) muestra una afectación basal bilateral con vidrio deslustrado, pérdida de volumen y bronquiectasias por tracción (flechas) concordantes con patrón de neumonía intersticial no específica.
Se describen también formas de NO rápidamente progresivas que pueden ser secundarias, entre otras, a enfermedades del colágeno61,62.
Consideraciones sobre algunas formas secundarias de neumonía organizadaPatrón NO/NINETanto en sus formas idiopáticas como en las secundarias, sobre todo asociada a enfermedades autoinmunes7,22,60, la NO y la NINE pueden coexistir tanto histológicamente como en forma de patrón radiológico mixto. De hecho, se considera el patrón radiológico de NO/NINE como un criterio en el dominio morfológico para el diagnóstico de la neumonía intersticial con características autoinmunes (IPAF)63. Este patrón se define por la presencia de consolidación basal, habitualmente yuxtadiafragmática, asociada a signos de fibrosis, con bronquiectasias por tracción, reticulación y pérdida de volumen63.
NO por toxicidadLa NO puede ser la forma de presentación de la toxicidad pulmonar de numerosos fármacos, solapándose también a veces con la NINE64. Cabe destacar, por su frecuencia, la asociación a la amiodarona y la inmunoterapia64,65.
El patrón radiológico de NO puede solaparse con el de la neumonía eosinófila crónica inducida por fármacos21,64.
NO por radioterapiaLa NO secundaria a radioterapia puede aparecer tanto en la zona irradiada como a distancia de la misma o en el pulmón contralateral y con un intervalo relativamente largo desde la finalización del tratamiento, por lo que en ocasiones pueden no relacionarse. En las enfermas tratadas por cáncer de mama es característica la presencia de una zona respetada de pulmón entre la banda de neumonitis por radioterapia subpleural debida a la radiación directa y la consolidación por la NO (fig. 6a), la cual aparece en una serie aproximadamente unos 7 meses tras el tratamiento12.
Hay que tener en cuenta también que la neumonitis por radioterapia puede aparecer de forma tardía como un patrón de NO con consolidación en la zona irradiada, en forma de la llamada «neumonitis de recuerdo» en pacientes que reciben quimioterapia e inmunoterapia después de la radioterapia66.
En 6 de 16 pacientes con el «signo de la recaída en negativo» descrito anteriormente existía radioterapia como antecedente, en 3 de ellos asociada a inmunoterapia58.
NO en COVID-19El patrón histológico de la neumonía por SARS-CoV-2 en fases iniciales se describió como daño alveolar difuso y NO fibrinoide aguda en la mayoría de los enfermos67. Sin embargo, tanto desde el punto de vista radiológico como patológico, la neumonía por SARS-CoV-2 puede presentarse como un patrón de NO, especialmente en fases avanzadas de la enfermedad en la que son visibles, aparte del patrón característico de consolidación multifocal, los signos del halo invertido y el patrón perilobulillar68–70.
ConclusiónEn este artículo se describen los diferentes hallazgos que caracterizan el patrón de NO y que el radiólogo debe de tener en cuenta para alertar al clínico sobre el posible diagnóstico, tanto en la forma secundaria, cuando se asocia a entidades relacionadas con la misma, como en su forma idiopática (anexo).
Autoría- 1.
Responsable de la integridad del estudio: JJA-J.
- 2.
Concepción del estudio: JJA-J, EG-G, AUV, MSM y EFR.
- 3.
Diseño del estudio: no procede.
- 4.
Obtención de los datos: no procede.
- 5.
Análisis e interpretación de los datos: no procede.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: JJA-J, EG-G, AUV, MSM y EFR.
- 8.
Redacción del trabajo: JJA-J, EG-G, AUV, MSM y EFR.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JJA-J, EG-G, AUV, MSM y EFR.
- 10.
Aprobación de la versión final: JJA-J, EG-G, AUV, MSM y EFR.
Los autores declaran no tener ningún conflicto de intereses.
Al Dr. Ignacio Aranda, jefe del Servicio de Anatomía Patológica del Hospital General Universitario Dr. Balmis de Alicante, por su asesoramiento sobre los aspectos patológicos de la enfermedad.