Suplemento:Actualización y buenas prácticas en los usos de los medios de contraste
Más datosLa resonancia magnética hepática con medios de contraste hepatoespecíficos es una herramienta diagnóstica crucial para evaluar las enfermedades hepáticas. Permite la detección y la caracterización de lesiones focales y alteraciones vasculares hepáticas, así como la evaluación y la gradación de la hepatopatía crónica. Los contrastes hepatoespecíficos paramagnéticos están basados en el gadolinio, se incorporan parcialmente a los hepatocitos, y se excretan tanto por la vía renal como por la biliar. Actualmente se dispone comercialmente de 2 moléculas lineales iónicas: el ácido gadobénico (Gd-BOPTA) y el ácido gadoxético (Gd-EOB-DTPA). Sus principales indicaciones clínicas incluyen diferenciar y caracterizar lesiones focales hepáticas sobre el hígado sano, diagnosticar y estadificar el carcinoma hepatocelular en los pacientes con hepatopatía crónica, e incrementar la fiabilidad en la detección de metástasis hepáticas en pacientes oncológicos, especialmente antes de la cirugía. También son útiles en la evaluación anatómica de la vía biliar y las complicaciones de la cirugía hepática como la fuga biliar.
The use of hepatobiliary-specific contrast agents in liver MRI is a crucial diagnostic tool for evaluating liver disease, enabling the detection and characterisation of focal lesions and vascular alterations, as well as the assessment and grading of chronic hepatopathy. Paramagnetic hepatobiliary-specific contrast agents are gadolinium-based, partially taken up by hepatocytes, and excreted via both renal and biliary pathways. There are two linear ionic molecules that are currently commercially available: gadobenic acid (Gd-BOPTA) and gadoxetic acid (Gd-EOB-DTPA). Their main clinical indications include distinguishing and characterising focal liver lesions on healthy liver tissue, diagnosing and staging hepatocellular carcinoma in patients with chronic hepatopathy, and increasing reliability in the detection of hepatic metastases in oncology patients, especially prior to surgery. They are also useful in the evaluation of the biliary tract and in assessing complications of hepatic surgery such as bile leaks.
La resonancia magnética (RM) hepática con contraste intravenoso es una herramienta diagnóstica indispensable para la evaluación de las enfermedades hepáticas, y permite mejorar la detección y la caracterización de lesiones focales y alteraciones vasculares hepáticas en los pacientes con lesiones incidentales, hepatopatía crónica, trastornos vasculares o enfermedad oncológica.
Los medios de contraste se administran por vía intravenosa y pueden clasificarse en general por su mecanismo de acción (paramagnéticos o superparamagnéticos) o por su distribución en el organismo tras su administración. Los medios de contraste empleados actualmente son paramagnéticos y están basados en el gadolinio. En el estudio del hígado pueden utilizarse tanto contrastes extracelulares como hepatoespecíficos1.
Los medios de contraste extracelulares son los más empleados en los estudios de RM. Tras su administración intravenosa se distribuyen inicialmente en el compartimento vascular y difunden progresivamente al espacio intersticial extravascular y extracelular, sin incorporarse al interior de las células. De este espacio vuelven a los vasos para su excreción renal. En el hígado, estos contrastes pueden tener una fase de distribución prolongada en áreas con un aumento del espacio vascular, como en los hemangiomas, o con un aumento del espacio extracelular con afinidad por el contraste, como en la fibrosis. Existen varios medios de contraste extracelulares comercializados, con diferencias en función de su estructura molecular, sus características fisicoquímicas y sus propiedades farmacocinéticas2. Los contrastes en uso tienen una estructura macrocíclica y presentan un perfil de seguridad muy alto, incluso en pacientes con función renal deteriorada3. Típicamente se administran con un bolo intravenoso rápido, a una dosis de 0,1mmol/kg (equivalente a 0,2ml/kg a la concentración habitual de 0,5mmol/ml), seguido de un bolo de empuje de suero salino fisiológico a la misma velocidad2,4.
Los contrastes hepatoespecíficos se desarrollaron históricamente como medios de contraste paramagnéticos basados en el gadolinio y en el manganeso o como contrastes superparamagnéticos basados en el hierro. En la actualidad solo se emplean los contrastes paramagnéticos basados en el gadolinio1. Los contrastes hepatoespecíficos paramagnéticos con gadolinio tienen una incorporación parcial al interior del hepatocito. Su excreción se realiza tanto por la vía renal como por la vía biliar. La incorporación parcial del contraste al hepatocito y su excreción por el canalículo biliar es la que permite evaluar con una alta fiabilidad el parénquima hepático, caracterizar su anatomía, las lesiones focales y las alteraciones del árbol vascular y biliar5. En esta revisión se tratarán las propiedades y las características de los medios de contraste hepatoespecíficos de gadolinio en la RM, sus indicaciones clínicas y los criterios de interpretación radiológica de los hallazgos principales.
Tipos de contraste hepatoespecíficos usados en estudios hepáticos con resonancia magnéticaLos medios de contraste hepatoespecíficos se incorporan al interior de los hepatocitos a través de un mecanismo de transporte activo por proteínas de membrana. Una vez en el interior del hepatocito pueden volver al espacio vascular sinusoidal o excretarse al canalículo biliar. Esta dinámica marca las diferentes fases de visualización de los vasos, del parénquima hepático y del árbol biliar. La captación por los hepatocitos se produce a través del grupo de transportadores organic anion transporting polypeptides (OATP1), particularmente el OATP1B1/B3 (también denominado OATP8) localizados en la membrana sinusoidal del hepatocito. Desde el interior del hepatocito (fig. 1), parte de este contraste intracelular se excreta a la bilis a través del transportador multidrug resistance-associated protein 2 (MRP2) localizado en la membrana canalicular6,7. Otra parte del contraste vuelve al espacio vascular a través del transportador sinusoidal multidrug resistance-associated protein 3/4) (MRP3/MRP4). Este aclaramiento hacia la sinusoide depende del flujo portal8. Las lesiones hepáticas cuya celularidad haya perdido la expresión de estos transportadores y las lesiones cuyo origen no sea hepatocelular no incorporarán este contraste al interior de sus células.
Esquema del transporte y acumulación del contraste hepatoespecífico al interior del hepatocito. Existe captación activa desde la membrana sinusoidal a través del transportador OATP8 (=OATP1 B1/B3) y excreción hacia el canalículo biliar a través del canal MPR2. Parte del contraste intracelular puede volver al espacio vascular a través del transportador sinusoidal MRP3/MRP4.
En Europa se dispone actualmente de 2 medios de contraste hepatobiliares para su uso asistencial. Ambos contrastes se administran por vía intravenosa, están basados en el gadolinio, y presentan una captación y una excreción hepática parcial, lo que permite obtener imágenes en la fase en la que el contraste está predominantemente en el interior del hepatocito, denominada fase hepatobiliar (FHB). Estos contrastes son el ácido gadobénico (Multihance®, Braco, Italia) y el ácido gadoxético (Primovist/Eovist®, Bayer-Schering Pharma, Alemania). En este trabajo se empleará la denominación Gd-BOPTA y Gd-EOB-DTPA para estos contrastes, dada su mayor familiaridad con el lenguaje radiológico.
Estructuralmente, tanto el Gd-BOPTA como el Gd-EOB-DTPA son moléculas lineales iónicas con capacidad para fijarse a las proteínas plasmáticas. En el caso del Gd-BOPTA, la formulación presenta una concentración de 0,5mmol/ml, con una dosis habitual de 0,1ml/kg de peso. En cuanto al Gd-EOB-DTPA su dosis aprobada es de 0,1ml/kg de peso, aunque su concentración es menor, de 0,25mmol/ml.
El Gd-BOPTA presenta una excreción hepática aproximada del 4% de la dosis administrada. Para la obtención de imágenes en la FHB deben adquirirse imágenes a los 90-120min para maximizar la captación del parénquima hepático. Este contraste permite obtener un estudio dinámico con las fases arteriales precoz y arterial tardía, portal, y de equilibrio entre los compartimentos vascular e intersticial, todas ellas separadas de la FHB que es mucho más tardía. Respecto al Gd-EOB-DTPA, su excreción biliar es aproximadamente del 50%, lo que permite obtener imágenes en la FHB a partir de los 20min tras su administración intravenosa. El Gd-EOB-DTPA también permite obtener un estudio dinámico completo con fase arterial precoz y arterial tardía, y portal. La fase de transición representa una mezcla de contraste en el intersticio y en el hepatocito, por lo que es diferente de la fase de equilibrio tradicional que presentan el resto de los contrastes. Las principales características fisicoquímicas de ambos compuestos, Gd-BOPTA y Gd-EOB-DTPA, se resumen en la tabla 1. En este trabajo se definen unos protocolos de adquisición de las secuencias dinámicas tras la administración de contraste con una velocidad de inyección del contraste de 2ml/s y un volumen ajustado a peso (0,1ml/kg), según se indica en el prospecto.
Principales características fisicoquímicas de los 2 contrastes hepatobiliares comercializados en Europa: Gd-BOPTA y Gd-EOB-DTPA
| Gd-BOPTA | Gd-EOB-DTPA | |
|---|---|---|
| Nombre comercial | Multihance® | Primovist/Eovist® |
| Exceso de ligandoa | 0% | 0,5% |
| Osmolalidad (mOsm/kg H2O, 37°C) | 1970 | 688 |
| Viscosidad (mPa·s, 37°C) | 5,3 | 1,2 |
| Constante de estabilidad termodinámica (Log Kterm) | 22,6 | 23,5 |
| Constante de estabilidad condicional (Log Kcond) | 18,4 | 18,7 |
| T1/2 | <5 s | <5 s |
| Relajatividad (r1/r2, 1,5T)b | 6,0-6,6/7,8-9,6 | 6,5-7,3/7,8-9,6 |
| Relajatividad (r1/r2, 3,0T)b | 5,2-5,8/10,0-12,0 | 5,9-6,5/10,0-12,0 |
| Eliminación | 96% renal4% hepática | 50% renal50% hepática |
Tras la administración del medio de contraste, las imágenes de la RM se adquieren con una temporalidad que está marcada por el compartimento principal dónde exista una mayor concentración del compuesto inyectado. Dadas las diferencias en el comportamiento dinámico de los contrastes hepatoespecíficos, la denominación de alguna de las fases tras su administración varía en función del contraste empleado.
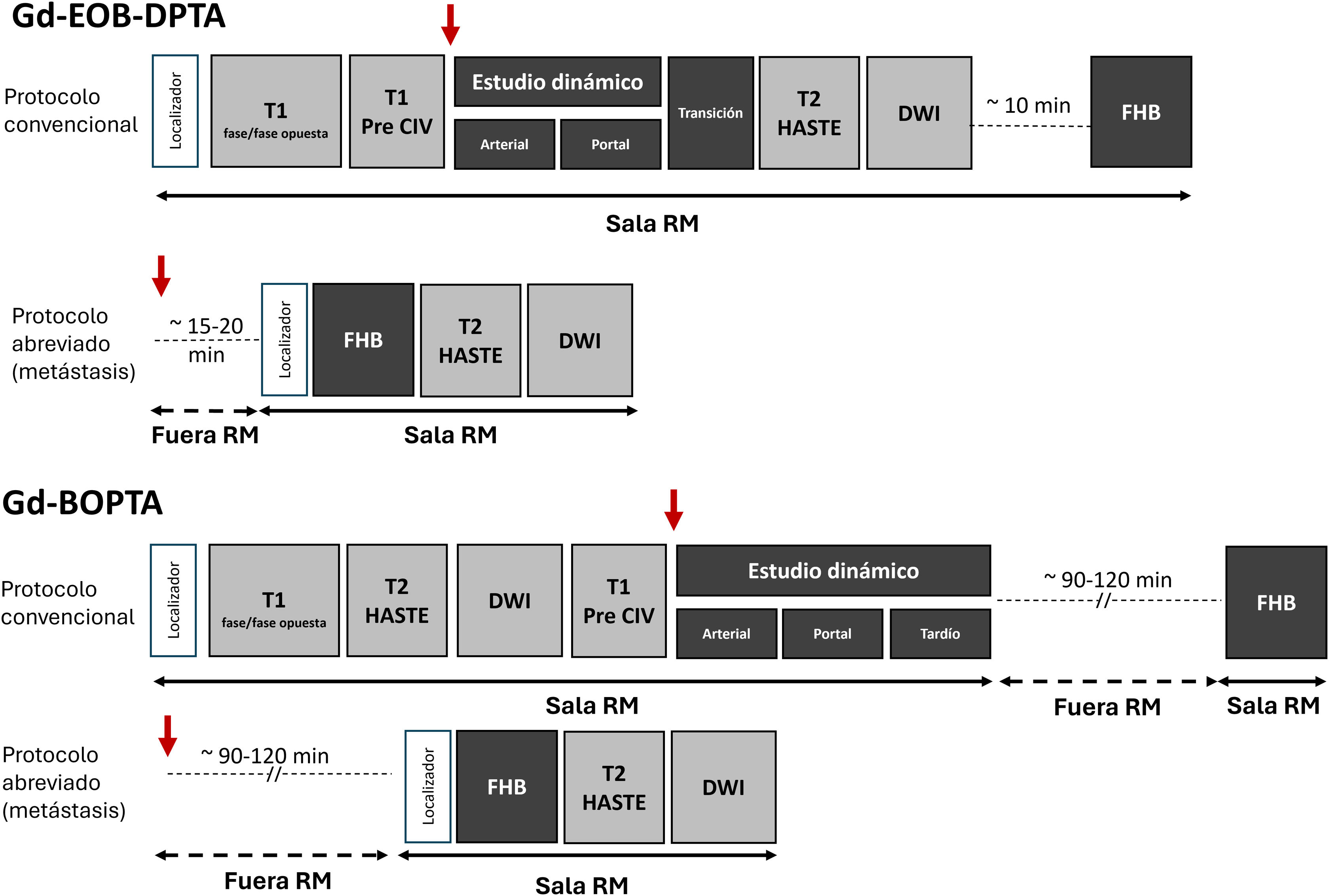
La mayor parte de los parámetros que se utilizan en los protocolos de adquisición de la RM hepática con contrastes hepatoespecíficos son similares a los empleados para los medios de contraste extracelulares, a excepción de las imágenes obtenidas en la FHB cuya demora dependerá, como se ha mencionado, del tipo de contraste empleado. En ocasiones puede que solamente se necesite adquirir la FHB en lo que conocemos como protocolos abreviados para la detección prequirúrgica de metástasis hepáticas, especialmente en pacientes con cáncer colorrectal10. La figura 2 resume los protocolos habituales empleados con los contrastes hepatoespecíficos. La secuencia principal para el estudio precontraste, dinámico y FHB está basada en eco de gradiente, 3D, con tiempos TR/TE muy cortos, un ángulo de inclinación (flip angle) entre 13 y 30o, y usualmente con supresión de la señal de la grasa para maximizar la señal del contraste.
Protocolos de la RM hepática habituales para contrastes hepatoespecíficos. Se representa un protocolo convencional y un protocolo abreviado que puede emplearse en la detección de metástasis hepáticas, en ambos casos inyectando el contraste fuera del equipo de RM y esperando 15-20min en Gd-EOB-DPTA y 90-120min en Gd-BOPTA. En todos los casos, la flecha roja indica la inyección intravenosa del contraste. DWI: difusión; FHB: fase hepatobiliar.
En esta fase, la arteria hepática y sus ramas presentan un realce completo mientras que el contraste aún no ha alcanzado las venas suprahepáticas. La definición ACR-LIRADS11 distingue 2 fases arteriales: 1) la fase arterial precoz, en la que la vena porta no está opacificada y 2) la fase arterial tardía, en la que ya existe opacificación de la vena porta, pero no de las venas suprahepáticas.
El tiempo que debemos esperar entre el comienzo de la inyección del contraste en una vena periférica de la extremidad superior y la adquisición de las imágenes es un parámetro muy importante. En general, se prefiere adquirir la fase arterial precoz una vez se detecta el contraste en la aorta abdominal en los estudios con detección de bolo (bolus tracking). La región de interés (ROI) para identificar la llegada del bolo de contraste debe situarse en el centro del vaso, habitualmente en la aorta abdominal cerca del origen del tronco celíaco. Para maximizar la calidad del estudio arterial en la adquisición dinámica, se utiliza un bolo de empuje de suero salino de 25ml, inmediatamente tras finalizar la inyección del contraste y a la misma velocidad.
Usualmente se adquieren 2 fases arteriales, una precoz y otra tardía. La fase arterial precoz se adquiere unos 5s tras detectar la llegada de contraste a la aorta (es el tiempo necesario para cancelar la secuencia de trazabilidad del bolo e iniciar la adquisición). Si no se dispone de esta secuencia, la fase arterial precoz podría obtenerse unos 15s después de la inyección, aunque la calidad de la fase arterial no estará garantizada. En el caso de la fase arterial tardía, esta se adquiere unos 20s en estudios con detección de bolo, o aproximadamente 30-35s tras la administración venosa periférica.
La fase arterial tardía es fundamental para maximizar la detección y la caracterización del carcinoma hepatocelular (CHC)12, por lo que la obtención de unas imágenes con calidad diagnóstica durante esta fase es crítica. Por este motivo, actualmente los protocolos de imagen hepática se realizan con múltiples adquisiciones durante la fase arterial, lo que minimiza la variabilidad en los estudios. Estas adquisiciones arteriales múltiples minimizan los problemas asociados a la disnea transitoria autolimitada que puede suceder durante la adquisición de la fase arterial tras la administración de Gd-EOB-DTPA, lo que provoca artefactos de movimiento limitando la calidad de la adquisición. Así, un metaanálisis reciente13 constató una incidencia de artefactos transitorios graves del 13% en las adquisiciones arteriales únicas, frente al 3% en las adquisiciones multifásicas, con una diferencia estadísticamente significativa. También se observó una diferencia significativa en la incidencia de estos artefactos transitorios entre estudios realizados con población occidental (Europa y EE. UU., 16%) y oriental (Asia-Pacífico, 9%)13. La edad superior a 65 años, un índice de masa corporal ≥25kg/m2, la presencia de enfermedad pulmonar obstructiva crónica y la existencia de derrame pleural moderado o grave son factores de riesgo independientes para que aparezcan estos artefactos en las adquisiciones arteriales tras la administración de Gd-EOB-DPTA14.
Fase portal o fase venosa portalLa serie de imágenes adquirida en la fase portal se obtiene aproximadamente a los 60s tras la administración de contraste intravenoso en el miembro superior o aproximadamente a los 50s tras el umbral de disparo en los estudios con detección de bolo. Durante esta fase el parénquima hepático presenta su máximo realce, y tanto la vena porta como las venas suprahepáticas se encuentran completamente opacificadas. Estas imágenes permiten valorar la presencia de lavado tumoral en pacientes con CHC independientemente del medio de contraste. También es la fase del estudio dinámico con mayor rentabilidad diagnóstica en la detección de metástasis hepáticas.
Fase de equilibrio o tardíaEsta serie se obtiene aproximadamente a los 3min tras la administración del contraste extracelular y Gd-BOPTA. En esta fase la vena porta y las venas suprahepáticas están opacificadas, pero menos que en la fase venosa portal. También se observa realce del parénquima hepático, pero de menor intensidad que en la fase portal. En los estudios realizados con medios extracelulares o con Gd-BOPTA, es posible determinar durante esta fase la presencia de lavado según criterios LI-RADS en los pacientes con hepatopatía crónica.
Esta fase no existe si se emplea como contraste Gd-EOB-DPTA.
Fase de transiciónEsta fase se obtiene en los estudios con Gd-EOB-DPTA, ya que este contraste se incorpora precozmente a los hepatocitos y no existe una fase extracelular pura más allá de la fase portal. Esta fase no se considera en los estudios realizados con Gd-BOPTA. En general, se obtiene entre los 2 y los 5min tras la administración del contraste, donde existe una transición con el contraste tanto en el compartimento extracelular como intracelular. En esta fase, los vasos y el parénquima hepático tienen una intensidad de señal similar. Para la caracterización de las lesiones focales en pacientes con hepatopatía crónica, la presencia de hipointensidad durante esta fase de transición no se considera lavado en la mayoría de las guías internacionales, a excepción de la guía KLCA-NCC de Corea del Sur15,16.
Fase hepatobiliarEl retraso con el que se debe obtener la FHB está en función del medio de contraste utilizado. El Gd-EOB-DPTA permite obtener una FHB de calidad ya a los 15-20min tras su administración intravenosa. En algunos centros se realizan las secuencias de DWI y T2-WI después del estudio dinámico para optimizar el protocolo y reducir el tiempo de adquisición del estudio17.
Por otro lado, los estudios que emplean Gd-BOPTA requieren de un mayor tiempo de espera, entre 90-120min, para la obtención de la FHB. En estos casos el paciente suele esperar fuera de la sala del equipo de RM para su adquisición. Esta situación añade tiempo al estudio, aunque la adquisición de esta segunda parte es rápida y apenas distorsiona la citación cuando se controla.
La FHB se considera de calidad adecuada cuando el parénquima hepático presenta hiperintensidad de forma inequívoca comparado con los vasos sanguíneos. La presencia de contraste excretado a la vía biliar no equivale a un realce del parénquima hepático máximo, y por sí sola no implica una FHB de calidad11,12,18.
En los pacientes con enfermedades hepáticas, debido a la pérdida de funcionalidad de los transportadores de membrana de los hepatocitos, es habitual observar una disminución del realce del parénquima en esta FHB, así como un enlentecimiento en la obtención de realce hepático máximo. Además, en esta situación puede observarse un patrón de realce heterogéneo si existe fibrosis hepática o trastornos en la perfusión sinusoidal significativos. También se ha descrito un patrón de hipocaptación con distribución periportal en otras hepatopatías crónicas, especialmente en la cirrosis biliar primaria y en la hipertensión portal idiopática18.
Algunos estudios han empleado este realce del parénquima hepático para determinar la función del hígado de forma cualitativa y cuantitativa, lo que puede resultar de utilidad en el seguimiento a largo plazo y la monitorización tras tratamiento19. Por ejemplo, el realce relativo del hígado está relacionado directamente con la probabilidad de supervivencia a un año en pacientes con trasplante hepático20.
Indicaciones clínicasLa mayor parte de las lesiones focales hepáticas no presentan hepatocitos normales y funcionantes y no van a presentar captación de los medios contraste hepatoespecíficos, por lo que la mayoría de las lesiones se presentan como hipointensas en FHB.
Algunas lesiones presentan captación de medios de contraste a través de los transportadores OATP8, lo que constituye una característica valiosa para la caracterización de lesiones focales. La tabla 2 resume el comportamiento de las principales lesiones evaluadas habitualmente mediante medios de contraste hepatoespecíficos en diferentes contextos clínicos.
Clasificación de los principales tipos de lesiones focales hepáticas en función del contexto clínico y su comportamiento habitual en la fase hepatobiliar
| Contexto clínico | Tipo de lesión | Comportamiento habitual durante la FHB | Comentarios adicionales |
|---|---|---|---|
| Pacientes no cirróticos | Hiperplasia nodular focal (HNF) | Iso/hiperintensas en el 97%Algunas lesiones pueden presentar un anillo periférico hiperintenso | Lesión benigna que rara vez requiere tratamiento quirúrgico. |
| Adenoma hepatocelular (AHC) | Hipointensidad:100% de los AHC HNF-1α-inactivadoIso/hiperintensidad: 59% de los β-catenina mutados;14% de AHC inflamatorios; 11% de los AHC no clasificados | Neoplasia hepatocelular benigna con diferentes subtipos moleculares. Diferente riesgo de sangrado y de transformación maligna en función del subtipo. | |
| Pacientes cirróticos | Carcinoma hepatocelular (CHC) | Hipointensidad: comportamiento habitual, mayoría de CHCIso/hiperintensidad: 8,8-14,4% de los CHC | Comportamiento habitual de realce en la fase arterial y lavado durante la fase portal o de equilibrio (Gd-BOPTA). Fase de transición (2-5min) obtenida con GD-EOB-DPTA no válida para la detección de lavado, excepto en guías de Corea del Sur. |
| Colangiocarcinoma intrahepático | Típicamente hipointensos, aunque el centro puede presentar hiperintensidad por acumulación del contraste | Fenómeno nube-EOB menos frecuente que sobre hígado sano. | |
| Nódulos de regeneración | Típicamente isointensos al resto del parénquima | ||
| Nódulos displásicos | Hasta el 30% hipointensos; el resto iso/hiperintensos | ||
| Nódulos cirróticos multiacinares | Morfología en donut con realce periférico en anillo hiperintenso | No presentan realce en fase arterial. | |
| Pacientes oncológicos | Metástasis hepáticas | Hipointensidad:Comportamiento habitual en la mayoría de las metástasis hepáticasIso/hiperintensidad:Retención del material de contraste en zona central | FHB también útil para detección de metástasis de tumores neuroendocrinos. |
| Lesión tipo-HNF | Típicamente hiperintenso o isointensoEn ocasiones, hipointenso con un anillo hiperintenso | Pacientes tratados con regímenes de quimioterapia que contiene oxaliplatino. | |
| Colangiocarcinoma intrahepático | Zona central hiperintensa con anillo periférico hipointenso (fenómeno EOB-cloud) | ||
| Alteraciones vasculares | Lesión tipo-HNF (Budd-Chiari) | Típicamente hiperintenso o isointenso | Suelen ser hiperintensas en T1 e hipointensas en T2 comparado con el resto del parénquima. |
| Lesión tipo-HNF (Fontan) | Típicamente hiperintenso o isointenso | En ocasiones pueden presentar lavado durante la fase portal. |
FHB: fase hepatobiliar.
Las principales indicaciones en este apartado se relacionan con la caracterización de las tumoraciones de origen hepatocelular.
Hiperplasia nodular focal y adenoma hepatocelularLa diferenciación entre la hiperplasia nodular focal (HNF) y el adenoma hepatocelular (AHC) es una de las principales indicaciones en la práctica clínica habitual para realizar estudios de RM y obtener imágenes en la FHB. Ambas entidades presentan características similares en los estudios de imagen convencionales y puede ser difícil su diferenciación (figs. 3 y 4). Establecer esta diferencia es importante, ya que la HNF es una entidad benigna que raramente requiere tratamiento, mientras que el AHC es un tumor benigno que puede presentar riesgo de sangrado y de transformación maligna, por lo que en ocasiones puede requerir tratamiento quirúrgico. Además, los AHC no son una entidad homogénea y presentan diferentes subtipos patológicos con comportamiento y pronóstico diferentes. En el año 2017, se publicó la última versión de la clasificación molecular y de expresión génica de los AHC, que los clasifica en 8 subtipos21. No obstante, la mayoría de los grupos y publicaciones consideran 4 principales subtipos: adenoma HFN1α-inactivado (HFN1α; hepatocyte nuclear factor 1 α), el adenoma inflamatorio, el adenoma β-catenina mutado y adenoma no clasificado.
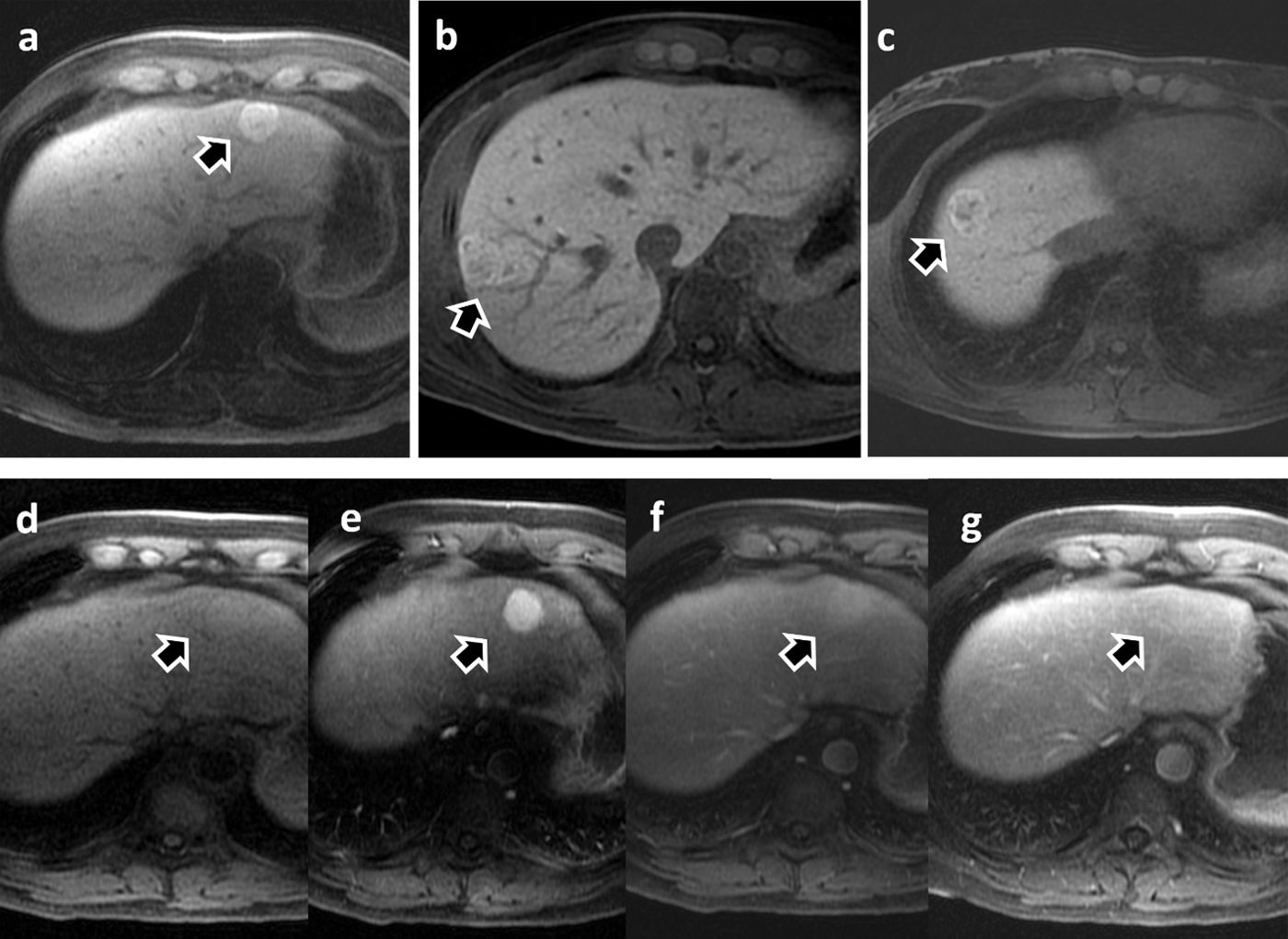
Hiperplasia nodular focal (HNF). Las flechas en las imágenes a-c muestran 3 lesiones con acumulación de contraste de 3 pacientes diferentes caracterizadas como HNF durante la fase hepatobiliar con Gd-BOPTA. Las imágenes d-g muestran el estudio dinámico del paciente de la imagen a. La lesión se presenta ligeramente hiperintensa en T1 sin contraste (d), marcado realce durante la fase arterial (e) y progresivamente homogenización con el parénquima hepático en fase portal (f) y tardía (g).
Adenoma hepatocelular subtipo inflamatorio (confirmado con biopsia) en paciente de 35 años en tratamiento con anticonceptivos orales. La lesión se presenta hiperintensa en T2-WI (a) comparado con el parénquima hepático, hallazgo típico del subtipo inflamatorio. En las secuencias de fase y fase opuesta (b y c) se observa caída de señal en parte de la lesión por presencia de grasa intracelular (observese también caída de señal en el parénquima hepático por esteatosis). En el estudio dinámico (d, T1-WI sin CIV; e, fase arterial; f, fase portal y g, fase hepatobiliar) destaca la marcada hipointensidad durante la fase hepatobiliar (g).
El adenoma HFN1α-inactivado presenta bajo riesgo de complicaciones cuando su tamaño es inferior a 5cm. Su asociación con el uso de anticonceptivos orales y obesidad es menor que en el caso del adenoma inflamatorio, que se encuentra fuertemente asociado. Ambos subtipos presentan una mayor incidencia en mujeres y son los subtipos más frecuentes.
Los adenomas β-catenina mutado son un grupo de adenomas con mutaciones en el gen CTNNB1 (catenina β-1) en el exón 3 o en el exón 7/8. La mutación en el exón 3 presenta un alto riesgo de malignización (de hasta el 40%) y la mutación del exón 7/8 presenta un alto riesgo de sangrado con menor riesgo de malignización. La mutación del exón 3 se asocia al uso de anabolizantes esteroideos y al sexo masculino21,22.
Una revisión sistemática ya clásica concluyó que la intensidad de señal de la tumoración en la FHB presentaba un alto rendimiento diagnóstico para diferenciar la HNF del AHC, con una sensibilidad del 91-100% y una especificidad del 87-100% para el diagnóstico de HNF23. La HNF es la entidad más común que presenta captación con iso- o hiperintensidad de la lesión durante la FHB. Sin embargo, esta característica no es exclusiva de la HNF y también puede observarse en algunos subtipos de AHC e incluso en algunos CHC bien diferenciados. Así, por ejemplo, hasta el 83% de los adenomas β-catenina mutados presentan iso- o hiperintensidad durante la FHB24.
Una revisión sistemática más reciente25 incluyó 410 casos de AHC y observó que hasta el 14% de ellos presentan iso- o hiperintensidad durante la FHB. Cuando se analizó este comportamiento en función de los subtipos patológicos, el porcentaje varió desde el 0% de los adenomas HNF1α-inactivado hasta el 59% de los β-catenina mutados. Los adenomas inflamatorios y los no clasificados presentaron una proporción del 14 y de 11%, respectivamente. En este mismo trabajo, la especificidad de la iso o hiperintensidad de la lesión en la FHB para diferenciar la HNF del AHC fue del 89% si se incluyen todos los subtipos de AHC. Sin embargo, esta especificidad desciende al 65% si solo se incluyen los subtipos β-catenina mutado y los no clasificados. Los autores concluyen que el alto rendimiento diagnóstico de la iso o hiperintensidad en FHB es debida a la baja prevalencia de estos subtipos, especialmente del β-catenina mutado. Esto puede resultar un problema relevante en la práctica clínica ya que el subtipo β-catenina mutado en el exón 3 es el subtipo con mayor riesgo de malignización entre los adenomas, como se ha mencionado previamente.
Por tanto, aunque tradicionalmente, se ha empleado la intensidad de señal en FHB para diferenciar de forma sencilla los AHC de la HNF, la mayoría de estos estudios no consideraron los subtipos de adenoma y estas 2 entidades no pueden diferenciarse únicamente por la intensidad de señal en FHB. Para su caracterización precisa debe combinarse con otras características, como, por ejemplo, la presencia de lípidos intracelulares en el adenoma HNF1α-inactivado, o la marcada hiperintensidad en T2 y el signo de atolón en el adenoma inflamatorio22.
Lesiones tipo hiperplasia nodular focalLos tratamientos quimioterápicos, especialmente aquellos basados en oxaliplatino que se utilizan en pacientes con cáncer de páncreas o colorrectal, pueden inducir en el hígado la formación de lesiones regenerativas similares a la hiperplasia nodular focal (tipo-HNF o FNH-like, por sus sigas en inglés). El desarrollo de lesiones tipo-HNF y su observación en los estudios de seguimiento de los pacientes con neoplasias del tracto digestivo puede inducir a error al confundirse con metástasis, lo que conlleva el riesgo de cambios inadecuados de tratamiento e incluso la realización de procedimientos invasivos innecesarios. Las lesiones tipo-HNF presentan un comportamiento típico en RM, con presencia de realce durante la fase arterial e hiper o isointensidad durante la FHB26. También es característica, hasta en el 50% de las lesiones inducidas por oxaliplatino, la presencia de un anillo hiperintenso en la periferia de la lesión regenerativa en la FHB27.
En los pacientes con hepatopatía tras cirugía Fontan, una técnica derivativa de flujo entre la vena cava inferior y la arteria pulmonar para pacientes con malformaciones cardíacas congénitas, es habitual el desarrollo de lesiones regenerativas hipervasculares benignas de aspecto similar a la HNF. En este contexto, además de la apariencia descrita anteriormente, algunas de estas lesiones tipo-HNF pueden mostrar características típicas del CHC como el lavado durante la fase portal, lo que en ocasiones dificulta el diagnóstico28,29.
Más de un 30% de los pacientes con síndrome de Budd-Chiari desarrollan lesiones tipo-HNF30. A diferencia de la HNF, estas lesiones pueden mostrarse hiperintensas en las imágenes potenciadas en T1 e hipointensas en las potenciadas en T2 cuando se comparan con el resto del parénquima hepático. Es habitual y característica la presencia de realce arterial y la retención del contraste en la lesión durante la FHB (fig. 5)26,30.
Lesiones tipo hiperplasia nodular focal (tipo-HNF) en 2 pacientes diferentes. a-d) Mujer de 45 años con síndrome de Budd-Chiari y múltiples lesiones tipo-HNF, con Gd-BOPTA. Destaca la presencia de la lesión marcada con flecha, hipointensa comparada con resto del parénquima en secuencia T2-WI (a) e hiperintensa en T1 (b). La lesión presenta realce arterial (c; fase arterial con sustracción) e hiperintensidad durante la FHB (d). e-g) Varón de 23 años con procedimiento de Fontan y RM hepática con Gd-EOB-DPTA. Pueden observarse múltiples lesiones focales hepáticas con características de tipo-HNF. Presentan hiperintensidad en T1 sin contraste IV (e) con realce durante la fase arterial (f), isointensidad durante la fase portal (g) y marcada hiperintensidad durante la fase hepatobiliar (h).
La gran mayoría de los carcinomas hepatocelulares (CHC) se desarrollan en pacientes con cirrosis hepática. El diagnóstico no invasivo de esta neoplasia primaria hepática está aceptado en los pacientes con hepatopatía crónica cuando se demuestra unas características concretas en el comportamiento dinámico de la lesión tras la administración del medio de contraste. Según las guías europeas de la EASL31, puede establecerse el diagnóstico no invasivo de CHC cuando se cumplen todos estos criterios: nódulos mayores de 1cm que presenten hiperrealce en la fase arterial y lavado durante la fase portal o de equilibrio. Los criterios LIRADS v201811 permiten el diagnóstico definitivo de CHC e incluyen además otras características de imagen como la presencia de pseudocápsula durante la fase portal y el crecimiento del nódulo en estudios seriados (fig. 6).
Paciente con cirrosis por VHB. La RM hepática dinámica con Gd-EOB-DPTA. Lesión focal hepática con criterios definitivos de hepatocarcinoma: presencia de realce en fase arterial (b), con lavado y formación de pseudocápsula durante la fase portal (c) e hipointensidad durante la fase hepatobiliar (d).
A diferencia de los criterios anteriores de la EASL y LIRADS, en los que la presencia de hipointensidad en la FHB no se considera un criterio mayor y es diferente al lavado tumoral, algunas de las principales guías diagnósticas asiáticas, como la KLCA-NCC de Corea del Sur16 o la JSH-HCC de Japón32, consideran la hipointensidad en esta FHB como lavado siempre que pueda excluirse que la sesión se comporte como un hemangioma por su alta señal en T2 o un colangiocarcinoma intrahepático por su aspecto en diana en la imagen potenciada en difusión. Esta discrepancia entre las guías de Europa/EE. UU. y las asiáticas se basan en que los criterios diagnósticos buscan «alta especificidad» o «alta sensibilidad», respectivamente, en función de la incidencia de la enfermedad en cada región33 y en la aproximación terapéutica: el trasplante hepático o los tratamientos locales15,34.
La hipointensidad de las lesiones de CHC se debe a la pérdida de los transportadores de membrana con la desdiferenciación celular. La disminución de la expresión de OATP1B3 es una de las alteraciones que se producen en la hepatocarcinogénesis, por lo que la mayoría de los CHC se presentan como hipointensos en la FHB35. En este sentido, los criterios LIRADS consideran la hipointensidad durante esta fase como un criterio auxiliar sugestivo de malignidad, y la isointensidad o hiperintensidad de la lesión durante esta fase un criterio que favorece benignidad. No obstante, hemos de recordar que entre el 9 y el 14% de los CHC pueden presentar hiperintensidad en la FHB por sobreexpresión del transportador OATP8, tratándose de CHC bien diferenciados con un mejor pronóstico36,37.
En los últimos años, la generalización del uso de medios de contraste hepatoespecíficos ha generado un interés creciente en los nódulos hipointensos en la FHB que no presentan realce en fase arterial38. En general, se reconoce que estas lesiones pueden representar estadios iniciales del CHC ya que durante el proceso de la hepatocarcinogénesis, la disminución en la expresión del transportador OATP837 ocurre antes del desarrollo de los cambios característicos en la vascularización del tumor. Identificar y caracterizar adecuadamente estos nódulos y su progresión a nódulos hipervascularizados mediante seguimiento más estrecho permite un tratamiento precoz del CHC.
En un estudio multicéntrico retrospectivo con pacientes de alto riesgo de desarrollar CHC, los nódulos ≤30mm, hipointensos en la FHB y sin realce en la fase arterial se correspondieron en un 44% de casos con CHC avanzados, en un 20% a CHC precoz, un 28% en nódulos displásicos de alto grado, y solo un 8% en nódulos displásicos de bajo grado o nódulos regenerativos39. En un intento de ajustar más la probabilidad de malignidad, se han descrito los factores predictores de la transformación hipervascular de estos nódulos: un tamaño >10mm, la presencia de hiperintensidad en las imágenes T2, la restricción en las imágenes potenciadas en difusión, y la existencia de un CHC previo13.
Colangiocarcinoma intrahepáticoEn los pacientes con cirrosis, el cribado por imagen para detectar CHC permite localizar también lesiones de colangiocarcinoma intrahepático en estadios iniciales. Este colangiocarcinoma suele presentarse como una lesión con realce periférico o en anillo en las imágenes obtenidas en la fase arterial y con realce centrípeto en las fases portal o tardía, aunque en ocasiones la diferenciación entre ambas entidades es problemática en pacientes con cirrosis (fig. 7). En la FHB se ha descrito un comportamiento del colangiocarcinoma intrahepático como una tumoración con una zona central mal definida en sus bordes de mayor intensidad de señal. denominado «nube EOB» (EOB-cloud en inglés), y rodeada por un margen hipointenso40. No obstante, este comportamiento no es habitual en los colangiocarcinomas sobre hígado cirrótico.
Colangiocarcinoma intrahepático en paciente con cirrosis hepática. La RM hepática con Gd-BOPTA (a), sin contraste; b) fase arterial; c) fase portal; d) fase hepatobiliar; e) difusión con b=800) mostró una lesión con realce arterial en anillo (b) que persistió durante la fase portal (c). En la fase hepatobiliar (d) destaca la hipointensidad de la mayor parte de la lesión con zona central hiperintensa, probablemente por retención de contraste en la matriz extracelular. También se observa restricción de la difusión (e). La lesión fue biopsiada y se confirmó el diagnóstico de colangiocarcinoma intrahepático.
La Clasificación Internacional de Lesiones Hepatocelulares divide en este contexto las lesiones en regenerativas y displásicas/neoplásicas41. Entre las lesiones regenerativas se encuentran los nódulos regenerativos monoacinares, entre 1-3mm y constituidos por un solo espacio porta, y los nódulos regenerativos multiacinares o grandes, constituidos por más de un espacio porta. Cuando estas lesiones se observan en la cirrosis hepática se denominan nódulos cirróticos monoacinares o multiacinares, respectivamente42. Los nódulos regenerativos asociados a la cirrosis hepática presentan habitualmente en las imágenes obtenidas en la FHB una intensidad de señal similar a la del parénquima hepático, aunque ocasionalmente se pueden presentar hiperintensos. Dentro de las lesiones regenerativas, hasta en el 6% de los pacientes cirróticos puede observarse en esta FHB los denominados nódulos con realce en donut (HBP-doughnut nodules). Estos nódulos no tienen realce durante la fase arterial y se corresponden con los nódulos cirróticos multiacinares descritos en histología42. Los nódulos displásicos suelen ser iso o hiperintensos en la FHB debido a la preservación de la expresión de los transportadores OATP1B3. Sin embargo, hasta un tercio de estos nódulos displásicos de alto grado pueden ser hipointensos en la FHB35. Vemos pues que la hipointensidad en la FHB de un nódulo en presencia de hepatopatía crónica es un criterio de alerta y seguimiento a corto plazo.
Detección de metástasis hepáticasLas metástasis constituyen el tumor hepático maligno más frecuente43. El empleo de la RM con medios de contraste hepatoespecíficos y la adquisición de imágenes en FHB ha mejorado el rendimiento diagnóstico en su detección, con una rentabilidad diagnóstica superior a la TC y a la RM con medios de contraste extracelulares (fig. 8).
Pequeña metástasis hepática en paciente con adenocarcinoma de páncreas detectada en la RM hepática con Gd-BOPTA. a) Fase hepatobiliar, b) Secuencia de difusión (b=800) y c) Mapa del coeficiente de difusión aparente (ADC). En estudio de TC realizado para la estadificación local (d) realizado previamente, la lesión no fue detectada y es díficilmente identificable. Se confirmó la lesión metastásica mediante biopsia.
La combinación de imágenes potenciadas en difusión y en la FHB es la mejor estrategia para maximizar la detección de metástasis. En un metaanálisis que incluyó 39 estudios, la combinación de la secuencia de difusión junto con la FHB obtuvo la mejor sensibilidad, con un 96% para la detección de metástasis. Esta combinación mejoró la sensibilidad comparada con el uso de forma aislada, del 87 y 91%, respectivamente44. Este estudio evidenció resultados similares incluso para metástasis menores de 1cm. Otros estudios han comparado el uso de protocolos de RM convencionales con estudio dinámico completo frente a protocolos abreviados (incluyen imágenes potenciadas en T2, difusión y FHB) para la detección de metástasis en el cáncer colorrectal, y obtuvieron tasas de detección de metástasis similares con ambos protocolos45.
En la evaluación de metástasis hepáticas por tumores neuroendocrinos, la combinación de la FHB y la secuencia de difusión también presentó la tasa de detección más alta con comparado con el resto de las combinaciones de secuencias y presentó una sensibilidad y una especificidad del 86 y 94%, respectivamente46. En este mismo trabajo, esta combinación presentó la mayor concordancia interobservador de forma estadísticamente significativa. Otro estudio mostró que la secuencia de FHB presentaba la mayor relación contraste/ruido para la detección de metástasis hepáticas de tumores neuroendocrinos47. Estos estudios sugieren utilizar contrastes hepatoespecíficos en la evaluación de pacientes con sospecha de metástasis por tumores neuroendocrinos (fig. 9).
Paciente con metástasis hepática de tumor neuroendocrino ileal. La RM hepática dinámica con Gd-BOPTA (a-f): a) fase sin contraste; b) fase arterial; c) fase portal; d) fase hepatobiliar; e) T2-WI; f) difusión con b=800); y PET/TC con Ga-68-DOTATATE (g). La lesión es hipervascular durante la fase arterial (b), apenas se visualiza durante la fase portal (c) y es marcadamente hipointensa en FHB (d), así como hiperintensa en la secuencia de difusión (f). El PET/TC confirmó la presencia de receptores de somatostina en la lesión (g).
La mayoría de las metástasis hepáticas son hipointensas en la FHB dada la ausencia de hepatocitos y transportadores de membrana. No obstante, algunas lesiones, principalmente metástasis de adenocarcinoma, presentan una zona central relativamente hiperintensa durante la FHB, que tiene el mismo comportamiento de realce en nube que el que se observa en el colangiocarcinoma. Esta captación probablemente se deba al acúmulo del contraste en la matriz extracelular con fibrosis o a su difusión a la zona de necrosis central36.
Valoración de la vía biliar y la función hepáticaLa obtención de imágenes durante la excreción biliar del contraste hepatoespecífico, permite obtener un estudio detallado del árbol biliar, tanto para la evaluación prequirúrgica en procedimientos que se estima complejos como para demostrar la presencia de fugas biliares, incluso dependientes de pequeñas ramas.
En la valoración de donantes hepáticos vivos para el trasplante hepático, la adición de secuencias de colangiografía 3D potenciadas en T1 tras la administración de contraste hepatobiliar mejoró la visualización de los ductos biliares de segundo orden e incrementó la confianza diagnóstica en la valoración de la anatomía biliar comparado con secuencias de colangio-RM potenciadas en T248.
La fuga biliar es una de las principales complicaciones de la cirugía hepática, y se presenta con una incidencia del 4-10%. Su existencia condiciona un aumento en la morbilidad con prolongación de la estancia hospitalaria y un incremento de la mortalidad49. En un estudio que evaluó la colangiografía por RM con medio de contraste hepatobiliar en pacientes con fugas biliares de más de una semana de duración, se logró una exactitud del 100% en su detección y localización49. Esto evitó la realización de colangiografía directa invasiva e identificó las fugas periféricas subsidiarias de tratamiento conservador.
En nuestra experiencia, en los pacientes con alta sospecha de fuga biliar y con presencia de colecciones perihepáticas, es conveniente realizar los estudios de colangiografía por RM adquiriendo las imágenes más tardías con respecto a la FHB habitual, ya que, en ocasiones, la excreción está enlentecida y las fugas pueden pasar desapercibidas en las primeras fases de la excreción biliar (fig. 10).
Paciente de 62 años con colección detectada en ecografía tras colecistectomía. Estudio hepático dinámico con Gd-EOB-DPTA. En la fila superior: a) sin contraste; b) fase arterial; c) fase portal; d) fase tardía; e) fase de transición. En la fila interior adquisiciones secuenciales durante la fase hepatobiliar y adquisiciones adicionales que permiten identificar la extravasación del material de contraste (flechas) hacia la colección en las imágenes de los minutos 26, 30 y 40.
El grado de realce hepático está directamente relacionado con la masa de hepatocitos funcionantes y su eficiencia para incorporar el medio de contraste. Las áreas del hígado con función reducida o hepatocitos dañados mostrarán un menor realce. Este comportamiento diferencial permite evaluar la función hepática. La RM con FHB se ha integrado en la práctica clínica y ofrece un excelente método no invasivo para evaluar la función hepática. Diversos estudios han demostrado que la combinación de radiómica y variables clínicas con modelos de aprendizaje profundo puede estratificar la reserva funcional hepática de manera efectiva en los pacientes con enfermedad hepática50,51.
ConclusiónLos medios de contraste hepatoespecíficos permiten una mejor detección y caracterización de las lesiones focales hepáticas en la mayoría de las situaciones clínicas, tanto en pacientes oncológicos, pacientes con hepatopatía crónica y pacientes con lesiones probablemente de origen hepatocelular. Además, facilitan la evaluación de las lesiones de la vía biliar y la funcionalidad del parénquima hepático, lo que aumenta significativamente la confianza y la seguridad en el diagnóstico.
Autorías- 1.
Responsable de la integridad del estudio: APG, JML y LMB
- 2.
Concepción del estudio: No aplica
- 3.
Diseño del estudio: No aplica
- 4.
Obtención de los datos: No aplica
- 5.
Análisis e interpretación de los datos: No aplica
- 6.
Tratamiento estadístico: No aplica
- 7.
Búsqueda bibliográfica: APG, JML y LMB
- 8.
Redacción del trabajo: APG, JML y LMB
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: APG, JML y LMB
- 10.
Aprobación de la versión final: APG, JML y LMB
Los autores declaran no tener ningún conflicto de intereses.