Suplemento:Actualización y buenas prácticas en los usos de los medios de contraste
Más datosLos contrastes de gadolinio (CGd) de distribución extracelular se utilizan frecuentemente en resonancia magnética (RM) porque aumentan la detección de alteraciones, mejoran la caracterización tisular y permiten un diagnóstico diferencial más preciso.
Los CGd se consideran seguros, pero no están exentos de riesgo. Conocer los riesgos, saber qué actitud adoptar en diferentes situaciones (embarazo, lactancia, insuficiencia renal) y cómo reaccionar si se producen complicaciones (extravasaciones, reacciones adversas, alérgicas y anafilácticas) es imprescindible para el uso adecuado de los CGd.
Se presentan las características de la molécula de gadolinio (Gd), las diferencias en la estructura bioquímica, su biodistribución y el efecto sobre la señal de RM. Se revisan los aspectos de seguridad y las aplicaciones clínicas más frecuentes.
Extracellular gadolinium-based contrast agents (GBCA) are commonly used in magnetic resonance imaging (MRI) because they increase the detection of alterations, improve tissue characterisation and enable a more precise differential diagnosis.
GBCAs are considered to be safe but they are not risk-free. When using GBCAs, it is important to be aware of the risks and to know how to react in different situations (pregnancy, breastfeeding, kidney failure) including if complications occur (extravasations, adverse, allergic or anaphylactic reactions).
The article describes the characteristics of the gadolinium molecule, the differences in the biochemical structure of these GBCA, their biodistribution and the effect on the MRI signal. It also reviews s
afety aspects and the most common clinical applications.
Los medios de contraste basados en gadolinio (Gd) de distribución extracelular son útiles porque aumentan la sensibilidad y la especificidad de la resonancia magnética (RM)1.
El Gd es un metal que, en su forma básica, es tóxico pero unido a grandes moléculas orgánicas forma complejos estables y se convierte en un material inerte, no tóxico, utilizable como medio de contraste. La unión de las moléculas de Gd y las macromoléculas orgánicas se denominan quelatos de Gd2.
Los quelatos de Gd, según su estructura química, tienen propiedades fisicoquímicas, perfiles de seguridad y frecuencia de efectos no deseados diferentes3,4.
Los contrastes de Gd (CGd) son muy bien tolerados, pero no están exentos de provocar reacciones adversas agudas2. Conocer si es necesario el ayuno previo a administrar CGd, saber lo aconsejado sobre los CGd durante el embarazo y la lactancia y cuál es el uso adecuado de CGd en pacientes con insuficiencia renal es fundamental para el uso correcto de estos contrastes. Las diferencias de seguridad de cada CGd deben conocerse para adoptar las medidas necesarias, evitar complicaciones o solucionarlas si se producen5.
El objetivo de este trabajo es presentar las características fisicoquímicas, la farmacocinética, las dosis y modos de administración de los CGd de distribución extracelular, revisar aspectos fundamentales sobre la seguridad de su utilización y resumir las aplicaciones clínicas más frecuentes.
Características fisicoquímicasCaracterísticas del gadolinioEl Gd es un metal blanco plateado, maleable y dúctil del grupo de los lantánidos con el núm. atómico 64, con propiedades magnéticas altas.
El magnetismo del Gd se debe al número y disposición de electrones no apareados en sus capas externas; en su forma iónica el Gd3+ es el ión estable con mayor número de electrones en su capa externa lo que condiciona su elevado efecto paramagnético.
Las propiedades paramagnéticas del Gd3+ provocan alteraciones del campo magnético en torno a la molécula y facilitan la relajación de los núcleos de hidrógeno (H1). La potencia paramagnética de Gd3+ es tan intensa que un solo átomo de Gd3+ provoca acortamiento del tiempo de relajación longitudinal y transversal de muchos H1.
Características de los medios de contrasteEl Gd3+ en su forma libre es tóxico pero unido a grandes moléculas orgánicas forma un complejo inerte, no tóxico, utilizable como medio de contraste. Los CGd pueden ser lineales y macrocíclicos según su estructura y, según su carga, iónicos y no iónicos (tabla 1)4.
Contrastes de gadolinio de distribución extracelular: bioestructura, carga iónica y relajatividad en plasma a 37°C
| Nombre genérico | Nombre comercial | Bioestructura | Carga iónica | Relajatividad r11.5T (mmol–1s–1) | Relajatividad r13T (mmol–1s–1) | Comercializado enEspaña |
|---|---|---|---|---|---|---|
| Gadodiamida | Omniscan®GE Healthcare | Lineal | No iónica | 4,0-4,6 | 3,8-4,2 | No |
| Gadopentetato dimeglumina | Magnevist®Schering-Bayer | Lineal | Iónica | 3,9-4,3 | 3,5-3,9 | No |
| Gadoversetamina | Optimark®Guerbet | Lineal | No iónica | 4,4-5,0 | 4,2-4,8 | No |
| Ácido gadobénicoGadobenato de dimeglumina | MultiHance®Bracco Diagnostics | Lineal | Iónica | 6,0-6,6 | 5,2-5,8 | Sí |
| Gadobutrol | Gadovist®Bayer HealthCare | Macrocíclico | No iónico | 4,9-5,5 | 4,7-5,3 | Sí |
| Pixooscan®GE Healthcare | Macrocíclico | No iónico | 4,9-5,5 | 4,7-5,3 | Sí | |
| Ácido gadotéricoGadoterato meglumina | Dotarem®Guerbet | Macrocíclico | Iónico | 3,4-3,8 | 3,3-3,7 | Sí |
| Clariscan®GE Healthcare | Macrocíclico | Iónico | 3,4-3,8 | 3,3-3,7 | Sí | |
| Gadoteridol | Prohance®Bracco Diagnostics | Macrocíclico | No iónico | 3,9-4,3 | 3,5-3,9 | Sí |
| Gadopiclenol | Vueway®Bracco Diagnostics | Macrocíclico | No iónico | 12,8 | 11,6 | No |
| Elucirem®Guerbet | Macrocíclico | No iónico | 12,8 | 11,6 | No |
Se ha demostrado que los complejos macrocíclicos iónicos son más estables que los lineales y menos propensos a liberar Gd3+ que pueda depositarse en diversos tejidos.
Siguiendo las indicaciones de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y las recomendaciones del Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia, se ha suspendido la comercialización de los CGd lineales Magnevist®, Optimark® y Omniscan®6,7. Aunque existen discrepancias con esa recomendación de paralizar la comercialización de los CGd lineales para uso general, sin tener en cuenta los perfiles individuales de cada uno3.
Efecto de los contrastes de gadolinio sobre la señal de resonancia magnéticaLa molécula de Gd3+ provoca acortamiento del tiempo de relajación longitudinal (T1) y del tiempo de relajación transversal (T2).
El acortamiento del T1 de los protones adyacentes a la molécula de Gd3+ es lo que provoca el aumento de la señal en las secuencias potenciadas en T1. Así pues, la hiperintensidad visible no es el Gd3+ sino su efecto sobre los H1 adyacentes.
El acortamiento del T2 provoca disminución de la intensidad en las secuencias potenciadas en T2.
El efecto predominante del Gd3+ sobre la relajación longitudinal o transversal está en relación con su concentración. Así, con concentraciones bajas predomina el acortamiento de T1 y provoca hiperintensidad en secuencias potenciadas en T1 y con concentraciones altas predomina el acortamiento de T2 que provoca hiposeñal en secuencias potenciadas en T2.
La relajatividad es una propiedad de los CGd que describe el «poder de realce» de un contraste; esta constante física depende de la estructura molecular que determina el número de moléculas de agua con las que interacciona el contraste y de la cinética del compuesto y expresa la capacidad del contraste para modificar los tiempos de relajación de los H1 más próximos. Las unidades de medida de la relajatividad son r1 y r2 y se expresan en mmol–1 s–1 (tabla 1)3,8–10.
Recientemente, se han publicado los resultados fisicoquímicos y farmacocinéticos de una nueva molécula macrocíclica con alta relajatividad, el gadopiclenol10 que ha sido aceptado por la Agencia Europea de Medicamentos (EMA) y en la Reunión del Comité de Medicamentos de Uso Humano (CHMP) de octubre 2023 se ha emitido una opinión positiva11.
Farmacocinética / biodistribuciónLos CGd de distribución extracelular se caracterizan porque son hidrófilos y no se unen a proteínas ni a receptores. Habitualmente, se administran por vía intravenosa (i.v.). De forma inicial, se distribuyen por el espacio intravascular y por su bajo peso molecular pasan rápidamente al espacio intersticial, a través de los capilares. No atraviesan la barrera hematoencefálica ni las membranas celulares intactas y se eliminan sin metabolizar por vía urinaria mediante filtración glomerular1.
La vida media de los CGd, es decir, el tiempo necesario para que un contraste reduzca su concentración a la mitad es de unos 90 minutos en pacientes sanos; habitualmente más del 95% del CGd se ha eliminado en menos de 24 horas4. En caso de insuficiencia renal, la vida media se prolonga; si la insuficiencia es moderada puede ser de unas seis horas, si es severa puede ser mayor de nueve horas y si el filtrado glomerular estimado es <5mL/min o el paciente está en diálisis puede alcanzar las 30 horas4. Tras la fase de eliminación rápida existe una eliminación más lenta de cantidades residuales, nanomolares y de distribución tisular desigual. De hecho, se sabe que la recuperación del CGd en la orina no alcanza el 100% de la dosis administrada y se ha demostrado la presencia de Gd residual principalmente en el hueso, el hígado y el encéfalo lo que indica la existencia de un compartimento intersticial extracelular en el que el Gd podría quedar retenido durante mucho tiempo3.
SeguridadAyunoNo está indicado el ayuno previo a la administración de CGd.
La necesidad de ayuno previo a la administración i.v. de contrastes era habitual cuando se empleaban contrastes yodados hiperosmolares y muchos pacientes vomitaban; por eso, se aconsejaba el ayuno para evitar posibles aspiraciones2,12. Sin embargo, los CGd y los contrastes yodados no iónicos hipo e isomolares tienen un riesgo muy bajo de provocar nauseas, vómitos o aspiración y el ayuno previo a su administración no proporciona ningún beneficio2,12,13.
ExtravasaciónLa extravasación de contrastes es una de las complicaciones más frecuentes de las inyecciones i.v., la mayoría limitadas a los tejidos blandos adyacentes a la vena, la piel y el tejido subcutáneo14,15.
Las extravasaciones de CGd son menos frecuentes que las de contrastes yodados, probablemente por los menores volúmenes de CGd administrados, la velocidad de administración más baja y la administración manual más frecuente16.
Los factores de riesgo de extravasación están relacionados con la técnica y con las condiciones del paciente. Para minimizarlos se aconseja: 1) utilizar angiocatéteres en lugar de agujas de mariposa, 2) realizar una técnica meticulosa de inserción del catéter y 3) fijar la posición del catéter insertado2.
Embarazo y contrastes de gadolinioSe ha demostrado que algunos CGd atraviesan la barrera placentaria en primates no humanos17, alcanzan la circulación fetal y se excretan al líquido amniótico a través de la orina; posteriormente, una pequeña cantidad del CGd puede ser tragada y absorbida desde el intestino fetal y de nuevo eliminada hacia el líquido amniótico.
No se han demostrado efectos adversos sobre el feto tras la administración de CGd a las dosis clínicas habitualmente utilizadas. Sin embargo, en un estudio retrospectivo se citó que existía mayor riesgo de muerte fetal o neonatal, de sufrir enfermedades reumatológicas, inflamatorias o infiltrativas y de problemas de la piel en los niños18 y, aunque se ha cuestionado la metodología de ese estudio y no se ha confirmado posteriormente, se recomienda evitar la administración de CGd y usarlos solo en indicación muy clara de la necesidad de RM con CGd en la que el beneficio supere el riesgo desconocido de exposición fetal2,12,19. La European Society of Urogenital Radiology (ESUR) recomienda administrar CGd macrocíclico exclusivamente con la menor dosis posible12.
Lactancia y contrastes de gadolinioSe considera seguro continuar normalmente la lactancia tras administrar CGd macrocíclicos a una mujer lactante12. Si bien, algunos indican que debe informarse a la paciente para que decida si suspender temporalmente la lactancia durante un periodo de 12 a 24 horas o no2, indicándole que la administración de CGd puede modificar el sabor de la leche y el lactante podría rechazar la toma.
Estas posiciones se basan en que menos del 0,04% del contraste administrado a la madre se excreta en la leche materna en las primeras 24 horas. Probablemente, la mayoría del Gd en la leche materna está en forma estable y quelada20. Menos del 1% del contraste deglutido se absorbe por el tracto gastrointestinal del lactante, lo que supone una cantidad menor a 0,0004% de la dosis administrada y eso es mucho menos que la dosis permitida para uso i.v. en recién nacidos.
Reacciones adversasLos CGd son muy bien tolerados. Las reacciones adversas pueden producirse entre 0,07 y 2,4% de los casos, la mayoría son leves y fisiológicas como sensación de frío, calor o dolor en la zona de la inyección, náuseas con o sin vómitos, dolor de cabeza, parestesias y mareos. Las reacciones adversas de tipo alérgico pueden producirse entre 0,004 y 0,7% y sus manifestaciones son similares a las de una reacción de tipo alérgico a un medio de contraste yodado.
Las reacciones anafilácticas graves que ponen en peligro la vida son infrecuentes, con una frecuencia descrita de entre 0,001 y 0,01%2, con reacciones mortales excepcionales, aunque existen casos descritos21.
El riesgo de reacción adversa aumenta hasta ocho veces si ha habido antecedente de reacción a un CGd; si la reacción fue de tipo alérgico moderada o severa y se considera necesario realizar una RM con CGd, se deberá utilizar un contraste diferente al que provocó la reacción anterior y se aconseja efectuar profilaxis con corticoides, aunque no hay estudios que demuestren que sea efectivo para reducir la probabilidad de una nueva reacción.
Función renal - nefrotoxicidadLos CGd no son nefrotóxicos con las dosis aprobadas para uso clínico. La baja viscosidad de CGd y los pequeños volúmenes administrados minimizan su potencial nefrotóxico; en pacientes con función renal normal, el riesgo de fracaso renal agudo tras CGd es prácticamente inexistente y en caso de insuficiencia renal leve-moderada tampoco hay evidencia de riesgo de nefrotoxicidad4.
Fibrosis sistémica nefrogénicaLa fibrosis sistémica nefrogénica (FSN) es una enfermedad descrita en el año 2000 en pacientes con enfermedad renal crónica en etapa terminal, particularmente en pacientes en diálisis. Los síntomas iniciales suelen ser engrosamiento de la piel y/o prurito y posteriormente, pueden desarrollan contracturas e inmovilidad articular. Afecta principalmente a la piel y tejidos subcutáneos, pero también al pulmón, esófago, corazón y músculos esqueléticos2. En 2006, se observó la asociación de la FSN con la administración de CGd en pacientes con enfermedad renal avanzada, con un tiempo de aparición de los síntomas desde la administración del CGd variable de días o meses y, excepcionalmente, años tras la última administración.
El mecanismo de desarrollo de FSN se desconoce, pero se cree que puede estar en relación con la liberación del Gd de los quelatos.
Desde que se demostró la asociación entre CGd y FSN se establecieron guías para el uso adecuado de CGd en pacientes con insuficiencia renal y tras la implantación de estas guías no se han producido nuevos casos de FSN2,12.
La clasificación de los CGd según la probabilidad de desarrollo de FSN y las recomendaciones de uso de los CGd se resumen en las tablas 212 y tabla 32.
Clasificación y recomendaciones de la ESUR sobre el uso de CGd en relación con la fibrosis sistémica nefrogénica12
| Grupo | Nombre genérico | Nombre comercial | Bioestructura | Recomendaciones |
|---|---|---|---|---|
| Mayor riesgo | Gadodiamida | Omniscan® | Lineal | La agencia europea del medicamento (AEM) ha suspendido el uso intravenoso de los contrastes de alto riesgo (Omniscan®, Magnevist®) y se ha retirado Optimark® del mercado europeo.• La AEM permite el uso para artrografía de Magnevist® |
| Gadopentetato dimeglumina | Magnevist® | Lineal | ||
| Gadoversetamina | Optimark® | Lineal | ||
| Riesgo intermedio | Ácido gadobénico | MultiHance® | Lineal con grupo benceno | La AEM aprueba el uso de los CGd de riesgo intermedio (Multihance®, Primovist®) únicamente para estudios hepatobiliares |
| Ácido gadoxético | Eovist®Primovist® | Lineal con grupo benceno | ||
| Menor riesgo | Gadobutrol | Gadovist® | Macrocíclico | -No es obligatorio hacer análisis para medir la función renal- Deben emplearse con precaución si:• filtrado glomerular <30 mL/min• deberían pasar al menos 7 días entre dos administraciones de contraste- Embarazadas: se puede usar si es necesario para obtener información diagnóstica esencial- Recomendación para todos los pacientes:• nunca denegar una exploración clínicamente bien indicada mediante RM con CGd• usar la menor cantidad de contraste necesaria para obtener un resultado diagnóstico• registrar siempre en la historia: el nombre del CGd y la dosis administrada |
| Ácido gadotérico | Dotarem® | Macrocíclico | ||
| Ácido gadotérico | Clariscan® | Macrocíclico | ||
| Gadoteridol | ProHance® | Macrocíclico |
CGd: contrastes de gadolinio; ESUR: European Society of Urogenital Radiology; RM: resonancia magnética.
Clasificación y recomendaciones de la ACR sobre el uso de CGd en relación con la fibrosis sistémica nefrogénica2
| Grupo | Nombre genérico | Nombre comercial | Bioestructura | Recomendaciones |
|---|---|---|---|---|
| Grupo IContrastes asociados con el mayor número de casos de FSN | Gadodiamida | Omniscan® | Lineal | Riesgo de desarrollar FSN si:• paciente en diálisis• insuficiencia renal crónica grave (filtrado glomerular <30 mL/min/1,73 m2) sin diálisis• insuficiencia renal aguda |
| Gadopentetato dimeglumina | Magnevist® | Lineal | ||
| Gadoversetamina | Optimark® | Lineal | ||
| Grupo IIContrastes asociados con pocos casos, si es que hay alguno, de FSN sin factores de confusión | Ácido gadobénico | MultiHance® | Lineal con grupo benceno | El riesgo de FSN con dosis estándar o inferiores de CGd es suficientemente bajo o posiblemente inexistente como para que la evaluación de la función renal con un cuestionario o pruebas de laboratorio antes de la administración i.v. de CGd sea opcional |
| Gadobutrol | Gadovist® | Macrocíclico | ||
| Ácido gadotérico | Dotarem® | Macrocíclico | ||
| Ácido gadotérico | Clariscan® | Macrocíclico | ||
| Gadoteridol | ProHance® | Macrocíclico | ||
| Gadopiclenol | Elucirem® | Macrocíclico | ||
| Gadopiclenol | Vueway® | Macrocíclico | ||
| Grupo IContrastes con datos limitados del riesgo de FSN. Pero se han notificado pocos casos de FSN, si es que hay alguno, sin factores de confusión | Ácido gadoxético | Eovist®Primovist® | Lineal con grupo benceno | No hay datos suficientes para determinar el riesgo de FSN tras administración CGd del grupo III.Es importante identificar los pacientes con riesgo de desarrollar FSN:• paciente en diálisis• insuficiencia renal crónica grave (filtrado glomerular <30 mL/min/1,73 m2) sin diálisis• insuficiencia renal aguda |
ACR: American College of Radiology®; CGd: contraste de gadolinio; FSN: fibrosis sistémica nefrogénica; i.v.: intravenoso.
La detección en 2014 de áreas de hiperseñal en secuencias potenciadas en T1 en los núcleos dentados, globos pálidos y en otras múltiples localizaciones cerebrales en pacientes con función renal normal, sin evidencia clínica de enfermedad renal o hepática a los que se había administrado múltiples dosis habituales de CGd llevó a la realización de investigaciones tras las cuales se puede afirmar que esas hiperseñales en T1 corresponden a depósitos de Gd en forma del quelato de Gd original, de nuevos quelatos formados con macromoléculas endógenas o de formas insolubles del Gd. La confirmación de estos depósitos de Gd se ha efectuado en biopsias y en necropsias de pacientes expuestos a CGd diversos3. Los depósitos se producen incluso en ausencia de enfermedad clínicamente evidente y en el contexto de una barrera hematoencefálica intacta2. También se ha demostrado un depósito de Gd en el hueso, riñón e hígado; en el hueso, el depósito de Gd es incluso mayor que en el sistema nervioso y se cree que el hueso puede constituir un reservorio de Gd tras su transmetilación con el calcio; en el riñón y el hígado el Gd se encuentra principalmente en el endotelio vascular y el intersticio tisular con una distribución heterogénea3.
En julio de 2015 se emitió una alerta de seguridad y se comunicó que se estaba investigando el riesgo y la importancia clínica de estos depósitos de Gd2. Hasta la actualidad no hay informes de que estos depósitos estén asociados con cambios histológicos y, aunque no se conocen consecuencias clínicas adversas, está justificado continuar las investigaciones para aclarar los mecanismos del depósito, el estado de quelación de estos depósitos, la relación con la estabilidad y la afinidad de unión del CGd, y el potencial tóxico teórico, que puede ser diferente para distintos CGd. Hasta que se comprendan completamente los mecanismos implicados y sus consecuencias clínicas, se debe evaluar cuidadosamente la seguridad y el potencial de depósito tisular de los CGd2.
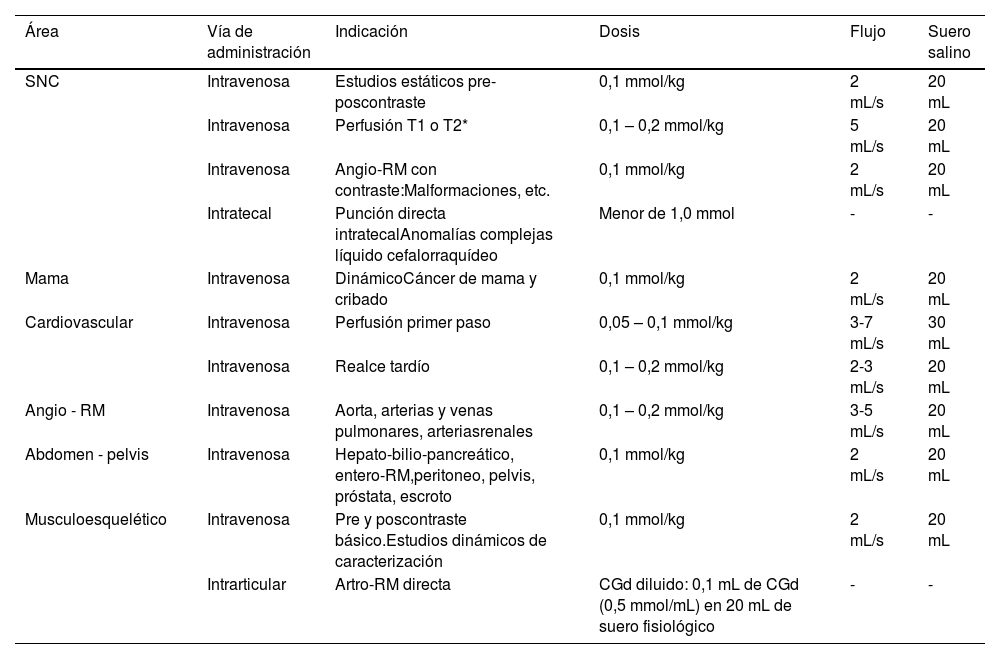
Dosis y modo de administraciónEl CGd de distribución extracelular se administra más frecuentemente por vía i.v. pero existen otras posibles vías de administración como la intraarticular y, excepcionalmente, la intratecal.
Vía intravenosa: en la administración i.v. la dosis generalmente es de 0,1 mmol/kg22. Puede administrarse en embolada manual, si no se requieren estudios dinámicos, o mediante inyector, que asegura la homogeneidad de la embolada, cuando se requiere un estudio dinámico y análisis de la cinética del contraste con curvas de captación. La administración de los CGd puede ser variable según la patología, los equipos de resonancia y las secuencias utilizadas. En la tabla 4 se resumen algunas de sus principales indicaciones23–25.
Vías de administración, dosis y flujo habituales en CGd extracelular en algunas de las indicaciones clínicas
| Área | Vía de administración | Indicación | Dosis | Flujo | Suero salino |
|---|---|---|---|---|---|
| SNC | Intravenosa | Estudios estáticos pre-poscontraste | 0,1 mmol/kg | 2 mL/s | 20 mL |
| Intravenosa | Perfusión T1 o T2* | 0,1 – 0,2 mmol/kg | 5 mL/s | 20 mL | |
| Intravenosa | Angio-RM con contraste:Malformaciones, etc. | 0,1 mmol/kg | 2 mL/s | 20 mL | |
| Intratecal | Punción directa intratecalAnomalías complejas líquido cefalorraquídeo | Menor de 1,0 mmol | - | - | |
| Mama | Intravenosa | DinámicoCáncer de mama y cribado | 0,1 mmol/kg | 2 mL/s | 20 mL |
| Cardiovascular | Intravenosa | Perfusión primer paso | 0,05 – 0,1 mmol/kg | 3-7 mL/s | 30 mL |
| Intravenosa | Realce tardío | 0,1 – 0,2 mmol/kg | 2-3 mL/s | 20 mL | |
| Angio - RM | Intravenosa | Aorta, arterias y venas pulmonares, arteriasrenales | 0,1 – 0,2 mmol/kg | 3-5 mL/s | 20 mL |
| Abdomen - pelvis | Intravenosa | Hepato-bilio-pancreático, entero-RM,peritoneo, pelvis, próstata, escroto | 0,1 mmol/kg | 2 mL/s | 20 mL |
| Musculoesquelético | Intravenosa | Pre y poscontraste básico.Estudios dinámicos de caracterización | 0,1 mmol/kg | 2 mL/s | 20 mL |
| Intrarticular | Artro-RM directa | CGd diluido: 0,1 mL de CGd (0,5 mmol/mL) en 20 mL de suero fisiológico | - | - |
Angio-RM: angiografía por resonancia magnética; Artro-RM: artrografía directa por RM; CGd: contraste de gadolinio; Entero-RM: enterografía por RM; SNC: sistema nervioso central.
Los nuevos contrastes de alta relajatividad (aún no comercializados) permiten reducir la dosis de Gd sin disminuir su eficacia11,26; se ha publicado que el gadopiclenol a 0,05 mmol/kg, tiene un perfil de seguridad y capacidad de detección de lesiones comparable a 0,1 mmol/kg de un CGd como Gadovist®27 con una farmacocinética y seguridad similar en pacientes pediátricos de dos a 17 años, que en adultos28.
Vía intraarticular: la artrografía directa por RM (artro-RM) con administración de CGd intraarticular es la técnica de referencia para la valoración de las estructuras articulares. Se realiza administrando CGd diluido mediante una punción articular (tabla 4); la dilución adecuada es fundamental porque el aumento de la concentración provoca la disminución de la señal en secuencias potenciadas en T1 y en T2 y causa posibles errores diagnósticos29. La cantidad a inyectar depende de la articulación y generalmente se acepta: glenohumeral 8-15mL, codo 3-6mL, radiocarpiana 3-4mL, cadera 10-12mL, rodilla 30-40mL, tobillo 4-8 mL, metatarsofalángicas 1-2mL30.
Vía intratecal: la administración intratecal de CGd se ha utilizado para detectar anomalías complejas del líquido cefalorraquídeo. Los CGd intratecales son seguros con dosis bajas, pero se han producido manifestaciones neurotóxicas en casos de sobredosis accidental. En un metanálisis reciente se detectaron 10 pacientes (de 1.036 analizados) con manifestaciones neurotóxicas graves tras CGd intratecal y concluyen que existe seguridad clínica relativa con dosis intratecales bajas (hasta 1,0 mmol), pero plantean que se requieren ensayos controlados aleatorios o estudios prospectivos para definir con seguridad indicaciones y dosis de administración de los CGd31.
Aplicaciones clínicas de los contrastes de gadolinio extracelularesLa administración de CGd está indicada en el estudio de múltiples patologías de las diferentes áreas de la radiología. A continuación, se recogen algunas de las recomendaciones principales de su uso, de forma orientativa. El análisis exhaustivo de las patologías y de las diferentes secuencias utilizadas con los CGd está fuera del objetivo de este trabajo.
Sistema nervioso centralLa RM con CGd está indicada en múltiples patologías del sistema nervioso central (SNC), cabeza y cuello. Las indicaciones más frecuentes son el diagnóstico diferencial y extensión de tumores (fig. 1), metástasis, infecciones, enfermedades desmielinizantes y sospecha de lesiones vasculares (malformaciones arteriovenosas, aneurismas, fístulas durales), entre otras32–35. Según la sospecha clínica, la RM con CGd está indicada en el diagnóstico, en los controles tras el tratamiento y durante el seguimiento34; en otros casos, como en la esclerosis múltiple, el CGd está indicado en el estudio basal para el diagnóstico y pronóstico de la enfermedad, pero en la actualidad se considera que generalmente no es necesario y no debe utilizarse de forma rutinaria durante el seguimiento34.
Varón de 17 años con una lesión indurada y adherida en la cara ventral de la lengua. La RM en secuencia T1-TEG con supresión grasa poscontraste demuestra un nódulo en 1/3 anterior izquierdo de la lengua con realce heterogéneo (flechas). El diagnóstico anatomopatológico fue de sarcoma sinovial.
RM: resonancia magnética; TEG: turbo eco de gradiente.
Según la sospecha clínica, el equipo de RM y las secuencias disponibles, los estudios se realizarán preferentemente con espín-eco rápido (TSE), turbo eco de gradiente (TEG) 3D o secuencias de sangre negra. De acuerdo con la patología a estudio, se obtendrán imágenes estáticas pre y poscontraste potenciadas en T1 o secuencias dinámicas de perfusión durante la administración del CGd. Las secuencias de perfusión potenciadas en T1 se realizan para la caracterización tisular y el análisis de la cinética del contraste y las de perfusión potenciadas en T2* (dynamic susceptibility contrast [DSC]) para obtener información de la perfusión tisular capilar y del volumen sanguíneo. Las dosis y flujos más frecuentemente empleados en el SNC se resumen en la tabla 4.
MamaLa RM tiene una gran sensibilidad para detectar el cáncer de mama, debido a que la neoangiogénesis tumoral tiene mayor permeabilidad y provoca una extravasación precoz del CGd36 (fig. 2). El estudio se realiza con una secuencia dinámica T1-TEG, con o sin supresión grasa, preferentemente en el plano transversal. Se adquiere una serie precontraste y tras la administración del CGd se obtienen las series poscontraste (tabla 4). Es fundamental que las adquisiciones posCGd sean lo más precoces posible, tanto para la estadificación del cáncer (fig. 3), la valoración de respuesta de posneoadyuvancia como para los estudios de cribado36–38. La aplicación del protocolo de adquisición y posprocesado de las imágenes, permite efectuar un informe radiológico estructurado óptimo39.
Mujer de 59 años que se palpa un nódulo en la mama izquierda. Biopsia guiada con ecografía y anatomía patológica de carcinoma ductal infiltrante. La RM preneoadyuvancia en secuencia T1-TEG con supresión grasa poscontraste evidencia el nódulo único con realce intenso en la fase arterial (flechas).
RM: resonancia magnética; TEG: turbo eco de gradiente.
Mujer de 42 años con mamas muy densas. Nódulo en la mama izquierda biopsiado mediante control ecográfico con anatomía patológica de carcinoma ductal infiltrante. La RM preneoadyuvancia T1-TEG con supresión grasa poscontraste demuestra el nódulo biopsiado y nódulos múltiples dispersos con realce intenso en la fase arterial (flechas).
RM: resonancia magnética; TEG: turbo eco de gradiente.
El CGd está indicado en múltiples patologías cardiovasculares como la enfermedad coronaria para establecer el pronóstico y seguimiento de la cardiopatía isquémica (fig. 4)40, en el síndrome coronario crónico41, en miocardiopatías, cardiopatías congénitas, masas cardiacas, etc41,25.
Varón de 39 años. La RM cardiaca en secuencia de realce tardío poscontraste, en plano de dos cámaras, demuestra hiperseñal miocárdica en los segmentos inferiores basales y medios (flechas) por contraste retenido en el miocardio patológico debido a infarto en el territorio de la coronaria derecha.
La dosis, volumen y velocidad de administración del CGd varían según se requieran estudios de perfusión de primer paso, de realce tardío o estudios de angiografía por RM (fig. 5), pero existen indicaciones estandarizadas según acuerdos de expertos que se recogen en la tabla 423,42,43.
Hepato-bilio-pancreáticoEl CGd extracelular es parte fundamental de la RM multiparamétrica (RMmp) hepato-bilio-pancreática, mediante un estudio dinámico T1-TEG con supresión grasa y obtención de imágenes basales precontraste, de administración del contraste (tabla 4) y adquisición poscontraste de, al menos, tres fases: arterial, venosa portal e intersticial o de equilibrio44 (fig. 6).
Mujer de 25 años con ictericia y colestasis. La RM hepática, secuencia T1-TEG con supresión de grasa (a) sin contraste y poscontraste (b) en fase arterial, portal (c) y equilibrio (d), demuestra una masa de 36mm en el segmento VIII (flechas), bien delimitada, con realce intenso y heterogéneo, con centro hipointenso en la fase arterial, que en las fases portal y de equilibrio se hace mayoritariamente isointensa con alguna zona central que permanece hiperintensa, en relación con hiperplasia nodular focal.
RM: resonancia magnética; TEG: turbo eco de gradiente.
El CGd está indicado en la enterografía por RM para identificar la presencia y severidad de la actividad inflamatoria y la detección de complicaciones. Generalmente, se obtienen imágenes T1-TEG con supresión grasa en el plano coronal poscontraste en la fase portal (60 s) (fig. 7), aunque algunos autores adquieren cuatro fases: sin contraste, arterial (20-25 s), portal (60 s) y equilibrio (120 s). Tras el plano coronal, se realizan secuencias T1-TEG con supresión grasa en los planos transversal y sagital45,46.
Mujer de 20 años. La RM intestinal con CGd demuestra un realce de la pared de un segmento de 7cm de íleon terminal (flechas) y de 8cm de ciego y colon ascendente (punta de flecha) y realce en la pared del colon descendente (puntas de flecha), por enfermedad de Crohn, con actividad inflamatoria.
CGd: contraste de gadolinio; RM: resonancia magnética.
La RM es de elección para la identificación y caracterización de las fístulas complejas de cara a decidir su tratamiento47. Las secuencias T1-TEG 3D con supresión grasa en el plano transversal y coronal al eje del canal anal, sin y tras la administración de CGd (tabla 4), permite identificar el realce de los trayectos fistulosos y del tejido de granulación y detectar la presencia de abscesos48,49.
RectoEl CGd no está indicado en la valoración inicial porque no mejora la seguridad diagnóstica del grado de extensión local50,51. En la reevaluación tras neoadyuvancia no se emplea de forma habitual, aunque puede tener utilidad, en algunos casos, para detectar la persistencia tumoral como áreas de realce heterogéneo51 y posibles complicaciones como fistulización o abscesos pélvicos52. Sí está indicado el CGd en casos de sospecha de una recurrencia local tras el tratamiento.
PeritoneoLa RM del peritoneo puede aportar información para el diagnóstico y la planificación quirúrgica de tumores peritoneales primarios o metastásicos53. La secuencia dinámica T1-TEG 3D en los planos transversal, coronal y sagital de todo el abdomen a los cinco minutos de la administración del CGd permite valorar las zonas de realce anómalo del peritoneo, fundamental para la valoración de la extensión tumoral54.
Pelvis femeninaLos estudios de RM de la pelvis femenina se realizan con protocolos diversos según el tipo de patología que se esté estudiando55. Dada la diversidad en los protocolos, se detallan a continuación los aspectos más relevantes de las patologías principales.
Cáncer de cérvixLa RM es una técnica indicada para la estadificación locorregional basal, la respuesta del tumor a la quimiorradioterapia y la valoración de recidivas locorregionales. El CGd no está indicado en la valoración inicial y en la respuesta tras neoadyuvancia, aunque puede ser de utilidad en casos de duda, fundamentalmente en la valoración de infiltración de estructuras adyacentes. Sí está indicado en la sospecha de recaída tras el tratamiento55,56.
Carcinoma de endometrioLa RM con CGd está indicada para valorar el tamaño del tumor y la profundidad de la invasión miometrial. La secuencia T1-TEG a los dos minutos y 30 segundos permite obtener el mejor contraste entre el tumor y el miometrio55. Se puede hacer el estudio con adquisición de una secuencia pre y otra poscontraste o bien mediante la obtención de una secuencia dinámica T1-TEG 3D con supresión de grasa55,57 (fig. 8).
Mujer de 60 años con metrorragia. Neoformación endometrial en el cuerpo uterino (asteriscos) que se extiende hasta el orificio cervical interno. El CGd permite definir la invasión de más del 50% del miometrio y por el realce normal de la mucosa cervical (flechas) excluir la invasión del estroma cervical.CGd: contraste de gadolinio.
La secuencia dinámica T1-TEG con supresión grasa con CGd en las fases arterial, portal y de equilibrio es útil para caracterizar y definir la extensión de las masas58.
Masas anexialesLa RMmp está indicada para caracterizar las masas anexiales cuando la ecografía es indeterminada. La RM con CGd, mediante una secuencia T1-TEG dinámica o bien una secuencia potenciada en T1 pre y poscontraste, preferiblemente en un plano transversal (paralelo al cuerpo uterino) es primordial para detectar el realce de nódulos o áreas sólidas murales y áreas de necrosis55.
EndometriosisLa RMmp es complementaria a la ecografía si esta no es concluyente o si se requiere más información para planificar la cirugía.
No existe una recomendación clara sobre la necesidad de CGd y es opcional en el diagnóstico inicial para la valoración de la endometriosis anexial indeterminada o el diagnóstico diferencial con otras patologías pélvicas59.
PróstataLas guías clínicas del cáncer de próstata recomiendan utilizar la RMmp para diagnosticar esta entidad en pacientes con antígeno prostático específico (PSA) elevado previo a la biopsia60. La guía Prostate Imaging Reporting & Data System (PI-RADS®) 2.1 incluye realizar una secuencia dinámica posCGd para completar la valoración de la zona periférica de la glándula (tabla 4)61.
Últimamente, se ha planteado la posibilidad de suprimir la secuencia dinámica poscontraste y realizar una RM biparamétrica con secuencias potenciadas en T2 y de difusión62. Sin embargo, abandonar las imágenes poscontraste supondría un aumento de lesiones indeterminadas y una reducción en la detección de cáncer de próstata clínicamente significativo, especialmente si la interpretación la efectúan profesionales con menos experiencia63. Recientemente, se ha publicado que se necesitan más estudios prospectivos para poder hacer recomendaciones basadas en evidencia sobre la RM sin contraste en el diagnóstico inicial del cáncer de próstata64.
En la valoración de recidiva local tras una prostatectomía o radioterapia y en pacientes en vigilancia activa se debe incluir una secuencia dinámica con CGd65.
Escroto - testículoLa RM escrotal es complementaria de la ecografía66 porque aporta información útil cuando los hallazgos ecográficos no son concluyentes o no son concordantes con la exploración clínica en: 1) diferenciación entre lesiones intratesticulares y paratesticulares, 2) caracterización de lesiones intratesticulares y paratesticulares, 3) diagnóstico diferencial entre los tumores de células germinales y tumores testiculares del cordón sexual, estadificación local de neoplasias malignas testiculares (en pacientes planificados para cirugía conservadora de testículos), 5) diferenciación entre seminomas y tumores no seminomatosos (cuando la quimioterapia inmediata se planifica y se retrasa la orquiectomía), 6) en evaluación del escroto agudo y traumatismo escrotal y 7) detección y localización de testículos no descendidos67. La RM proporciona una sensibilidad del 100% y una especificidad del 88% en la evaluación y caracterización de masas intratesticulares para la diferenciación de benignos y malignos68. La RMmp escrotal incluye la secuencia T1-TEG 3D en el plano coronal pre y posCGd con obtención de cinco a siete dinámicos69.
MusculoesqueléticoLa administración de CGd i.v. mejora el diagnóstico y la extensión de las infecciones musculoesqueléticas y ayuda a caracterizar y diferenciar la celulitis focal, absceso, miositis, fascitis, infección necrotizante de tejidos blandos, artritis séptica e infecciones óseas70. En el estudio de las masas de partes blandas, los CGd son fundamentales para la caracterización y valoración de su extensión71 (fig. 9).
Varón de 65 años con una masa en el hombro izquierdo. La RM T1-TEG (a) sin contraste y (b) poscontraste en la fase arterial demuestra una masa (asterisco) de 3 x 2cm, de contorno irregular, en tejido celular subcutáneo que infiltra la fascia y el compartimento muscular. El diagnóstico anatomopatológico fue de linfoma.
RM: resonancia magnética; TEG: turbo eco de gradiente.
Recientemente, la Sociedad de Radiología Esquelética (SSR) ha propuesto un sistema de datos e informes óseos (Bone-RADS) y algoritmos para el diagnóstico de lesiones óseas en el que se especifica que en múltiples circunstancias el uso de CGd ayuda al diagnóstico de las lesiones óseas72.
Estudios articulares: la artro-RM directa se considera la modalidad de imagen más precisa para la evaluación de estructuras intraarticulares. Recientemente, se ha publicado un documento de consenso de la SSR con recomendaciones sobre el uso de la artro-RM y sus aplicaciones clínicas habituales72. La artro-RM directa sigue siendo en la actualidad, un procedimiento importante para el diagnóstico y es especialmente útil cuando la RM convencional es indeterminada o los resultados discrepan de la evaluación clínica30.
ConclusionesLos CGd de distribución extracelular son los más frecuentemente utilizados en la práctica clínica. Son contrastes seguros que aumentan la capacidad diagnóstica y que forman parte de los protocolos básicos de estudio de múltiples patologías. Conocer su formulación, biodistribución, complicaciones e indicaciones mejora el proceso diagnóstico en RM en todas las áreas de la radiología.
Autoría- 1.
Responsable de la integridad del estudio: RSF.
- 2.
Concepción del estudio: RSF.
- 3.
Diseño del estudio: RSF.
- 4.
Obtención de los datos: no procede.
- 5.
Análisis e interpretación de los datos: no procede.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: RSF, CMD, ERG.
- 8.
Redacción del trabajo: RSF.
- 9.
Revisión críıtica del manuscrito con aportaciones intelectualmente relevantes: RSF, CMD, ERG.
- 10.
Aprobación de la versión final: RSF, CMD, ERG.
No se ha recibido ninguna subvención ni ayuda económica de instituciones públicas o privadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.