
El liposarcoma mixoide se encuadra dentro del grupo de sarcomas con diferenciación adiposa, constituyendo el segundo grupo en frecuencia de todos los tipos de liposarcomas, si bien no es una entidad homogénea, ya que dentro de los liposarcomas mixoides nos encontramos con tumores de comportamiento y evolución clínica muy diferentes. Los objetivos del estudio son describir las características por RM de los liposarcomas mixoides y determinar si existe asociación entre los datos analizados por RM con el grado histológico que permita diferenciar los tumores de bajo y alto grado ayudando en la toma de decisiones.
Material y métodosSe incluyeron 36 pacientes tratados en nuestro centro de liposarcoma mixoide entre los años 2010 y 2018. Por un lado, se analizaron variables clínicas: edad, sexo y localización, y por otro se valoraron características por RM: tamaño, profundidad, contornos, componente graso, componente mixoide, componente no graso-no mixoide, valor del coeficiente de difusión aparente y tipo de realce tras la administración de contraste intravenoso. Las variables analizadas por RM se correlacionaron con el grado histológico y el porcentaje de células redondas.
ResultadosEn nuestra serie, los liposarcomas mixoides afectan principalmente a adultos jóvenes (mediana de edad 43 años), sin diferencias significativas según el sexo, el 97,2% ubicados en miembros inferiores, el 86,1% de localización profunda y el 77,8% con contornos bien delimitados. El 69,6% (16 de 23) de los liposarcomas mixoides que no contenían grasa fueron de alto grado (p=0,01). Todos los tumores con componente mixoide inferior al 25% fueron lesiones de alto grado (p=0,01). El 83,3% de los tumores con componente no graso-no mixoide superior al 50% fueron de alto grado (p=0,03). Igualmente, el 61,5% de los tumores con un componente no graso-no mixoide superior al 50% presentaron un porcentaje de células redondas de más del 5% (p=0,01). Disponíamos secuencias de difusión en 14 de los 36 pacientes, obteniendo valores de coeficiente de difusión aparente altos (mediana de 2×10-3 mm2/s), aunque no hubo asociación estadísticamente significativa entre los tumores de bajo-alto grado. Treinta de los 36 pacientes incluidos en el estudio disponían de series con contraste intravenoso, de los cuales el 83,3% de los que presentaron realce heterogéneo fueron de alto grado (p=0,01).
ConclusionesLa RM puede ser una herramienta diagnóstica útil para diferenciar entre liposarcomas mixoides de alto-bajo grado y ayudar en la toma de decisiones clínicas.
Myxoid liposarcoma is classified in the group of sarcomas with adipose differentiation, which is the second most common group of sarcomas. However, myxoid liposarcoma is not a homogeneous entity, because the behavior and clinical course of these tumors can vary widely. This study aimed to describe the magnetic resonance imaging (MRI) features of myxoid liposarcomas and to determine whether the MRI features are associated with the histologic grade and can differentiate between low-grade and high-grade tumors and thus help in clinical decision making.
Material and methodsWe studied 36 patients with myxoid liposarcomas treated at our center between 2010 and 2018. We analyzed clinical variables (age, sex, and tumor site) and MRI features (size, depth, borders, fatty component, myxoid component, non-fatty / non-myxoid component, apparent diffusion coefficient (ADC), and type of enhancement after the administration of intravenous contrast material). We correlated the MRI features with the histologic grade and the percentage of round cells.
ResultsIn our series, patients with myxoid liposarcomas were mainly young adults (median age, 43 years). There were no differences between sexes; 97.2% were located in the lower limbs, 86.1% were deep, and 77.8% had well-defined borders. Of the 23 myxoid liposarcomas that contained no fat, 16 (69.6%) were high grade (p=0.01). All the tumors with a myxoid component of less than 25% were high grade (p=0.01); 83.3% of those with a non-fatty / non-myxoid component greater than 50% were high grade (p=0.03) and 61.5% had more than 5% round cells (p=0.01). Diffusion sequences were obtained in 14 of the 36 patients; ADC values were high (median, 2 x 10-3 mm2/s), although there were no significant associations between low-grade and high-grade tumors. Contrast-enhanced images were available for 30 (83.3%) patients; 83.3% of the tumors with heterogeneous enhancement were high grade (p=0.01).
ConclusionsMRI can be useful for differentiating between high- and low-grade myxoid liposarcomas and can help in clinical decision making.
El sarcoma de tejidos blandos afecta en España a una de cada 20.000 personas, lo que implica aproximadamente 2300 casos al año. Aunque se trata de un grupo de cánceres que solo representan el 1% del total, son causantes del 2% de toda la mortalidad debida al cáncer. En la edición del 2013 de la Organización Mundial de la Salud (OMS) sobre tumores de partes blandas, los liposarcomas están incluidos dentro del grupo conocido como tumores mesenquimales con diferenciación adiposa1,2. Son uno de los sarcomas más frecuentes del adulto y se han descrito varios subtipos: atípico/bien diferenciado, desdiferenciado, mixoide y pleomórfico. Los liposarcomas mixoides (LPSM) constituyen el 30% de todos los liposarcomas, son el segundo grupo más frecuente después del subtipo atípico/bien diferenciado, y corresponden aproximadamente a un 5-10% del total de los sarcomas de partes blandas en los adultos3–5, lo que supondría una media aproximada de 162 casos/año en España.
Epidemiológicamente, los LPSM afectan a adultos jóvenes con un pico de incidencia entre la 4.ª y 5.ª década de la vida y, aunque raros, es la variante de liposarcoma más frecuente en niños y adolescentes. Su incidencia es similar en mujeres y hombres. Ocurren más frecuentemente en la profundidad de los tejidos de partes blandas de las extremidades, más de dos terceras partes en el muslo, siendo más raros en el retroperitoneo o el tejido celular subcutáneo. Clínicamente se presentan con una masa indolora de gran tamaño en la profundidad de un miembro. Un tercio de los pacientes desarrollan metástasis. Al contrario que otros liposarcomas, los LPSM tienden a metastatizar en localizaciones poco frecuentes de partes blandas (retroperitoneo, miembro contralateral, axila) o en el hueso (principalmente en columna) incluso antes que en el pulmón6.
Desde el punto de vista genético, los LPSM se caracterizan por la presencia de la translocación t (12;16) (q3; p11) que conduce a la fusión genética FUS-DDIT3, la cual está presente en más del 95% de los casos. En el resto de los casos se presenta la variante t (12;22) (q13; q12) en la que DDIT3 (conocido también como CHOP) se fusiona con EWSR1, un gen muy relacionado con el FUS2.
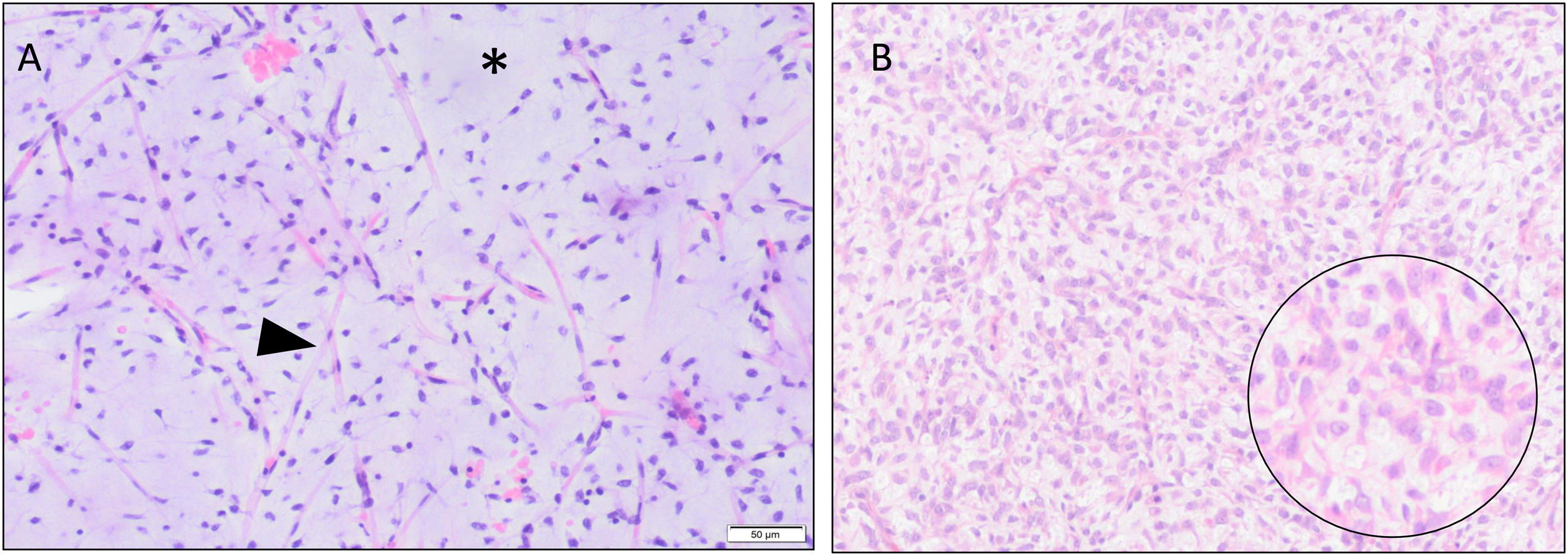
Histológicamente, constituyen un espectro continuo de lesiones que va desde formas de bajo grado (predominantemente mixoides) a otras formas de alto grado, pobremente diferenciadas, con un componente de células redondas superior al 5% (fig. 1). Este 5% tiene una gran relevancia pronóstica, mientras que los LPSM puramente mixoides son tumores de lento crecimiento, bajo riesgo de desarrollar metástasis y una supervivencia alta (próxima al 70%); los LPSM con más del 5% de células redondas son considerados de alto grado, con un mayor riesgo de recurrencias, desarrollar metástasis y una supervivencia que puede llegar en ocasiones al 20%4,7,8.
Se muestran cortes histológicos (H&E) que incluyen el espectro anatomopatológico de este tipo de tumores. En A se muestra un liposarcoma mixoide (LPSM) de bajo grado, constituido por células fusiformes con marcada red capilar plexiforme (cabeza de flecha) y abundante estroma mixoide (*). En B se presenta un LPSM de alto grado, constituido por células redondas y ovoides (ampliación en círculo) con importante red capilar subyacente de tipo plexiforme.
La resonancia magnética (RM) es la técnica de imagen de elección en la valoración de los LPSM. Aunque el aspecto por RM puede ser muy variable, los LPSM presentan ciertas características en función de su histología, de tal forma que los puramente mixoides suelen presentar un alto contenido en agua y por tanto baja intensidad de señal en secuencias T1 y marcada hiperseñal en secuencias T2, hasta el punto de que pueden confundirse con lesiones quísticas. Pueden mostrar algunos focos de tejido adiposo en el interior del tumor, aunque habitualmente en menos del 10% del total, y muestran un realce variable tras la administración de gadolinio. Otras características descritas son los contornos polilobulados, el aumento de señal T2 perilesional y la existencia de septos internos7. Por otro lado, los LPSM con alto contenido en células redondas muestran un aspecto más heterogéneo, poco específico, indistinguible de otros sarcomas de alto grado de partes blandas.
El tratamiento de elección de los LPSM es la resección quirúrgica sin o con neoadyuvancia previa (radioterapia y/o quimioterapia). La neoadyuvancia se suele reservar para pacientes con LPSM de alto riesgo, es decir los de alto grado histológico, localización profunda y mayores de 5 cm9–11.
Con este trabajo pretendemos describir las características de los LPSM diagnosticados en nuestro centro y determinar si existe asociación entre los datos analizados por RM con el grado histológico.
Material y métodosEn este trabajo de investigación descriptivo retrospectivo realizamos un análisis de todos los casos de LPSM atendidos en nuestro centro entre el 1 de enero de 2010 y el 31 de diciembre de 2018, tomando como base de datos la información proporcionada por el registro del servicio de anatomía patológica. La revisión fue aprobada por el Comité de Ética de Investigación Biomédica de nuestro centro. Los criterios de inclusión y exclusión se muestran en la tabla 1.
Criterios de inclusión y exclusión
| Criterios inclusión | Criterios exclusión |
|---|---|
| Pacientes≥18 años | Pacientes<18 años |
| LPSM diagnosticados y tratados en nuestro centro | LPSM diagnosticados y/o tratados en otros centros |
| Confirmación histológica realizada en nuestro centro | LPSM sin confirmación histológica |
| Disponer de RM inicial anterior a cualquier tratamiento | RM inicial anterior a cualquier tratamiento no disponible, mala calidad o carentes de secuencias para el análisis |
LPSM: liposarcoma mixoide.
Las variables demográficas de los pacientes se obtuvieron de las historias clínicas digitalizadas. Inicialmente se incluyeron 49 pacientes diagnosticados de LPSM. Tras la aplicación de los criterios de inclusión/exclusión, se descartaron 13 casos, estando constituida la muestra final por 36 pacientes.
Estudio histológicoRecogemos las características histológicas de los informes de la biopsia inicial y/o pieza quirúrgica no sometida a tratamiento neoadyuvante, realizado por los patólogos especializados en sarcomas de nuestro hospital, que está recogido en la historia clínica digital siguiendo el sistema de gradación histológica de la FNCLCC (Federation Nationale des Centres de Lutte Contre Le Cancer)12 y cuantificando la presencia de células redondas expresado en porcentaje. Los LPSM de grado 1 se consideraron de bajo grado y los grados 2-3, de alto grado. En todos los pacientes se realizó biopsia con aguja gruesa (BAG) percutánea previo a cualquier tratamiento, salvo un caso en que se hizo biopsia escisional. El 91,7% (33 de 36) de las BAG fueron realizadas por traumatólogos y solo dos fueron realizadas por radiólogos.
Análisis de la RMLas imágenes de RM fueron obtenidas del sistema de almacenamiento de imágenes médicas de nuestro hospital (PACS) y analizadas por un radiólogo con 10 años de experiencia en patología musculoesquelética, que desconocía el grado histopatológico y el porcentaje de células redondas de los LPSM seleccionados para este estudio.
Los protocolos de RM fueron muy variables al proceder de diferentes centros y equipos distintos. El 25% de los estudios fue realizado en nuestro centro, con equipos de 1.5 T o 3 T (Philips Healthcare, Países Bajos). El protocolo basal que utilizamos para el estudio de lesiones ocupantes de espacio de partes blandas incluye: axial TSE T1 sin y con supresión grasa y TSE T2, secuencia TSE T2 con supresión grasa paralela al eje largo de la lesión (sagital o coronal) y secuencia difusión SS-EPI en plano axial (con tres valores b0, 400 y 1000 s/mm2). Tras la administración de contraste (gadoterato meglumina 0,1 mmol/kg. Dotarem® Guerbet, Francia) se realiza una secuencia dinámica de aproximadamente 3 minutos de duración GRE 3D T1 con supresión grasa. Posteriormente se realizan secuencias con contraste axiales y en el eje largo de la lesión TSE-T1 sin y con supresión grasa. Los parámetros de adquisición se han adaptado en función de la localización de la lesión, tamaño, tipo de antena utilizada y actualizaciones de los softwares realizada a lo largo de estos años. El 75% de los estudios de RM procedían de centros externos al hospital. No obstante, todos los protocolos, independientemente del lugar de procedencia, disponían de secuencias T1, secuencias sensibles al líquido (potenciadas en T2) y secuencias con supresión de la grasa. Del total de las RM, disponíamos de secuencia difusión con obtención de mapas ADC (coeficiente de difusión aparente) en 14 de los 36 casos. Se administró contraste en todos los casos salvo en 6 pacientes (todos ellos procedentes de centros externos). En caso de disponer de varios estudios de RM, se recogió la información de la RM más cercana al comienzo del tratamiento, bien fuera quirúrgico o neoadyuvante.
Se estudiaron las siguientes variables: tamaño (diámetro máximo medido en milímetros, obtenido en cualquiera de los planos de la RM realizada); localización de la lesión (miembro superior, miembro inferior y tronco); profundidad del tumor (superficial o profundo respecto a la fascia muscular); márgenes (bien definido/encapsulado, definición intermedia/no encapsulado, mal definido). Basándose en una estimación visual, se realizó una valoración cualitativa de las características de señal sobre el global del tumor, dividida en 5 grupos (0%,<25%, 25-50%, 50-75%,>75%) del componente graso (definido como tejido hiperintenso en secuencias T1, que se suprime en secuencias con supresión grasa y no muestran realce tras la administración del contraste) (fig. 2); componente mixoide (definido como tejido hipointenso en T1 y muy hiperintenso en T2 (similar al líquido) con diferente grado de realce tras la administración de contraste) (fig. 3); componente no graso-no mixoide (definido como tejido hipointenso en T1, intensidad de señal alta/intermedia en T2 (menor que el líquido) y diferente grado de realce) (fig. 4). En los estudios que disponían de secuencias de difusión (14 de 36) se analizó el valor ADC (utilizando el valor medio englobando todo el tumor en el área de interés) (fig. 5). Los estudios que disponían de contraste (30 de 36) se clasificaron en función del tipo de realce en: uniforme (cuando más del 75% del tumor realza de forma homogénea) y heterogéneo (cuando el realce es incompleto constituyendo menos del 75% del total).
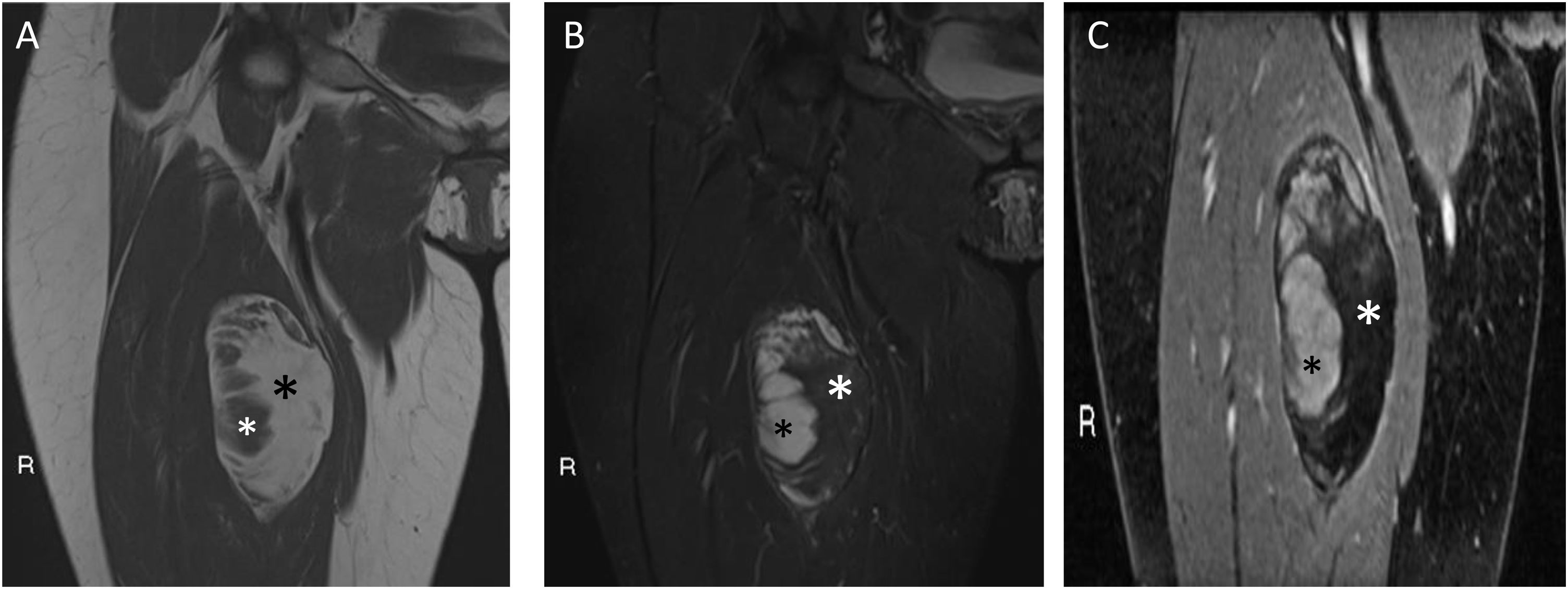
Mujer de 30 años con liposarcoma mixoide (LPSM) en el compartimento anterior del muslo derecho. Se muestran secuencias coronales T1 (A), T2 con supresión grasa (B) y T1 con supresión grasa y gadolinio (C). Se aprecia una tumoración de contornos bien definidos, con componente graso (asterisco negro en A y blanco en B y C) entre el 50% y el 75% (hiperintensa en T1, con pérdida de señal en secuencias con supresión de la grasa y sin realce tras la administración de gadolinio). En el margen externo del tumor se aprecia un componente mixoide (asterisco blanco en A y negro en B y C) entre el 25% y el 50%, con intensidad de señal similar al líquido en secuencias sin contraste y realce tras la administración del gadolinio. LPSM de bajo grado 0% de células redondas.
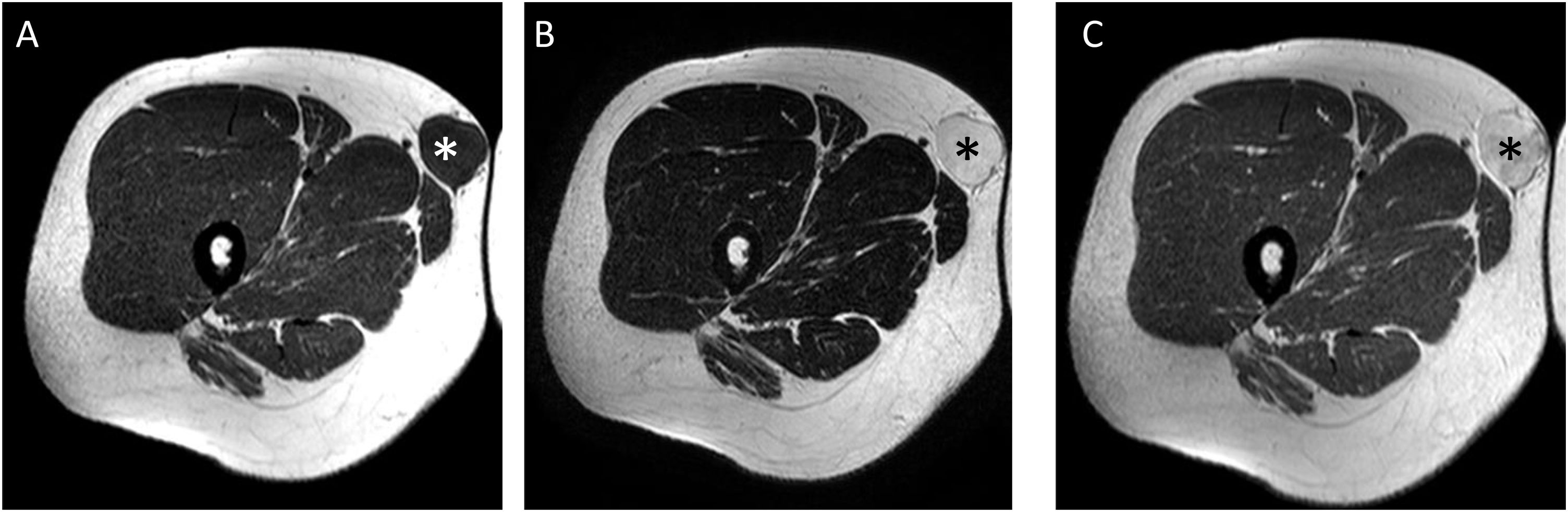
Varón de 28 años con liposarcoma mixoide (LPSM) superficial en tejido celular subcutáneo de la cara interna de la raíz del muslo derecho. Se muestran secuencias axiales T1 (A), T2 (B) y T1 tras la administración de gadolinio (C). Se aprecia una tumoración de contornos bien definidos (asterisco blanco en A y negro en B y C) con un componente mixoide mayor del 75% (intensidad de señal similar al líquido en las secuencias sin contraste, hipointensa en T1, marcadamente hiperintensa en T2 y con realce uniforme tras la administración del contraste). Los LPSM con alto contenido mixoide pueden simular una lesión quística; ante toda lesión de aspecto “aparentemente quístico” en secuencias sin contraste con una localización no habitual para un quiste sinovial/ganglión es necesaria la administración de contraste o en su defecto su estudio ecográfico. En nuestro caso, la lesión mostraba un intenso realce uniforme tras la administración de gadolinio, confirmando su naturaleza sólida.
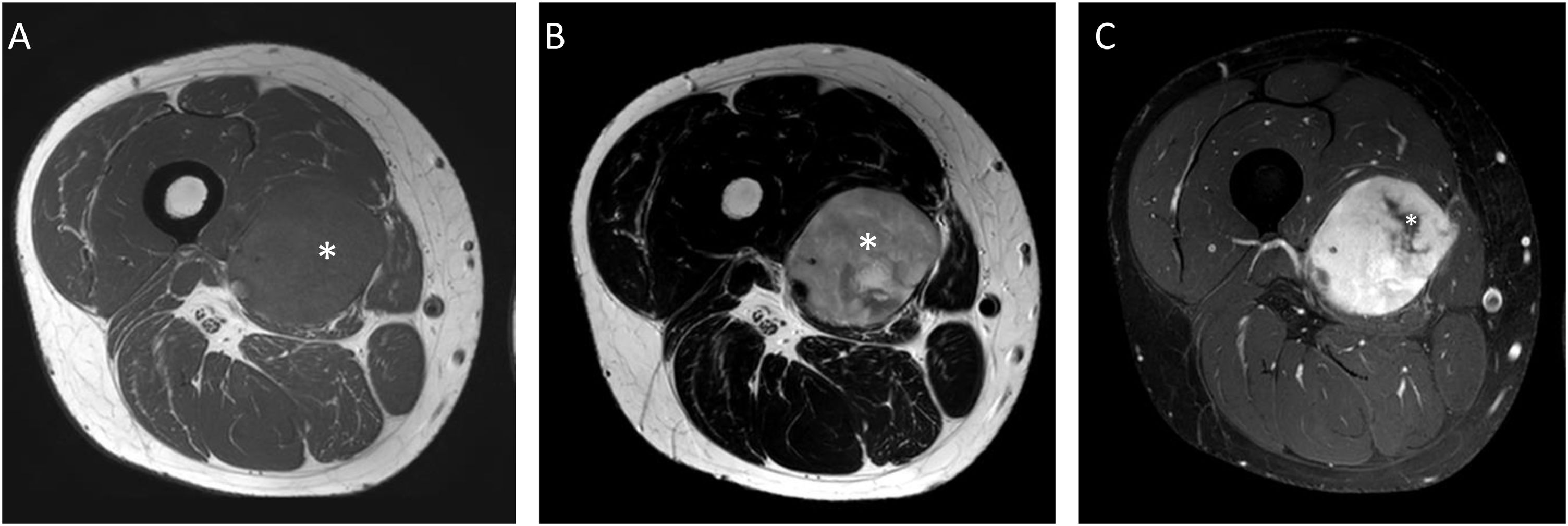
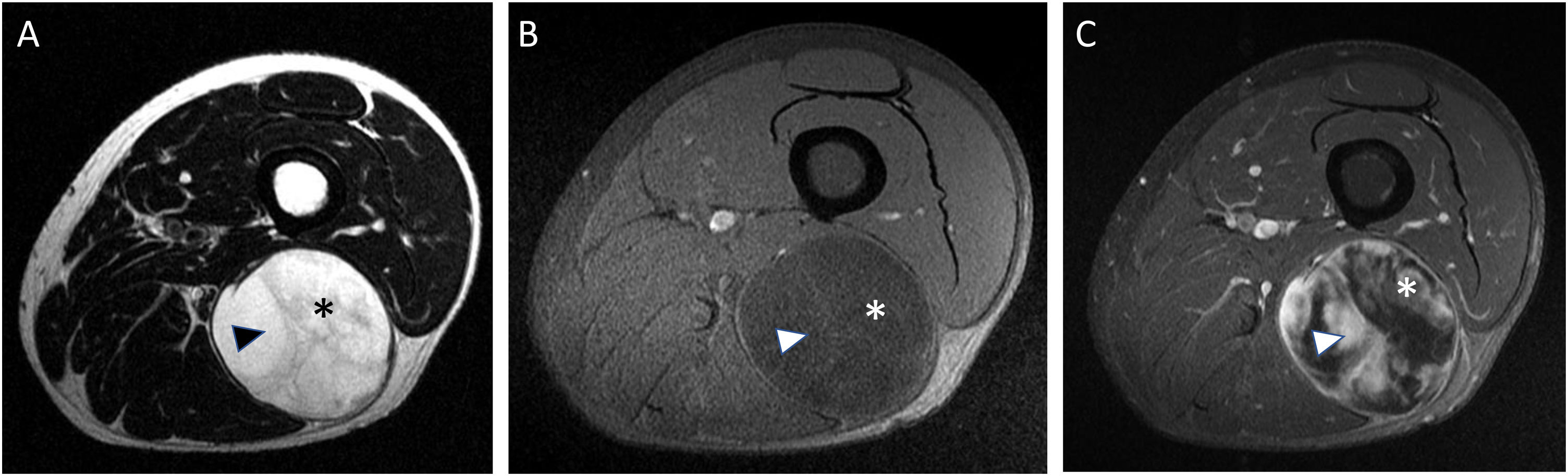
Varón de 30 años con liposarcoma mixoide (LPSM) en el compartimento medial del muslo derecho. Se muestran secuencias axiales T1 (A), T2 (B) y T1 con supresión grasa tras la administración de gadolinio (C). Se aprecia un componente no graso-no mixoide mayor del 75% (asterisco blanco en A y B) [hipointensa en T1, intensidad intermedia en secuencias T2 y realce heterogéneo con focos que no captan en el margen medial de la lesión (asterisco blanco en C)]. LPSM de alto grado con 90% de células redondas.
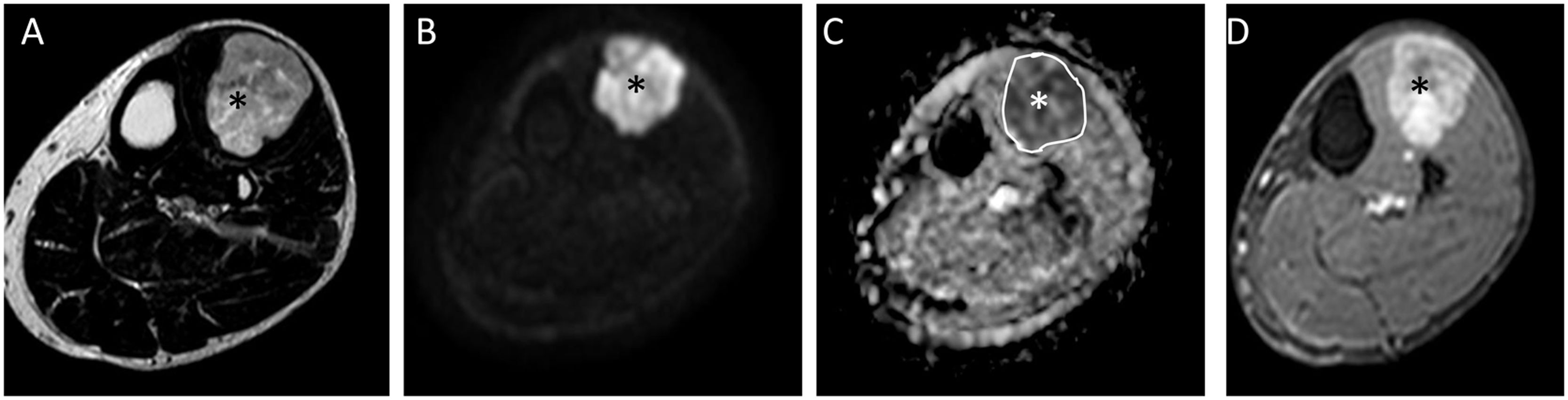
Varón de 44 años con liposarcoma mixoide (LPSM) en el compartimento anterior de la pierna derecha (asterisco negro en A, B y D, blanco en C). Resonancia magnética procedente de centro externo con secuencias axiales T2 (A), estudio de difusión con tres valores de b 0, 400, 1000, del que mostramos el valor b=1000 (B), mapa ADC (C) y T1 con supresión grasa tras la administración de gadolinio (D). Se aprecia una lesión con un componente no graso-no mixoide superior al 75% (intensidad intermedia en secuencias T2), con un valor ADC medio de 1,1×10-3 mm2/s (ROI marcado en blanco) y realce heterogéneo con zona central necrótica (asterisco negro); estos hallazgos sugieren alta celularidad para este tipo de tumores mixoides. LPSM de alto grado con 100% de células redondas.
Analizamos todas las variables cualitativas y cuantitativas. Se utilizó la prueba de la t de Student para muestras independientes en el estudio de la relación entre el tamaño y valor ADC con el grado histológico (alto/bajo grado de la FNCLCC) y porcentaje de células redondas. La prueba de la χ2 y métodos no asintóticos se usaron para evaluar la relación de los márgenes del tumor y las características tisulares (componente graso, componente mixoide, componente no graso-no mixoide y realce) con el grado histológico (alto/bajo grado de la FNCLCC) y porcentaje de células redondas. El análisis se realizó con el software IBM SPSS Statistics para Windows, v. 25.0. Las asociaciones se consideraron estadísticamente significativas si p<0,05.
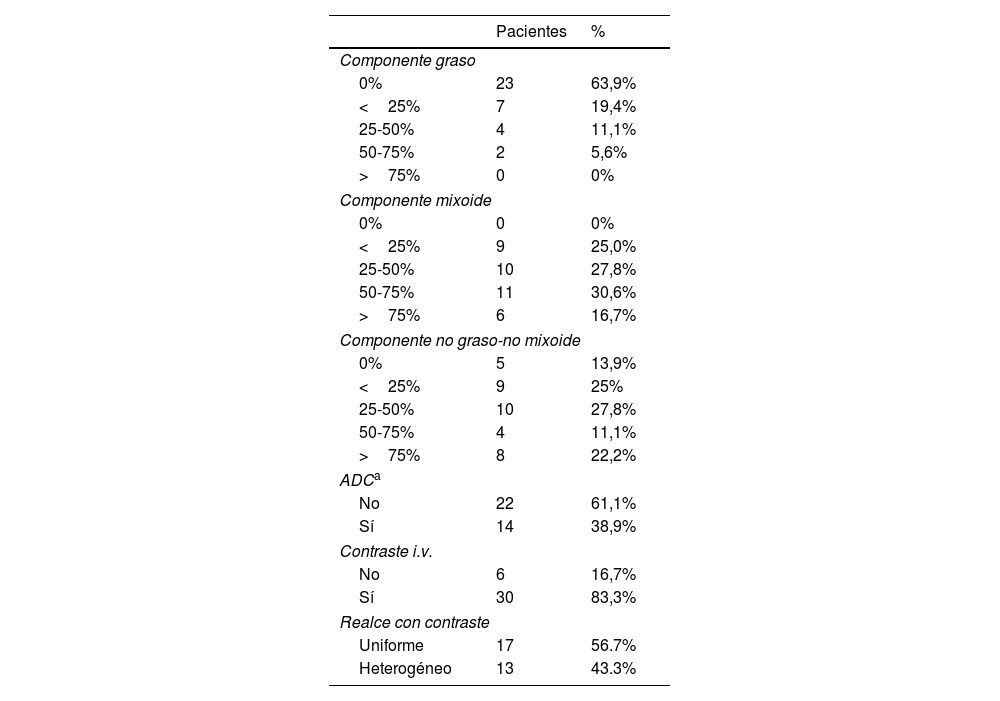
ResultadosAnálisis descriptivoSe estudiaron un total de 36 pacientes, 20 hombres y 16 mujeres, de los cuales 19 pacientes fueron sometidos a tratamiento neoadyuvante previo a la cirugía; en el 78,9% (n=15) fue una combinación de radioterapia y quimioterapia, en el 10,5% (n=2) solo quimioterapia y en el 10,5% (n=2) solo radioterapia. Todos los pacientes fueron sometidos a cirugía, salvo 2 casos por negativa de los pacientes. La mediana de edad fue de 43 años, el paciente más joven tenía 24 años y el mayor 82 años. El 97,2% (n=35) presentó el tumor en el miembro inferior y tan solo un paciente presentaba el tumor en el miembro superior. La mediana del tamaño tumoral fue de 107 mm, siendo el más pequeño de 34 mm y el mayor de 250 mm. En el 86,1% (n=31) el tumor se situó en profundidad respecto a la fascia y en el 13,9% (n=5) eran superficiales a la fascia. El 77,8% (n=28) de los tumores mostraban bordes bien definidos, el 16,7% (n=6) mostró una definición intermedia y el 5,6% (n̴1=2) presentó márgenes mal definidos. Las características tisulares por RM se muestran en la tabla 2.
Variables tisulares analizadas por resonancia magnética
| Pacientes | % | |
|---|---|---|
| Componente graso | ||
| 0% | 23 | 63,9% |
| <25% | 7 | 19,4% |
| 25-50% | 4 | 11,1% |
| 50-75% | 2 | 5,6% |
| >75% | 0 | 0% |
| Componente mixoide | ||
| 0% | 0 | 0% |
| <25% | 9 | 25,0% |
| 25-50% | 10 | 27,8% |
| 50-75% | 11 | 30,6% |
| >75% | 6 | 16,7% |
| Componente no graso-no mixoide | ||
| 0% | 5 | 13,9% |
| <25% | 9 | 25% |
| 25-50% | 10 | 27,8% |
| 50-75% | 4 | 11,1% |
| >75% | 8 | 22,2% |
| ADCa | ||
| No | 22 | 61,1% |
| Sí | 14 | 38,9% |
| Contraste i.v. | ||
| No | 6 | 16,7% |
| Sí | 30 | 83,3% |
| Realce con contraste | ||
| Uniforme | 17 | 56.7% |
| Heterogéneo | 13 | 43.3% |
Entre los datos a destacar, el 63,9% (n=23) de los tumores no mostró señal grasa alguna y ningún caso presentó componente graso superior al 75%. El 75% (n=27) de los tumores mostraron un componente mixoide igual o superior al 25% (fig. 6). El 33,3% (n=12) mostró un componente no graso-no mixoide de más del 50%. Tan solo dispusimos de secuencias difusión en 14 de los 36 pacientes, obteniéndose valores de ADC que oscilaban entre 1,1-2,5×10-3 s/mm2, con una mediana de 2×10-3 s/mm2.
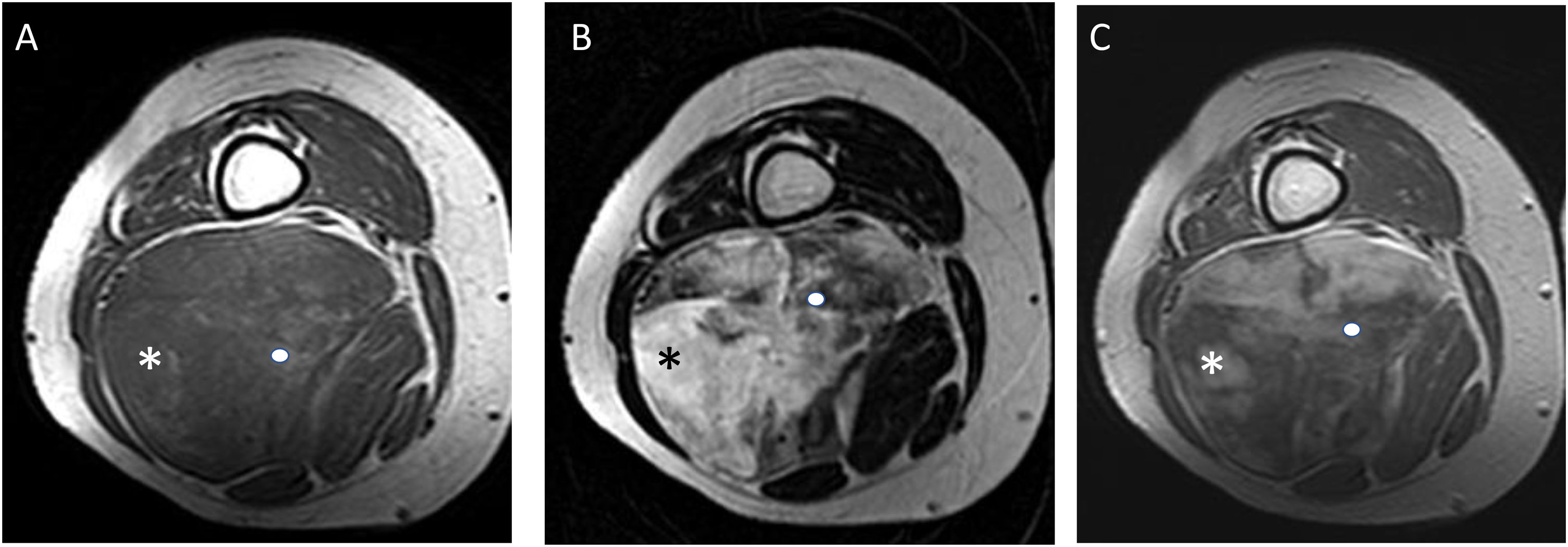
Varón de 54 años con liposarcoma mixoide (LPSM) en el compartimento posterior del muslo izquierdo. Se muestran secuencias axiales potenciadas en T2 (A), T1 con supresión grasa (B) y T1 con supresión grasa tras la administración de gadolinio (C). Se aprecia un componente principal no graso-no mixoide (asterisco) con intensidad intermedia en secuencias T2 y un componente mixoide en margen interno de la lesión con señal alta similar al líquido en T2 (cabeza de flecha). Tras la administración de gadolinio se aprecia un realce heterogéneo. LPSM de alto grado con 25% de células redondas.
Todos los tumores estudiados con contraste (30 de los 36) mostraron captación en grado variable, que en el 56,7% fue un realce uniforme (>75% de captación del tumor).
El 55,6% (n=20) de los tumores fueron diagnosticados de LPSM de alto grado, mientras que el 44,4% (n=16) lo fue de bajo grado. El 44,4% (n=16) mostró células redondas en el análisis histológico, con valores que oscilaron entre el 2% y el 100%. Un 22,2% (n=8) de las biopsias iniciales realizadas no aportaron información completa del grado histológico ni del porcentaje de células redondas. Todos estos pacientes se sometieron a tratamiento quirúrgico de entrada sin neoadyuvancia previa. Cinco de estos 8 pacientes fueron finalmente diagnosticados en la pieza quirúrgica como tumores de alto grado.
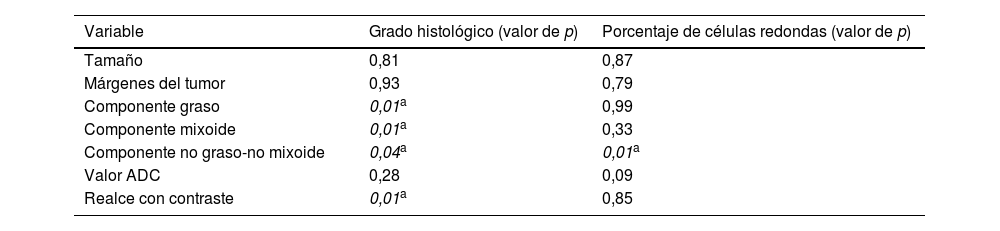
Análisis inferencialEl grado de significación estadística de la asociación entre las variables analizadas por RM y las variables histológicas se muestra en la tabla 3.
Grado de significación estadística de las variables analizadas
No encontramos diferencias significativas entre el tamaño y los márgenes tumorales y tumores de alto y bajo grado (p=0,81 y p=0,93. respectivamente).
Hallamos significación estadística (p=0,01) entre el componente graso y el grado histológico. El 69,6% (n=16) de los tumores sin grasa en RM fueron de alto grado. Por el contrario, la presencia de grasa en el estudio de RM es sugestiva de lesión de bajo grado; cuanto mayor es la presencia de grasa detectada en RM, mayor es la probabilidad de presentar un tumor de bajo grado (ninguno de los tumores con fracción de grasa superior al 50% fue de alto grado).
Los pacientes que mostraron una fracción de tejido mixoide inferior al 25% (n=9) se correspondieron con lesiones de alto grado, encontrando significación estadística entre el componente mixoide y el grado histológico (p=0,01).
Los pacientes con un componente no graso-no mixoide superior al 75% (n=8) fueron de alto grado, existiendo una asociación estadísticamente significativa entre el componente no graso no-mixoide y el grado histológico (p=0,04). Por otro lado, con los datos disponibles se encuentra una asociación estadísticamente significativa entre el componente no graso-no mixoide y el porcentaje de células redondas (p=0,01). Dicho de otro modo, la presencia de un componente no graso-no mixoide superior al 50% supone 7 veces más riesgo de corresponder a tumor de alto grado y 4 veces más riesgo de presentar un contenido de células redondas mayor del 5%. No obstante, los intervalos de confianza al 95% de estos estadísticos son demasiado amplios debido al pequeño tamaño muestral de estos subgrupos.
En nuestra muestra no encontramos asociación estadísticamente significativa de los valores ADC con el grado histológico.
El 83,3% de los tumores con realce heterogéneo fueron de alto grado, mientras que el 64,7% de los tumores con un realce uniforme fueron de bajo grado, encontrando asociación estadísticamente significativa entre el tipo de realce y el grado histológico (p=0,01).
DiscusiónCon este estudio se demuestra la utilidad de la RM como técnica diagnóstica que nos permite diferenciar entre LPSM de alto y bajo grado, complementando la información obtenida en la biopsia, la cual puede infraestimar el grado tumoral de la neoplasia, al no incluir la zona de más alto grado en la muestra, en cuyo caso se podría plantear realizar una nueva biopsia o modificar un determinado tratamiento neoadyuvante12,13.
Nuestro estudio coincide con lo descrito en la literatura científica2,6 en referencia a las características clínicas y epidemiológicas de los LPSM. Es una enfermedad que afecta a adultos jóvenes, localizada en profundidad, principalmente en los miembros inferiores, de contornos bien delimitados y sin diferencias significativas según el sexo.
Aunque está previamente publicada la asociación entre tamaño tumoral y el grado histológico, en nuestra serie no encontramos diferencias estadísticamente significativas7,14.
Aunque los LPSM están incluidos en el grupo de sarcomas con diferenciación adiposa, no suele presentar grasa visible en las pruebas de imagen; en nuestra serie, el 63,9% no mostró intensidad de señal grasa, similar a lo descrito en la literatura14, y cuando aparece lo suele hacer en forma de tenues focos lineales o amorfos15. En nuestra serie, ningún caso presentó un componente graso superior al 75% y solo 2 casos presentaron más del 50%. Si bien la presencia de grasa detectable por RM puede ocurrir en los tumores de bajo y alto grado, la detección de grasa orienta hacia una lesión de bajo grado7,14; en nuestra serie, los dos casos con componente graso superior al 50% fueron de bajo grado y el 69,6% de los LPSM de los pacientes sin evidencia de grasa fue de alto grado (p=0,01).
El componente mixoide es otro elemento característico de la matriz tumoral de los LPSM; a menor contenido puramente mixoide, mayor probabilidad de corresponder a un LPSM de alto grado. En nuestra serie, todos los pacientes con un componente mixoide inferior al 25% se correspondían con tumor de alto grado (p=0,01), coincidiendo con los resultados de Löwenthal et al.14.
En los LPSM también se describe un tercer componente que se corresponde con un tejido que no muestra características de señal grasa ni puramente mixoide y que suele asociarse al componente de células redondas y por tanto a los tumores de alto grado14. En nuestro estudio, todos los pacientes con un componente no graso-no mixoide superior al 75% fueron de alto grado (p=0,04).
Tal y como describen Carrascoso Arranz et al.16, al tratarse de tumores con matriz mixoide y alto contenido en mucina y agua presentan valores altos de ADC (mediana de 2×10-3 mm2/s), si bien no encontramos asociación estadísticamente significativa de los valores ADC con el grado histológico.
Los LPSM con alto contenido mixoide pueden simular lesiones “quísticas” en secuencias sensibles al líquido, por lo que es fundamental realizar series tras la administración del gadolinio para evitar su infradiagnóstico. No existe unanimidad a la hora de clasificar los diferentes patrones de captación de los LPSM. En el estudio retrospectivo realizado por Tateishi et al.13, que incluía 36 pacientes con LPSM, se describe el realce en función de su extensión (ausente, débil o intenso) y patrón (globular-nodular y difuso). En el estudio de Gimber et al.7, que incluye 31 pacientes con LPSM, se refieren al porcentaje de realce tumoral (ninguno,<25%, 25-75% y>75%). En el artículo de Mi-Sook et al.15 se describen tres patrones: homogéneo (realce total), heterogéneo (realce parcial) y ausencia de realce. En el estudio de Tateishi et al., la presencia de un realce intenso fue el factor pronóstico adverso de mayor influencia y se correlacionaba con el contenido de células redondas en las muestras histológicas. En nuestra serie, el 83,3% de los pacientes con un realce heterogéneo fue de alto grado (p=0,01) y hasta un 64,7% de los pacientes con un realce uniforme fue de bajo grado. Una posible explicación a este hallazgo de nuestra serie podría ser que el realce heterogéneo se corresponde con mayor componente de necrosis, más propia de lesiones de alto grado según la FNCLCC, mientras que los tumores con realce uniforme y homogénea carecen de necrosis, lo que es más propio de LPSM de bajo grado.
El manejo de los pacientes diagnosticados de LPSM debe realizarse mediante un abordaje multidisciplinar. Si bien el tratamiento quirúrgico es el de elección en pacientes con enfermedad localizada, en determinadas circunstancias, pueden beneficiarse de una neoadyuvancia mediante quimioterapia o radioterapia4, para lo cual, antes de iniciar el tratamiento es necesario tener presente una serie de factores, como son: la comorbilidad del paciente, localización, tamaño y relación del tumor con estructuras adyacentes, grado histológico y porcentaje células redondas, siendo estos dos últimos de gran relevancia. Tal y como se ha descrito, los LPSM distan mucho de constituir una entidad homogénea y las muestras de la BAG no siempre aportan toda la información necesaria sobre el grado histológico y el porcentaje de células redondas17,situación en la que la información que proporciona la RM puede ayudar en la toma de decisiones. En nuestro trabajo, un 22,2% (n=8) de las biopsias iniciales no aportaron información completa sobre el grado histológico ni porcentaje de células redondas. Todos estos pacientes se sometieron a tratamiento quirúrgico de entrada sin neoadyuvancia previa. Cinco de los 8 pacientes fueron diagnosticados en la pieza quirúrgica como tumores de alto grado. Al revisar las imágenes de RM de estos 5 pacientes, ninguno mostró componente graso significativo, dos mostraron componente no graso-no mixoide de más del 50% y cuatro presentaron un realce heterogéneo (en un caso no disponíamos de estudio con contraste). Es decir, estos tumores mostraron signos por imagen que, según nuestro trabajo, se asocian a los tumores de alto grado. Por tanto, si se hubiera tenido en cuenta la información proporcionada por la RM, se podría haber planteado realizar tratamiento neoadyuvante o bien repetir la biopsia inicial antes de la cirugía (fig. 7).
Mujer de 49 años con tumefacción de rápido crecimiento en la cara posterior del muslo derecho que acude a urgencias con sospecha inicial de hematoma en el contexto de rotura fibrilar. Se muestran secuencias axiales T1 (A), T2 (B), T1 sin supresión grasa tras la administración de gadolinio (C). Se aprecia una lesión con componente no graso-no mixoide de más del 50% [hipointenso en T1, intensidad intermedia en secuencias T2 y realce heterogéneo tras la administración de gadolinio (asterisco)]. En este caso, la tumoración muestra también un componente hemorrágico (círculo). Ante los hallazgos por imagen, se realiza biopsia con aguja gruesa (BAG) con diagnóstico de LPSM de células redondas, pero sin poder especificar el porcentaje de estas ni el grado histológico. Se realiza resección quirúrgica sin neoadyuvancia previa, con diagnóstico final en la pieza quirúrgica de LSPM de alto grado. La información proporcionada por la RM orientaba hacia un alto grado, por lo que se podría haber planteado la opción de tratamiento neoadyuvante o repetir BAG para un diagnóstico más preciso. Seis años después, la paciente desarrolló una metástasis ósea de su LPSM en la región diafisaria distal del fémur contralateral (lesión endomedular hiperintensa) confirmada tras la biopsia ósea.
Cualquier lesión que presente una matriz extracelular con alto contenido en mucupolisacáridos, cartílago hialino y necrosis puede simular una lesión quística15. Son muchos los tumores de partes blandas con contenido mixoide, por lo que en el diagnóstico diferencial se tiende a considerar entidades tanto benignas: mixoma intramuscular (son difíciles de diferenciar de los LPSM, si bien los mixomas suelen presentar un realce más homogéneo y no presentan contenido graso), ganglión (suelen tener localizaciones características en relación con vainas tendinosas y no intramusculares, sin realce o ligero realce capsular) como malignas: condrosarcoma mixoide extraesquelético (suelen mostrar un patrón de realce heterogéneo lobular en arcos-anillos que reflejan su origen cartilaginoso).
Nuestro estudio tiene varias limitaciones. Primero se trata de un estudio retrospectivo. Segundo, al igual que los estudios previos, disponemos de un tamaño muestral pequeño, reflejo de la baja incidencia de este tipo de tumores. Aquellas asociaciones con un nivel de significación estadística en el límite probablemente se podrían haber demostrado con un mayor tamaño muestral. Tercero, nuestro estudio solo incluye pacientes adultos de 18 años o más, lo cual podría suponer un sesgo. Cuarto, los estudios de RM se han obtenido en varios centros, con protocolos no estandarizados ni homogéneos y a lo largo de un período de 9 años, lo que puede en ocasiones complicar la obtención de los valores analizados al ser difícil distinguir los diferentes componentes de tejido. Finalmente, la reproducibilidad interobservador no fue verificada.
En conclusión, la RM es una herramienta diagnóstica útil que permite diferenciar entre LPSM de alto/bajo grado y ayudar en la toma de decisiones clínicas. Las características por RM que orientan hacia un LPSM de alto grado en nuestra muestra son la ausencia de grasa, escaso contenido mixoide, alto contenido en tejido no graso-no mixoide y realce heterogéneo. La presencia de alto contenido en grasa y realce uniforme orientaría hacia un LPSM de bajo grado. No obstante, creemos que sería de interés realizar un estudio prospectivo con mayor tamaño muestral, para lo cual sería necesaria la colaboración de varios centros, dada la baja incidencia de este tipo de tumores y el uso de protocolos de RM estandarizados.
Autoría- 1.
Responsable de la integridad del estudio: VET.
- 2.
Concepción del estudio: VET, CAG, DVP, MCM, JIR, ACR, JMP.
- 3.
Diseño del estudio: VET, CAG, DVP, MCM, JIR, ACR, JMP.
- 4.
Obtención de los datos: VET.
- 5.
Análisis e interpretación de los datos: VET, CAG, DVP, MCM, JIR, ACR, JMP.
- 6.
Tratamiento estadístico: VET, CAG.
- 7.
Búsqueda bibliográfica: VET.
- 8.
Redacción del trabajo: VET, CAG, DVP, MCM, JIR, ACR, JMP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: VET, CAG, DVP, MCM, JIR, ACR, JMP.
- 10.
Aprobación de la versión final: VET, CAG, DVP, MCM, JIR, ACR, JMP.
Los autores declaran no tener ningún conflicto de intereses.









![Varón de 30 años con liposarcoma mixoide (LPSM) en el compartimento medial del muslo derecho. Se muestran secuencias axiales T1 (A), T2 (B) y T1 con supresión grasa tras la administración de gadolinio (C). Se aprecia un componente no graso-no mixoide mayor del 75% (asterisco blanco en A y B) [hipointensa en T1, intensidad intermedia en secuencias T2 y realce heterogéneo con focos que no captan en el margen medial de la lesión (asterisco blanco en C)]. LPSM de alto grado con 90% de células redondas. Varón de 30 años con liposarcoma mixoide (LPSM) en el compartimento medial del muslo derecho. Se muestran secuencias axiales T1 (A), T2 (B) y T1 con supresión grasa tras la administración de gadolinio (C). Se aprecia un componente no graso-no mixoide mayor del 75% (asterisco blanco en A y B) [hipointensa en T1, intensidad intermedia en secuencias T2 y realce heterogéneo con focos que no captan en el margen medial de la lesión (asterisco blanco en C)]. LPSM de alto grado con 90% de células redondas.](https://static.elsevier.es/multimedia/00338338/00000065000000S2/v2_202310041452/S0033833821000527/v2_202310041452/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


![Mujer de 49 años con tumefacción de rápido crecimiento en la cara posterior del muslo derecho que acude a urgencias con sospecha inicial de hematoma en el contexto de rotura fibrilar. Se muestran secuencias axiales T1 (A), T2 (B), T1 sin supresión grasa tras la administración de gadolinio (C). Se aprecia una lesión con componente no graso-no mixoide de más del 50% [hipointenso en T1, intensidad intermedia en secuencias T2 y realce heterogéneo tras la administración de gadolinio (asterisco)]. En este caso, la tumoración muestra también un componente hemorrágico (círculo). Ante los hallazgos por imagen, se realiza biopsia con aguja gruesa (BAG) con diagnóstico de LPSM de células redondas, pero sin poder especificar el porcentaje de estas ni el grado histológico. Se realiza resección quirúrgica sin neoadyuvancia previa, con diagnóstico final en la pieza quirúrgica de LSPM de alto grado. La información proporcionada por la RM orientaba hacia un alto grado, por lo que se podría haber planteado la opción de tratamiento neoadyuvante o repetir BAG para un diagnóstico más preciso. Seis años después, la paciente desarrolló una metástasis ósea de su LPSM en la región diafisaria distal del fémur contralateral (lesión endomedular hiperintensa) confirmada tras la biopsia ósea. Mujer de 49 años con tumefacción de rápido crecimiento en la cara posterior del muslo derecho que acude a urgencias con sospecha inicial de hematoma en el contexto de rotura fibrilar. Se muestran secuencias axiales T1 (A), T2 (B), T1 sin supresión grasa tras la administración de gadolinio (C). Se aprecia una lesión con componente no graso-no mixoide de más del 50% [hipointenso en T1, intensidad intermedia en secuencias T2 y realce heterogéneo tras la administración de gadolinio (asterisco)]. En este caso, la tumoración muestra también un componente hemorrágico (círculo). Ante los hallazgos por imagen, se realiza biopsia con aguja gruesa (BAG) con diagnóstico de LPSM de células redondas, pero sin poder especificar el porcentaje de estas ni el grado histológico. Se realiza resección quirúrgica sin neoadyuvancia previa, con diagnóstico final en la pieza quirúrgica de LSPM de alto grado. La información proporcionada por la RM orientaba hacia un alto grado, por lo que se podría haber planteado la opción de tratamiento neoadyuvante o repetir BAG para un diagnóstico más preciso. Seis años después, la paciente desarrolló una metástasis ósea de su LPSM en la región diafisaria distal del fémur contralateral (lesión endomedular hiperintensa) confirmada tras la biopsia ósea.](https://static.elsevier.es/multimedia/00338338/00000065000000S2/v2_202310041452/S0033833821000527/v2_202310041452/es/main.assets/thumbnail/gr7.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


