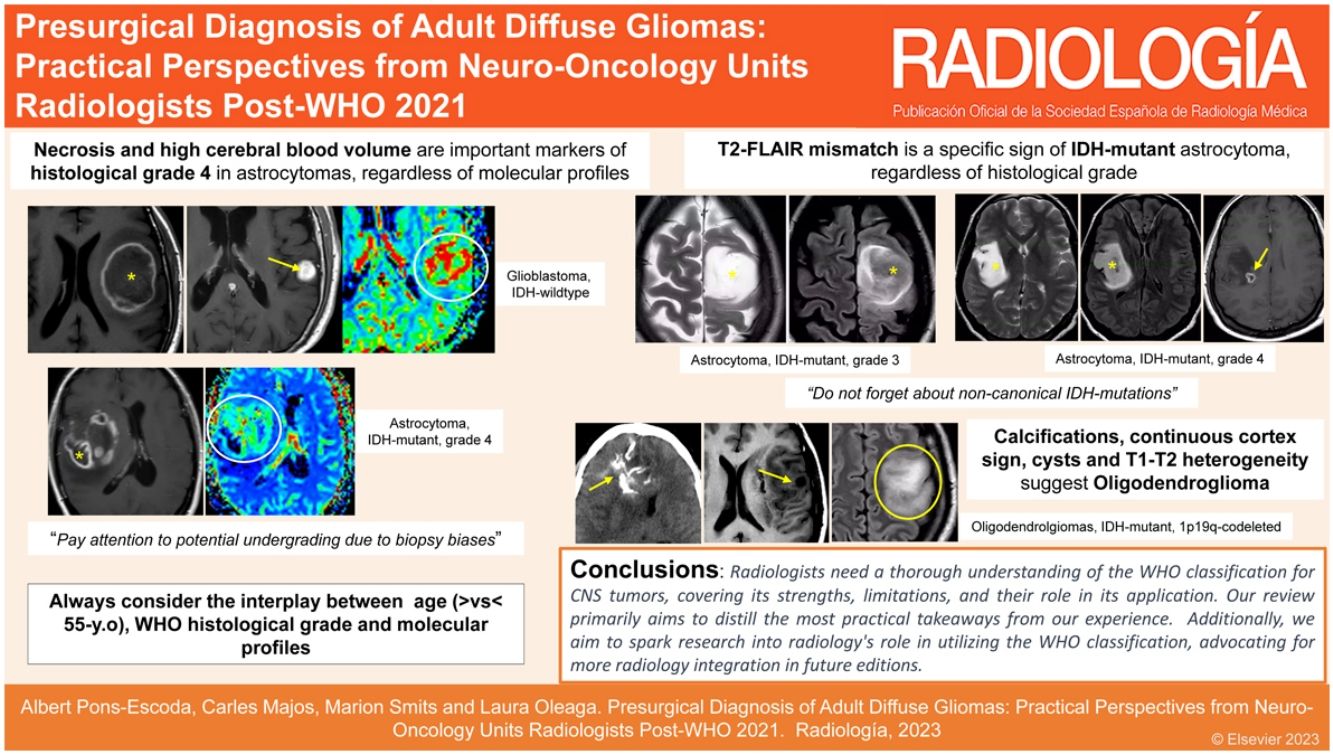
La Clasificación 2021 de tumores del sistema nervioso central (SNC) por la Organización Mundial de la Salud (OMS) fue acogida con entusiasmo, aunque al principio pudo parecer abrumadora. Con el tiempo, hemos comprendido los puntos clave, y basándonos en nuestra experiencia en Unidades de Neurooncología de hospitales internacionales, hemos elaborado una guía práctica para radiólogos. Esta guía esclarece los criterios de clasificación de los gliomas difusos en los adultos y presenta un formato claro para su aplicación diaria. El manuscrito repasa la evolución histórica de las clasificaciones y destaca las novedades más relevantes. Ofrece un análisis detallado de las entidades principales, centrándose en las manifestaciones radiológicas. Además, discute los temas más controvertidos de los últimos años. Con este documento, los radiólogos estarán preparados para realizar diagnósticos prequirúrgicos, y sobre todo para colaborar eficazmente en la toma de decisiones clínicas, con impacto directo sobre el tratamiento, el pronóstico o la atención personalizada.
The 2021 World Health Organization classification of CNS tumours was greeted with enthusiasm as well as an initial potential overwhelm. However, with time and experience, our understanding of its key aspects has notably improved. Using our collective expertise gained in neuro-oncology units in hospitals in different countries, we have compiled a practical guide for radiologists that clarifies the classification criteria for diffuse gliomas in adults. Its format is clear and concise to facilitate its incorporation into everyday clinical practice. The document includes a historical overview of the classifications and highlights the most important recent additions. It describes the main types in detail with an emphasis on their appearance on imaging. The authors also address the most debated issues in recent years. It will better prepare radiologists to conduct accurate presurgical diagnoses and collaborate effectively in clinical decision making, thus impacting decisions on treatment, prognosis, and overall patient care.
Tras la publicación de la clasificación de 2021 de la Organización Mundial de la Salud (OMS) para los tumores del sistema nervioso central (SNC), se produjo un aumento rápido de artículos relacionados en el área de la radiología1–3. Inicialmente, esta cantidad de publicaciones podía parecer desalentadora para muchos radiólogos, pero, con el tiempo y la práctica, nuestra comprensión de los nuevos aspectos clave ha mejorado considerablemente y, al compartir nuestra experiencia, adquirida en Unidades de Neurooncología de hospitales internacionales, creemos que estamos preparados para ofrecer una guía práctica. Este documento, dirigido a radiólogos (y a otros médicos relacionados con esta área) destaca los componentes cruciales de la 5.a edición de la clasificación de una forma clara y comprensible, que puede incorporarse rápidamente a la práctica diaria.
El objetivo principal de este trabajo es ofrecer una revisión práctica basada en la experiencia de los autores en la caracterización de gliomas difusos del adulto en unidades multidisciplinares. En última instancia, esta categorización se realiza mediante evaluaciones visuales de las imágenes radiológicas4, pero es esencial no pasar por alto conceptos clínicos críticos que son fundamentales para una aplicación óptima de los conocimientos de imagen. Además de esclarecerse los conceptos y fundamentos esenciales de la clasificación desde una perspectiva crítica aplicada, el contenido se ha diseñado para que resulte comprensible para un público amplio. La guía, centrada en la imagen, puede adaptarse a protocolos de resonancia magnética nuclear (RMN) estándar5–7, sin requerir un procesamiento o análisis de datos complejo, lo que garantiza su aplicabilidad, practicidad y pertinencia.
Antecedentes históricosEn 2007, la clasificación se basaba en el examen histológico de muestras quirúrgicas. Los gliomas difusos se dividían en astrocíticos, oligodendrocíticos o mixtos- (oligoastrocíticos)8. Así pues, la caracterización de cada tumor dependía de las evaluaciones de los anatomopatólogos, con cierto grado de subjetividad9. En especial, el consenso entre patólogos no alcanzaba una precisión ideal cuando se trataba de tumores con algún elemento oligodendroglial10.
Gracias a los avances sustanciales en patología molecular, se integraron criterios moleculares a la evaluación histológica en la clasificación de la OMS de 2016. Una actualización clave consistió en diferenciar los oligodendrogliomas de los astrocitomas requiriéndose la presencia de una mutación del gen isocitrato deshidrogenasa (IDH) y la codelección de 1p/19q en los oligodendrogliomas, reduciéndose de este modo la subjetividad en la clasificación histológica10,11. Otra actualización significativa consistió en catalogar los astrocitomas teniendo en cuenta no solo su grado histológico, sino también la presencia o ausencia de una mutación de IDH. Este cambio estuvo impulsado por el reconocimiento de diferencias biológicas y pronósticas sustanciales entre los tumores con mutación de IDH y aquellos sin esta, más allá del grado histológico11. Tras algunos años de influencia creciente de la patología molecular12, el cambio de paradigma se completó en 2021, cuando la clasificación se centró, principalmente, en entidades genéticas.
OMS 2021: clasificación de los gliomas difusos en adultos, resumen claveEl nuevo sistema de clasificación se centra ahora en tres categorías principales definidas genéticamente: glioblastoma sin mutación de IDH (IDH-wildtype) astrocitoma con mutación de IDH (IDH-mutado) y oligodendroglioma con mutación de IDH y codelección de 1p/19q (IDH-mutado y 1p/19q-codeleccionado). Los astrocitomas tienen grados de 2 a 4, mientras que los oligodendrogliomas 2 y 3. El término anaplásico se abandona y se sustituye por grado 3, y el astrocitoma IDH-mutado grado 4 deja de denominarse glioblastoma (un término que ahora se reserva exclusivamente para IDH-wildtype).
El sistema de clasificación en grados de cada tumor sigue basándose fundamentalmente en la histología, de modo que las mitosis elevadas y la presencia de necrosis o de proliferación microvascular indican un grado 4. Sin embargo, con los nuevos criterios genéticos, lo que antes se consideraba un grado (únicamente) histológico 2 o 3, puede ser ahora un grado 4 por criterios moleculares (grados 4 moleculares): 1) una codelección homocigota del inhibidor de las cinasas dependientes de ciclinas (CDKN)2A o CDKN2B en un astrocitoma IDH-mutado hace que se clasifique como astrocitoma IDH-mutado grado 4, o bien 2) una amplificación del gen receptor del factor de crecimiento epidérmico (EGFR), una mutación del promotor de transcriptasa inversa de la telomerasa (TERT) o una ganancia del cromosoma 7 y una pérdida del 10 (7+/10 -) concurrentes en el tumor IDH-wildtype lo cataloga como glioblastoma (grado 4 de la OMS), independientemente de los rasgos histológicos13.
Así pues, en resumen, las principales actualizaciones clave fueron: 1) simplificación de la clasificación a tres categorías definidas genéticamente (glioblastoma IDH-wildtype, astrocitoma IDH-mutado, y oligodendroglioma IDH-mutado y 1p/19q-codeleccionado); y 2) incorporación en la clasificación de los tumores de grado 4 molecular junto con las evaluaciones histológicas tradicionales2,13.
Además, la nueva clasificación establece una distinción particular entre gliomas de tipo adulto y pediátrico, y reconoce que es posible que algunos tipos de tumores pediátricos se desarrollen también en adultos jóvenes. Como consecuencia, se añade otro marcador molecular crucial para catalogar los tumores IDH-wildtype en adultos jóvenes, especialmente si están localizados en la línea media: las mutaciones en el gen de la histona H3. Las mutaciones H3K27M se observan con frecuencia en gliomas difusos infiltrantes situados en estructuras de la línea media. Las mutaciones H3.3G34R/V están presentes en un grupo más reducido de gliomas de alto grado en los hemisferios cerebrales, con un pronóstico más favorable. Por lo tanto, en sujetos jóvenes, deben descartarse las mutaciones en H3 antes de confirmar un glioblastoma IDH-wildtype13–15.
Por último, es fundamental comprender dos términos: «not otherwise specified» (NOS) y «not elsewhere classified» (NEC). NOS indica que no se dispone de las pruebas necesarias que permitan una caracterización definitiva. NEC significa que, tras realizar todas las pruebas requeridas, el tumor no puede asignarse a ninguna de las categorías establecidas por la OMS13,16. Las entidades principales de NEC corresponden a tumores astrocíticos IDH-wildtype de grado 2 o 3. Estos no cumplen los criterios histológicos o moleculares del grado 4 y, por tanto, no pueden definirse como glioblastoma2,17. Estas entidades, en cierto modo enigmáticas, han atraído gran atención en los debates académicos y se tratarán en este artículo en un subapartado posterior dedicado a ellas.
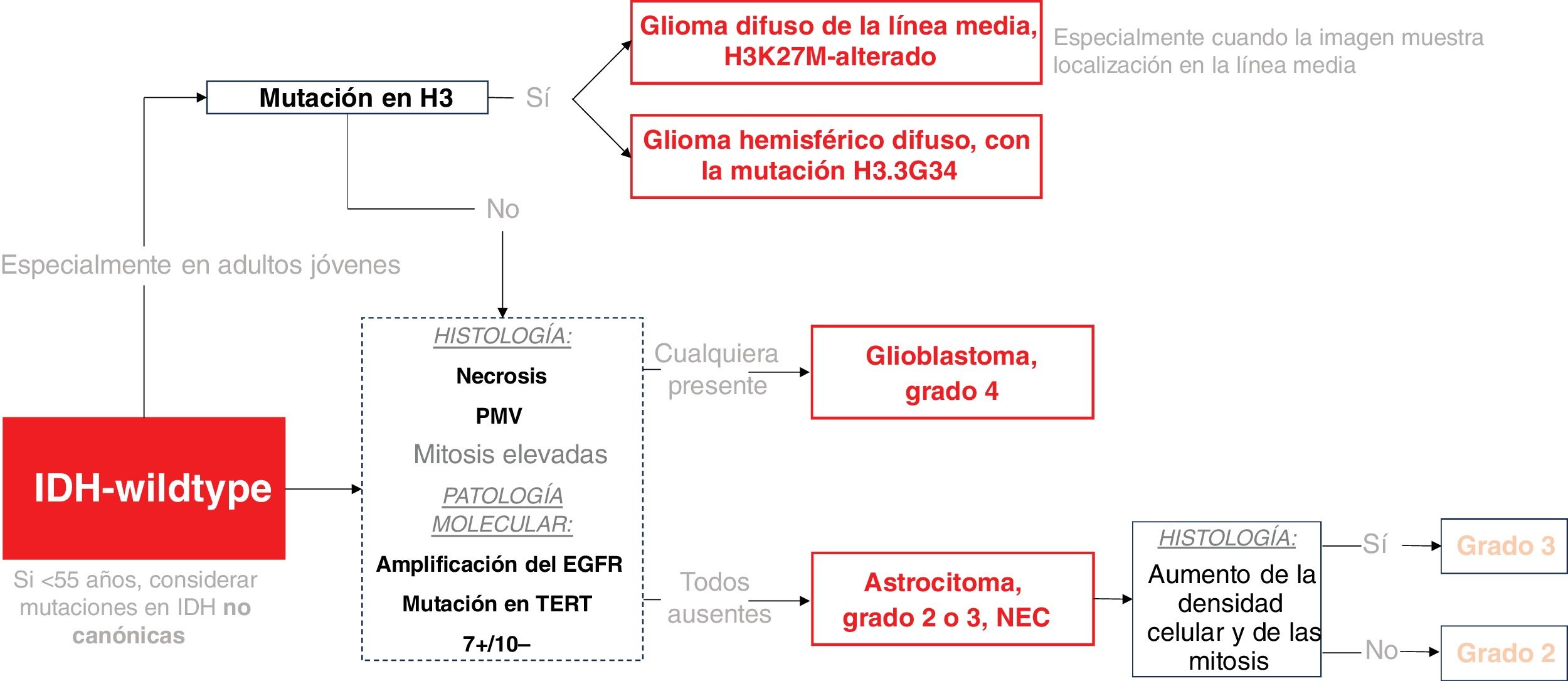
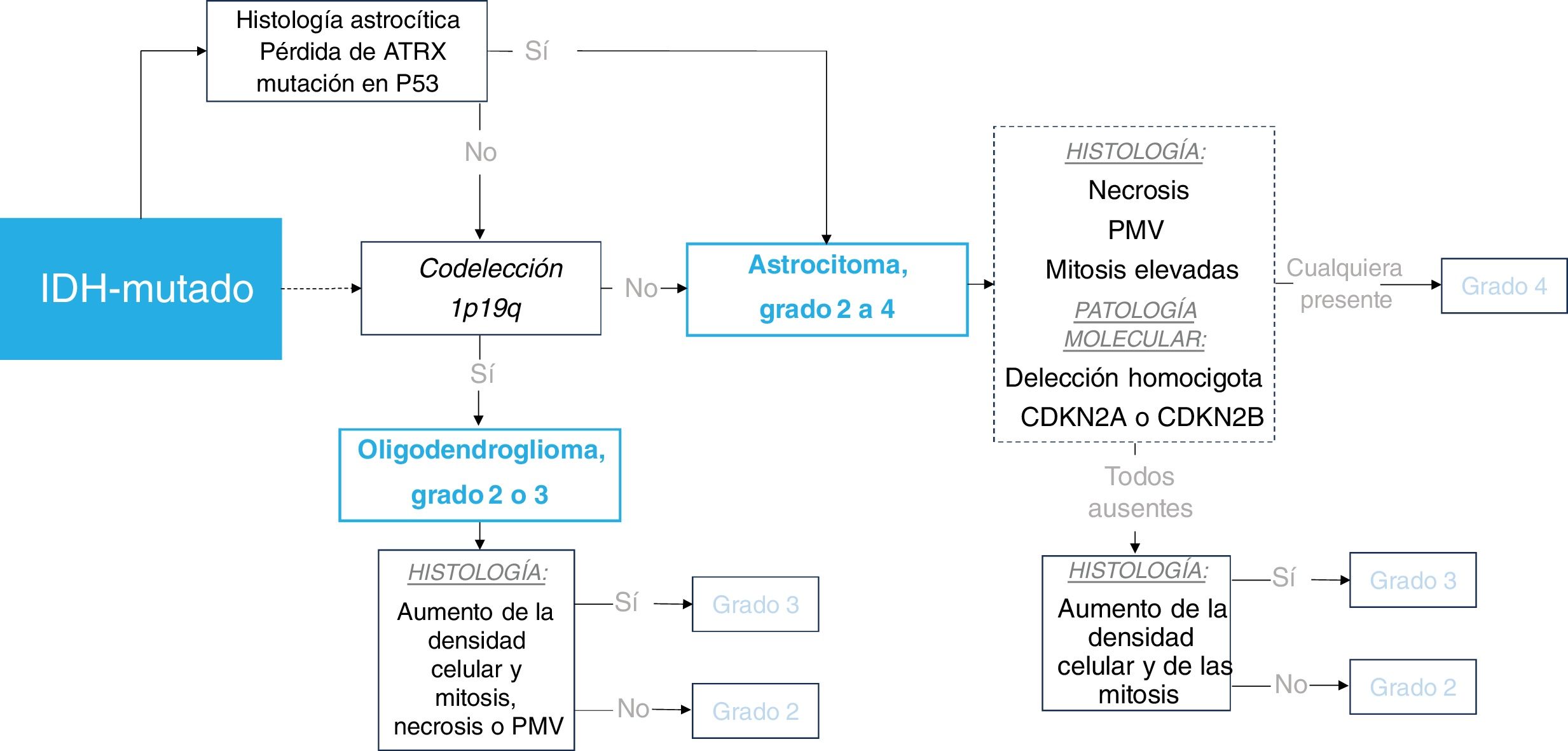
En la figura 1 se presenta un marco simplificado de la clasificación de los tumores sin mutación de IDH y, en la figura 2, de los tumores con dicha mutación.
Esquema de clasificación de los gliomas IDH-wildtype en adultos. Las mutaciones en H3 se consideran gliomas de tipo pediátrico, pero se incluyen aquí debido a su posible interés en adultos jóvenes. El recuadro discontinuo resalta los escenarios en los que la patología molecular puede determinar un tumor de grado 4, independientemente de la histología.
EGFR: receptor del factor de crecimiento epidérmico; IDH: gen isocitrato deshidrogenasa; H3: histona 3; NEC: «not elsewhere classified»; PMV: proliferación microvascular; TERT: transcriptasa inversa de la telomerasa.
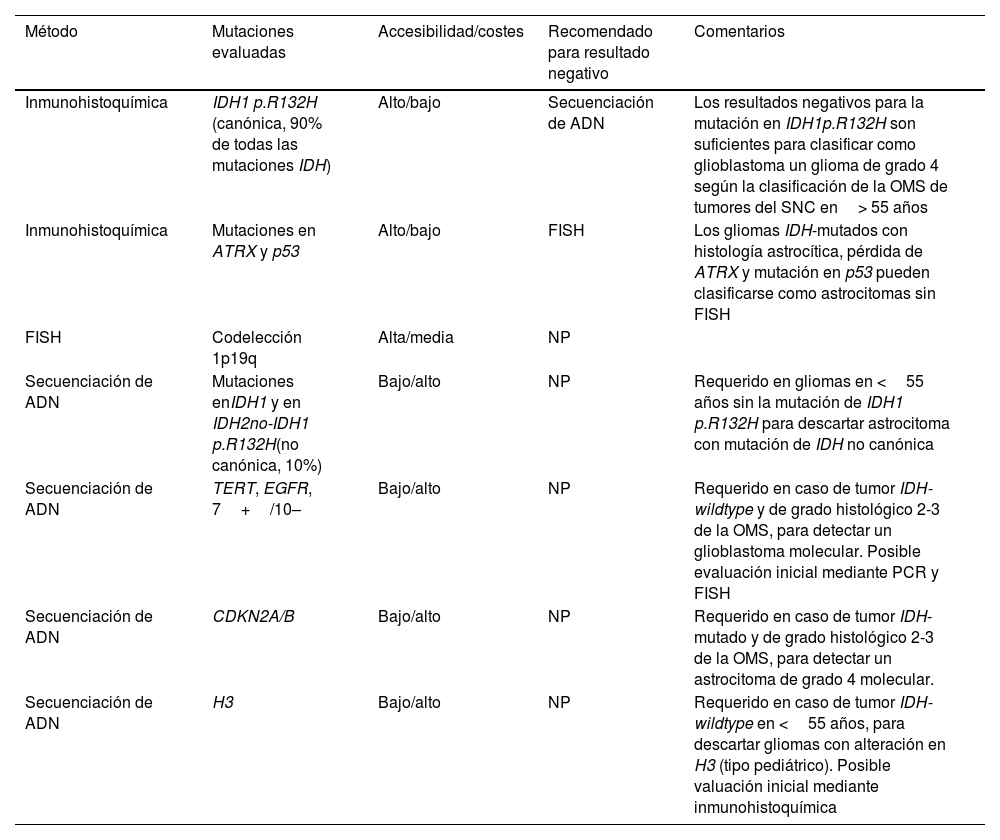
Es fundamental conocer las pruebas moleculares disponibles, así como sus ventajas y limitaciones. La inmunohistoquímica es el método más accesible para evaluar la presencia o no de mutaciones en el gen IDH. Sin embargo, evalúa exclusivamente las mutaciones en IDH1 p.R132H, que representan más de 90% de estas.
La secuenciación genética, menos accesible y más cara, amplía la detección a otros locus de IDH1 e IDH2, conocidos como mutaciones de IDH no canónicas. Por lo tanto, si el resultado de la inmunohistoquímica es negativo, se recomienda realizar una secuenciación de ADN. Sin embargo, no es obligatoria para los gliomas de grado 4 en pacientes de ≥ 55 años, en los que un resultado inmunohistoquímico negativo es suficiente para clasificar el tumor como glioblastoma IDH-wildtype13,18,19. Además, en lo que respecta a los oligodendrogliomas y la codelección 1p/19q, si las características histológicas, la mutación de IDH y el estado de p53 y ATRX indican la presencia de un astrocitoma IDH-mutado, no hace falta recurrir a la hibridación fluorescente in situ (FISH) para determinar la codelección 1p/19q13,20,21 (tabla 1).
Resumen de las pruebas de patología molecular
| Método | Mutaciones evaluadas | Accesibilidad/costes | Recomendado para resultado negativo | Comentarios |
|---|---|---|---|---|
| Inmunohistoquímica | IDH1 p.R132H (canónica, 90% de todas las mutaciones IDH) | Alto/bajo | Secuenciación de ADN | Los resultados negativos para la mutación en IDH1p.R132H son suficientes para clasificar como glioblastoma un glioma de grado 4 según la clasificación de la OMS de tumores del SNC en> 55 años |
| Inmunohistoquímica | Mutaciones en ATRX y p53 | Alto/bajo | FISH | Los gliomas IDH-mutados con histología astrocítica, pérdida de ATRX y mutación en p53 pueden clasificarse como astrocitomas sin FISH |
| FISH | Codelección 1p19q | Alta/media | NP | |
| Secuenciación de ADN | Mutaciones enIDH1 y en IDH2no-IDH1 p.R132H(no canónica, 10%) | Bajo/alto | NP | Requerido en gliomas en <55 años sin la mutación de IDH1 p.R132H para descartar astrocitoma con mutación de IDH no canónica |
| Secuenciación de ADN | TERT, EGFR, 7+/10– | Bajo/alto | NP | Requerido en caso de tumor IDH-wildtype y de grado histológico 2-3 de la OMS, para detectar un glioblastoma molecular. Posible evaluación inicial mediante PCR y FISH |
| Secuenciación de ADN | CDKN2A/B | Bajo/alto | NP | Requerido en caso de tumor IDH-mutado y de grado histológico 2-3 de la OMS, para detectar un astrocitoma de grado 4 molecular. |
| Secuenciación de ADN | H3 | Bajo/alto | NP | Requerido en caso de tumor IDH-wildtype en <55 años, para descartar gliomas con alteración en H3 (tipo pediátrico). Posible valuación inicial mediante inmunohistoquímica |
EGFR: receptor del factor de crecimiento epidérmico; FISH: hibridación fluorescente in situ; IDH: gen isocitrato deshidrogenasa; NP: no procede; OMS: Organización Mundial de la Salud; PCR: reacción en cadena de la polimerasa; SNC: sistema nervioso central; TERT: transcriptasa inversa de la telomerasa.
Comprender esto capacita a los radiólogos a contribuir eficazmente para que se alcance el diagnóstico más preciso y recomendar pruebas específicas en situaciones concretas. Por ejemplo, si los resultados inmunohistoquímicos son negativos para mutación de IDH en un tumor con T2-FLAIR mismatch (signo altamente específico para astrocitoma IDH-mutado), deberíamos insistir en el análisis de mutaciones de IDH no canónicas con secuenciación genética.
OMS 2021: diagnóstico diferencial por imagen de gliomas difusos en adultosLa radiología en la era de la clasificación genética, tendencias actuales y perspectiva críticaComo consecuencia de los recientes avances en la caracterización genética de los gliomas, existe un creciente interés por la radiogenómica: la clasificación de entidades definidas genéticamente en función de fenotipos de imagen22. Por lo general, es cuantitativa y se basa en «big data», y está ampliamente representada en la literatura científica. Sin embargo, la radiogenómica visual/cualitativa también es factible y útil; y, de hecho, la evaluación visual sigue predominando en la práctica clínica23–28.
Al revisar la literatura radiológica sobre la clasificación de 2021, es esencial adoptar una perspectiva crítica. Muchos estudios dicen distinguir entre diferentes entidades genéticas, si bien estas afirmaciones a menudo requieren una interpretación cuidadosa, ya que existe una estrecha correlación entre los marcadores genéticos y los grados histológicos. Así, por ejemplo, los tumores IDH-wildtype son, en su mayoría, glioblastomas de grado histológico 4, mientras que los astrocitomas IDH-mutados suelen ser de grado 2-3. Por lo tanto, las afirmaciones de algunos estudios sobre la diferenciación entre la presencia y la ausencia de mutaciones IDH podrían ser, en realidad, una distinción más familiar entre los grados 2-3 y 4. Por ejemplo, ¿es la presencia de necrosis un marcador de IDH-wildtype o es simplemente un marcador de grado 4 como ya sabíamos? Todo ello invita al debate. Por ejemplo, en pacientes jóvenes, en los que coexisten IDH-wildtype y IDH-mutado de forma más balanceada que en las personas de edad avanzada13,19,29, la necrosis, más allá de indicar un grado histológico 4, puede ser un marcador no fiable de la presencia o ausencia de mutaciones en IDH. Otro caso en el que no sería posible determinar el estado de IDH a partir de la ausencia de necrosis radiológica es el de un astrocitoma grado 2-3 IDH-wildtype NEC, que no debería presentar necrosis en la histología13. Por lo tanto, existe una delicada interacción entre los datos clínico-epidemiológicos, el grado histológico y el perfil genético que el radiólogo debe manejar con destreza a la hora de sugerir un diagnóstico específico en los informes clínicos o en los comités de neurooncología.
Conceptos clave preliminaresEl primer factor que hay que tener en cuenta al abordar el diagnóstico diferencial adecuado debe ser la edad del paciente. Las mutaciones en IDH son mucho más frecuentes en los menores de 55 años13,17,19,29. Por lo tanto, en los sujetos mayores de esta edad, existe una probabilidad sustancial de identificar un tumor IDH-wildtype, que casi siempre es un glioblastoma. La precisión de la imagen en la detección del grado histológico 4 en gliomas astrocíticos, independientemente de la presencia o ausencia de mutaciones en IDH, es crucial para los radiólogos. De acuerdo con los criterios histológicos de la OMS para el grado 4, existen dos métodos principales. El primero consiste en identificar necrosis en secuencias potenciadas en T1 (T1w) poscontraste30,31. El segundo radica en evaluar las manifestaciones indirectas de proliferación microvascular mediante imagen de perfusión dinámica (DSC-PWI)32,33. Simplificando: los mapas del volumen sanguíneo cerebral (CBV) sin hallazgos patológicos (sin aumentos significativos) se asocian típicamente a astrocitomas de grado 2. En el grado 3, cabría observar un rango que iría desde la ausencia de aumentos significativos de CBV hasta algunos focos de CBV ligeramente elevado. Por el contrario, las elevaciones manifiestas difusas o nodulares claras del CBV son más indicativas de un grado 434. Además, la imagen potenciada en difusión (DWI) puede proporcionar información sobre la densidad celular y, por lo tanto, la actividad mitótica, que es también importante para la clasificación histológica35,36. Todos estos criterios de gradación basada en imágenes son más controvertidos en el caso de los oligodendrogliomas24,37.
Por último, es importante mencionar una manifestación radiológica bien conocida y extremadamente específica de los astrocitomas IDH-mutados: el mismatch T2/FLAIR, el cual consiste en una señal T2w alta y FLAIR baja dentro de un tumor sólido, a menudo acompañada de un borde periférico de hiperintensidad en FLAIR38. Esta manifestación sirve como marcador específico de la mutación de IDH y está ausente en los gliomas con codelección 1p19q, lo que posibilita la diferenciación entre los astrocitomas (IDH-mutados y sin codelección 1p19q) y los oligodendrogliomas (IDH-mutados y 1p19q-codeleccionados). Además, puede actuar como un indicador de pronóstico favorable en el caso de los astrocitomas23.
Glioblastoma IDH-wildtypeEl glioblastoma es el tumor maligno primario más frecuente en adultos y afecta especialmente a personas mayores de 55 años13,17,19,29,39. Los síntomas clínicos oscilan de agudos a subagudos40. Se trata de un glioma astrocítico, sin mutaciones en IDH ni en H3, que se caracteriza por proliferación microvascular o necrosis; o alteración de TERT, EGFR, o ganancia en el cromosoma 7 y pérdida en el 1013,15. Surge en la sustancia blanca subcortical e infiltra el córtex y la sustancia gris profunda. Su extensión por el cuerpo calloso es un patrón de crecimiento bien conocido41. El pronóstico en cuanto a supervivencia es malo, de alrededor de 15-18 meses con tratamiento13. La metilación del promotor del MGMT (O[6]-methylguanine-DNA methyltransferase) es un factor pronósitco independiente y conlleva una supervivencia mayor, independientemente de la edad y el estado funcional del paciente42,43.
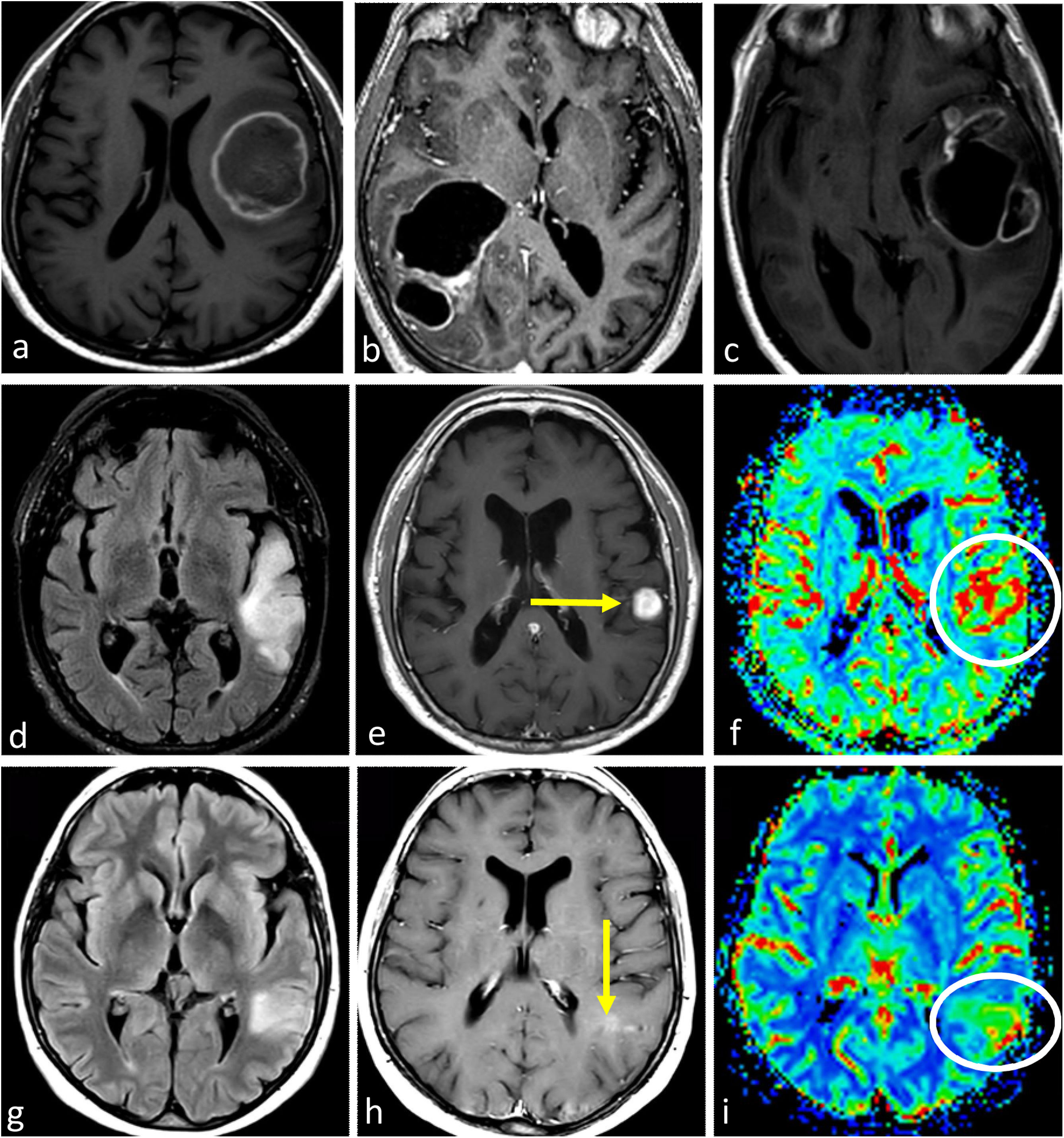
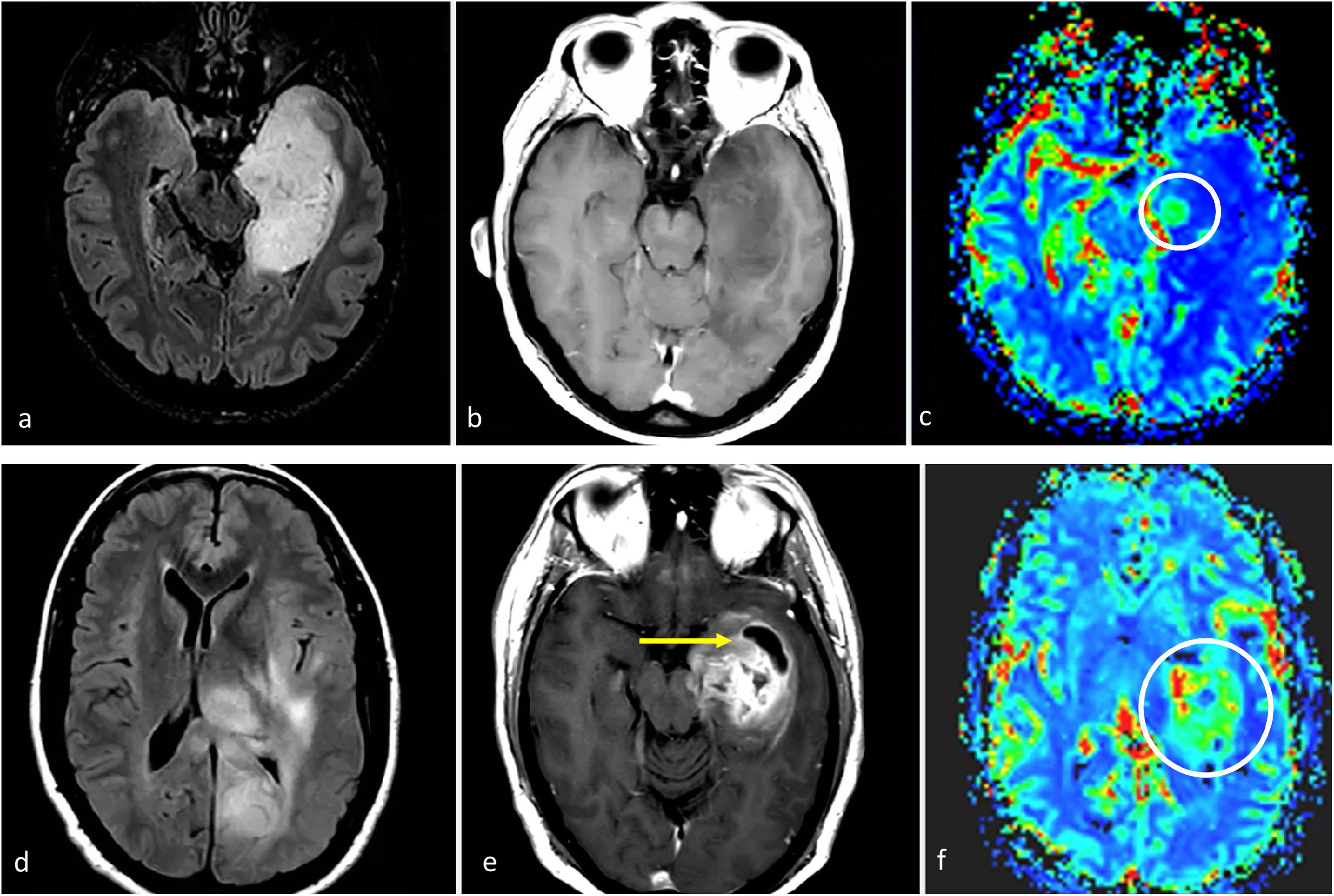
ImágenesLas imágenes características del glioblastoma consisten en una lesión expansiva-infiltrante con realce irregular prominente, necrosis central extensa y márgenes mal definidos. Con frecuencia se observan diferentes grados de hemorragia. Son habituales las zonas de edema de moderadas a grandes y el efecto de masa1–3,23. Son recurrentes la infiltración de la piamadre y el epéndimo44. Los componentes tumorales en T2w y FLAIR, no captantes, pueden ser radiológicamente visibles, aunque no suelen ser la parte predominante del tumor45,46. Son muy comunes las áreas de CBV claramente elevado y difusión restringida dentro del tumor captante47,48. Además, la detección de estas áreas hiperperfundidas/con difusión restringida más allá del tumor captante es útil para diferenciar el glioblastoma de las metástasis únicas49–51 (fig. 3).
Tres presentaciones típicas diferentes del glioblastoma IDH-wildtype en pacientes de entre 60 y 70 años. a-c) características paradigmáticas en imágenes axiales T1w poscontraste de tres pacientes diferentes, con márgenes irregulares, realce en anillo y necrosis extensa. d-f) FLAIR axial, T1w poscontraste y mapas de color del CBV de DSC-PWI. Extensa lesión infiltrante temporal izquierda en FLAIR (d) con realce nodular sólido asociado y sin necrosis (flecha en d), pero con CBV claramente elevado (círculo en f). g-i) FLAIR axial, T1w poscontraste y mapas de color de CBV de DSC-PWI. Lesión infiltrante temporal izquierda en FLAIR focal (g) con realce mínimo y ausencia de necrosis (flecha en h), pero con CBV claramente elevado (círculo en i).
CBV: volumen sanguíneo cerebral; DSC-PWI: imagen de perfusión dinámica; IDH: gen isocitrato deshidrogenasa.
En ciertos casos, el glioblastoma puede manifestarse sin necrosis clara y presentar predominantemente un patrón infiltrante. Estos tumores se caracterizan por mayores componentes no (o escasamente) captantes y mal definidos13. En estos tumores sin realce y no necróticos, la presencia de una clara restricción de la difusión o un aumento del CBV son de especial interés, ya que respaldan notablemente el diagnóstico de glioblastoma23,52 (fig. 3). En resumen, ante una lesión expansiva-infiltrante en un adulto mayor de 55 años, el neurorradiólogo debe buscar minuciosamente manifestaciones de un grado histológico 4 que sugieran altamente el diagnóstico de glioblastoma. En concreto, necrosis en T1w poscontraste, hipercelularidad en DWI e hipervascularización en DSC-PWI.
Por otra parte, no se han determinado marcadores cualitativos robustos del estado de metilación del promotor MGMT en las imágenes. No obstante, según un estudio, el glioblastoma con metilación del promotor MGMT tiene más probabilidades de presentar menos edema, un mayor coeficiente de difusión aparente (ADC) y un menor CBV que el glioblastoma sin metilación53.
Glioblastoma molecularLas manifestaciones radiológicas típicas del glioblastoma pueden no ser aplicables en aquellos casos que no están definidos histológicamente sino solo desde el punto de vista molecular (TERT, EGFR, 7+/10-), para los que las imágenes siguen siendo relativamente desconocidas. Pueden presentarse como lesiones infiltrantes mal definidas en las secuencias T2w y FLAIR, con realce mínimo o nulo, sin necrosis y sin hallazgos patológicos en DWI y DSC-PWI. De hecho, pueden observarse con un aspecto histológico clásico de grado 2-3. Sin embargo, según algunos estudios, hay una tendencia a la multifocalidad y multicentricidad, así como un patrón giriforme de infiltración cortical en los tumores con mutaciones en EGFR o TERT54–56. Desde un punto de vista práctico, la presencia de un patrón de gliomatosis cerebral (con posibleas areas de infiltración cortical giriforme) en un adulto mayor de 55 años puede hacer sospechar la presencia de un glioblastoma molecular, en particular con mutación en TERT54–56 (fig. 4). No se han encontrado descripciones cualitativas de imágenes para los casos con ganancia del cromosoma 7 y pérdida del 10.
Posible presentación de glioblastoma IDH-wildtype con alteración molecular de TERT o EGFR. Dos pacientes, uno de 80 años (a-c) y otro de 55 años (d-f). En secuencias FLAIR axiales (a-b y d-e), hiperintensidades infiltrantes difusas y extensas que recuerdan un patrón de gliomatosis cerebral en glioblastomas con mutación del promotor TERT. Las imágenes T1w poscontraste (c y f) no muestran realce ni signos de necrosis.
EGFR: receptor del factor de crecimiento epidérmico; IDH: gen isocitrato deshidrogenasa;
TERT: transcriptasa inversa de la telomerasa.
Estos tumores, no incluidos como una entidad diferenciada en la clasificación de la OMS, son las principales de la categoría NEC y han sido objeto de debate. Son gliomas astrocíticos difusos sin mutaciones en IDH ni en H3, carentes de marcadores histológicos y moleculares de grado 4. Estas entidades, en cierto modo enigmáticas, han atraído gran atención en los debates académicos más recientes. En teoría, estos tumores deberían ser excepcionales y es necesario descartar cualquier posible sesgo en su caracterización. Por ejemplo, podría haber un sesgo de biopsia: los gliomas son heterogéneos y pueden coexistir diferentes grados histológicos, por lo que una muestra focal de una biopsia podría no reflejar el grado histológico máximo dentro de un tumor que, de hecho, podría estar infraestimado. Hipotéticamente, este sesgo puede evitarse con las imágenes: en un principio, estas deberían servir de guía para realizar la biopsia; y posteriormente, permitirían detectar necrosis o una vascularización elevada clara que podría haber pasado por alto en el tejido biopsiado, ambas manifestaciones radiológicas sugerirían un grado 431. Aunque esto no se indica explícitamente en la clasificación 2021 de la OMS, los posibles sesgos de biopsia no son excepcionales en las Unidades de Neurooncología. Por lo tanto, los radiólogos deben ser conscientes de esta posibilidad y comprender su papel crucial para evitarlos.
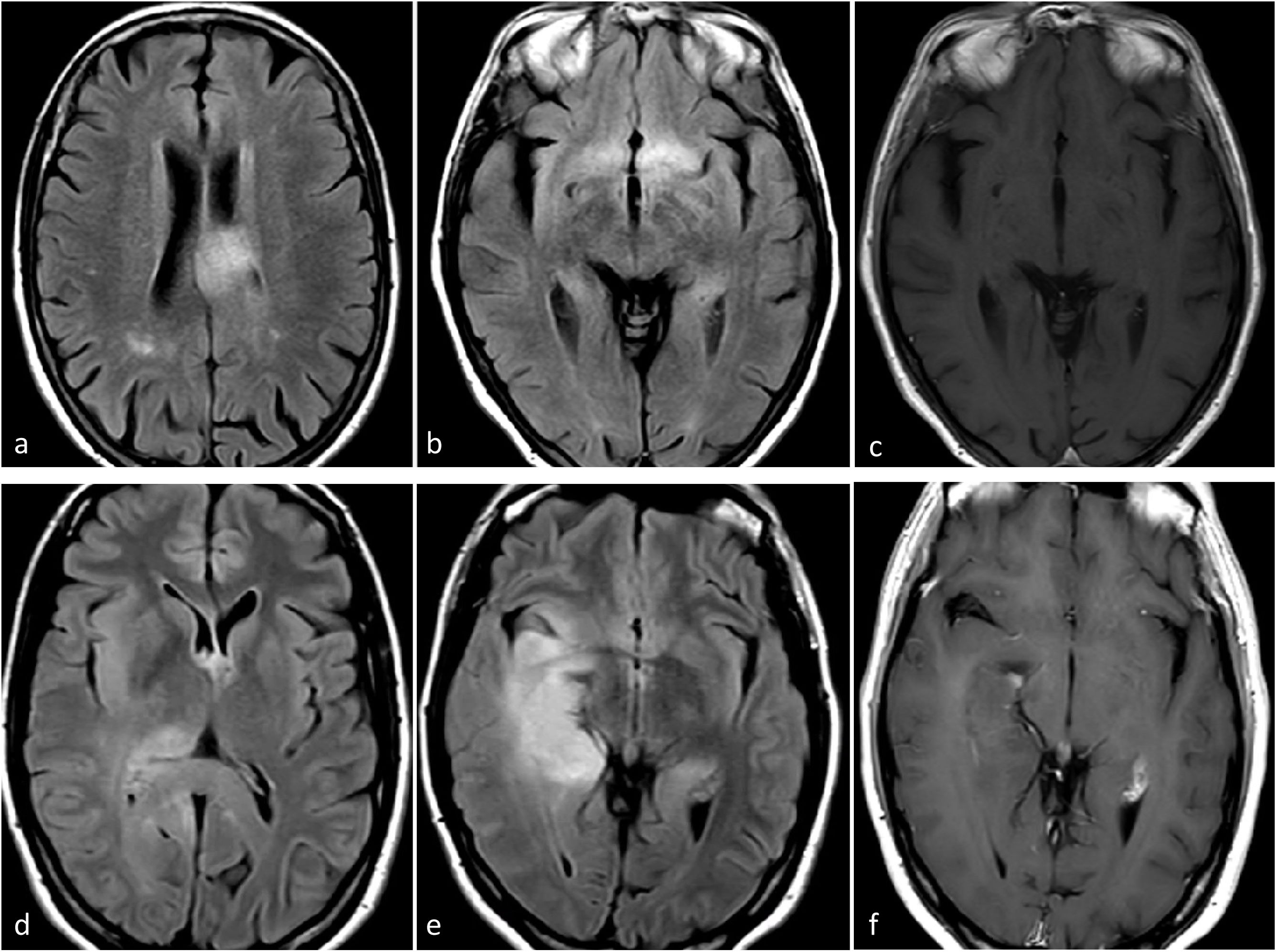
Según los supuestos de publicaciones anteriores a la 5.a edición, estos tumores podrían presentarse en las imágenes como lesiones infiltrantes mal definidas, con realce mínimo o nulo, sin necrosis y sin hallazgos patológicos en DWI o DSC-PWI. Pueden exhibir márgenes más mal definidos y posible propensión a una localización temporal, así como ausencia de mismatch T2/FLAIR en comparación con los mismos grados, pero IDH-mutados57 (fig. 5). Desde la perspectiva del abordaje radiológico, los autores recomiendan tener en cuenta el papel de la radiolgía en los siguientes aspectos: 1) guiar las biopsias para localizar las regiones de los tumores con mayor grado y 2) analizar atentamente las imágenes para identificar marcadores de grado histológico 4 que puedan no haber sido captados en la biopsia. Estas prácticas deberían minimizar los posibles sesgos de biopsia y la infraestimación del grado del tumor31.
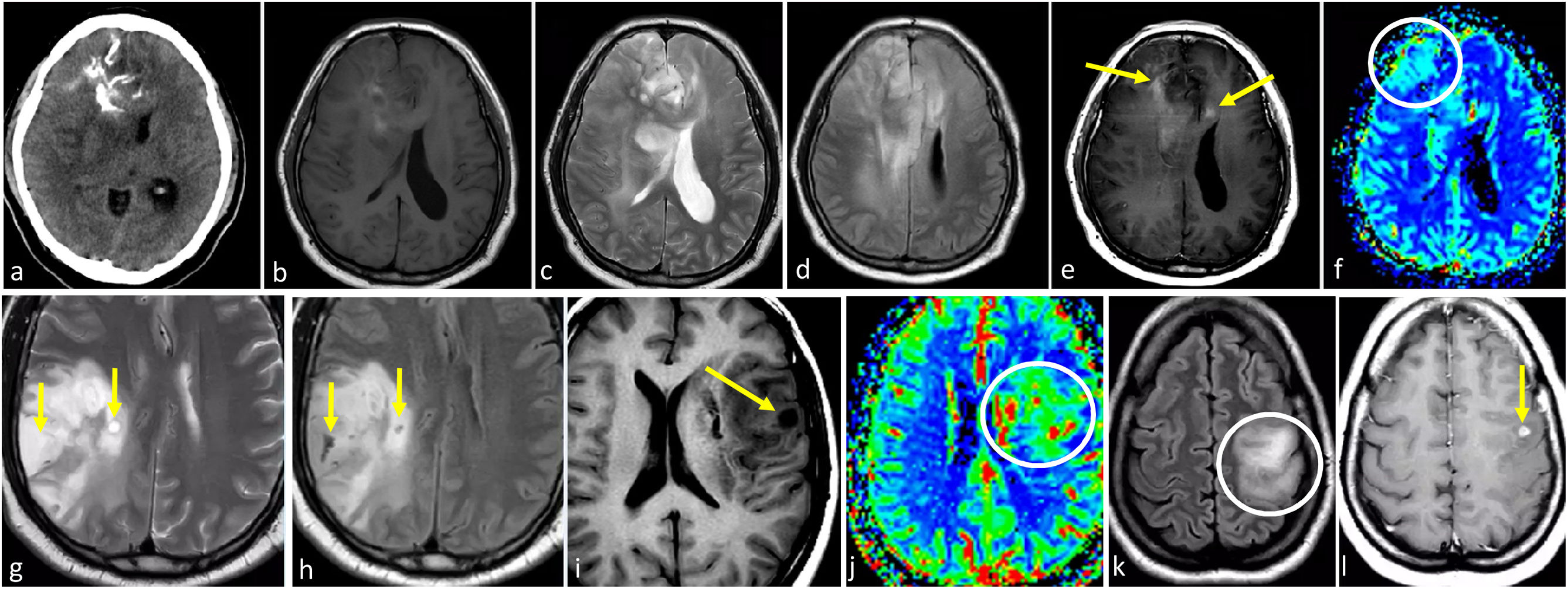
Dos casos de ejemplo en los que los resultados de la biopsia podrían corresponder a un grado histológico 2-3 para un tumor que en realidad sería de grado 4. a-c) Paciente de 57 años. FLAIR axial (a), T1w poscontraste (b) y mapas de color de CBV derivados de DSC-PWI (c). Extensa lesión infiltrante temporal medial izquierda hiperintensa en FLAIR (a), sin realce ni necrosis (b), y un sutil foco nodular de CBV claramente elevado (círculo en c). Es decir, con una biopsia que no captara los focos de CBV elevado se correría el riesgo de subestimar el grado este tumor astrocítico IDH-wildtype como grado 2-3 (NEC) en el estudio anatomopatológico. d-f) Paciente de 58 años. FLAIR axial (d), T1w poscontraste (e) y mapas de color de CBV derivados de DSC-PWI (f). Extensa lesión infiltrante temporal medial izquierda hiperintensa en FLAIR en (d), con un área más focal de realce prominente y necrosis (flecha en e), así como CBV elevado (círculo en f). Es decir, con una biopsia que no captara la necrosis o el componente de CBV elevado se correría el riesgo de subestimar el grado este tumor astrocítico IDH-wildtype como grado 2-3 (NEC) en el estudio anatomopatológico. Se trató a ambos pacientes como glioblastomas IDH-wildtype según la decisión consensuada de un comité de neurooncología.
CBV: volumen sanguíneo cerebral; DSC-PWI: imagen de perfusión dinámica; IDH: gen isocitrato deshidrogenasa; NEC: not elsewhere classified.
El astrocitoma IDH-mutado no presenta codelección 1p/19q y se asocia frecuentemente con la pérdida de ATRX y mutación en TP5358. En general, aparecen sobre todo en pacientes menores de 55 años13,17,19,29: de grado 2-3 entre los 30-40 años y de grado 4 en aquellos ligeramente mayores59. Tienen predilección por los lóbulos frontales57,60 y los síntomas rara vez se presentan de forma abrupta a menos que se manifiesten con convulsiones60. Los componentes focales oligodendrogliales son posibles y eran motivo de clasificaciones erróneas antes del establecimiento de los criterios moleculares9,10. En los últimos años, se ha debatido sobre el valor pronóstico de la categorización en grados en el caso de los astrocitomas IDH-mutados de grado 2-3, y varias publicaciones científicas analizan estos grados de forma colectiva18,59,61,62.
Según la última clasificación de la OMS13, la mediana de supervivencia global es mayor de cinco y de 10 años, respectivamente. Por el contrario, los astrocitomas IDH-mutados grado 4 muestran tasas de supervivencia más cortas (de alrededor de tres años13); sin embargo, son superiores que en los tumores IDH-wildtype, a pesar de compartir características histológicas63. Los de grado 4 molecular vienen determinados por la delección homocigota de CDKN2A o CDKN2B, en ausencia de necrosis y proliferación microvascular13,17. Por último, y en contra de la creencia clásica, según trabajos recientes, la mayoría de los astrocitomas IDH-mutados de grado 4 se producen de novo y no como evolución de un glioma de menor grado subyacente13,64.
Imágenes.
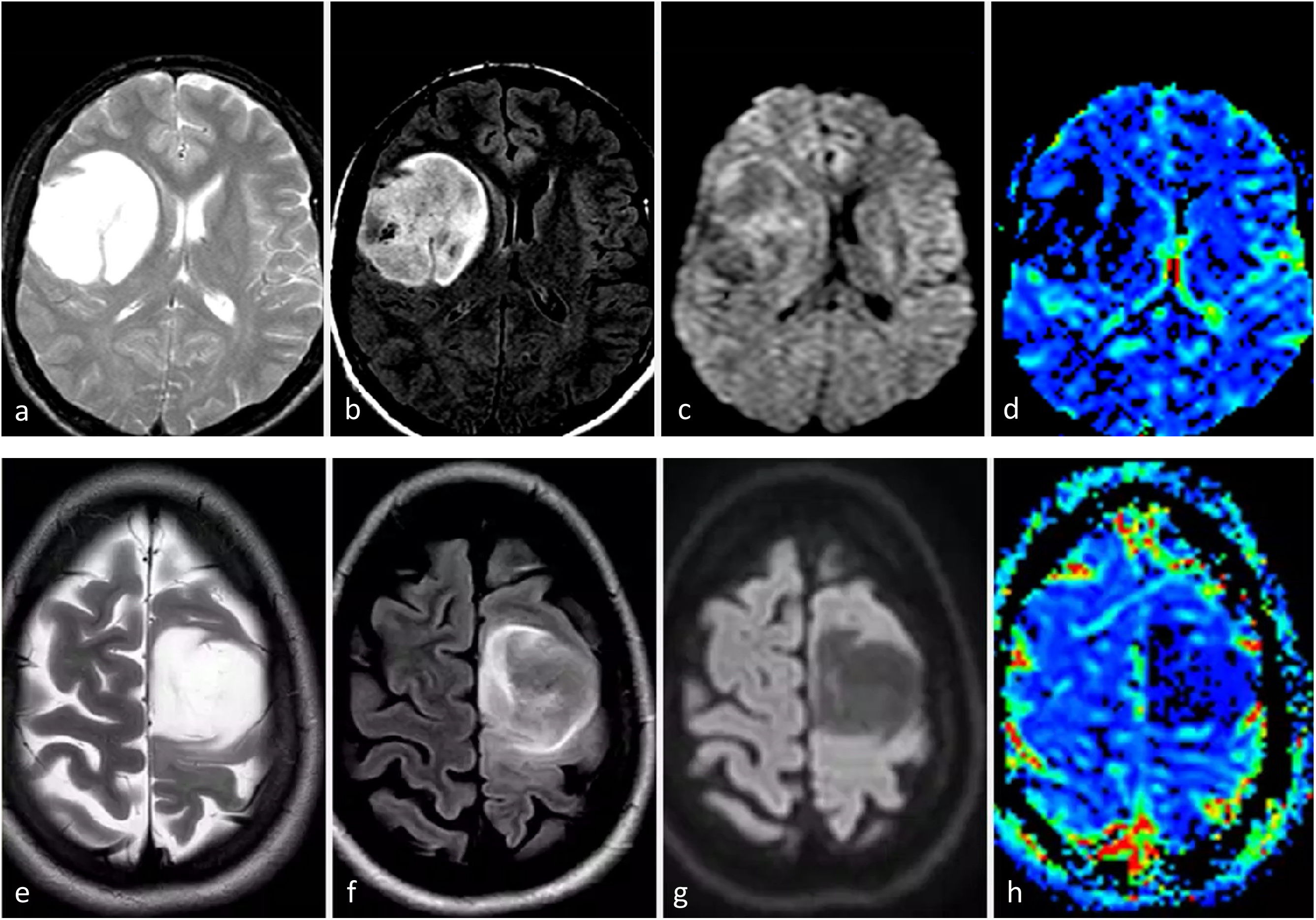
Astrocitoma IDH-mutado grado 2-3Estos dos grados histológicos suelen tratarse juntos debido a sus comportamientos similares18,59,61,62. La presentación más frecuente en las imágenes es una lesión infiltrante, sin o con escaso realce, con márgenes bien definidos y morfología nodular/ovalada. A pesar de una sensibilidad relativamente baja, el signo de mismatch T2-FLAIR muestra una especificidad casi perfecta en adultos (cuando representa, como mínimo, más de 25-50% de la extensión del tumor). El efecto de masa es más o menos escaso, así como el edema perilesional. No deben presentar indicios de necrosis en las imágenes4,23–27,38. En la DWI, la difusión puede variar entre facilitada y homogénea en el grado 2 y ligeramente heterogénea en el 3. No deben observarse elevaciones francas del CBV con la DSC-PWI34–36 (fig. 6). La ausencia de calcificación y de quistes, así como la morfología nodular/ovalada en lugar de un patrón giriforme siguiendo la corteza pueden ayudar en el diagnóstico diferencial con los oligodendrogliomas4,23–27.
Dos pacientes diferentes con características de imagen típicas de astrocitoma IDH-mutado grado 2-3. Sujetos de 31 (a-d) y 34 (e-h) años. Axial T2w (a y e), FLAIR (b y f), DWI (c y g) y mapas de color de CBV derivados de DSC-PWI (d y h). Masas redondeadas, bien definidas e hiperintensas en T2w con la correspondiente hipointensidad en FLAIR, con un fino borde periférico de hiperintensidad: signo de mismatch T2/FLAIR. Sin restricción significativa de la difusión en DWI y CBV bajo en los mapas de color de CBV.
CBV: volumen sanguíneo cerebral; DSC-PWI: imagen de perfusión dinámica; DWI: imagen potenciada en difusión; IDH: gen isocitrato deshidrogenasa.
En resumen, el neurorradiólogo debe tener en cuenta esta entidad cuando se encuentre con un adulto joven con un tumor en el lóbulo frontal de aspecto nodular u ovalado, bordes bien definidos, ausencia de necrosis, realce de contraste mínimo o nulo, así como DWI y DSC-PWI sin hallazgos patológicos. Si se observa un mismatch T2-FLAIR, la probabilidad de este diagnóstico es muy elevada; y en caso de resultados inmunohistoquímicos negativos, desde la perspectiva del radiólogo debe considerarse la secuenciación de ADN para una evaluación adicional de las mutaciones no canónicas de IDH.
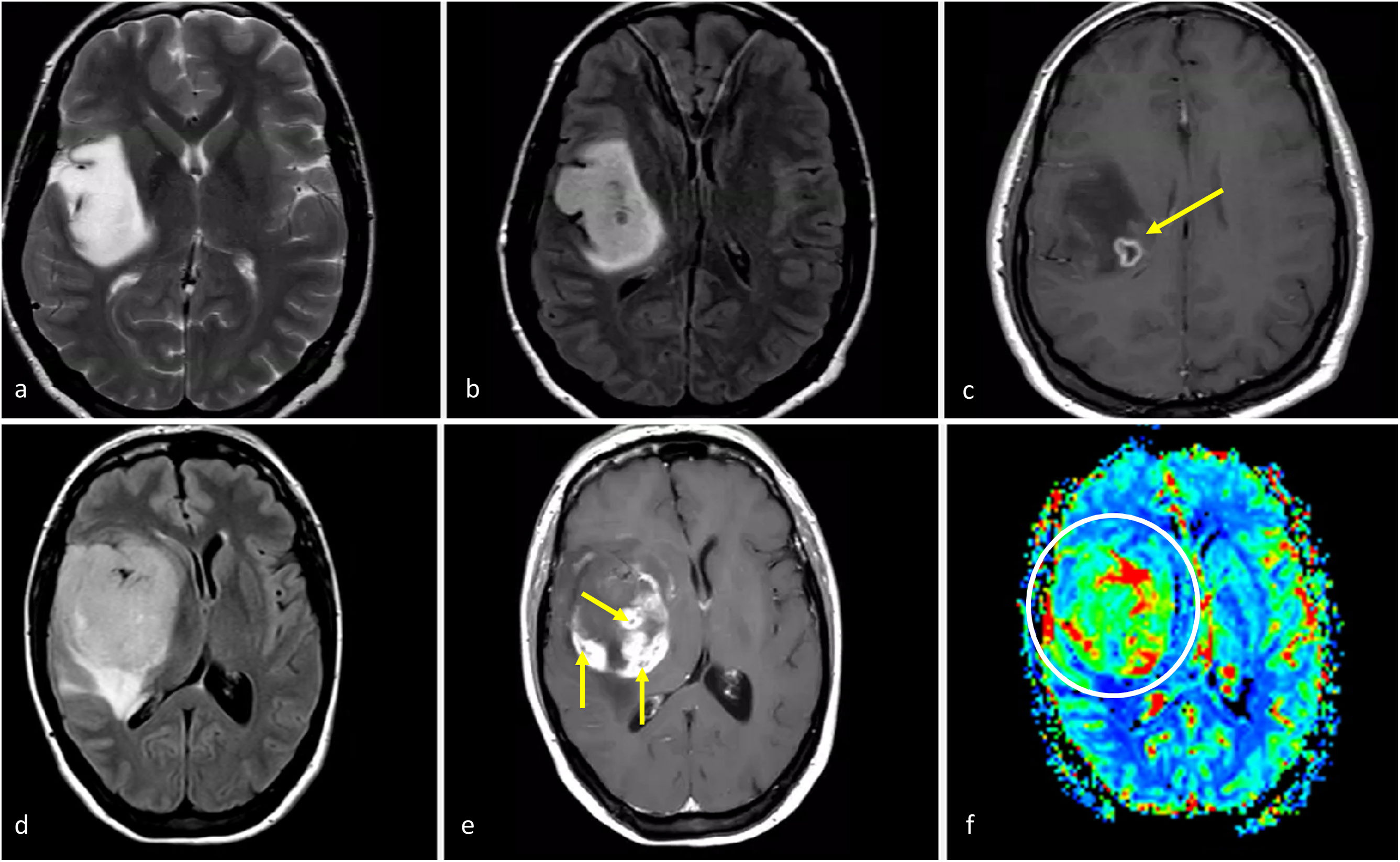
Astrocitoma IDH-mutado grado 4Este subgrupo de astrocitomas con mutación de IDH ha sido menos estudiado en comparación con los grados 2-3, por lo que sigue suponiendo un gran desafío radiológico. Lamentablemente, estos tumores a menudo se agrupan (y, en consecuencia, están infrarrepresentados) con los de grados 2-3 dentro de la categoría más amplia de astrocitomas IDH-mutados. Sin embargo, esta agrupación generalizada puede ser contraproducente porque: 1) las diferencias entre los tumores IDH-mutados grados 2-3 y 4 son vitales para el manejo de los pacientes; y 2) la aplicación de estos indicadores de imagen en los grados 2-3 y 4 puede no arrojar resultados precisos para este último, que comparte características de imagen con los glioblastomas (del mismo grado histológico). De hecho, según las hipótesis, las imágenes de los astrocitomas IDH-mutados grado 4 se encuentran entre las de aquellos de grado 2-3 (con los que comparten la mutación IDH) y la de los glioblastomas sin mutaciones IDH (con los que comparten el grado histológico). Por lo tanto, según el grado histológico, este tumor debería presentar necrosis, restricción de la difusión y CBV elevado con frecuencia; no obstante, debido a la presencia de mutacion IDH debería manifestarse en pacientes menores de 55 años, estar bien definido y con una morfología nodular/ovalada. Además, recientemente se ha descrito la presencia de mismatch T2-FLAIR como específico también para el astrocitoma IDH-mutado grado 4. Si sumamos esto a los conocimientos previos, cabe pensar que un tumor con un mismatch T2/FLAIR que presenta focos de necrosis, realce prominente, restricción de la difusión o CBV elevado debería ser muy probablemente un astrocitoma IDH-mutado grado 465,66 (fig. 7).
Características de imagen en dos pacientes con astrocitoma IDH-mutado grado 4. a-c) Paciente de 37 años. Axial T2w, FLAIR y T1w poscontraste. Extensa lesión bien definida hiperintensa en T2w (a) con la correspondiente hipointensidad en FLAIR y delgado borde hiperintenso periférico en (b), consistente con el signo de mismatch T2/FLAIR que sugiere mutación en IDH. Se observa un pequño foco de realce y necrosis dentro del margen profundo del tumor (c), lo que sugiere un grado 4. Obsérvese también que, en este caso, una biopsia que no captara la necrosis podría subestimar el grado del tumor y considerarlo de grado 2-3. La detección de características de imagen de grado 4 dentro de un tumor con mismatch T2/FLAIR parece ser una manifestación específica de astrocitoma IDH-mutado grado 4. d-f) Paciente de 49 años. FLAIR axial (d), T1w poscontraste (e), y mapa de color de CBV derivado de DSC-PWI (f). Masa tumoral bien definida y redondeada en FLAIR (d) con áreas internas de realce sólido (e) dentro del tumor no captante. Pequeños focos de necrosis (flechas en e) y CBV claramente elevado (círculo en f). Cabe destacar que existía una necrosis más extensa en otras partes del tumor que no aparecen en esta figura. Un glioma con aspecto de grado 4 en un paciente menor de 55 años con algunas características atípicas para un glioblastoma, como una morfología redondeada clara y márgenes bien definidos, podría sugerir un astrocitoma IDH-mutado grado 4
CBV: volumen sanguíneo cerebral; DSC-PWI: imagen de perfusión dinámica; IDH: gen isocitrato deshidrogenasa.
En cuanto a los astrocitomas IDH-mutados de grado 4 molecular (delección homocigota CDKN2A/B), hasta donde saben los autores, no se han descrito características en las imágenes que permitan su detección prequirúrgica2,25.
Oligodendroglioma IDH-mutado y 1p/19q-codeleccionadoEstos tumores son infrecuentes en pacientes mayores de 55 años13,17,19,29. Aproximadamente dos tercios de los sujetos presentan crisis como síntoma inicial13,67. Faltan datos de supervivencia sobre los oligodendrogliomas definidos genéticamente (solo disponibles desde la clasificación de la OMS 2016), ya que en los registros anteriores la interpretación está dificultada por la inclusión de gliomas sin mutación IDH o codelección 1p/19q. Sin embargo, en general, se asocian a una respuesta favorable al tratamiento y posiblemente a la mayor mediana de supervivencia, superior a los 10 años68,69. También existe una tendencia en la literatura radiológica a tratar los grados 2-3 juntos.
ImágenesEstos tumores suelen mostrar predilección por los lóbulos frontales. Se manifiestan como lesiones centradas en la corteza y la sustancia blanca subcortical. Su epicentro cortical es característico y a menudo está marcado por un signo típico de «cortex continuo». Este término se refiere a la afectación de la corteza en más de 50% de la extensión del tumor. Con frecuencia se observan calcificaciones (que se detectan mejor con tomografía axial computarizada [TAC]) y quistes; y ambos pueden ser distintivos. Es posible la hemorragia. Estas tres características son infrecuentes en los astrocitomas IDH-mutados. Además, suelen presentar una heterogeneidad prominente en las imágenes en T1w y T2w, con márgenes tumorales mal definidos. En la mayoría de los casos no poseen realce, pero algunos sí lo hacen, posiblemente con mayor frecuencia en el grado 3. Su morfología suele seguir un patrón giriforme a lo largo de la corteza, en lugar del aspecto nodular/redondeado de los astrocitomas con mutación en IDH4,23–27. Además, los oligodendrogliomas muestran patrones más heterogéneos en DWI y DSC-PWI; posiblemente exhiban áreas de CBV más alto y restricción de la difusión34–36 y la gradación basada en imágenes no es fiable24,37 (fig. 8).
Oligodendrogliomas IDH-mutados 1p/19q codeleccionados grado 2-3. a-f) Paciente de 53 años. TAC axial sin contraste (a), T1w (b), T2w (c), FLAIR (d), T1w poscontraste (e) y mapa de color de CBV (f). Masa bifrontal difusa mal definida con extensa infiltración cortical (c y d) y señal heterogénea en T1w y T2w (b y c). Calcificaciones prominentes en TAC (a). Realce irregular muy sutil (flechas en e) y áreas de CBV elevado (círculo en f). g-h) Paciente de 52 años. Axial T2w (g) y FLAIR (h). Masa parietal infiltrante mal definida con señal heterogénea y extensa infiltración cortical (g-h). Presencia de pequeñas áreas intratumorales sin realce con intensidad de señal sugestiva de líquido, compatibles con focos quísticos (flechas en g y h). i-j) Paciente de 38 años. T1w axial (i) y mapa de color de CBV (j). Ejemplo de un pequeño quiste intratumoral en T1w (flecha en i) y CBV claramente elevado (j). k-l) Paciente de 35 años. FLAIR axial (k) y T1w post-contraste (l). Masa infiltrante mal definida e hiperintensa en FLAIR claramente centrada en la corteza y siguiendo su morfología giriforme: signo de cortex continuo (círculo en k). Pequeños focos asociados de realce sólido (flecha en l). Obsérvese también la ausencia del signo de mismatch T2/FLAIR en c-d y g-h.
CBV: volumen sanguíneo cerebral; IDH: gen isocitrato deshidrogenasa; TAC: tomografía axial computarizada.
En resumen, los radiólogos deben sospechar la existencia de un oligodendroglioma en adultos jóvenes que presenten una masa cercana a la región frontal con heterogeneidad en T1w y calcificaciones o quistes en T2w, bordes mal definidos, morfología giriforme y signo de cortex continuo. También deben ser conscientes de la posible heterogeneidad en DWI y DSC-PWI.
Algunos autores postulan que debería considerarse la realización de un análisis molecular adicional en el caso de los gliomas IDH-mutados con resultados discordantes en las pruebas de neuroimagen y la FISH para codelección 1p/19q. Por ejemplo, si las imágenes son indicativas de un oligodendroglioma y los resultados de la FISH son negativos para la codelección, otras técnicas, como el análisis de «microarrays» cromosómicos, pueden servir para decantar el diagnóstico en un sentido u otro70.
Por último, se observa ocasionalmente diseminación leptomeníngea en pacientes con oligodendroglioma, sobre todo en caso de recidiva71.
Glioma difuso de la línea media H3K27M-alterado y glioma hemisférico difuso H3 G34-mutadoEstos gliomas de tipo pediátrico, que carecen de mutaciones en IDH, pueden presentarse a veces en adultos jóvenes. En consecuencia, en este grupo de edad, sin mutaciones IDH en las pruebas inmunohistoquímicas y la secuenciación del ADN, los radiólogos deben estar atentos. Deben informar rápidamente a los otros médicos cuando un tumor se localiza en la línea media, ya que resulta crucial descartar un glioma difuso de la línea media con alteración de H3K27M antes de clasificarlo como glioblastoma. Además, en casos de tumores hemisféricos en el mismo subgrupo de pacientes, también es importante considerar los gliomas hemisféricos difusos con mutación H3.3G34R/V, tal como se recomienda en la clasificación más reciente13,15.
Según la experiencia de los autores, los gliomas difusos de la línea media con alteración de H3K27M en adultos pueden manifestarse como gliomas clásicos del tronco encefálico, a veces con ciertas características atípicas, que sirven como señales de alarma como, por ejemplo, un realce claro y anomalías en DWI o DSC-PWI. De forma alternativa, estos tumores pueden presentarse en el tronco encefálico o en otras estructuras de la línea media (tálamo) con características claramente agresivas, como realce heterogéneo ávido, restricción de la difusión, CBV elevado, necrosis y hemorragia (fig. 9). Se ha descrito que esta última presentación es más frecuente cuando se han extendido fuera de la línea media estricta72.
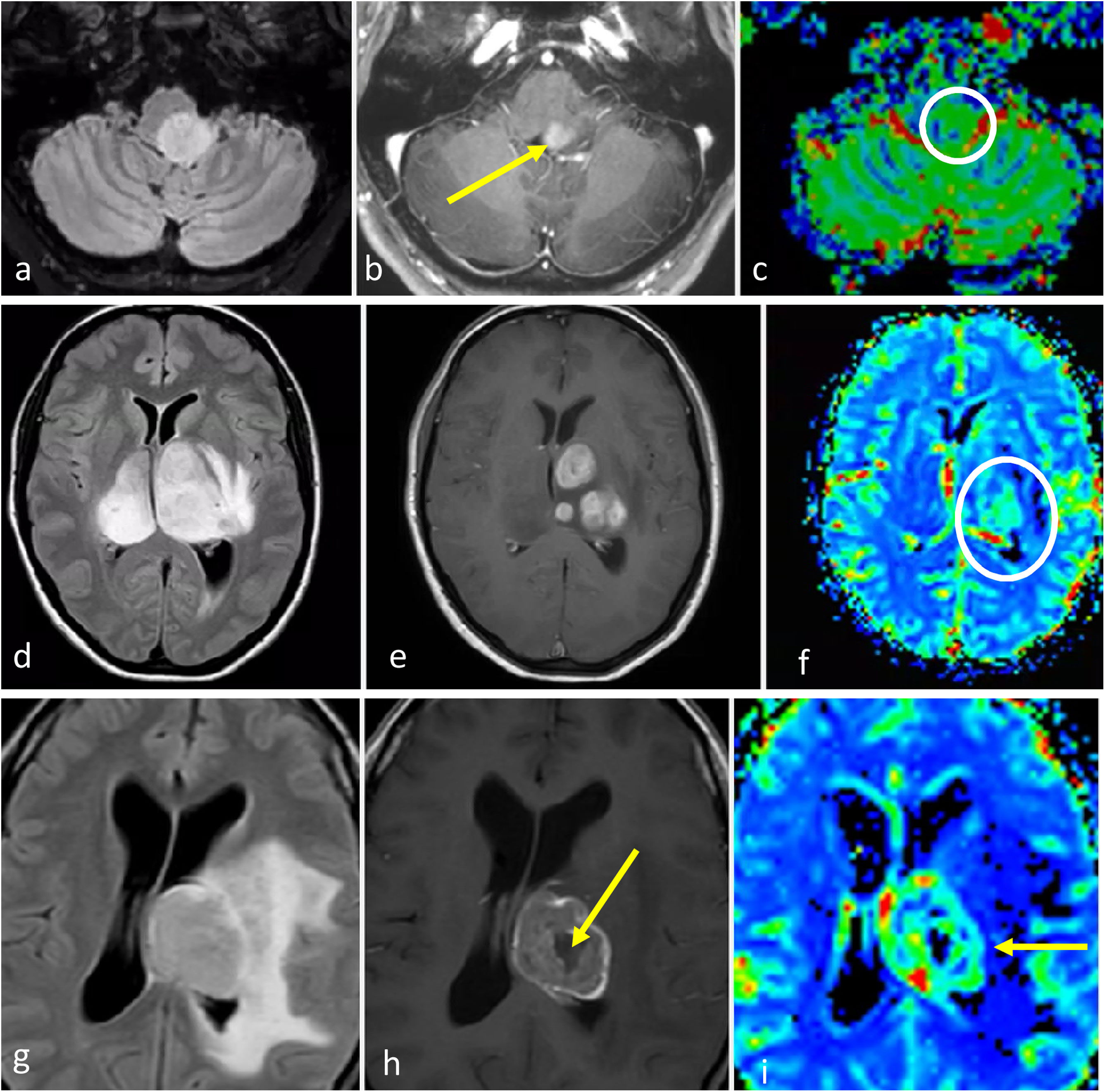
Gliomas difusos de línea media H3K27M-alterados. a-c) Paciente de 52 años. FLAIR axial (a), T1w poscontraste (b) y mapa de color de CBV (c). Glioma troncoencefálico, ligeramente paramediano, nodular y bien definido en FLAIR (a), con focos de realce (flecha en b) y CBV ligeramente elevado (círculo en c). d-f) Paciente de 48 años. FLAIR axial (d), T1w poscontraste (e) y mapa de color de CBV (f). Masa infiltrante bitalámica hiperintensa en FLAIR (d) con realces nodulares sólidos multifocales (e) y CBV elevado. g-i) Paciente de 33 años. FLAIR axial (g), T1w poscontraste (h) y mapa de color de CBV (i). Masa talámica hiperintensa en FLAIR con edema extenso (g), realce irregular en anillo grueso con necrosis central (flecha en h) y CBV elevado en la periferia (flecha en i).
CBV: volumen sanguíneo cerebral.
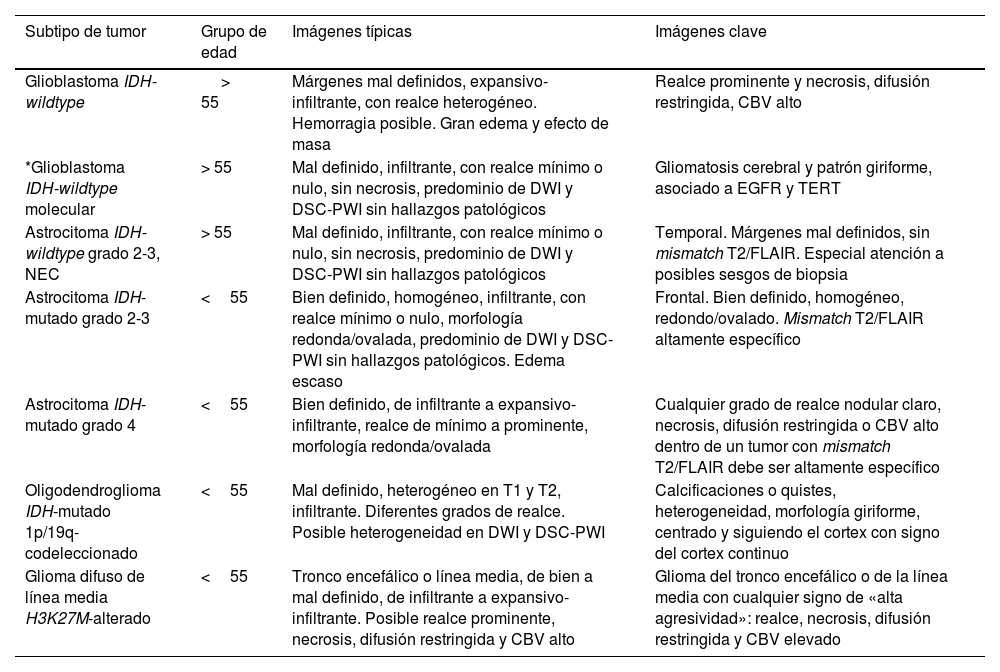
Las descripciones de las imágenes y las características clave de todos los tumores documentados pueden consultarse en la tabla 2.
Resumen de las características de imagen de los gliomas difusos en adultos
| Subtipo de tumor | Grupo de edad | Imágenes típicas | Imágenes clave |
|---|---|---|---|
| Glioblastoma IDH-wildtype | > 55 | Márgenes mal definidos, expansivo-infiltrante, con realce heterogéneo. Hemorragia posible. Gran edema y efecto de masa | Realce prominente y necrosis, difusión restringida, CBV alto |
| *Glioblastoma IDH-wildtype molecular | > 55 | Mal definido, infiltrante, con realce mínimo o nulo, sin necrosis, predominio de DWI y DSC-PWI sin hallazgos patológicos | Gliomatosis cerebral y patrón giriforme, asociado a EGFR y TERT |
| Astrocitoma IDH-wildtype grado 2-3, NEC | > 55 | Mal definido, infiltrante, con realce mínimo o nulo, sin necrosis, predominio de DWI y DSC-PWI sin hallazgos patológicos | Temporal. Márgenes mal definidos, sin mismatch T2/FLAIR. Especial atención a posibles sesgos de biopsia |
| Astrocitoma IDH-mutado grado 2-3 | <55 | Bien definido, homogéneo, infiltrante, con realce mínimo o nulo, morfología redonda/ovalada, predominio de DWI y DSC-PWI sin hallazgos patológicos. Edema escaso | Frontal. Bien definido, homogéneo, redondo/ovalado. Mismatch T2/FLAIR altamente específico |
| Astrocitoma IDH-mutado grado 4 | <55 | Bien definido, de infiltrante a expansivo-infiltrante, realce de mínimo a prominente, morfología redonda/ovalada | Cualquier grado de realce nodular claro, necrosis, difusión restringida o CBV alto dentro de un tumor con mismatch T2/FLAIR debe ser altamente específico |
| Oligodendroglioma IDH-mutado 1p/19q-codeleccionado | <55 | Mal definido, heterogéneo en T1 y T2, infiltrante. Diferentes grados de realce. Posible heterogeneidad en DWI y DSC-PWI | Calcificaciones o quistes, heterogeneidad, morfología giriforme, centrado y siguiendo el cortex con signo del cortex continuo |
| Glioma difuso de línea media H3K27M-alterado | <55 | Tronco encefálico o línea media, de bien a mal definido, de infiltrante a expansivo-infiltrante. Posible realce prominente, necrosis, difusión restringida y CBV alto | Glioma del tronco encefálico o de la línea media con cualquier signo de «alta agresividad»: realce, necrosis, difusión restringida y CBV elevado |
*No se trata de una categoría específica de la Organización Mundial de la Salud, sino de un subgrupo dentro de los glioblastomas IDH-wildtype que pueden manifestarse con patrones de imagen diferentes.
CBV: volumen sanguíneo cerebral; DSC-PWI: imagen de perfusión dinámica; DWI: imagen potenciada en difusión; EGFR; receptor del factor de crecimiento epidérmico; IDH: gen isocitrato deshidrogenasa; TERT; transcriptasa inversa de la telomerasa.
Un subconjunto de gliomas se manifiesta con lesiones múltiples, llamadas multifocales o multicéntricas. Los gliomas multifocales muestran vías de propagación contiguas entre los focos, mientras que los multicéntricos están claramente separados. Asimismo, la extensión intracerebral difusa puede denominarse gliomatosis cerebral. Este patrón puede observarse en los glioblastomas IDH-wildtype y en los oligodendrogliomas IDH-mutados y 1p/19q codeleccionados13,73.
Los términos gliomas primarios y secundarios deben utilizarse con cautela en el contexto radiológico, dados los conocimientos recientes. En la actualidad, se sabe que la mayoría de los astrocitomas IDH-mutados de grado 4 son de novo13,64 y que la presencia de componentes tumorales sin realce no indica necesariamente una menor agresividad subyacente74. Por lo tanto, los radiólogos deben clasificar un glioma como secundario solo cuando sea demostrable un tumor previo de grado inferior. En pocas palabras, los especialistas deben evitar etiquetar un glioma como secundario solo porque observen focos con aspecto de alto grado acompañados de áreas con apariencia de bajo grado, a menos que haya más pruebas que lo respalden.
Interés clínico de un diagnóstico prequirúrgico no invasivoComo radiólogos, podríamos encontrarnos con la pregunta: «¿cuál es la importancia de intentar detectar entidades específicas de forma no invasiva si el diagnóstico definitivo se basa en última instancia en la anatomía patologíca?» Esta perspectiva minimiza el papel del radiólogo y es falsa con base en la realidad que se vive en las Unidades de Neurooncología. Aunque a primera vista esta afirmación pueda parecer válida, pasa por alto el papel vital que desempeña en realidad este especialista a la hora de garantizar un diagnóstico definitivo de forma eficaz y segura.
Las pruebas de biología molecular de primera línea suelen incluir las de inmunohistoquímica y FISH debido a su amplia disponibilidad. Sin embargo, la secuenciación del ADN es el método preferible para detectar mutaciones de IDH no canónicas y otras alteraciones genéticas que intervienen en la clasificación. Lamentablemente, en muchos centros de todo el mundo, la secuenciación del ADN es cara o no está disponible. Esta falta de acceso subraya el papel fundamental del radiólogo para indicar los tests moleculares que deben aplicarse13,18–21,70.
La identificación precoz de subtipos moleculares específicos es cada vez más importante, puesto que permite seleccionar candidatos óptimos para tratamientos específicos o ensayos clínicos en los que se evalúan nuevas terapias dirigidas. En un estudio reciente, por ejemplo, se demostró la eficacia significativa de la terapia dirigida al IDH en el tratamiento de astrocitomas IDH-mutados75. Un diagnóstico por imagen no invasivo preciso, especialmente en determinadas localizaciones como el tronco encefálico, el cuerpo calloso o los ganglios basales, puede evitar intervenciones invasivas diagnósticas o terapéuticas. Es esencial identificar precozmente los tumores que pueden beneficiarse de un abordaje intensivo y rápido, y los que no. En última instancia, en situaciones excepcionales, podría iniciarse la terapia sin un diagnóstico definitivo, una opción contemplada en las directrices europeas15. Además, detectar y corregir posibles sesgos en las biopsias puede influir significativamente en las estrategias de tratamiento. Por ejemplo, si a un paciente se le diagnostica un tumor de grado 2-3, pero el radiólogo identifica claramente una necrosis que sugiere un grado 4, el abordaje terapéutico debe ser más intensivo que si asumimos que las características anatomopatológicas son siempre definitivas.
Es importante que los especialistas sean conscientes de estas situaciones y las informen en su práctica clínica31. Por último, las descripciones radiológicas, de los tumores, aunque a menudo están vinculadas a un diagnóstico prequirúrgico específico, engloban información pronóstica de interés. La presencia de un mismatch T2/FLAIR, por ejemplo, puede indicar un pronóstico más favorable, mientras que la de necrosis, realce, restricción de la difusión o CBV elevado suele implicar desenlaces menos positivos. Los radiólogos deben permanecer atentos a estos indicadores pronósticos, reconociendo que su importancia va más allá de la mera consecución de un diagnóstico prequirúrgico no invasivo preciso y alineado con los resultados anatomopatológicos finales23.
ConclusionesLos radiólogos deben comprender en profundidad la clasificación de la OMS, sus fortalezas y sus limitaciones, y reconocer cómo puede contribuir su especialidad a garantizar una atención óptima al paciente.
En este trabajo se ponen de relieve las áreas en las que es necesario seguir investigando para optimizar el papel de la radiología en la aplicación de la clasificación de la OMS y su potencial para mejorar el manejo de los pacientes.
Por último, los autores desean subrayar el papel fundamental de la radiología en la aplicación óptima de la clasificación de la OMS y manifiestan su confianza en que las futuras ediciones incorporen la radiología en mayor medida. No obstante, estos especialistas deben estar preparados para asumir tal responsabilidad.
Autoría- 1.
Responsable de la integridad del estudio: A. Pons-Escoda
- 2.
Concepción del estudio: A. Pons-Escoda
- 3.
Diseño del estudio: A. Pons-Escoda
- 4.
Obtención de los datos: A. Pons-Escoda
- 5.
Análisis e interpretación de los datos: A. Pons-Escoda
- 6.
Tratamiento estadístico: No procede
- 7.
Búsqueda bibliográfica: A. Pons-Escoda
- 8.
Redacción del trabajo: A. Pons-Escoda
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: A. Pons-Escoda, C. Majos M. Smits y L. Oleaga
- 10.
Aprobación de la versión final: A. Pons-Escoda, C. Majos M. Smits y L. Oleaga
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesM. Smits declares consultancy fees from Bracco and Speaker fees from GE Healthcare, AuntMinnie and Fondazione Internazionale Menarini (all paid to institution). A. Pons-Escoda, C. Majos and L. Oleaga confirm that they have no conflicts of interest to declare pertaining to this manuscript.
A. Pons-Escoda and C. Majos acknowledge support from the Instituto de Salud Carlos III (Proyectos de Investigación en Salud, PI20/00360).
A. Pons-Escoda and C. Majos thank CERCA Programme/Generalitat de Catalunya for institutional support.