El constante avance tecnológico de las técnicas de imagen basadas fundamentalmente en la tomografía computarizada y la resonancia magnética ha permitido, además de la clásica valoración morfológica de la patología pancreática, su evaluación cuantitativa funcional y molecular. Esta información basada en la imagen conlleva en muchos casos un sustancial cambio en el manejo de los pacientes y podría ser una herramienta fundamental en el desarrollo de biomarcadores. El objetivo de este artículo es revisar el papel de las técnicas emergentes funcionales y moleculares basadas en la tomografía computarizada y la resonancia magnética, para la valoración de la patología pancreática.
In addition to the classical morphological evaluation of pancreatic disease, the constant technological advances in imaging techniques based fundamentally on computed tomography and magnetic resonance imaging have enabled the quantitative functional and molecular evaluation of this organ. In many cases, this imaging-based information results in substantial changes to patient management and can be a fundamental tool for the development of biomarkers. The aim of this article is to review the role of emerging functional and molecular techniques based on computed tomography and magnetic resonance imaging in the evaluation of pancreatic disease.
La imagen radiológica ha evolucionado del ámbito anatómico a la posibilidad de evaluar las características funcionales y moleculares de los tejidos. El desarrollo de múltiples técnicas de imagen avanzadas basadas fundamentalmente en la tomografía computarizada (TC) y la resonancia magnética (RM) ha permitido un cambio en el abordaje de la patología pancreática. Estas técnicas ofrecen una mejor capacidad de detección y caracterización e influyen de modo determinante en las decisiones terapéuticas y en el manejo de los pacientes. Este artículo revisará sus aplicaciones clínicas y sus limitaciones en el momento actual.
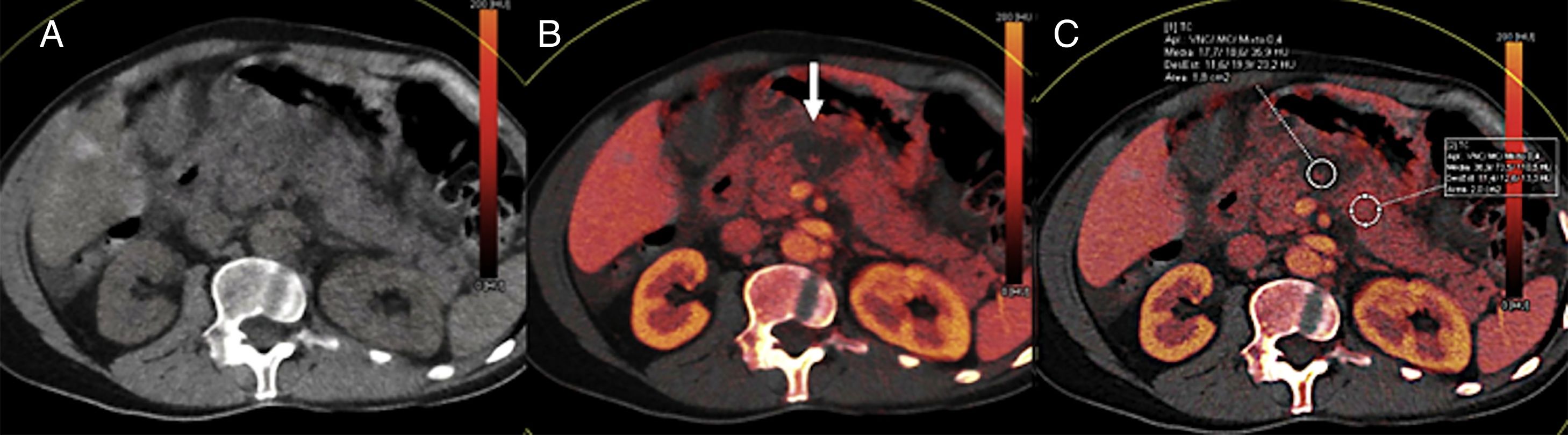
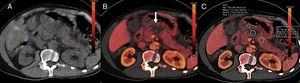
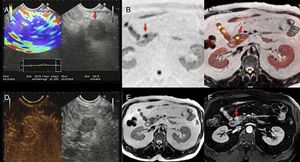
Técnicas Avanzadas De Tomografía ComputarizadaTomografía computarizada de energía dualLa tomografía computarizada de energía dual (TCED) consiste en la adquisición de imágenes con una combinación de distintos kilovoltajes (la más utilizada es 80kV y 140kV). Dado que la absorción de rayos X depende de la energía del haz y que la atenuación de los distintos elementos químicos es diferente a 80kV que a 140kV, esto permite clasificarlos basándose en el análisis de la diferencia de atenuación con cada espectro de energía. Además de ello, se puede sustraer el yodo de una TC realizada con contraste y obtener estudios denominados “sin contraste virtual” o generar “mapas de yodo”, y también realizar su cuantificación (fig. 1). La TCED permitiría mejorar la detección del adenocarcinoma de páncreas. Diferentes autores han demostrado que el uso de un bajo kilovoltaje (80kV) facilitaría la diferenciación entre tumor y tejido pancreático normal1,2. Por su parte, un estudio que comparaba TC multifásica y TCED mostró una mayor sensibilidad diagnóstica con el uso de la energía dual3. Asimismo, recientes trabajos han mostrado resultados prometedores en la diferenciación entre adenocarcinoma y masa inflamatoria secundaria a la pancreatitis crónica mediante energía dual4.
Varón de 56 años con pancreatitis aguda. Tomografía computarizada (TC) sin contraste (A), mapa de colores de la concentración de yodo (B) y mapa con región de interés (ROI) para la medición de la concentración de yodo (C). La TC de energía dual (TCED) muestra un área de necrosis a nivel del cuerpo pancreático, visualizado en el mapa de colores de concentración de yodo como un área sin captación de contraste yodado (flecha), pudiendo cuantificar el yodo mediante la colocación de una ROI en el parénquima glandular.
La TCED permite, además, realizar estudios pancreáticos con una menor dosis de radiación, al poder eliminar la fase sin contraste gracias a la “TC sin contraste virtual” y una reducción de la dosis de contraste yodado, dado su mayor contraste intrínseco debido a la utilización de bajos kilovoltajes5. En los pacientes con pancreatitis aguda, Wichmann et al. demostraron que una única fase portal con TCED sería suficiente para valorar el índice de gravedad, por lo que es posible suprimir la fase sin contraste y la arterial, limitando la dosis de radiación6.
Otro nuevo campo de investigación es la colangiografía virtual, pero existen pocas publicaciones que hayan valorado el uso de la TCED en la determinación de la composición de las litiasis biliares7.
Perfusión por tomografía computarizadaLa perfusión por TC (pTC) es una técnica funcional que permite el estudio de las características de la vascularización de un órgano. Dicha técnica está basada en la monitorización del paso de contraste a través del lecho vascular, existiendo una relación lineal entre la concentración de contraste y la atenuación. Para ello, se adquieren cortes rápidos seriados sobre una misma zona tras la administración de contraste endovenoso a flujo alto, lo que permite la obtención de información temporal del paso del contraste a través de la red capilar. Dependiendo del modelo matemático usado es posible calcular mapas cuantitativos de distintos parámetros, incluyendo el flujo sanguíneo (FS), el volumen sanguíneo (VS), el tiempo de tránsito medio (TTM) o el coeficiente de transferencia (Ktrans), para el estudio funcional de la vascularización tisular8.
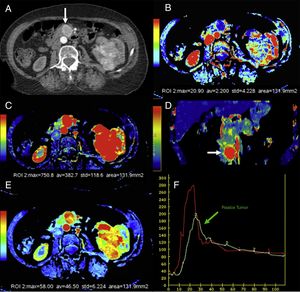
La pTC se ha sido utilizado en el páncreas fundamentalmente en la valoración de los tumores y de la patología inflamatoria. En el campo de la oncología, la pTC estudia de un modo no invasivo el fenómeno de la angiogénesis tumoral9. Los tumores presentarían, en general, un aumento de su vascularización y una permeabilidad alterada (fig. 2). En el caso del adenocarcinoma pancreático, debemos considerar la extensa reacción desmoplásica asociada al mismo que explicaría su menor perfusión en relación con el parénquima pancreático. La pTC ha mostrado utilidad a la hora del diagnóstico, la estadificación y el establecimiento del pronóstico de los pacientes con tumores neuroendocrinos (TNE) al correlacionarse con su grado de agresividad. Estos tumores muestran un aumento de los parámetros del VS y del FS comparado con el páncreas normal10–12. Zhu et al. confirmaron que cuando se combina la pTC con técnicas convencionales aumenta la capacidad de diagnóstico de los insulinomas13. Por otra parte, el grado de diferenciación tumoral de los adenocarcinomas parece correlacionarse con el VS. Así, los adenocarcinomas de alto grado mostraban menor VS y un menor pico de realce14.
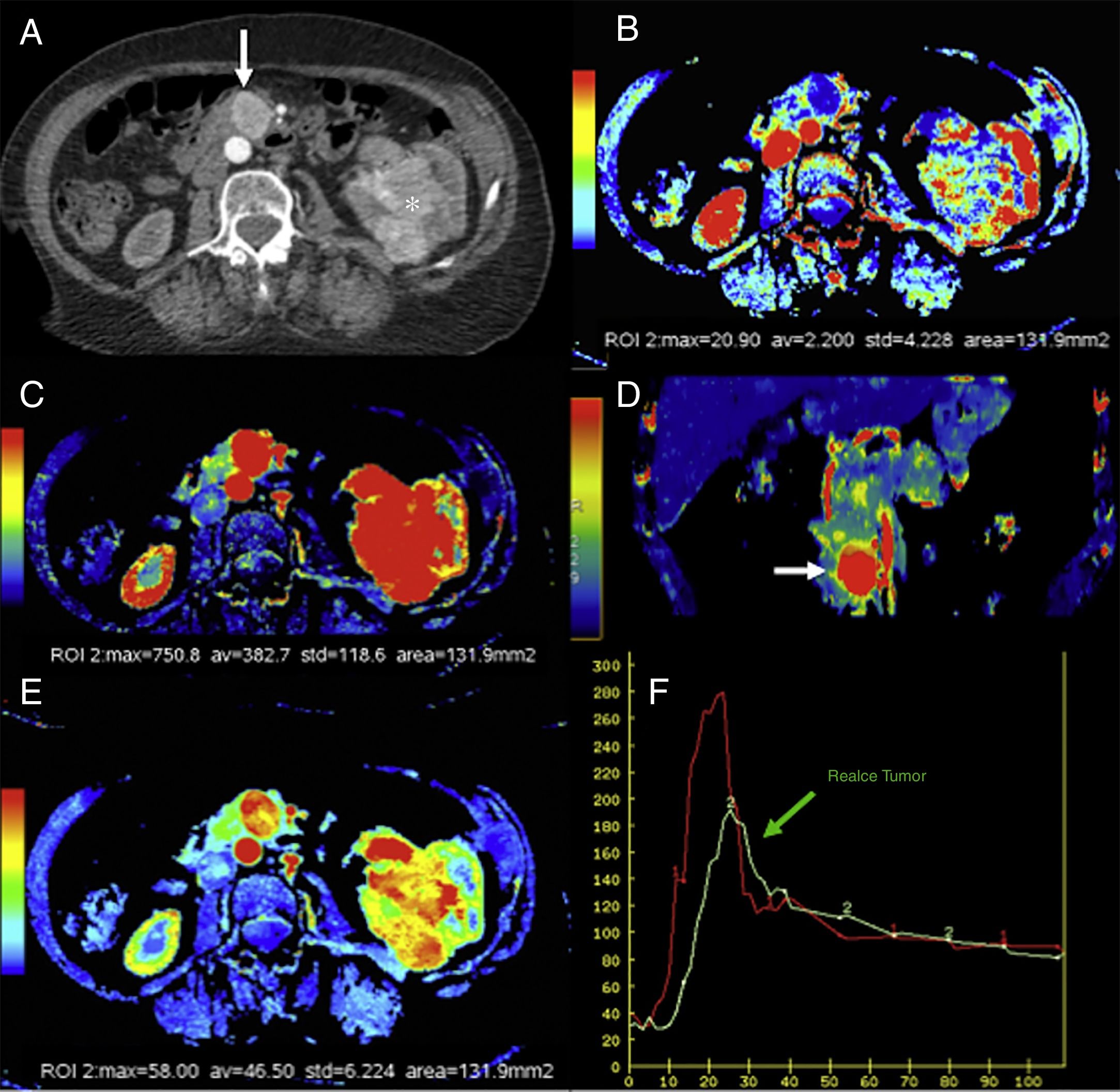
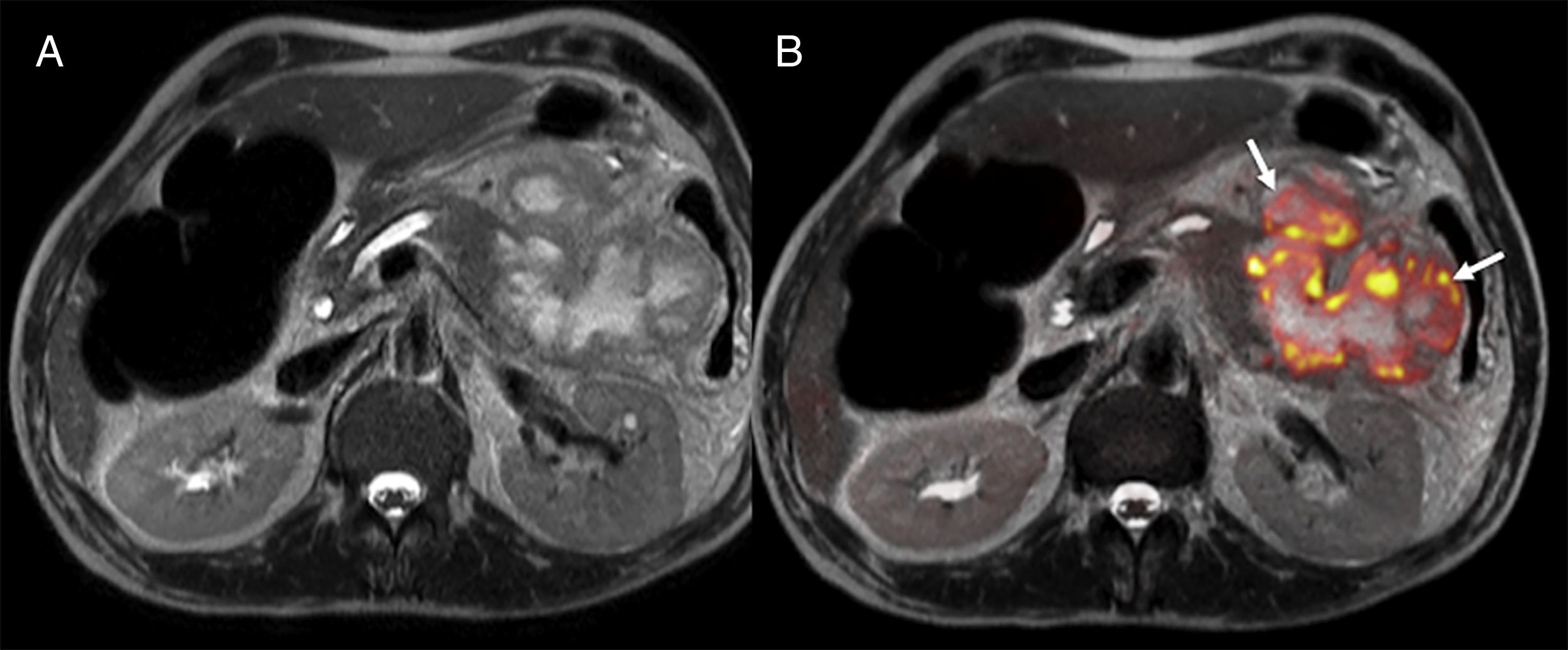
Tomografía computarizada (TC) con perfusión en un paciente con cáncer de células claras en el riñón izquierdo (asterisco) y una metástasis en el uncinado pancreático (flechas). TC con contraste en fase arterial (A), mapas paramétricos en el plano axial de permeabilidad (B), de flujo sanguíneo en planos axial (C) y coronal (D), de volumen sanguíneo (E) y curvas de captación de la aorta y del tumor (F). En los mapas de color se demuestran altos valores de flujo y volumen sanguíneo y bajos de permeabilidad en la lesión metastásica pancreática en comparación con el páncreas normal. La curva realce-tiempo muestra el realce de la metástasis pancreática (curva verde) de morfología similar a la de la aorta (curva roja).
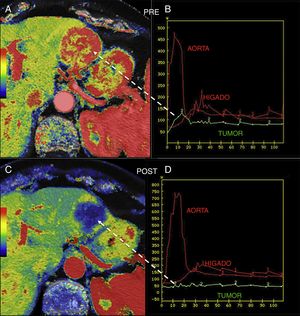
Además, la perfusión permitiría valorar la respuesta tumoral a distintas terapias. Se ha descrito que los tumores con valores más elevados de Ktrans tienden a presentar una mejor respuesta a la radioquimioterapia15 y que, en el caso de la terapia antiangiogénica, valores basales más elevados de FS y VS se asocian a mejor respuesta a dicha terapia. También sería una herramienta de evaluación precoz de respuesta de los TNE, al haberse objetivado una caída del FS a las 48 horas del inicio de la terapia antiangiogénica y posteriormente una caída del VS (fig. 3)15,16.
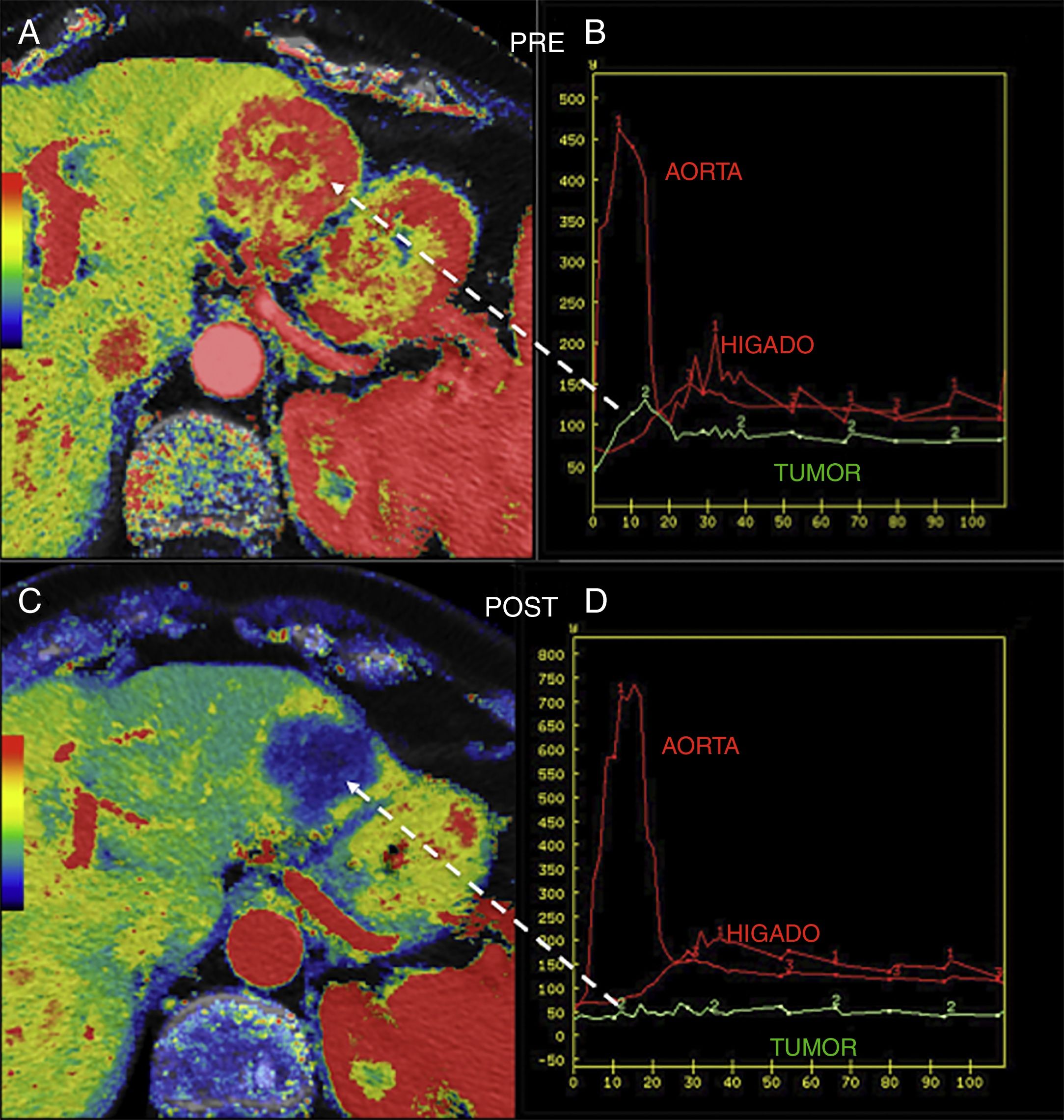
Metástasis hepática de tumor neuroendocrino de páncreas tratada con terapia antiangiogénica. Mapas paramétricos de flujo sanguíneo pretratamiento (A) y tras 15 días de terapia antiangiogénica (C) superpuestos sobre imagen anatómica de tomografía computarizada (transparencia del 50%) y curvas de captación de la lesión metastásica, en verde, y de la aorta y del parénquima hepático normal (B y D) que muestran una importante respuesta tumoral con caída del flujo de la metástasis de 118 ml/100 g/min a 8 ml/100 g/min y cambio de morfología de la curva de realce de la lesión, pasando de una curva de realce con lavado (tipo 3) (B) a una curva plana sin prácticamente cambios (D).
Otro punto interesante es la posible utilidad de la pTC para diferenciar la masa inflamatoria secundaria a una pancreatitis crónica del adenocarcinoma. Ambas entidades presentarían menor perfusión que el parénquima normal, pero esta disminución sería mayor en el caso del cáncer10,11. Esta técnica podría tener también un papel en el diagnóstico de tumores isodensos con el parénquima en el estudio de TC convencional11.
En el caso de la patología inflamatoria pancreática, diversos autores han evaluado el papel de la pTC en el diagnóstico de pancreatitis aguda o crónica y en la predicción precoz del desarrollo de necrosis en la pancreatitis aguda8,17,18. Pieńkowska et al. sugieren que la pTC podría seleccionar en las primeras 24 horas del desarrollo de síntomas aquellos pacientes en riesgo de desarrollo de necrosis pancreática o peripancreática19. Por su parte, el grupo de Yadav evidenció que valores de corte para el FS y del VS de 27,29 ml/100 ml/min y 8,96 ml/100ml, respectivamente, permitirían predecir la presencia de necrosis con una sensibilidad del 87,5% y una especificidad del 100%17. En el caso de la pancreatitis crónica, se ha sugerido una posible utilidad de la perfusión en su diagnóstico precoz8,10,20.
Técnicas avanzadas de resonancia magnéticaColangiopancreatografía por resonancia magnética con secretinaLa colangiopancreatografía por resonancia magnética (CPRM) valora la morfología ductal pancreática y biliar gracias al uso de secuencias muy potenciadas en T2 que permiten visualizar el contenido líquido de los conductos biliopancreáticos, mientras que los tejidos adyacentes se suprimen en la imagen. La secretina es una hormona que estimula la secreción de agua y bicarbonato por las células ductales pancreáticas y aumenta el tono del esfínter de Oddi durante los primeros 5-6 minutos tras su administración. Como resultado, aumenta el contenido de líquido dentro de los conductos pancreáticos y, por lo tanto, su tamaño. La CPRM con secretina tiene un papel fundamental en el diagnóstico de variantes anatómicas ductales, complicaciones como la disrupción del canal pancreático (fig. 4) o trastornos funcionales, como la disfunción del esfínter de Oddi. Además, permite el diagnóstico precoz de la pancreatitis crónica, dado que logra mejorar la visualización del conducto pancreático principal y sus ramas secundarias y estima de forma indirecta la función pancreática exocrina21. Su papel en las lesiones focales pancreáticas es clave dado que la presencia del “signo del ducto penetrante” ayuda a excluir el diagnóstico de adenocarcinoma ductal22. Finalmente, otros posibles usos de la técnica serían la valoración de las anastomosis pancreatoyeyunales poscirugía, la evaluación funcional de trasplantes pancreáticos, la valoración de la integridad ductal en pacientes traumatizados o el estudio de pacientes con una elevación asintomática de los niveles séricos de enzimas pancreáticas. En estos últimos, permite aumentar de modo significativo el diagnóstico de las causas de la misma23.
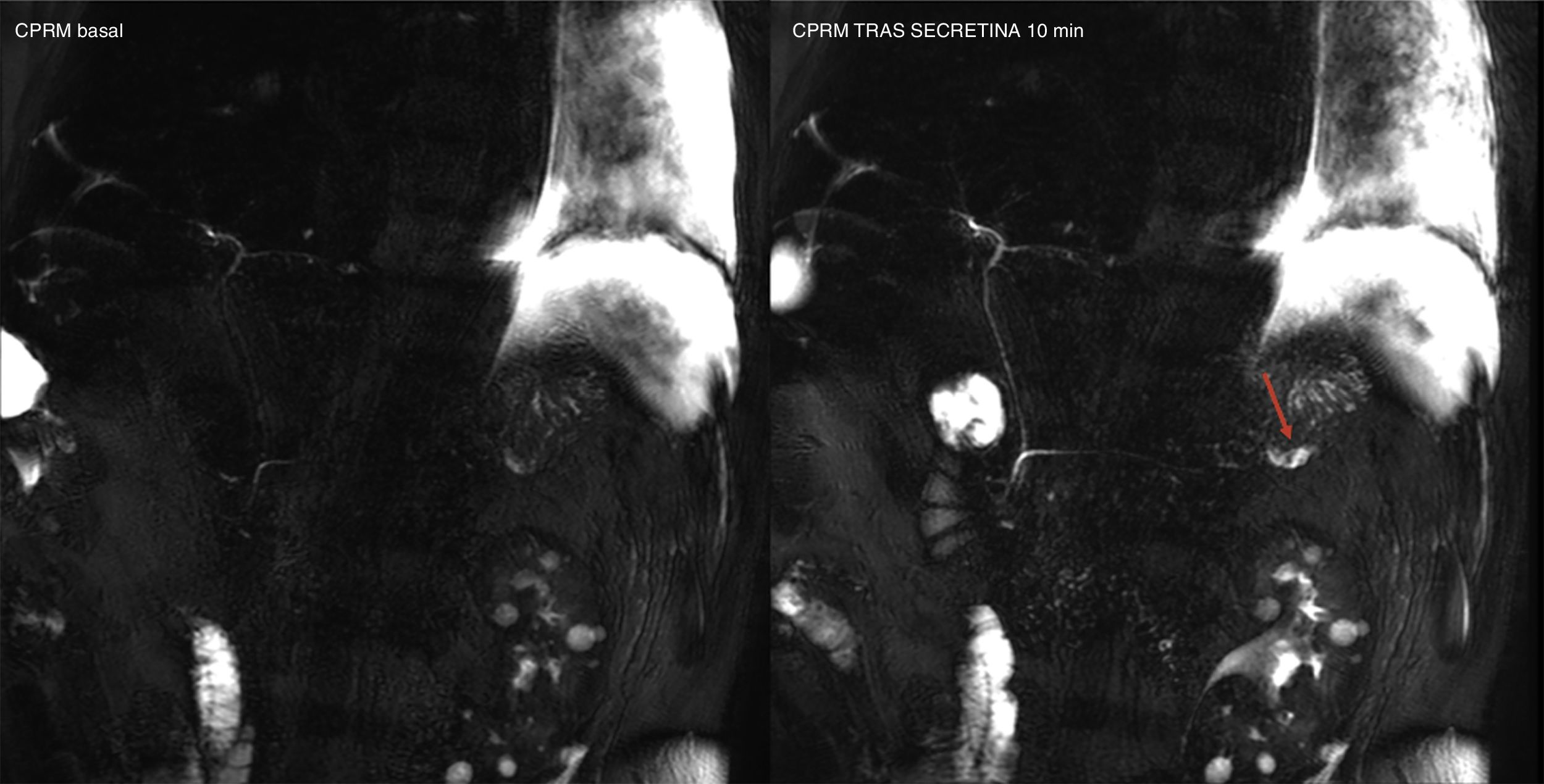
Colangiopancreatografía por resonancia magnética (CPRM) dinámica con secretina en un varón de 57 años con disrupción del Wirsung tras esplenectomía postraumatismo. Imagen de CPRM basal y a los 10 minutos tras la administración de secretina, en esta última se identifica la extravasación de secreción pancreática y el relleno de una colección localizada a nivel de la cola del páncreas (flecha roja).
El término difusión se refiere al movimiento microscópico espontáneo y aleatorio (movimiento browniano) del agua y de otras pequeñas moléculas debido a colisiones térmicas. La imagen potenciada en difusión permite el mapeo de dicho proceso en los tejidos biológicos in vivo y de modo no invasivo. La sensibilidad de la secuencia de imagen a la difusión varía de acuerdo con los valores b utilizados. A mayor valor b, mayor potenciación de la imagen en difusión. Distintos factores influyen la difusión in vivo, incluyendo la organización y estructura del tejido, su celularidad y fenómenos de flujo y perfusión. En los tejidos existen diferentes compartimentos de distribución del agua: intracelular, extracelular-extravascular e intravascular. La difusión del agua en el espacio extracelular-extravascular estaría dificultada por la presencia de las células y por la tortuosidad de este, y es el principal compartimento evaluado con las técnicas de difusión clásicas, basadas en el análisis monoexponencial de la señal. Así, tejidos o estructuras en los que predominen moléculas de agua con difusión libre perderían senal a medida que el valor b aumente, mientras que, por el contrario, los muy celulares (como serían, en general, los tumores) y aquellos con detritos y elevado contenido proteico (como los abscesos) conservarían su intensidad de señal en valores b altos al estar restringido el movimiento de las moléculas de agua. Por último, debemos considerar que en lesiones con importante vascularización, el movimiento de agua en la red microcapilar crea un proceso de seudodifusión que va a modificar la señal en difusión en valores bajos de b, lo que representa la base del modelo de difusión basado en el movimiento incoherente intravóxel o IVIM (intravoxel incoherent motion).
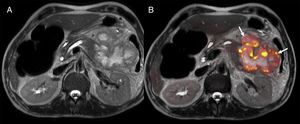
Modelo monoexponencial de análisisEs posible un análisis cuantitativo de la difusión basado en el cálculo del valor del coeficiente de difusión aparente o ADC (apparent diffusion coefficient). El ADC representa la pendiente de la caída exponencial de la intensidad de señal al aumentar la potenciación en difusión (el valor b). A mayor restricción de la difusión menores valores de ADC. Existe, en general, una importante correlación entre los valores de ADC e importantes características biológicas, como la celularidad, el índice de proliferación tumoral, el grado tumoral o la presencia de necrosis y/o apoptosis. Actualmente, la difusión se aplica de forma rutinaria en los estudios de RM abdominal y ha permitido una mejor detección y caracterización de la patología pancreática24. Así, en el caso de la pancreatitis aguda, permitiría su diagnóstico con difusión, con una mayor sensibilidad que la TC sin administración de contraste25. Además, la difusión no solo permitiría el diagnóstico de pancreatitis aguda, sino que, gracias al ADC, posibilitaría la gradación de su gravedad según el índice de Balthazar26. En ese sentido, de Freitas Tertulino et al. determinaron que un valor de ADC de 1,58×10-3 mm2/s identificaba la necrosis con una sensibilidad del 100% y una especificidad del 92,25%27. Sin embargo, la principal aplicación clínica de la difusión en el contexto de pancreatitis sería la diferenciación entre seudoquistes y abscesos (fig. 5). Las colecciones infectadas presentarían valores de ADC menores que los de las colecciones estériles28,29.
Paciente de 45 años, con pancreatitis aguda necrotizante y presencia de necrosis pancreática y peripancreática encapsulada con signos de infección en resonancia magnética. Imagen axial potenciada en T2 (A) e imagen de fusión de la imagen T2 y de la de difusión en valor alto de b (b800) en mapa de color (B). La imagen fusionada muestra restricción de la difusión en la periferia de la colección, sugestiva de sobreinfección de esta (flechas).
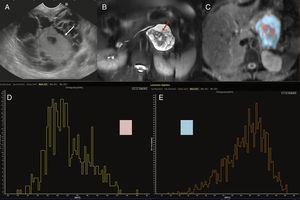
Otra de las aplicaciones fundamentales de la difusión en la imagen pancreática es la valoración de los tumores. En el caso de las masas quísticas pancreáticas, la imagen tiene un papel fundamental en su detección y caracterización, dado que aproximadamente el 31% de estas lesiones pueden ser potencialmente malignas, y resulta especialmente importante la diferenciación entre tumores serosos y mucinosos y, dentro de estos últimos, la distinción entre las neoplasias mucinosas quísticas (NMQ) y los tumores papilares mucinosos intraductales (TPMI) (fig. 6). Distintos estudios han intentado establecer el papel de la difusión en esta patología, pero los datos publicados resultan contradictorios. Así, Fátima et al. mostraron que valores de ADC de 2,4×10-3 s/mm2 permitían diferenciar con una sensibilidad del 98% y una especificidad del 100% entre TPMI y NMQ. Los TPMI presentaban valores de ADC sistemáticamente superiores a los de las NMQ, probablemente debido a su comunicación con el Wirsung que permite un mayor movimiento del contenido de la lesión30. Por otra parte, el grupo de Kang et al. estableció que la difusión permitía la diferenciación entre TPMI benignos y malignos y aportaba información sobre el grado de agresividad en función de los valores de ADC31. Sin embargo, otros estudios publicados han aportado resultados contradictorios, lo que evidencia que los valores de ADC no permitirían distinguir entre los diferentes tipos de lesiones quísticas pancreáticas32,33. Por ello, la capacidad de caracterización individual de una lesión quística con la difusión sería limitada.
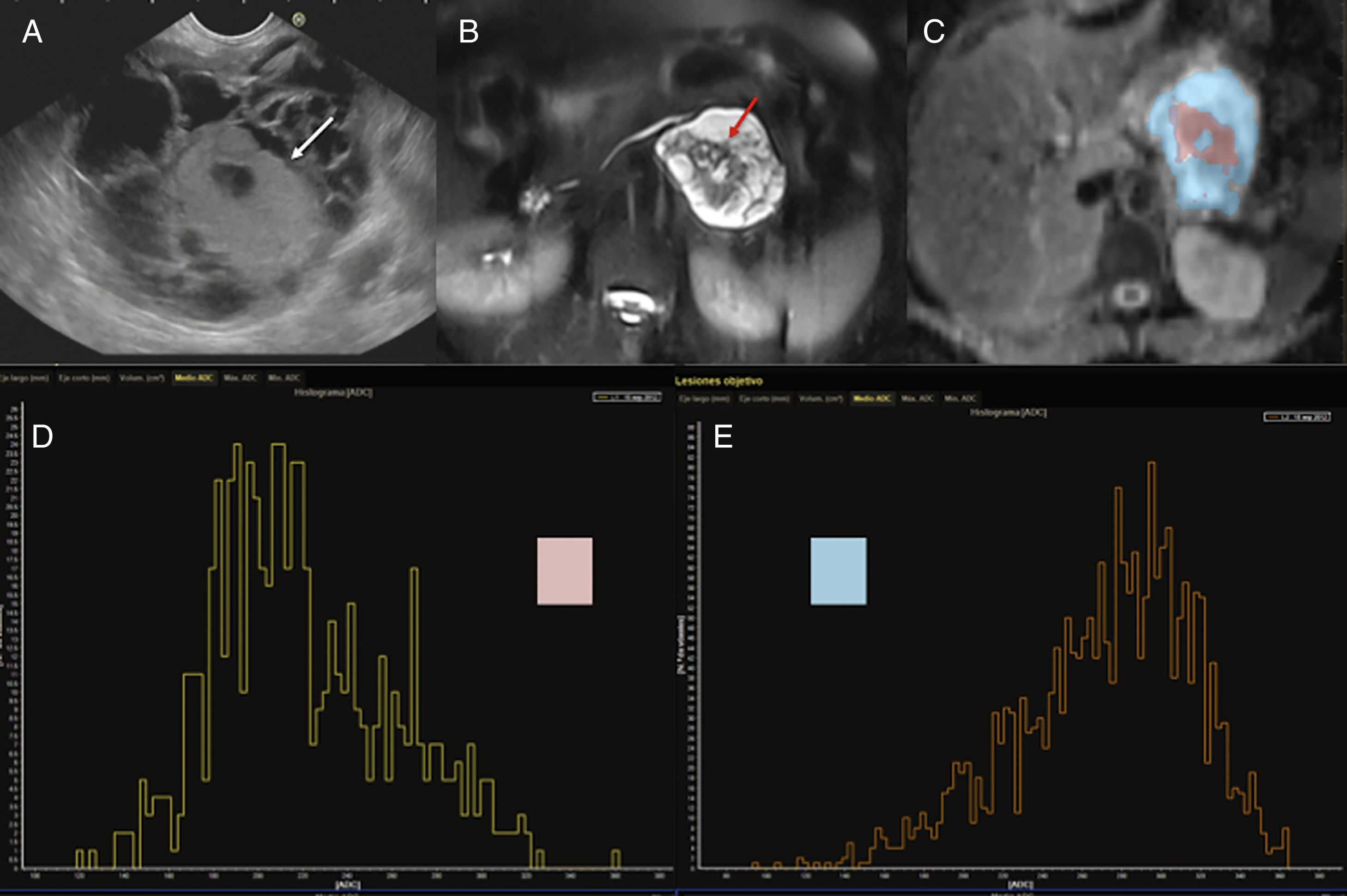
Mujer de 45 años con una tumoración quística en la cola del páncreas. Imagen de ultrasonografía endoscópica (USE) (A), imagen de resonancia magnética (RM) potenciada en T2 con saturación grasa (B), mapa de ADC con segmentación en color de las porciones periférica (azul) y central (rosa) (C) e histogramas correspondientes a los valores de ADC de dichas partes de la masa (D y E). La imagen endoscópica y la de RM potenciada en T2 con saturación de la grasa demuestran una masa quística con un componente central sólido (flechas blanca en la imagen de USE y roja en la de RM potenciada en T2). El análisis del mapa de ADC permite distinguir la porción quística periférica (segmentada en azul) con unos valores altos de ADC en el histograma (E) y un valor medio del mismo de 2,7, mientras que la porción central sólida (segmentada en color rosa) en el mapa de ADC presenta valores menores (D), con un ADC medio de 2,1. Tras la cirugía, el diagnóstico anatomopatológico fue de cistadenocarcinoma mucinoso.
En cuanto a los tumores sólidos, la difusión ha mostrado una alta sensibilidad y especificidad para el diagnóstico del adenocarcinoma de páncreas, mejorando tanto en su detección, como en la estadificación y monitorización del tratamiento. Kartalis et al. e Ichikawa et al. encontraron una sensibilidad del 92% y del 96%, respectivamente, y una especificidad del 97% y del 98,6%34,35 en su diagnóstico, valores muy superiores a otras técnicas como la TC y la tomografía por emisión de positrones (PET)-TC36,37. Comparando con la ecografía endoscópica, esta sería una técnica invasiva y con una especificidad menor (50%), pese a su sensibilidad del 100%38.
Asimismo, la difusión es capaz de identificar lesiones tumorales de pequeño tamaño, y es especialmente útil en la detección de los TNE39. El grupo de Brenner estableció que la fusión de las imágenes T2 y difusión con altos valores de b permitía identificar pequeños TNE en casi el 100% de los casos40. En esta misma línea, un estudio que comparaba el valor de la RM (incluyendo secuencias morfológicas y difusión) con la PET-TC con 68Ga-DOTANOC encontró que la capacidad de detección con RM multiparamétrica era del 92% y superior a la de la PET-TC41. En valores altos de b, los TNE generalmente muestran una marcada hiperseñal cuando se compara con el parénquima glandular (fig. 7). Sin embargo, sus valores de ADC son variables y dependen del grado de diferenciación y de la presencia de hemorragia y/o necrosis. Además, publicaciones recientes han descrito que el ADC está relacionado con el grado de agresividad, con el Ki-67 y se han visto valores superiores de ADC en los TNE de grado 1 de la clasificación WHO del 2011 e inferiores en el grado 342,43.
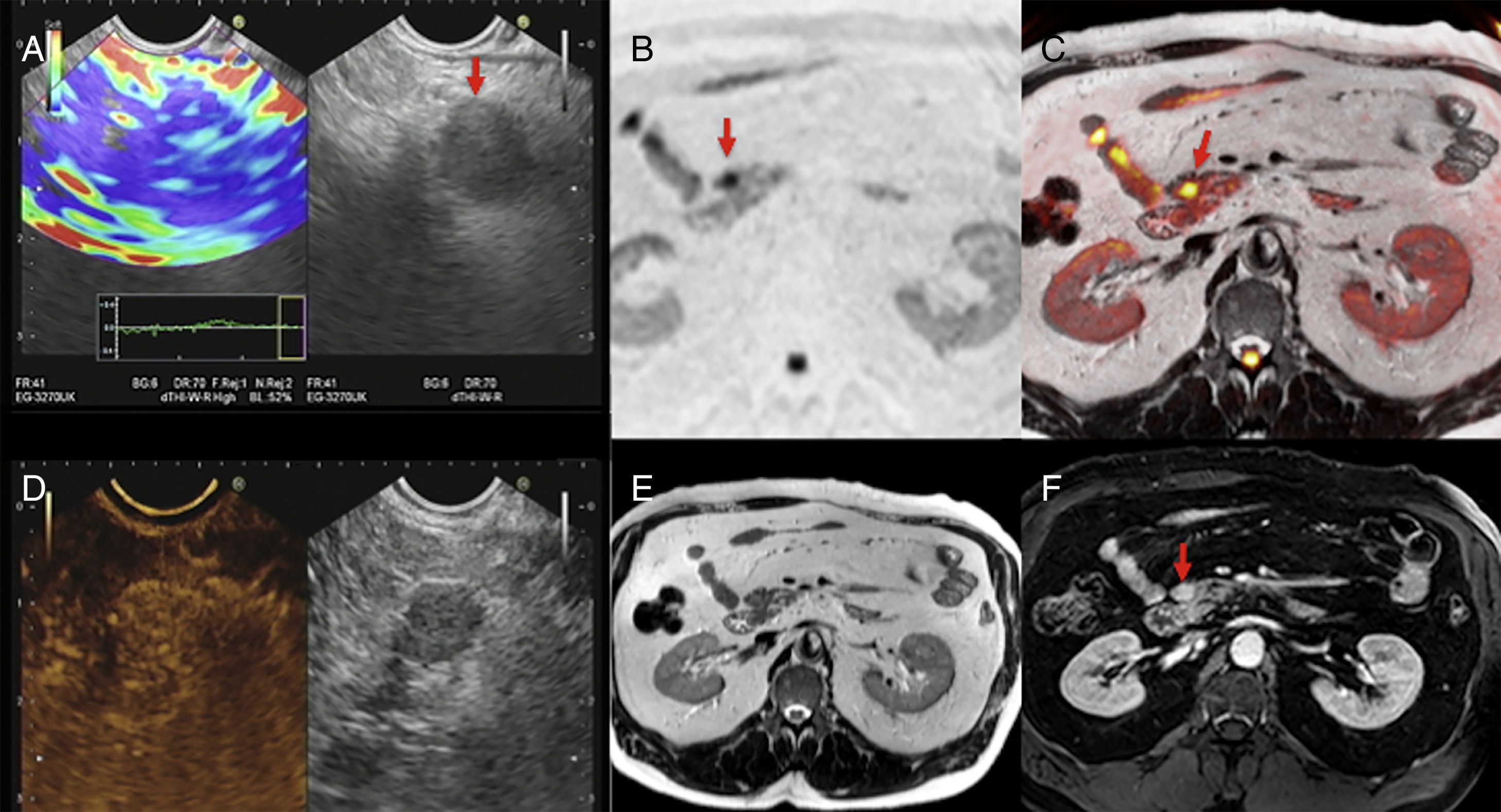
Imagen multimodalidad de un tumor neuroendocrino de páncreas. Imágenes de ecografía endoscópica con elastografía (A), imagen de difusión en b1000 con inversión de la escala de grises (B), imagen de fusión de la imagen T2 y de la difusión en b1000 en color (C), estudio de ecoendoscopia con contraste ecográfico (D), imagen de resonancia magnética (RM) potenciada en T2 (E) e imagen de RM potenciada en T1 con contraste en fase portal (F). Se identifica en el estudio ecográfico endoscópico una lesión (flecha roja en A) con patrón elastográfico homogéneo y azul (característico de los tumores malignos) y realce tras la administración de contraste (D). En RM con difusión (B) y mapa de color fusión (T2+difusión) (C) se identifica claramente el pequeño tumor en el istmo pancreático, que presenta un mayor realce que el parénquima tras la administración de contraste paramagnético (F) (flechas rojas).
En cuanto a la posibilidad de caracterizar las lesiones pancreáticas, Kartalis et al. mostraron que las lesiones malignas del páncreas presentaban valores muy inferiores de ADC al comparar con las benignas, aunque se halló una superposición de valores en los diferentes tipos de lesiones malignas34. Existe una amplia bibliografía que intenta correlacionar la histopatología del adenocarcinoma del páncreas con los valores de ADC con resultados muy diversos y contradictorios42,44. En ese sentido, uno de los mayores retos diagnósticos para la imagen pancreática continúa siendo la diferenciación entre adenocarcinoma y pancreatitis crónica focal. Diferentes signos radiológicos, como el signo del ducto penetrante o el pico de realce, han sido utilizados mostrando sensibilidades y especificidades muy variables en las distintas publicaciones22,45. Por ello, el grupo de Wieggermann et al. evaluó el papel de la difusión y de los valores de ADC en la diferenciación entre la pancreatitis focal y el adenocarcinoma, y vieron que la difusión y el ADC permitían diferenciar entre tejido pancreático normal y anormal, pero existía una superposición de los valores de ADC que no posibilitaba la distinción entre ambas entidades46. Un metaanálisis en el que se incluyeron 9 estudios encontró una sensibilidad y especificidad del 86% y 82%, respectivamente, cuando se establece un valor de ADC de 0,91 como punto de corte47.
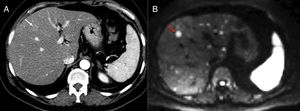
Una de las mayores ventajas de la utilización de la difusión en el cáncer de páncreas es la identificación de la enfermedad metastásica (fig. 8), dado que un 80% de los casos no son resecables al diagnóstico. Los resultados de un estudio sobre enfermedad metastásica en cáncer de páncreas pusieron de manifiesto que la difusión era más sensible y específica en la detección de metástasis hepáticas que la TC multidetector con contraste con unos valores del 86,7% y 97,5%, respectivamente, frente a 53,3% y 77,8% de la TC48. Sin embargo, la difusión muestra una capacidad muy limitada para la valoración de las adenopatías44. La difusión sería, también, una herramienta prometedora para la valoración de la respuesta al tratamiento de nuevas terapias percutáneas como la crioablación y/o la electroporación y podría ofrecer información pronóstica en pacientes con cáncer de páncreas localmente avanzado, al haberse encontrado que valores inferiores de ADC se asocian con una supervivencia libre de progresión más corta44.
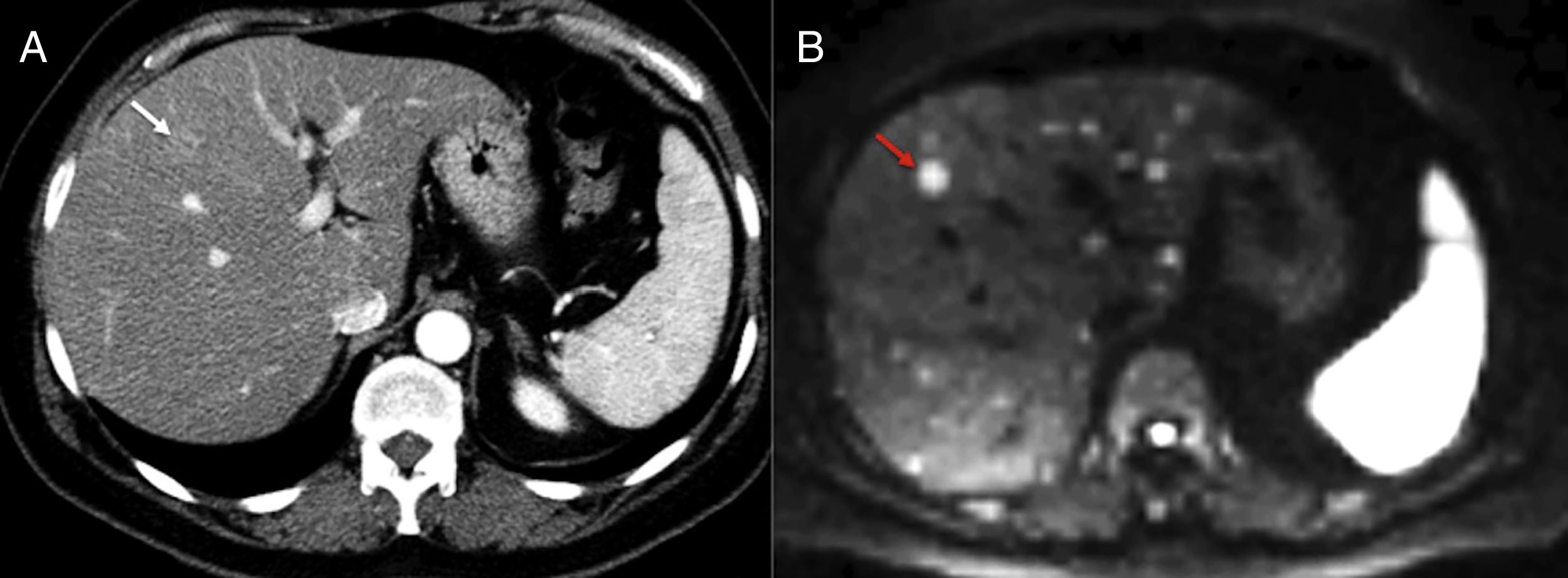
Estadificación de tumores pancreáticos con imagen de difusión. Paciente operado de tumor neuroendocrino de páncreas con elevación de cromogranina A durante su seguimiento. La imagen de tomografía computarizada (TC) con contraste en fase arterial en plano axial (A) evidencia una tenue lesión hipervascular hepática (flecha blanca). La imagen de difusión del hígado con valor de b800 (B) al mismo nivel que la TC confirma la existencia de esa lesión (flecha roja) y muestra la presencia de innumerables lesiones subcentimétricas hepáticas con hiperseñal en difusión correspondientes a metástasis hepáticas.
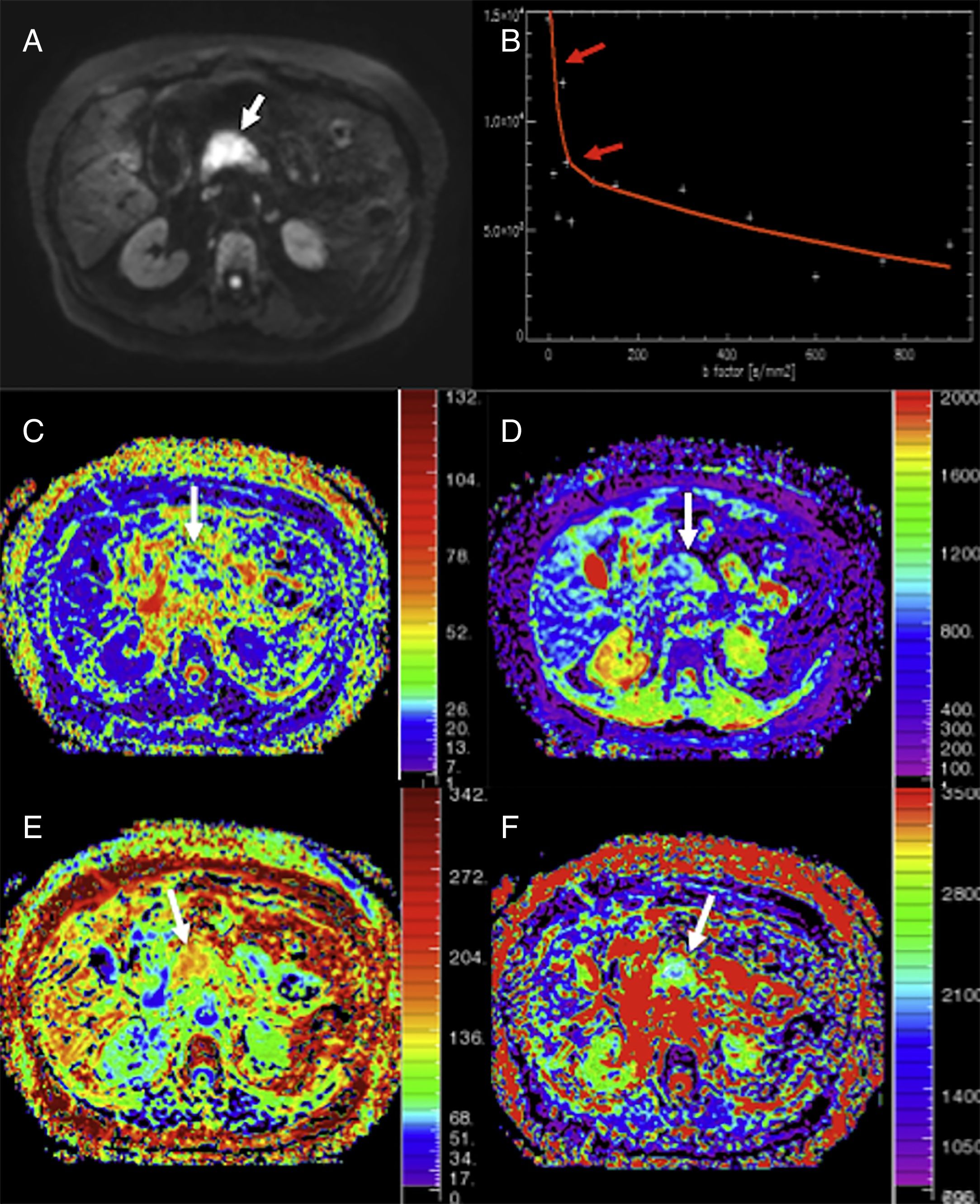
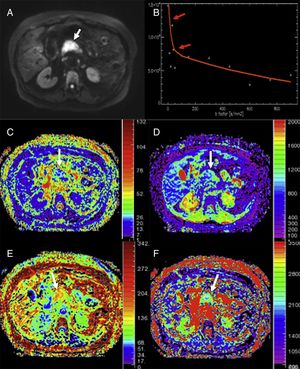
Al margen del análisis clásico de la señal de la difusión, existen otros modelos alternativos como el IVIM (que permite medir la perfusión a partir de la señal de difusión), el tensor de difusión o DTI (diffusion tensor imaging) (que posibilita la valoración de la microestructura tisular) o el modelo de kurtosis, que puede aportar información sobre la heterogeneidad y complejidad de los tejidos. El modelo IVIM permite discriminar dos elementos diferentes en la caída de la intensidad de señal al aumentar la potenciación en difusión de la secuencia. Para los valores bajos de b (entre 0 y 100-200 s/mm2), la señal experimenta una caída rápida debida al paso de la sangre a través de la red microvascular, mientras que para los valores b más altos (mayores de 100-200 s/mm2), la caída de la señal estaría relacionada con el comportamiento de la difusión de las moléculas de agua en el espacio intersticial sin considerar los efectos derivados de la perfusión, mostrando una caída más progresiva (fig. 9). Del análisis de esta se obtienen tres parámetros: D* que se corresponde con la seudodifusión, es decir, la difusión de la sangre en el lecho capilar; D que refleja el coeficiente de difusión (la difusión verdadera libre de perfusión o difusividad tisular) y la fracción de perfusión (f) que indicaría el volumen de agua en el componente capilar en relación con el volumen de agua total del vóxel, conocido por algunos autores como densidad capilar activa. Este modelo de análisis podría permitir la diferenciación entre pacientes con patología pancreática (pancreatitis y diferentes tipos tumorales) de aquellos con parénquima pancreático sano y que podría ser de utilidad en la diferenciación entre adenocarcinomas y TNE49. Los artículos publicados han mostrado también diferencias significativas en f entre el carcinoma y la pancreatitis focal50. Sin embargo, en el caso de la pancreatitis crónica focal, la técnica IVIM no permitiría la distinción entre esta y el carcinoma pancreático51. Nuevas aplicaciones del IVIM en el páncreas han ido apareciendo en la literatura científica. Así, se ha descrito una relación entre parámetros obtenidos con la técnica IVIM (como D) con el grado de fibrosis glandular (un elemento característico tanto de la pancreatitis crónica como del adenocarcinoma)52,53 y su posible uso como biomarcador en la monitorización terapéutica de los TNE51 y de las pancreatitis autoinmunitarias54.
Análisis con modelos no monoexponenciales de un paciente con adenocarcinoma de la cabeza del páncreas (flechas). Imagen de difusión en b800 (A), curva de caída de la señal con el incremento de valores b (B), mapas paramétricos obtenidos con modelo de movimiento incoherente intravóxel (IVIM) de fracción de perfusión (C) y difusión libre de perfusión (D), y mapas paramétricos de kurtosis (E) y de difusión aparente (F). La imagen de difusión muestra la neoplasia (flecha blanca en A). El tumor muestra una rápida y marcada caída de la señal en difusión al aumentar los valores de b en valores de b <100 (flechas rojas en B), lo que sugeriría un importante componente de perfusión y/o de seudodifusión en estructuras glandulares en la masa, con un valor medio de la fracción de perfusión (f) en torno al 25% (C) y valores bajos de difusión libre de perfusión (D*) (imagen D). El tumor muestra valores aumentados de kurtosis (imagen E) (posiblemente debidos a mayor complejidad estructural de este) y disminución de la difusión aparente o Dk (F), un parámetro que corrige el comportamiento no gaussiano de la difusión a altos valores b.
La técnica DTI se basa en el hecho de que la difusión de las moléculas de agua es, en general, un fenómeno tridimensional y anisotrópico, mayor en una dirección que en otras, debido a diferentes factores como las membranas celulares o la fibrosis y la microestructura ductal típica de órganos secretores como el páncreas. Diferentes publicaciones han evidenciado valores relativamente altos de anisotropía en el páncreas normal con cambios significativos en pacientes con cáncer o inflamación. Nissan et al. demostraron diferencias significativas en el grado de anisotropía entre pacientes sanos y aquellos con pancreatitis crónica55.
Hoy día, el modelo de kurtosis de la difusión ha sido muy poco usado en la valoración pancreática (fig. 9). Sin embargo, resultados preliminares indican que podría mejorar la fiabilidad de la difusión en la diferenciación de tejido tumoral del no tumoral en pacientes con adenocarcinoma de páncreas56. Además, Noda et al. han descrito que la kurtosis podría correlacionarse con los niveles de hemoglobina glicosilada en pacientes diabéticos57.
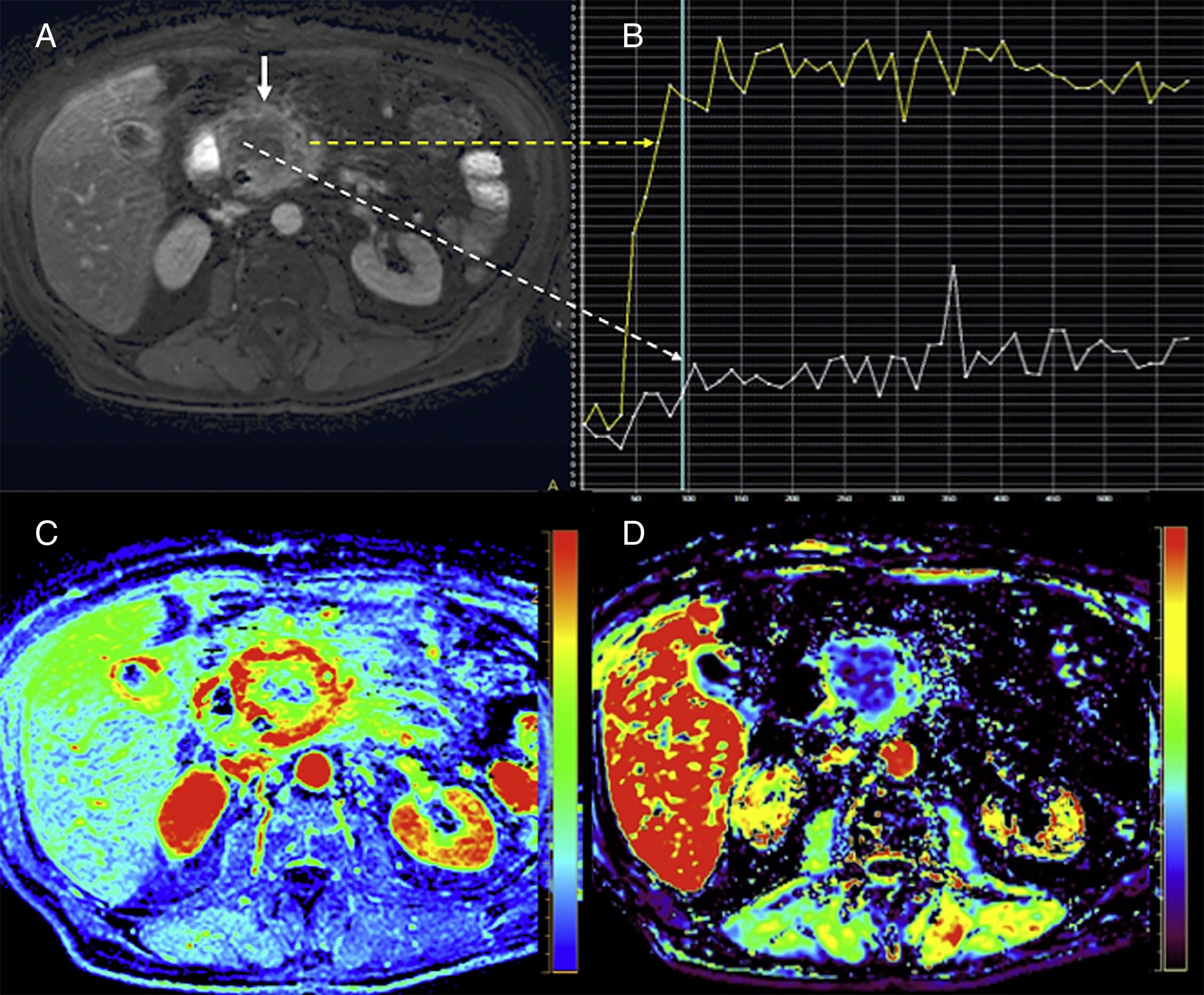
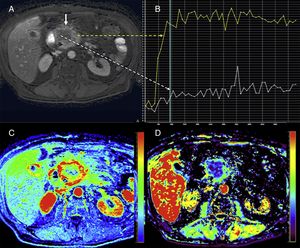
Perfusión por resonancia magnéticaMúltiples técnicas de RM pueden ser utilizadas para evaluar la perfusión pancreática, pero las técnicas de perfusión dinámica con secuencias potenciadas en T1 tras la administración de un medio de contraste son las más usadas58. La imagen de perfusión por RM (pRM) evalúa la cinética de contraste a lo largo del tiempo con el paso del medio de contraste a través del lecho vascular y su fuga al espacio extravascular-extracelular, y proporciona así comprensión de la naturaleza de las propiedades del tejido a nivel microvascular. Sin embargo, su cuantificación es mucho más compleja que la de la pTC, dado que no existe una relación directa entre la señal del tejido y la concentración de gadolinio en el mismo, y la correlación biológica de sus parámetros es más difícil. Por ello, la aplicación clínica de la pRM en el estudio del cáncer de páncreas ha sido limitada (fig. 10), aunque mostrando el adenocarcinoma de páncreas valores significativamente menores de Ktrans, de la constante de retorno (Kep) y del área bajo la curva de gadolinio (AUC) en relación con el tejido pancreático adyacente59–61. También se han demostrado diferencias significativas en los parámetros de valoración de la perfusión entre adenocarcinomas, TNE y pacientes control61.
Estudio de perfusión con resonancia magnética pancreática en un paciente con adenocarcinoma de páncreas de la cabeza glandular. Una imagen del estudio dinámico con contraste (A) muestra una gran masa con contorno mal definido y extensas áreas de necrosis central (flecha blanca continua). Las curvas de captación (B) demuestran claras diferencias entre la porción central con escaso realce (curva y flecha discontinua blancas), mientras que la periferia más viable evidencia un patrón de curva tipo II (curva y flecha discontinua amarillas) con realce rápido y meseta tras el pico máximo de realce. La perfusión posibilita además la evaluación tisular basada en parámetros semicuantitativos, que permiten analizar características de las curvas de realce, como el área bajo la curva (area under the curve, AUC) (imagen C); o cuantitativos, como el coeficiente de retorno (Kep) (imagen D), dependientes de modelos matemáticos, de más compleja obtención, pero dotados de un mayor significado biológico.
La pRM también se ha usado en la valoración de respuesta a terapias de los TNE62,63. Miyazaki et al. encontraron que una mayor fracción de flujo arterial hepático se asociaba a una mejor respuesta a terapia con octreotidas en pacientes con TNE y metástasis hepáticas63. Las técnicas de pRM se han usado también en la valoración de pacientes con pancreatitis crónica, y se ha evidenciado una superposición de los valores con los de pacientes control64.
El uso de otras técnicas de perfusión que no precisan del uso de contraste, como el arterial spin labelling (ASL), pese a su potencial atractivo al evitar los posibles efectos adversos de los medios de contraste, ha sido limitado, habiéndose usado fundamentalmente en la valoración de voluntarios sanos y pacientes diabéticos65,66.
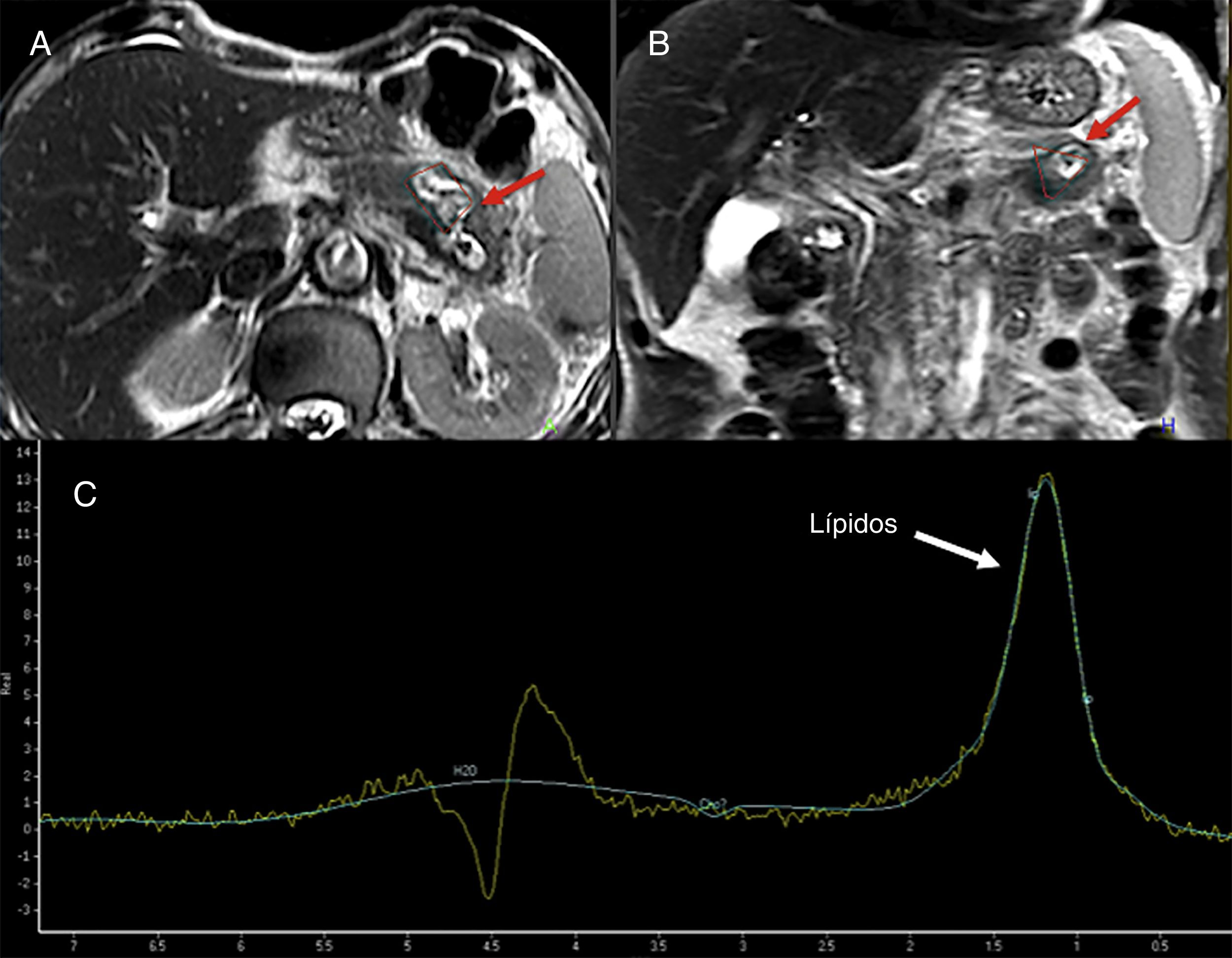
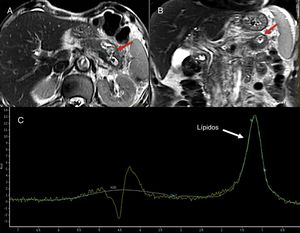
Espectroscopia por resonancia magnéticaLa espectroscopia por RM (eRM) permite la identificación in vivo de diversas moléculas involucradas en vías metabólicas de procesos fisiológicos o patológicos67. El uso de la espectroscopia en la glándula pancreática ha sido muy reducido dadas sus dificultades técnicas (fig. 11). Su et al. demostraron que los principales metabolitos detectados en la glándula pancreática normal eran colina y lípidos insaturados68. La colina se asocia, en general, al metabolismo del recambio de membranas, mientras que los lípidos insaturados se asociaban a procesos de proliferación celular y detención del crecimiento. Diferentes autores han abogado por el uso de los lípidos detectados en la espectroscopia como posible marcador del cáncer de páncreas. Varios autores han descrito que los lípidos aumentaban de forma significativa en el cáncer de páncreas69,70. Esta técnica también se ha empleado para diferenciar pancreatitis crónica focal de cáncer, y se han encontrado niveles de lípidos significativamente menores en la pancreatitis71. Finalmente, la eRM podría ser útil en el estudio de patologías metabólicas pancreáticas. Un aumento del contenido graso del páncreas determinado mediante eRM podría asociarse a insulinorresistencia en pacientes no obesos72.
Varón de 74 años que ingresa por dolor abdominal. Las imágenes turbo espín eco potenciadas en T2 en plano axial (A) y coronal (B) usadas como referencia para la localización de la lesión muestran una masa de aproximadamente 4 cm, de aspecto quístico, localizada en el cuerpo-cola del páncreas, marcadamente hiperintensa en T2 (flechas rojas). La espectroscopia con tiempo de eco (TE) corto 35 ms (C) evidencia un pico de lípidos a 1,3 ppm, lo que probablemente indica la presencia de necrosis. La cirugía confirmó una lesión cavitada con contenido necrohemorrágico y revestimiento epitelial compatible con tumor mucinoso.
Una parte fundamental del contraste entre tejidos que aporta la RM viene dado fundamentalmente por sus características T1 y T2. La alteración en la señal T1 del páncreas se correlaciona con la función exocrina pancreática, posiblemente por la pérdida de células acinares (ricas en proteínas) y su reemplazamiento por fibrosis. Por ello, la cuantificación del tiempo de relajación T1 podría permitir una valoración cuantitativa para el diagnóstico de pancreatitis73.
En el futuro, el uso de múltiples técnicas de imagen avanzadas para la valoración de la patología pancreática podría ofrecer una mejor valoración del fenotipo de imagen de los pacientes. La combinación de múltiples datos extraídos de la imagen con datos clínicos, genéticos, epigenéticos o proteómicos (los denominados radiomics y radiogenomics) va a resultar clave para un posible abordaje individual del manejo de estos (medicina personalizada) y el desarrollo de biomarcadores de imagen en la patología pancreática74,75.
ConclusiónLa imagen funcional aporta ventajas en la valoración de la patología del páncreas superando las limitaciones de la imagen anatómica. En la actualidad, la difusión es una técnica de imagen fundamental con un importante impacto en la detección y caracterización de lesiones pancreáticas, en la estadificación tumoral y en la valoración de la respuesta a distintas terapias. Por su parte, el uso de secretina en los estudios colangiográficos permite una valoración no invasiva de la función exocrina glandular. Finalmente, las técnicas de perfusión podrían permitir una adecuada evaluación de la respuesta en pacientes oncológicos tratados con terapias diana. Sin embargo, una mayor implementación futura de la imagen funcional en la práctica clínica precisaría de una adecuada estandarización de estas técnicas.
Autoría- 1.
Responsable de la integridad del estudio: SBG y RGF.
- 2.
Concepción del estudio: SBG, MRD y AL.
- 3.
Diseño del estudio: SBG, JCV y RFG.
- 4.
Obtención de los datos: SBG, MR y RGF.
- 5.
Análisis e interpretación de los datos: SBG, RGF, MR, AL y JCV.
- 6.
Tratamiento estadístico: N.A.
- 7.
Búsqueda bibliográfica: SBG, MR y RGF.
- 8.
Redacción del trabajo: SBG, RGF, MR, AL y JCV.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SBG, RGF, MR, AL y JCV.
- 10.
Aprobación de la versión final: SBG, RGF, MR, AL y JCV.
Los autores declaran no tener ningún conflicto de intereses relacionado con este artículo.