Los datos del Ministerio de Sanidad y Consumo acerca de la creciente incidencia y prevalencia del cáncer de pulmón demuestran que es la causa más frecuente de mortalidad por enfermedad neoplásica en los varones1,2.
En Cataluña la tasa ajustada de mortalidad para los varones es de 41,9/100.000 y para las mujeres de 4,1/100.000, y muestra una supervivencia global al año del 30% y a los 5 años del 12% (con un aumento del 2,95% entre 1984 y 1998). El mal pronóstico se atribuye a su rápida evolución y diagnóstico tardío, así como por el conjunto de enfermedades concomitantes relacionadas con el tabaco, como la enfermedad pulmonar obstructiva crónica y las enfermedades cardiovasculares, que condicionan un manejo más complejo de los pacientes3.
Actualmente se está valorando y discutiendo la utilidad del cribado con tomografía computarizada (TC), tema muy debatido, ya que no hay evidencia científica de que sea clínicamente efectivo en la reducción de la mortalidad por cáncer de pulmón4–10. El objetivo de un método de cribado es un diagnóstico y tratamiento tempranos para poder prevenir la mortalidad por esa enfermedad4,9,10. En ausencia de un método de cribado científicamente probado, se analizan otras opciones más asequibles, como la reducción del tiempo para el diagnóstico y tratamiento una vez hay sospecha clínica de cáncer de pulmón11–13.
El Catsalut (Servei Català de la Salut), en línea con los objetivos del Plan de Cáncer de Cataluña, impulsó el establecimiento de programas de diagnóstico rápido del cáncer de pulmón, mama y colorrectal en toda Cataluña. El programa PDTR (programa de diagnóstico y tratamiento rápido) del cáncer de pulmón se estableció en el Hospital de la Santa Creu i Sant Pau desde octubre de 2005. Según el programa PDTR, el tiempo desde la llegada del paciente con sospecha de cáncer de pulmón hasta su tratamiento no debe superar 30 días en la mayoría de los pacientes, lo cual representaría una reducción de tiempo respecto al período previo a su instauración.
El objetivo principal de nuestro estudio es evaluar el cumplimiento del PDTR del cáncer de pulmón y la reducción del tiempo transcurrido desde la primera visita en que se sospecha clínicamente hasta que se realiza el diagnóstico y se instaura el tratamiento con respecto a los pacientes diagnosticados antes de su puesta en marcha. Asimismo, se revisa el patrón de aparición y distribución del cáncer de pulmón diagnosticado en el Hospital de la Santa Creu i Sant Pau.
Material y métodosSe revisaron retrospectivamente las historias clínicas de 29 pacientes diagnosticados de cáncer de pulmón dentro del circuito PDTR en el Hospital de la Santa Creu i Sant Pau durante el período de octubre de 2005 a mayo de 2006. Durante este período fueron 62 los pacientes diagnosticados de cáncer de pulmón, pero se excluyeron 8 por no cumplir los criterios de inclusión en el programa PDTR, 3 por presentar un tumor benigno, 3 por decisión propia del paciente, 6 por ingreso del paciente y 13 por estar pendiente de diagnóstico definitivo al finalizar el período de estudio. Por otro lado, de los 120 pacientes que se diagnosticaron durante el año previo al establecimiento del PDTR, se seleccionaron de manera aleatoria, mediante un sistema informático, 29 pacientes como grupo control.
Se consideró que cumplía criterios de derivación al PDTR cualquier paciente que por primera vez presentara alguno de los síntomas o signos sospechosos de cáncer de pulmón, siendo derivado urgentemente según 2 circuitos conforme el grado de sospecha clínica de cáncer de pulmón:
- Alta sospecha clínica. El paciente entraba directamente al PDTR si había un nódulo, masa o infiltrado en la radiografía de tórax (hilio patológico, atelectasia, neumonía obstructiva) sospechoso de neoplasia de pulmón (aparición reciente y naturaleza no establecida) y/o hemoptisis de causa no filiada (no atribuible a episodio de bronquitis aguda) en persona fumadora de más de 35 años.
- Baja sospecha clínica. El paciente no entraba directamente al PDTR. Previamente debía confirmarse la sospecha con valoración de un especialista o con otras pruebas complementarias si fuera necesario. Se incluían en este grupo los pacientes si eran mayores de 55 años, fumadores habituales o ex fumadores, con disnea de causa desconocida (descartando cardiopatía subyacente), especialmente si se acompañaba de estridor y/o tos persistente (>3 s) de causa no explicada y/o pérdida de >5% de peso.
Estos criterios eran aplicables tanto a pacientes que consultaban desde atención primaria como desde el hospital. Por ello, se determinaron los circuitos de derivación en función del origen del paciente, ya sea desde urgencias de nuestro hospital, desde el ambulatorio, desde el médico de cabecera o desde el especialista. Ante un paciente que presentaba una masa, nódulo o infiltrado en radiografía de tórax sospechoso de neoplasia de pulmón, o bien hemoptisis en fumador >35 años de causa no filiada, se derivaba al cirtuito PDTR. El paciente podía proceder de urgencias, de consultas externas (CCEE) del hospital o del centro de atención primaria (CAP). Seguidamente se derivaban a neumología, donde se realizaba la primera visita para confirmar si cumplían criterios de entrada en PDTR y, en caso afirmativo, se programaba a CCEE de neumología. Los pacientes procedentes del CAP o especialistas de atención primaria se derivaban mediante contacto ágil y rápido (comunicación verbal telefónica). En la primera visita de neumología se solicitaban las siguientes exploraciones complementarias: coagulación y análisis convencional de sangre, espirometría y broncoscopia (+ citología/biopsia si era necesario), TC torácica hasta suprarrenales (informe el mismo día) +/− TC punción (si era necesaria). Según los resultados y la valoración en el comité de cáncer de pulmón se remitía o programaba con carácter preferente según el caso para ingreso en neumología (si había dudas diagnósticas), CCEE de cirugía torácica (mediastinoscopia, mediastinotomía, visita preanestésica o gammagrafía pulmonar), CCEE de oncología médica o radioterápica (quimioterapia y/o radioterapia), o bien al médico de atención primaria-PADES (tratamiento paliativo).
La estadificación del tumor se realizó según la clasificación TNM del American Joint Committee of Cancer valorando conjuntamente historia clínica y exploración física, radiología simple, TC , resonancia magnética, PET o PET-TC, ultrasonografía endoscópica y punción transtorácica (punción aspiración con aguja fina [PAAF] o tru-cut), broncoscopia, mediastinoscopia, mediastinotomía, toracocentesis, toracoscopia y toracotomía14,15.
Se registraron diferentes variables, como la edad, el sexo, el tipo histológico, las fechas de primera visita, broncoscopia, TC, PAAF guiada por TC, mediastinoscopia, confirmación diagnóstica histológica, estadificación TNM, y se registraron los intervalos de tiempo desde la llegada del paciente con sospecha clínica de cáncer de pulmón hasta la primera visita con el especialista, la realización del diagnóstico, la visita pretratamiento y el inicio del tratamiento.
Para el análisis estadístico se describieron las variables categóricas mediante el porcentaje y el número de casos, y la comparación se llevó a cabo con tablas de contingencia y test de χ2. En el caso de variables cuantitativas se describió facilitando la media y desviación típica (DT) y la comparación con test de t. En algunas variables se detectó una clara asimetría positiva, por lo que se repitió el análisis inferencial, esta vez con un test no paramétrico (Mann-Whitney). En todos los casos el nivel de significación fue el usual del 5% bilateral. El software empleado para el análisis fue el paquete estadístico SPSS (V 14).
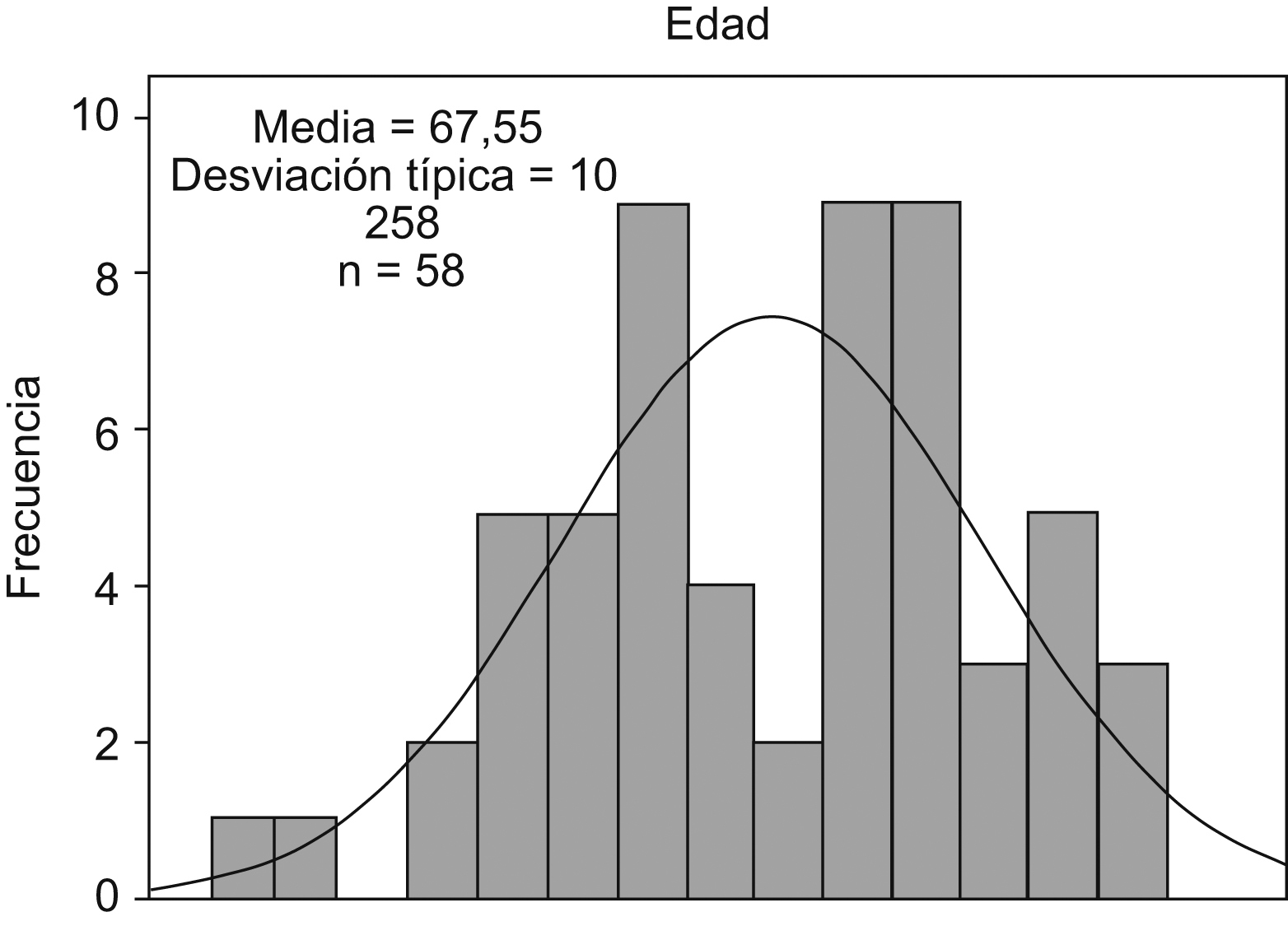
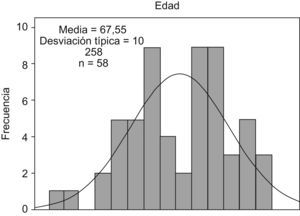
ResultadosPatrón de distribución del cáncer de pulmónAnalizando el total de 58 pacientes, 29 del grupo PDTR y 29 del grupo control, la edad media observada fue de 67 años (rango: 43–86), observando 2 picos de frecuencia situados a principios de la década de los sesenta y de los setenta (fig. 1). La distribución por edades de manera independiente en los 2 grupos fue muy similar, siendo la media de edad al diagnóstico de 67 años para ambos grupos.
Figura 1. Distribución por edad incluyendo a los 58 pacientes.
En cuanto a los subtipos histológicos encontrados, el más frecuente fue el carcinoma escamoso (36,2%), seguido del carcinoma de célula grande (24,1%), el adenocarcinoma (18,9%), célula pequeña (CPCP) (13,7%) y otros (5%). En las mujeres (n=6) predominó el adenocarcinoma y en los varones (n=52) el carcinoma escamoso (tabla 1). Al separar los subtipos histológicos según cada grupo PDTR y no PDTR (control) se observó que eran similares, sin observar diferencias significativas (p=0,689).
Tabla 1. Distribución por sexos de los subtipos histológicos del cáncer de pulmón
| Varones | Mujeres | Total | |
| Escamoso | 21 (40,38%) | 0 (0%) | 21 (36,2%) |
| Célula grande | 12 (23%) | 2 (33,33%) | 14 (24,1%) |
| Adenocarcinoma | 8 (15,38%) | 3 (50%) | 11 (18,9%) |
| Célula pequeña | 8 (15,38%) | 1 (16,66%) | 9 (13,7%) |
| Otros | 3 (5,77%) | 0 (0%) | 3 (5%) |
| Total | 52 (100%) | 6 (100%) | 58 (100%) |
Cuando se analizó la distribución de la estadificación TNM del tumor al momento del diagnóstico, se encontraron 2 hallazgos diferenciales:
- El grupo PDTR tenía menos tumores con la categoría T1 o T2 y más en T4, aunque no se trató de una diferencia estadísticamente significativa (p=0,3) (tabla 2).
- Al evaluar la afectación ganglionar (categoría N ) (tabla 3), se encontraron diferencias: el grupo PDTR presentó más casos con N0 y N1 que el grupo control. Por otro lado, en el grupo control se encontraron más casos con N2 y N3 respecto el PDTR. El análisis estadístico χ2 mostró unas diferencias significativas entre ambos grupos (p=0,007).
Tabla 2. Tabla de contingencia que muestra la distribución de la categoría T en cada grupo control y PDTR
| Grupo | Total | ||
| Control | PDTR | ||
| T | |||
| 1 | 4 (13,8%) | 1 (3,4%) | 5 (8,6%) |
| 2 | 9 (31%) | 7 (24,1%) | 16 (27,6%) |
| 3 | 7 (24,1%) | 6 (20,7%) | 13 (22,4%) |
| 4 | 9 (31%) | 15 (51,7%) | 24 (41,4%) |
| Total | 29 (100%) | 29 (100%) | 58 (100%) |
El análisis estadístico χ 2 no mostró diferencias significativas, siendo la p=0,3.
Tabla 3. Tabla de contingencia que muestra la distribución del grado de afectación tumoral (categoría N) en los 2 grupos
| Grupo | Total | ||
| Control | PDTR | ||
| N | |||
| 0 | 9 (31%) | 13 (44,8%) | 22 (37,9%) |
| 1 | 0 (0%) | 7 (24,1%) | 7 (12,1%) |
| 2 | 14 (48,3%) | 7 (24,1%) | 21 (36,2%) |
| 3 | 6 (20,7%) | 2 (6,9%) | 8 (13,8%) |
| Total | 29 (100%) | 29 (100%) | 58 (100%) |
El análisis estadístico χ 2 mostró unas diferencias significativas entre ambos grupos, siendo la p=0,007.
La presencia de afectación metastásica (categoría M, tabla 4) en el momento del diagnóstico no mostró diferencias entre ambos grupos (p=0,773).
Tabla 4. Tabla de contingencia que muestra la distribución de la afectación metastásica (categoría M) en el grupo PDTR y control
| Grupo | Total | ||
| Control | PDTR | ||
| M | |||
| 0 | 20 (69%) | 21 (74,2%) | 41 (70,7%) |
| 1 | 9 (31%) | 8 (27,6%) | 17 (29,3%) |
| Total | 29 (100%) | 29 (100%) | 58 (100%) |
Sin diferencias significativas (p=0,773).
Al evaluar la estadificación TNM de manera global (tabla 5) tampoco se encontraron diferencias significativas, aunque el grupo PDTR mostró más casos con estadios I y II respecto al grupo control (10 en el PDTR frente a 5 en el grupo control), así como menos casos con estadio III o IV (19 en el PDTR frente a 24 en el grupo control). A pesar de estas diferencias no se observó significación estadística (p=0,134).
Tabla 5. Tabla de contingencia que muestra la distribución del cribado en ambos grupos (PDTR y control) teniendo en cuenta las categorías TNM de manera global
| Grupo | Total | ||
| Control | PDTR | ||
| E | |||
| I–II | 5 (17,2%) | 10 (34,5%) | 15 (25,9%) |
| IIIA | 8 (27,6%) | 2 (6,9%) | 10 (17,2%) |
| IIIB | 7 (24%) | 9 (31%) | 16 (27,6%) |
| IV | 9 (31%) | 8 (27,6%) | 17 (29,3%) |
| Total | 29 (100%) | 29 (100%) | 58 (100%) |
No se observaron diferencias significativas (p=0,134).
Cumplimiento y eficacia del programa PDTR del cáncer de pulmón
En primer lugar se midieron los intervalos desde la llegada del paciente a la primera visita por sospecha clínica de cáncer de pulmón hasta la realización de la TC, la confirmación histológica y el inicio del tratamiento. La media de tiempo desde la primera visita al inicio del tratamiento en el grupo PDTR fue de 26,72 días (DT, 13,6), en el grupo control fue de 84 días (DT, 53 días). La mediana para este mismo intervalo fue de 26 días en el grupo PDTR (rango: 8–59 días) frente a los 73 días en el grupo control (rango: 17–261 días) (tabla 6).
Tabla 6. Medida de los intervalos de tiempo encontrados desde la primera visita con sospecha clínica de cáncer de pulmón al estudio con tomografía computarizada (TC) o al inicio del tratamiento, desde la confirmación diagnóstica histológica hasta el inicio del tratamiento (DXAP-tratamiento) y desde el estudio TC al inicio de tratamiento (TC-tratamiento)
| Primera visita-TC | Primera visita-tratamiento | DXAP-tratamiento | TC-tratamiento | |
| Control | ||||
| Mediana | 19 | 73 | 37 | 47 |
| Rango | 1–107 | 17–261 | 0–112 | 7–229 |
| Media | 30,55 | 84,17 | 44,34 | 61,24 |
| DT | 30,747 | 53,055 | 31,053 | 48,911 |
| PDTR | ||||
| Mediana | 2,00 | 26,00 | 13,00 | 22,00 |
| Rango | 0–12 | 8–59 | 0–38 | 0–53 |
| Media | 2,86 | 26,72 | 15,59 | 23,17 |
| DT | 3,215 | 13,585 | 9,519 | 11,887 |
DT: desviación típica.
Intervalos de tiempo
Hay una reducción del tiempo significativa para todos los intervalos de tiempo estudiados (desde la llegada del paciente hasta el diagnóstico, la visita pretratamiento y el inicio del tratamiento), y son inferiores en el grupo PDTR. El estudio estadístico fue doble, con una t de Student y con un test no paramétrico (U de Mann-Whitney) debido a que la variable tiempo mostraba una clara asimetría positiva y no cumplía suficientes criterios para establecer un estudio paramétrico con patrón de distribución normal. En ambos casos los resultados fueron significativos con una p<0,001.
DiscusiónEl pronóstico del cáncer de pulmón está condicionado por diferentes variables. Su escasa sintomatología hasta estadios avanzados y su rápida evolución, junto con la coexistencia de patologías concomitantes como son las relacionadas con el tabaco (enfermedad pulmonar obstructiva crónica y enfermedades cardiovasculares), hacen que su tratamiento sea de difícil manejo por un incremento de la morbilidad y la mortalidad de los pacientes4. La variabilidad individual del efecto de los carcinógenos como el tabaco es conocida y esto es patente incluso entre ambos sexos. Recientes estudios han descrito mayor susceptibilidad al efecto carcinogénico del tabaco en las mujeres16.
Una de las variables que condiciona el pronóstico es la estirpe histológica. Así pues, se diferencia el oat-cell o CPCP por su peor pronóstico del resto, cáncer de pulmón de célula no pequeña (CPCNP)17–19, incluyendo el carcinoma escamoso o epidermoide, adenocarcinoma, carcinoma de célula grande y carcinomas combinados, con sus diferentes grados de diferenciación20. El tipo histológico más frecuente en varones ha sido el escamoso, aunque estudios recientes muestran un incremento de incidencia del adenocarcinoma, el más frecuente en las mujeres21. En nuestro estudio se ha encontrado con mayor frecuencia el carcinoma escamoso en los varones y el adenocarcinoma en las mujeres.
La estadificación exacta del cáncer de pulmón, valorada conjuntamente con la comorbilidad asociada y la estirpe histológica, es esencial para definir operabilidad y establecer un tratamiento adecuado. La estadificación entre el grupo PDTR y el grupo control mostró algunas diferencias reseñables:
- Se encontraron T mayores en el grupo PDTR, cosa que se podría explicar por la exclusión de los casos dudosos o con nódulos subcentimétricos sometidos a control. Por otro lado, teniendo en cuenta que el PDTR busca diagnosticar con certeza la enfermedad en el menor tiempo posible y no hacerlo de manera precoz, no es de extrañar que si se incluyen sujetos con radiografías sospechosas de cáncer de pulmón o sintomáticos, se encuentren tumores en estadios avanzados. Aún así, esta diferencia no fue significativa.
- Por otro lado, se encontraron diferencias en cuanto a la afectación ganglionar, con una p=0,007 a favor del grupo PDTR, donde los casos sin afectación ganglionar (N0) representaban el 44,77% de los pacientes. Este dato hay que analizarlo con precaución. Es cierto que los rangos desde la llegada del paciente hasta el momento del diagnóstico en el grupo control son amplios (17–261 días) pero la mediana es de 26 días para PDTR y 73 días para el grupo control. Realmente, la diferencia es de menos de 2 meses. Sería muy cuestionable pensar si en tan poco tiempo, la evolución de la enfermedad puede justificar las diferencias en el N o, por el contrario, este dato se debe a una muestra pequeña. En cualquier caso, analizando globalmente todos los valores del TNM no se observó significación estadística. Aunque en el grupo PDTR aparecieron más casos en estadios I y II y menos con estadios más avanzados (III y IV), esta diferencia no fue significativa.
Al evaluar los intervalos de tiempo desde la llegada del paciente con sospecha clínica de cáncer de pulmón hasta su diagnóstico y tratamiento, se concluye que el PDTR del cáncer de pulmón establecido en nuestro hospital ha conseguido reducir el intervalo de tiempo para diagnosticar y tratar el cáncer de pulmón con una media y mediana de 26 días. Al comparar con el grupo control, la reducción de tiempo fue significativa para todos los intervalos de tiempo estudiados: El intervalo “primera visita-inicio de tratamiento” en el grupo control fue de 84 días (DT, 53 días) y en el grupo PDTR de 26,72 días (DT, 13,6 días). La mediana para este mismo intervalo en el grupo control fue de 73 días (rango: 17–261) frente a 26 en el PDTR (rango: 8–59 días).
Por la gran prevalencia del cáncer de pulmón, su pobre esperanza de vida y la ausencia de clínica en estadios iniciales, hay el beneficio potencial del desarrollo de un programa de detección precoz. Actualmente se está valorando y discutiendo la utilidad del cribado con TC, tema muy debatido ya que no hay evidencia científica de que sea clínicamente efectivo en la reducción de la mortalidad por cáncer de pulmón4–10. En ausencia de un sistema de cribado científicamente probado, se analizan otras vías que pueden influir en la supervivencia, como evaluar el efecto que tiene reducir el retraso en el tiempo del diagnóstico y tratamiento. Algunos estudios sugieren que determinados grupos, fundamentalmente en los estadios iniciales donde la cirugía puede ser curativa, muestran mayor supervivencia al disminuir el tiempo en el que se diagnostica y se inicia el tratamiento del cáncer de pulmón4,9,10.
El tiempo transcurrido en el que se realizó el trabajo es insuficiente para poder evaluar el posible efecto que pudiera tener la reducción del tiempo en la supervivencia de los pacientes incluidos. Otra limitación de nuestro estudio es que, al tratarse de un trabajo preliminar, se han incluido pocos pacientes para poder inferir conclusiones en este aspecto. Se plantea la duda de si con una mayor muestra se podrían encontrar diferencias en la supervivencia atribuibles a una menor evolución de la enfermedad secundaria al diagnóstico y tratamiento rápido. Lo que es indudable, es la mejoría en la calidad de vida que condiciona al paciente el hecho de reducir el período en el proceso diagnóstico y terapéutico. Asimismo, sería interesante realizar un análisis de costes relacionado con la reducción de la estancia hospitalaria que conlleva.
En conclusión, con el programa PDTR del cáncer de pulmón se ha obtenido una disminución significativa de tiempo desde la llegada del paciente con sospecha clínica de cáncer de pulmón hasta la confirmación diagnóstica y el inicio de tratamiento (de 84 a 26 días de media para el grupo control y PDTR, respectivamente). Así pues, el programa PDTR del cáncer de pulmón representa una herramienta útil en el manejo del paciente con neoplasia pulmonar.
La posibilidad de una potencial mejoría en la supervivencia atribuible a la disminución del tiempo de evolución de la enfermedad resulta muy dudosa y requiere de estudios específicos con mayores muestras y tiempo de seguimiento.
AgradecimientosA todos los miembros del comité de tumores de cáncer de pulmón por su trabajo conjunto en el manejo del paciente y en el establecimiento de guías y protocolos de actuación.
Declaración de conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Autor para correspondencia.
E. Granell
Dirección: egranell@santpau.es