Suplemento “Patología Intersticial Pulmonar”
Más datosLas enfermedades autoinmunes sistémicas son un grupo heterogéneo y complejo de entidades. Entre sus complicaciones pulmonares destaca la afectación intersticial, que se manifiesta con los mismos patrones radiopatológicos descritos en las neumonías intersticiales idiopáticas. La tomografía computarizada de alta resolución es la técnica de imagen de referencia, que permite identificar, clasificar y determinar la extensión de la enfermedad pulmonar, aportando datos pronósticos. En este grupo de procesos el patrón de afectación más común es el de neumonía intersticial no específica. La colaboración del radiólogo con otros especialistas resulta esencial tanto para alcanzar el diagnóstico correcto como para un manejo adecuado e integral del paciente.
Systemic autoimmune diseases comprise a complex, heterogeneous group of entities. Noteworthy among the pulmonary complications of these entities is interstitial involvement, which manifests with the same radiopathologic patterns as in idiopathic interstitial pneumonia. High-resolution computed tomography is the gold-standard imaging technique; it enables us to identify and classify the disease and to determine its extent, providing useful information about the prognosis. In this group of processes, the most common pattern of presentation is non-specific interstitial pneumonia. It is essential for radiologists to work together in collaboration with other specialists to reach the correct diagnosis and enable appropriate, integrated treatment.
Las enfermedades autoinmunes sistémicas (EAS) constituyen un grupo diverso de procesos cuyo denominador común es la presencia de autoanticuerpos circulantes capaces de causar daño orgánico. Las más importantes son las enfermedades del tejido conectivo o conectivopatías: artritis reumatoide (AR), esclerosis sistémica (ES), síndrome de Sjögren (SS), miositis inflamatorias idiopáticas (MII), enfermedad mixta del tejido conectivo (EMTC) y lupus eritematoso sistémico (LES). Las vasculitis sistémicas con anticuerpos anticitoplasma de neutrófilo (ANCA) también se han incorporado al espectro de las EAS.
En todas ellas la afectación pulmonar es común, aunque con prevalencia variable; la presencia de enfermedad pulmonar intersticial (EPI) tiene impacto tanto pronóstico como terapéutico. Pueden estar implicados otros componentes del pulmón (vía aérea, espacio alveolar, vasos) y compartimentos extrapulmonares del tórax (pleura, pericardio, miocardio, músculos de la pared torácica, esófago), lo que origina un amplio abanico de manifestaciones1–3.
La TC desempeña un papel indispensable en el diagnóstico y el manejo de las EPI asociadas a EAS (EPI-EAS), que debe hacerse en el seno de un equipo multidisciplinar3.
Este artículo revisa las manifestaciones radiológicas de estas enfermedades y su abordaje diagnóstico.
Contexto clínicoLa presentación clínica de las EPI-EAS es muy variada: desde pacientes asintomáticos a otros con disnea grave. La asociación de conectivopatía y EPI es más común en la esclerodermia y en las miopatías inflamatorias idiopáticas2. Los avances técnicos de la TC y su uso generalizado han incrementado la detección de la afectación pulmonar, que puede aparecer en cualquier momento de la historia natural de la enfermedad. Se describen 3 escenarios: a) en pacientes con una EAS establecida (lo más habitual); b) como primera manifestación de una conectivopatía oculta (en el 20-30% de los casos); c) asociada a ciertas características autoinmunes, pero sin una entidad definida, la denominada neumopatía intersticial con rasgos autoinmunes o interstitial pneumonia with autoinmune features (IPAF)1–4.
La prevalencia estimada de EPI en las diferentes conectivopatías y las principales manifestaciones extratorácicas de cada enfermedad se resumen en la tabla 15.
Prevalencia de EPI y manifestaciones extratorácicas en las principales conectivopatías
| Conectivopatía | Prevalencia de EPI | Síntomas y signos |
|---|---|---|
| AR | Detectable en TCAR: 19-56%Clínicamente evidente: 10-30% | Sinovitis poliarticularNódulos reumatoideos cutáneos |
| ES | Detectable: hasta el 75%Clínicamente relevante: 25-45% | Fenómeno de Raynaud, esclerodactilia, úlceras digitales, telangiectasia, engrosamiento cutáneo,síntomas gastrointestinales |
| SS | 10-30% | Síndrome secoAgrandamiento parotídeo |
| MII | 30-50%80% en el síndrome antisintetasaClínicamente relevante: 17-35% | Debilidad muscular proximal simétrica, manos de mecánico, signo de Gottron, rash en heliotropo, «signo del chal» |
| EMTC | 20-85% | Edema de manos, sinovitis, miositis, acroesclerosis, fenómeno de Raynaud |
| LES | Detectable: 30-70%Clínicamente evidente: 3-11% | Rash malar o fotosensibilidad,serositis, úlceras orales, alopecia |
AR: artritis reumatoide; EMTC: enfermedad mixta del tejido conectivo; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; LES: lupus eritematoso sistémico; MII: miopatía inflamatoria idiopática; SS: síndrome de Sjögren; TCAR: tomografía computarizada de alta resolución.
Las pruebas de función respiratoria (PFR) pueden mostrar un patrón restrictivo, junto con disminución de la capacidad de difusión del monóxido de carbono (DLCO). Tienen utilidad en el seguimiento, pero su sensibilidad es baja en fases iniciales2.
El estudio de autoanticuerpos séricos forma parte del proceso diagnóstico de las EAS y de la valoración de pacientes con sospecha de neumonía intersticial idiopática (NII)1,3. Ciertos perfiles de autoanticuerpos son característicos de una enfermedad concreta y pueden sugerir la afectación de determinados órganos. Las principales asociaciones se recogen en la tabla 25,6.
Autoanticuerpos en las conectivopatías
| Conectivopatía | Autoanticuerpo |
|---|---|
| Artritis reumatoide | FR |
| Anti-CCP: asociación con EPI-AR | |
| Esclerodermia | ANA |
| Anticentrómero: asociación con HTP (enfermedad limitada) | |
| Anti-Scl 70 (anti-ADN topoisomerasa I): asociación con EPI (enfermedad difusa) | |
| Anti-ARN polimerasa I, III | |
| Síndrome de Sjögren | ANA |
| Anti-Ro 60 (SSA), anti-Ro 52 (SSA), anti-La (SSB) | |
| Miositis inflamatoria idiopática | ANA |
| Ac. específicos de miositis: | |
| Ac antisintetasa (Jo-1, PL7, PL12, EJ, OJ) | |
| Anti-MDA5: asociado con EPI rápidamente progresiva | |
| Anti-Mi2 | |
| Anti-TIF1-gamma, anti-NXP2: DM asociada con neoplasias | |
| Ac. asociados a miositis: anti-PM-Scl, anti-Ro 52, anti-ku | |
| EMTC | ANA |
| Anti-RNP (criterio diagnóstico de EMTC) | |
| Lupus eritematoso sistémico | ANA: en el 95% |
| Anti-dsDNA: correlación con la actividad de la enfermedad | |
| Anti-Ro 60, anti-Ro 52, Anti-La: afectación cutánea | |
| Anti-Sm: ac. más específico de LES (presente en 5-30%) | |
| Anti-RNP (en 20-50%) |
Ac: anticuerpo; ADN: ácido desoxirribonucleico; ANA: anticuerpos antinucleares; ARN: ácido ribonucleico; CCP: péptido citrulinado cíclico; DM: dermatomiositis; dsDNA: ADN de doble cadena; EMTC: enfermedad mixta del tejido conectivo; EPI-AR: enfermedad pulmonar intersticial asociada a artritis reumatoide; FR: factor reumatoide; HTP: hipertensión arterial pulmonar; LES: lupus eritematoso sistémico; MDA5: melanoma differentiation-associated gene 5; NXP2: proteína 2 de matriz nuclear; RNP: ribonucleoproteínas; Sm: Smith; SSA: Sjögren's syndrome related antigen A; SSB: Sjögren's syndrome related antigen B; TIF: factor transcripcional intermediario.
La TC de alta resolución (TCAR) es el método de imagen de referencia para el diagnóstico de las EPI. Permite confirmar la afectación intersticial, definir el patrón morfológico y la extensión5. Su uso rutinario en el cribado solo se ha propuesto en enfermedades con alta prevalencia de afectación pulmonar intersticial, como la esclerodermia y el síndrome antisintetasa. Una proporción variable de pacientes asintomáticos o paucisintomáticos presenta alteraciones intersticiales leves, por lo que la TCAR permite identificar estadios subclínicos. La radiografía de tórax es poco sensible para detectar EPI, pero tiene utilidad en el seguimiento y en la identificación de complicaciones pulmonares. En los últimos años se ha propuesto la ecografía pulmonar como método de detección y monitorización de EPI en las conectivopatías, especialmente en la esclerodermia2,7.
Patrones radiopatológicosLos patrones radiológicos e histológicos de las EPI-EAS son superponibles a los que se han descrito en las NII8. En las conectivopatías el más común es el patrón de neumonía intersticial no específica (NINE), seguido del patrón de neumonía intersticial usual (NIU); también pueden aparecer otros patrones como el de neumonía organizada (NO), neumonía intersticial linfoide (NIL) y el de daño alveolar difuso (DAD). La tabla 3 muestra la prevalencia relativa de estos patrones en las diferentes conectivopatías9–11.
Prevalencia relativa de los patrones de EPI en las conectivopatías
| Patrón de EPI | ES | AR | LES | MII | SS | EMTC |
|---|---|---|---|---|---|---|
| Incidencia global | +++ | ++ | + | +++ | ++ | ++ |
| NINE | +++ | ++ | ++ | +++ | +++ | ++ |
| NIU | + | +++ | + | + | + | + |
| NO | + | ++ | ± | +++ | ± | + |
| NIL | ± | ± | ± | ± | ++ | ± |
AR: artritis reumatoide; EMTC: enfermedad mixta del tejido conectivo; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; LES: lupus eritematoso sistémico; MII: miopatía inflamatoria idiopática; NIL: neumonía intersticial linfoide; NINE: neumonía intersticial no específica; NIU: neumonía intersticial usual; NO: neumonía organizada; SS: síndrome de Sjögren; +++: más común; ++: común; +: reconocido pero infrecuente; ±: raro.
- –
Patrón de NINE: se caracteriza por opacidades en vidrio deslustrado, que suelen asociarse a bronquiectasias/bronquiolectasias y reticulación leve. Predominan en los lóbulos inferiores, a menudo con distribución peribroncovascular y simétrica. La ausencia de afectación de la región subpleural es típica y aparece aproximadamente en el 60% de los casos12. La panalización suele estar ausente o ser limitada y se presenta en fases avanzadas9,10.
- –
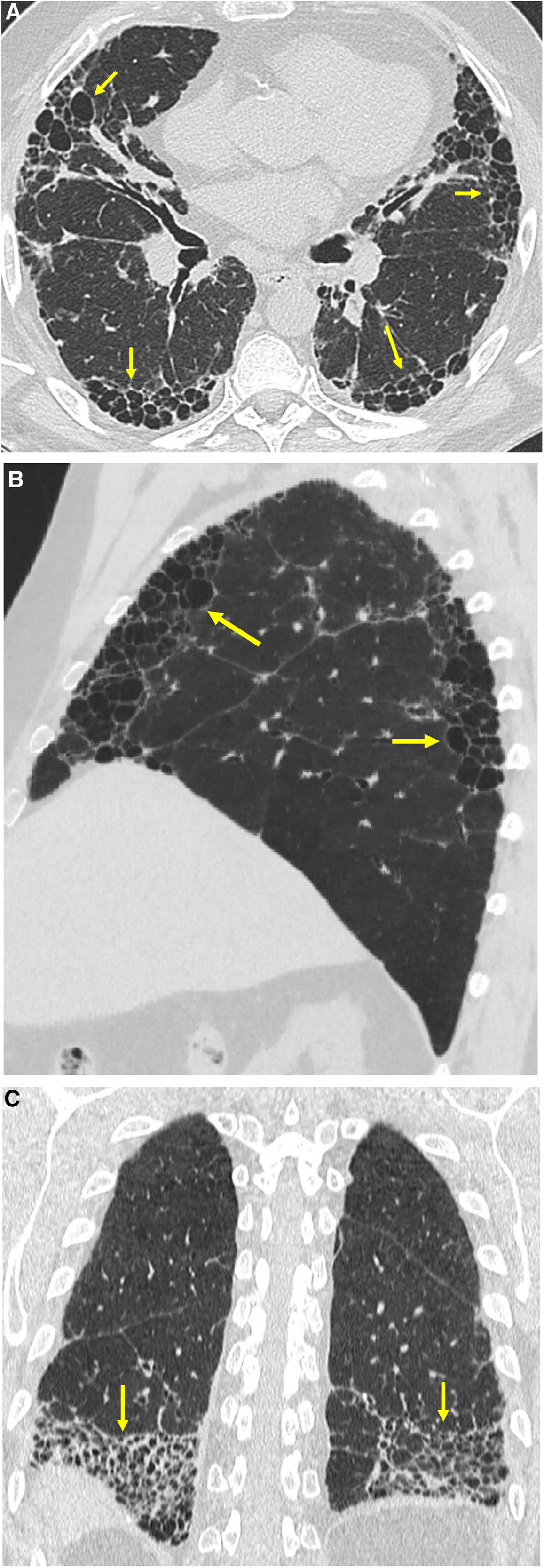
Patrón de NIU: cursa con reticulación, bronquiectasias de tracción y quistes de panal, de distribución periférica y con predominio basal8–11. Puede haber vidrio deslustrado poco extenso coincidente con áreas de reticulación. Chung et al. han descrito 3 signos cuya presencia aumenta la sospecha de una conectivopatía: el signo del lóbulo superior anterior (los hallazgos fibróticos se sitúan en la región anterior de los lóbulos superiores, con mínima afectación de las regiones posteriores de dichos lóbulos), la panalización exuberante (cuando ocupa más del 70% de la extensión de los hallazgos fibróticos) y el signo del borde recto (delimitación nítida entre la fibrosis de los lóbulos inferiores y el pulmón sano en el eje craneocaudal). Los 2 últimos son los más específicos13 (fig. 1).
- –
Patrón de NO: aparecen consolidaciones bilaterales de distribución periférica o peribronquial, más frecuentes en los lóbulos inferiores. El patrón perilobulillar (opacidades poligonales limitando los lobulillos pulmonares secundarios) y el signo del halo invertido sugieren el diagnóstico. Otras manifestaciones incluyen lesiones nodulares o seudonodulares, opacidades en vidrio deslustrado y el signo del halo. La rápida respuesta al tratamiento esteroideo es característica8–11.
- –
Patrón de NIL: tiene apariencia variable; suele presentarse con opacidades en vidrio deslustrado de predominio basal y quistes aéreos de pared fina con distribución peribroncovascular9,11.
- –
Patrón de DAD: muestra opacidades en vidrio deslustrado combinadas con consolidaciones o patrón en empedrado. La distribución es simétrica y gravitacional. Puede evolucionar a fibrosis (generalmente en semanas) con reticulación y bronquiectasias de tracción de predominio anterior y superior3.
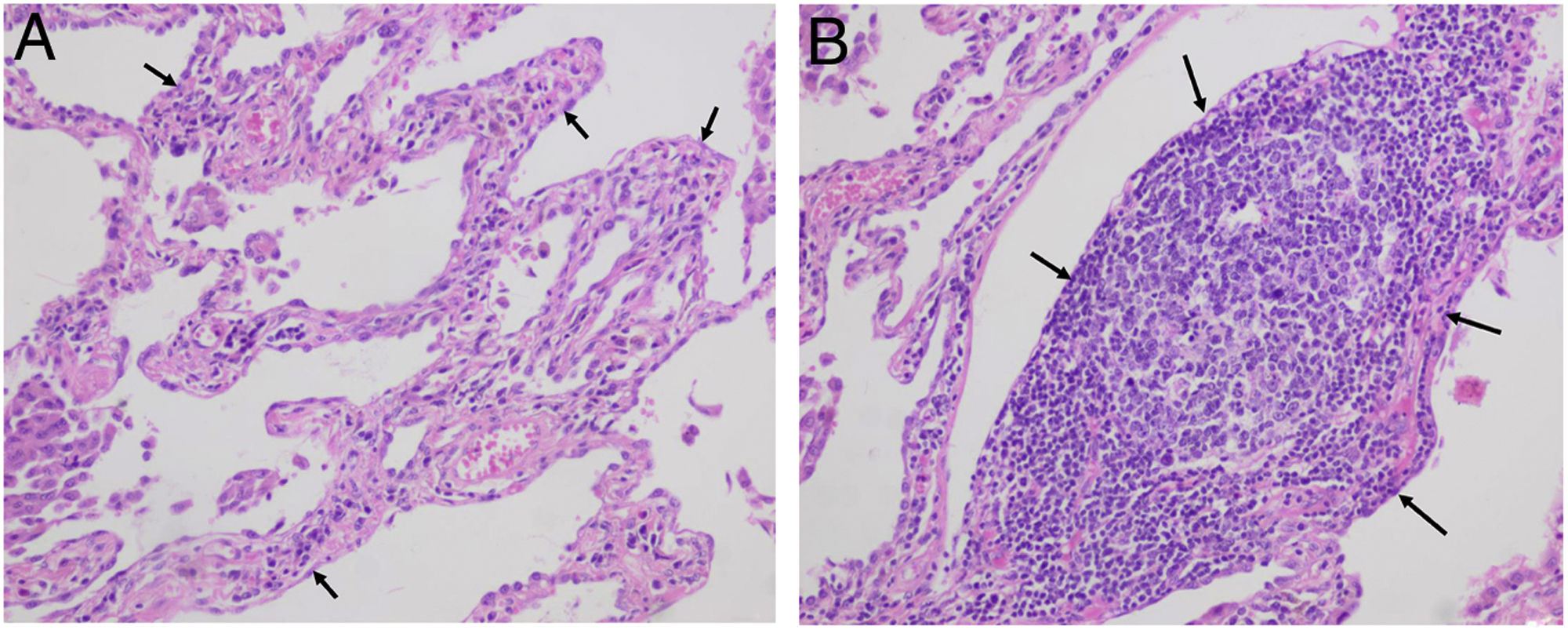
El papel de la biopsia quirúrgica es incierto ante una EAS establecida, ya que habitualmente no aporta información diagnóstica o pronóstica adicional. Por ello, debe reservarse para aquellos casos con dudas diagnósticas tras la discusión multidisciplinar5,14. En general, los hallazgos radiopatológicos no permiten diferenciar los patrones causados por una NII de aquellos asociados a una EAS. Sin embargo, además de los signos previamente mencionados, existen algunos rasgos que pueden sugerir una conectivopatía, en especial cuando aparecen en un contexto atípico para fibrosis pulmonar idiopática (FPI), como puede ser su presentación en mujeres menores de 50 años. Entre dichos rasgos se encuentran la combinación de patrones (p. ej., NINE y NO), la afectación torácica multicompartimental (tabla 4), así como ciertos hallazgos histológicos (agregados linfoides con centros germinales, infiltración plasmocitaria prominente o colágeno perivascular denso)1,3,14 (fig. 2).
Manifestaciones torácicas (no EPI) en las conectivopatías (afectación multicompartimental)
| Manifestación | ES | AR | LES | MII | SS | EMTC |
|---|---|---|---|---|---|---|
| Enfermedad de la vía aéreaa | – | +++ | ± | – | ++ | – |
| Derrame/engrosamiento pleural | – | ++ | +++ | – | – | + |
| Hemorragia alveolar | – | – | +++ | – | – | − |
| Neumonía aspirativa / infección pulmonar | ++ | + | +++ | ++ | ± | + |
| HTP | +++ | ± | + | ± | ± | ++ |
| Nódulosb | – | +++Necrobióticos | – | – | +AmiloidosisLinfoma MALT | – |
| Patología de músculos respiratorios o de pared torácica | ++ | – | ++ | ++ | − | + |
| Dilatación esofágica | +++ | – | – | + | ± | + |
| Enfermedad cardiaca/pericárdica | + | ++ | +++ | + | – | + |
| Lesión osteoarticular en la caja torácica | – | +++ | – | – | – | – |
AR: artritis reumatoide; EMTC: enfermedad mixta del tejido conectivo; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; HTP: hipertensión arterial pulmonar; LES: lupus eritematoso sistémico; MALT: tejido linfoide asociado a mucosas; MII: miopatía inflamatoria idiopática; SS: síndrome de Sjögren; +++: muy frecuente; ++: frecuente; +: infrecuente; ±: rara; –: ausente.
Consiste en una EAS de carácter inflamatorio crónico, con afectación simétrica de articulaciones pequeñas de las manos. Es la conectivopatía más frecuente (1% de la población adulta en países desarrollados); se da más en mujeres (3:1). La afectación respiratoria representa una de las manifestaciones extraarticulares más comunes y una de las causas más habituales de morbimortalidad15. Aunque la patogenia no está completamente aclarada, el pulmón parece el órgano donde se inicia el proceso autoinmune. La inhalación de tabaco, toxinas y las infecciones pulmonares podrían iniciar una reacción inflamatoria local y promover la citrulinación de proteínas en los pulmones (conversión de arginina a citrulina). Esta modificación de proteínas activaría la respuesta inmunitaria, la aparición de tejido linfoide en la pared bronquial y la formación de anticuerpos: factor reumatoide (FR) y anticuerpos antipéptidos citrulinados (APCC)16,17.
La EPI asociada a AR (EPI-AR) suele detectarse en los primeros 5 años del diagnóstico de la AR, pero en el 10-20% de los casos puede preceder a las manifestaciones articulares5,15–17. Su prevalencia varía según las publicaciones, debido a que los estudios incluyen poblaciones no homogéneas y diferentes métodos de imagen. Con TCAR oscila entre el 19 y el 56%18, aunque solo el 10-30% de los pacientes desarrolla una EPI clínicamente significativa.
Los principales factores de riesgo para desarrollar EPI-AR son el tabaquismo y la presencia de APCC. Otros predictores incluyen: sexo masculino (4 veces más frecuente en hombres), títulos elevados de FR, inicio de la AR en edad avanzada y enfermedad articular grave y erosiva5,15–17.
El tipo histológico-radiológico más frecuente es el patrón de NIU (60%), seguido del patrón de NINE (1/3) y de la NO (11%). Este hecho diferencia la EPI-AR del resto de las conectivopatías, en las que el patrón predominante es el de NINE. Son más raros el patrón de NIL, el de DAD y la neumonía intersticial descamativa (NID)3,15,16,18. La mayoría de los pacientes con manifestaciones clínicas importantes presenta patrón de NIU.
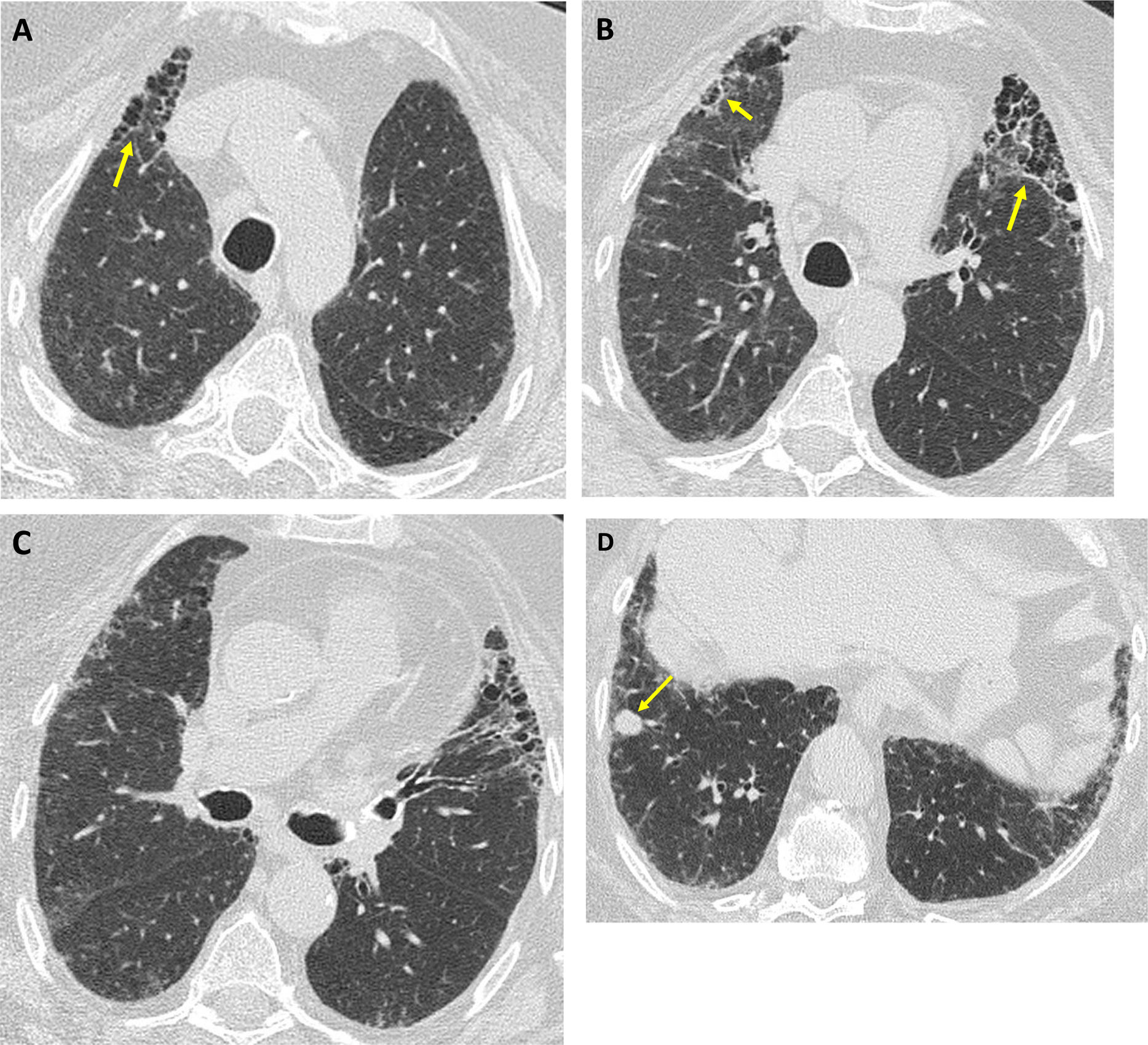
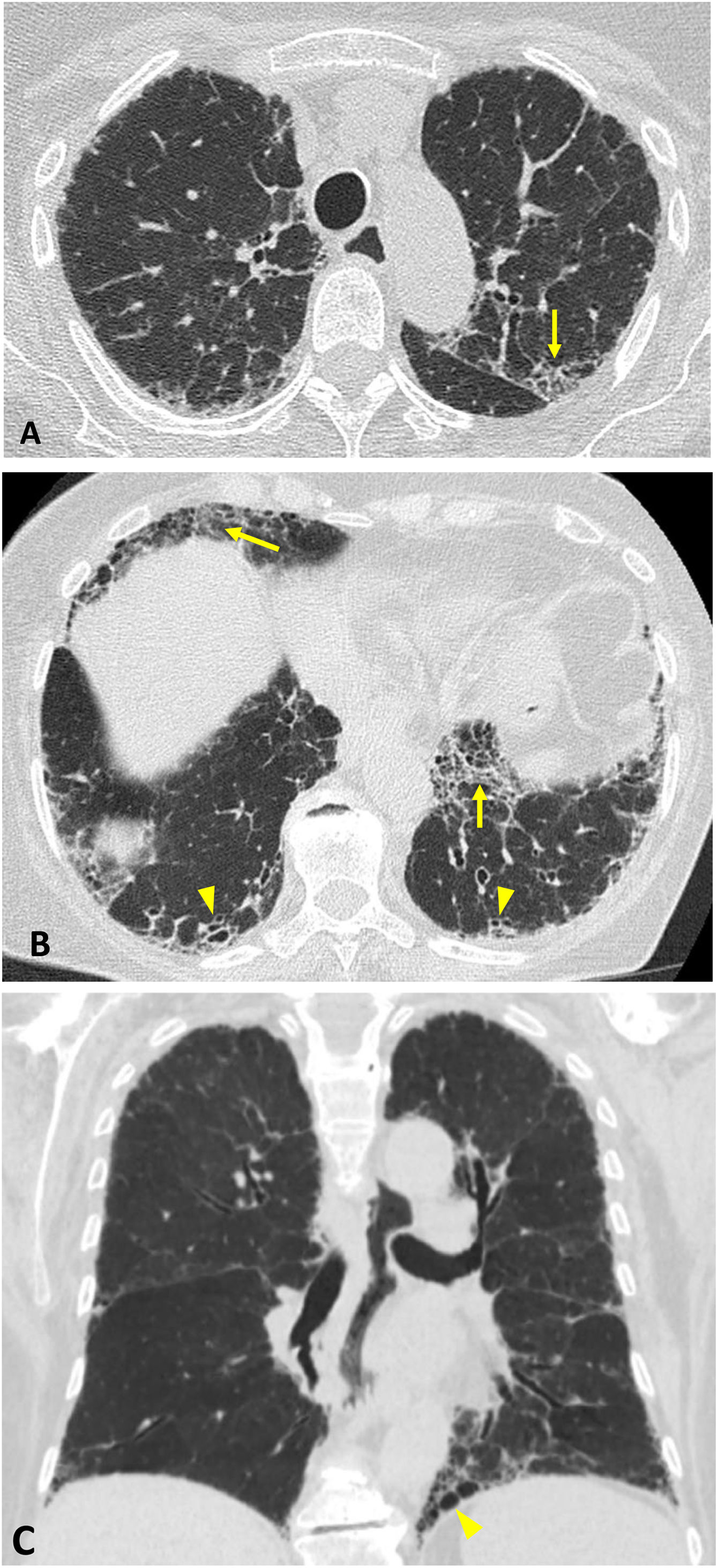
Las guías para el diagnóstico de la FPI son útiles en el diagnóstico de patrones fibróticos en pacientes con EPI-AR19,20. Jacob et al. han propuesto 2 modificaciones a estas guías debido a las particularidades del patrón de NIU en la AR, con el fin de diagnosticar correctamente al mayor número de pacientes. La primera es aceptar que los hallazgos fibróticos (panal, reticulación y bronquiectasias de tracción) pueden localizarse preferentemente en regiones periféricas de campos pulmonares superiores y medios (fig. 3). La segunda propone eliminar el patrón en mosaico como hallazgo inconsistente con el diagnóstico de NIU que haría considerar un diagnóstico alternativo. Esta modificación se justifica por la afectación frecuente de la vía aérea en la AR (bronquiectasias, bronquiolitis obliterante o folicular) y el patrón en mosaico consecuente21.
Artritis reumatoide. Imágenes axiales de TCAR en campos pulmonares superior (A), medio (B y C) e inferior (D). Patrón de neumonía intersticial usual. Los cambios fibróticos predominan en los lóbulos superiores (flechas en A y B). Nódulo reumatoide subpleural en el lóbulo inferior derecho (flecha en D).
La asociación de EPI-AR con el enfisema es bien conocida, dada la alta prevalencia de pacientes fumadores; además, se ha descrito enfisema en el 27% de los pacientes con EPI-AR nunca fumadores. El enfisema se asocia a peor pronóstico tanto en fumadores como no fumadores5,18,22.
La EPI es la segunda causa de muerte en la AR, tras la enfermedad cardiovascular15. A pesar de que las tasas de mortalidad global han disminuido, la mortalidad por EPI-AR se ha incrementado en los últimos 25 años17. Los aspectos radiológicos que implican peor pronóstico son el patrón de NIU y la extensión de la fibrosis. El patrón de NIU asocia una supervivencia media de 4 años y pronóstico similar a la FPI16, mientras que los pacientes con patrón no-NIU tienen un pronóstico significativamente mejor17. Jacob et al. han cuantificado la fibrosis en EPI-AR con 2 métodos: uno visual y otro informático (Computed Aided Lung Informatics for Pathology Evaluation and Rating [CALIPER]); han comparado ambos y los han correlacionado con el pronóstico21.
No existen protocolos recomendados para la detección de la EPI-AR, pero se ha sugerido realizar PFR y TCAR a los pacientes con síntomas clínicos o con factores de riesgo17.
Esclerosis sistémica o esclerodermiaEnfermedad autoinmune multisistémica más común en mujeres, con 2 formas clínicas según el grado de lesión cutánea: limitada (80%) y difusa (20%); esta última de curso más agresivo, con afectación cutánea extensa y de órganos internos (riñón, corazón, tubo digestivo y pulmón). Histológicamente se caracteriza por la tríada de inflamación, fibrosis con aumento de colágeno y daño vascular9,11,23.
La EPI y la hipertensión pulmonar (HTP) son los hallazgos torácicos principales; la primera predomina en las formas difusas y la segunda tiene mayor prevalencia en las formas limitadas. La EPI ocurre en la mayoría de los pacientes (más del 60%) y tiene un curso variable. La HTP se da en el 20% y suele asociarse a enfermedad pulmonar grave, aunque puede aparecer aislada23,24.
La mortalidad secundaria a enfermedad pulmonar ha aumentado en los últimos años debido a la menor mortalidad por causa nefrológica relacionada con un mejor manejo de la enfermedad renal25. La EPI es responsable del 40% de las muertes a los 10 años del inicio de la enfermedad23.
Ciertos factores se relacionan con el desarrollo o progresión de la EPI: forma difusa de ES, diagnóstico reciente de la conectivopatía, edad avanzada al diagnóstico, sexo masculino, tabaquismo, presencia de anti-Scl 70 y reflujo gastroesofágico23,24. El diagnóstico precoz es fundamental para establecer el pronóstico e instaurar un tratamiento adecuado, por lo que todo paciente con ES debe ser evaluado desde el punto de vista respiratorio independientemente de la extensión sistémica de la enfermedad24,25.
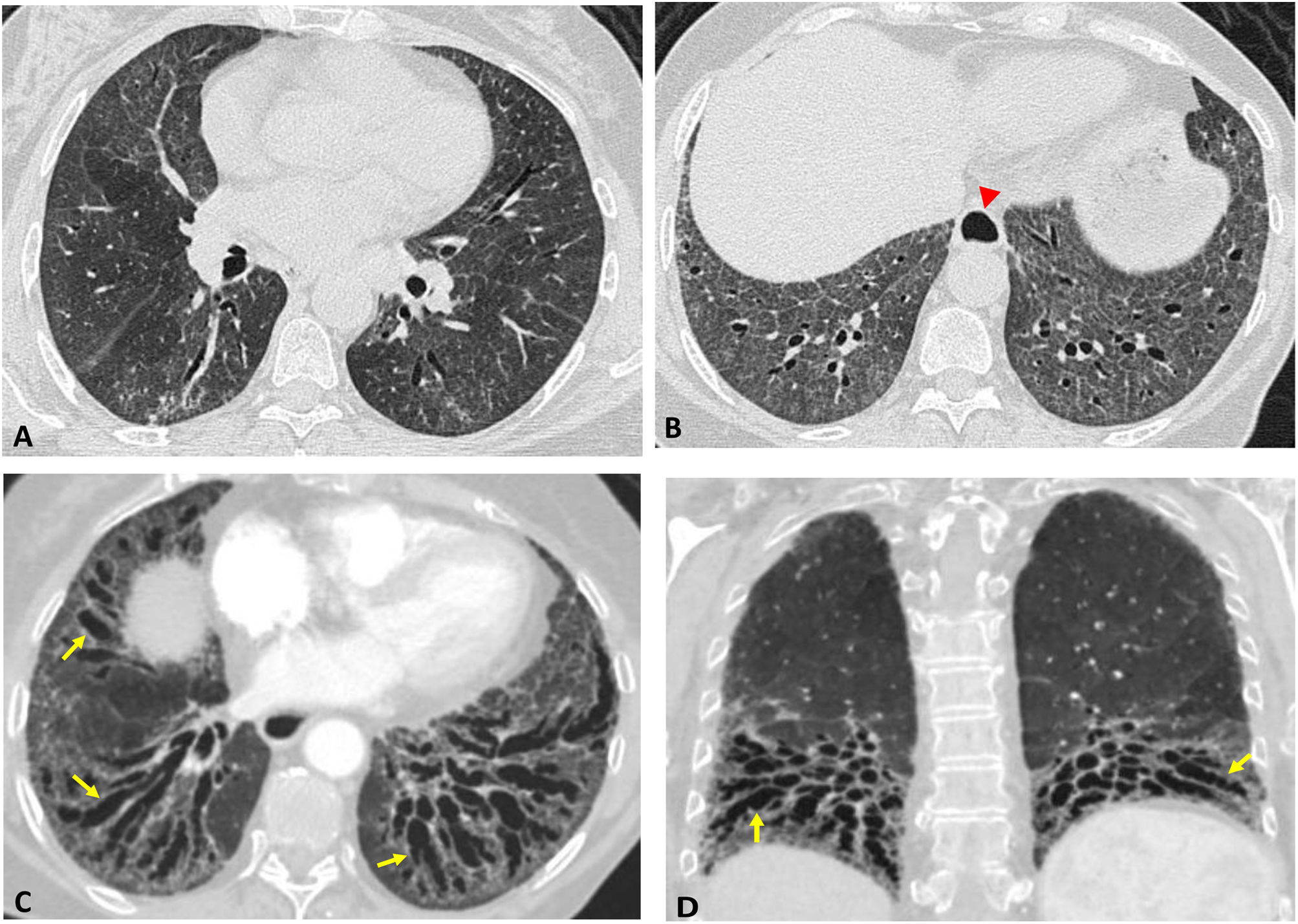
En la TCAR casi un 50% de los pacientes presenta hallazgos al inicio de la enfermedad24. El patrón de NINE constituye la manifestación más común (77%), muy por delante del patrón de NIU (8%) o del de NO (1%); es frecuente la combinación de patrones NINE y NIU. La fibroelastosis pleuropulmonar cuando se presenta conlleva un peor pronóstico23,26.
En pacientes con patrón de NINE la TCAR ayuda a diferenciar cambios inflamatorios reversibles (áreas de vidrio deslustrado puras) correspondientes a una NINE de tipo celular frente a hallazgos sugestivos de una NINE fibrótica irreversible (reticulación asociada al vidrio deslustrado, bronquiectasias de tracción, distorsión, pérdida de volumen o panal) (fig. 4)23,27.
Esclerodermia. TCAR inicial. Imágenes axiales (A y B): patrón de neumonía intersticial no específica, con vidrio deslustrado predominante en lóbulos inferiores asociado a reticulación fina. Dilatación del esófago distal (cabeza de flecha). TC de seguimiento (8 años después). Reconstrucciones en proyección de mínima intensidad: axial (C) y coronal (D). Bronquiectasias de tracción prominentes (flechas) y pérdida de volumen de ambos lóbulos inferiores, datos indicativos de fibrosis pulmonar.
El signo de las «cuatro esquinas» (predominio de la afectación intersticial en regiones anterolaterales de campos superiores-medios y posterosuperiores de lóbulos inferiores) representa un hallazgo infrecuente, pero bastante específico de la EPI asociada a ES y facilita el diagnóstico diferencial con la FPI9,28.
Otras manifestaciones incluyen: dilatación esofágica, consolidación por aspiración o neumonía, derrame pleural y pericárdico, e HTP. Esta última provoca dilatación de las arterias pulmonares centrales, aunque un tamaño arterial normal no la excluye; cuando se asocia a EPI implica mal pronóstico9,27.
En el cribado de EPI en pacientes con ES se recomienda incluir la TCAR como estudio inicial y de seguimiento, aunque no está establecida su periodicidad (suele realizarse ante la sospecha clínica de progresión)24.
La TCAR y las PFR combinadas son los métodos fundamentales para evaluar la afectación pulmonar, determinar el pronóstico y la respuesta al tratamiento. La ausencia de enfermedad intersticial en la TCAR inicial es el mejor predictor de una buena evolución temporal. El 68% de los casos con vidrio deslustrado evoluciona a fibrosis29, siendo la presencia de datos fibróticos un predictor de mal pronóstico23. Se ha demostrado la utilidad de la TCAR para cuantificar la extensión de la EPI. Goh et al. establecieron que la extensión de la enfermedad pulmonar representa un factor pronóstico importante; definen «enfermedad limitada» (afectación claramente < 20%) y «extensa» (> 20%) mediante TCAR y recurren a las PFR (capacidad vital forzada mayor o menor de 70%) en casos dudosos18,30. Además de la estimación visual, se han desarrollado sistemas de cuantificación semiautomáticos o automáticos, basados en el histograma y el análisis de textura26.
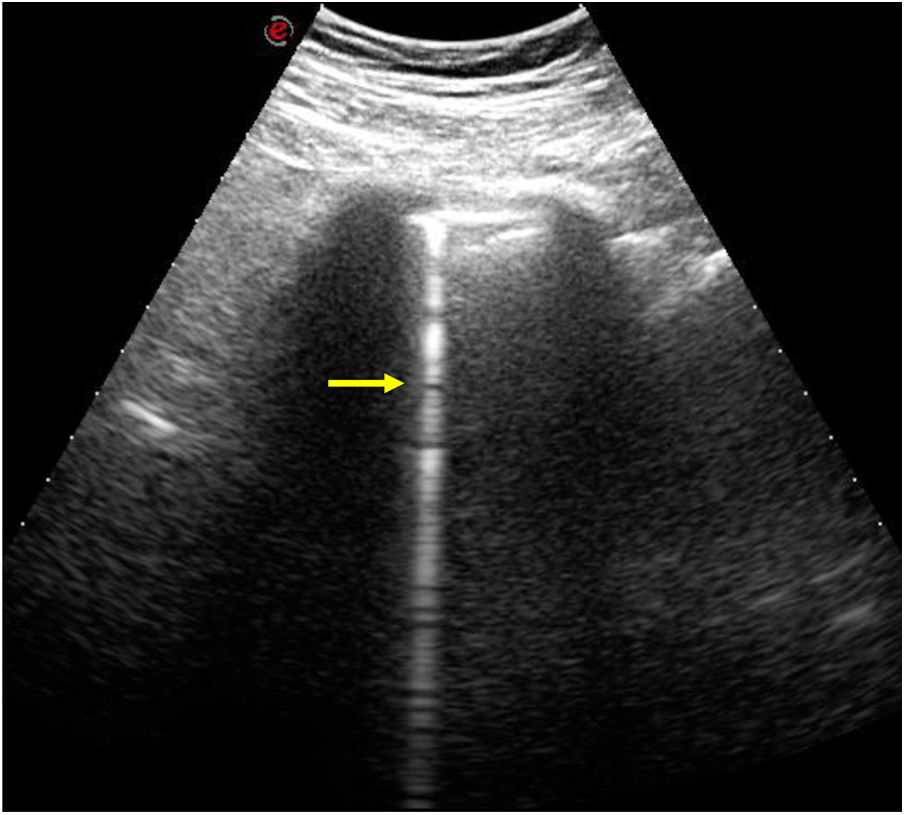
En los últimos años la ecografía pulmonar se ha postulado como una técnica útil para la detección precoz y el seguimiento de la EPI en la ES, que permitiría reducir el número de estudios de TC en estos pacientes2,24. Las líneas B son artefactos hiperecogénicos que se extienden verticalmente desde la pleura (fig. 5), cuyo número se correlaciona con la extensión de la EPI en la TCAR7,25. Recientemente se ha descrito la relación entre el número de líneas B y el deterioro de la función respiratoria, dato que apoyaría la utilidad pronóstica de la ecografía pulmonar25. El papel exacto de esta técnica aún no está definido.
Ecografía pulmonar en una paciente con esclerodermia (forma difusa) y enfermedad pulmonar intersticial fibrosante. Se aprecia una imagen hiperecogénica lineal perpendicular a la superficie pleural, que se extiende en profundidad a lo largo de todo el campo de visión (línea B) (flecha).
Cortesía de la Dra. E. Vicente.
Se caracteriza por una alteración de la función glandular exocrina, que origina sequedad ocular y oral («síndrome seco»), junto con infiltración linfocitaria de las glándulas salivales. Es la segunda conectivopatía más común, tras la AR. Predomina en mujeres (9:1) y la edad media de presentación está en torno a los 50 años9,11. Sus manifestaciones sistémicas son múltiples: musculo-esqueléticas, neurológicas, renales, vasculares y pulmonares. Se distinguen 2 formas: primaria (aislada) y secundaria (asociada con otras EAS como el LES, la AR o la esclerodermia)10,11,31.
Entre las manifestaciones extraglandulares destacan las respiratorias, siendo las más frecuentes en el SS primario la neumopatía intersticial y la enfermedad de la vía aérea (bronquial y bronquiolar). Con frecuencia coexisten varias alteraciones pulmonares, lo que complica la interpretación de los estudios de TC e histológicos32. En pacientes asintomáticos las pruebas de imagen detectan alteraciones hasta en el 65% de los casos33–35.
La prevalencia estimada de EPI está alrededor del 20% según la mayoría de las series, siendo una de las complicaciones más graves del SS primario36. Son factores de riesgo para su desarrollo: sexo masculino, hábito tabáquico activo, inicio tardío de la enfermedad y largo tiempo de evolución31.
En la TCAR pueden coexistir EPI y signos de enfermedad de vía aérea (nódulos centrolobulillares, bronquiectasias o atrapamiento aéreo). Aunque la NIL constituye el patrón más típico de afectación intersticial (15%), el patrón histológico de NINE es más común (45%), seguido del de NIU (16%)31,37; la combinación de diferentes patrones no es infrecuente28.
Una gran proporción de las EPI en el SS sigue un curso indolente, pero cuando existe patrón de NIU la enfermedad puede progresar y condiciona un peor pronóstico33,36. Los pacientes con patrón de NIU asociado a SS primario en comparación con aquellos con NIU en la FPI se caracterizan por: edad más avanzada, predominio del sexo femenino y mayor prevalencia de adenopatías mediastínicas y engrosamiento bronquial en TC34.
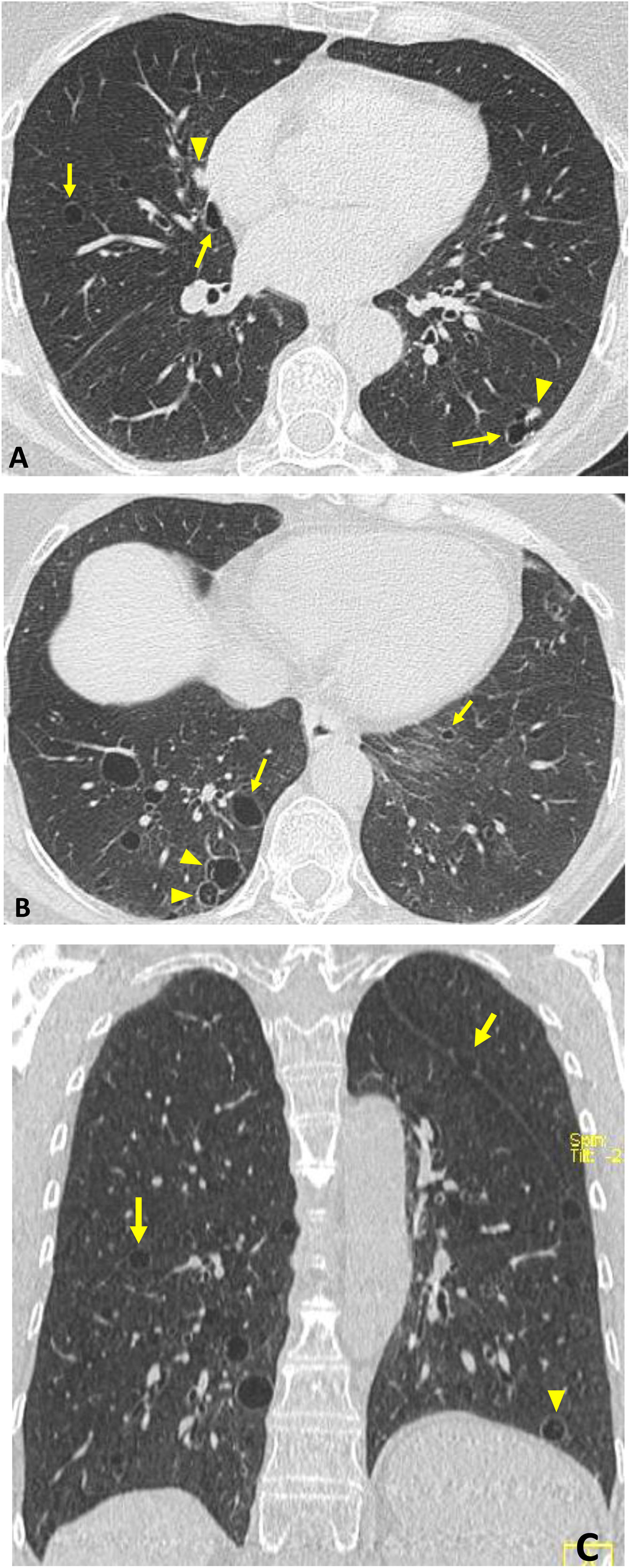
La NIL se clasifica como NII rara y además se considera un trastorno linfoproliferativo11,32. A menudo se presenta en el SS con el único hallazgo en TCAR de quistes aéreos de pared fina. Es conocida la asociación de NIL y amiloidosis, que suele manifestarse con quistes, opacidades en vidrio deslustrado, reticulación y nódulos (estos pueden estar calcificados) (fig. 6)28,32,36.
Síndrome de Sjögren «oculto» en mujer asintomática de 54 años. Hallazgo casual en TC. Imágenes axiales (A y B) y coronal (C): quistes aéreos pulmonares de pared fina dispersos (flechas), algunos con septos finos incompletos (cabezas de flecha en B y C). Se asocian varios nódulos sólidos (cabezas de flecha en A). La biopsia demostró NIL y amiloidosis pulmonar.
La incidencia de linfoma en el SS está muy aumentada respecto a la población general. El linfoma pulmonar primario se da en el 1-2% de los pacientes, generalmente de tipo MALT (tejido linfoide asociado a mucosas) y con buen pronóstico. La presencia de nódulos > 1cm, masas o consolidaciones debe alertar sobre esta posibilidad11,28,31,32,36.
Miopatías inflamatorias idiopáticasLas MII o miositis se caracterizan por debilidad muscular proximal, elevación de enzimas musculares, cambios miopáticos en la electromiografía y biopsia muscular patológica. Se clasifican en 3 subgrupos: polimiositis (PM), dermatomiositis (DM) y miositis con cuerpos de inclusión (en esta última la afectación pulmonar es rara). Algunos autores añaden la DM amiopática (con afectación cutánea, pero sin miositis). El pulmón es la segunda localización extramuscular más frecuente, tras la piel38. Aunque la PM y la DM tienen manifestaciones similares, en la DM existen alteraciones cutáneas típicas como el exantema heliotropo y las pápulas de Gottron. El síndrome antisintetasa es una forma clínica de miositis caracterizada por la presencia de anticuerpos frente a la sintetasa aminoacil-tARN y alguna o algunas de las siguientes manifestaciones: EPI, PM, DM, artritis, fenómeno de Raynaud y manos de mecánico39.
En las MII se describen 2 grupos de autoanticuerpos: a) específicos de miositis (pueden predecir la forma clínica y suelen ser excluyentes entre sí), que incluyen anticuerpos antisintetasa (presentes en el 25-35% de las miositis) y anticuerpos no antisintetasa, y b) asociados a miositis, no específicos de MII: pueden aparecer en síndromes de solapamiento o en otras conectivopatías. Tienen especial relevancia los anticuerpos anti Jo-1 (el principal anticuerpo antisintetasa) y los anti-MDA5, que se relacionan con EPI rápidamente progresiva (en el transcurso de semanas o pocos meses), generalmente en el contexto de DM amiopática40.
La EPI es una de las manifestaciones más importantes de las MII y frecuentemente condiciona el tratamiento y el pronostico. La prevalencia de EPI clínicamente relevante es variable (17-35%), pero su incidencia global es mucho mayor (65% o superior en algunas series). Precede al diagnóstico de miositis en el 20% de los casos40. Se diferencian 3 formas clínicas: aguda con progresión rápida, crónica con síntomas lentamente progresivos y subclínica o asintomática.
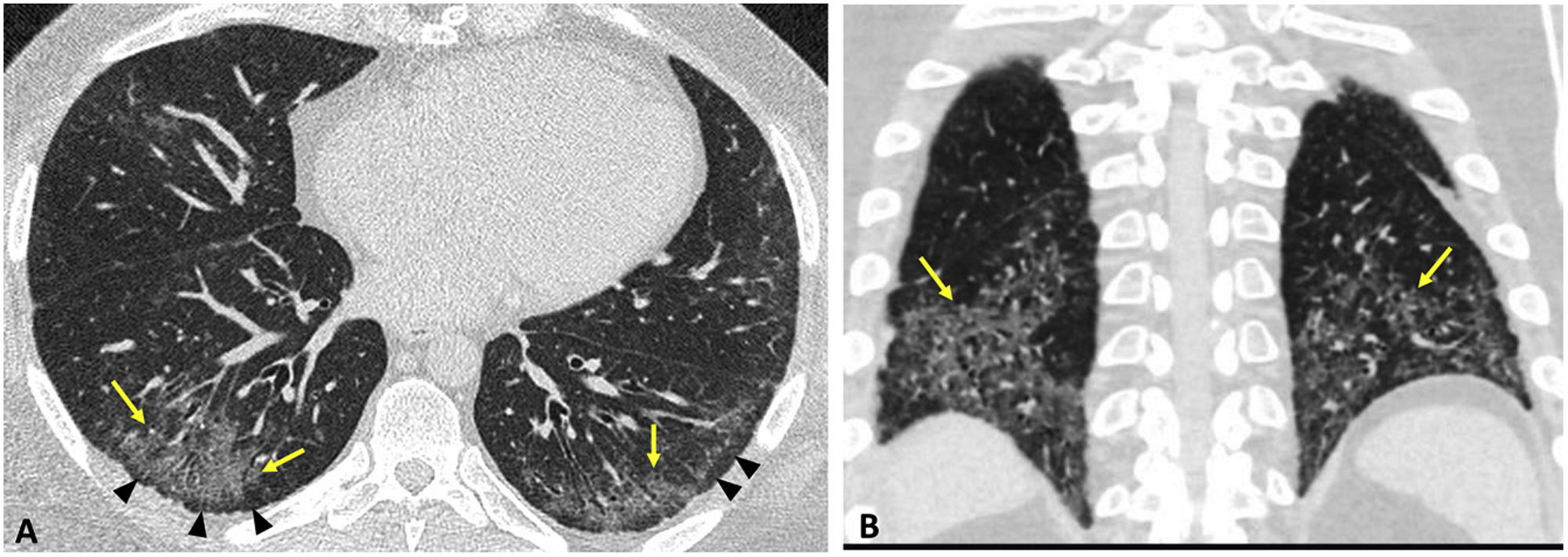
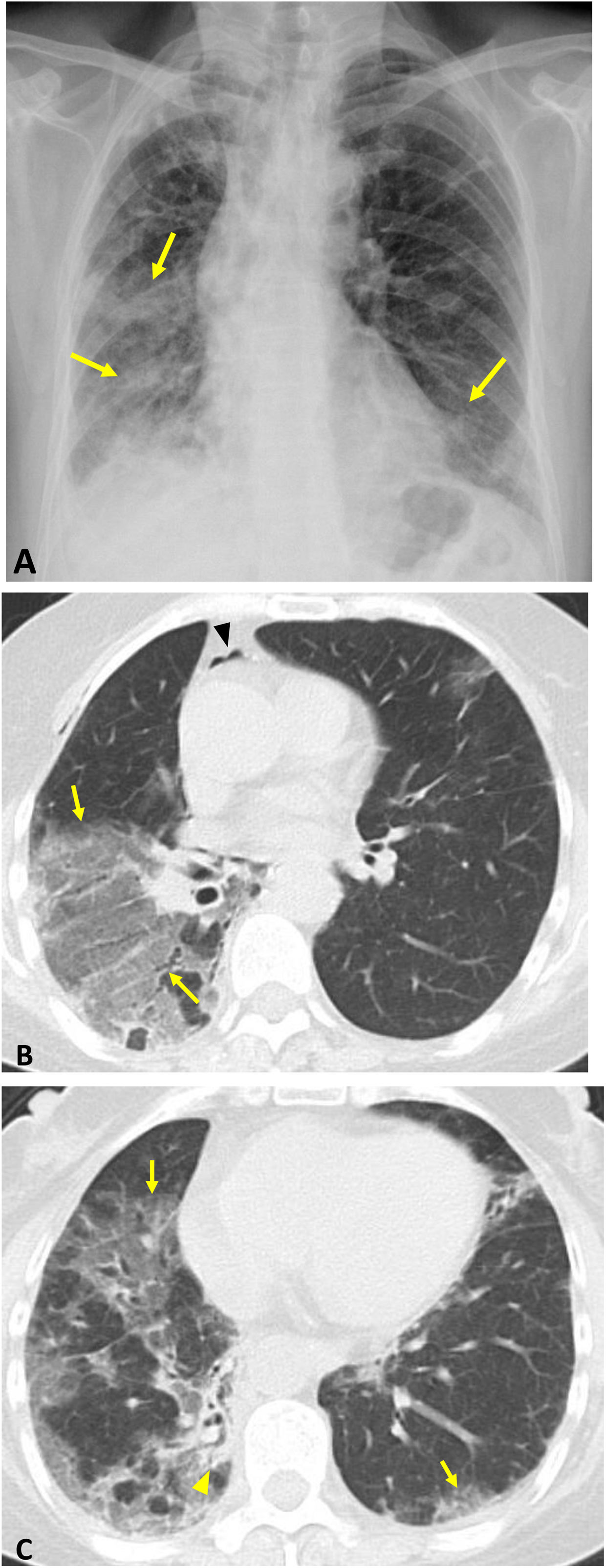
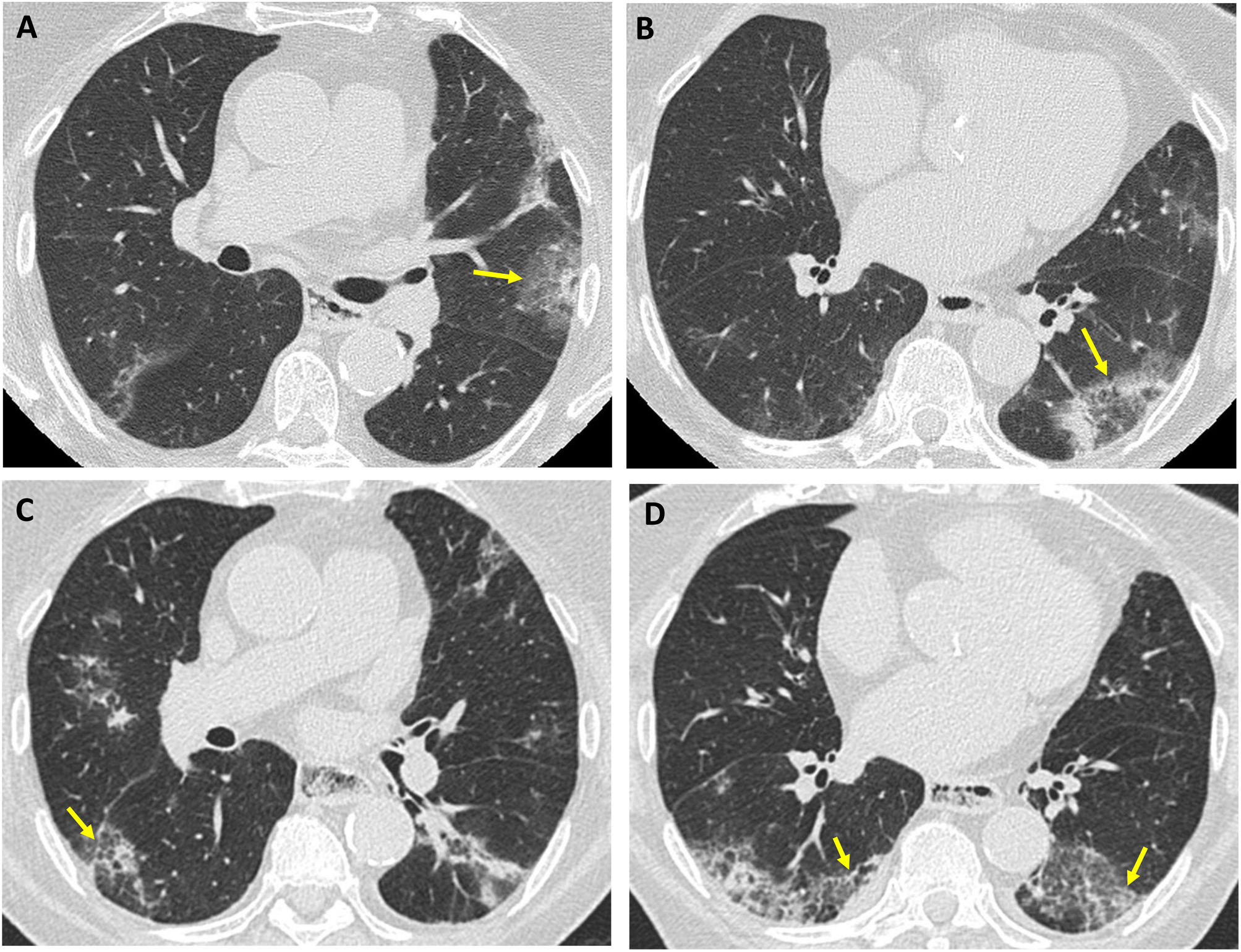
En la TC el patrón de NINE es el más frecuente (65% en la serie de Cottin et al.)41, pero también aparecen NO y la combinación de NINE-NO, siendo el patrón de NIU poco común (fig. 7). La EPI rápidamente progresiva en pacientes con DM y anticuerpos anti-MDA5 se manifiesta con patrón de NO y de DAD (consolidaciones y vidrio deslustrado, con o sin signos de fibrosis); el neumomediastino o neumotórax se asocian a mayor mortalidad18 (fig. 8).
Polimiositis en un varón de 53 años. Las imágenes axial (A) y coronal (B) de TCAR muestran un patrón de neumonía intersticial no específica: opacidades en vidrio deslustrado predominantes en ambos lóbulos inferiores con distribución simétrica (flechas), reticulación leve y ausencia de afectación en la región subpleural (cabezas de flecha en A).
Mujer de 57 años con EPI rápidamente progresiva asociada a anticuerpos anti-MDA5. Radiografía de tórax (A): consolidaciones bilaterales de predominio derecho (flechas). Imágenes axiales de TC (B y C): extensas opacidades en vidrio deslustrado con marcado predominio en el pulmón derecho (flechas) y pequeño foco de consolidación (cabeza de flecha en C). Neumomediastino (cabeza de flecha en B) secundario a broncoscopia con biopsia transbronquial.
La EMTC es una entidad clínica definida que reúne características comunes a LES, esclerodermia, SS o miositis (por lo que se denomina síndrome de solapamiento), junto con anticuerpos antirribonucleoproteínas (anti-RNP). Predomina en mujeres (9:1) jóvenes. El diagnóstico clínico se basa en la presencia de fenómeno de Raynaud, edema de manos y algunos de los signos propios de las enfermedades mencionadas, como miositis, artritis, dismotilidad esofágica, leucocitopenia, serositis, EPI e HTP6.
Las manifestaciones respiratorias aparecen hasta en el 80% de los casos. El anticuerpo anti-Ro 52 es un marcador de afectación pulmonar. Aunque con frecuencia los pacientes están asintomáticos, la TC demuestra hallazgos en más del 50%, siendo la EPI el más común. Bodolay et al. encontraron neumopatía intersticial en el 66% de los casos42. El patrón radio-patológico predominante es el de NINE, seguido del de NIU; los patrones de NIL y NO son infrecuentes (fig. 9). La presencia de HTP, en el 10-45% de los pacientes afectados de EMTC, implica mal pronóstico11,43,44.
Mujer de 62 años con enfermedad mixta del tejido conectivo y patrón combinado NO-NINE. Imágenes axiales de TC (A y B): consolidaciones periféricas bilaterales; signo del halo en el lóbulo superior izquierdo (flecha en A) y signo del halo invertido en el lóbulo inferior izquierdo (flecha en B). TC de seguimiento (C y D): predominan las opacidades en vidrio deslustrado en ambos lóbulos inferiores, que se asocian a reticulación y bronquiolectasias (flechas en C y D).
Enfermedad multiorgánica de curso crónico con remisiones y recaídas, que muestra amplia variedad de manifestaciones clínicas y se asocia con diferentes autoanticuerpos (la mayoría de los pacientes presenta positividad para anticuerpos antinucleares [ANA]). Predomina en mujeres (9:1) en edad reproductiva. La afectación del tracto respiratorio ocurre en el 50-70% de los casos y en el 4-5% constituye la primera manifestación de la enfermedad45. El espectro de posibles alteraciones implica múltiples estructuras torácicas, siendo la EPI una de las menos comunes (tabla 5).
Alteraciones torácicas en el lupus eritematoso sistémico
| Parénquima pulmonar | Agudas: |
| Neumonitis lúpica (1-8%) | |
| Hemorragia alveolar aguda (rara) | |
| Infección pulmonar en el 50% | |
| Crónica: EPI | |
| Pleura (lo más frecuente) | Pleuritis |
| 40-60% | Derrame pleural |
| Vía aérea | Superior: afectación laríngea |
| Bronquiolitis | |
| Bronquiectasias (raras) | |
| Vasos pulmonares | Tromboembolia pulmonar (10%) |
| Síndrome de hipoxemia aguda reversible | |
| HTP (rara) | |
| Músculos respiratorios | Síndrome del pulmón encogido (raro) |
EPI: enfermedad pulmonar intersticial, HTP: hipertensión arterial pulmonar.
La gravedad de las complicaciones respiratorias es muy variable, desde formas subclínicas a potencialmente mortales46. Las manifestaciones respiratorias que se presentan de forma aguda habitualmente se asocian a la actividad general de la enfermedad, mientras que las crónicas pueden progresar de manera independiente45. En la evaluación inicial de lesiones pulmonares debe descartarse infección, pues la neumonía bacteriana es una complicación muy común y una de las principales causas de muerte47.
La neumonitis lúpica aguda es una complicación temida, pero infrecuente (1-8%); cursa con fiebre, tos, dolor torácico, hemoptisis y, en las formas graves, insuficiencia respiratoria aguda. Suele presentarse en el contexto de un brote sistémico (nefritis, serositis, artritis) y se asocia a anticuerpos anti-Ro45. Histológicamente se caracteriza por daño alveolar difuso, que puede acompañarse de capilaritis y hemorragia alveolar10,45. La TC muestra consolidaciones bilaterales con predominio basal; la angio-TC permite excluir embolia pulmonar. En la mitad de los casos existe derrame pleural. El lavado broncoalveolar ayuda a diferenciar la neumonitis lúpica de la infección y la hemorragia47. Tiene mal pronóstico, con elevada mortalidad (40-50%) y un porcentaje significativo desarrolla neumonía intersticial crónica45.
La EPI crónica es menos frecuente que en otras conectivopatías, aunque su prevalencia (6-24%) probablemente está infraestimada45. El patrón radio-patológico más común es el de NINE, aunque también aparecen patrones de NIU, NIL y NO. Brady et al. describen signos de fibrosis que no se ajustan a los patrones clásicos de NIU o de NINE fibrótica en el 44% de sus pacientes48. Entre los factores de riesgo para desarrollar EPI destacan: historia de neumonitis lúpica aguda, largo tiempo de evolución del LES, fenómeno de Raynaud, esclerodactilia, capilaroscopia patológica y anticuerpos anti-RNP. El pronóstico de las EPI fibrosantes en el LES es mejor que en las asociadas a FPI o a AR45.
Vasculitis-ANCALas vasculitis constituyen un grupo heterogéneo de enfermedades caracterizadas por inflamación leucocitaria necrosante de las paredes de los vasos sanguíneos. La afectación pulmonar es más frecuente en el subgrupo de vasculitis asociadas a ANCA, que tienen predilección por vasos pequeños e incluyen 3 síndromes: poliangeítis microscópica (PAM), granulomatosis con poliangeítis (antes llamada enfermedad de Wegener) y granulomatosis eosinofílica con poliangeítis (antes síndrome de Churg-Strauss)49,50 (tabla 6).
Características de las vasculitis-ANCA
| Granulomatosis con poliangeítis | Granulomatosis eosinofílica con poliangeítis | Poliangeítis microscópica | |
|---|---|---|---|
| Histología | Inflamación necrosante con granulomas | Vasculitis necrosanteGranulomas extravascularesInfiltrados eosinófilos | Vasculitis no granulomatosa/capilaritis |
| Patrón ANCA | ANCA-PR3 (90%) | ANCA-MPO (40-70%) | ANCA-MPO (50-75%) |
| Manifestaciones clínicas | Rinitis destructiva, otitisGlomerulonefritis (50-80%)Estenosis de vía aérea | Asma (95%)Poliposis nasalAfectación cardiacaNeuropatía periféricaRash cutáneo | Glomerulonefritis (90%)Artralgias/mialgiasAfectación cutáneaNeuropatía periférica |
| Hallazgos torácicos (TC) | Nódulos/masas (90%), cavitación frecuenteConsolidaciones/vidrio deslustrado | Consolidaciones/vidrio deslustrado transitoriosEngrosamiento septalDerrame pleural (50%) | Consolidaciones/vidrio deslustradoFibrosis pulmonar |
ANCA: anticuerpos anticitoplasma de neutrófilo; ANCA-PR3: ANCA frente a proteínasa 3 (c-ANCA: ANCA con patrón citoplasmático); ANCA-MPO: ANCA frente a mieloperoxidasa (p-ANCA: ANCA con patrón perinuclear).
La asociación entre vasculitis-ANCA y EPI es cada vez más reconocida, siendo la poliangeítis microscópica con ANCA antimieloperoxidasa (anti-MPO) la que más se relaciona con afectación intersticial (hasta en el 45%)49. En pacientes con diagnóstico inicial de FPI se ha descrito la conversión a ANCA positivo en aproximadamente un 10% de los casos, lo que ha llevado a incluir las determinaciones de anticuerpos ANCA en los pacientes con neumopatía intersticial/fibrosis pulmonar50.
La patogenia de la EPI asociada a vasculitis-ANCA se conoce poco, pero se han sugerido varios mecanismos, entre ellos los episodios repetidos de hemorragia alveolar y los autoanticuerpos ANCA-MPO per se. También se ha postulado que la FPI podría inducir el desarrollo de ANCA y vasculitis51.
Además de síntomas respiratorios inespecíficos como disnea y tos, pueden presentarse otros relacionados con la vasculitis: hemoptisis, artralgias, fiebre, pérdida de peso o hematuria.
En pacientes con PAM se ha estimado una prevalencia de enfermedad intersticial detectada con TC del 66%. Los hallazgos más comunes en la EPI asociada a vasculitis-ANCA incluyen opacidades en vidrio deslustrado, reticulación, engrosamiento septal, consolidación y panal. Su distribución suele ser simétrica con predominio periférico y en los lóbulos inferiores. El patrón más habitual es el de NIU, seguido del de NINE; también puede presentarse NID. En un porcentaje significativo de casos la TC muestra alteraciones intersticiales fibróticas no encuadrables en un patrón definido50. Se describe además afectación de la vía aérea (bronquiolitis, bronquiectasias)49 (fig. 10).
Poliangeítis microscópica (ANCA-MPO) con patrón de neumonía intersticial usual. TC axial (A y B) y reconstrucción coronal en proyección de mínima intensidad (C). Reticulación asociada a opacidades en vidrio deslustrado (flechas), bronquiectasias/bronquiolectasias de tracción (cabezas de flecha en B) y pequeñas áreas de panalización (cabeza de flecha en C). Hallazgos con predominio periférico y basal.
La supervivencia global de las vasculitis-ANCA ha aumentado en los últimos años por la estandarización de la terapia inmunosupresora, pero la presencia de EPI, en particular el patrón de NIU, tiene un impacto pronóstico adverso49.
Neumonía intersticial con rasgos autoinmunes (IPAF)Este término designa casos de NII (identificados en TCAR o estudio histológico) con rasgos sugestivos, pero no definitivos, de conectivopatía (en los que se han excluido otras etiologías). Sus criterios clasificatorios incluyen 3 dominios: clínico, serológico y morfológico (tabla 7). Dentro del dominio morfológico figuran ciertos patrones de TCAR: NINE, NO, combinado NINE-NO y NIL, así como la presencia de hallazgos en otras estructuras torácicas (afectación multicompartimental). En un paciente con neumopatía intersticial el patrón de NIU no aumenta la probabilidad de conectivopatía subyacente, por lo que no se considera criterio de IPAF4. El concepto de IPAF refleja el solapamiento que puede existir entre la FPI y las EAS-EPI, y la necesidad de un manejo multidisciplinar de esta enfermedad52.
Criterios clasificatorios de IPAFa
| Dominio clínico | Dominio serológico | Dominio morfológico |
|---|---|---|
| Manos de mecánicoÚlcera distal en dedosArtritis o rigidez matutina > 60 minTelangiectasias palmaresFenómeno de RaynaudSigno de Gottron (rash en superficie extensora de dedos)Edema digital | ANA ≥ 1:320 patrón difuso o moteado ANA patrón nucleolar o centrómero (a cualquier título)FR ≥ límite normal × 2Anti-CCPAnti-dsDNAAnti-Ro (SSA)Anti-La (SSB)Anti-RNPAnti-SmAnti-Scl-70Ac. antisintetasaAnti-PM-SclAnti-MDA5 | Patrón TCAR: NINE, NO, NINE-NO, NILBiopsia: NINE, NO, NINE-NO, NIL, agregados linfoides con centros germinales, infiltración linfoplasmocitaria difusaAfectación multicompartimental (además de EPI): pleura, pericardio, vía aérea, vasculatura pulmonar |
Ac: anticuerpos; ADN: ácido desoxirribonucleico; ANA: anticuerpos antinucleares; CCP: péptido citrulinado cíclico; DAD: daño alveolar difuso; dsDNA: ADN de doble cadena; EPI: enfermedad pulmonar intersticial; FR: factor reumatoide; IPAF: neumonía intersticial con rasgos autoinmunes; MDA5: melanoma differentiation-associated gene 5; NIL: neumonía intersticial linfoide; NINE: neumonía intersticial no específica; NIU: neumonía intersticial usual; NO: neumonía organizada; RNP: ribonucleoproteínas; Sm: Smith; SSA: Sjögren's syndrome related antigen A; SSB:Sjögren's syndrome related antigen B; TCAR: tomografía computarizada de alta resolución.
Dada la gran variabilidad de manifestaciones de las EPI-EAS y el impacto pronóstico de la afectación pulmonar, resulta crucial la integración de los hallazgos clínicos, serológicos y radiológicos en una discusión multidisciplinar (neumólogo, reumatólogo, radiólogo, inmunólogo y ocasionalmente patólogo), con el fin de alcanzar un diagnóstico precoz y exacto que permita instaurar un manejo global adecuado2,5.
El curso clínico de la EPI es variable y poco predecible. En la evolución de estos pacientes pueden producirse exacerbaciones agudas, al igual que en la FPI. Se definen como deterioro respiratorio en menos de un mes asociado a lesiones nuevas en la TCAR (generalmente opacidades en vidrio deslustrado), en ausencia de infección o edema pulmonar. Esta situación es más común en la EPI-AR que en otras EAS y conlleva una elevada mortalidad28.
El empeoramiento respiratorio agudo de un paciente con EAS en tratamiento también puede obedecer a 2 complicaciones frecuentes:
- –
Toxicidad farmacológica. Existen múltiples fármacos que se emplean en las EPI-EAS (tabla 8). El tratamiento específico debe individualizarse en función del tipo de enfermedad autoinmune, su curso clínico y el patrón y la gravedad de la EPI. El diagnóstico de toxicidad pulmonar suele ser de exclusión; debe establecerse la relación temporal entre la instauración del tratamiento y la aparición de síntomas y hallazgos radiológicos. Los patrones de afectación más frecuentes son neumonitis por hipersensibilidad, neumonía eosinófila, edema pulmonar y DAD. El metotrexato (fármaco de primera línea en la AR) puede causar una neumonitis aguda en el primer año de tratamiento por un mecanismo de hipersensibilidad; aunque poco frecuente, esta complicación tiene alta mortalidad5,15,28.
Tabla 8.Fármacos más empleados en el tratamiento de las EAS y EPI-EAS
Inmunosupresores FAME Corticoides FAME-sc sintéticos convencionales FAME-b biológicos FAME-sd sintéticos dirigidos Ciclofosfamida Glucocorticoides Micofenolato Metotrexato Anti-TNF Tofacitinib Azatioprina Leflunomida Rituximab Baricitinib Ciclosporina Hidroxicloroquina Abatacept Tacrólimus Sulfasalazina Tocilizumab Anti-TNF: inhibidores del factor de necrosis tumoral; EPI: enfermedad pulmonar intersticial; EAS: enfermedad autoinmune sistémica; FAME: fármacos modificadores de la enfermedad.
- –
Infección pulmonar, cuyo riesgo está incrementado por los tratamientos inmunosupresores y las alteraciones inmunitarias propias de la enfermedad sistémica. Los gérmenes implicados incluyen bacterias, virus, hongos (Pneumocystis jiroveci,Aspergillus) y micobacterias (tuberculosa y no tuberculosas). Antes de iniciar la terapia anti-TNF (inhibidores del factor de necrosis tumoral) se debe investigar la presencia de tuberculosis latente o hallazgos radiológicos de tuberculosis previa (por riesgo alto de transformación en una infección activa)5. Algunos fármacos se asocian a infecciones específicas; por ejemplo, la neumonía por P. jiroveci es más común en el tratamiento con metotrexato, rituximab y corticoides.
Las EPI-EAS pueden mostrar un fenotipo progresivo, caracterizado por empeoramiento de la calidad de vida con descenso de la capacidad vital forzada y la DLCO, y mayor extensión de las lesiones fibróticas en la TCAR. Este comportamiento, similar al de la FPI, se denomina genéricamente «fibrosis pulmonar progresiva» y tiene un impacto pronóstico negativo con aumento de la mortalidad53. Varios ensayos clínicos recientes han demostrado que el tratamiento antifibrótico (nintedanib, pirfenidona) es beneficioso en las EPI fibrosantes progresivas asociadas a las EAS. El papel de estos fármacos y su empleo conjunto con el tratamiento inmunosupresor está aún por determinar5.
ConclusiónEl patrón radiológico-histológico de NINE es el más común en las EPI-EAS, exceptuando la AR y las vasculitis-ANCA, en las que predomina el patrón de NIU. En una minoría significativa de pacientes la afectación pulmonar constituye la forma de inicio de la enfermedad sistémica; la presencia de patrón de NINE en la TCAR junto con afectación torácica multicompartimental incrementan la sospecha diagnóstica. El radiólogo torácico debe conocer el amplio espectro de manifestaciones de cada una de estas enfermedades.
Autoría- 1.
Responsable de la integridad del estudio: SHM, MJOS y PCSR.
- 2.
Concepción del estudio: SHM, MJOS y PCSR.
- 3.
Diseño del estudio: SHM, MJOS y PCSR.
- 4.
Obtención de los datos: SHM, MJOS, PCSR, JAJH y CV.
- 5.
Análisis e interpretación de los datos: N/A.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: SHM, MJOS, PCSR y CV.
- 8.
Redacción del trabajo: SHM, MJOS, PCSR y JAJH.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SHM, MJOS, PCSR, JAJH y CV.
- 10.
Aprobación de la versión final: SHM, MJOS y PCSR.
Los autores declaran no tener conflicto de intereses.