Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosLa enfermedad de Crohn es una enfermedad inflamatoria crónica del tracto gastrointestinal que cursa en brotes y requiere múltiples revaloraciones. Las técnicas de imagen seccional (tomografía computarizada, resonancia magnética y ultrasonidos) desempeñan un papel crucial en la valoración inicial y el seguimiento de la enfermedad, así como de sus complicaciones. La calidad y la homogeneidad del informe radiológico son críticas para asegurar una comunicación efectiva entre especialistas y optimizar el tratamiento del paciente.
En este artículo repasaremos los principales hallazgos por imagen asociados a la enfermedad de Crohn en las diferentes modalidades de imagen y los diferentes puntos que deben figurar en el informe radiológico para permitir una óptima comunicación con los diferentes médicos implicados en el manejo de estos pacientes.
Crohn's disease is a chronic inflammatory disease of the gastrointestinal tract. The course of the disease involves periods of remission and flare-ups that require multiple evaluations. Cross-sectional imaging techniques (computed tomography, magnetic resonance imaging, and ultrasonography) play a crucial role in the initial evaluation and in the follow-up of the disease and its complications. The quality and homogeneity of the radiology report is critical to ensure effective communication among specialists and optimize the patient's treatment.
This article reviews the main findings in Crohn's disease on different imaging techniques and the different points that must be included in the radiology report to enable optimal communication with the different physicians involved in the management of these patients.
La enfermedad de Crohn (EC) es una enfermedad inflamatoria crónica que puede afectar a cualquier segmento del tracto gastrointestinal y que presenta un curso clínico impredecible, alternando períodos de actividad (brotes) con períodos de remisión. Suele iniciarse en pacientes jóvenes, pudiendo causar una importante morbilidad. A lo largo de la enfermedad pueden aparecer complicaciones graves que pueden requerir tratamientos inmunosupresores o cirugía. En la actualidad existen varias opciones terapéuticas disponibles (médicas, endoscópicas y quirúrgicas) que se elegirán en función de la clínica y la gravedad de la enfermedad, por lo que es fundamental una correcta valoración de la enfermedad para un óptimo manejo clínico. En esta valoración las técnicas de imagen seccional incluyendo la tomografía computarizada (TC), la resonancia magnética (RM) y los ultrasonidos (US) desempeñan un papel esencial, ya que permiten un estudio global de todo el tracto gastrointestinal de una forma no invasiva, proporcionando información transmural y periintestinal, siendo útiles tanto en el diagnóstico inicial de la enfermedad como en la valoración de la respuesta terapéutica y en el diagnóstico de complicaciones1.
Para una comunicación eficiente entre especialistas y especialidades involucradas en el manejo de los pacientes con EC, es importante optimizar y estandarizar el informe radiológico. Este artículo de revisión tiene como objetivo la identificación de hallazgos por imagen seccional y sugerir cómo reportarlos y caracterizarlos mediante las diferentes técnicas de imagen seccional.
Información clínica necesaria antes de la prueba de imagenPara la óptima interpretación de los hallazgos es importante disponer de información clínica. Debemos saber si estamos ante una primera valoración de la enfermedad o bien se trata de un control para valorar la respuesta a un tratamiento. Hay que conocer si se sospecha de un nuevo brote o una complicación, la presencia de síntomas, el tratamiento que está siguiendo el paciente, así como los antecedentes de cirugía previos. También es útil conocer la localización de la enfermedad (ileal, íleo-cólica, cólica o en el intestino delgado proximal). Respecto a la elección de la prueba, esta dependerá en gran parte de la disponibilidad de la técnica y la experiencia del equipo radiológico local.
Calidad técnica del estudioIndependientemente de la modalidad de imagen elegida, existe una serie de factores que pueden disminuir la calidad técnica del estudio y, en consecuencia, su sensibilidad y capacidad diagnóstica. En la TC y la RM los más importantes son una escasa distensión intestinal, artefactos de movimiento y una inadecuada opacificación de la pared intestinal tras la administración de contraste por vía intravenosa. En el caso de los US, además de una escasa distensión intestinal, se añaden factores como la interposición de gas intestinal o anatómicos (p. ej. obesidad). Es importante que estas limitaciones queden reflejadas en el informe.
Valoración de actividadLa principal pregunta clínica que debemos responder es si el paciente presenta signos de actividad de la enfermedad. Debe valorarse cuidadosamente todo el tracto gastrointestinal en busca de segmentos afectados. Una vez detectados, debe describirse la localización de estos, así como la longitud afectada aproximada (en centímetros) en el caso del intestino delgado y enumerar los segmentos de colon con lesiones derivadas de la EC. En los segmentos afectados deben valorarse los siguientes aspectos:
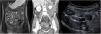
Grosor de la paredDebe medirse el grosor máximo de la pared (en milímetros) de cada segmento afectado, considerándose como patológico un grosor> 3mm, determinado por cualquiera de las técnicas de imagen descritas2,3. Hay que tener en cuenta que los segmentos intestinales no correctamente distendidos pueden parecer falsamente engrosados. También hay que considerar que un grosor de pared aumentado no es siempre sinónimo de actividad ya que debido a un brote previo la pared intestinal puede presentar cambios crónicos (depósito de grasa intramural o fibrosis) que aumentan su grosor4. De este modo, un grosor de pared aumentado debe asociarse a otros de los signos descritos a continuación para considerarse enfermedad activa (fig. 1). Podemos estratificar el grosor de la pared y asociarlo a diferentes grados de actividad: normal (≤ 3mm), leve (> 3-5mm), moderado (> 5-9mm) y grave (≥ 10mm)5,6.
Grosor de la pared en diferentes modalidades de imagen (diferentes pacientes). A) Secuencia T2 coronal de enterografía por RM que muestra un engrosamiento del íleon distal de unos 10cm de longitud y 8mm de grosor (flecha blanca), correspondiente a un engrosamiento moderado. B) Reconstrucción en coronal de TC abdominal con contraste por vía intravenoso que muestra un asa ileal de paredes engrosadas de unos 10mm de grosor (flecha negra), correspondiente a un engrosamiento grave. C) US intestinal que muestra un engrosamiento de las paredes de un segmento de íleon distal de unos 6mm de grosor (flecha blanca), correspondiente a un engrosamiento moderado.
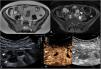
Los cambios inflamatorios en la pared (edema mural) pueden estar presentes en las zonas con engrosamiento mural, siendo visibles de diferente modo en las diferentes técnicas de imagen (fig. 2). La técnica más precisa para evidenciarlas es la RM, donde se visualizan como hiperintensidad mural en las secuencias T2 con saturación grasa6. Por TC el edema mural se visualiza como una pared engrosada e hipodensa, si bien su aspecto no es específico, ya que podría tener el mismo aspecto en caso de corresponder a fibrosis. Finalmente, por US los cambios inflamatorios en la pared intestinal se visualizan como una hipoecogenicidad de la pared asociada a pérdida del patrón de estratificación habitual de las paredes del intestino visibles por ecografía7,8. La identificación de edema mural es un signo clínicamente relevante porque se asocia a cambios inflamatorios moderados-graves9,10.
Signos de edema mural (diferentes pacientes). A) Segmento de íleon terminal de paredes engrosadas (7mm) con zonas que presentan hipoecogenicidad de la pared y pérdida de la estructura por capas en algunas secciones (flechas), correspondientes a signos de edema mural por US. B y C) RM enterografía. Secuencia T2 (B) que muestra un engrosamiento difuso de las paredes del íleon distal de 10mm de grosor (flecha) con aumento asociado de la señal T2 en la pared, indicativo de edema mural. La secuencia T2 con saturación grasa (C) confirma la presencia de edema mural (diferenciándolo de la presencia de grasa intramural) y permite delimitar mejor la presencia de cambios inflamatorios perientéricos (punta de flecha).
La identificación de úlceras en técnicas de imagen seccional se asocia a actividad grave de la enfermedad4,6,11. Estas corresponden a zonas de disrupción de la mucosa que penetran en la pared, pero sin atravesar la serosa. Para ser detectadas en las pruebas de imagen se requiere una correcta distensión intestinal (fig. 3). Habitualmente se detectan en TC o RM, pero también pueden ser visualizadas por US como imágenes lineales hipoecoicas que penetran en el espesor de la pared de un segmento afectado, pudiendo verse hiperecoicas si se encuentran ocupadas por gas intestinal8,12.
Úlceras murales (diferentes pacientes). US intestinal (A) que muestra una sección transversal de un asa ileal que presenta unas paredes engrosadas, hipoecoicas y con pérdida del patrón de estratificación mural, identificándose una imagen hiperecoica (gas) que se extiende desde la luz intestinal hacia el espesor de la pared delimitando una úlcera mural (flecha). B) Secuencia T1 con saturación de la grasa tras la inyección de contraste por vía intravenosa en plano coronal que muestra una sección longitudinal de un asa ileal en la pelvis, que presenta engrosamiento e hipercaptación de sus paredes y una irregularidad mural que corresponde a una úlcera (flecha).
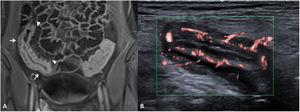
La presencia de inflamación activa en la pared intestinal asocia un aumento de la vascularización en la zona afectada (fig. 4). Este aumento de la vascularización se aprecia en TC y RM como un aumento de realce parietal (difuso o en capas) del segmento intestinal afectado en comparación con otros segmentos intestinales no afectados6. Puede observarse también una hipertrofia de los vasa recta, correspondiente al llamado signo del peine (comb sign).
Incremento de la vascularización (diferentes pacientes). Enterografía por RM. A) Secuencia T1 con saturación de la grasa tras la inyección de contraste por vía intravenosa en plano coronal que muestra un largo segmento de íleon distal de paredes engrosadas, con aumento de captación (flechas) e hipertrofia de los vasa recta (signo del peine, punta de flechas). B) US intestinal de otro paciente que muestra una sección transversal de un segmento de íleon con paredes engrosadas e incremento de la vascularización intestinal que afecta a toda la circunferencia de la pared intestinal y a los vasos mesentéricos adyacentes, correspondiente a una categoría grave de la escala modificada de Limberg.
Por US debe valorarse el grado de vascularización mediante Doppler color en los segmentos con máximo grosor de pared, ajustando previamente el Doppler color a velocidades bajas (4-7 m/s). Para caracterizar la vascularización se suele utilizar una escala semicuantitativa. Por ejemplo, en el caso de la escala modificada de Limberg, el incremento de la vascularización se clasifica en: ausente (no hay registros vasculares), leve (pequeña área de Doppler color en la pared intestinal), moderada (presencia de varias áreas de Doppler color limitada en la pared intestinal) o grave (presencia de Doppler color circunferencial o continuo en la pared intestinal pudiendo existir extensión a los vasos mesentéricos)7.
Cambios inflamatorios perientéricosLos cambios inflamatorios perientéricos son visibles por TC y RM como trabeculación de la grasa mesentérica que borra parcialmente los límites externos de la pared intestinal5,6 y como hiperecogenicidad de la grasa mesentérica por US, pudiendo estar asociados a una mínima cantidad de líquido. La presencia de ganglios locorregionales (aumentados en tamaño o en número), aunque inespecíficos, también sugiere actividad7. No obstante, no está definido qué tamaño ganglionar se considera patológico, por lo que su identificación debe valorarse juntamente con otros signos de actividad.
Otros hallazgos que pueden ayudar a la interpretaciónLa hiperseñal en difusión en RM en un segmento con cambios inflamatorios es un hallazgo que apoya la presencia de actividad. Es un hallazgo altamente sensible, pero con una especificidad limitada13, por lo que su interpretación no debería hacerse de forma aislada. Los segmentos de intestino delgado con actividad presentan una reducción en la motilidad que puede ser detectada mediante US o en modo cine en la RM. Dadas la subjetividad y la variabilidad entre los diferentes segmentos intestinales y pacientes, estos hallazgos también deberían considerarse como auxiliares e interpretarse juntamente con los otros signos mencionados con anterioridad.
Valoración de las complicaciones derivadas de la ECEn los estudios por imagen de la EC es fundamental detectar la presencia de complicaciones, ya que impactarán directamente en el manejo clínico del paciente. Las principales complicaciones que pueden producirse son las siguientes:
EstenosisExisten múltiples definiciones en la literatura que definen una estenosis14. Con el fin de consensuar una definición de estenosis en el intestino delgado reproducible que facilitara la comunicación entre especialistas y con alta especificidad para su detección, un panel de expertos propuso una definición de estenosis que incluye 3 elementos: grosor parietal> 25% de la pared normal, reducción luminal <50% de la luz normo-distendida y una dilatación proximal> 3cm15.
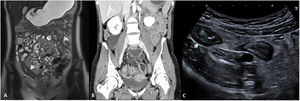
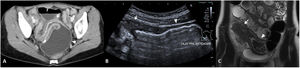
En el informe radiológico deben describirse la presencia y la localización de las estenosis, su longitud y el grado de dilatación de asas que causan (fig. 5). La dilatación intestinal causante puede considerarse como leve (dilatación de 3-4cm) o moderada-grave (> 4cm).
Estenosis ileales. A) Corte axial de una TC abdominal con contraste por vía intravenosa que muestra un segmento largo de íleon medio en la pelvis de paredes engrosadas y aspecto estenótico (flecha), que condiciona una severa dilatación preestenótica de unos 5cm de diámetro (cabeza de flecha). B) US intestinal de otro paciente que muestra una sección longitudinal de íleon distal, observándose un segmento de aspecto estenótico y paredes engrosadas (flecha) que condiciona una grave dilatación (cabeza de flecha). C) Secuencia coronal T2 de la enterografía por RM del mismo paciente de la imagen B, observándose el segmento estenótico (flecha) y la dilatación preestenótica (cabeza de flecha).
En la mayoría las estenosis coexisten un componente de inflamación activa y cambios crónicos (fibrosis), pudiendo predominar un componente sobre el otro. No obstante, no existen evidencias consistentes que permitan caracterizar o cuantificar la fibrosis intestinal, por lo que se recomienda reportar si hay signos inflamatorios acompañantes o no, evitando el término fibroestenosis en casos en que no haya evidencia de inflamación.
Sinus y fístulasUn sinus o fístula ciega es una estructura tubular que se origina en un defecto de la pared de una zona inflamada, rebasando la serosa de la pared y extendiéndose hasta el mesenterio perientérico sin comunicar con ninguna otra estructura.
Una fístula es una estructura tubular que comunica un asa intestinal con otra estructura, como otra asa intestinal (fístula entero-entérica), la vejiga urinaria (entero-vesical), el colon (entero-cólica o entero-sigmoidea) o la piel (entero-cutánea), entre otras. Las fístulas pueden clasificarse como simples (un solo tracto) o complejas (varios tractos, habitualmente con morfología estrellada)5,6.
En el caso de los US, pueden visualizarse como imágenes tubulares hipoecoicas con algunas imágenes puntiformes hiperecoicas en su interior, que corresponderían a burbujas de gas. La administración de contraste ecográfico puede mejorar su detección y delimitación7,8.
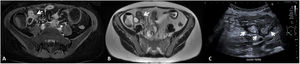
En el informe radiológico debe describirse la presencia y la localización de los sinus y las fístulas, y en el caso de estas últimas, detallar las estructuras comunicadas (fig. 6).
Enfermedad fistulizante. Fístula íleo-ileal (flecha) en enterografía por RM que comunica 2 asas ileales de paredes engrosadas e hipercaptantes. A) Secuencia axial T1 con saturación de la grasa y contraste por vía intravenosa. B) T2 en plano axial. C) US intestinal de otro paciente: múltiples fístulas íleo-ileales en la fosa ilíaca derecha (flechas), visibles como tractos hipoecoicos que conectan asas de paredes engrosadas, hipoecoicas y con pérdida del patrón mural.
La presencia de sinus y fístulas puede complicarse con la presencia de una masa inflamatoria mesentérica (antiguamente denominada flemón mesentérico, correspondiente a una zona con cambios inflamatorios-infecciosos, pero sin líquido en su interior) o bien con una colección/absceso (cuando se identifica una zona líquida en su interior)5,6.
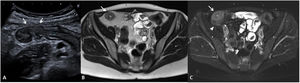
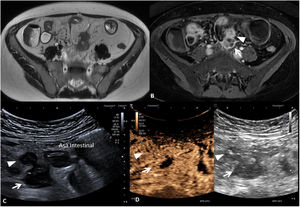
Tanto las masas inflamatorias como las colecciones o abscesos son clínicamente relevantes y su existencia se asocia a riesgo de requerir cirugía. Ambas presentan un manejo clínico distinto y para diferenciarlas se requiere la administración de contraste por vía intravenosa. Mientras que las masas inflamatorias muestran una captación difusa de la lesión, las colecciones o los abscesos muestran un realce de la periferia de la lesión con líquido o gas en su interior (fig. 7).
Masa inflamatoria mesentérica y absceso. Se muestran las imágenes de la enterografía por RM (A) secuencia T2 y secuencia T1 (B) con saturación grasa y con contraste por vía intravenosa y de la ecografía intestinal sin contraste (C) y con contraste ecográfico (D) de un mismo paciente. La masa inflamatoria mesentérica (cabeza de flecha) se visualiza como una lesión hipointensa en T2 (A) e hipoecoica en el US (C), en ambos casos con captación completa de contraste intravenoso (B y D). El absceso (flecha) presenta una señal heterogénea, con zonas hipointensas e hiperintensas en T2 (A) y sin llegar a presentar realce completo tras la administración de contraste por vía intravenosa (B). En el US el absceso también presenta un aspecto heterogéneo, siendo hipoecoico con zonas hipoanecoicas (C) y presentando ausencia de captación central tras la administración de contraste ecográfico (D).
Debe informarse de la presencia de estas 2 complicaciones, sus dimensiones y, en el caso del absceso, si es técnicamente factible su drenaje percutáneo por técnicas de imagen.
Por último, en algunas ocasiones puede producirse una perforación libre, identificándose la presencia de gas intraperitoneal. En este contexto, la exploración más adecuada es la TC, ya que es difícil detectar un leve neumoperitoneo por RM (visible como imágenes hipointensas en T1 y T2) o por US (pequeñas imágenes hiperecoicas puntiformes con artefactos de reverberación subyacentes al peritoneo anterior o adyacentes a la zona afectada). Debe comunicarse la presencia de esta complicación de forma inmediata a su médico responsable.
Monitorización de la actividadExiste un interés creciente en revalorar la extensión y la gravedad de la EC durante el tratamiento, ya sea por un cambio clínico del paciente o bien para valorar la respuesta a los diferentes tratamientos. En ambos contextos las pruebas de imágenes son fundamentales. Se comparará con estudios previos valorando los cambios en los parámetros previamente descritos. Finalmente, se tratará de categorizar los hallazgos en 4 situaciones: 1) remisión transmural (correspondiente a la normalización de las alteraciones)16; 2) respuesta (mejoría respecto al estudio previo, aunque con persistencia de signos inflamatorios); 3) enfermedad estable (sin cambios significativos respecto al estudio previo y ausencia de nuevos segmentos con actividad), y 4) progresión (incremento de los cambios inflamatorios, afectación de nuevos segmentos o aparición de complicaciones). No existe un consenso relativo a la definición de «respuesta transmural» y dicha valoración a menudo resulta subjetiva y debe tener en cuenta el conjunto de los cambios en los hallazgos presentes en el estudio previo al inicio del tratamiento.
ConclusiónEn este artículo de revisión hemos aportado recomendaciones prácticas que pueden servir de ayuda para uniformizar criterios en la lectura de las imágenes de los pacientes afectados de EC, de acuerdo con los conocimientos actuales de la enfermedad y de forma que pueda servir de guía para elaboración de informes radiológicos precisos, homogéneos y de calidad que faciliten la comunicación entre los diferentes especialistas implicados (radiólogos, gastroenterólogos y cirujanos). La tabla 1 muestra un ejemplo de informe estructurado.
Ejemplo de informe estructurado en la enfermedad de Crohn (EC)
| Ejemplo de informe estructurado en la EC |
|---|
| Tipo de estudio: RM/TC/US |
| Indicación de la prueba |
| Antecedentes |
| Diagnóstico previo de EC o bien sospecha/primer estudio |
| Fenotipo de la EC |
| Antecedente de complicaciones previas |
| Antecedentes quirúrgicos |
| Sintomatología actual |
| Tratamiento actual |
| Disponibilidad de un estudio de imagen previo para comparar |
| Calidad técnica del estudio: óptima/limitada (motivo, p. ej., artefactos de movimiento, escasa distensión intestinal, mala ventana ecográfica) |
| Presencia/ausencia de segmentos intestinales afectados. Informar para cada segmento |
| Localización |
| Íleon terminal/distal/medio/proximal |
| Yeyuno distal/medio/proximal |
| Colon ascendente/transverso/descendente/sigma |
| Otras localizaciones |
| Longitud aproximada del segmento afectado (cm) |
| Grosor máximo de pared (mm) |
| Presencia edema mural (sí/no) |
| Presencia de úlceras (sí/no) |
| Presencia de incremento de vascularización (sí/no) |
| Presencia de cambios inflamatorios perientéricos (sí/no) |
| Condiciona estenosis (sí/no) |
| Presencia/ausencia de complicaciones |
| Presencia de sinus y fístulas: localización, longitud (cm) y estructuras involucradas |
| Presencia de masa inflamatoria mesentérica: localización, dimensiones (cm) y estructuras involucradas |
| Presencia de absceso: localización, dimensiones (cm), estructuras involucradas y posibilidad de drenaje percutáneo |
| Presencia de perforación |
| Conclusiones |
| Diagnóstico inicial (3 categorías) |
| Ausencia de signos de actividad |
| Signos de actividad sin complicaciones |
| Signos de actividad con complicaciones |
| Estudio comparativo con previo (4 categorías) |
| Remisión transmural (resolución de las alteraciones) |
| Respuesta (mejoría respecto a estudio previo) |
| Enfermedad estable (sin cambios significativos) |
| Progresión de la enfermedad (empeoramiento respecto a estudio previo) |
- 1.
Responsable de la integridad del estudio: ERF, SRG, ÁSP, MJM y JRG
- 2.
Concepción del estudio: ERF, SRG, ÁSP, MJM y JRG
- 3.
Diseño del estudio: ERF, SRG, ÁSP, MJM y JRG
- 4.
Obtención de los datos: ERF, SRG, ÁSP, MJM y JRG
- 5.
Análisis e interpretación de los datos: ERF, SRG, ÁSP, MJM y JRG
- 6.
Tratamiento estadístico: ERF, SRG, ÁSP, MJM y JRG
- 7.
Búsqueda bibliográfica: ERF, SRG, ÁSP, MJM y JRG
- 8.
Redacción del trabajo: ERF, SRG, ÁSP, MJM y JRG
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ERF, SRG, ÁSP, MJM y JRG
- 10.
Aprobación de la versión final: ERF, SRG, ÁSP, MJM y JRG
Enric Ripoll Fuster: sin conflictos de intereses que declarar.
Sonia Rodríguez Gómez: sin conflictos de intereses que declarar.
Jordi Rimola Gibert: ha recibido becas de investigación de AbbVie y Genentech, ha recibido pago por conferencias de Janssen, Gilead y Takeda, y ha recibido pago por consultas de Boehringer Ingelheim, Janssen Pharmaceuticals, Takeda, TiGenix, Alimentiv and Origo.Álex Soler y Manuel Julián Moreno: sin conflictos de intereses.