La embolización transarterial (ETA) es el tratamiento de referencia de los pseudoaneurismas (PSA) yatrógenos de la arteria renal y de los pseudoaneurismas yatrógenos de la arteria renal con fístula arteriovenosa (PSA+FAV), pero su efecto sobre la función renal no se ha investigado lo suficiente. El objetivo del estudio es evaluar el efecto de la ETA en la función renal, así como su eficacia técnica y clínica.
Materiales y métodosSe revisaron retrospectivamente 67 procedimientos de embolización en 61 pacientes consecutivos desde diciembre de 2006 hasta octubre de 2020 en dos centros para determinar los siguientes parámetros: éxito y fracaso técnico y clínico, materiales embolizantes, tipo y dimensiones de las lesiones vasculares, porcentaje de parénquima renal isquémico tras el procedimiento y valores de la filtración glomerular estimada (FGe) antes y un día después del procedimiento quirúrgico, percutáneo o endoscópico (QPE), así como antes, un día después y 6meses después de la ETA.
ResultadosIdentificamos 44PSA y 23 PSA+FAV. El éxito técnico fue del 95,5%, el éxito clínico primario del 90,2% y el éxito clínico secundario del 96,7%. Se utilizaron diferentes materiales embolizantes. Se observó una disminución significativa de la FGe tras el procedimiento QPE. No hubo diferencias significativas entre la FGe antes y después de la ETA. Se observó una mejoría mínimamente significativa de la FGe 6meses después de la ETA. La embolización de lesiones de mayor tamaño dio lugar a áreas de isquemia más extensas después del procedimiento. Los PSA+FAV fueron significativamente mayores (p=0,0142) y provocaron un área de isquemia de mayor tamaño después del procedimiento. No se observó ninguna correlación entre las dimensiones, el tipo de lesión vascular o el área de isquemia después del procedimiento y la FGe.
ConclusiónLa ETA tiene unas tasas elevadas de éxito técnico y clínico y no afecta negativamente a la función renal, independientemente de las dimensiones o el tipo de las lesiones vasculares o del área de isquemia después del procedimiento.
Transarterial embolization (TAE) is the gold standard treatment for iatrogenic renal artery pseudoaneurysms (PSA) and pseudoaneurysms with arteriovenous fistula (PSA+AVF), but its impact on renal function has not been sufficiently investigated. The aim of the study is to assess the impact on of TAE on renal function and its technical and clinical effectiveness.
Materials and methodsSixty-seven embolization procedures in 61 consecutive patients from December 2006 to October 2020 in two centers were retrospectively reviewed for the following parameters: technical and clinical success and failure, embolization materials, type and dimensions of vascular injuries, percentage of post-procedural ischemic renal parenchyma and estimated glomerular filtration rate (eGFR) values before and 1day after the surgical, percutaneous or endoscopic (SPE) procedure and before, 1day after and 6months after TAE.
ResultsWe identified 44 PSA and 23 PSA+AVF. Technical success was 95.5%, primary clinical success was 90.2% and secondary clinical success was 96.7%. Different embolization materials were used. A significant decrease of the eGFR was found after the SPE procedure. No significant difference was found between eGFR before and after TAE. A minimal significant improvement of the eGFR was found 6months after TAE. Embolization of larger lesions resulted in larger post-procedural ischemic areas. PSA+AVF were significantly larger (P=.0142) and determined a larger post-procedural ischemic area. No correlation was found between dimensions, kind of vascular injury or post-procedural ischemic area and eGFR.
ConclusionTAE has high technical and clinical success rates and does not affect renal function negatively, regardless of dimensions or kind of vascular injuries or post-procedural ischemic area.
Las causas yatrógenas son responsables de más del 50% de las lesiones renovasculares que provocan hematuria1.
El pseudoaneurisma (PSA) y los pseudoaneurismas con fístula arteriovenosa (PSA+FAV) yatrógenos de la arteria renal son poco frecuentes, con una prevalencia del 2% y desconocida, respectivamente2. Un PSA se define como una alteración focal de la pared vascular, que da lugar a un flujo sanguíneo anómalo a través de la íntima y la media, limitado únicamente por la adventicia o por los tejidos circundantes (rotura)3. Una fístula arteriovenosa (FAV) renal es una anomalía en la comunicación entre una arteria renal y una rama de una vena renal.
La cirugía conservadora de nefronas (CCN) es una de las causas más frecuentes de estas lesiones renovasculares2,4,5. Otras posibles causas son las nefrostomías, la litotricia, la pielolitotomía, la biopsia renal y la colocación de endoprótesis renales6-10.
El PSA y el PSA+FAV suelen manifestarse con dolor en fosa renal, hematuria macroscópica y anemia2.
La embolización transarterial (ETA) se considera el tratamiento de referencia porque es segura, mínimamente invasiva y permite detectar fácilmente el foco de la hemorragia y conseguir la hemostasia11.
El efecto de la ETA sobre la función renal no ha sido objeto de estudios exhaustivos y en la bibliografía existente este aspecto solo se aborda de manera parcial, ya que los datos publicados se refieren especialmente a las concentraciones de creatinina en lugar de la filtración glomerular estimada (FGe) y se basan en series relativamente pequeñas6,7,11-18. Además, aún no se ha investigado la relación entre las dimensiones del PSA y del PSA+FAV o el tipo de lesión vascular y el área de isquemia después de la ETA.
Nuestro estudio es un estudio observacional retrospectivo que evalúa el efecto de la ETA de los PSA y los PSA+FAV yatrógenos de la arteria renal sobre la función renal tanto después del procedimiento como a un plazo relativamente largo (6meses), el efecto de la ETA sobre el área de isquemia renal después del procedimiento, y su eficacia técnica y clínica como tratamiento de primera línea.
Materiales y métodosPacientesSe revisaron de manera retrospectiva los datos clínicos y de imagen de todos los pacientes sometidos a embolización por PSA y PSA+FAV renal yatrógeno entre diciembre de 2006 y octubre de 2020 en dos centros del mismo país (UOC Radiologia 2, Azienda Ospedale Università Padova, Padua, Italia; UOC Radiologia, Ospedale di San Bassiano, Bassano del Grappa, Vicenza, Italia). Seis pacientes se sometieron al procedimiento en (UOC Radiologia, Ospedale di San Bassiano, Bassano del Grappa, Vicenza, Italia) y 55 pacientes fueron tratados en (UOC Radiologia 2, Azienda Ospedale Università Padova, Padua, Italia).
Los procedimientos que originaban la formación del PSA o del PSA+FAV se han agrupado en este documento bajo el acrónimo QPE (quirúrgico, percutáneo o endoscópico), donde Q indica intervención quirúrgica (cirugía conservadora de nefronas abierta, laparoscópica o robótica, enucleorresección, etc.), P indica un procedimiento percutáneo en el riñón (nefrostomía, biopsia, etc.) y E indica un procedimiento endoscópico en el riñón (pielolitotomía, litotricia endoscópica, etc.).
Los criterios de inclusión para la angiografía y la embolización se basaron tanto en las características clínicas (hematuria, empeoramiento de la anemia, inestabilidad hemodinámica y shock hemorrágico) como en las características de las pruebas de diagnóstico por la imagen (visualización de la hemorragia en la tomografía computarizada con contraste [TCC]).
Todos los pacientes firmaron un consentimiento informado para el procedimiento de embolización.
Pruebas de diagnóstico por la imagen previas al procedimientoA todos los pacientes se les hizo una TCC como prueba de referencia (Lightspeed VCT, GE Healthcare, Milwaukee, EE.UU. y Somatom Sensation, Siemens, Erlangen, Alemania). Se inyectaron 50-80ml de 350-400mgI/ml de un medio de contraste yodado no iónico (Omnipaque 350, GE Healthcare, EE.UU.; Ultravist 370, Bayer Healthcare, Bruselas, Bélgica, e Iomeron 400, Bracco, Milán, Italia) en una vena antecubital a un caudal de 3,5-5ml/s seguido de un bolo de 30-40ml de solución salina a la misma velocidad de inyección con un inyector automático de doble cabezal (Stellant D, Medrad, Bayer Healthcare, Whippany, NJ, EE.UU.).
Se obtuvieron las fases precontraste, arterial temprana, venosa y urográfica. El momento de la fase arterial temprana se determinó mediante la técnica de seguimiento de bolo colocando la región de interés (RdI) a nivel de la aorta abdominal suprarrenal con un umbral de realce de 100UH (unidades Hounsfield). La fase venosa se efectuó con un retraso de 70segundos después de la fase arterial y la fase urográfica se adquirió al cabo de 8-10minutos.
Se realizaron reconstrucciones multiplanares (coronal y sagital) y se enviaron al sistema de almacenamiento y comunicación de imágenes (picture archiving and communication system [PACS]).
El PSA se definió en la TCC como una cavidad realzada en comunicación directa con una rama arterial renal lesionada en la fase arterial temprana; se diferenció de la hemorragia activa con hematoma subcapsular o perirrenal, porque un PSA es una acumulación densa bien definida de medio de contraste similar al realce arterial, limitada por la adventicia o el tejido conjuntivo. La extravasación activa de medio de contraste es una zona de realce mal definida (blush) o un área focal de hiperatenuación dentro de un hematoma que se difumina en un hematoma agrandado y realzado con posible estratificación en las imágenes diferidas19.
Las FAV se detectaron cuando se visualizó una comunicación directa entre una rama arterial y otra venosa, o por el realce de la vena renal o la vena cava inferior en la fase arterial temprana (fig. 1).
TCC y angiogramas que muestran PSA y PSA+FAV. a, b)TCC en la fase arterial y angiograma que muestran un gran PSA en el tercio medio del riñón izquierdo después de una CCN. c)TCC que muestra solo un PSA en el polo inferior del riñón derecho (flecha) después de la colocación de una sonda de nefrostomía. d)Angiograma del paciente en c que indica, en cambio, 2PSA (flechas). e)TCC que muestra un PSA en el tercio medio del riñón derecho asociado a un realce temprano de la vena renal ipsilateral (flecha), compatible con una FAV después de una CCN. f)Angiograma que confirma la presencia de PSA+FAV en el paciente e con opacificación temprana de la vena cava inferior (flecha). g, h)Angiogramas que muestran un PSA en el polo superior del riñón izquierdo tras una CCN antes y después de una embolización con espirales (flecha) con exclusión del PSA y pérdida de parénquima mínima (0-20%).
Un radiólogo intervencionista experimentado efectuó los procedimientos de embolización en una sala de angiografía.
Se hizo una punción percutánea de la arteria femoral común y se colocó una camisa estándar de 5F (Radifocus, Terumo, Tokio, Japón). Con un catéter diagnóstico de 5F (RDC o Cobra o Simmons, Tempo Aqua, Cordis, Miami, FL, EE.UU. o Glidecath, Terumo, Tokio, Japón) se hizo un cateterismo selectivo y una angiografía diagnóstica de la arteria renal principal. Una vez identificado el vaso intrarrenal diana, se llevó a cabo un cateterismo superselectivo mediante técnica coaxial con un microcatéter de 2,7F (Progreat, Terumo, Tokio, Japón). En todos los casos de cateterismo inestable se utilizó una técnica coaxial con un catéter guía (RDC o HS Vista Brite, 7F, Cordis, Miami, FL, EE.UU.; Contra, 8F, Boston Scientific, Natick, MA, EE.UU.).
El objetivo de la embolización era minimizar el parénquima renal sacrificado mediante la administración del material embolizante en una posición lo más distal posible. Se emplearon microespirales (Vortx, Boston Scientific, Natick, MA, EE.UU.; Tornado, Cook, Bloomington, IN, EE.UU.) implantadas por medio de una inyección de solución salina en bolo o un dispositivo de empuje de espirales (Coil pusher, Boston Scientific, Natick, MA, EE.UU.), microespirales desmontables (Concerto, ev3, Covidien, Plymouth, MA, EE.UU.), Spongostan (Spongostan, Johnson & Johnson Ethicon Inc, New Brunswick, NJ, EE.UU.), partículas de alcohol polivinílico (polyvinyl alcohol [PVA]) (Contour Emboli, Boston Scientific, Natick, MA, EE.UU.) o pegamento de cianoacrilato con aceite etiodizado (Glubran 2, GEM, Viareggio, Italia; Lipiodol Ultra Fluid, Guerbet, Villepinte, Francia). La elección del material embolizante se basó tanto en la lesión diana como en la experiencia personal del radiólogo intervencionista.
Después de administrar el material embolizante, se practicó una angiografía por sustracción digital (ASD) del riñón afectado para confirmar la exclusión de la lesión vascular.
Resultados de los procedimientosEl éxito técnico se definió como la oclusión completa del vaso diana con ausencia de hemorragia o visualización del PSA o PSA+FAV en la ASD final.
El fracaso técnico se definió como la imposibilidad de completar el procedimiento, la exclusión incompleta de la lesión vascular o la persistencia del PSA+FAV en la ASD final.
El éxito clínico se basó en la mejoría de los síntomas y de los datos de laboratorio de los pacientes.
El fracaso clínico se definió como la persistencia de los síntomas y el empeoramiento de los datos de laboratorio indicativos de persistencia de la lesión vascular.
Se utilizó el sistema de clasificación CIRSE como referencia para notificar y clasificar las complicaciones20.
La función renal se evaluó antes y un día después del procedimiento QPE y antes, un día después y 6meses después del procedimiento de embolización, utilizando la fórmula Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) para determinar la FGe (ml/min×1,73m2).
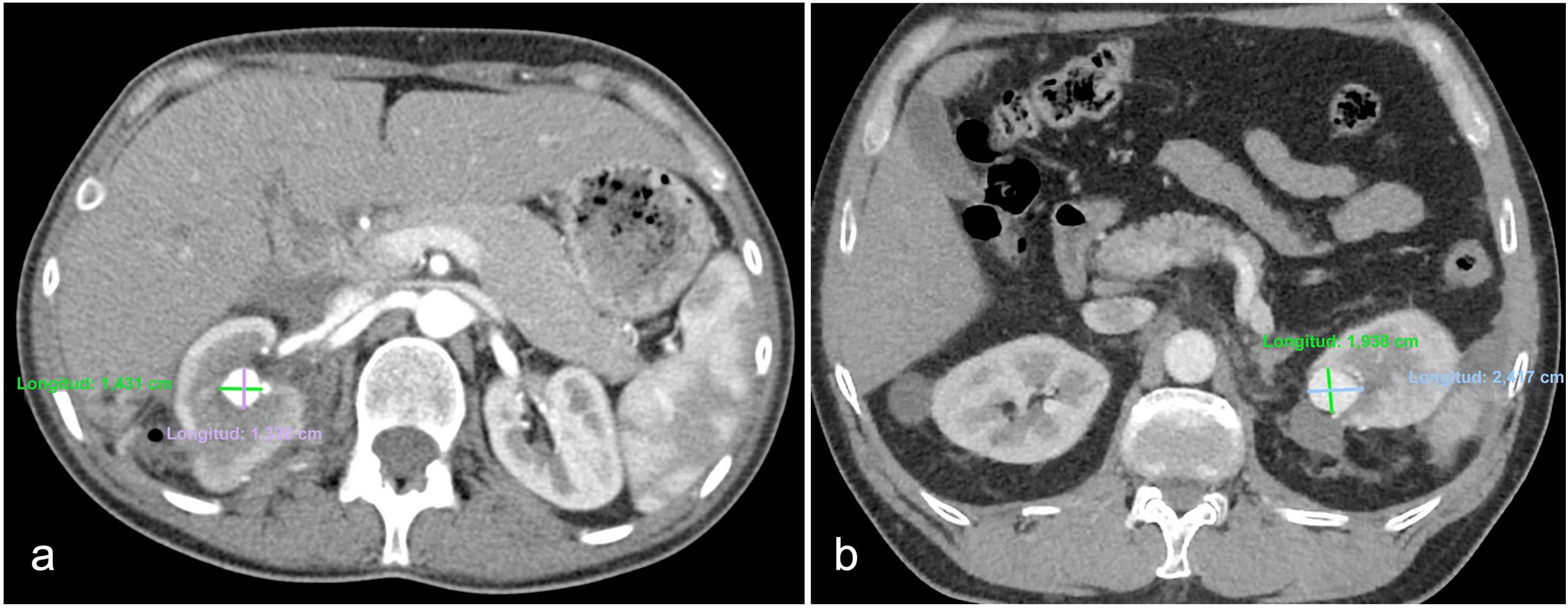
Las dimensiones de la lesión vascular se evaluaron en una imagen axial de la TCC previa al procedimiento en la fase arterial y las áreas (mm2) se calcularon con la fórmula de área de la elipse (A=πab, donde a indica el semieje mayor y b el semieje menor), como se muestra en la figura 2.
Las imágenes axiales en fase arterial de la TCC muestran un PSA+FAV (a) en el tercio medio del riñón derecho después de la CCN y un PSA (b) en el polo superior del riñón izquierdo después de la CCN. Los ejes mayor y menor de las lesiones son de 14 y 13mm en a y de 24 y 19mm en b, respectivamente. Las áreas de las lesiones calculadas mediante la fórmula de la elipse son de 143mm2 en a y de 358mm2 en b.
La pérdida de parénquima renal se calculó comparando la primera y la última parenquimografía renal y evaluando el porcentaje (%) de parénquima renal isquémico, con estratificación del área de isquemia en 0-20%, 20-40%, 40-60% y>60%, que a su vez se dividió en 0-20% y 20-60% para el análisis estadístico. En la figura 3 se explica cómo se evaluó el parénquima renal isquémico después de la ETA.
Evaluación de la isquemia del parénquima renal después del procedimiento mediante la comparación de la parenquimografía renal anterior y posterior a la ETA, con estratificación del área de isquemia en 0-20%, 20-40% y 40-60% en función de la cantidad de parénquima renal sin realce después de la ETA en comparación con la parenquimografía anterior a la ETA.
El seguimiento de todos los casos se llevó a cabo por medio de exploraciones clínicas y pruebas de laboratorio (es decir, creatinina sérica y filtración glomerular [FG]) periódicas. Los pacientes habían sido objeto de un seguimiento constante inmediatamente después de la ETA para comprobar la mejoría de los datos tanto clínicos como de laboratorio, en particular para confirmar que los parámetros cardiocirculatorios (frecuencia cardíaca y presión arterial) y los niveles de hemoglobina volvían a los valores fisiológicos normales y para confirmar el cese de la hematuria. En los casos en que los datos clínicos indicaban la persistencia de la hemorragia, se obtenía una nueva TCC de abdomen y, si el PSA o el PSA+FAV seguían presentes, se practicaba una nueva ETA.
Tras la primera TAC protocolizada en cuatro fases, esta no se repitió para evitar el riesgo de deterioro de la función renal como consecuencia del medio de contraste yodado. No se hicieron renogramas isotópicos debido a su escasa disponibilidad en nuestros centros.
Se hizo un seguimiento clínico o radiológico a medio y a largo plazo de los pacientes con un calendario basado en la patología subyacente por la que fueron operados o sometidos a otros procedimientos (cáncer, cálculos renales, hidroureteronefrosis, etc.).
Métodos estadísticosTodos los datos se analizaron con SAS 9.4 para Windows (SAS Institute Inc., Cary, NC, EE.UU.).
Se aplicó la prueba de la t de Student para datos emparejados para comparar los valores de la FGe.
La correlación entre el área de las lesiones vasculares y los valores de FGe se expresó mediante el coeficiente de correlación de rangos de Spearman.
El efecto de las dimensiones de la lesión (área) sobre el área de isquemia se evaluó mediante un método de regresión logística univariable y se expresó en forma de cociente de probabilidades (odds ratio [OR]).
Se utilizó la prueba de la t de Student con muestras independientes para comparar los valores de la FGe entre las categorías del área de isquemia (0-20%/20-60%) y el tipo de lesión vascular.
Las áreas de las lesiones se compararon en función del tipo de lesión vascular con la prueba de suma de rangos de Wilcoxon.
La asociación entre el tipo de lesión vascular y el área de isquemia se analizó con la prueba exacta de Fischer.
Se declaraba la significación estadística con valores de p<0,05.
ResultadosSe realizaron 67 procedimientos de embolización en 61 pacientes consecutivos. Los datos demográficos, clínicos y angiográficos se presentan en la tabla 1.
Datos demográficos, clínicos y angiográficos
| Características | Número (porcentaje) o media (DE o intervalo) | ||
|---|---|---|---|
| Número total de pacientes | 61 | ||
| Sexo | |||
| VM | 45 (73,8%)16 (26,2%) | ||
| Media de edad, años (intervalo) | 59 (16-83) | ||
| Lesiones vasculares | |||
| PSAPSA+FAV | 44 (65,7%)23 (34,3%) | ||
| Causa yatrógena | |||
| Cirugía conservadora de nefronasaLitotriciaNefrostomíaBiopsia percutáneaPielolitotomíaColocación de endoprótesis en la arteria renal | 49 (80,3%)5 (8,2%)3 (4,9%)2 (3,3%)1 (1,6%)1 (1,6%) | ||
| Éxito técnico | 95,5% | ||
| Éxito clínico | |||
| PrimarioSecundario | 90,2%96,7% | ||
| Materiales embolizantes | |||
| EspiralesEspirales y microespirales desmontablesMicroespirales desmontablesMicroespirales desmontables y partículas de PVAEspirales y SpongostanEspirales, microespirales desmontables y partículas de PVAPartículas de PVAEspirales y partículas de PVAMicroespirales desmontables y pegamento de cianoacrilato con aceite etiodizado | 39 (58,2%)8 (11,9%)5 (7,5%)5 (7,5%)3 (4,5%)3 (4,5%)2 (3%)1 (1,5%)1 (1,5%) | ||
| Áreas de lesión | |||
| Media (intervalo)b | 227,1mm2 (19,6-2705,7mm2) | ||
| Mediana de PSA (C1-C3) | 78,2mm2 (53-170,1mm2) | ||
| Mediana de PSA+FAV (C1-C3) | 176,7mm2 (63,6-673,9mm2) | ||
| Área de isquemia después del procedimiento | Total | PSA | PSA+FAV |
| 0-20% | 54 (80,6%) | 41 (95,3%) | 13 (56,5%) |
| 20-40% | 8 (11,9%) | 2 (4,7%) | 6 (26,1%) |
| 40-60% | 4 (6%) | 4 (17,4%) | |
| Valores de FGe (ml/min×1,73 m2) | |||
| Antes del procedimiento QPE (DE)Un día después del procedimiento QPE (DE)Antes de la ETA (DE)Un día después de la ETA (DE)6 meses después de la ETA (DE) | 82,3 (20,8)66,9 (22,4)66,8 (22,2)66,6 (23,1)75 (20,5) | ||
C1: cuartil inferior; C3: cuartil superior; DE: desviación estándar; ETA: embolización transarterial; FGe: filtración glomerular estimada; M: mujer; PSA: pseudoaneurisma; PSA+FAV: pseudoaneurisma con fístula arteriovenosa; PVA: alcohol polivinílico; QPE: quirúrgico, percutáneo o endoscópico; V: varón.
Identificamos 44 PSA yatrógenos y 23 PSA+FAV yatrógenos; cuatro pacientes presentaron dos PSA al mismo tiempo y dos pacientes tuvieron simultáneamente un PSA y un PSA+FAV.
Las causas de las lesiones vasculares yatrógenas, los materiales embolizantes, el área media de las lesiones vasculares y el porcentaje de parénquima renal isquémico después del procedimiento se recogen en la tabla 1.
Se consiguió el éxito técnico en 64 procedimientos (95,5%). En dos casos solo fue posible una embolización parcial, pero la hemorragia se detuvo de manera espontánea y la TCC de seguimiento practicada una semana después no documentó la extravasación del medio de contraste. En un caso hubo que suspender el procedimiento por problemas técnicos (apagón eléctrico) y el paciente tuvo que ser trasladado a un servicio de radiología intervencionista cercano, donde el procedimiento se completó con éxito. Por lo tanto, hubo fallo técnico en el 4,5% de los procedimientos (3/67).
El éxito clínico se obtuvo originalmente en 55 pacientes (90,2%). Cinco pacientes presentaron síntomas hemorrágicos 2, 6, 4, 8 y 7días después del primer procedimiento de embolización. Se les practicó una TCC, que indicó la persistencia de PSA o PSA+FAV, y otro procedimiento de embolización con el que se consiguió la hemostasia final (éxito clínico secundario, 59/61, 96,7%). En un único caso fue necesaria una tercera embolización 2días después del segundo procedimiento.
Los éxitos y fracasos técnicos y clínicos se muestran en el diagrama de flujo (fig. 4).
No se observaron complicaciones.
Los valores medios de la FGe y las diferencias medias de estos valores se presentan en la tabla 1, en la tabla 2 y en la figura 5. La FGe antes y después del procedimiento QPE estaba disponible para 53 pacientes. La FGe antes y un día después de la ETA estaba disponible para todos los pacientes excepto uno. La FGe a los 6meses estaba disponible para 48 pacientes, porque se perdió el contacto durante el seguimiento con seis pacientes y el procedimiento se realizó durante los 6meses anteriores al estudio en seis pacientes. Hubo una disminución significativa de la FGe un día después del procedimiento QPE. No se observaron diferencias significativas en la función renal antes y un día después de la ETA. La diferencia entre la FGe previa a la ETA y la FGe a los 6meses fue estadísticamente significativa, con una mejoría mínima pero significativa de la función renal después de 6meses (diferencia media en la FGe 5,6ml/min×1,73m2).
Diferencias medias en los valores de la FGe en diferentes puntos temporales. Hubo una disminución significativa de la FGe después de los procedimientos QPE, pero la FGe no disminuyó después de la ETA. Se observó una mejoría mínima de la función renal a los 6meses de seguimiento
| Comparación de la FGe | Diferencia media (DE) ml/min×1,73m2 | IC95% | p | |
|---|---|---|---|---|
| Antes – un día después del procedimiento QPE | 15,4 (15,6) | 11,1 | 19,7 | <0,0001* |
| Antes del procedimiento QPE - antes de la ETA | 13,6 (14,1) | 9,8 | 17,6 | <0,0001* |
| Un día después del procedimiento QPE - antes de la ETA | −1,6 (12,3) | −5 | 1,7 | 0,3362 |
| Antes de la ETA – un día después de la ETA | 0,2 (11,3) | −2,6 | 3 | 0,9977 |
| Antes de la ETA - 6meses después de la ETA | −5,6 (13) | −9,1 | −2,1 | 0,0021* |
| Un día después de la ETA - 6meses después de la ETA | −5,3 (14,4) | −9,2 | −1,3 | 0,0103* |
| Antes del procedimiento QPE - 6meses después de la ETA | 7,9 (13,1) | 4 | 11,7 | 0,0002* |
DE: desviación estándar; ETA: embolización transarterial; FGe: filtración glomerular estimada; IC: intervalo de confianza; PSA pseudoaneurisma; QPE: quirúrgico, percutáneo o endoscópico.
La probabilidad de un área de isquemia renal del 20-60% tras el procedimiento se multiplicaba por 1,8 por cada 200mm2 de área de lesión vascular (fig. 6).
Correlación entre las áreas de lesión vascular (mm2) y el porcentaje de parénquima renal isquémico después del procedimiento (%). La probabilidad de un área de isquemia renal del 20-60% después del procedimiento se multiplicaba por 1,8 por cada 200mm2 de área de lesión vascular (OR: 1,845; IC95%: 1,16-3,25; p=0,0219).
En la figura 7 se muestran las diferencias entre las áreas de PSA y PSA+FAV y la probabilidad de tener un área de isquemia después del procedimiento del 20-60%.
En la parte izquierda, áreas (mm2) de las lesiones vasculares en relación con el tipo de lesión vascular. Las áreas de los PSA+FAV fueron significativamente mayores que las dimensiones de los PSA (mediana de la diferencia 78,15mm2; IC95%: 8,6mm2-201,1mm2; p=0,0142). A la derecha, el porcentaje de frecuencia de un área de isquemia después del procedimiento del 0-20% o del 20-60% en función de la lesión vascular. La probabilidad de tener un área de isquemia del 20-60% después del procedimiento fue significativamente mayor en el grupo de PSA+FAV (diferencia de proporciones 38,8%; IC 16,4%-61,5%; p=0,0002).IC95%: intervalo de confianza al 95%; PSA: pseudoaneurisma; PSA+FAV: pseudoaneurisma con fístula arteriovenosa.
No se observó ninguna correlación entre el área de las lesiones vasculares, el porcentaje de parénquima isquémico renal después del procedimiento o el tipo de lesión vascular y la diferencia en los valores de la FGe antes y después del procedimiento (tabla 3).
Correlación entre las diferencias medias de los valores de la FGe en diferentes puntos temporales y las dimensiones de las lesiones vasculares (expresadas mediante el coeficiente de correlación de rangos de Spearman), el porcentaje de parénquima isquémico renal después del procedimiento y el tipo de lesión vascular. La FGe se mide en ml/min×1,73m2. No se observaron correlaciones significativas
| Correlación | Áreas | 20-60%-0-20% | PSA+FAV-PSA | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ρ de Spearman | p | Media | IC95% | p | Media | IC95% | p | |||
| FGe antes de la ETA – un día después de la ETA | −0,05 | 0,6992 | −0,9 | 6,1 | +4,2 | 0,7041 | −1,4 | −7,3 | +4,5 | 0,6434 |
| FGe antes de la ETA – 6meses después de la ETA | 0,13 | 0,3581 | +1,2 | −7,2 | +9,6 | 0,7778 | −0,2 | −7,4 | +7 | 0,9523 |
| FGe un día después de la ETA - 6meses después de la ETA | 0,14 | 0,3238 | +1,5 | −8,1 | +11 | 0,7613 | −0,2 | −8,3 | +8 | 0,9663 |
ETA: embolización transarterial; FGe: filtración glomerular estimada; IC95%: intervalo de confianza al 95%; PSA: pseudoaneurisma; PSA+FAV: pseudoaneurisma con fístula arteriovenosa.
El PSA yatrógeno y el PSA+FAV son cada vez más frecuentes en la práctica clínica diaria9.
La CCN constituyó la causa principal en nuestra serie (49/61). Se ha notificado que la nefrectomía parcial laparoscópica se relaciona con una mayor incidencia de PSA que la nefrectomía parcial abierta, mientras que los datos sobre la CCN robótica son escasos y aislados2,21. Se ha descrito una incidencia de PSA renal del 0,5% y del 1,7% después de la NP abierta y laparoscópica, respectivamente, aunque la incidencia real de PSA y PSA+FAV después de la CCN es objeto de debate4,12,22-24. Varios autores han señalado que la mayor duración de la intervención quirúrgica, el mayor tiempo de isquemia fría y una localización del tumor más próxima al seno renal o al sistema colector podrían explicar la mayor incidencia de PSA y PSA+FAV13,25.
El tiempo transcurrido hasta la aparición del PSA y del PSA+FAV después de la cirugía varía desde horas hasta meses, y la mayoría se manifiestan en un plazo de 15días. Es importante descartar la presencia de PSA y de PSA+FAV en pacientes con síntomas típicos incluso meses después de la intervención quirúrgica14,26,27.
Entre otras causas de PSA y PSA+FAV en nuestra serie se encuentran las nefrolitotomías, las nefrostomías y las biopsias renales, con una incidencia notificada del 0,4-0,7%, 2% y 5%, respectivamente9. Las angioplastias, la colocación de endoprótesis, las litotricias y otros procedimientos endourológicos son causas extremadamente raras9,28.
La ETA se considera la mejor opción de tratamiento del PSA o del PSA+FAV sintomáticos; el primer caso descrito se remonta a 197529. Los agentes embolizantes preferentes son las microespirales, que permiten una embolización selectiva y distal con el fin de preservar la máxima vascularización y reducir al mínimo la pérdida de parénquima renal. Hay que tener en cuenta que no pueden utilizarse materiales embolizantes como las partículas de PVA para el PSA+FAV debido al riesgo de migración del material al sistema venoso. Sin embargo, las partículas de PVA pueden utilizarse con seguridad para ocluir completamente el segmento de una arteria diana, en especial en casos de PSA pequeño y distal (sin comunicación venosa). Si no es posible posicionar el microcatéter de forma superselectiva en el vaso diana, pueden inyectarse partículas de PVA seguidas de una o más espirales. La embolización con espirales es muy eficaz e induce el cierre completo del vaso y la exclusión de la lesión vascular diana. El pegamento se reserva para las lesiones arteriales graves, puesto que permite un cierre rápido, pero debe administrarse con precaución para evitar el reflujo hacia ramas no deseadas15,16. Empleamos pegamento de cianoacrilato con aceite etiodizado en un paciente en el tercer procedimiento de embolización, después de que las espirales, las espirales desmontables y las partículas de PVA resultaran ineficaces. La elección del agente embolizante y su combinación se basa en el diámetro del vaso diana, la presencia de una FAV y la experiencia del radiólogo intervencionista.
La ETA es segura y muy eficaz, con un éxito técnico y clínico de hasta el 100% en la mayoría de los resultados publicados, y nuestros resultados coinciden con los de los estudios anteriores1,7,11,13-16,24.
El éxito clínico fue del 90,2%, ya que cinco pacientes debieron someterse a una segunda embolización debido a la reperfusión del saco pseudoaneurismático; este problema se describe en la literatura médica13,15,24. La necesidad de una segunda intervención se relaciona con diversos factores, como una embolización incompleta, vasos accesorios, la recanalización de los vasos tratados o la formación de nuevos pseudoaneurismas17.
Un tema muy controvertido es cuándo tratar los PSA. Aparte de los sintomáticos, no todos los PSA de la arteria renal precisan tratamiento. El empeoramiento de la anemia y las grandes dimensiones del saco pseudoaneurismático hacen necesaria la intervención ante el riesgo de hemorragia masiva4,13,27,30.
La embolización de una rama de la arteria renal que irriga un PSA o un PSA+FAV genera inevitablemente un área de isquemia parenquimatosa, aun cuando la embolización se efectúe en una posición lo más distal posible, ya que las ramas de la arteria renal son arterias terminales anatómicas. Como sabemos, el método volumétrico por TCC es el método de referencia para el cálculo del volumen del parénquima renal sacrificado tras un procedimiento de embolización, pero es preciso disponer de exploraciones por TCC anteriores y posteriores al procedimiento. Para calcular el porcentaje de isquemia del parénquima renal decidimos evaluar la primera y la última parenquimografía renal, ya que se disponía de imágenes angiográficas de todos los pacientes. No se disponía de imágenes de TAC —que habrían permitido una evaluación volumétrica más fiable— de muchos pacientes por diversos motivos, principalmente porque a menudo los pacientes habían sido derivados a nuestros centros de radiología intervencionista para el procedimiento de embolización o para exploraciones de seguimiento quirúrgico/urológico y las exploraciones radiológicas se habían realizado en otros centros. En este estudio, revelamos que el porcentaje de parénquima sacrificado depende tanto de las dimensiones como del tipo de lesión vascular. Demostramos que, con un aumento de las dimensiones de la lesión vascular de 200mm2, la probabilidad de que se genere un área de isquemia mayor (20-60%) como consecuencia de la ETA se multiplicaba por 1,8. También observamos que los PSA+FAV tienen dimensiones significativamente mayores que los PSA y su embolización da lugar a un área de isquemia mayor, algo que ya habíamos investigado en nuestro estudio anterior, pero sin resultados concluyentes18. Otra posible explicación de que los PSA+FAV produzcan un área de isquemia mayor podría ser la localización proximal de la comunicación entre las ramas renales arterial y venosa, que obligaría a una embolización más proximal. Hasta donde sabemos, no hay datos en la literatura médica que recomienden un material embolizante u otro para reducir el área de isquemia después del procedimiento, pero Dong et al.31 sugieren que una embolización en una posición lo más distal posible con microespirales permite una pérdida de parénquima mínima, frente al uso de partículas de esponja de gelatina o partículas de PVA seguido de espirales cuando no es posible una embolización superselectiva; en estos casos, el uso de partículas con espirales puede ser eficaz para la oclusión de la lesión vascular, pero podría producir un área de isquemia mayor después del procedimiento.
Como consecuencia de la pérdida de parénquima renal, al menos debe plantearse la hipótesis de una disminución de la función renal. Dado que los centros incluidos en el estudio son centros de referencia en radiología intervencionista y teniendo en cuenta el carácter retrospectivo del estudio, con seis pacientes se perdió el contacto durante el seguimiento y sus valores de la FGe a los 6meses no estaban disponibles. Otros seis pacientes habían sido sometidos al procedimiento en los 6meses anteriores al estudio y sus datos sobre la FGe no estaban disponibles, pero se han incluido en el estudio para evaluar el área de isquemia posterior al procedimiento, ya que esta estaba disponible en las imágenes angiográficas de la ETA. La FGe 6meses después de la ETA fue significativamente menor que la FGe antes del procedimiento «causante», pero la disminución significativa de la función renal fue posterior a los procedimientos QPE. No se observó un empeoramiento de la función renal antes y después de la ETA ni antes de la ETA y a los 6meses, cuando los valores de FGe mostraban una mejoría muy escasa pero estadísticamente significativa en comparación con los valores anteriores a la ETA. No se observó un efecto negativo sobre la función renal en un grupo u otro, en particular las lesiones de mayor tamaño y la presencia de PSA+FAV, que dieron lugar a áreas de isquemia más grandes, no determinaron una reducción de la función renal. En este estudio se demuestra que, aunque la ETA produce cierta pérdida de parénquima, no afecta negativamente a la función renal. Esto podría explicarse por los mecanismos compensatorios homeostáticos, entre los que se incluye la hipertrofia del parénquima renal conservado. En un grupo de estudios anteriores se ha investigado el efecto de la ETA sobre la función renal, pero aunque sus resultados coinciden con los de nuestro estudio, se basaron principalmente en la creatinina o la FGe justo después de la ETA, sin un control a medio o a largo plazo, o se basaron en muestras más pequeñas, o bien solo tuvieron en cuenta PSA o PSA+FAV después de la CCN, sin incluir otros procedimientos6,7,11-18. Chavali et al.13 revisaron 1,417casos de nefrectomía parcial, en 20 de los cuales se desarrollaron PSA y se practicaron ETA, y no observaron diferencias en el porcentaje de conservación de la filtración glomerular estimada (FGe) entre los pacientes sometidos a embolización frente a los controles. Gupta et al.17 no observaron ningún efecto adverso a largo plazo sobre la función renal al comparar los valores de la FGe de 25 pacientes antes y después de una ETA, excepto en el caso de un paciente con un solo riñón. Nuestros hallazgos contrastan con los notificados por Lee et al.25, y es probable que esto se deba a que nuestra muestra es mayor y a que ellos también tuvieron en cuenta la función renal después de un año, que podría verse afectada no solo por la ETA, sino también por enfermedades crónicas como la diabetes y la hipertensión y por una reducción de la FGe asociada a la edad. En otros estudios se utilizó la renografía dinámica con radioisótopos para evaluar la función renal después de la ETA y sus resultados coinciden con los de nuestro estudio basado en la FGe según la fórmula CKD-EPI32,33.
Por lo que sabemos, este estudio es uno de los primeros en investigar la relación entre las dimensiones, el tipo de lesión vascular y el área de isquemia después de la ETA en una muestra uniforme. En segundo lugar, este estudio revela que la ETA conserva la función renal cuando se utiliza en el tratamiento del PSA y el PSA+FAV yatrógenos en una muestra mayor en comparación con la mayoría de los resultados publicados. Por último, nuestro estudio confirma la eficacia técnica y clínica de la ETA en las lesiones renovasculares yatrógenas.
Las limitaciones del presente estudio incluyen su carácter retrospectivo y la falta de comparación con una cohorte de pacientes tratados quirúrgicamente. No obstante, la incidencia relativamente baja de estas lesiones vasculares hace improbable que se lleve a cabo un ensayo prospectivo aleatorizado. También es poco probable que los pacientes sean sometidos a una intervención quirúrgica como tratamiento de primera línea. Además, este estudio no establece una correlación de la conservación del parénquima renal con pruebas cuantitativas y cualitativas de la función renal.
Es necesario llevar a cabo otros estudios para revisar los criterios de inclusión y exclusión para el tratamiento del PSA y el PSA+FAV e investigar las causas de la reperfusión del saco pseudoaneurismático.
ConclusionesEn conclusión, la ETA es el tratamiento de referencia del PSA y del PSA+FAV, ya que es segura, eficaz y presenta un elevado éxito técnico y clínico. La ETA no reduce significativamente la función renal, independientemente de las dimensiones de la lesión vascular, el tipo de lesión vascular o el área de isquemia después del procedimiento.
Contribuciones de los autoresTodos los autores contribuyeron a la concepción y el diseño del estudio. El Dr. Stefano Groff, el Dr. Giulio Barbiero y la Prof. Anna Chiara Frigo se encargaron de la preparación del material, la recopilación de datos y el análisis. El Dr. Stefano Groff y el Dr. Giulio Barbiero redactaron el primer borrador del artículo, y todos los autores expresaron su opinión sobre versiones anteriores. Todos los autores leyeron y aprobaron el artículo final.
Consentimiento informadoSe obtuvo el consentimiento informado de todos los participantes individuales incluidos en el estudio.
FinanciaciónEsta investigación no recibió ninguna subvención específica de organismos de financiación de los sectores público, privado o sin ánimo de lucro.
Contribuciones de los autoresTodos los autores contribuyeron a la concepción y el diseño del estudio. El Dr. Stefano Groff, el Dr. Giulio Barbiero y la Prof. Anna Chiara Frigo se encargaron de la preparación del material, la recopilación de datos y el análisis. El Dr. Stefano Groff y el Dr. Giulio Barbiero redactaron el primer borrador del artículo, y todos los autores expresaron su opinión sobre versiones anteriores. Todos los autores leyeron y aprobaron el artículo final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.