Revisar la tolerancia y la eficacia a medio plazo de la crioablación guiada con ecografía realizada como tratamiento alternativo a la cirugía en lesiones fibroadenomatosas de mama en nuestro hospital.
MétodoSe recogieron de los archivos los datos de las 12 pacientes con fibroadenomas tratados con crioablación guiada con ecografía entre noviembre del 2020 y julio del 2022 en nuestro hospital. Para la crioablación se utilizaron los sistemas Galil Boston Scientific® con gas argón y Prosense Ice Cure® con nitrógeno líquido, con protocolo triple fase (congelación-descongelación-congelación) de duración variable dependiendo del tamaño de la lesión. Se hizo el seguimiento con ecografías, la primera a los 3 meses del procedimiento y posteriormente semestrales hasta los 18 meses.
ResultadosTodas las pacientes toleraron bien el procedimiento, 2de ellas refirieron dolor moderado en las horas siguientes, no hubo ninguna otra complicación. Los hallazgos en el seguimiento fueron: disminución del volumen del fibroadenoma (del 47,07% a los 3 meses, 77,79% a los 6 meses, 81,77% a los 12 meses y 88,81% a los 18 meses), peor definición de los márgenes del nódulo, disminución significativa o desaparición del flujo en el estudio Doppler en la lesión, una banda ecogénica (que representaba edema, hemorragia y necrosis grasa) y zonas hipoecoicas sugerentes de fibrosis rodeando el fibroadenoma.
ConclusionesLa crioablación se realiza de forma ambulatoria, evita una anestesia general, es menos costosa y tiene mejor resultado cosmético.
To review the tolerance to and medium-term efficacy of ultrasound-guided cryoablation as an alternative to surgical treatment of fibroadenomas of the breast in our hospital.
MethodWe analyzed data from the 12 patients with fibroadenomas treated with ultrasound-guided cryoablation in our hospital between November 2020 and July 2022. Cryoablation was performed with a system using argon gas (Galil Boston Scientific®) or liquid nitrogen (Prosense Ice Cure®) following a triple-phase (freeze-thaw-freeze) protocol of variable duration depending on the size of the lesion. Patients were followed up with ultrasonography at 3, 6, 12, and 18 months.
ResultsAll patients tolerated the procedure well. Two patients reported moderate pain in the hours immediately after the procedure; no other complications occurred. The findings during follow-up included decreased volume of the fibroadenoma (47.07% at 3 months, 77.79% at 6 months, 81.77% at 12 months, and 88.81% at 18 months), blurring of the nodule's margins, a significantly reduced or absent signal within the lesion in the Doppler study, an echogenic band (representing edema, hemorrhage, and fat necrosis), and hypoechoic areas suggestive of fibrosis surrounding the fibroadenoma.
ConclusionsCryoablation is done on an outpatient basis, avoiding general anesthesia, thus making it less expensive. Cryoablation yields better cosmetic results than surgery.
Los fibroadenomas son los tumores benignos de la mama femenina más frecuentes. Aunque son más comunes durante la segunda y tercera décadas, pueden presentarse en cualquier edad. Aproximadamente el 10% de las mujeres tendrá un fibroadenoma a lo largo de su vida, siendo múltiples en un 20% de las mujeres. Son lesiones proliferativas de elementos epiteliales y conectivos, que se originan en los lóbulos del tejido mamario. Son estrógeno dependientes y pueden crecer1-3.
En la mayoría de los casos se manejan de forma conservadora, haciendo seguimiento con prueba de imagen, generalmente ecografía, para demostrar su estabilidad. Sin embargo, en algunas pacientes, pueden ser sintomáticos: (palpables, dolorosos), causar deformidad en la mama, aumentar de tamaño o motivar ansiedad. La extirpación quirúrgica es el tratamiento tradicional en estos casos. Las técnicas ablativas percutáneas, mínimamente invasivas, ofrecen la oportunidad de tratar fibroadenomas sin cirugía, evitando las posibles complicaciones de esta además de la anestesia general1,2,4,5.
La eficacia y seguridad de la crioablación de fibroadenomas se han demostrado en múltiples publicaciones3,5,6.
En Estados Unidos, la crioablación y la extirpación percutánea mediante biopsia asistida por vacío (BAV) han sido aprobadas para su uso en la práctica clínica por la Food and Drug Administration en el tratamiento de los fibroadenomas e incluidas en el algoritmo de manejo de estos por las Guías de la Sociedad Americana de Cirujanos de Mama4,7.
La crioablación puede ser especialmente útil en mujeres con múltiples fibroadenomas que ya han sido tratadas mediante cirugía de alguno de ellos o en las que prefieren evitar un tratamiento quirúrgico8,9 y como alternativa a la BAV en nódulos demasiado grandes para ser extirpados con esta técnica.
El objetivo de este estudio retrospectivo es revisar la tolerancia y la eficacia a medio plazo de la crioablación guiada con ecografía, realizada como tratamiento alternativo a la cirugía y la BAV en lesiones fibroadenomatosas de mama en nuestra unidad.
MétodosEstudiamos retrospectivamente los casos de 12 pacientes con fibroadenomas tratados con crioablación en nuestro centro entre noviembre del 2020 y julio del 2022.
La indicación de crioablación fue el aumento de tamaño de la lesión en al menos 2de las 3medidas en ecografía en fibroadenomas palpables en todos los casos excepto en una paciente que presentaba varios fibroadenomas de gran tamaño, todas ellas mujeres que deseaban tratamiento. Se excluye el tratamiento de fibroadenomas únicos estables.
Tras objetivar el aumento de tamaño del fibroadenoma en una ecografía de seguimiento se realizó biopsia con aguja gruesa (BAG) guiada por ecografía para confirmación histológica del diagnóstico, previa al tratamiento. Las BAG diagnósticas se hicieron con agujas 14 G Acecut Léleman® (TSK Laboratory, Hirayanagi-Cho, Tochigi-Ken, Japón) o Bip-HistoCore® (BIP GmbH,Türkenfeld, Alemania) 14G, obteniendo entre 3 y 5 cilindros.
Antes de someterse al procedimiento de crioablación las pacientes firmaron un consentimiento informado en el que, además de la descripción de la técnica y de sus posibles riesgos y beneficios, se les garantizaba la anonimización de las imágenes e información de su historia clínica en caso de ser utilizados con fines docentes o científicos.
Se usó un ecógrafo Acuson 2000® (Siemens, Berlín, Alemania) con un transductor de 18MHz.
Para la crioablación se utilizaron indistintamente los sistemas ICEfx Galil Boston Scientific® (Boston Scientific Way, Marlborough, MA, Estados Unidos) con gas argón empleando agujas de 14 y 17 G y el Prosense Ice Cure® (IceCure Medical, Caesarea, Israel) con nitrógeno líquido mediante agujas 13 G. En un caso se utilizaron 2agujas a la vez en la misma lesión y en 6 casos, después de un primer ciclo de congelación-descongelación-congelación, al comprobar la existencia de una parte del nódulo sin cubrir por la bola de hielo, se realizó un segundo ciclo tras recolocar la aguja para englobar completamente la parte restante del fibroadenoma.
Los procedimientos de crioablación fueron realizados por los 7 radiólogos de la Unidad de Mama, con experiencia de entre 5 y 25 años.
El procedimiento se realizó con la paciente en decúbito supino. Tras la administración de anestésico local en el punto de acceso, bajo control ecográfico, se insertó la aguja de crioablación atravesando el centro del nódulo a lo largo de su eje mayor, sobrepasándolo unos 5mm. Se obtuvieron imágenes ortogonales para documentar el posicionamiento central de la aguja en el fibroadenoma.
Se aplicó el protocolo habitual de congelación-descongelación-congelación, con fases de duración variable dependiendo del sistema utilizado, el tamaño del fibroadenoma, la distancia de este a la piel y el margen de ablación deseado. A la anestesia inyectada se le añade el efecto anestésico local del frío.
Se controló ecográficamente, en tiempo real, la formación y crecimiento de la bola de hielo hasta que esta englobó el nódulo por completo (figs. 1-3). En caso de lesiones muy superficiales, durante el procedimiento, se aplicó una bolsa de suero caliente sobre la piel de la paciente para minimizar la posibilidad de quemadura por frío.
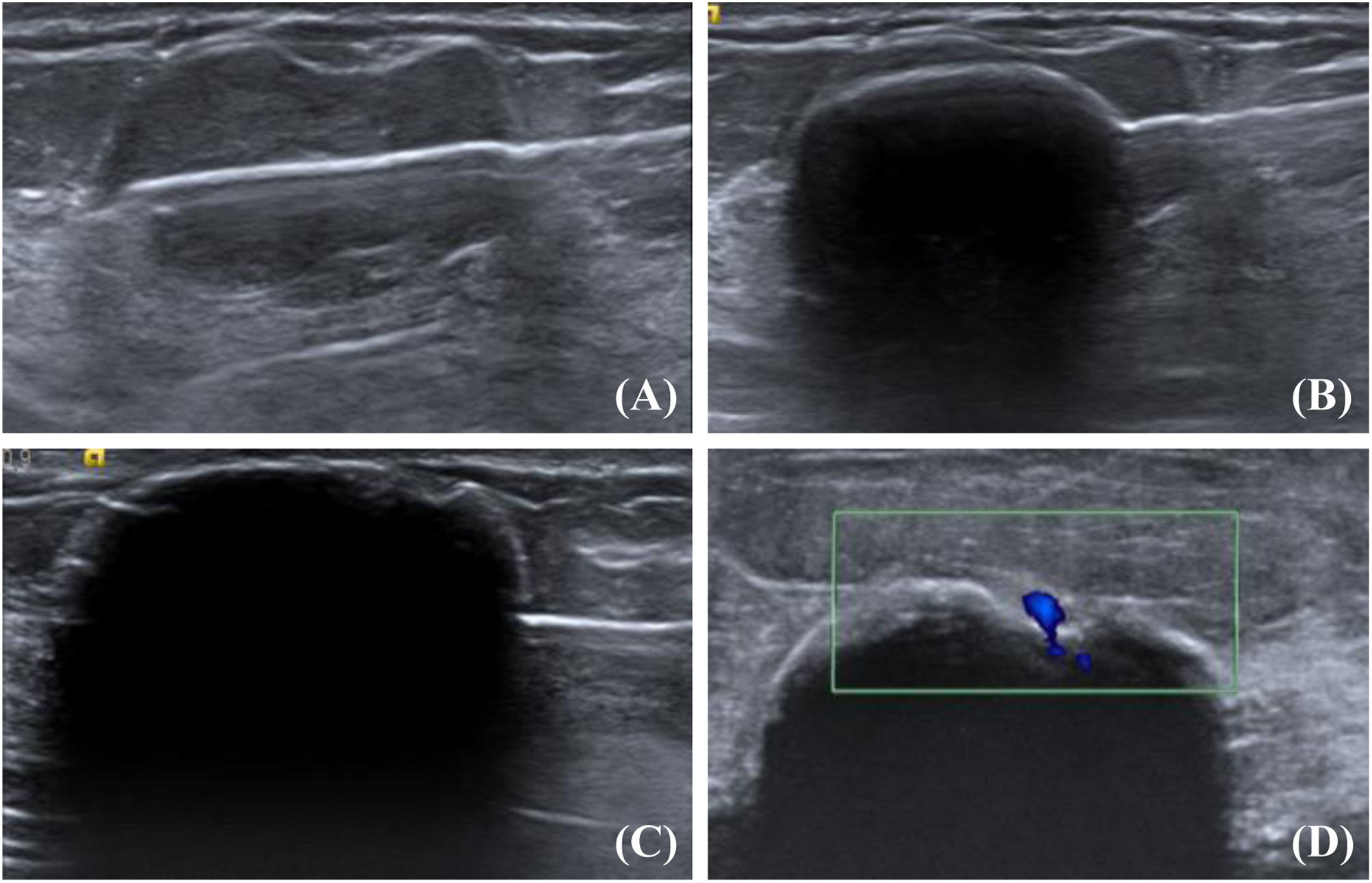
Procedimiento de crioablación guiado por ecografía. A) La aguja de crioablación atraviesa el fibroadenoma a lo largo de su eje mayor. B) Formación de la bola de hielo: imagen lineal ecogénica convexa con sombra acústica posterior. C) La bola de hielo va aumentando hasta englobar completamente el fibroadenoma, se mantiene el tiempo pautado. Posteriormente se inicia la descongelación pasiva y después una nueva fase de congelación. D) En otro caso, se observa una concavidad en la superficie de la bola de hielo debido al calentamiento del vaso sanguíneo adyacente (plano ortogonal).
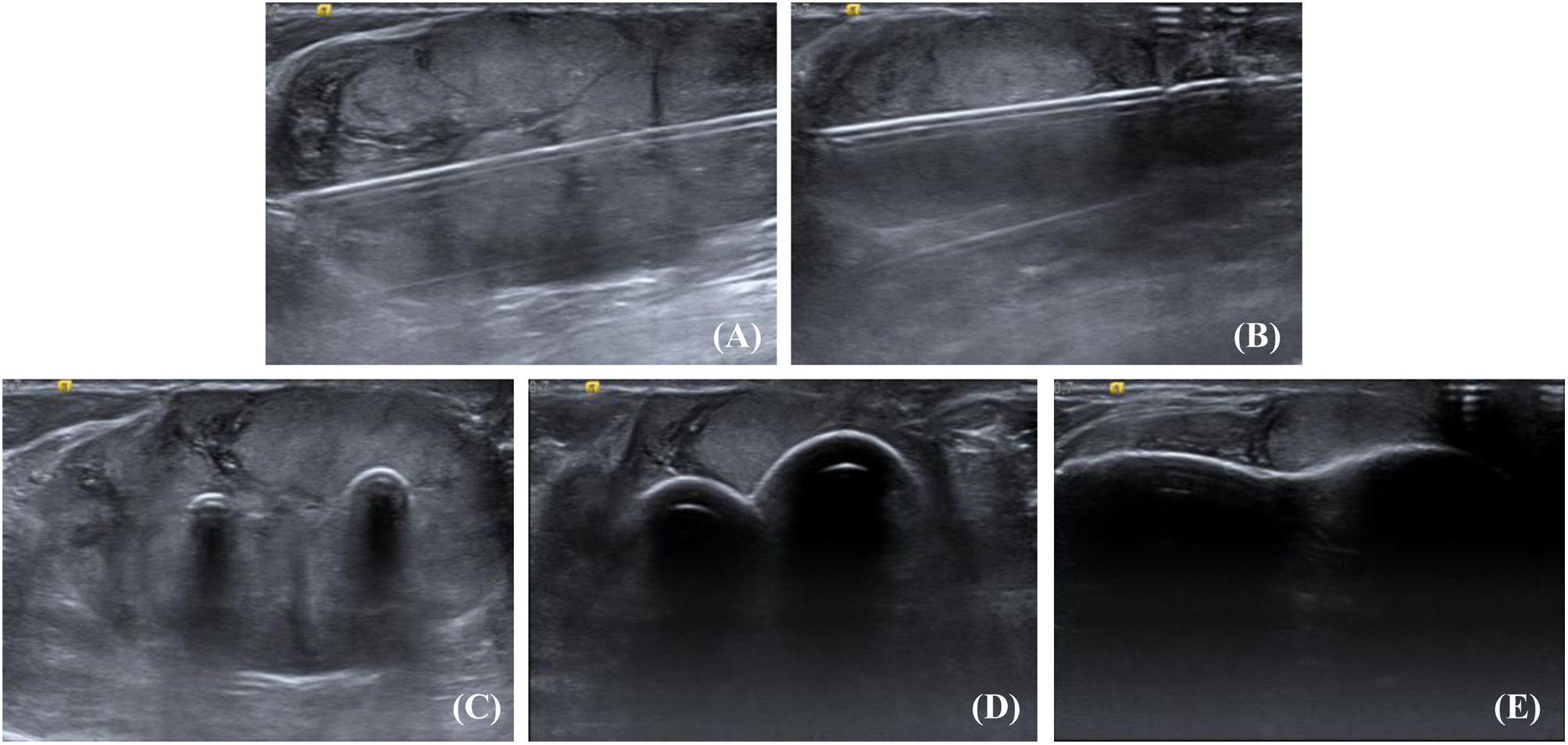
Fibroadenoma de 38mm, crioablación con aguja Icepearl® 14 G, cubriendo en 2ciclos de congelación-descongelación-congelación la totalidad del nódulo. A) Fibroadenoma de 38mm en el CSE de la mama izquierda. B) Primer ciclo de congelación-descongelación congelación cubriendo los 2tercios internos del fibroadenoma. C) Se comprueba que persiste una parte del fibroadenoma sin cubrir por la bola de hielo. D) Segundo ciclo cubriendo la porción externa restante tras la recolocación de la aguja.
Después del procedimiento, tras la retirada de la aguja, se mantuvo compresión del punto de acceso hasta conseguir la hemostasia.
Se pidió a las pacientes que calificaran el grado de dolor como leve, moderado o intenso al terminar el procedimiento y en el primer control a los 3 meses.
Se hicieron revisiones con ecografía a los 3 y 6 meses del procedimiento, con controles semestrales hasta los 18 meses.
Se registraron las siguientes variables: número de pacientes, edad (años), medida del eje mayor (mm) y volumen (cc) del fibroadenoma antes de la crioablación, distancia desde el borde más superficial de la lesión a la piel (mm), sistema de crioablación y aguja utilizados, duración total del protocolo aplicado (minutos), dolor (leve, moderado o intenso), otras complicaciones, medida del eje mayor (mm) y volumen (cc) del fibroadenoma y hallazgos ecográficos en cada revisión posterior.
La descripción de los datos cuantitativos se realizó mediante la mediana, media±desviación típica.
ResultadosSe estudiaron los casos de 12 pacientes con edades comprendidas entre 16 y 47 años (mediana 35, media 34,7±9,6).
Todos los fibroadenomas eran palpables, de tamaños que oscilaban entre 23 y 64mm de eje mayor (mediana 37,5; media 40,3±13,5), con volumen entre 3,9 y 61,5 cc (mediana 14,3; media 19,4±18,3). La distancia desde el borde más superficial de la lesión a la piel osciló entre 0 y 9mm (mediana 2,1; media 2,9±2,6).
La duración total del procedimiento fue entre 15 y 52 min (mediana 30; media 29,8±11,7).
Todas las pacientes toleraron bien el procedimiento, 2de ellas refirieron dolor moderado en las horas posteriores. No hubo ninguna otra complicación (tabla 1).
Doce pacientes con fibroadenomas tratados con crioablación
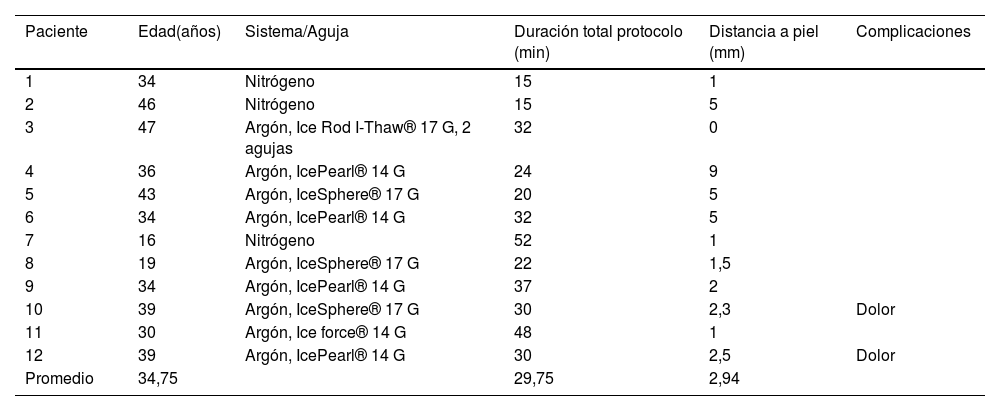
| Paciente | Edad(años) | Sistema/Aguja | Duración total protocolo (min) | Distancia a piel (mm) | Complicaciones |
|---|---|---|---|---|---|
| 1 | 34 | Nitrógeno | 15 | 1 | |
| 2 | 46 | Nitrógeno | 15 | 5 | |
| 3 | 47 | Argón, Ice Rod I-Thaw® 17 G, 2 agujas | 32 | 0 | |
| 4 | 36 | Argón, IcePearl® 14 G | 24 | 9 | |
| 5 | 43 | Argón, IceSphere® 17 G | 20 | 5 | |
| 6 | 34 | Argón, IcePearl® 14 G | 32 | 5 | |
| 7 | 16 | Nitrógeno | 52 | 1 | |
| 8 | 19 | Argón, IceSphere® 17 G | 22 | 1,5 | |
| 9 | 34 | Argón, IcePearl® 14 G | 37 | 2 | |
| 10 | 39 | Argón, IceSphere® 17 G | 30 | 2,3 | Dolor |
| 11 | 30 | Argón, Ice force® 14 G | 48 | 1 | |
| 12 | 39 | Argón, IcePearl® 14 G | 30 | 2,5 | Dolor |
| Promedio | 34,75 | 29,75 | 2,94 |
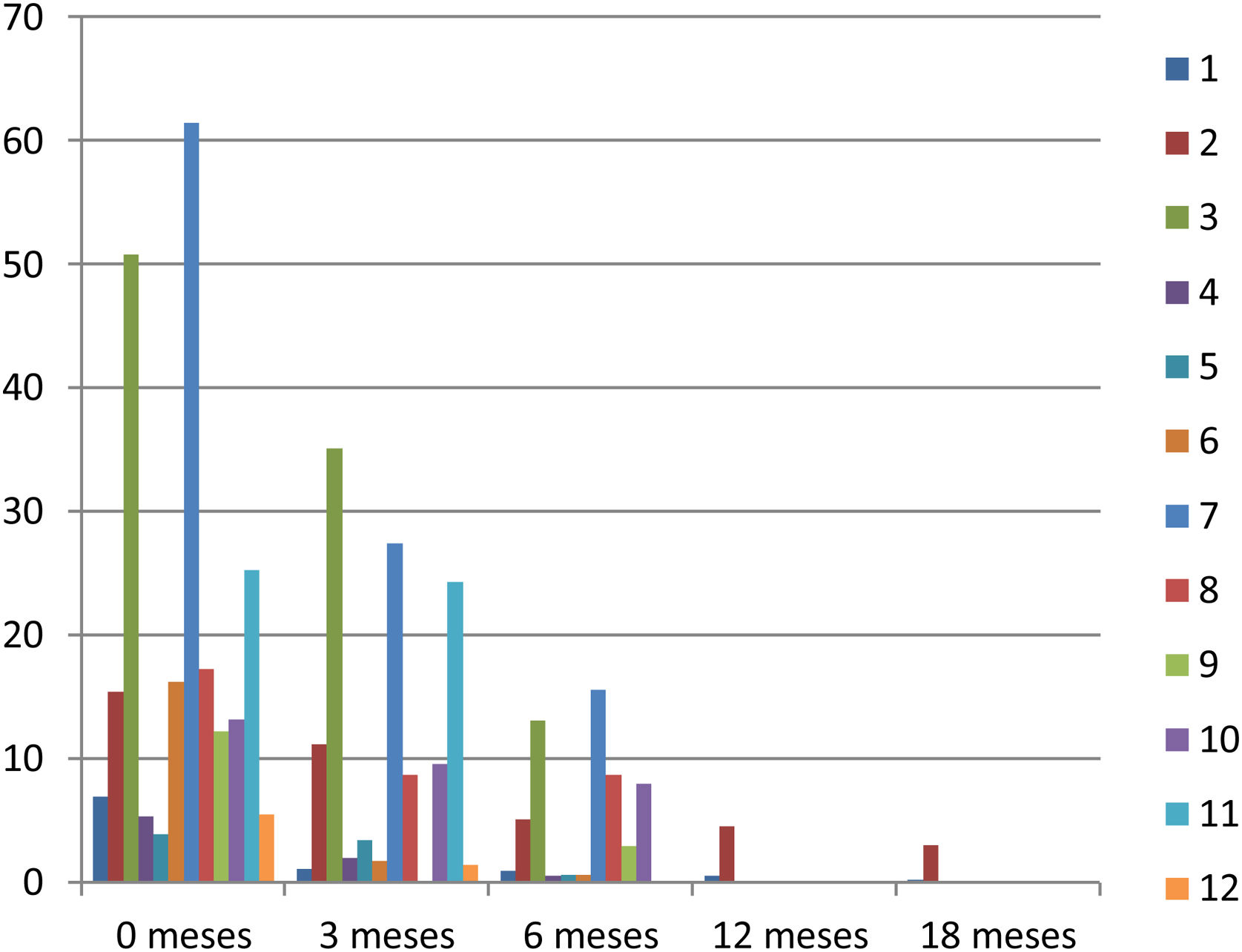
El seguimiento disponible hasta el momento oscila entre 90 y 675 días (media 237). El hallazgo principal en el seguimiento fue la disminución del tamaño del fibroadenoma, la media de disminución de volumen a los 3 meses fue del 47,07±29%, mediana 50%, a los 6 meses del 73,95±18%, mediana 75%, a los 12 meses del 78,20±13%, mediana 71% y a los 18 meses del 88,81±12%, mediana 89% (fig. 4) (tabla 2). Los nódulos presentaban un borde peor definido que dificultaba su medida. Se encontró también una disminución significativa o desaparición del flujo mediante estudio Doppler en la lesión, una banda ecogénica que representaba edema, hemorragia y necrosis grasa, y zonas hipoecoicas sugerentes de fibrosis rodeando el fibroadenoma.
Seguimiento: reducción de volumen
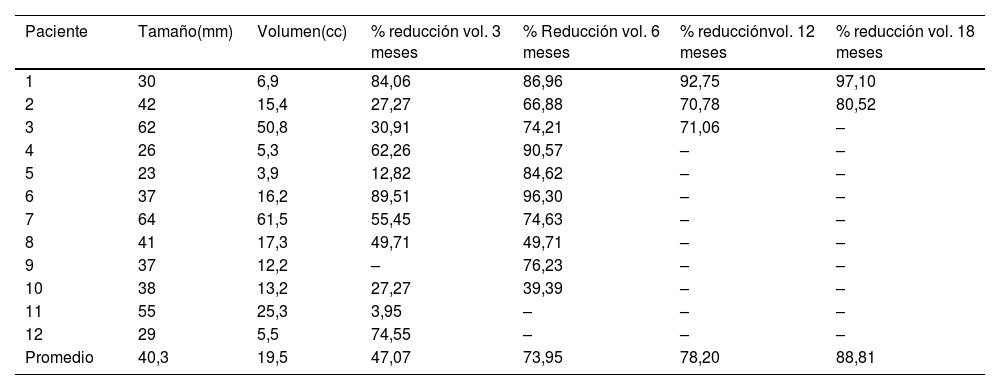
| Paciente | Tamaño(mm) | Volumen(cc) | % reducción vol. 3 meses | % Reducción vol. 6 meses | % reducciónvol. 12 meses | % reducción vol. 18 meses |
|---|---|---|---|---|---|---|
| 1 | 30 | 6,9 | 84,06 | 86,96 | 92,75 | 97,10 |
| 2 | 42 | 15,4 | 27,27 | 66,88 | 70,78 | 80,52 |
| 3 | 62 | 50,8 | 30,91 | 74,21 | 71,06 | – |
| 4 | 26 | 5,3 | 62,26 | 90,57 | – | – |
| 5 | 23 | 3,9 | 12,82 | 84,62 | – | – |
| 6 | 37 | 16,2 | 89,51 | 96,30 | – | – |
| 7 | 64 | 61,5 | 55,45 | 74,63 | – | – |
| 8 | 41 | 17,3 | 49,71 | 49,71 | – | – |
| 9 | 37 | 12,2 | – | 76,23 | – | – |
| 10 | 38 | 13,2 | 27,27 | 39,39 | – | – |
| 11 | 55 | 25,3 | 3,95 | – | – | – |
| 12 | 29 | 5,5 | 74,55 | – | – | – |
| Promedio | 40,3 | 19,5 | 47,07 | 73,95 | 78,20 | 88,81 |
Los fibroadenomas menores de 3cm dejaron de ser palpables entre los 3 y los 6 meses. En el resto de casos la paciente apreció una reducción de volumen a la palpación.
DiscusiónLa crioablación consigue una importante disminución de volumen de los fibroadenomas.
Las bajas temperaturas alcanzadas provocan la muerte celular por mecanismos directos e indirectos. La técnica se hace en 3 fases: primera congelación, descongelación pasiva y segunda congelación. En la primera fase de congelación el agua extracelular se congela antes debido a la mayor osmolaridad intracelular, esto hace que el agua salga de la célula y esta se deshidrate. Los cristales de hielo que también se forman en el interior de la célula en esta fase dañan orgánulos y membranas. Durante la descongelación pasiva se invierte el gradiente osmótico, la célula se hincha y se rompe. La afluencia de agua hacia el interior de la célula disminuye la osmolaridad intracelular con lo que se eleva el punto de congelación y aumenta el hielo intracelular. La fase de congelación se repite porque el tejido dañado transmite eficientemente las bajas temperaturas expandiendo así el área de necrosis.
El daño endotelial, la agregación plaquetaria, la formación de microtrombos y la isquemia resultante forman parte de los mecanismos indirectos con los que la crioablación produce también daño tisular8,9.
Hay 2posibles mecanismos de acción en los equipos de crioablación, los 2forman una bola de hielo a lo largo de la zona distal de la aguja. La zona letal (< –30°C) está unos 5mm por dentro del margen de la bola de hielo visible en la ecografía8-10.
En los equipos que funcionan con nitrógeno líquido, a medida que este circula a través de la parte distal de la aguja, no aislada, la temperatura en el tejido que la rodea disminuye rápidamente. En general, estos dispositivos generan bolas de hielo grandes más rápidamente que los de gas argón. Estos sistemas admiten una única aguja de crioablación en cada procedimiento. Aunque se están empezando a usar en otras partes del cuerpo su uso principal actualmente es en la mama.
En los equipos que funcionan con gas argón el mecanismo de acción se basa en el efecto Joule-Thomson de enfriamiento causado por la rápida descompresión del gas argón a través de la válvula en la punta de la aguja de crioablación. Con estos sistemas se pueden utilizar múltiples agujas a la vez, lo que permite una mayor individualización del tamaño y la forma de la bola de hielo. Los dispositivos de gas argón se emplean también para la ablación en otras partes del cuerpo9-11 (fig. 5).
Sistema de crioablación Galil Boston Scientific®. A) Aparato con 4 puertos dobles para 8 agujas y bala de gas argón. B) Aguja IceSphere®. C) Prueba previa de la aguja con formación de la bola de hielo en una batea con suero. D) Introducción de 2 agujas en la lesión, con control ecográfico.
La Sociedad Americana de Cirujanos de mama recomienda como criterios para indicar la posible crioablación o extirpación percutánea con BAV de fibroadenomas los siguientes: correcta visualización de la lesión con ecografía, confirmación histológica de fibroadenoma antes del tratamiento, diagnóstico concordante con los hallazgos de imagen, la exploración física y la historia de la paciente y tamaño de la lesión menor de 4cm en su eje más largo; no obstante, no establece como criterio de contraindicación una dimensión mayor del fibroadenoma4,7.
El tratamiento de los fibroadenomas es, hoy en día, mediante extirpación con BAV en muchos centros, un procedimiento más barato y disponible. La crioablación es una técnica sencilla, menos cruenta y con menos complicaciones, que puede ser muy útil en el tratamiento de los nódulos demasiado grandes para ser extirpados con BAV. En nuestra experiencia la crioablación de fibroadenomas mayores de 4cm es viable y segura.
Este procedimiento se postula como eficaz, gracias a la posibilidad de personalizar el tamaño y la forma de la bola de hielo en función del número de agujas empleadas y de los diferentes calibres escogidos en los sistemas con gas argón y a la formación de bolas de hielo grandes con los sistemas de nitrógeno líquido11.
El control ecográfico permite vigilar a lo largo de todo el proceso la proximidad del hielo con la superficie cutánea.
En estudios publicados se menciona que las lesiones más adecuadas para la crioablación se sitúan al menos a 5mm de la piel, idealmente a 1 cm9, algunos grupos describen la inyección de suero salino entre el fibroadenoma y la piel aumentando así la distancia entre ellos y protegiendo la piel de posibles quemaduras por frio en el caso de nódulos muy superficiales5,6,8. En nuestras pacientes la proximidad entre el borde más superficial de la lesión y la piel no supuso ninguna complicación, en el caso de lesiones muy superficiales se aplicó, a lo largo del procedimiento, una bolsa de suero caliente sobre la piel de la paciente para protegerla8,10.
Las complicaciones posibles de la crioablación descritas son el dolor durante el procedimiento o en las horas posteriores, quemadura cutánea por el hielo con formación de ampollas, equimosis o hematoma, infección y despigmentación.
La respuesta al tratamiento y la velocidad de reabsorción del fibroadenoma podrían estar relacionadas con su tamaño inicial. El número de ciclos de congelación, la duración de las fases de congelación y descongelación, el tamaño de la bola de hielo y la temperatura aplicada son factores que también pueden influir en la velocidad de reabsorción del fibroadenoma5.
En los trabajos publicados los fibroadenomas menores de 2cm han mostrado tener la mejor respuesta, los más grandes parecen tener tasas de reducción de volumen más lentas y reabsorciones incompletas.
Estudios anteriores han concluido que se produce una disminución de volumen de entre el 73 y el 99% a los 12 meses en fibroadenomas que miden hasta 4,2cm y una media de reducción de volumen del 40,6% a los 6 meses y del 87,3% a los 12 meses1,2,12. En fibroadenomas de hasta 2cm (de media) la reducción de volumen a los 12 meses es de 89-97%1.
Golatta et al. encuentran una reducción del 100% a los 12 meses en el 93% de los 58 FA tratados que medían un máximo de 3cm, con una media de volumen de 1,2 cc6.
Kaufman et al. postulan que la lesión entera se puede reabsorber a los 2 o 3 años de la crioablación, presentan 17 fibroadenomas menores de 2cm que a los 12 meses tienen una media de reducción de volumen del 100%3. En nuestras pacientes la media de disminución de volumen del fibroadenoma a los 3 meses fue del 47,07%, a los 6 meses del 73,95%, a los 12 meses del 78,20% y a los 18 meses del 88,81%. El estudio presenta limitaciones: escaso número de pacientes y tiempo de seguimiento limitado.
Aunque es necesario un mayor número de pacientes y seguimiento más prolongado parece claro que el volumen de los fibroadenomas se reduce con la crioablación; sin embargo, el número de casos y tiempo de seguimiento que se presentan en este trabajo no son suficientes para demostrar que esta técnica pueda lograr la desaparición completa del nódulo y es posible que los fibroadenomas muy grandes no lleguen a desaparecer del todo, en estos casos se consigue que disminuyan y dejen de crecer y ser palpables. Tampoco es nuestro objetivo que el nódulo desaparezca de todo ya que son lesiones benignas.
Vemos como ventajas frente a la BAV que la técnica es sencilla, menos cruenta y con menos complicaciones. En el caso de una extirpación parcial con BAV es posible que la lesión residual siga creciendo mientras que con la crioablación esto no ocurre.
Otros hallazgos encontrados en las ecografías de seguimiento fueron peor definición de los márgenes del fibroadenoma, disminución significativa o desaparición del flujo en el estudio Doppler y una banda ecogénica que representaba edema, hemorragia y necrosis grasa o zonas hipoecoicas sugerentes de fibrosis rodeando la lesión (fig. 6).
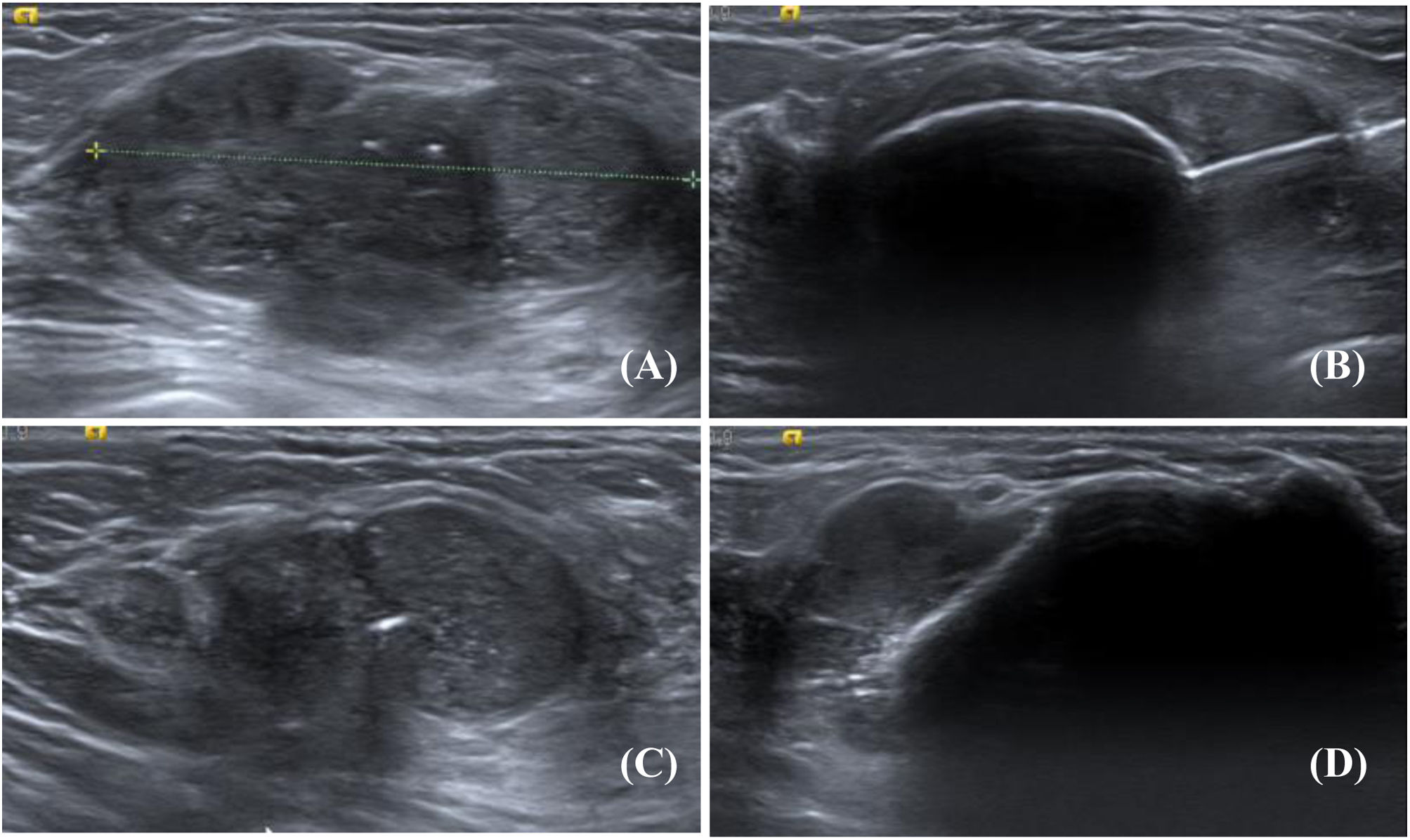
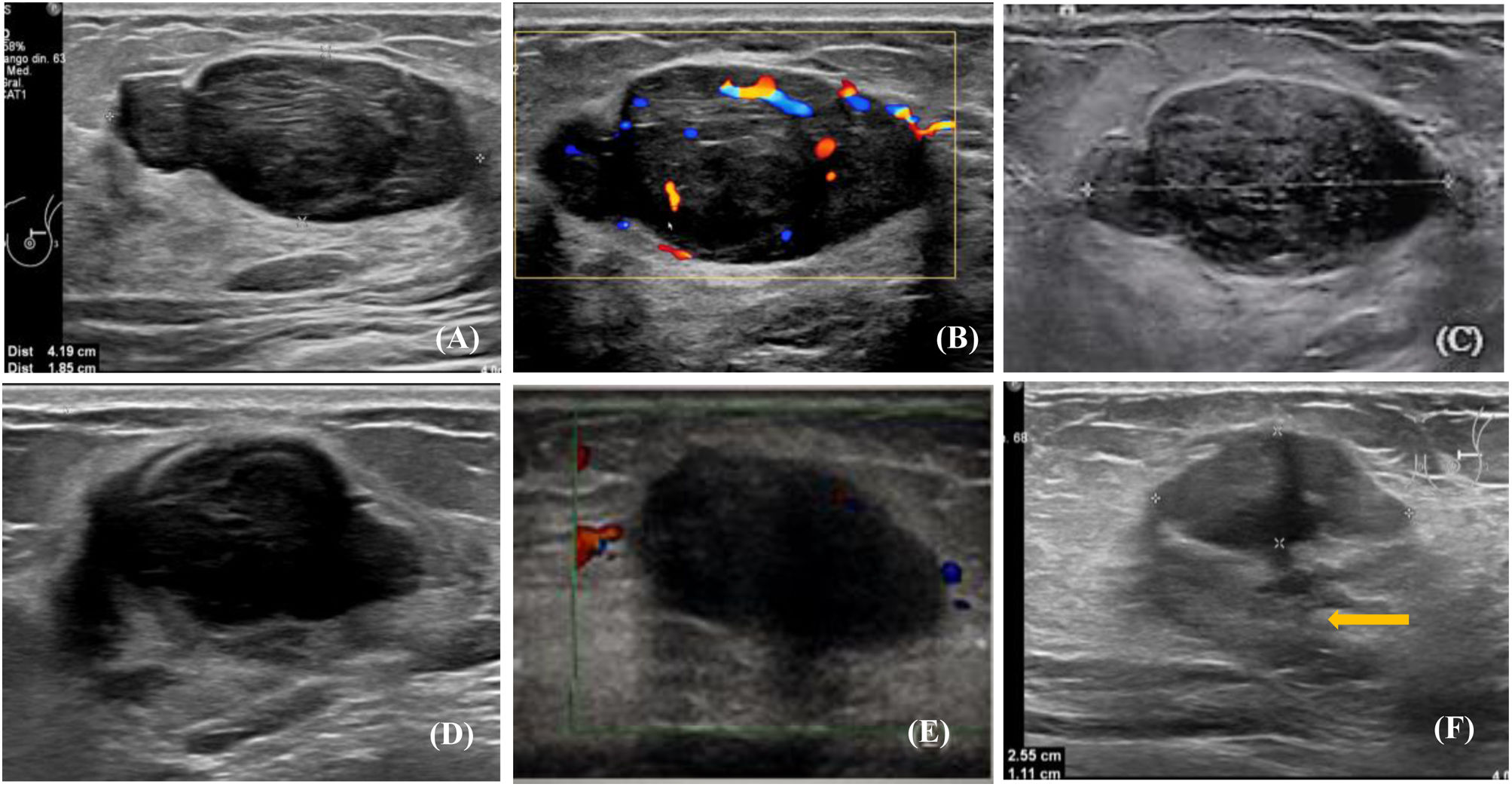
Fibroadenoma de 42×18mm antes y después de la crioablación. A) Ecografía modo B del fibroadenoma antes del procedimiento. B) Estudio Doppler del nódulo antes de la crioablación. C) Mismo fibroadenoma, ecografía modo B, control a los 12 días del procedimiento, el nódulo mide 37mm, con halo ecogénico circundante. D) Mismo nódulo, ecografía modo B 3 meses después de la crioablación. El fibroadenoma mide 35×21mm, presenta un borde peor definido rodeado por un halo ecogénico. E) Mismo fibroadenoma, estudio Doppler, control a los 7 meses. Han disminuido el tamaño (mide 26×14mm) y la vascularización. Se observa el halo ecogénico. F) Mismo nódulo, ecografía modo B a los 17 meses, el fibroadenoma mide 25×11mm, tiene un borde peor definido, asocia el halo ecogénico y una zona hipoecoica de fibrosis (flecha).
La BAV es un procedimiento aceptado y barato que se emplea de forma habitual. En el caso de fibroadenomas grandes, la crioablación resulta una técnica de manejo sencilla, menos cruenta y con menos complicaciones. La crioablación consigue una importante reducción de volumen de los fibroadenomas que pueden incluso llegar a desaparecer. Es un procedimiento innovador, seguro y efectivo, mínimamente invasivo para la paciente y bien tolerado. Sus complicaciones son poco frecuentes, leves y ofrece un mejor resultado cosmético al evitar cicatrices. Se realiza de forma ambulatoria con anestesia local, evitando así un ingreso hospitalario y una anestesia general, lo que permite un ahorro de recursos sanitarios y económicos, además de ayudar a gestionar las listas de espera quirúrgicas.
Autoría- 1.
Responsable de la integridad del estudio: TDBD y MJRN
- 2.
Concepción del estudio: TDBD, MJRN, MVCC, DGA, YNM, FGM
- 3.
Diseño del estudio: TDBD, MJRN, MVCC y JMOG
- 4.
Obtención de los datos: TDBD, MJRN, DGA, MVCC, YNM, FGM y JMOG
- 5.
Análisis e interpretación de los datos: TDBD, MVCC, DGA y YNM
- 6.
Tratamiento estadístico: TDBD
- 7.
Búsqueda bibliográfica: TDBD, MJRN, YNM, y JMOG
- 8.
Redacción del trabajo: TDBD, MJRN, MVCC, DGA
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JMOG
- 10.
Aprobación de la versión final: TDBD, MJRN, MVCC, DGA,YNM, FGM y JMOG
Ninguno.