INTRODUCCIÓN
La gran mayoría de los tumores de mama, ya sean benignos o malignos, proceden de tejido glandular mamario. Algunos casos, poco frecuentes, (5% de los tumores de mama1,2) aparecen como neoplasias altamente heterogéneas, caracterizadas por una mezcla de adenocarcinoma con áreas de metaplasia, se trata de áreas de tejido epitelial glandular que ha sufrido una diferenciación escamoide, sarcoide, ósea o condroide, hacia células gigantes, fusocelular o acantolítica.
El componente metaplásico puede ser benigno o maligno. Tanto el grado de diferenciación, como la proporción de los elementos que se presentan junto al tumor, son altamente variables y se demuestran aplicando inmunohistioquímica y análisis estructurales.
Es importante el diagnóstico diferencial del carcinoma metaplásico con otros tipos de neoplasia, sobre todo entre carcinoma metaplásico con componente sarcomatoso y los sarcomas de mama, porque el tratamiento y el pronóstico varían según la estirpe de la clona origen de la neoplasia2.
Se han publicado diferentes series de carcinoma metaplásico de mama en los que se analizan los distintos hallazgos ecográficos, mamográficos y anatomopatológicos, y sólo existen dos series sobre los hallazgos en resonancia magnética, una de dos casos3 y otra muy reciente de 12 casos4. Por ello el objetivo de este estudio es revisar la presentación del carcinoma metaplásico en mamografía y ecografía, introduciendo nuestra experiencia con la resonancia magnética, que permite hacer un estudio mucho más adecuado de la mama, así como revisar la presentación clínica e histopatológica del mismo, en nuestro centro.
MATERIAL Y MÉTODOS
Se analizaron retrospectivamente ocho casos de carcinoma mataplásico, diagnosticados y confirmados patológicamente en nuestro centro entre los años 1996 y 2003.
Se valoró, en cada paciente, su edad, estado hormonal (premenopáusica, posmenopáusica sin o con tratamiento hormonal sustitutivo) y la clínica, según presentaban un nódulo palpable, dolor, otra clínica o fue un hallazgo incidental.
En todas las pacientes se realizaron mamografías en las dos proyecciones de rutina, cráneo-caudal y oblicua medio lateral, usando equipos mamográficos convencionales (modelo Lorad MIIe y Lorad M-IV), las cuales fueron revisadas retrospectivamente por dos radiólogos especialistas en radiología de mama. En ellas se valoró el patrón del parénquima mamario, que se clasificó en adiposo, heterogéneo o extremadamente denso. Además se valoraron las características mamográficas de la lesión atendiendo a su localización por cuadrantes, su tamaño en mm, su silueta, su margen y su densidad respecto al parénquima mamario, así como los hallazgos asociados, como la presencia y el tipo de micro calcificaciones, la retracción o engrosamiento de la piel o pezón. Se usó como guía el sistema de clasificación: American College of Radiology's Breast Imaging Reporting and Data System (BI-RADS)5.
La ecografía se realizó en seis pacientes, usando equipos Toshiba PowerVision y transductores lineales multifrecuencia (6-10 MHz). En las otras dos no se procedió a realizar ecografía, ya que se les practicó directamente tumorectomía y biopsia, porque una presentaba antecedente de adenoma pleomórfico de mama y se pensó en una recidiva del mismo, y la otra presentaba microcalcificaciones en la mamografía, altamente sugerentes de malignidad.
Se revisaron las imágenes ecográficas en la misma sesión que las mamografías, y se valoró el tamaño en mm, la silueta, los márgenes y la ecogenicidad de la lesión.
En seis pacientes se realizó resonancia magnética (RM). Estos estudios se realizaron con equipos RM de 1.0 Tesla (Siemens Magnetom Harmony o Siemens Magnetom Expert), empleando una bobina multicanal específica de mama bilateral, con la paciente en decúbito prono y los brazos extendidos a lo largo del cuerpo.
El protocolo del estudio que se usó incluyó dos secuencias: 1) T2-TSE (TR/TE, 8256/136; grosor 4 mm; matriz 120 x 256; FOV 350 x 350; ángulo 180°) y 2) secuencia 3D gradiente de eco potenciada en T1 (FLASH 3D; TR/TE 14/7, ángulo 25°; matriz 122 x 256; grosor dos mm; FOV 350 x 350), que se realizó un total de seis veces consecutivas (serie dinámica). Cada secuencia duró un minuto 27 segundos entre la primera y la segunda serie, se inyectó el contraste endovenoso (e.v.) (gadolinio-DTPA), mediante una bomba de inyección automática a un flujo de 2,5 ml/seg, con una dosis de 0,16 mmol/ kg de peso. El postprocesado de las imágenes incluyó la sustracción de las imágenes precontraste de las imágenes postcontraste (precoz y tardío), así como la realización de reconstrucciones multiplanares (MPR) o proyección de máxima intensidad (MIP) y de curvas intensidad señal/tiempo, conjuntamente con la evaluación morfológica y el cálculo del tamaño de la lesión.
El análisis retrospectivo de las imágenes procesadas se realizó anotando las mediciones de las intensidades de señal, en las regiones de interés (ROI) de todas las lesiones, tanto en las secuencias T1 como T2, y comparándolas con la intensidad de señal del tejido glandular mamario, conviniendo que las intensidades de señal lesión-parénquima comprendidas entre + 40 y 40 corresponden a lesiones isointensas. Así mismo, se aplicó la clasificación de puntuaciones que usa el sistema de clasificación multimodal definido por Baum y colaboradores6,en el que se distribuyen las lesiones en cinco categorías en función de la puntuación adquirida al analizar la figura y el margen de la lesión, el patrón de captación, la captación inicial y la captación postinicial de contraste. (grupo I: 0 puntos, negativo; grupo II: 1-2 puntos, benigno; grupo III: 3 puntos, probablemente benigno; grupo IV 4-5 puntos, sospecha de malignidad; grupo V: 6-8 puntos, alta sospecha de malignidad). Se catalogó el patrón de captación, así como la captación inicial y postinicial de la siguiente manera: se considera captación patológica (precoz e intensa) de contraste cuando el incremento de la intensidad de señal de la lesión en los dos primeros minutos postcontraste es mayor del 50%. Con los datos se elaboró la morfología de la curva intensidad de señal/tiempo que se divide en: a) curva en lavado rápido (Washout), como la que presenta un descenso en la intensidad de señal de más del 10%, respecto al pico máximo de los dos minutos, y b) en curva en meseta (Plateau) cuando la intensidad máxima de los dos minutos perdura hasta los 6 minutos con una variación inferior al 10%.
Todas las lesiones fueron tratadas quirúrgicamente después de obtener los resultados por biopsia, excepto en una paciente a la que se le practicó tumorectomía sin biopsia, al considerarse una recidiva local de un adenoma pleomórfico. La biopsia de las lesiones se realizó con aguja gruesa guiada por ecografía en seis pacientes, realizándose cuatro pases; y guiada por estereotaxia (estereotaxia vertical Lorad StereolocII), utilizando aguja de 14-G automática, realizando 8 pases, en una paciente, al presentar como ya se ha comentado anteriormente, microcalcificaciones altamente sugestivas de malignidad en la mamografía.
En todas las pacientes se practicó vaciamiento ganglionar axilar ipsilateral a la mama afectada, acompañado de mastectomía (siete casos) o tumorectomía (un caso) en función del tamaño relativo del nódulo respecto al tamaño de la mama.
Dos patólogos revisaron todos los cortes anatomopatológicos y se realizaron de nuevo los estudios inmunohistoquímicos, comprobando su positividad frente a los siguientes reactivos: vimentina, desmina, proteína S100 y proteína bcl-2, actina muscular específica (SACT), EMA, queratinas E1/AE3, citoqueratinas de bajo peso molecular CAM 5.2, citoqueratinas 7, 34, 19 y marcadores vasculares CD34 y CD31.
RESULTADOS
Todos los casos se presentaron en mujeres con edades comprendidas entre los 41 y 72 años con una media de edad de 55 años. En el momento del diagnóstico dos de ellas eran premenopáusicas, mientras que las seis restantes eran posmenopáusicas sin tratamiento hormonal sustitutivo.
En cinco casos la presentación clínica fue como nódulo palpable, en dos fue un hallazgo incidental en una mamografía de screening sin palpación de nódulo alguno y uno presentó retracción del pezón sin palparse ni visualizarse nódulo en mamografía. Seis casos se localizaron en la mama derecha y dos en la izquierda.
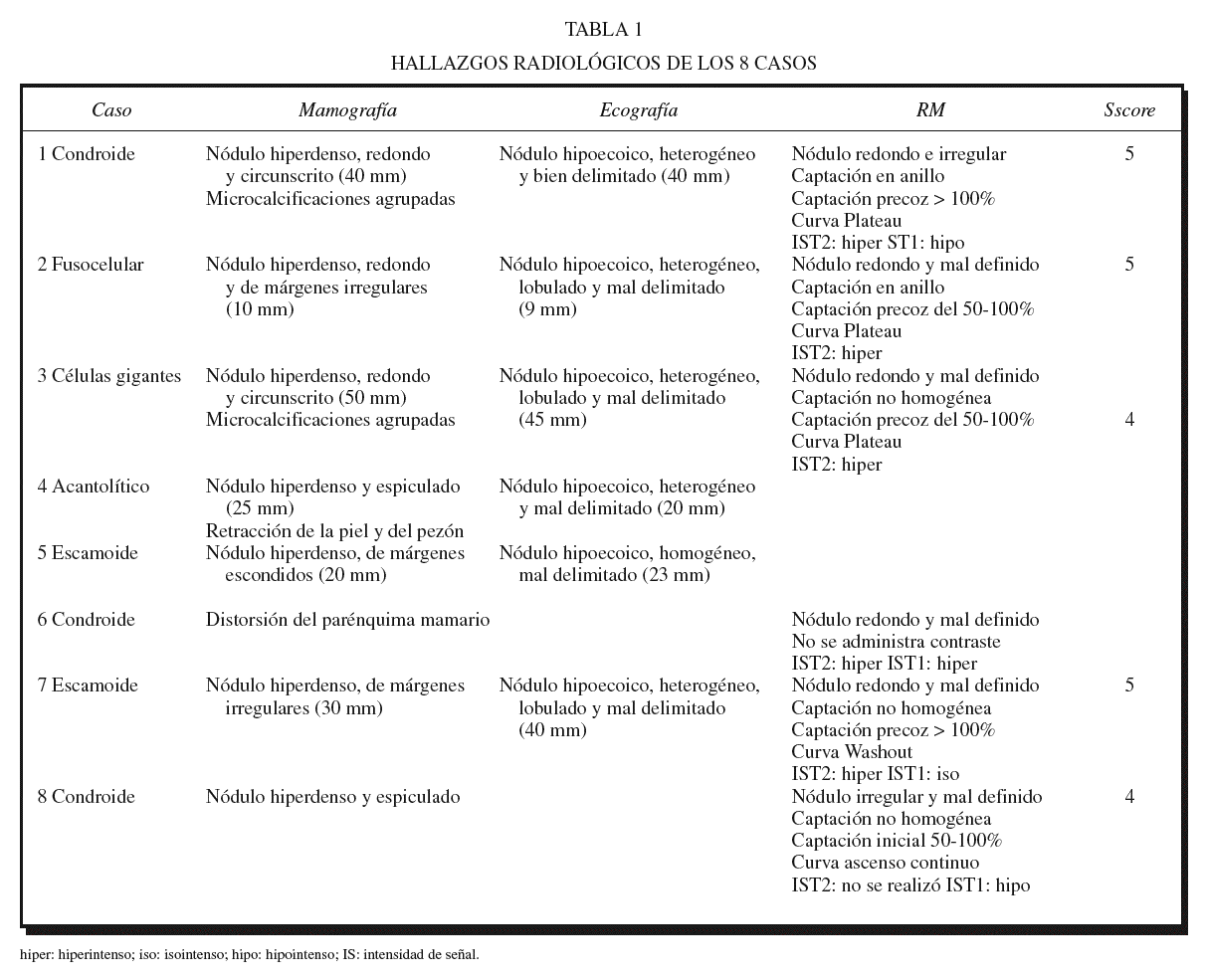
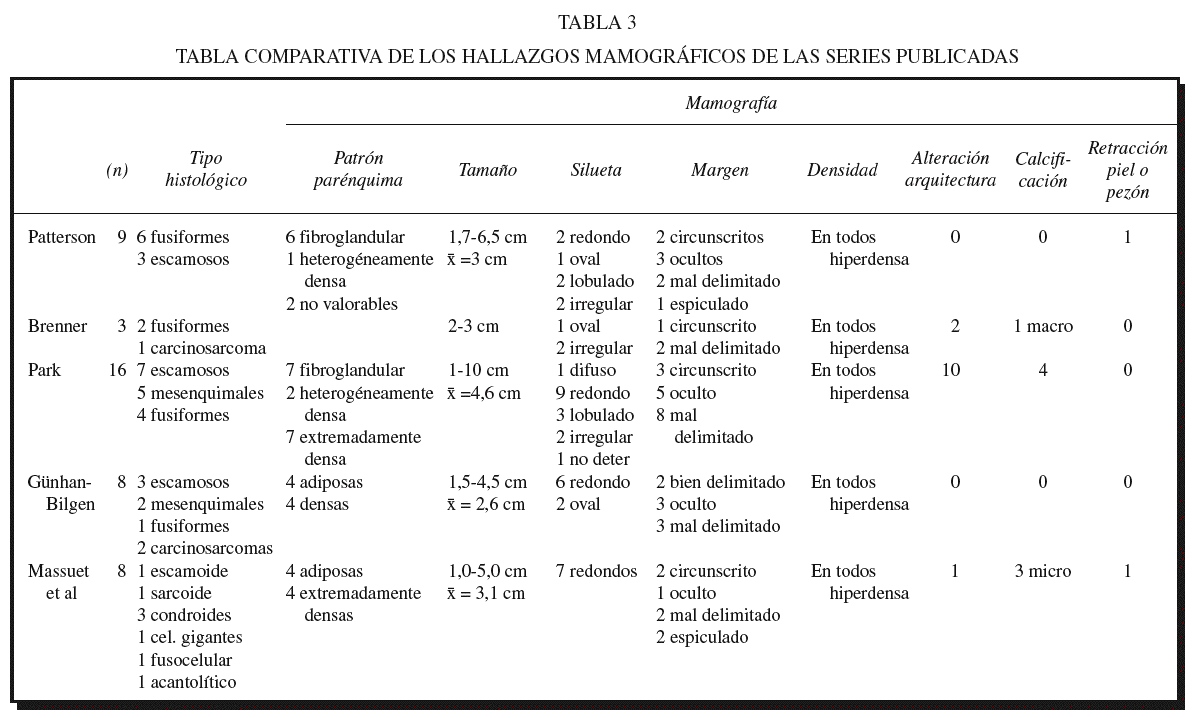
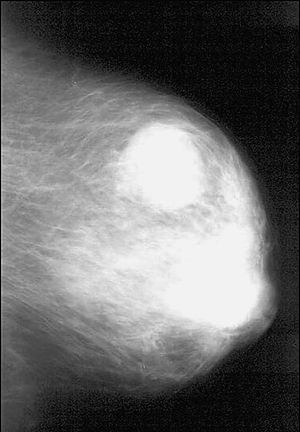
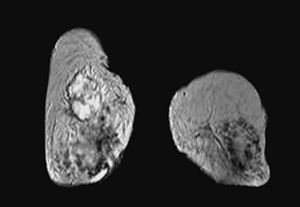
Mamográficamente, se visualizaron sobre un patrón parenquimatoso adiposo (4) o denso (4). En siete casos apareció un nódulo redondo, hiperdenso, de 10 a 50 mm de tamaño (con una media de 31,5 mm), de márgenes variables (hallándose dos casos de nódulos bien circunscritos (figs. 1 y 2), dos casos con márgenes irregulares, dos espiculados y un caso de margen parcialmente oculto). Sólo un caso no mostró un nódulo mamográficamente aparente, hallándose retracción de la piel y del pezón con distorsión de la arquitectura del parénquima mamario. En tres casos se asociaron microcalcificaciones agrupadas y en ningún caso se visualizaron adenopatías axilares por mamografía.
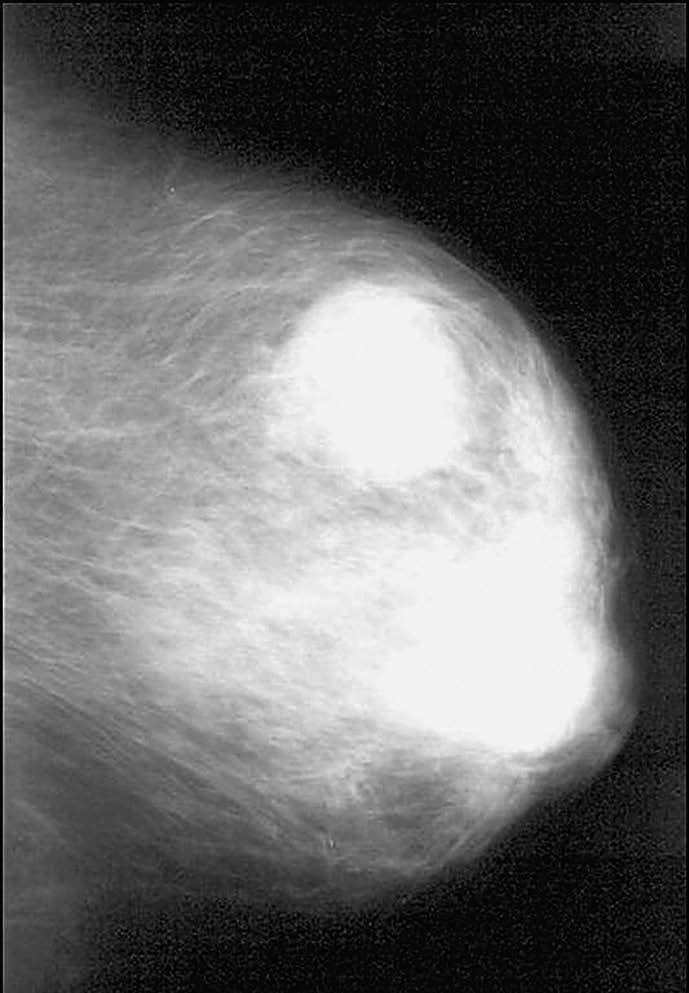
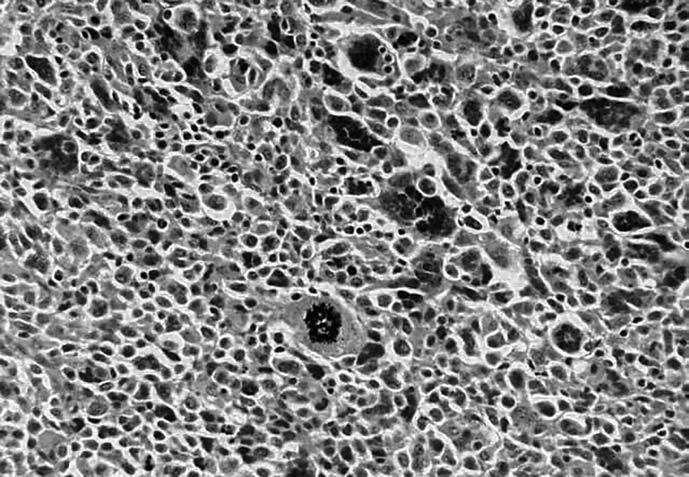
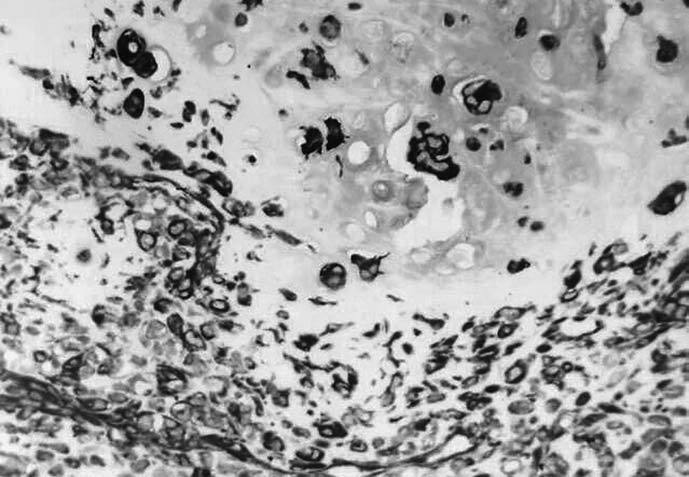
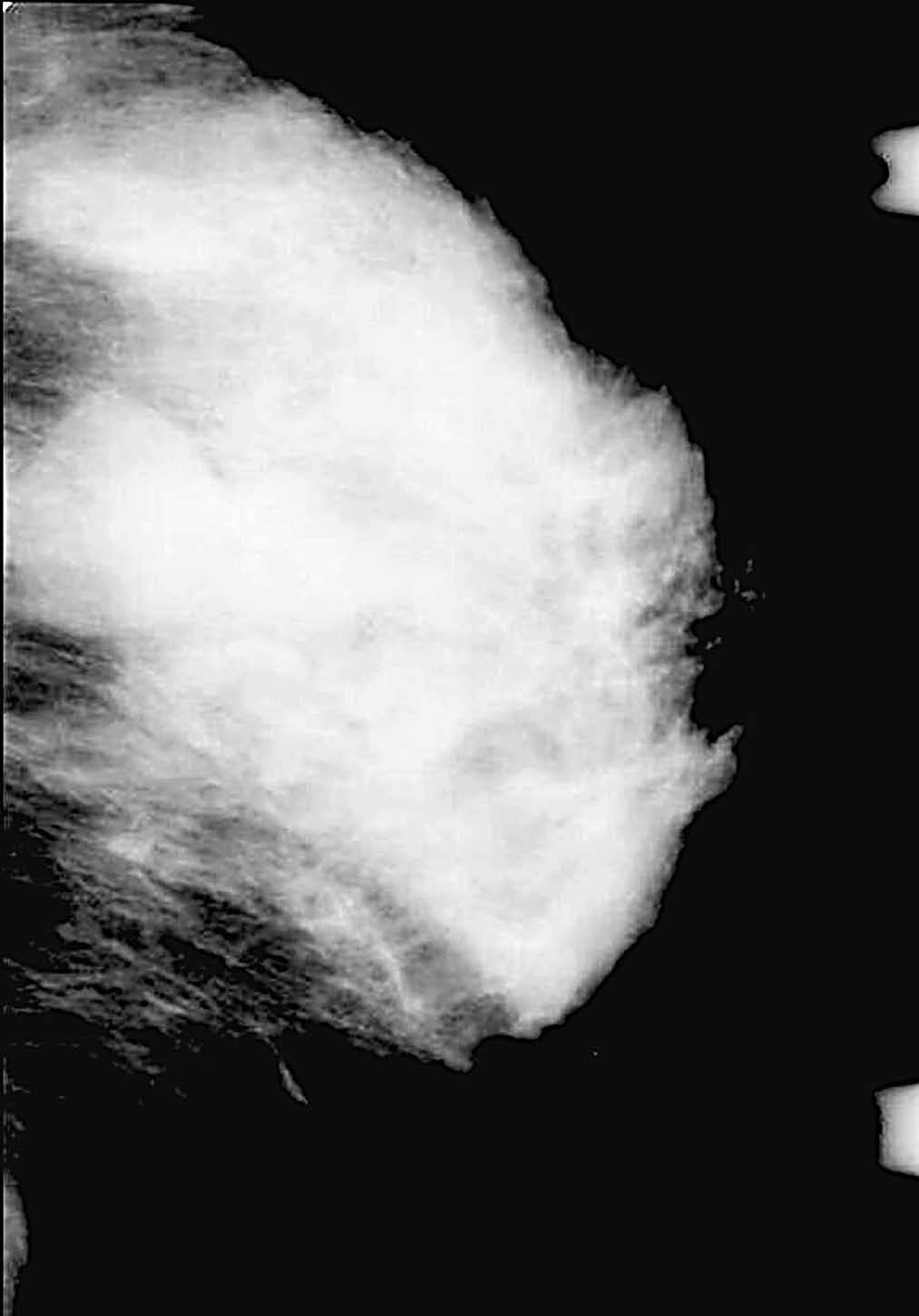
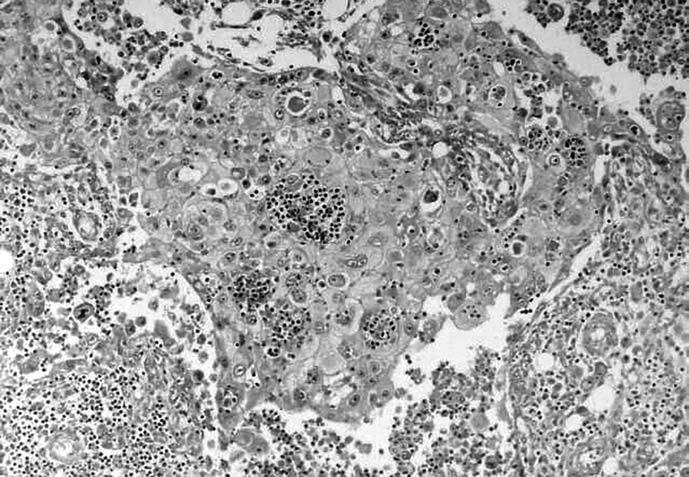
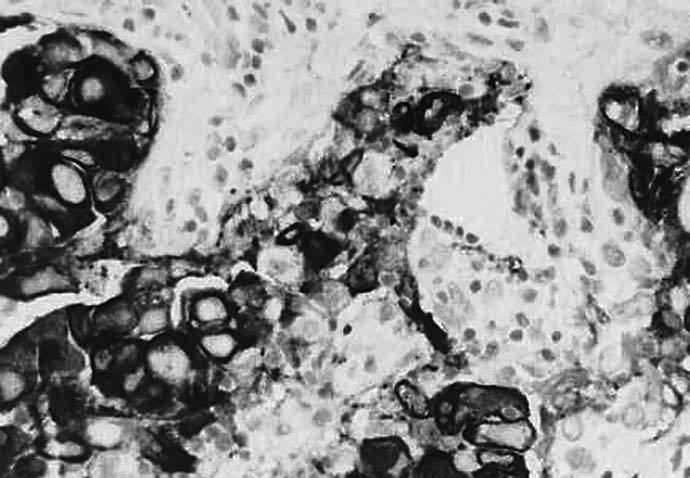
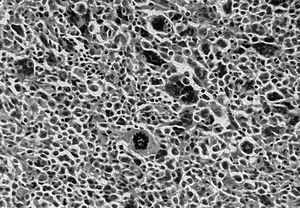
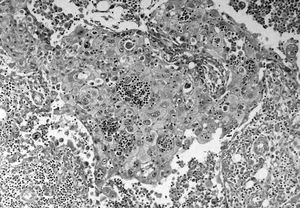
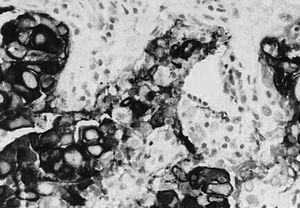
Fig. 1.--Carcinoma metaplásico condroide. Mamografía oblicua (A) y craneocaudal derecha (B). Se observa una masa de contornos bien delimitados y aumentada de densidad respecto al parénquima mamario, localizada en el cuadrante supero-interno. C: tinción hematoxilina-eosina. D: carcinoma metaplásico condroide, tinción vimentina positiva.
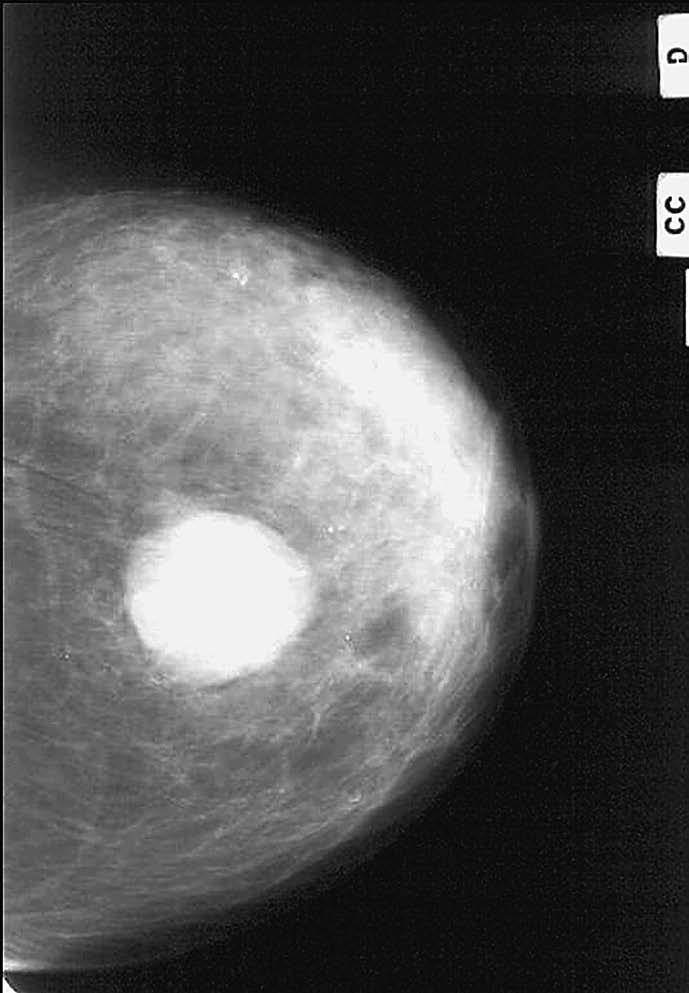
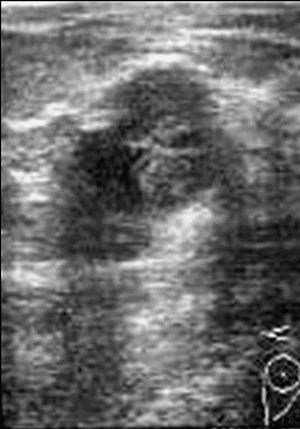
Fig. 2.--Carcinoma metaplásico de células gigantes. Mamografía craneocaudal que muestra un nódulo hiperdenso, de márgenes bien delimitados, que mide 50 mm de diámetro máximo.
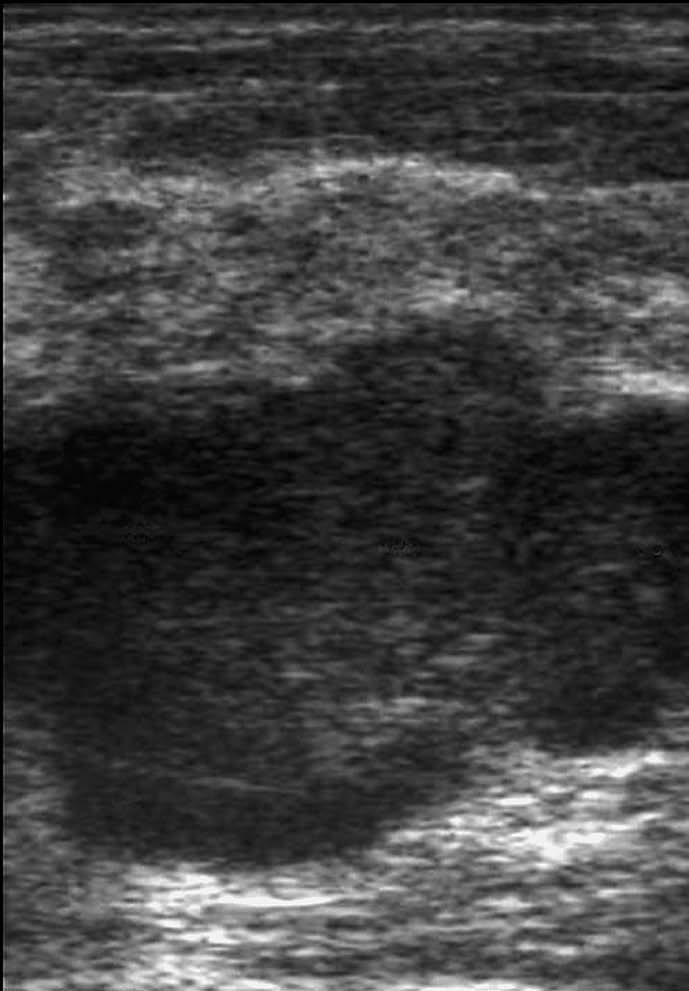
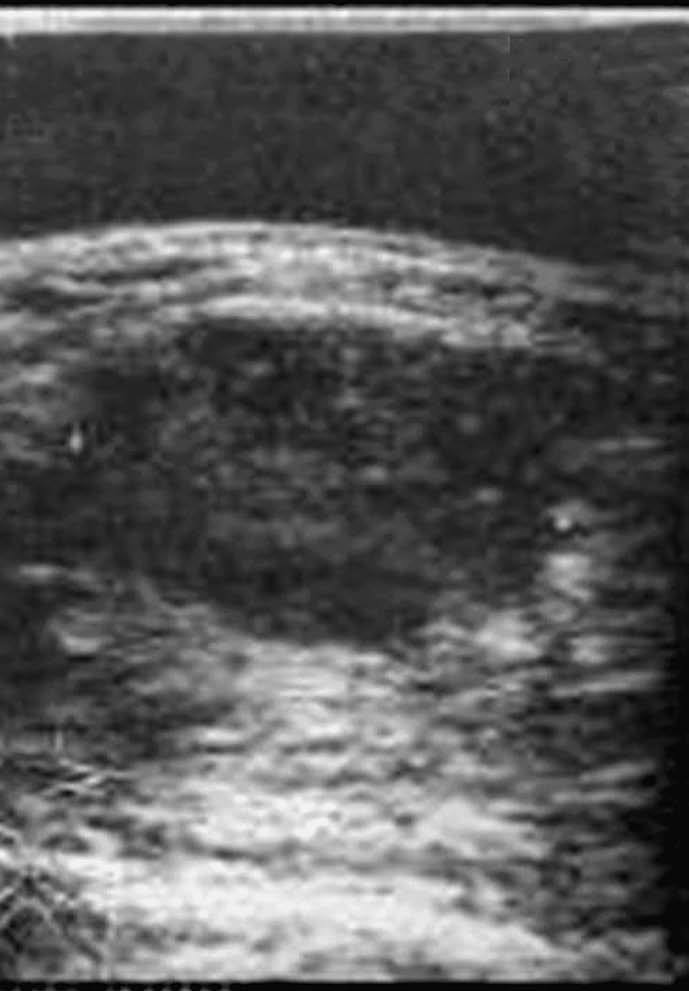
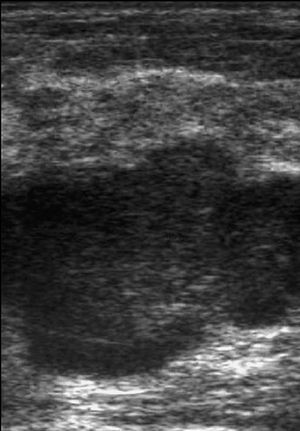
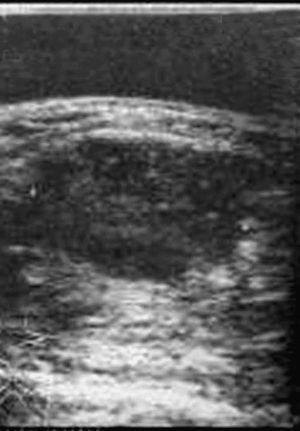
En las seis ecografías revisadas los carcinomas se presentaron como nódulos sólidos, de tamaño variable entre 9 y 45 mm de diámetro (con una media de 29,5 mm), redondos, con silueta lobulada (fig, 3) o irregulares (fig. 4), heterogéneos con áreas hipoecogénicas y otras isoecogénicas respecto el parénquima mamario, excepto en un caso que fue homogéneo.
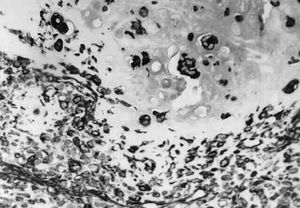
Fig. 3.--Carcinoma metaplásico escamoide de dos pacientes. A y B: ecografías que muestran masa de contornos poliglobulados, de ecogenicidad no homogénea. C: tinción hematoxilina-eosina. D: tinción CK AE1/AE3 positiva.
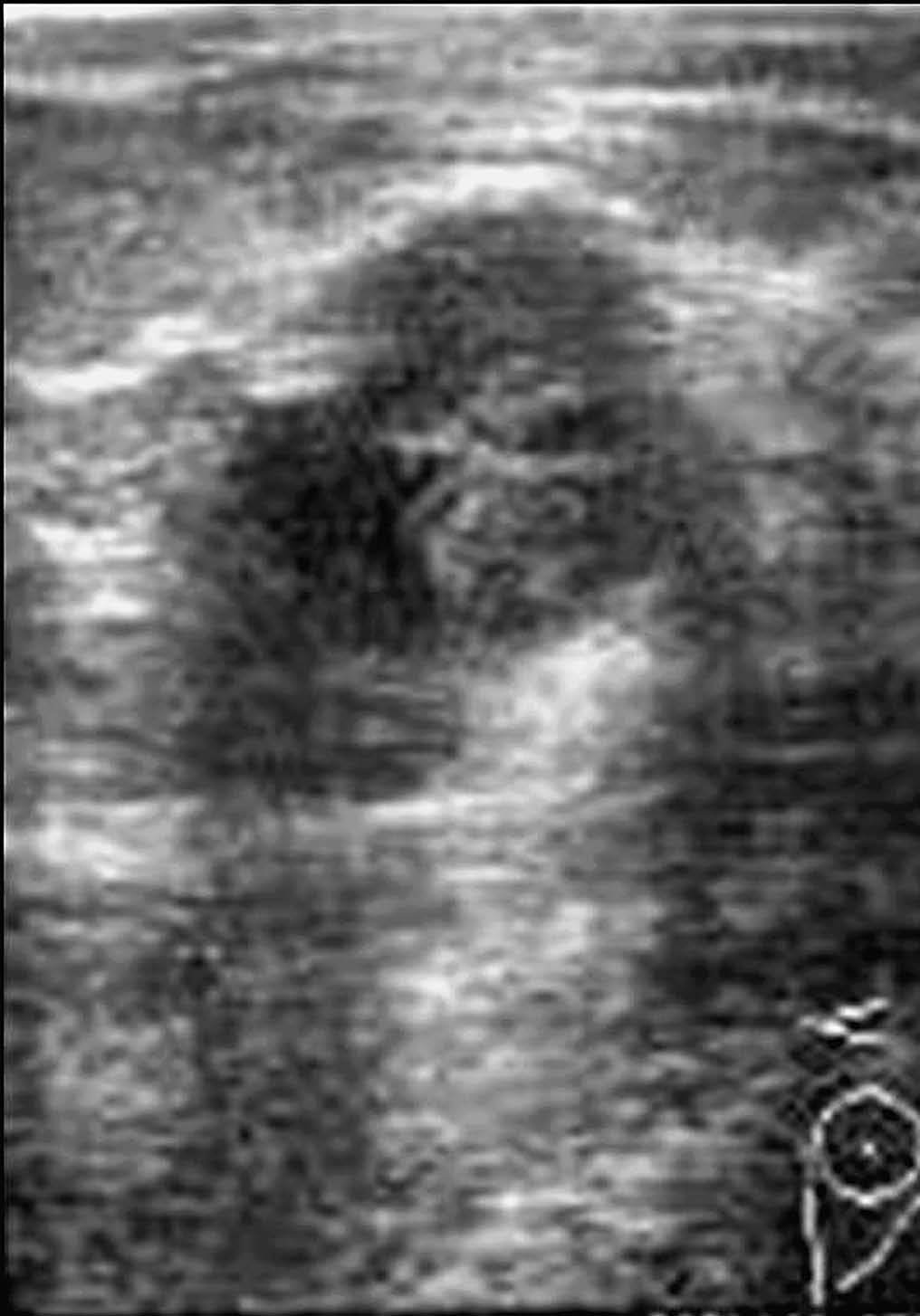
Fig. 4.--Carcinoma metaplásico fusocelular. Ecografía en la que se observa un nódulo de contornos irregulares mal delimitado y heterogéneo.
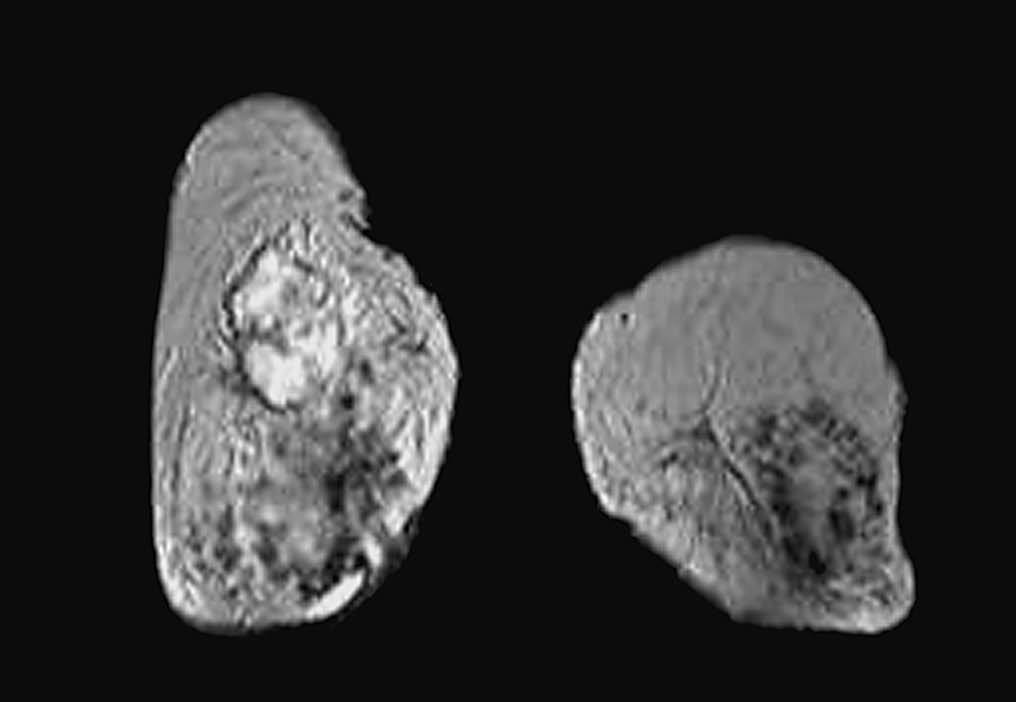
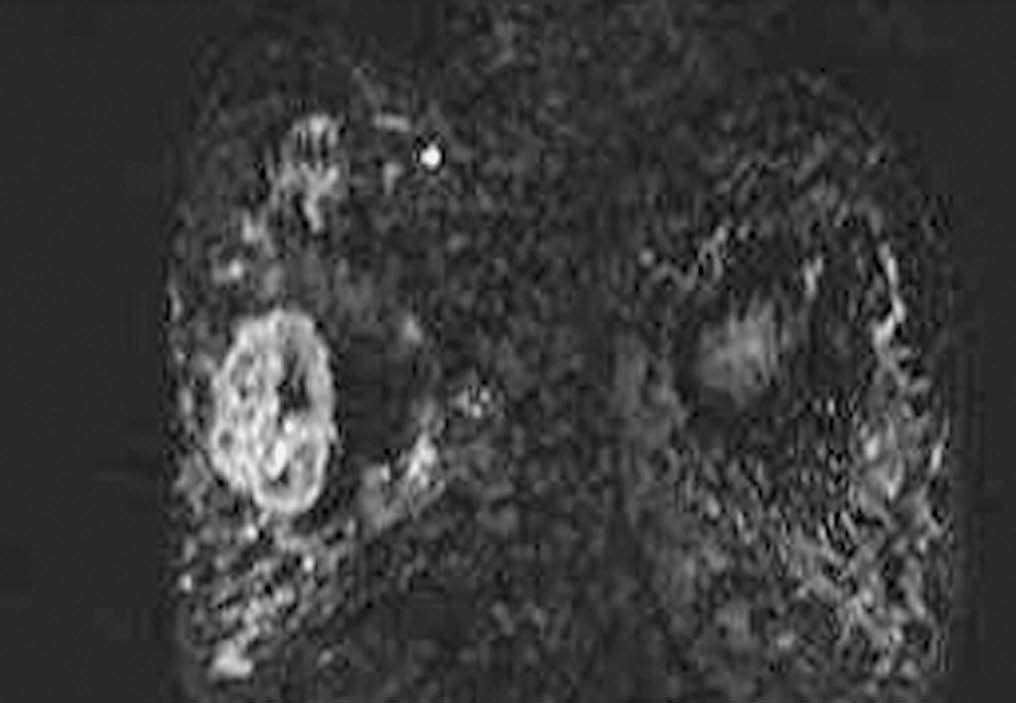
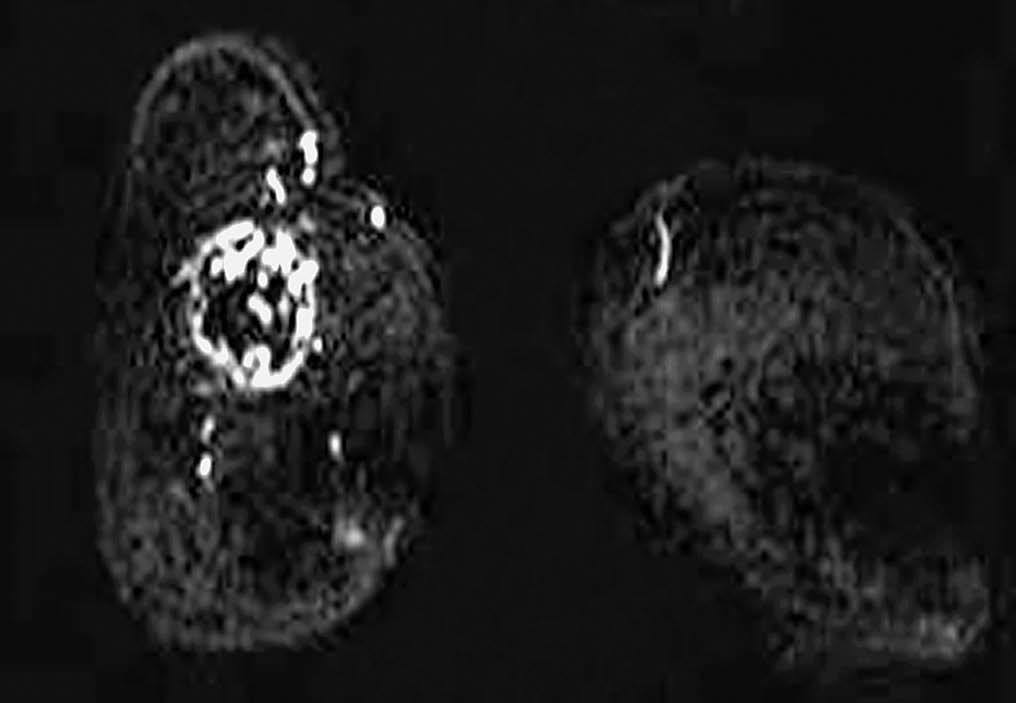
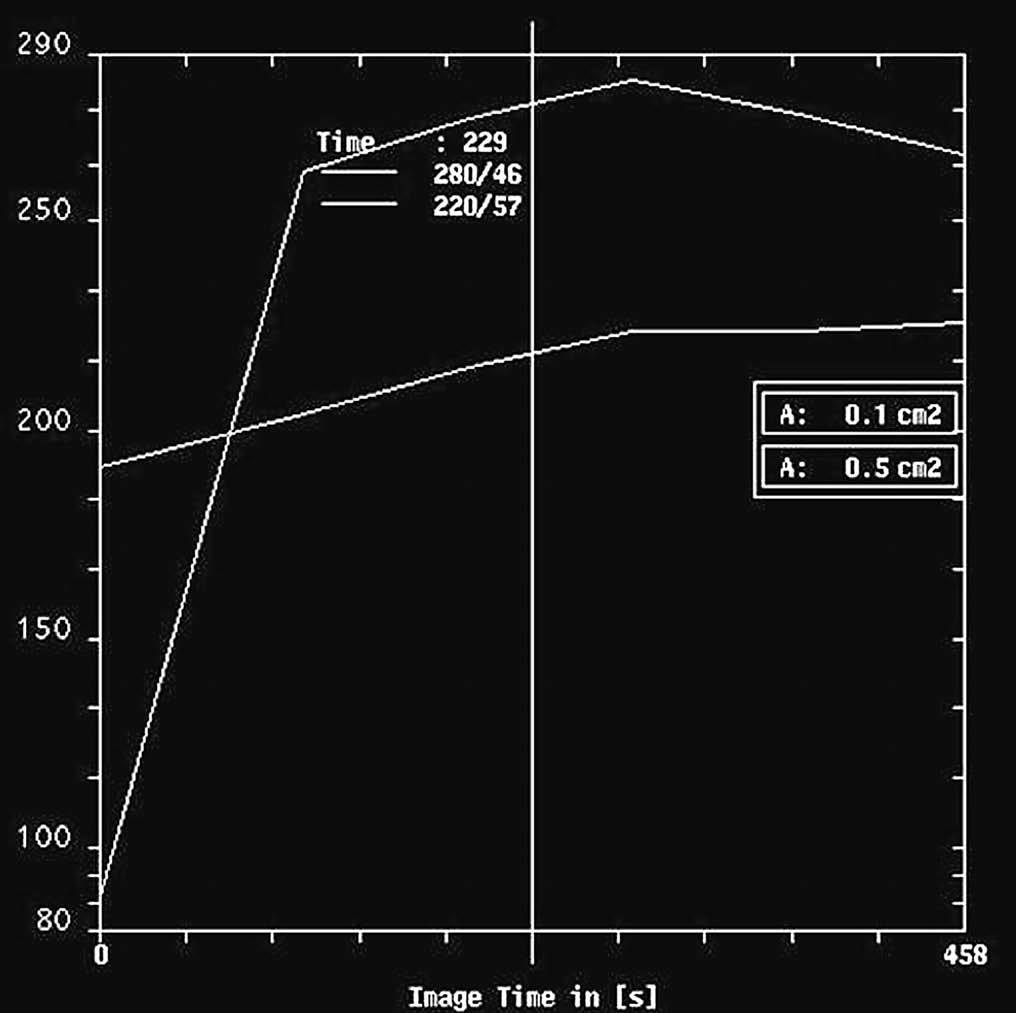
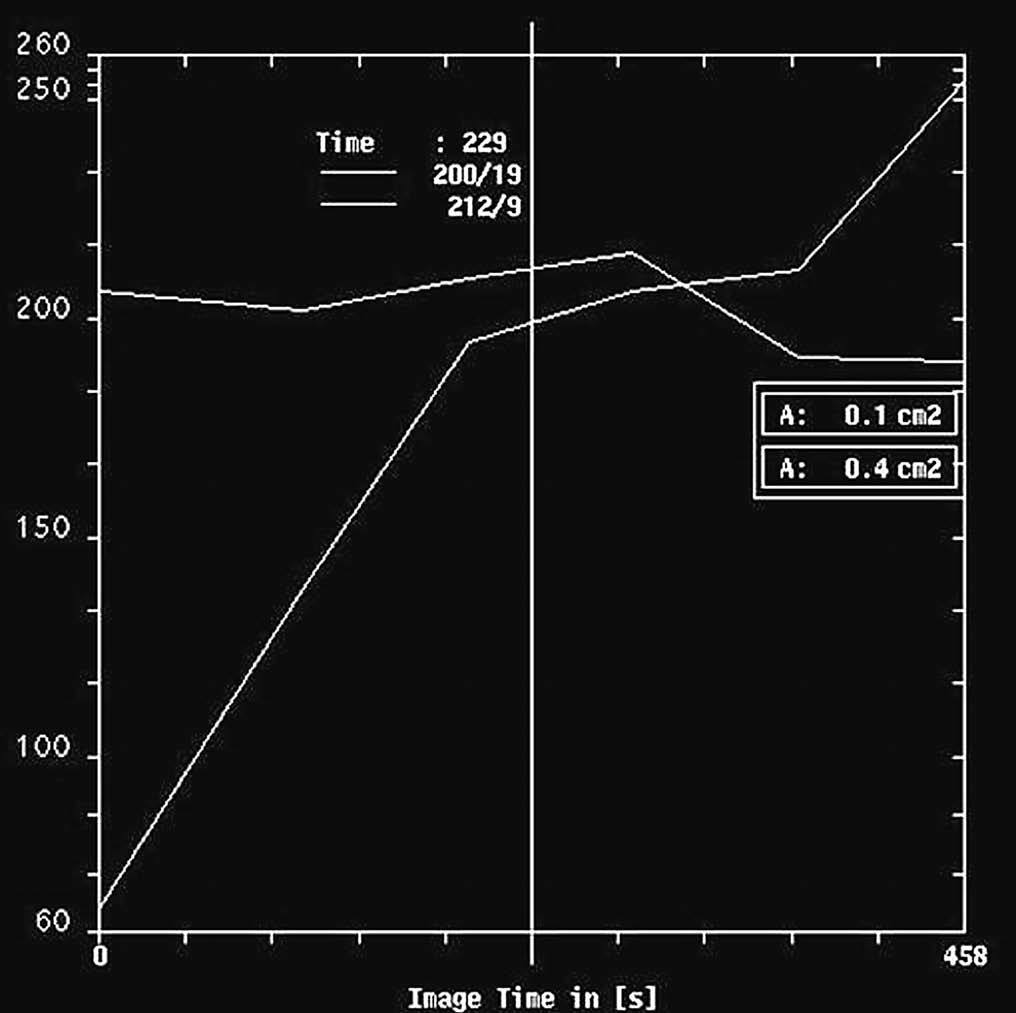
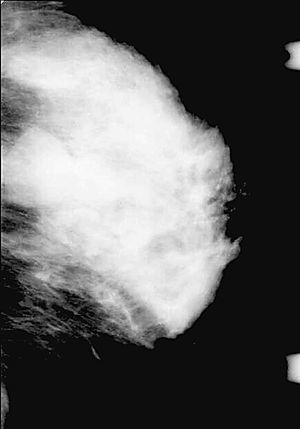
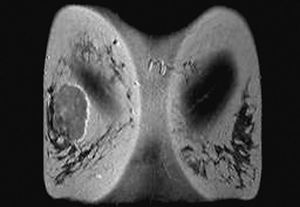
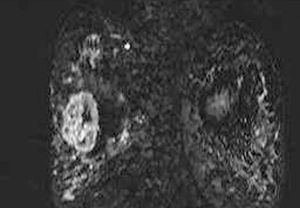
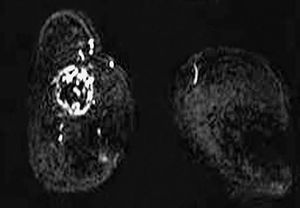
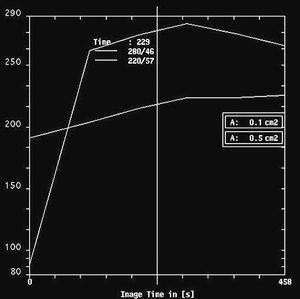
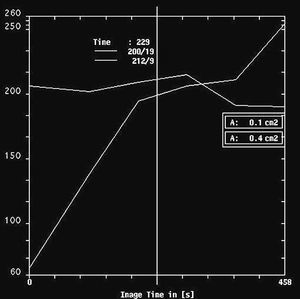
Por RM, se visualizaron todos como nódulos redondos, excepto un caso que fue irregular, y todos mal definidos. En el análisis cuantitativo de la intensidad de señal, se observó que en las secuencias potenciadas en T2 todos eran hiperintensos (fig. 5) mientras que existió mayor variabilidad en las secuencias potenciadas en T1. Se evaluó el comportamiento de las lesiones en el estudio dinámico tras la administración de gadolinio en cinco casos, observándose en todas ellas una captación patológica de contraste (fig. 6) (tres presentaron un incremento del 50-100% de la intensidad en los dos primeros minutos tras la administración de contraste y en dos el incremento fue superior al 100%). Las curvas de intensidad de señal/tiempo fueron en un caso de tipo Washout, en tres de tipo Plateau y en un caso se observó un incremento continuo de intensidad (fig. 7). Así pues, todos presentaron una puntuación en el rango de la malignidad.
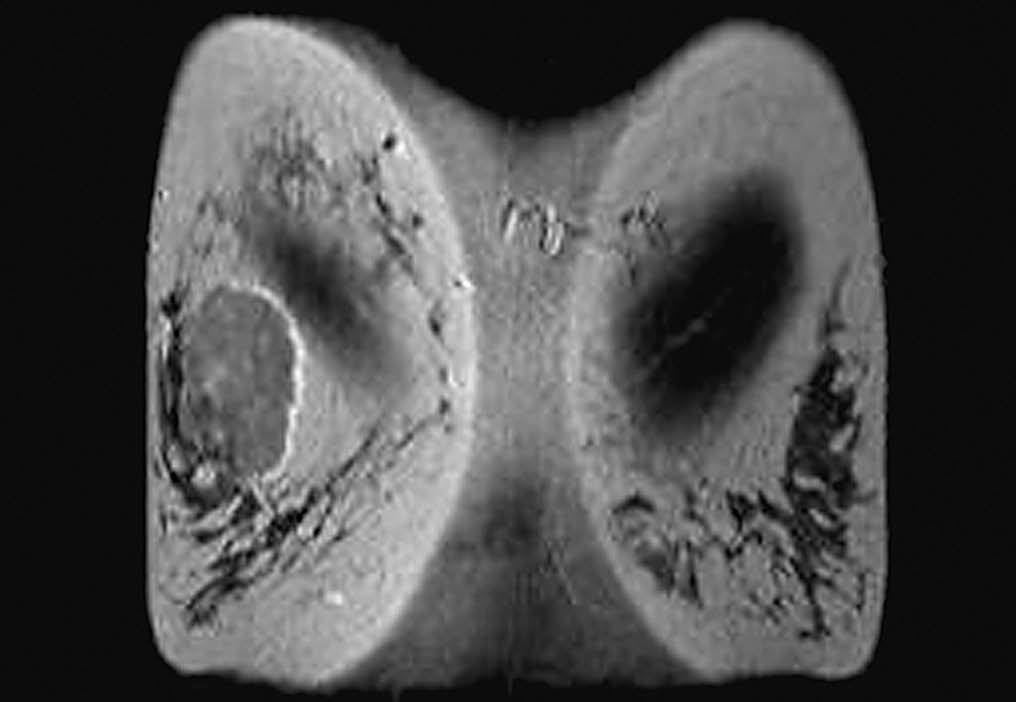
Fig. 5.--Aspecto RM T2 en dos pacientes diferentes: mostrándose en ambos casos que la lesión es hiperintensa respecto al parénquima mamario y músculo. A: carcinoma metaplásico condroide correspondiéndose a mamografía de la figura 1. B: carcinoma metaplásico escamoide correspondiéndose a la figura 3A.
Fig. 6.--Aspecto de la resonancia magnética postcontraste de las pacientes de la figura 5. A: carcinoma metaplásico condroide y B: carcinoma metaplásico escamoide. En ambas RM se observan imágenes de sustracción tras la administra-ción de contraste, observándose una captación con características de malignidad desde el punto de vista morfológico.
Fig. 7.--Curvas correspondientes a las pacientes de la figura 5. A: carcinoma metaplásico condroide, curva de lavado. B: carcinoma metaplásico escamoide. Curva de incremento continuo de intensidad.
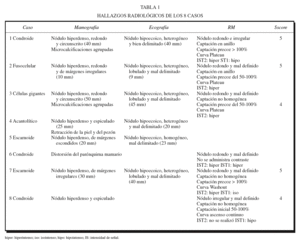
Todos los hallazgos radiológicos descritos en esta serie se resumen en la tabla 1, indicando en cada caso el tipo histológico resultante en el análisis histopatológico.
Los resultados de la biopsia de cinco pacientes fueron diagnósticos de carcinoma metaplásico, especificándose el tipo de metaplasia tras el estudio histopatológico de la pieza posquirúrgica; en dos pacientes la biopsia mostró carcinoma ductal, pero el estudio de la pieza quirúrgica demostró que se trataba de un carcinoma metaplásico condroide y de un carcinoma metaplásico escamoide.
En todas las pacientes se practicó vaciamiento ganglionar axilar ipsilateral a la mama afectada, acompañado de mastectomía o tumorectomía en función de tamaño relativo del nódulo respecto al tamaño de la mama. Se halló afectación metastásica en adenopatías axilares en tres de las ocho pacientes.
Los componentes metaplásicos de los ocho casos se subdividieron en: un carcinoma metaplásico variante escamoide, un carcinoma metaplásico variante sarcoide, tres carcinomas metaplásicos variante condroides, un carcinoma metaplásico variante de células gigantes, un carcinoma metaplásico variante fusocelular y un carcinoma metaplásico variante acantolítica.
Esta diferenciación se corroboró con la ayuda de la inmunohistoquímica (tabla 2) así pues, se comprobó que:
-- La celularidad de todos los carcinomas metaplásicos mostró positividad para la vimentina.
-- Todos los subtipos histológicos, excepto el acantolítico (que es ), mostraron positividad para el cóctel de queratinas AE1/AE3 y para la EMA.
-- Todos mostraron positividad para las citoqueratinas de bajo peso molecular CAM 5.2 y la citoqueratina 7 en grado variable, excepto en uno de los subtipos condroide en el que la citoqueratina fue negativa.
-- La proteína S100 fue positiva en los casos con diferenciación condroide y en el subtipo acantolítico. A diferencia de la proteína bcl-2 que fue positiva en todos los casos, excepto en el subtipo acantolítico y en el productor de matriz condroide.
-- La variante fusocelular fue la única que muestra positividad para la actina muscular específica.
-- Los marcadores vasculares CD34 y CD31 fueron negativos, excepto en uno de los subtipos escamoide que presentó una positividad focal de CD31.
DISCUSIÓN
El carcinoma metaplásico en una neoplasia altamente heterogénea caracterizada por una mezcla de adenocarcinoma con áreas de metaplasia. Se trata de áreas de tejido epitelial glandular que han sufrido una diferenciación. Esta diferenciación se corrobora con la ayuda de la inmunohistoquímica7,8.
Con los análisis inmunohistóquímicos se puede llegar a identificar muchos subtipos de carcinoma metaplásico: escamoide, sarcoide, condroide, células gigantes, fusocelular y acantolítica, con lo que este término quizás no sea del todo correcto y algunos autores proponen el uso de un nuevo término: carcinoma rediferenciado.
Los estudios realizados por Wargotz y Norris sugieren cuatro tipos de carcinoma metaplásico9-12, uno de ellos llamado carcinosarcoma11,13, que no se ha incluido en nuestro estudio porque se consideran dentro del grupo de neoplasias bifásicas, consistentes en procesos tumorales que contienen dos tipos de población celular independientes entre sí, en este caso epitelio maligno (carcinoma) y estroma maligno (sarcoma). Es importante no confundirlo con el carcinoma metaplásico con componente sarcoide, la diferencia radica en que éste último está compuesto por células con un mismo origen clonal, algunas de las cuales han sufrido una diferenciación, pero no se trata de dos poblaciones celulares independientes. El diagnóstico diferencial, entre ellos dos y con el sarcoma de mama, se realiza a través de análisis inmunohistológicos, y es importante a la hora de establecer el tratamiento y el pronóstico2. La afectación de los ganglios axilares es rara en los sarcomas de mama, pero no lo es en los carcinomas metaplásicos, por lo que difieren respecto a la necesidad de linfoadenectomía. Además estos últimos suelen responder a quimioterapia o terapia hormonal adyuvante, lo que no ocurre con los sarcomas2,13.
El carcinoma metaplásico suele verse en mujeres mayores de 50 años. Las edades de nuestras pacientes oscilan entre 41-72 años con una media de 55, siendo tres pacientes menores de 50. La revisión de la bibliografía nos muestra que la mayoría de los carcinomas metaplásicos se presentan clínicamente como un nódulo, sin palparse adenopatías axilares en la exploración, al igual que ocurre en nuestra serie.
Los hallazgos radiológicos del carcinoma metaplásico son inespecíficos y el diagnóstico no puede hacerse sólo basándose en métodos de imagen, ya que las características mamográficas, ecográficas o de RM pueden ser indistinguibles de las de otras neoplasias mamarias.
Existen pocas series en la literatura en las que se describa la apariencia mamográfica del carcinoma metaplásico, en todas ellas, al igual que en nuestra serie (tabla 3), se coincide en que este tipo de neoplasia se presenta como una lesión hiperdensa en las mamografías, en mamas sin predominio de un patrón parenquimatoso específico, con un tamaño medio de 2-4 cm, pudiendo llegar a medir hasta 10 cm de diámetro2, con silueta y márgenes variables, observándose un ligero predominio de la morfología oval o redonda, pero de márgenes no bien delimitados y en algunas ocasiones asociados a microcalcificaciones2,10 y a alteración de la arquitectura parenquimatosa2,13,14. Así pues, se concluye que los hallazgos son inespecíficos, sin existir ninguna característica propia que determine la naturaleza del carcinoma metaplásico de mama.
Las referencias bibliográficas que describen los hallazgos ecográficos son aún más escasas que las de los resultados mamográficos (tabla 4). Con esta técnica, los resultados existentes en la literatura también son inespecíficos, sin poderse establecer un predominio claro del tipo de margen, silueta o ecogeneicidad que muestran. Se habla de nódulos con una ecogeneicidad interna compleja, con áreas sólidas y quísticas15, que se correlacionan con necrosis y degeneración quística en el examen patológico. En nuestra serie no se halla este tipo de presentación, siendo la mayoría de los nódulos heterogéneos y mal definidos. Todo ello hace que el papel de la ecografía en el diagnóstico del carcinoma metaplásico sea el de confirmar la presencia de una lesión sólida.
Sólo se han encontrado en la literatura dos estudios que hacen referencia al comportamiento en RM del carcinoma metaplásico de mama. En nuestra serie todas las lesiones son hiperintensas en T2, al igual que ocurre en los carcinomas mucinosos y más raramente con los carcinomas infiltrantes con componente necrótico. En las secuencias dinámicas postcontraste presentan una captación precoz e intensa, sugestiva de enfermedad maligna, que es similar a las de las curvas de captación de los carcinomas infiltrantes de mama o incluso de algunos linfomas de mama, hallazgos que coinciden con los del estudio Chang3 y Velasco4.
A pesar de que la RM no proporciona información específica para el diagnóstico del carcinoma metaplásico, su hiperintensidad en T2 parece útil para diferenciarlo, junto con los carcinomas mucinosos, y algunos carcinomas infiltrantes con componente necrótico, de otros carcinomas invasivos de tipo histológico diferente, preferentemente el carcinoma lobulillar. Además ayuda a determinar la extensión local de la enfermedad de forma más exacta que el resto de técnicas de imagen, y permite descartar infiltración de los tejidos adyacentes o afectación de la mama contralateral.
No se conoce con exactitud la historia natural del carcinoma metaplásico de mama. Según algunos autores presenta el mismo pronóstico que los carcinomas ductales de mama11, otros autores, sin embargo, piensan que el carcinoma metaplásico de mama presenta una progresión más rápida y un peor pronóstico que los carcinomas ductales de mama, siendo la tasa de supervivencia a los cinco años de aproximadamente el 40%2.
CONCLUSIÓN
El carcinoma metaplásico de mama no tiene una apariencia radiológica específica. Puede presentarse como nódulos palpables con características mamográficas y ecográficas tanto benignas como malignas. Los hallazgos en RM tampoco son patognomónicos de carcinoma metaplásico, pero aunque el número de pacientes incluidos en nuestra serie no sea muy elevado, se intuye que su comportamiento es similar al de los carcinomas infiltrantes de mama. Así pues, la RM permite orientar el diagnóstico diferencial hacia patologías malignas y demostrar la extensión de la afectación tumoral de forma más exacta que con las técnicas radiológicas convencionales. Sin embargo, el diagnóstico ha de hacerse basándose en la histología.