El «código ictus» es un procedimiento multidisciplinar diseñado para detectar los ictus agudos de origen isquémico y trasladar a los pacientes para una terapia de reperfusión temprana.
Para la selección de estos pacientes es necesario un estudio radiológico multimodal indistintamente con TC o RM: 1) exploración convencional sin contraste, obligatoria para detectar sangrado; también identifica y cuantifica las áreas de infarto precoz utilizando la escala ASPECTS; 2) estudio angiográfico, necesario en pacientes candidatos a tratamiento mecánico intraarterial; identifica estenosis y obstrucciones y valora la circulación colateral; 3) estudio de perfusión para los pacientes con evolución de entre 6 y 24h o tiempo indeterminado desde el inicio del evento, que discrimina el tejido infartado del tejido isquémico recuperable.
Los softwares semiautomáticos facilitan el diagnóstico, pero precisan la interpretación del radiólogo.
“Code Stroke” is a multidisciplinary procedure designed to detect acute ischemic strokes and transfer patients for early reperfusion. Selecting these patients requires multimodal imaging with either CT or MRI. 1) Conventional studies without contrast material are obligatory to detect bleeding. Applying the ASPECTS scale, these studies can also identify and quantify areas of early infarction. 2) In candidates for mechanical thrombectomy, angiographic studies are necessary to identify stenoses and obstructions and to evaluate the collateral circulation. 3) Patients with known onset between 6 and 24hours or with unknown onset require perfusion studies to distinguish between infracted tissue and recoverable ischemic tissue. Semi-automatic software facilitates diagnosis, but radiologists must interpret its output.
El ictus es un síndrome clínico secundario al trastorno brusco del flujo sanguíneo cerebral (FSC) que altera de forma transitoria o permanente la función de una determinada zona del encéfalo. El 80% tiene origen isquémico y el 20%, hemorrágico.
El ictus es una enfermedad muy prevalente en nuestro medio, una de las principales causas de muerte y la primera causa de invalidez. Los ictus isquémicos son los que se incluyen en la guía de diagnóstico y tratamiento conocida como «código ictus»1–3.
Se denomina «código ictus» al procedimiento creado para identificar precozmente los signos y síntomas de un ictus isquémico y trasladar al paciente a un centro sanitario de referencia donde se selecciona aquel paciente que pueda beneficiarse de una terapia de reperfusión y cuidados especiales en una Unidad de Ictus.
No debe enviarse al paciente al centro médico más cercano, sino al centro médico de referencia más cercano. En caso de grandes distancias se puede practicar tratamiento con telerradiología descartando sangrado e iniciando terapia por vía intravenosa (IV)1–3.
Con este artículo se pretende una revisión actualizada y divulgativa que explique de modo sencillo cómo, cuándo y por qué se practica el estudio diagnóstico multimodal en «código ictus».
TratamientosLos tratamientos validados son la fibrinólisis IV y la trombectomía intraarterial (TIA).
La fibrinólisis IV consiste en la inyección IV de alteplasa, que es un activador recombinante del plasminógeno. Puede emplearse con un límite de 4h y media desde el inicio de los síntomas y su eficacia es mayor cuanto menos se demore su administración; es de fácil aplicación, pero presenta numerosas contraindicaciones, dado que puede complicarse con hemorragia intracerebral o sistémica.
La TIA se practica en centros de referencia acreditados; precisa de anestesista por si fuera necesaria sedación o anestesia general, implica demora en los preparativos e inevitablemente transcurre tiempo entre la punción femoral y la reperfusión vascular definitiva. Frente a la fibrinólisis IV tiene mayor ventana de actuación, es más eficaz en el tratamiento de obstrucciones proximales y trombos de mayor tamaño y tiene menos complicaciones hemorrágicas1–3.
Durante el año 2015 se publicaron varios ensayos clínicos, EXTEND IA, MR CLEAN, ESCAPE, REVASCAT y SWIFT PRIME4–8, que confirmaron la mayor eficacia de la TIA frente a la fibrinólisis IV en oclusiones arteriales proximales de la circulación anterior, estableciendo además el límite de 8h para la reperfusión e iniciando la punción vascular a las 6h del inicio del evento.
Posteriores ensayos, como DEFUSE 3 y DAWN9,10, permitieron ampliar la ventana terapéutica, a 16 y 24h, respectivamente. En estos casos con tiempo superior a 6h y en casos de inicio indeterminado de la clínica son cruciales los estudios de viabilidad tisular mediante técnicas de perfusión que calculan el volumen de tejido infartado (core) y la penumbra isquémica o tejido recuperable3.
Criterios de inclusión para tratamiento de reperfusiónLas guías incluyen unos límites clínicos y radiológicos a partir de los cuales se considera que hay escasa posibilidad de mejoría clínica y mayor probabilidad de complicaciones hemorrágicas:
- 1.
Puntuación de la exploración neurológica siguiendo la escala National Institute of Health Stroke Scale (NIHSS), que es una escala clínica que cuantifica desde el 0 hasta el 42. Son candidatos a tratamiento de reperfusión aquellos pacientes con NIHSS superior a 4 e inferior a 25. Se considera leve la puntuación<5, moderada entre 5-9 y severa 10 o más. Esta exploración es realizada por el neurólogo encargado del episodio1–3.
- 2.
Tiempo transcurrido desde el inicio del evento: se considera un límite de 4h 30min para el tratamiento fibrinolítico IV1–3, aunque en casos seleccionados, y contando con estudios radiológicos de viabilidad tisular, puede extenderse el uso compasivo del tratamiento IV3. La trombectomía mecánica tiene una ventana de actuación de 6h; sin embargo, si el estudio multimodal demuestra escaso infarto y buena penumbra isquémica, se puede intervenir hasta 24h después del inicio de los síntomas3,9,10.El ictus de la arteria basilar es diferente: se aplica una ventana terapéutica que puede llegar a 48h en los cuadros de sintomatología vertebrobasilar de aparición insidiosa progresiva. En la práctica se trata de una enfermedad tan grave que debe intentarse el tratamiento tras una evaluación radiológica adecuada11.
- 3.
Ausencia de sangrado. El sangrado constituye una contraindicación absoluta. La demostración de microsangrado con RM no impide el tratamiento. Los sangrados fuera del territorio afectado por el ictus no constituyen una contraindicación total a la trombectomía mecánica1–3.
- 4.
Extensión del infarto establecido superior a 1/3 del territorio de la arteria cerebral media (ACM) equivalente a 70-100 cc de tejido; supone una contraindicación relativa que afectaría fundamentalmente a los casos de más de 6h de evolución o con otras contraindicaciones parciales al tratamiento2,3. La guía AHA 2018 indica que no hay evidencia científica para excluir un paciente del tratamiento basándose en la extensión del core infartado; sin embargo, la mayoría de las guías clínicas desaconsejan la intervención en infartos extensos con puntuación ASPECTS<63.
La valoración radiológica del paciente en código ictus es esencial. Es imprescindible descartar un ictus hemorrágico, confirmar y localizar las oclusiones arteriales de cara al tratamiento intraarterial, y evaluar la viabilidad del tejido isquémico afectado. Para ello se emplea el estudio radiológico multimodal que consta de una serie convencional sin contraste, una serie angiográfica y una serie de perfusión. Estos estudios pueden practicarse indistintamente con TC o RM3 (fig. 1).
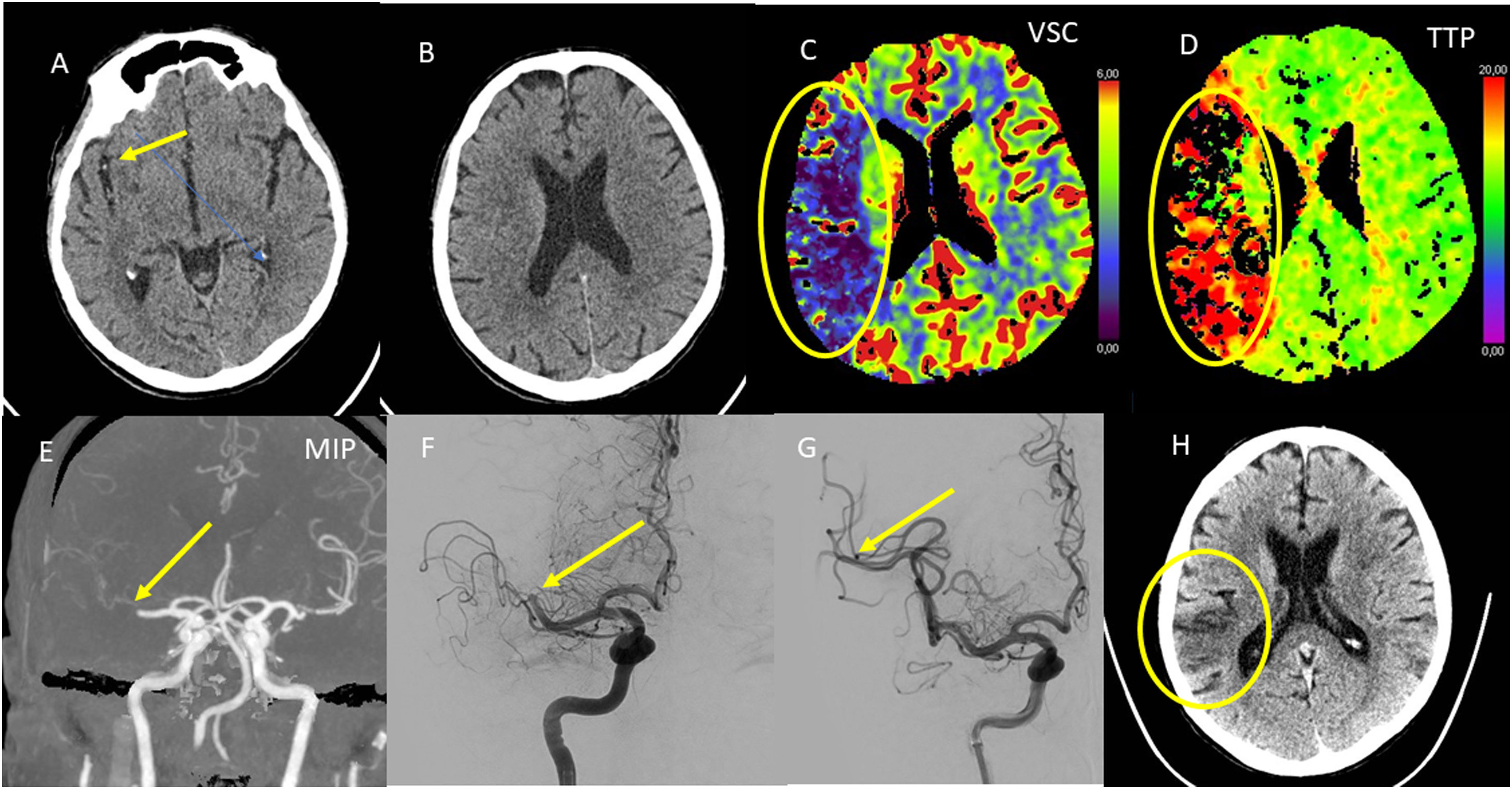
Ictus hiperagudo con imagen de falso positivo para infarto con técnicas de perfusión. Mujer 84 años con hemiplejia izquierda de menos de 1h de evolución. TC basal. A) Imagen centrada en el segmento M2 de la ACM. B) Imagen centrada en centros semiovales. Signo de la ACM hiperdensa (flecha) sin evidencia de infarto establecido, ASPECTS 10. TC perfusión. C) Mapa de VSC. D) Mapa de TP. Extenso infarto establecido en VSC con igual afectación en TP compatible con infarto de 2/3 del territorio ACM, sin penumbra isquémica significativa. E) Reconstrucción MIP de la angio-TC que demuestra una oclusión proximal de la ACM M1 (flecha). F y G) Angiografía con sustracción digital en la que se aprecia completa recanalización de la ACM derecha (flechas). H) TC de control tras la trombectomía con un infarto mucho menor que el predicho con la serie de perfusión. Una de las fuentes de falsos positivos en la perfusión es el ictus hiperagudo. Debemos recordar que siempre las imágenes de la TC convencional prevalecen sobre las de perfusión.
La RM con difusión (RMD) tiene una sensibilidad para detectar un infarto isquémico del 88-100% y una especificidad del 95-100% en las primeras 3h, lo que la convierte en la prueba de referencia12–14. No obstante, la sensibilidad de la TC para detectar un infarto se considera suficiente para el manejo de los pacientes dentro de las primeras 6h del ictus3.
Ambas técnicas tienen una sensibilidad y una especificidad muy altas (> 90%) para detectar sangrado y presentan en las guías clínicas un grado de recomendación A y nivel de evidencia I1–3,15,16.
El principal problema de la RM consiste en su baja disponibilidad en la mayoría de los servicios de urgencias: según datos del Stroke Imaging Repository Consortium (STIR), en 2016, tanto en Europa como en Estados Unidos, la RM de urgencias se usaba en no más de un 20% de los casos de código ictus. Los inconvenientes de la RM incluyen también la mayor duración del estudio (estimado en 15-20min), mayor susceptibilidad al movimiento, dificultad para la monitorización y contraindicaciones tales como algunos marcapasos o la posibilidad de toxicidad por gadolinio3. Por tanto, se suele preferir la TC por motivos de economía, disponibilidad y rapidez17.
Estudio convencional sin contrasteResulta obligatoria la práctica de una técnica convencional de neuroimagen (TC o RM) para la selección de los candidatos al tratamiento de reperfusión. Está indicado en las guías clínicas con grado de recomendación A y nivel de evidencia I.
- 1.
Descarta sangrado. Tanto la TC como la RM tienen sensibilidad y especificidad superiores al 90% para detectar sangrado y resultan equivalentes entre sí. La presencia de sangrado es una contraindicación absoluta para el tratamiento reperfusor, independientemente de que se trate de un ictus hemorrágico o un ictus isquémico complicado con sangrado. Ese es el motivo por el que las pruebas convencionales sin contraste son las únicas obligatorias antes de intentar un tratamiento reperfusor1–3.
- 2.
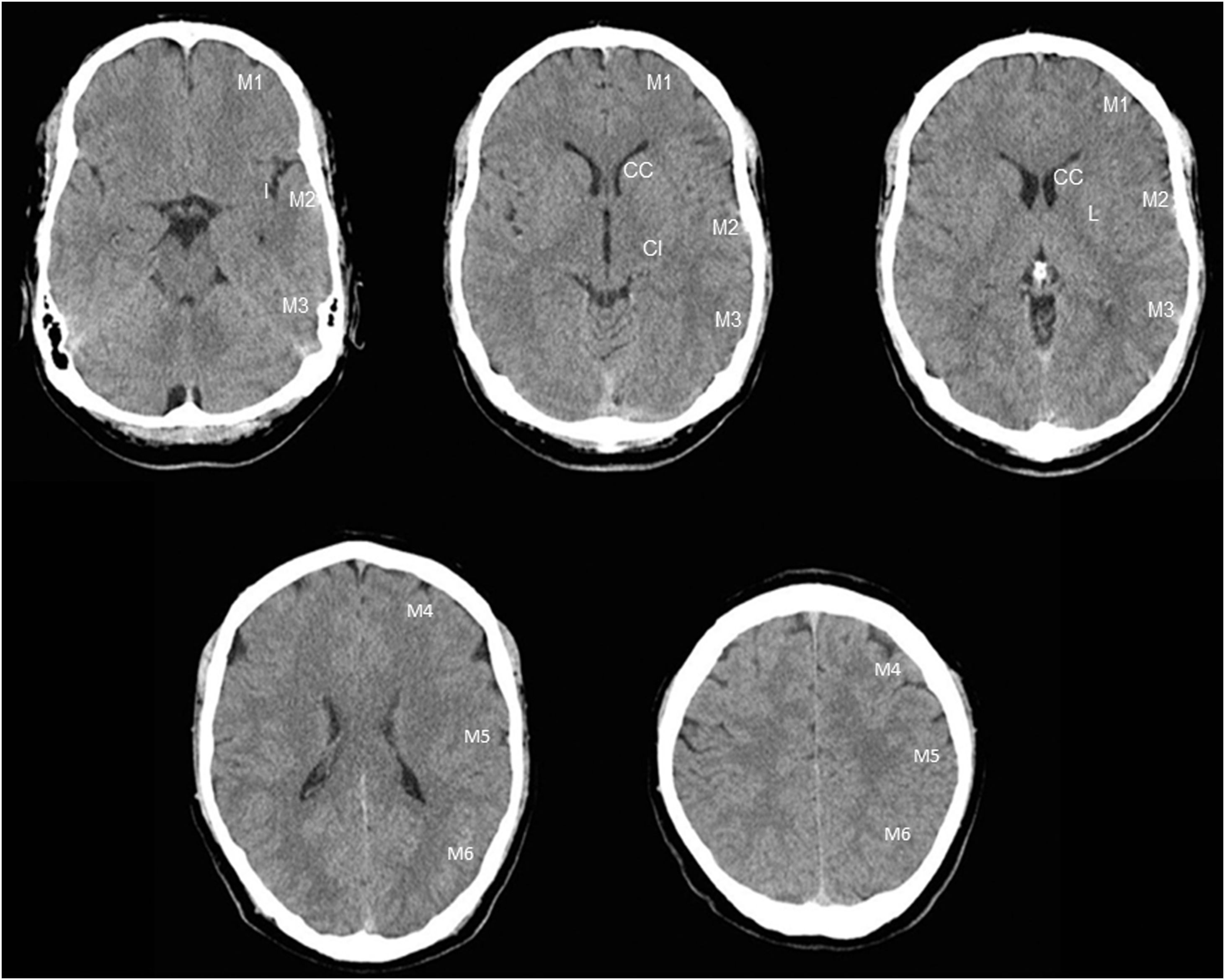
Delimita el infarto. Se considera límite para el tratamiento un infarto establecido con un volumen de un tercio del territorio de la ACM o 75-100ml de tejido cerebral. Se estima que la TC tiene una sensibilidad para los signos precoces de infarto de solo un 20% en las primeras 3h, que puede pasar a más del 60% en las primeras 6h. Cuando aparecen estos signos tienen una gran especificidad18,19.El Alberta Stroke Program Early CT Score (ASPECTS) es una escala semicuantitativa que puntúa del 10 al 0 según aparezcan signos de isquemia precoz en alguno de los 10 territorios vasculares predeterminados de ACM: una puntuación de 10 indica que no hay alteraciones, mientras que se resta un punto por cada región cerebral afectada. Una puntuación inferior a 6 indica un infarto grande, con escasa posibilidad de mejoría clínica tras el tratamiento y con elevado riego de sangrado.La escala ASPECTS se utiliza como referencia en todas las guías clínicas. Se ha utilizado en todos los ensayos a los que nos hemos referido confirmando la TC convencional como el estudio radiológico de primera línea. Debe recordarse que la escala ASPECTS no sirve para infartos lacunares, infartos del tronco encéfalo ni en cualquier otro territorio fuera del de ACM20,21 (fig. 2).
Figura 2.Cuantificación de la escala ASPECTS. La escala ASPECTS es una escala que divide el territorio vascular de la ACM en 10 áreas: 4 en núcleos de la base (CC: cabeza del núcleo caudado; CI: cápsula interna; L: núcleo lenticular; I: cápsula interna) y 6 en territorios corticales: M1, M2, M3 corresponden a circunvoluciones frontales, temporales y parietales a la altura de los núcleos de la base, y M4, M5 y M6 a la altura de los centros semiovales. Por cada área con evidencia de infarto se resta un punto, de modo que la ausencia de lesiones equivale a ASPECTS 10. Habitualmente se desaconseja el tratamiento en ASPECTS inferiores a 6.
(0,35MB). - 3.
Descartar imitadores del ictus. El 20% de los pacientes que llegan con código ictus y hasta el 16% de los pacientes fibrinolizados no presentan una enfermedad cerebrovascular sino imitadores del ictus22. El diagnóstico diferencial incluye tumores, malformaciones vasculares o colecciones extracerebrales que se aprecian bien con TC. Sin embargo, la mayoría de los imitadores clínicos del ictus (parálisis de Todd, hipoglucemia, encefalopatía posterior reversible y migrañas acompañadas, entre otros) no son visibles con métodos de imagen, aunque pueden ocasionar alteraciones en los estudios de perfusión22.
Es necesario practicar una angiografía por TC (ATC) o RM (ARM) en aquellos pacientes que reúnen criterios para la trombectomía mecánica intraarterial con grado de recomendación A y nivel de evidencia I2,3.
Esta exploración confirma la presencia o ausencia de una oclusión arterial, el nivel de la obstrucción, la extensión del trombo, el estado del árbol vascular y el grado de oclusión arterial.
La trombectomía mecánica estará indicada en los casos de oclusión de la arteria carótida interna, los segmentos M1 o M2 de la ACM o los segmentos A1 o A2 de la arteria cerebral anterior demostrados con angio-TC, angio-RM o angiografía con sustracción digital3.
Respecto a la angiografía por sustracción digital (prueba de referencia), la ATC tiene una sensibilidad del 87-100% y una especificidad del 82-100%. Se practica en pocos minutos y no es un procedimiento invasivo23–25.
La ARM con contraste IV tiene una sensibilidad del 86-97% y una especificidad del 62-91%. Resulta una mejora con respecto a la secuencia time of flight sin contraste, que todavía es muy utilizada. En el código ictus se recomienda, por tanto, realizar la ARM con contraste3,23–25.
El estudio angiográfico incluye también una valoración de la circulación colateral pial.
Se han propuesto numerosas clasificaciones que básicamente incluyen: 1) ausencia de colaterales; 2) pobres colaterales; 3) igual vascularización que el hemisferio contralateral, y 4) mayor circulación en el hemisferio afectado22,26.
Algunos autores emplean la ATC multifase (arterial, venosa media y venosa tardía) para mejorar la fiabilidad de la técnica, lo que evita una infraestimación de la circulación colateral cuando la adquisición de la imagen es demasiado rápida22,26.
Ante una oclusión proximal, la presencia de buenas colaterales se asocia habitualmente a un infarto pequeño, mayor componente de tejido rescatable y resulta predictora de buen pronóstico22,26.
Todos los ensayos señalados han empleado ATC y en un pequeño número de casos ARM. Solo el estudio ESCAPE empleó la valoración de las colaterales como criterio de exclusión de pacientes6. El cálculo de la colateralidad tiene un uso predictivo en programas de IA, pero debe interpretarse en conjunto con todos los datos obtenidos en el estudio multimodal3.
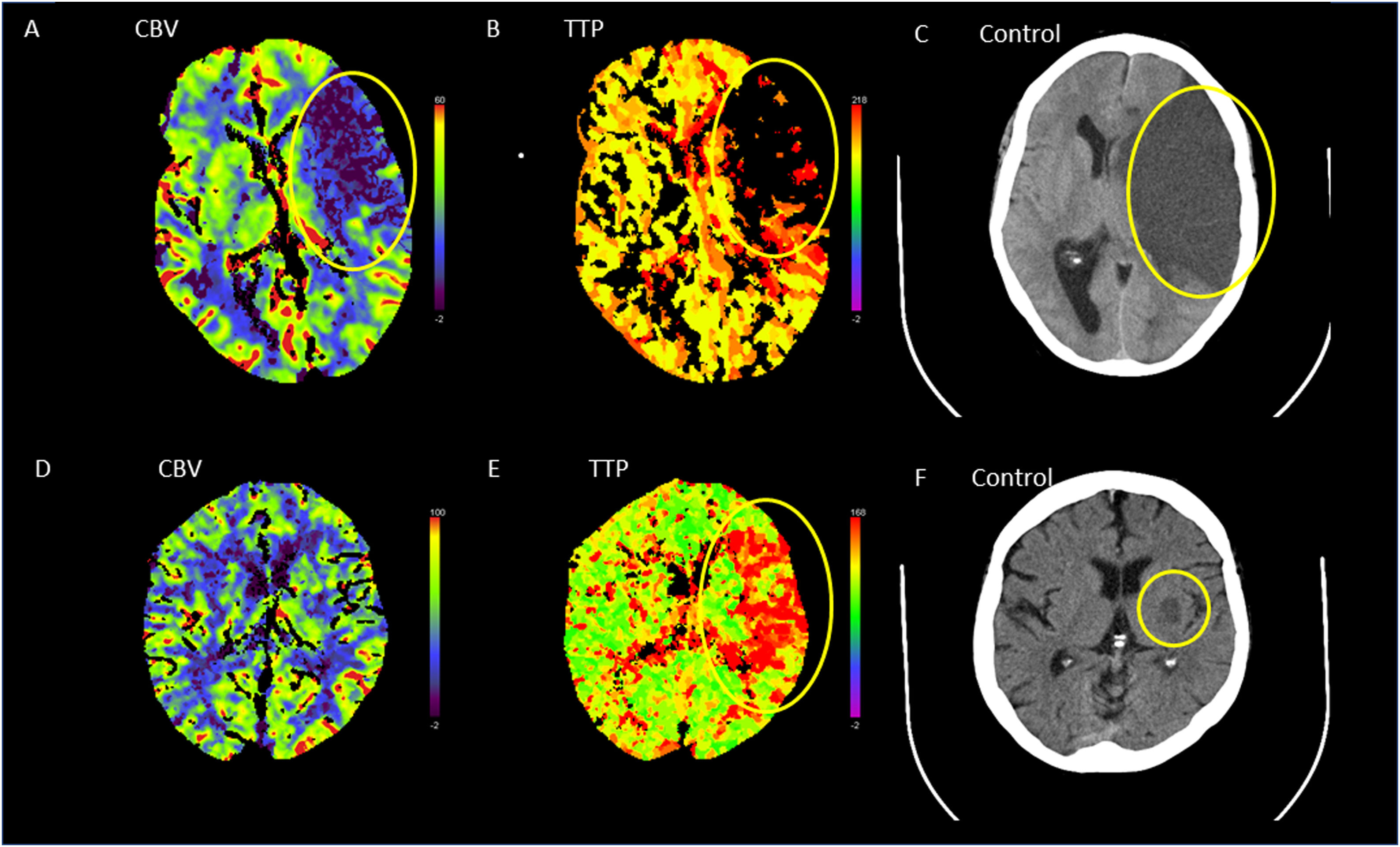
El estudio de las imágenes fuente de la ATC siguiendo la escala ASPECTS (ATC IF ASPECTS) identifica las áreas infartadas mejor y antes que el ASPECTS con TC27.
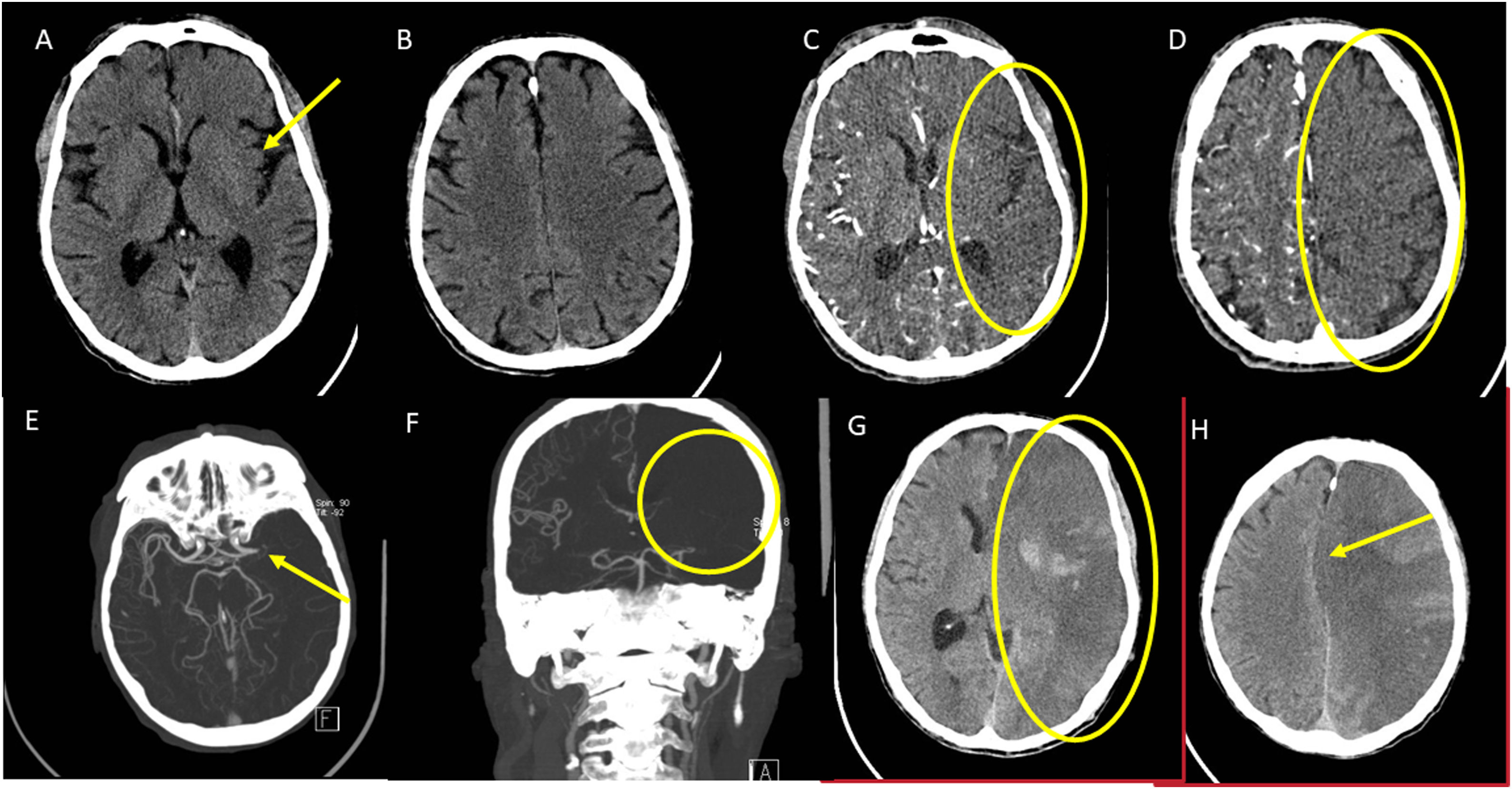
El uso de ATC IF y el análisis de las colaterales no están estandarizados y no son suficientes como criterios de exclusión, aunque de confirmarse los resultados, podrían sustituir a las técnicas de perfusión (fig. 3).
Ictus de mal pronóstico radiológico. Ictus intrahospitalario de menos de una hora de evolución. A y B) El estudio basal fue catalogado como ASPECTS 9 por hipodensidad en la cintilla insular (flecha). C y D) La serie ATC IF refleja un infarto extenso en forma de área de menor captación en la práctica totalidad del hemisferio izquierdo (señalado con elipse). E y F) La reconstrucción MIP de la ATC confirma una oclusión de la ACM izquierda M1 sin colaterales apreciables (señalado con elipse). G y H) Se trató con fibrinólisis dado el tiempo transcurrido y el ASPECTS basal. La TC de control demuestra un extenso infarto con complicación hemorrágica añadida.
El estudio de perfusión es un estudio dinámico que recoge las curvas de captación y eliminación de contraste en un volumen cerebral determinado.
Los estudios de perfusión calculan muchos parámetros a partir de diferentes algoritmos de deconvolución, cuya descripción queda más allá del alcance de esta revisión. Los más utilizados tanto en la TC como en la RM son el volumen sanguíneo cerebral (VSC), el flujo sanguíneo cerebral (FSC), el tiempo de tránsito medio (TTM), el tiempo al pico (TP) y el tiempo hasta el máximo realce (Tmáx).
Estos parámetros tienen distintos valores de referencia según diferentes autores: los más utilizados actualmente son FSC<30% en el lado patológico como equivalente a infarto y Tmáx prolongado más de 6 s respecto al hemisferio sano para indicar penumbra isquémica28–32.
En las actuales Guías clínicas de tratamiento (AHA 2018) los estudios de viabilidad tisular en pacientes con ictus de entre 6 y 24h de evolución o pacientes con ictus de inicio indeterminado son necesarios con un grado de recomendación A y nivel de evidencia I3.
Los estudios de perfusión tienen 2 aplicaciones fundamentales:
- 1.
Identificación de la necrosis isquémica: mientras que la RMD (prueba de referencia) identifica alteraciones metabólicas, la perfusión TC (PTC) interpreta alteraciones dinámicas de la perfusión sanguínea. Pese a ser un método indirecto, la PTC identifica el área infartada con una sensibilidad global del 80% y una especificidad del 95% (con respecto a la RM).La gran mayoría de los falsos negativos con PTC corresponden a infartos lacunares o infartos corticales que quedan fuera del campo estudiado (unos 8cm de espesor en los equipos de 64 detectores)31,32.Pese a los buenos resultados de la valoración del infarto con perfusión, en las guías de práctica clínica sigue teniendo prioridad la valoración ASPECTS con TC sin contraste3. Existen casos de sobrestimación del core, generalmente por motivos técnicos y, en ocasiones, por tratarse de un ictus hiperagudo32.
- 2.
Identificación de la penumbra isquémica: la penumbra isquémica es un volumen de tejido cerebral isquémico con alteración funcional pero potencialmente recuperable tras la recanalización. Estas áreas oligohémicas pueden detectarse tanto con PRM como con PTC.La discrepancia entre el volumen del infarto y el volumen de la penumbra se conoce como desajuste (mismatch) y se utiliza como predictor de buena respuesta al tratamiento.Esta capacidad resulta clave en casos de ictus de más de 6-8h desde el inicio, ictus del despertar y en casos de indicación terapéutica dudosa3. Los parámetros que indican retrasos en el tiempo (Tmáx, TP o TTM) pueden alterarse por causas distintas de la oclusión arterial; sin embargo, en casos de auténtico ictus y en ausencia de infarto establecido demostrado por disminución del VSC o del FSC van a indicar que el tejido afectado es viable incluso en pacientes fuera de los criterios de tiempo convencionales32 (fig. 4).
Figura 4.Ejemplos de ictus con discrepancia infarto/penumbra o sin discrepancia (mismatch). A) Ejemplo de estudio de perfusión con un infarto en 1/3 del territorio de la ACM (morado en VSC). B) Esta lesión coincide plenamente con la afectación del TP, sugiriendo un infarto establecido sin discrepancia. C) Una semana más tarde se comprueba un extenso infarto establecido en la TC de control. D) Un segundo ejemplo con el VSC no alterado, lo que excluye un infarto establecido. E) Extensa afectación del TP en el hemisferio izquierdo que indica penumbra isquémica recuperable. F) El estudio de control tras el tratamiento practicado a las 24h muestra un infarto limitado a los núcleos de la base del hemisferio izquierdo.
(0,64MB).
Actualmente, puede practicarse la trombectomía mecánica hasta 24h desde el inicio del evento si los pacientes presentan buenas colaterales, escaso infarto y penumbra recuperable significativa.
No son raras las imágenes de falsa penumbra, bien por motivos técnicos, bien por auténtica enfermedad imitadora de ictus: migraña acompañada, crisis epilépticas y encefalopatía posterior reversible. Los resultados de la perfusión deben interpretarse junto con las imágenes convencionales y angiográficas: una penumbra no acompañada de oclusión arterial puede corresponder a una seudopenumbra30–32.
Aplicaciones de inteligencia artificial en código ictusExisten aplicaciones de inteligencia artificial que hacen un cálculo automatizado del ASPECTS, un análisis del core y de la penumbra, así como un cálculo de las colaterales mediante parámetros como el índice de VSC y la ratio de intensidad de perfusión.
La aplicación más importante es RAPID, utilizada en 12 ensayos, entre los que se encuentran los DEFUSE, y estando también muy extendido el software de Brainomics.
Estas aplicaciones homogenizan la interpretación de los estudios, están respaldadas por importante evidencia científica y ya están siendo utilizadas en cientos de centros de más de 40 países. Su principal ventaja puede consistir en que envían de forma casi instantánea una evaluación del estudio multimodal a los dispositivos móviles de los profesionales implicados en el diagnóstico y el tratamiento del ictus.
Presentan inconvenientes, como no integrar la información clínica del paciente, umbrales distintos entre los distintos programas que pueden dar problemas en la reproducibilidad de los estudios y errores en la adquisición técnica que hacen necesaria la supervisión de un radiólogo32–34.
ConclusionesEl código ictus es un procedimiento multidisciplinar para identificar y tratar de modo urgente los ictus agudos de causa isquémica.
El procedimiento incluye un estudio radiológico multimodal que consta de un estudio convencional sin contraste, un estudio angiográfico y un estudio de perfusión.
Pueden emplearse tanto la TC como la RM, con un valor diagnóstico similar. Generalmente se utiliza la TC por motivos de disponibilidad y rapidez de la exploración.
Es obligatoria la exploración convencional sin contraste para descartar un ictus hemorrágico y para valorar la presencia de signos precoces de infarto utilizando la escala ASPECTS.
El estudio angiográfico es necesario cuando hay posibilidad de tratamiento intraarterial, aunque es recomendable practicarlo siempre. Esta modalidad añade mucha información, confirmando las oclusiones y las estenosis, y valorando la circulación colateral pial.
Los estudios de perfusión permiten distinguir la penumbra, que corresponde a tejido isquémico potencialmente recuperable, del infarto o tejido necrosado ya irrecuperable. Su práctica es necesaria en ictus de más de 6h de evolución y en aquellos ictus con hora de inicio desconocida.
En principio, aquellos pacientes con poco volumen infartado, amplia penumbra y buenas colaterales tienen buen pronóstico, independientemente del tiempo transcurrido desde el inicio de los síntomas.
Autoría1. Responsable de la integridad del estudio:
2. Concepción del estudio:
3. Diseño del estudio:
4. Obtención de los datos:
5. Análisis e interpretación de los datos:
6. Tratamiento estadístico:
7. Búsqueda bibliográfica:
8. Redacción del trabajo:
9. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes:
10. Aprobación de la versión final:
Conflicto de interesesLos autores declaran no tener conflicto de intereses con firmas comerciales u otras entidades. Declaran no tener financiación.