La gestación precoz anormal sigue constituyendo una situación clínica, en ocasiones compleja, a la que debe enfrentarse el ginecólogo. La ecografía se ha convertido en un arma diagnóstica fundamental en este contexto clínico. En el presente trabajo se pretende revisar, de modo somero y con visión práctica, el papel de la ultrasonografía en el diagnóstico y manejo de la gestación precoz anormal.
Early pregnancy failure still represents a challenge for most clinicians. Ultrasonography is currently an essential diagnostic tool in this clinical setting. The present review addresses the role of ultrasound in the diagnosis and management of early pregnancy failure.
Aproximadamente un 25% de las gestaciones precoces clínicamente reconocidas son gestaciones anómalas (abortos, gestaciones ectópicas o enfermedad trofoblástica gestacional [ETG])1. La introducción de la ecografía ha supuesto un avance importantísimo en el diagnóstico y el manejo de estas situaciones clínicas. En muchas ocasiones la práctica de una ecografía permite el diagnóstico de una gestación precoz anómala antes de que la paciente manifieste síntomas, fundamentalmente hemorragia vaginal, por lo que el manejo de algunas de estas situaciones ha cambiado drásticamente. Por esto las decisiones clínicas sobre la conducta que se debe seguir en la mayoría de las gestaciones precoces anómalas se toman basándose en los hallazgos ecográficos.
Sin embargo, no hay que olvidar que hay 2 datos objetivos, aparte de los hallazgos ecográficos y la situación clínica de la paciente, que pueden ayudar mucho a la interpretación de la ecografía y, por tanto, a decidir la conducta clínica recomendada en cada paciente. Estos 2 datos son la edad gestacional según amenorrea, cuando puede ser correctamente fijada basándose en la fecha de la última menstruación, y las cifras de gonadotropina coriónica beta (β-HCG) sérica.
Por tanto, una primera idea que se debe tener presente es que, aunque la ecografía puede proporcionar datos diagnósticos definitivos en muchas ocasiones, esto no siempre es así y el conocimiento de la edad gestacional según amenorrea y la tasa de β-HCG sérica pueden ser fundamentales para la interpretación de los hallazgos ecográficos y la toma de decisiones.
Una segunda idea de gran relevancia es el hecho de que, aunque la práctica de la ecografía para la evaluación de la gestación precoz anómala se inició a finales de la década de los sesenta con el uso de la ecografía transabdominal, la introducción de la ecografía transvaginal a finales de los años ochenta supuso un gran avance, ya que se incrementó sustancialmente la resolución de la imagen y permitió realizar diagnósticos más precisos y tempranos2. Debido a que el uso de la ecografía transvaginal está hoy día muy extendido, sólo nos referiremos a datos obtenidos a partir de esta vía, dándose por obsoletos los criterios empleados cuando se utilizaba exclusivamente la vía transabdominal. Esto no quiere decir que la ecografía transabdominal no tenga lugar en la evaluación de la gestación precoz anómala, sino que la vía inicial de estudio debe ser la transvaginal y que la vía transabdominal sólo debería emplearse en determinadas circunstancias.
Finalmente, hay que señalar que el papel de la ecografía en la evaluación de la gestación precoz anómala no es sólo diagnóstico. También se ha explorado el papel predictivo que la ecografía puede tener en diversas circunstancias, como el resultado de la gestación en la resolución espontánea en la amenaza de aborto o gestación ectópica.
En el presente artículo revisamos el papel diagnóstico y predictivo de la ecografía transvaginal en la evaluación de la gestación precoz anormal, exceptuando la ETG.
GESTACIÓN PRECOZ NORMALPara poder interpretar correctamente los hallazgos ecográficos en la gestación precoz anómala, resulta de vital importancia conocer los hallazgos en la gestación de curso normal. En este sentido, un conocimiento detallado de la embriología y una mínima experiencia en la práctica de la ecografía transvaginal resultan fundamentales. Esto es así porque, aun en el caso de no conocer la edad gestacional según amenorrea, la identificación de ciertas estructuras embrionarias y su correlación con el tamaño del saco gestacional nos pueden orientar respecto a la edad de la gestación.
Las estructuras embrioanatómicas visibles por ecografía transvaginal son: decidua, saco gestacional, corion, vesícula vitelina y embrión. No hay que olvidar que el cuerpo lúteo es visible en más del 90% de las gestaciones precoces3.
La primera estructura visible es el saco gestacional que puede identificarse ya con 2–3 mm de diámetro a las 4–5 semanas de amenorrea. Suele localizarse como un área anecoica en el espesor de la decidua y habitualmente de localización excéntrica. Se delimita de la decidua por un lado hiperecogénico que corresponde al corion precoz. Suele crecer a ritmo de 1 mm por día4,5.
La vesícula vitelina es la primera estructura que puede identificarse en el interior del saco gestacional. Se identifica como una estructura quística redondeada, de pared fina, dentro del saco cuando éste alcanza los 6–8 mm, a partir de las 5,5 semanas de amenorrea. Siempre es visible con sacos de más de 10 mm de diámetro. Crece a un ritmo de 1 mm por semana hasta alcanzar 6 mm en la semana 10 y regresa a partir de entonces; no es visible ya a las 12–13 semanas4,5.
Poco después es identificable el embrión, como una estructura ecogénica de unos 2–3 mm, junto a la vesícula vitelina. Su longitud cráneo-caudal (LCC) crece a ritmo de 1 mm por día, aproximadamente. El latido cardíaco puede detectarse casi desde el momento en que el tubo cardíaco empieza a latir. Sin embargo, se ha observado que hasta en un 10-20% de los embriones con LCC < 5 mm en gestaciones de curso normal, el latido cardíaco no es apreciable. Su identificación certera es lo único que permite establecer de modo definitivo la viabilidad de la gestación. Estudios longitudinales demuestran que el ritmo cardíaco se incrementa con la edad gestacional, pasando de 100–115 latidos/min a las 5-6 semanas a 140–150 latidos/min a las 9–10 semanas4,5.
Respecto al cuerpo lúteo, como ya se ha mencionado, es identificable en más del 90% de las ocasiones. Su apariencia puede ser variada y su tamaño no cambia sustancialmente durante las 10 primeras semanas; posteriormente regresa y queda como una estructura residual en el ovario hacia las 13 semanas3.
Un resumen esquemático de estos hallazgos se refleja en la tabla 1.
El empleo del Doppler para evaluar la circulación en la gestación precoz también se ha estudiado. Se ha analizado la circulación lútea, la circulación útero-placentaria, la circulación vitelina y la circulación embriofetal, y se han establecido los patrones de normalidad para todas ellas. Esto permitirá no sólo un estudio anatómico, sino también, en alguna medida, funcional de la gestación precoz4.
GESTACIÓN PRECOZ ANÓMALAComo ya se ha comentado, aproximadamente una cuarta parte de las gestaciones precoces clínicamente reconocidas tienen una evolución anormal o son anómalas de inicio, como la ETG o la gestación ectópica.
Desde el punto de vista clínico, las pacientes pueden presentarse asintomáticas al diagnóstico o realizarse el diagnóstico tras una manifestación clínica, habitualmente una hemorragia vaginal o dolor pélvico.
Las diferentes formas clínicas de la gestación precoz anómala son la amenaza de aborto, el aborto diferido, el aborto completo/incompleto y la gestación ectópica.
Para simplificar, iremos analizando cada una de ellas a partir, fundamentalmente, de los hallazgos ecográficos.
Gestación precoz intrauterina viableSin ser una situación anómala, todo lo contrario, he querido analizar esta situación para evaluar el papel predictivo de la ecografía.
Como su propio nombre indica, estaríamos ante una gestación intrauterina con embrión visible con latido cardíaco identificable en una paciente, en principio, asintomática.
La identificación del latido cardíaco garantiza una evolución normal de la gestación hacia el segundo trimestre en menos del 95% de los casos6.
Algunos autores han analizado el papel predictivo de ciertos hallazgos ecográficos en relación con el devenir de la gestación7,8.
- –
Saco gestacional: se ha descrito que un saco gestacional de tamaño menor de lo esperado o irregular se asocia a un mayor riesgo de aborto espontáneo. También un corion de espesor fino y una inserción “opuesta” del embrión, es decir el embrión se localiza en el lado del corion leve, se han asociado a mal pronóstico.
- –
Tamaño de la vesícula vitelina: se ha observado que un tamaño anormal, especialmente si es anormalmente grande, está asociado con un elevado riesgo de aborto espontáneo (70%).
- –
LCC embrionaria: se ha observado que una LCC menor de la esperada (diferencia > 7 días) en gestaciones bien datadas se asocia a un mayor riesgo de aborto espontáneo. Hay datos conflictivos sobre la asociación entre la LCC y la presencia de alteraciones cromosómicas. La mayoría de los estudios no encuentra asociación entre la LCC y las alteraciones cromosómicas.
- –
Frecuencia cardíaco-embrionaria (FCE): la mayoría de los autores que han analizado la FCE han observado que la bradicardia se asocia a una mayor probabilidad de aborto espontáneo. Se han empleado diversos criterios; los más aceptados son una FCE < 85 latidos/min o < 1,2 s de la media entre las 6-10 semanas. Entre el 90-100% de estos embriones no sobrevive9,10.
Aunque todos estos datos podrían resultar interesantes desde un punto de vista predictivo, son de poca utilidad clínica ya que, mientras se identifique latido cardíaco presente, la mayoría de los ginecólogos no adoptará una conducta intervencionista y tan sólo un seguimiento periódico determinará definitivamente el resultado final de la gestación.
Amenaza de abortoDesde el punto de vista clínico, se entiende por amenaza de aborto toda aquella situación de hemorragia vaginal en una mujer gestante antes de las 20 semanas de gestación. La mayoría de ellas se producirán en las 12 primeras semanas.
En este grupo deben incluirse, en principio, situaciones como gestación viable amenazada (embrión vivo), aborto diferido, aborto completo o incompleto, gestación ectópica y ETG, ya que todas ellas pueden manifestarse inicialmente con hemorragia vaginal. Sin embargo, en este apartado analizaremos específicamente la gestación viable amenazada.
Ya se ha señalado que, una vez identificado el latido cardíaco embrionario en una gestación precoz asintomática, la probabilidad de aborto final es inferior al 5%. Sin embargo, si se produce una amenaza de aborto con hematoma retrocorial esta probabilidad se eleva al 15%11.
En las gestaciones amenazadas con embrión vivo pueden aplicarse los mismos criterios que sobre la FCE, el saco gestacional, la vesícula vitelina y la LCC que en la gestación no amenazada.
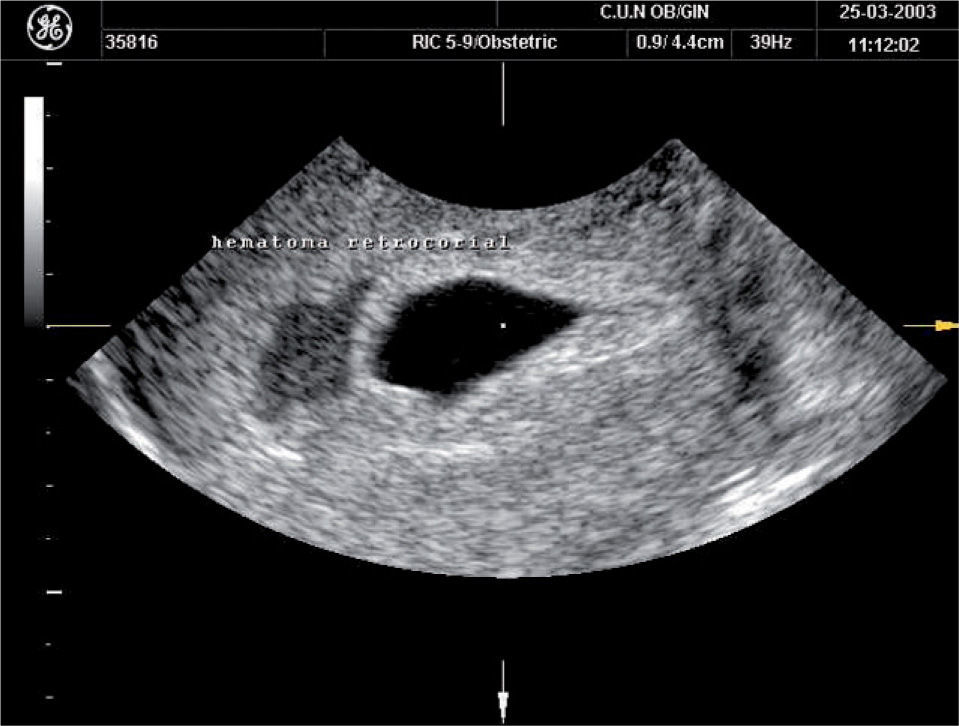
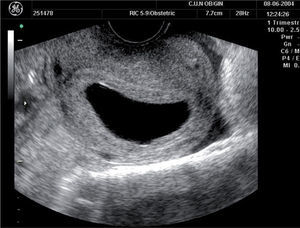
Sin embargo, en la gestación amenazada el principal hallazgo ecográfico asociado a mal pronóstico es el hematoma retrocorial. Éste se define como una colección sonoluscente entre el corion y el miometrio (fig. 1). Es importante no confundirlo con el líquido intracavitario procedente de secreciones deciduales, lo cual es difícil en muchas ocasiones. Diversos estudios han observado que tanto la localización del hematoma (afectación del corion frondoso) como el volumen están asociados a un mayor riesgo de aborto. Sin embargo, este riesgo está más influido por la localización que por el volumen del hematoma.
La mayoría de los estudios que han evaluado el flujo lúteo, uteroplacentario o embriofetal no han encontrado asociación entre los parámetros Doppler y un mayor riesgo de aborto, por lo que se puede concluir que estudiar estas circulaciones con Doppler no tiene valor práctico ni predictivo12–14.
Aborto diferidoEl diagnóstico del aborto diferido puede realizarse en pacientes sintomáticas o asintomáticas.
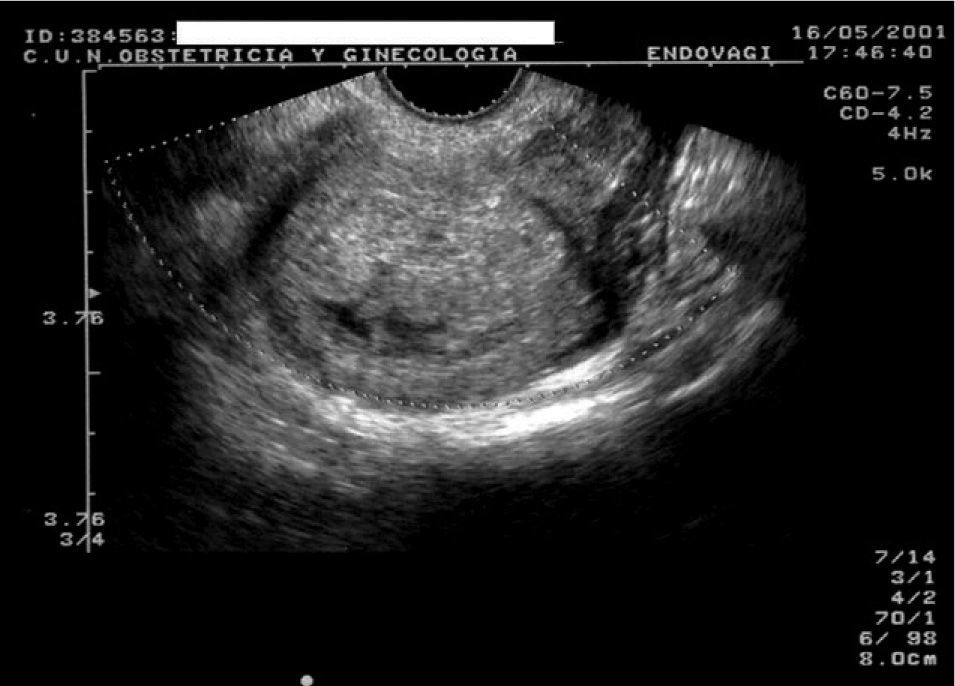
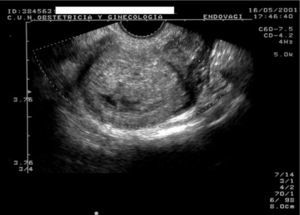
Pueden darse 2 circunstancias: que se vea el embrión o no. En el primer caso, el diagnóstico debe considerarse definitivo cuando no se identifica actividad cardíaca (fig. 2). Es conveniente mantener la exploración al menos 2 o 3 min para confirmar la muerte embrionaria o fetal. Asimismo conviene recordar que esto es aplicable en embriones de más de 5 mm.
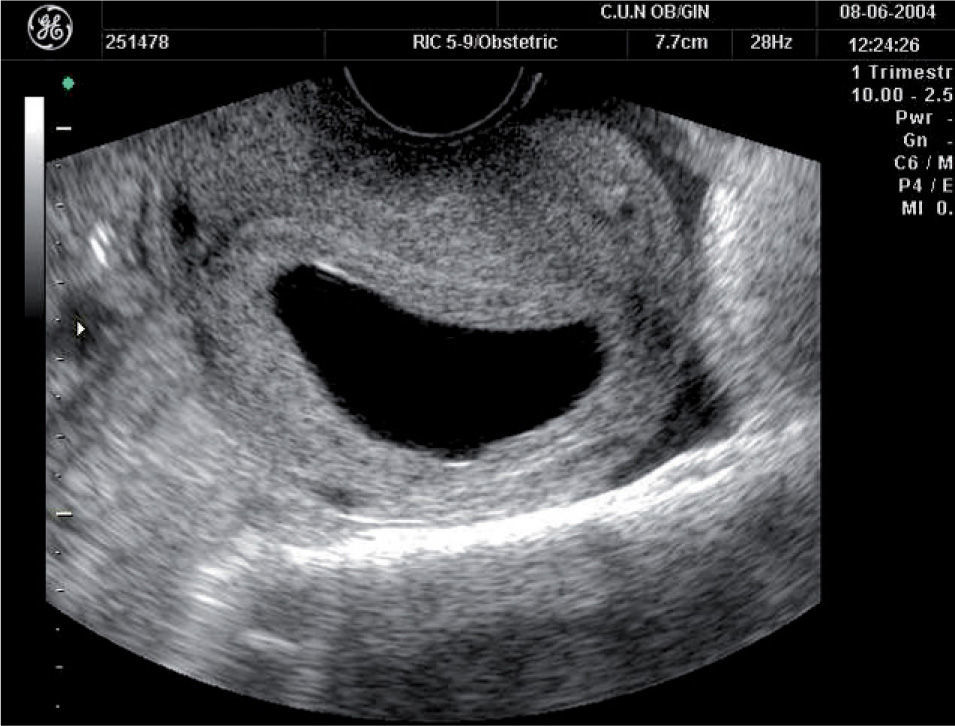
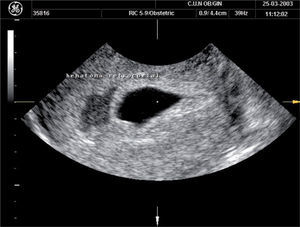
El diagnóstico de la gestación anembrionada o “huevo huero” puede hacerse con certeza cuando se visualiza un saco gestacional de más de 15 mm de diámetro promedio sin que se visualice un polo embrionario o un saco de 10 mm sin que se identifique vesícula vitelina (fig. 3).
El estudio Doppler del cuerpo lúteo y la circulación uteroplacentaria en estos casos, aunque interesantes desde el punto de vista fisiopatológico, son poco útiles desde el punto de vista práctico, ya que el diagnóstico definitivo lo proporciona la imagen bidimensional.
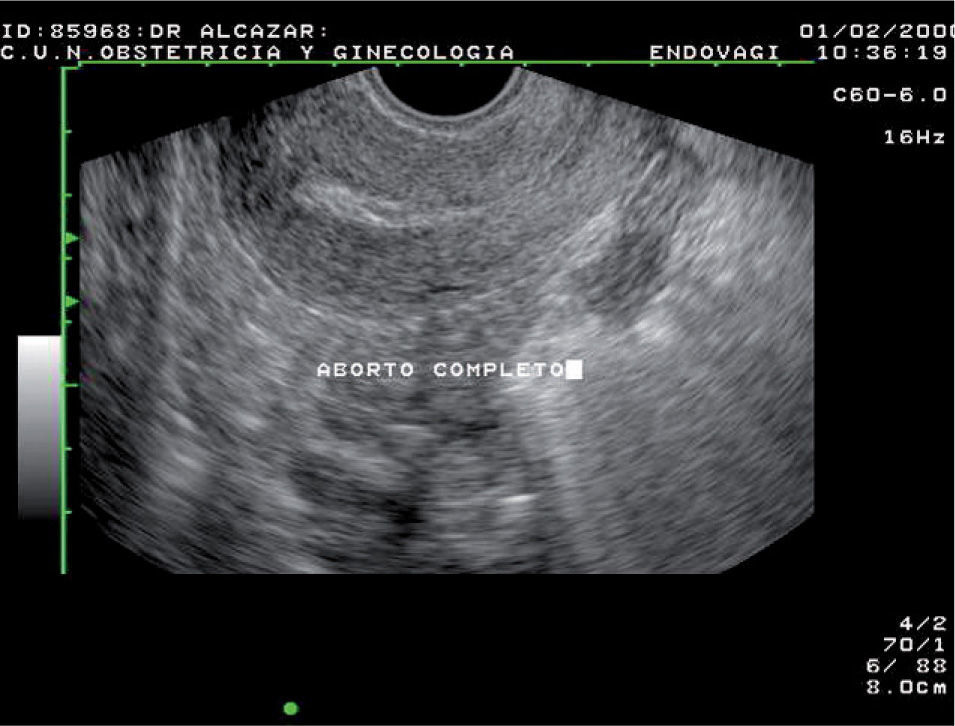
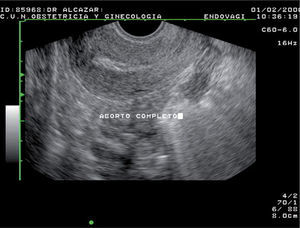
Aborto completo e incompletoProbablemente, uno de los problemas más difíciles con los que enfrenta en la clínica el ginecólogo es el diagnóstico diferencial entre el aborto completo y el aborto incompleto. Esta diferenciación es crucial, ya que en el primer caso la paciente no requiere intervención alguna, mientras que en el segundo habría que decir si se interviene o no y qué tipo de tratamiento puede ser el más idóneo para la paciente.
Cuando aún es posible identificar un saco intrauterino, aunque sea desestructurado y en el canal, el diagnóstico suele ser sencillo y hay que concluir que aún hay restos intracavitarios, es decir, se trata de un aborto incompleto.
Sin embargo, cuando no se identifica el saco intrauterino diferenciar entre si quedan restos trofoblásticos intracavitarios o no puede ser muy difícil.
No se han consensuado criterios definitivos para diferenciar una situación de otra mediante ecografía transvaginal.
Algunos autores han propuesto el espesor endometrial, definiendo un “útero vacío”, como aquél en el que el espesor endometrial es < 15 mm. Sin embargo, otros autores no encuentran útil o fiable este criterio. Sobre todo debido a una alta tasa de falsos positivos. Otros han propuesto la medición del área endometrial. Ningún otro grupo ha reproducido este criterio15,16.
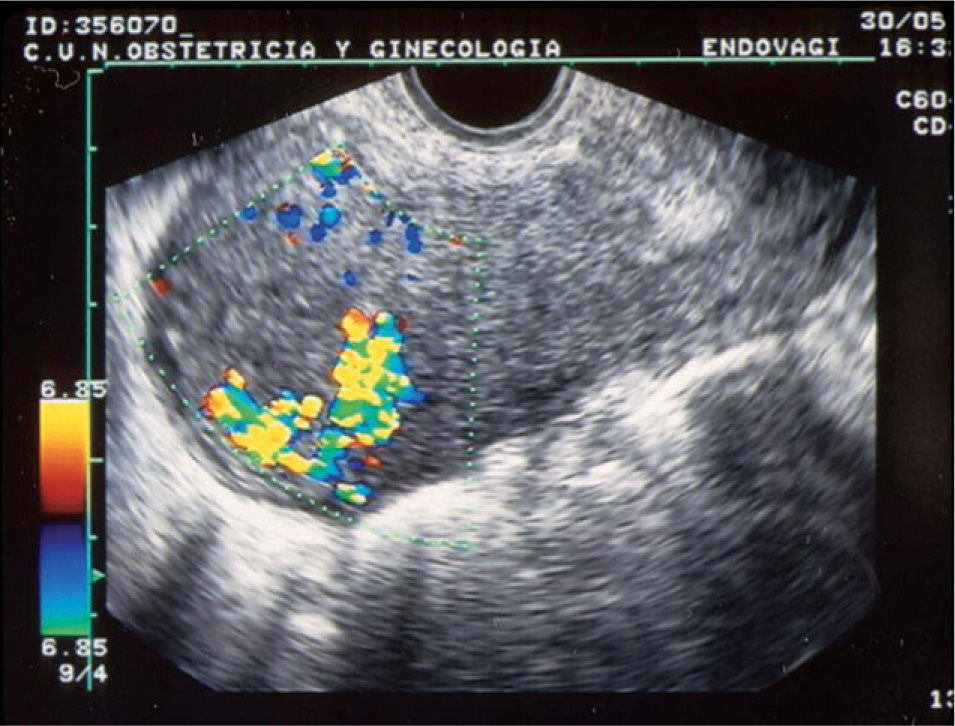
Un criterio que la mayoría de los autores ha analizado es la heterogeneidad del endometrio o contenido intracavitario. De manera que un endometrio heterogéneo suele considerarse como altamente sugestivo de restos retenidos (fig. 4), mientras que un endometrio homogéneo, más aún si es fino (< 5 mm) (fig. 5), prácticamente garantiza un útero vacío.
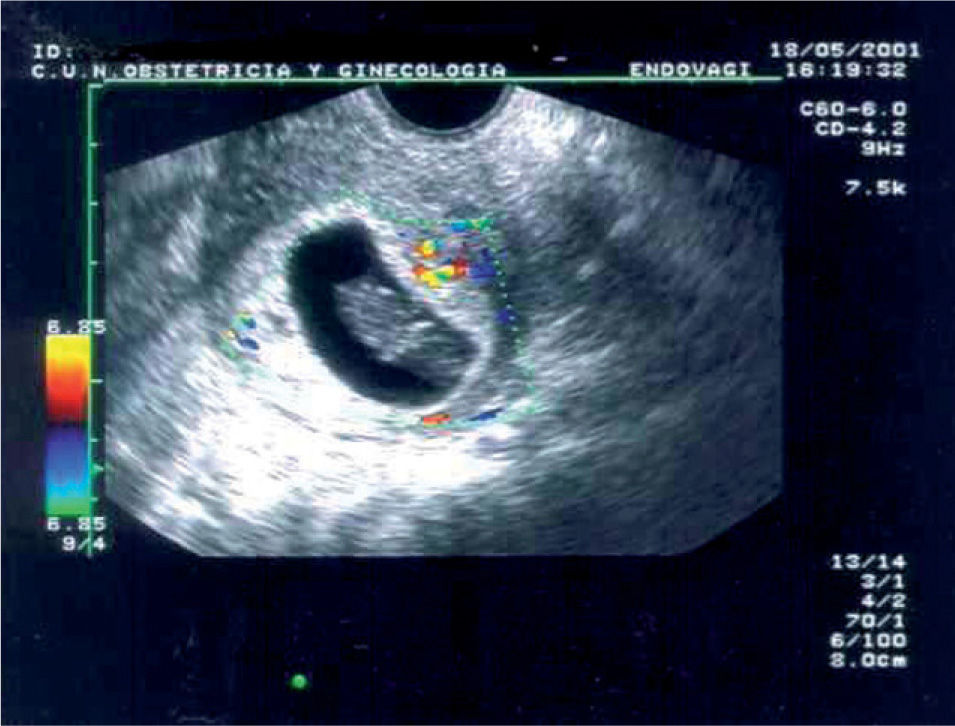
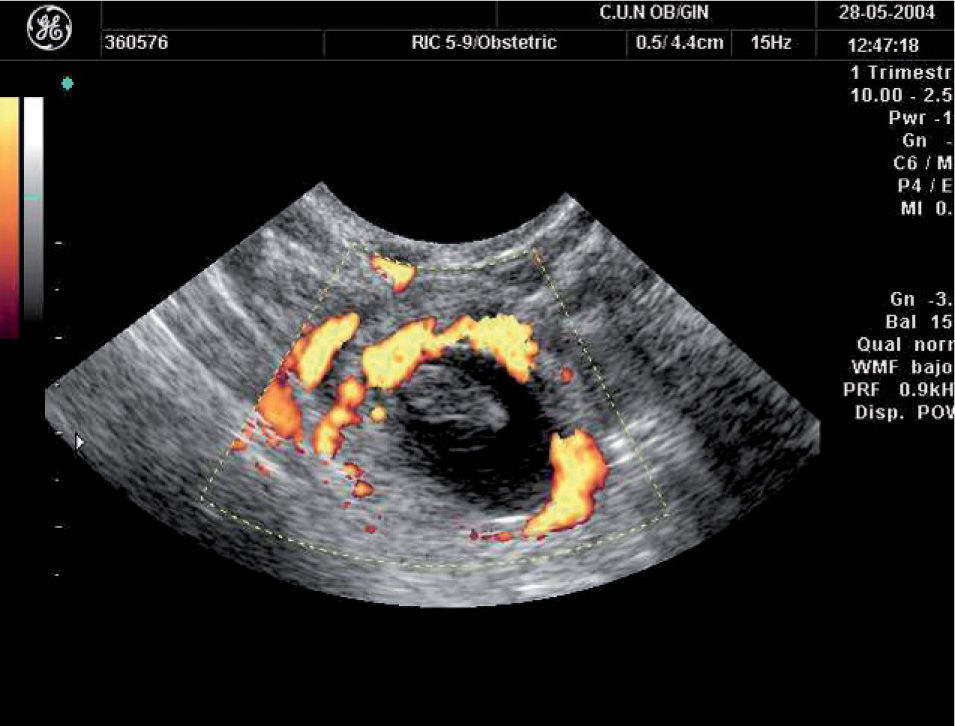
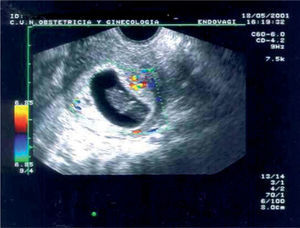
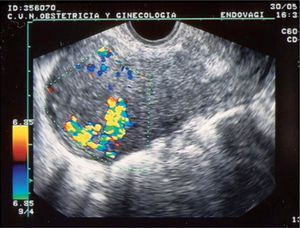
Sin embargo, el problema de los endometrios heterogéneos es que muchas veces la heterogeneidad no se produce por restos trofoblásticos sino por coágulos o restos deciduales. En estos casos se ha observado que el Doppler o la sonohisterografía puede contribuir a diferenciar los casos en que realmente quedan restos trofoblásticos adheridos a la decidua de los casos en que esto no sucede17,18. De modo que si se observa un foco de vascularización llamativa con ondas de velocidad de flujo con alta velocidad y baja resistencia (fig. 6) se encontrarán restos en más del 90% de los casos17.
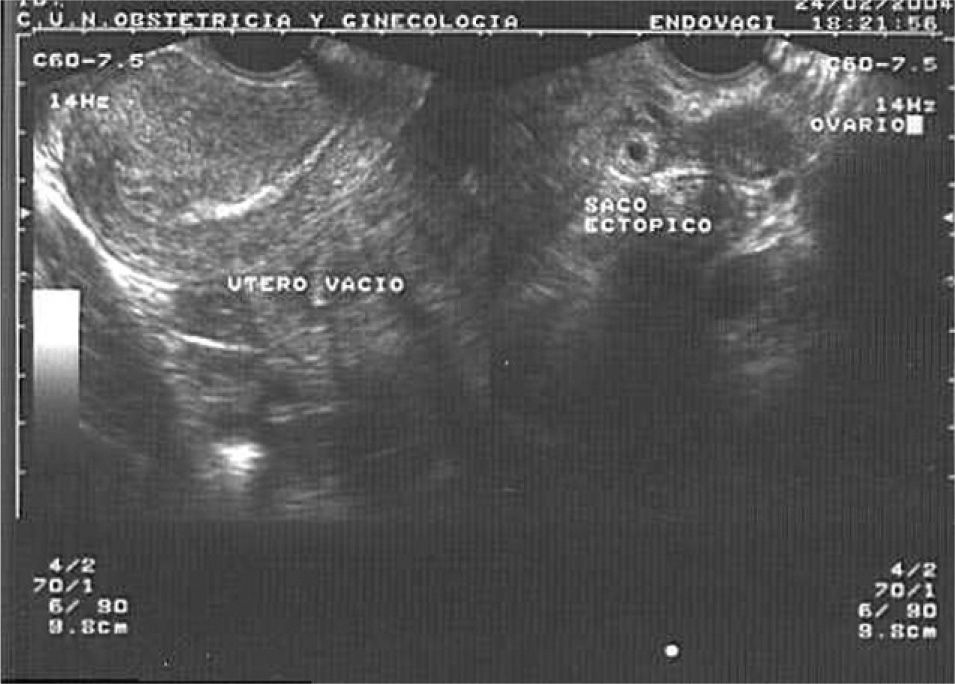
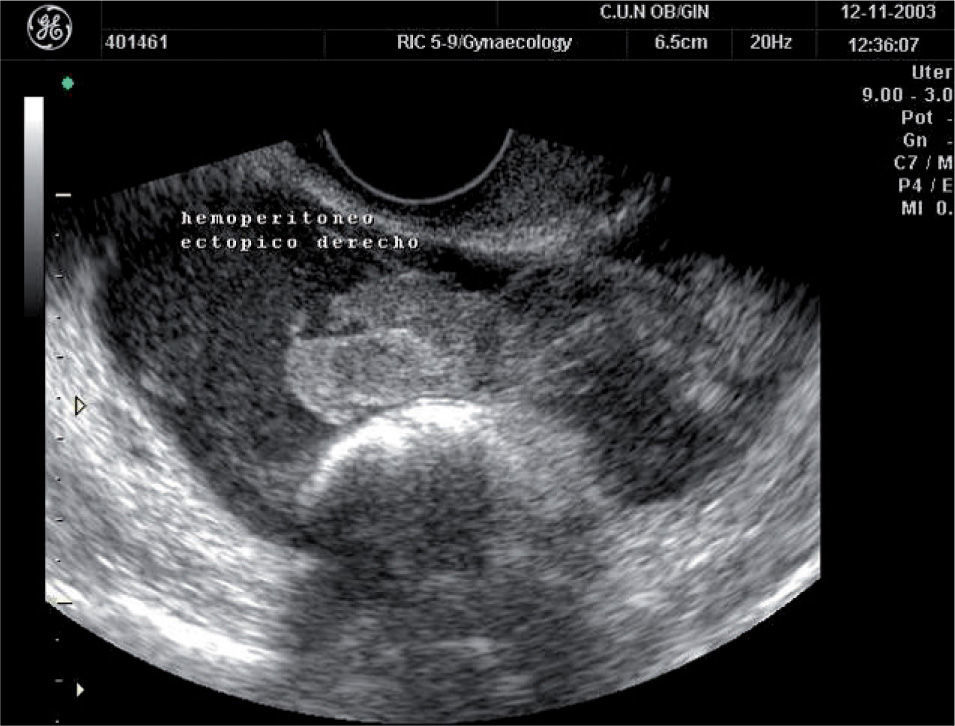
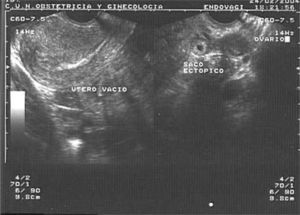
Embarazo ectópicoEl hallazgo 100% específico de una gestación ectópica es la visualización del saco gestacional con el embrión o la vesícula vitelina (fig. 7). Sin embargo, esto ocurre sólo en aproximadamente en un 25% de los casos3,5,8.
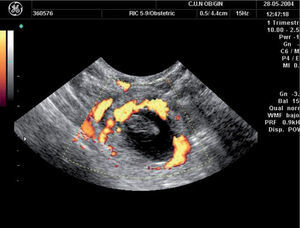
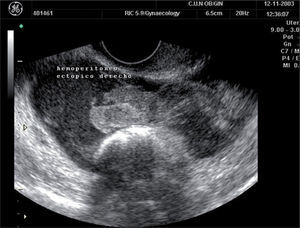
Otros hallazgos son el llamado “anillo tubárico” (fig. 8), una masa anexial (fig. 9) o líquido en el saco de Douglas3,5,8.
En una gestación de más de 6 semanas de amenorrea, el hallazgo de un útero vacío (sin saco visible) y una β-HCG sérica > 1.000 U/ml debe ponernos en alerta, ya que tiene un valor predictivo positivo ≥ 90% para gestación ectópica.
En ocasiones se identifica en el interior de la cavidad uterina lo que se denomina un seudosaco gestacional que corresponde a acumulaciones de fluidos intracavitarios, pero no un verdadero saco gestacional; cuando éste está presente suele verse el signo del “doble anillo decidual” que, además, suele ser de localización excéntrica en la cavidad, a diferencia del seudosaco, que suele ser de localización central.
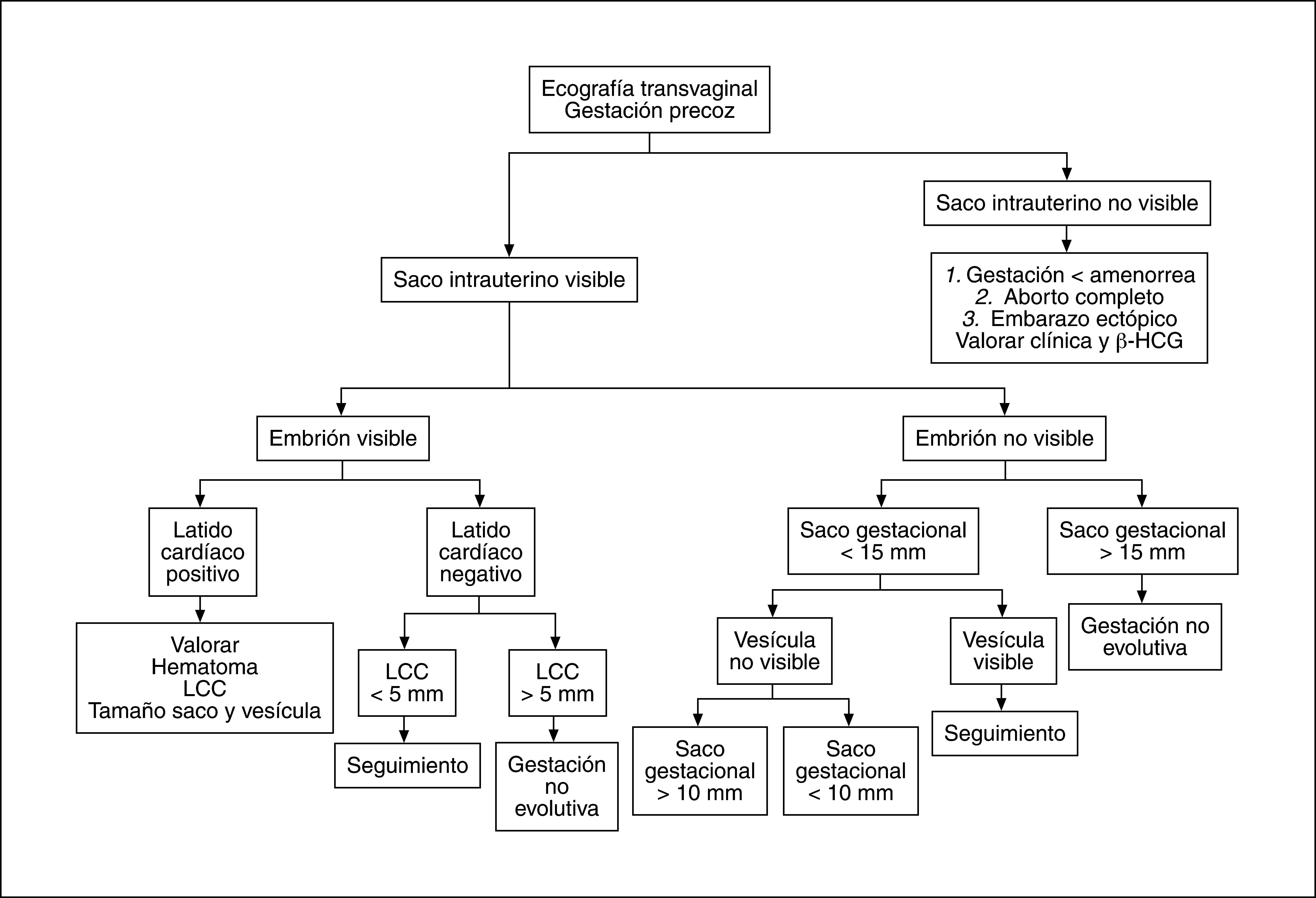
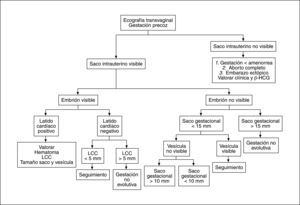
CONCLUSIÓNComo conclusión, podría proponerse el algoritmo presentado en la figura 10 para la valoración ecográfica de la gestación precoz patológica.
Departamento de Obstetricia y Ginecología. Clínica Universitaria de Navarra. Universidad de Navarra. Pamplona. Navarra. España.