En los últimos años se han producido avances muy importantes en el manejo de los tumores ginecológicos, tanto en el diagnóstico, como en los posibles tratamientos, ya sean médicos o quirúrgicos. El diagnóstico precoz de los procesos tumorales es el factor más importante para mejorar el pronóstico de las pacientes y permitirnos el uso de estrategias de tratamiento menos agresivas, que mejoran no solo la supervivencia sino la calidad de vida de aquellas. La incorporación de la PET en la oncología permite la evaluación de parámetros biológicos y fisiológicos como complemento a las técnicas de imágenes convencionales como la TC o la RM y permite diferenciar lesiones benignas de malignas, estadificar los procesos neoplásicos con un solo estudio, detectar y localizar recurrencias (difíciles de diferenciar de procesos cicatriciales poscirugía o posradioterapia con técnicas convencionales) así como monitorizar los efectos del tratamiento. Aunque la aplicabilidad clínica parece clara y el uso de la PET (y de equipos híbridos como la PET-TC) se está generalizando por el acceso al entorno hospitalario de un equipamiento altamente sofisticado, debe tenerse en cuenta el impacto final en términos de coste-eficacia para su uso generalizado. La siguiente revisión pretende aportar una visión actual del uso de la PET y la PET-TC en la ginecología oncológica con las últimas indicaciones y proyecciones de futuro.
In recent years, major advances have been made in the management of gynecological tumors, both in diagnosis and possible treatments, whether medical or surgical. Early diagnosis of the tumor is the most important factor to improve patient prognosis and allows the use of less aggressive treatment strategies that may increase both survival and quality of life in these patients. The incorporation of PET in oncology allows evaluation of biological and physiological parameters to supplement conventional imaging techniques such as CT or MR and helps to better differentiate benign from malignant lesions, stage tumors in a single study, detect and locate recurrences (difficult to distinguish from scarring processes after-surgery or radiotherapy with conventional techniques) and to monitor treatment effects. Although the clinical applicability seems clear and the use of PET (and hybrid equipment such as PET/CT) is becoming widespread due to access to highly sophisticated equipment in hospitals, the final impact in terms of cost-effectiveness needs to be considered. The following review aims to provide a current overview of the use of PET and PET-CT in gynecological oncology and discusses the latest indications and future prospects.
Los tumores del tracto genital inferior femenino son los terceros en incidencia en las mujeres españolas1. Las técnicas de imagen, cada vez más precisas en la descripción/extensión del proceso neoplásico, se han convertido en una herramienta indispensable para la correcta valoración de la enfermedad al permitir una mejor evaluación de la enfermedad y, consecuentemente, optimizar la planificación terapéutica. Así, las técnicas de diagnóstico por la imagen han permitido individualizar los tratamientos ofrecidos a las pacientes con cáncer ginecológico y hoy en día forman parte de las exploraciones rutinarias solicitadas en el diagnóstico, estadificación y manejo de estas pacientes. Por ello no es de extrañar que su demanda en pacientes con cáncer ginecológico se haya visto notablemente incrementada en los últimos tiempos en los países desarrollados.
Las técnicas de imagen anatómicas de alta resolución como la tomografía computarizada (TC) y la resonancia magnética (RM) son de uso habitual para la toma de decisiones en el manejo de estas neoplasias. Sin embargo, a pesar de su uso generalizado, estas técnicas de imagen convencionales pueden dar lugar a falsos negativos debido a su incapacidad para detectar lesiones de pequeño volumen (diámetro < 1cm) y de falsos positivos debido a su incapacidad para distinguir entre masas tumorales viables y masas necróticas o cicatriciales postratamiento. Las nuevas técnicas funcionales como la tomografía por emisión de positrones (PET) presentan una mayor precisión diagnóstica por lo que cada vez son más empleadas en oncología2. La PET utiliza un trazador radioactivo emisor de positrones, siendo el más utilizado la 18F-fluordesoxiglucosa (FDG), que evalúa el consumo de glucosa de los diferentes tejidos. En comparación con las técnicas de imagen estructurales, la PET con FDG presenta una mayor exactitud diagnóstica, y permite una mejor estadificación, monitorización de la respuesta al tratamiento y detección de enfermedad recurrente.
En el caso particular de los tumores ginecológicos, numerosos trabajos muestran el gran impacto clínico de esta técnica. La PET ha sido especialmente estudiada en pacientes con cáncer de cuello uterino y de ovario y, en menor medida, se ha demostrado su utilidad en cáncer de endometrio, sarcomas uterinos, cáncer de vulva y vagina. El informe anual de la Comisión Nacional de Oncología PET Registro de EE. UU. (NOPR) 2008 indicó que de los 81.951 estudios PET llevados a término en 1.368 instalaciones en Estados Unidos, 8.362 estudios (10,2%) se habían realizado en tumores ginecológicos, incluyendo 4.509 estudios sobre el cáncer de ovario (53,9%), 2.869 en el cáncer de endometrio y 984 sobre el cáncer de cuello uterino3. Estos trabajos muestran como la estrategia terapéutica se modificó en el 38% de los casos a partir de los resultados de PET, lo que indica la importancia de la PET en el diagnóstico y el tratamiento de estos tumores.
El objetivo de esta revisión es reunir la evidencia científica disponible sobre la utilidad de esta técnica en los tumores ginecológicos, tanto en su diagnóstico inicial como en su seguimiento, y las indicaciones clínicas para su uso en la práctica asistencial.
Características actuales de la tomografía por emisión de positrones con 18F-fluordesoxiglucosa y equipos híbridosEl uso de la PET-TC con FDG (PET/FDG) se basa en el comportamiento hipermetabólico de las células tumorales, que incorporan este trazador y lo retienen, permitiendo la identificación de las lesiones metabólicamente activas, ya sea por el aumento de la vascularización, el mayor consumo de glucosa ya sea por la diferente celularidad, independientemente de sus características morfológicas4.
Los tumores malignos ginecológicos se caracterizan típicamente por el aumento de metabolismo de la glucosa y por lo tanto se presentan con un aumento de la captación de FDG respecto al tejido sano, mientras que los tumores benignos no captan y son por lo general negativos en la PET5.
Existen varios métodos para medir la cantidad de FDG acumulada en los tumores. Habitualmente para conocer el grado de captación de una lesión se utiliza el standarized uptake value (SUV), que se calcula teniendo en cuenta la dosis de 18F-FDG administrada al paciente y sus características biométricas. Podemos calcular el valor máximo, mínimo, medio… del SUV. Diferentes estudios han evaluado el papel de cada uno de estos valores, siendo el valor máximo o SUVmax el valor más utilizado en la práctica clínica. Se ha intentado establecer un valor fijo de SUVmax que actúe como un dintel a partir del cual se pueda catalogar una lesión como maligna. Sin embargo, considerar de forma general un valor único de SUVmax en el diagnóstico (benigno vs. maligno) de las lesiones presenta problemas debidos a los resultados falsamente positivos o negativos. Los falsos positivos se deben en general a la capacidad de captación de FDG que poseen las lesiones inflamatorias y la enfermedad granulomatosa. Los falsos negativos derivan principalmente de las lesiones de pequeño tamaño, que pueden parecer poco metabólicas de forma global pero no lo son si se considera la captación en función de su reducido tamaño. Como alternativa a esta unidad de medida metabólica, en los 2 últimos años han aparecido nuevas unidades para medir el metabolismo como son la o el metabolic tumour value (MTV), que son parámetros más precisos ya que tienen en cuenta el volumen de la enfermedad y la heterogeneicidad de las lesiones. La utilización de estos nuevos parámetros nos permite obtener información de la agresividad de una lesión detectada mediante la PET6–8. La utilización del la PET/FDG en la práctica clínica ha abierto nuevas perspectivas en la oncología ginecológica. Sin embargo, actualmente todavía queda pendiente determinar qué papel puede jugar la PET/FDG en la estadificación de la enfermedad y el manejo de estas pacientes, ya sea en la planificación de un seguimiento más estricto o en la valoración de un tratamiento más agresivo en las pacientes con mayor carga tumoral.
La principal característica de un estudio PET es su elevada sensibilidad para la detección de enfermedad hipermetabólica. Como se ha comentado anteriormente, esta actividad no es exclusivamente tumoral, sino que también pueden mostrar un aumento del metabolismo glucídido en las enfermedades infecciosas y algunas enfermedades benignas como las granulomatosas o algunas enfermedades inflamatorias9. En la enfermedad ginecológica debe tenerse en cuenta la elevada captación fisiológica de FDG en los ovarios y en el endometrio, que fluctúa a lo largo del ciclo menstrual10. Por ello es esencial realizar una correcta anamnesis que nos permita conocer, entre otros datos, la fecha de última regla y las enfermedades inflamatorias asociadas de la paciente. Otras captaciones de trazador que deben tenerse en cuenta para interpretar un estudio PET son la captación por la musculatura lisa intestinal, la musculatura estriada, así como la eliminación urinaria a través de riñones y uréteres, que a menudo interfieren en la interpretación de las lesiones en la región pelviana11. Parte de estas limitaciones se han solventado con la aparición de los equipos híbridos, que añaden al tomógrafo PET un detector TC que permite obtener una imagen fusionada con información metabólica (PET) y morfológica (TC) en un solo estudio de mayor precisión diagnóstica12,13. Actualmente, en nuestro medio, solo existen equipos híbridos PET-TC. Los equipos híbridos en el cáncer de cuello uterino (CCU) han permitido incrementar la exactitud en la valoración de la neoplasia del 78-80 al 92-93% al añadir la fusión con el estudio anatómico de la TC. Recientemente se han desarrollado también los equipos híbridos PET-RM. Los estudios referentes a la aportación clínica de estos equipos son todavía escasos pero los resultados ya apuntan a que van a permitir dar un nuevo paso en el diagnóstico y caracterización de las masas anexiales y uterinas al poder sumar las ventajas de la PET con la RM14.
Tomografía por emisión de positrones con 18F-fluordesoxiglucosa/tomografía computarizada en cáncer de ovarioEl cáncer de ovario es la segunda neoplasia del aparato genital femenino en frecuencia, tras el cáncer de endometrio. Sin embargo es la principal causa de mortalidad por cáncer ginecológico. En España se diagnostican unos 3.300 casos de cáncer de ovario al año, lo que supone el 5% del total de los tumores en la mujer. La incidencia ha ido aumentando lentamente desde los años 60.
Se diferencian 3 tipos de cáncer de ovario en función del tejido celular en el que se origina el cáncer: carcinoma epitelial, tumores de células germinales y tumores del estroma.
El carcinoma epitelial es el más común: llega a representar entre el 70 y el 90% de todos los tumores ováricos. Los cánceres de ovario que se originan en las células germinales o en las células del estroma son muy poco frecuentes. Dentro de la estirpe epitelial se distinguen diferentes histologías: los carcinomas serosos, mucinosos, endometrioides, de células claras y de células transicionales, así como los tumores mixtos epiteliales-estromales con componente epitelial maligno (adenofibroma maligno) y los infrecuentes carcinomas indiferenciados de célula pequeña y neuroendocrinos.
La elevada mortalidad del cáncer de ovario se explica por 2 razones: 1) la ausencia de síntomas específicos al inicio, lo que motiva que la mayoría de pacientes se presenten con enfermedad diseminada al diagnóstico; y 2) la ausencia de métodos de detección precoz que sean eficaces y estén validados.
Por ello en los últimos años se están realizando grandes esfuerzos para conseguir que el diagnóstico del cáncer de ovario sea en estadios más tempranos. Además de un diagnóstico precoz, es fundamental la estadificación de la neoplasia, pues ello condicionará el enfoque terapéutico.
Diagnóstico inicial de la tumoración ováricaLos trabajos realizados para valorar la caracterización de masas anexiales mediante la PET presentan resultados contradictorios15,16. Algunos muestran resultados satisfactorios en la diferenciación entre lesiones borderline y lesiones malignas, con una exactitud diagnóstica del 81%, pero fallan en la discriminación entre las primeras y las tumoraciones benignas16. Por el contrario, otros estudios muestran un correcta diferenciación de lesiones benignas y lesiones borderline o malignas, pero no entre estas 2 últimas15. Esta disparidad de resultados se explica por el bajo grado de captación de FDG de algunas estirpes tumorales como la mucinosa o el tumor de células claras, cuyo espectro de actividad entra en el de las lesiones borderline o, incluso, en el de las lesiones benignas.
Por ello, podemos concluir que la PET no es la herramienta de elección para caracterizar masas anexiales y no aporta ventajas a las técnicas de imagen rutinariamente utilizadas, como sería la ecografía transvaginal o la RMN.
Estadificación tumoral y ganglionar inicialEn el cáncer epitelial de ovario la estadificación ganglionar es quirúrgica. Se realiza mediante linfadenectomía (pelviana y paraaórtica). Los estudios realizados hasta el momento no han conseguido cifras de sensibilidad suficientemente elevadas que permitan plantearse la sustitución de la estadificación quirúrgica por la PET-TC, pese al elevado valor predictivo negativo de esta técnica, del 96,5%17.
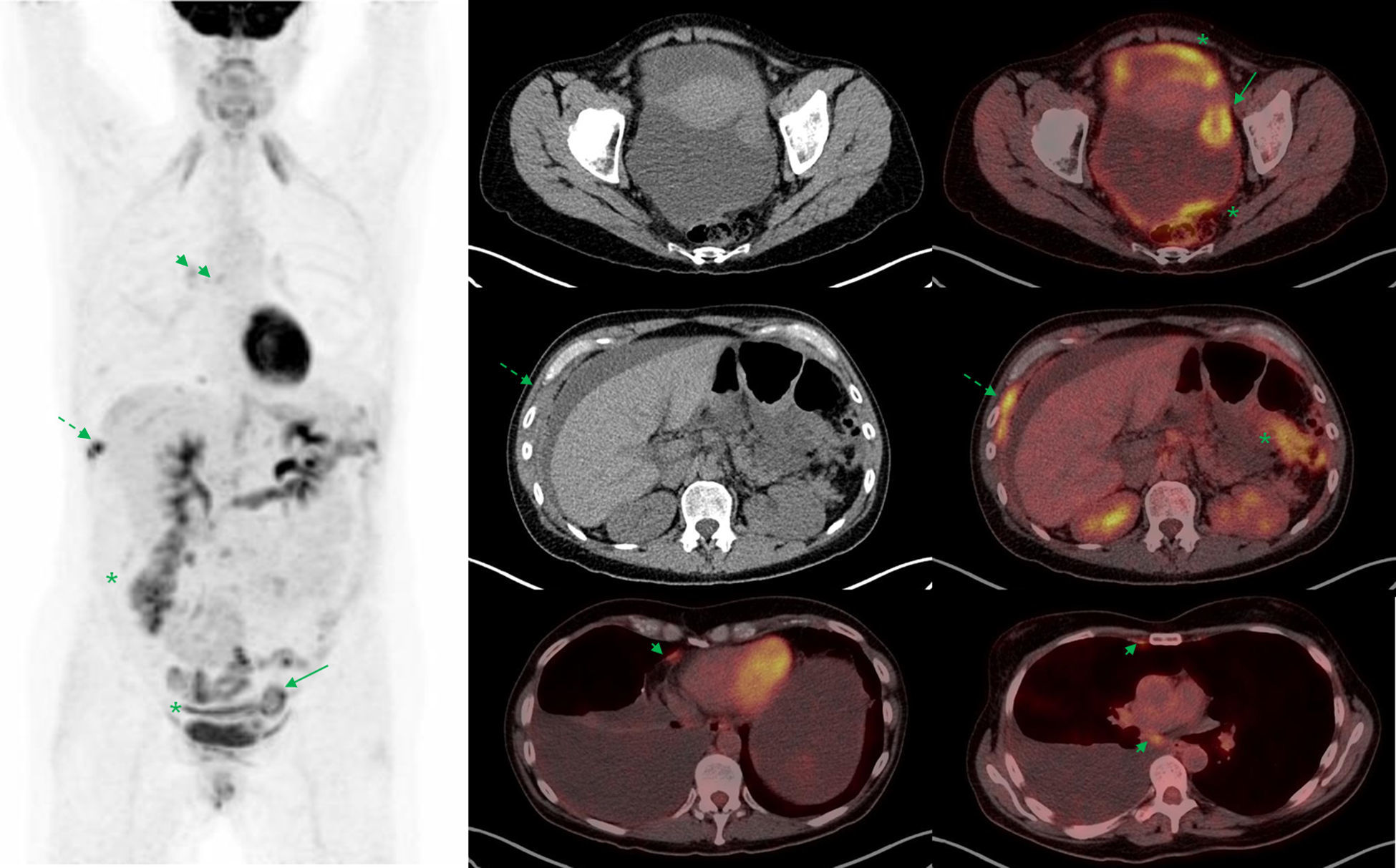
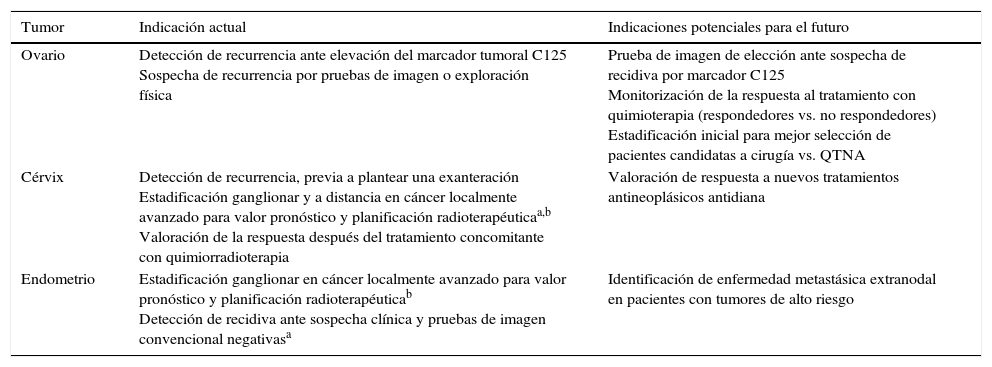
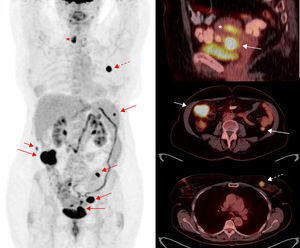
En el cáncer epitelial de ovario avanzado surge la necesidad de seleccionar a las pacientes con estadios más avanzados (IIIc y IV), que presentan enfermedad más allá de la cavidad abdominal. La detección mediante técnicas de imagen de lesiones extraabdominales condiciona un importante cambio de estrategia terapéutica, puesto que estas pacientes dejan de ser candidatas a una cirugía primaria como primera opción terapéutica y son candidatas a quimioterapia neoadyuvante. En la práctica habitual, la estadificación prequirúrgica se realiza mediante TC, presenta una elevada eficacia en la detección de carcinomatosis peritoneal, especialmente en las lesiones inferiores a 5mm o con diseminación miliar y en los implantes y nódulos mesentéricos18. En comparación con la TC, el estudio mediante PET-TC permite identificar con una sensibilidad similar las lesiones intraabdominales pero mejora la detección de lesiones extraabdominales (fig. 1), que suponen un cambio en el estadio de la enfermedad, y la convierten en un estadio iv19. Queda por determinar si este aumento en el estadio y la posible modificación del abordaje terapéutico en estos casos tiene impacto en la supervivencia global de las pacientes.
Estadificación pretratamiento de cáncer de ovario. Paciente de 48 años con diagnóstico por TC de carcinomatosis peritoneal de origen ovárico o carcinoma primario peritoneal. Se realiza PET-TC de estadificación previamente al tratamiento. La imagen de cuerpo entero de PET (izquierda) muestra captación aumentada de FDG en una masa ovárica izquierda (flecha) e implantes peritoneales (asterisco) pelvianos (derecha, arriba) y en colon ascendente (centro). En la región torácica, se visualizan implantes pleurales derechos (centro; flecha discontinua) y en adenopatías cardiofrénicas y mediastínicas (derecha, abajo; punta de flecha), que contraindican la cirugía citorreductora como tratamiento primario.
Otra técnica de imagen que está en alza es la RM con secuencias de difusión (RM-DWI). Esta presenta una elevada sensibilidad similar a la de la PET-TC para la detección de lesiones a distancia20.
Un valor añadido de la PET-TC en la estadificación es el valor pronóstico basado en el grado de captación de las lesiones. En la actualidad, este grado de captación se mide mediante el SUVmax, y se correlaciona con el estadio y el subtipo histológico21,22, lo que implica un valor pronóstico añadido. Por otro lado, se ha observado que el índice de captación establecido entre las lesiones supra- e infradiafragmáticas es predictor de recurrencia23. Sin embargo, no existe evidencia de que este sea un factor pronóstico independiente, como lo es la cirugía primaria. En cambio, las nuevas unidades de medida de la actividad metabólica sí que han demostrado correlación inversa con la supervivencia libre de progresión (progression free survival [PFS]), tanto el MTV8 como la total lesion glycolysis24.
Seguimiento y detección de recurrenciaEl seguimiento del cáncer de ovario ya tratado incluye la exploración física, la determinación de marcadores tumorales y el control mediante pruebas de imagen no invasivas. Entre ellas, la TC es probablemente la técnica más utilizada en la rutina asistencial.
La PET tiene un papel bien definido en la detección de recurrencia: ya sea cuando existe sospecha clínica, analítica o por pruebas de imagen, pero no como herramienta rutinaria de seguimiento en pacientes asintomáticas.
La serie más larga recogida en un mismo centro incluye a 152 pacientes25, en ella la PET-TC tiene una sensibilidad global para la detección de recurrencia del 98%, si bien esta disminuye al 91% en las pacientes asintomáticas. Por ello, se recomienda realizar una PET-TC solo cuando exista sospecha clínica, elevación de marcadores tumorales (CA125>30 U/mL) o se hayan realizado otras pruebas de imagen que no hayan resultado concluyentes26.
En la detección de recurrencia mediante la PET-TC la estirpe histológica del tumor es un factor determinante. En tumores mucinosos, tumores de la granulosa o borderline, de menor actividad metabólica, la sensibilidad de la PET-TC es baja, por lo que un estudio PET-TC negativo no puede interpretarse como ausencia de recidiva tumoral. Pese a todo ello, algunos trabajos reportan una elevada capacidad diagnóstica27, con una sensibilidad y especificidad del 88,6 y 90%, respectivamente28, incluso en pacientes con marcadores tumorales inferiores a 30 U/mL29.
Sin embargo, las histologías más frecuentes son el carcinoma seroso-papilar y el adenocarcinoma endometrioide, ambos con marcada avidez por la FDG. Cuando la recidiva tumoral se presenta en forma de una masa sólida de tamaño superior al centímetro va a ser fácilmente identificada por todas las técnicas de imagen morfológicas y funcionales. El problema clínico se plantea ante las lesiones de carcinomatosis peritoneal inferiores a 5mm, donde la PET-TC presenta mayor número de falsos negativos. En esta situación, la RM ha mostrado una elevada sensibilidad, superior a la TC y a la PET-TC30. En la detección de recidiva ganglionar, la PET-TC presenta una mayor capacidad de detección en comparación con las otras técnicas de imagen debido a que es capaz de detectar adenopatías patológicas de pequeño tamaño y, por lo tanto, sin criterios morfológicos para ser consideradas tumorales. La valoración multimodalidad de la enfermedad es la estrategia óptima para la detección de recidiva, no obstante, en términos de coste-efectividad la exploración que mejor exactitud diagnóstica aporta parece ser la PET/FDG con TC diagnóstica31,32, en la que se van a tener en consideración los criterios morfológicos y los metabólicos28,30,33. La incorporación de la PET al estudio TC ha tenido un importante impacto clínico. La PET-TC ha implicado un cambio de manejo en hasta un tercio de las pacientes evaluadas por sospecha de recidiva del cáncer de ovario33, y de forma global, ha supuesto un cambio de manejo terapéutico en la mitad de las pacientes, con elevada correlación con los hallazgos quirúrgicos34.
Por lo tanto, la introducción de la PET-TC en los algoritmos de seguimiento permite mejorar el diagnóstico de la recurrencia y seleccionar el tratamiento más adecuado para cada paciente, evitando así cirugías innecesarias35.
Valoración de respuestaLa PET y la PET-TC se han utilizado como herramientas de valoración de respuesta al tratamiento de quimioterapia adyuvante que se realiza tras la cirugía de citorreducción36,37. El estudio PET-TC en esta situación clínica presenta un elevado valor predictivo positivo, cercano al 90%36. Además, puesto que existen sólidas evidencias que muestran persistencia de enfermedad, se asocian a menor supervivencia libre de enfermedad (disease free survival [DFS]), la PET-TC permite identificar a las pacientes con mayor probabilidad de recurrencia. Por todo ello, se ha propuesto como alternativa no invasiva a la cirugía de second-look.
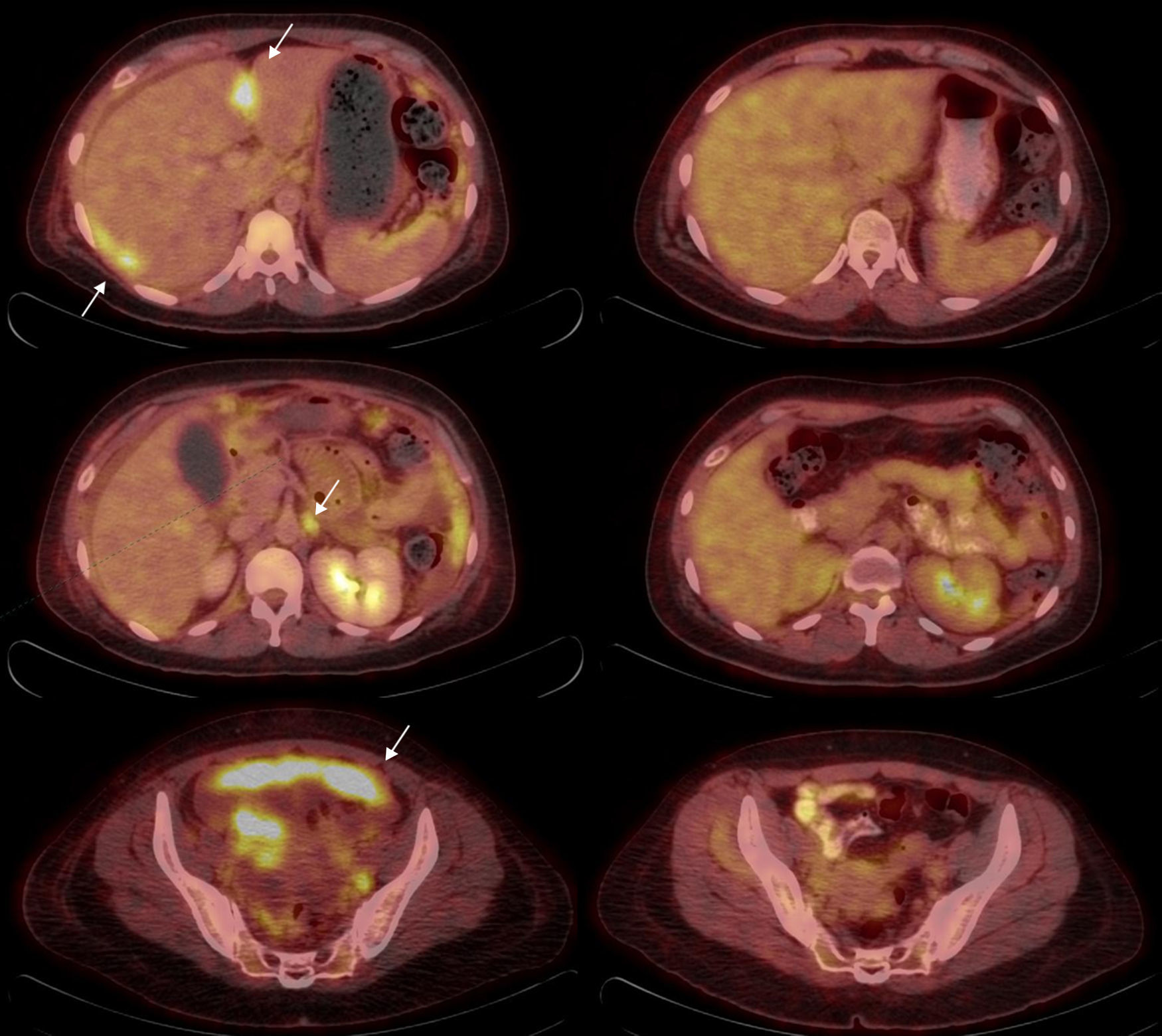
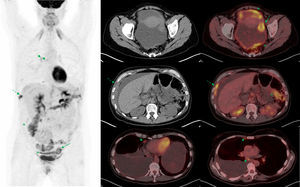
En el momento actual, en el que la quimioterapia en el cáncer de ovario tiene un papel cada vez más relevante, la PET-TC se utiliza también como herramienta de monitorización de respuesta a quimioterapia neoadyuvante. Ya sea en la valoración de la respuesta durante el tratamiento (al final del primer ciclo38 o del tercero38,39), ya sea en la valoración al final de tratamiento sistémico40. Los diferentes trabajos realizados en este sentido ponen en evidencia la capacidad de la PET-TC para diferenciar 2 poblaciones de pacientes: respondedoras y no respondedoras, con diferencias significativas en la supervivencia global38,40. Pese a tratarse de series cortas, los resultados son prometedores y apuntan hacia la PET-TC como herramienta preferente de monitorización de respuesta al tratamiento sistémico (fig. 2).
Valoración de respuesta al tratamiento en cáncer de ovario. Paciente de 38 años diagnosticada de carcinoma serosopapilar de ovario. Se realizó PET-TC basal (izquierda) y tras 3 ciclos de tratamiento de quimioterapia para valoración de respuesta (derecha). Las imágenes de fusión PET-TC muestran desaparición de los implantes peritoneales perihepáticos (arriba), pelvianos (abajo) y normalización del metabolismo en una adenopatía paraórtica izquierda (centro).
Como alternativa de futuro, existen otros trazadores PET capaces de valorar la respuesta al tratamiento de una forma más precisa. La fluortimidina (18F-FLT) es un marcador de proliferación celular que permite valorar la respuesta precoz a la quimioterapia, de forma que preceda a los cambios morfológicos de disminución del tamaño del tumor41.
Tomografía por emisión de positrones con 18F-fluordesoxiglucosa/tomografía computarizada en cáncer de cuello uterinoEl CCU es la tercera causa de muerte por cáncer entre las mujeres de todo el mundo. Su incidencia varía entre 1 y 50 casos por cada 100.000 mujeres, siendo más alta en los países en vías de desarrollo. El 60% de los casos incidentes serán mujeres que van a morir debido a un diagnóstico tardío. En España el cáncer de cérvix ocupa el sexto lugar tras el de mama, colorrectal, estómago, endometrio y ovario. Más del 80% de estos cánceres son carcinomas escamosos que se han desarrollado a partir de lesiones precursoras de intraepiteliales. La detección de lesiones precursoras a través de la citología cervicovaginal ha permitido reducir considerablemente la incidencia y mortalidad por este cáncer en los países con cribado poblacional.
El pronóstico del CCU depende en parte del estadio en el que se diagnostica el CCU. De acuerdo con la Federación Internacional de Ginecología y Obstetricia (FIGO) el CCU se estadifica a partir de parámetros clínicos sin tener en cuenta la existencia de enfermedad ganglionar42. Sin embargo existe fuerte evidencia de que la invasión metastásica de los ganglios linfáticos es un factor de mal pronóstico independiente, así como también la presencia de metástasis a distancia43–45. Una correcta estadificación y evaluación de los factores pronósticos es crucial para poder ofrecer el tratamiento y seguimiento óptimo a estas pacientes.
Estadificación tumoral y ganglionar inicialEn la valoración inicial del CCU, las técnicas de imagen son herramientas de gran utilidad clínica. La RM ofrece una detallada valoración de la tumoración primaria: tanto de su volumen tumoral como de la detección de invasión parametrial46,47. La PET/FDG permite la detección de afectación ganglionar con una elevada sensibilidad y especificidad (del 100 y del 99,6%, respectivamente), cuando el tamaño ganglionar supera los 5 mm48. Sin embargo las técnicas de imagen también presentan importantes limitaciones. La PET-TC raramente detecta infiltración micrometastásica, cuya óptima evaluación se realiza mediante la técnica de detección del ganglio centinela49. Algunos autores proponen el uso de PET-TC utilizando como imagen anatómica de fusión una TC diagnóstica realizada con contraste intravenoso. De esta manera se consigue una mayor especificidad y exactitud diagnóstica (86,7 y 77,5%, respectivamente), pero no mejora la sensibilidad para la detección de infiltración microscópica ganglionar (50%)50,51.
Pese al limitado número existente de estudios, la capacidad diagnóstica de la PET-TC parece ser superior a la de otras técnicas de imagen. En un metaanálisis que incluye 41 estudios, Choi52 muestra que la sensibilidad de la PET para la detección de infiltración ganglionar es superior a la de la TC y la RM y que además presenta mejor especificidad que la TC. Sin embargo, es necesaria una mayor evidencia científica para avalar el uso rutinario de la PET-TC en el CCU.
Las ventajas de la utilización de la PET en estadificación se centra básicamente en 3 puntos: 1) la detección de metástasis a distancia, 2) la valoración global de la enfermedad, permitiendo optimizar el tratamiento y reducir la morbilidad asociada a la suma de tratamientos inadecuados y 3) la aportación de información pronóstica.
En la planificación terapéutica del CCU, el conocimiento del estado ganglionar es fundamental. Los CCU en estadios precoces se tratan mediante la cirugía de la neoplasia, mientras que en estadios avanzados el tratamiento es la quimiorradioterapia, y la cirugía que se realiza es la linfadenectomía como parte del estudio de la extensión de la enfermedad. La incorrecta estadificación pretratamiento puede comportar un abordaje inicial quirúrgico subóptimo, que obligue a añadir tras la cirugía un tratamiento de quimiorradioterapia, sumando la morbilidad de ambas modalidades terapéuticas. Este hecho comporta además un retraso del inicio tratamiento de elección de estas pacientes. La introducción de un estudio PET-TC en la estadificación prequirúrgica permite reducir el número de pacientes que van a recibir más de un tratamiento del 30 al 12,5%, lo que significa que más del 87% de las pacientes pueden evitar los efectos colaterales de la suma de tratamientos subóptimos53.
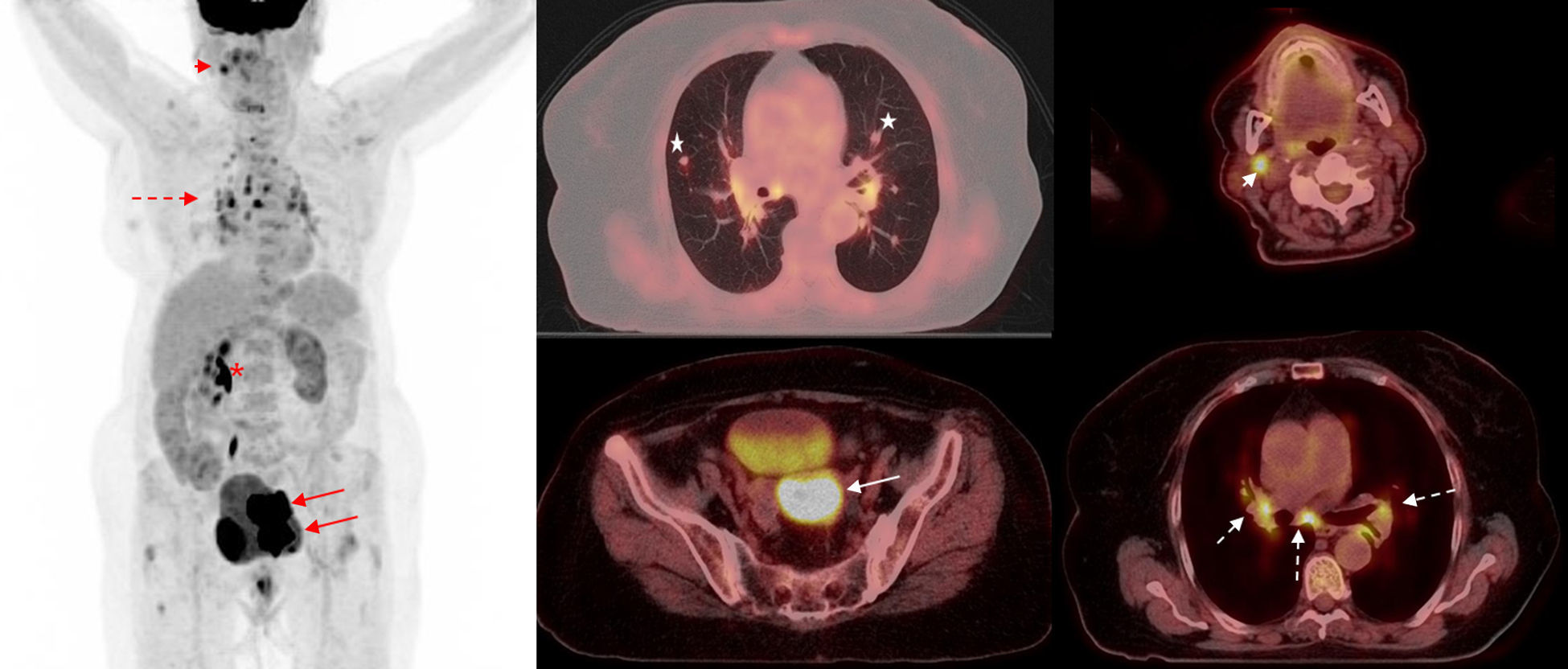
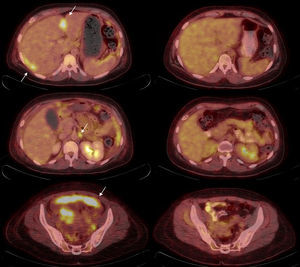
Además, el estudio preoperatorio de la PET/FDG permite tener información pronóstica de la neoplasia. En 2009 se publicó el primer trabajo que reportaba que el grado de captación del tumor primario se correlacionaba con algunos parámetros de riesgo como la invasión estromal, la invasión vasculolinfática o el tamaño tumoral superior a 4 cm54. En este estudio se identificó el SUVmax como factor independiente predictor de recurrencia, lo que permite diferenciar claramente 2 poblaciones en función del metabolismo pretratamiento de la lesión primaria e individualizar el tratamiento y seguimiento de las pacientes en función del riesgo de recurrencia. De igual manera, existe asociación entre la tasa de recurrencia y el grado de captación de las adenopatías pelvianas55 o paraaórticas56, así como se ha observado menor supervivencia global (overall survival) y menor DFS a mayor valor de SUVmax56,57. Y por último, a pesar de que parece razonable que las pacientes con afectación ganglionar más distal tengan peor pronóstico; se ha observado que las pacientes con el mismo estadio FIGO tienen peor pronóstico si las adenopatías muestran captación de FDG en el estudio preoperatorio58. Estos datos señalan la PET/FDG como herramienta prometedora en la estadificación pretratamiento (fig. 3).
Estadificación de cáncer de cérvix. Paciente de 72 años con carcinoma escamoso de cuello uterino con invasión parametrial y de la vagina y el cuerpo endometrial, sin adenopatías locorregionales detectadas mediante RM. Imagen de cuerpo entero de PET (izquierda) e imágenes de fusión PET-TC axiales que muestran la tumoración primaria cervical, retrovesical (flecha), que condiciona hidronefrosis derecha (asterisco), sin adenopatías locorregionales. Sin embargo, se evidenciaron adenopatías mediastínicas (flecha discontinua), laterocervical izquierda (flecha corta) y nódulos pulmonares (estrellas), que suponen un estadio IV.
En el seguimiento del CCU no inicial (Ib2-IV), la realización de un estudio PET-TC a los 3 meses de tratamiento detecta la enfermedad con una sensibilidad del 95% y una especificidad del 87%59, superiores a la de las técnicas de imagen convencionales (90 y 76%, respectivamente). Esta diferencia es especialmente importante en pacientes sintomáticas. Sin embargo, en términos de coste-efectividad, añadir un estudio PET-TC a las exploraciones de imagen habituales no resulta eficiente60 por lo que, si no sustituye a otros estudios, debería quedar relegado a la detección de recurrencia en las pacientes con sospecha clínica.
En esta situación clínica, la PET-TC permite la detección de recidiva local y a distancia en un 76-100% de los casos, lo que supone un cambio de la estrategia de tratamiento en el 37,5-48% de las pacientes61,62, ya sea como conversión de tratamiento curativo a paliativo, por la detección de mayor número de lesiones o bien de lesiones a distancia, gracias a la identificación de segundos tumores primarios, los cuales pueden tratarse de forma independiente. Además, modifica la intensidad del tratamiento, condicionando una reducción de dosis si el pronóstico empeora y la intención es paliativa y no radical.
Valoración de respuesta al tratamientoClásicamente, la valoración de respuesta al tratamiento se ha basado en el descenso de los valores séricos de los marcadores tumorales y en la disminución de tamaño de las lesiones, valorados mediante TC o RM. Sin embargo, dado que los cambios metabólicos preceden a los morfológicos, la PET-TC ofrece la posibilidad de obtener una valoración precoz de respuesta al tratamiento.
En términos generales, la captación de 18F-FDG puede estar aumentada si el estudio se realiza en un intervalo de tiempo muy corto después del tratamiento. En estos casos aumenta el número de falsos positivos, por lo que se aconseja esperar un mínimo de 3 semanas tras el último ciclo de quimioterapia y 3-6 meses tras finalizar la radioterapia. Se ha observado que la ausencia de captación en un estudio PET-TC realizado 3 meses después de finalizar el tratamiento de radioterapia se asocia a mayor PFS63. Por ello la PET-TC se utiliza como herramienta para la valoración de respuesta al tratamiento primario, con quimiorradioterapia, por su capacidad para distinguir entre persistencia de tumor y masa residual con una sensibilidad del 93-96% y una especificidad del 93-95%.
Además, estudios recientes muestran que el grado de respuesta a la terapia valorado mediante SUVmax tiene valor pronóstico. En un grupo de 60 pacientes en las que se realizó un estudio PET-TC basal, a las 4 semanas del inicio del tratamiento y un mes tras finalizar quimiorradioterapia se observó que la respuesta metabólica completa y una disminución del SUVmax superior o igual al 60% eran factores independientes predictores de PFS64. Estos resultados se han confirmado en un metaanálisis que incluye 16 estudios y más de 1.800 pacientes65, en el que la PET-TC con FDG tras tratamiento primario es predictora de PFS y OS.
También se ha evaluado el valor pronóstico de la PET-FDG tras el tratamiento de la recurrencia del cáncer de cérvix66. Aunque la evidencia es limitada, las pacientes con progresión metabólica de la enfermedad parecen tener peor PFS pero similar OS.
Tomografía por emisión de positrones con 18F-fluordesoxiglucosa/tomografía computarizada en cáncer de endometrioEl cáncer de endometrio es la neoplasia más frecuente del tracto genital femenino; ha aumentado su incidencia en el último siglo a la vez que descendía la del cáncer de cérvix. Pero a diferencia de este cáncer o del de ovario, el cáncer de endometrio suele detectarse en estadios precoces y en general presenta una baja mortalidad. Supone el 13% de los cánceres en mujeres con una incidencia en España de 7-13/100.000 mujeres y año. La edad más frecuente de presentación es entre los 55 y 59 años; solo un 20% de los casos se diagnostican durante la premenopausia, y es excepcional antes de los 40 años.
El pronóstico del cáncer de endometrio depende en gran parte de la presencia o ausencia de invasión de los ganglios pelvianos y paraaórticos; las metástasis a distancia son inusuales en ausencia de invasión ganglionar. Los factores asociados con la invasión ganglionar son: afectación del segmento bajo uterino, el grado de diferenciación tumoral y la profundidad de invasión miometrial. Existe correlación entre el grado de diferenciación y la invasión miometrial, siendo este último parámetro el factor pronóstico más importante.
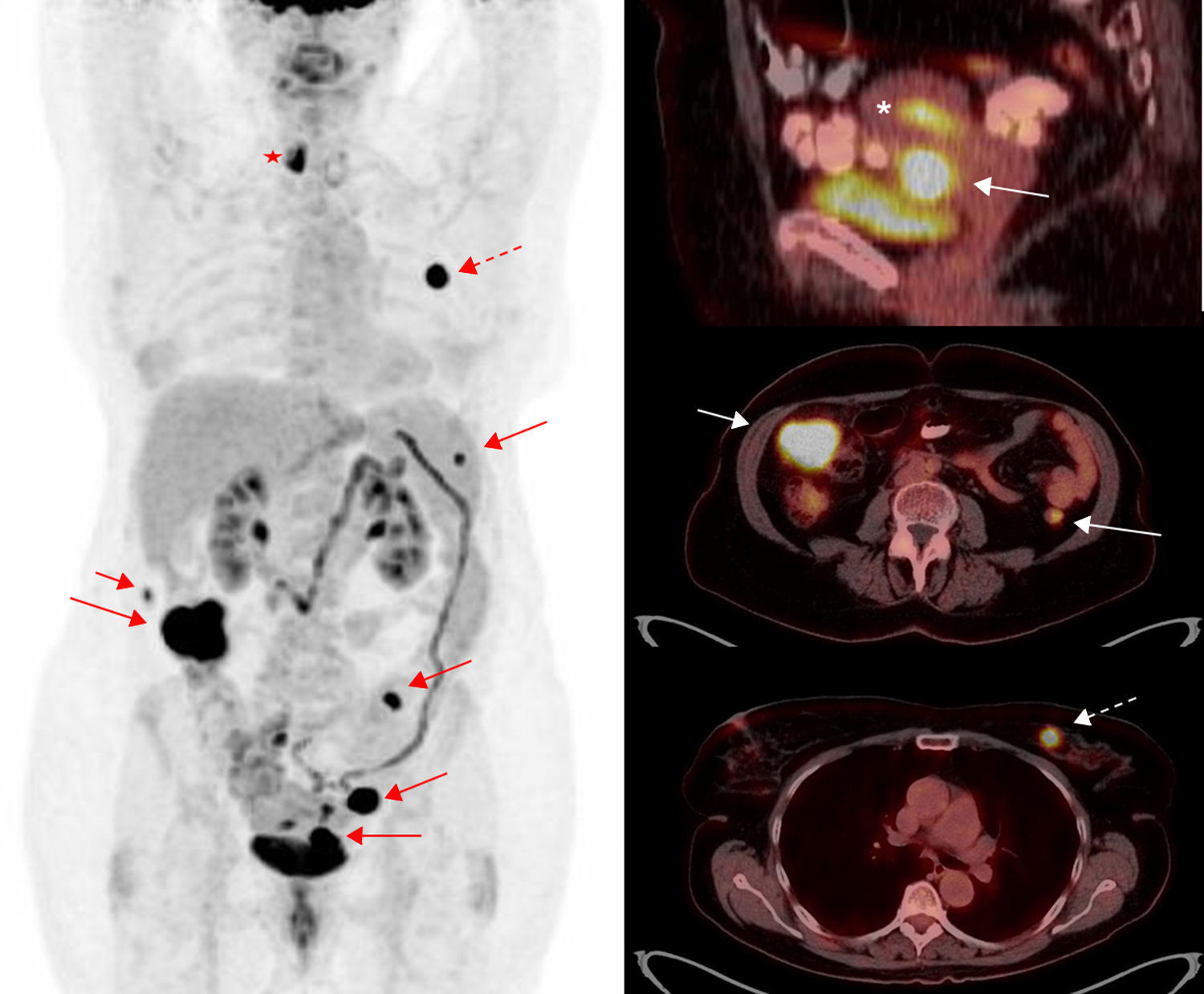
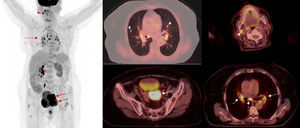
Estadificación tumoral y ganglionar inicialComo se ha comentado anteriormente el amplio espectro de captación endometrial de FDG en pacientes premenopáusicas dificulta la caracterización de las lesiones endometriales malignas. La captación fisiológica endometrial durante el ciclo menstrual puede alcanzar valores de SUVmax similares o incluso superiores a los de los tumores de bajo grado, por lo que clásicamente la PET-FDG se ha descartado como herramienta primaria para el diagnóstico del cáncer de endometrio67. El diagnóstico de sospecha y la valoración de la extensión inicial de estos tumores se basa en la realización de una ecografía transvaginal y de una RM para determinar el grado de invasión miometrial y la extensión cervical. No obstante, en un estudio multicéntrico que incluye a 318 pacientes se evaluó el papel de la PET-TC previo a la cirugía y se comparó con la RM y la ecografía 2D68. Se objetivó que la capacidad de detección de invasión miometrial es similar a la de la RM y superior a la de la ecografía 2D, como también es superior a ambas en la detección de invasión cervical. La PET-TC destacó por su elevado valor predictivo negativo en el diagnóstico de invasión miometrial, del 95%, y en la detección de la infiltración ganglionar, debido a la capacidad de identificar lesiones hipermetabólicas infracentimétricas. Si bien ninguna técnica de diagnóstico por la imagen puede sustituir la estadificación quirúrgica, el elevado valor pronóstico negativo de la PET-TC en cuanto al diagnóstico de invasión miometrial y ganglionar hace de esta técnica una opción para las pacientes con elevado riesgo quirúrgico y se convierte una herramienta de gran valor en la planificación quirúrgica (fig. 4).
Estadificación pretratamiento de cáncer de endometrio. Paciente de 65 años con carcinoma endometrial de células claras remitida para valoración pretratamiento. Imagen de cuerpo entero de PET (izquierda) e imágenes de fusión PET-TC (derecha) en proyección sagital (arriba) y axial (centro y abajo). Muestran la tumoración primaria en el cuerpo uterino (asterisco) con implantes peritoneales (flechas) y una neoplasia primaria en cuadrantes internos de la mama izquierda (flecha discontinua). Bocio multinodular en lóbulo tiroideo derecho (estrella).
La fusión de los estudios PET y RM permite sumar las ventajas de la RM, en cuanto a la caracterización morfológica del tumor, especialmente en la valoración de lesiones ováricas y uterinas, y de la PET, que valora el comportamiento de las células tumorales. Esta técnica híbrida presenta una mayor sensibilidad y especificidad que la PET-TC. Hasta el momento se ha realizado la fusión de las imágenes obtenidas en diferentes equipos69. Sin embargo, el siguiente escalón en el diagnóstico no invasivo de estos tumores serán los equipos híbridos PET-RM.
En la valoración del estado ganglionar, de igual modo que en el cáncer de cérvix, la sensibilidad de la PET es inferior a la de la estadificación quirúrgica, incluso si se realiza con PET-TC que incluya la realización de una TC diagnóstica.
La realización de un estudio PET-TC previo a la cirugía en el cáncer de endometrio permite obtener información en cuanto a la extensión y comportamiento tumoral. Se ha establecido una correlación entre la intensidad de captación (SUVmax) y el estadio según la FIGO70,71, el grado histológico, la invasión vasculolinfática y el tamaño tumoral70,72. En algunas series se ha podido determinar un dintel en el grado de captación (SUVmax = 8,7) que permite diferenciar entre lesiones de alto grado y de bajo grado, con una exactitud diagnóstica del 82%. Sin embargo, esta exactitud diagnóstica puede resultar insuficiente en la práctica clínica. Por ello ha adquirido especial relevancia la introducción de nuevos radiofármacos en la rutina asistencial, como el 18F-fluorestradiol (18F-FES), que puede ayudar en la discriminación, no solo entre tumores de alto y bajo riesgo sino también entre la hiperplasia endometrial y los tumores de bajo riesgo73.
La principal ventaja de la PET-TC prequirúrgica es la información pronóstica. La actividad metabólica medida con SUVmax se perfila como herramienta predictora de recurrencia y de muerte72. También se ha objetivado una asociación estadísticamente significativa entre el SUVmax y otros 2 parámetros de supervivencia: la DFS y la OS74. La tendencia actual, sin embargo, es la de utilizar otras unidades de medida de la actividad metabólica como el MTV. Diversos trabajos han demostrado que las pacientes con menor PFS, menor DFS y mayor tasa de recurrencia son las que tienen mayores niveles de MTV, especialmente en el subtipo endometrioide75,76.
Seguimiento y detección de recurrenciaEn la detección de recurrencia, la PET/FDG ha demostrado elevadas cifras de sensibilidad y especificidad, del 95,8 y 92,5%, respectivamente77, incluso en pacientes asintomáticas. Frente a otras técnicas de imagen, la capacidad de la PET/FDG para la detección de enfermedad recurrente presenta mejores cifras de especificidad (62 vs. 96%) y exactitud diagnóstica (76 vs. 92%), con similar sensibilidad (85 vs. 89,5%)78. Esta elevada capacidad de detección de recaída tiene un importante impacto clínico, puesto que supone un cambio en el manejo de un gran número de pacientes, que en algunas series alcanza el 22% de los casos estudiados79. Este cambio de manejo puede implicar tanto evitar tratamientos sistémicos, al caracterizar algunas lesiones como benignas, como plantear tratamientos más agresivos, si la PET detecta recidiva multifocal que obliga a sustituir una posible cirugía de rescate por un tratamiento sistémico. Pese a las prometedoras ventajas que la PET parece ofrecer en el manejo terapéutico de estas pacientes, hacen falta estudios clínicos prospectivos bien diseñados que permitan evaluar el verdadero impacto en la supervivencia global que ofrece la detección temprana de una recurrencia por PET/FDG.
Valoración de respuesta a tratamientoActualmente no existe suficiente evidencia científica disponible sobre el uso de la PET-TC para valorar la respuesta al tratamiento sistémico en cáncer de endometrio. Únicamente se dispone de series cortas de pacientes40 en las que se observa un mayor descenso del metabolismo en las pacientes respondedoras frente a las no respondedoras. Si se confirmara esta ventaja, se podría introducir una nueva estrategia terapéutica más eficaz sobre el último subgrupo y reducir costes y morbilidad.
Otros tumores ginecológicosCáncer de vulvaEl carcinoma escamoso de vulva es la estirpe histológica con mayor avidez por la FDG. La sensibilidad de la PET para la detección de este subtipo histológico de cáncer de vulva es del 100% en los estudios preoperatorios frente al 60% detectado en las pacientes con carcinoma no escamoso. El estudio PET-TC prequirúrgico permite identificar lesiones a distancia, que no son infrecuentes en estadios avanzados de esta enfermedad80 y, debido a su elevado valor predictivo positivo, del 100%, planificar la mejor estrategia terapéutica81. Sin embargo, en la estadificación ganglionar, la PET tiene menor sensibilidad (50%), debido a que habitualmente la infiltración es micrometastásica o de pequeño tamaño. Por ello, la herramienta de estadificación de elección debe ser la linfadenectomía o la detección de ganglio centinela.
Cáncer de vaginaEn el carcinoma de vagina la experiencia es escasa, aunque se ha observado que la PET detecta un mayor número de lesiones ganglionares y a distancia que la TC82.
Tumores no epiteliales de ovarioEn los tumores germinales la captación de FDG es muy variable, depende en gran parte del porcentaje de componente maduro del tumor, que generalmente es poco hipermetabólico, y del componente quístico. Pero también varía en función del tejido que compone el tumor, ya que fisiológicamente algunos tejidos como el cerebral muestran gran avidez por la FDG. Todo ello dificulta la caracterización de los tumores germinales y existe un riesgo no despreciable tanto de falsos negativos (tumores con gran porcentaje de tejido maduro o quístico) como de falsos positivos (tumores en los que se halla tejido cerebral). A pesar de ello, en ocasiones se incluye la realización de una PET-TC en el diagnóstico de estos tumores, ya que puede ser de utilidad en su seguimiento: en pacientes con un tumor que muestre captación en el estudio PET prequirúrgico, se podrán identificar las lesiones residuales postratamiento y de posibles recurrencias en el seguimiento83,84.
En el caso de los tumores borderline de ovario caracterizados por un bajo índice de proliferación celular, la captación de FDG es nula o escasa, reportándose un número importante de falsos negativos (incluso para aquellos tumores con implantes peritoneales) lo que no apoya el uso de la PET para su diagnóstico y estadificación.
ConclusionesNo cabe duda de que las aplicaciones potenciales de la PET-TC en el manejo de los tumores ginecológicos van en aumento. Sobre las indicaciones actuales establecidas, otras áreas de investigación están en marcha por la mejora que la PET-TC ofrece en la precisión diagnóstica, tanto en la caracterización, estadificación y en el control evolutivo para el diagnóstico de recaídas, como para la valoración de respuesta al tratamiento de esos tumores (tabla 1). En la era de la oncología personalizada, la posibilidad de obtener pruebas de imagen más precisas permite a los especialistas optimizar el diagnóstico e individualizar el tratamiento. Sin embargo, la integración de esta técnica va asociada a un extracoste si se compara con las técnicas de imagen convencionales por lo que son necesarios estudios prospectivos que demuestren que el uso de la PET-TC no solo cambia el manejo terapéutico de estos tumores sino que realmente conlleva un impacto en la mejora de la supervivencia de estas pacientes.
Indicaciones actuales de la PET-TC para los tumores ginecológicos más frecuentes
| Tumor | Indicación actual | Indicaciones potenciales para el futuro |
|---|---|---|
| Ovario | Detección de recurrencia ante elevación del marcador tumoral C125 Sospecha de recurrencia por pruebas de imagen o exploración física | Prueba de imagen de elección ante sospecha de recidiva por marcador C125 Monitorización de la respuesta al tratamiento con quimioterapia (respondedores vs. no respondedores) Estadificación inicial para mejor selección de pacientes candidatas a cirugía vs. QTNA |
| Cérvix | Detección de recurrencia, previa a plantear una exanteración Estadificación ganglionar y a distancia en cáncer localmente avanzado para valor pronóstico y planificación radioterapéuticaa,b Valoración de la respuesta después del tratamiento concomitante con quimiorradioterapia | Valoración de respuesta a nuevos tratamientos antineoplásicos antidiana |
| Endometrio | Estadificación ganglionar en cáncer localmente avanzado para valor pronóstico y planificación radioterapéuticab Detección de recidiva ante sospecha clínica y pruebas de imagen convencional negativasa | Identificación de enfermedad metastásica extranodal en pacientes con tumores de alto riesgo |
QTNA: quimioterapia neoadyuvante.
Los autores declaran no tener ningún conflicto de interés.