INTRODUCCION
Los síntomas premenstruales, en determinadas ocasiones categorizados como síndrome premenstrual (premenstrual syndrome, PMS), son casi omnipresentes en la mujer en edad reproductiva; se han descrito al menos 200 síntomas premenstruales, entre físicos o fisiológicos y psicológicos. Casi todos los aspectos del funcionamiento de la mujer pueden verse afectados por los cambios que en ella se producen durante el ciclo menstrual. Cambios «positivos» a veces, cambios «negativos» otras veces, y tanto positivos como negativos la mayoría de las veces, dependiendo de la vivencia subjetiva de cada mujer (tabla 1).
En otras palabras, es normal percibir síntomas premenstruales, ya que la mayoría de las mujeres los experimenta. Sólo en los casos en que estos síntomas afectan negativamente la funcionalidad física, psíquica y/o social de la mujer, o sea, cuando en su conjunto provocan una reducción o merma notable de la calidad de vida, podemos hablar de un síndrome premenstrual. Exclusivamente en los casos en que esta merma de la calidad de vida de la persona llega a ser un impedimento funcional psíquico absoluto temporal, estamos ante un trastorno disfórico premenstrual (premenstrual dysphoric disorder, PMDD) (tabla 2).
Durante los últimos 70 años se han propuesto muchas teorías acerca de las causas de los síntomas. Empezando por la obvia causa intuitiva, que es un supuesto desarreglo hormonal. Pero rápidamente se incluyeron supuestos factores psicológicos para poder explicar por qué una mujer sufre, cuando otras en las mismas circunstancias y con los mismos valores hormonales no lo hacen. La investigación no ha podido identificar ninguna alteración biológica como causa única del síndrome o del trastorno, lo cual apunta a un problema multicausal.
Algunas teorías acerca de los supuestos factores psicológicos van muy lejos. Relacionan el PMS con el neuroticismo, con trastornos afectivos o con una personalidad anormal, propuestas todas ellas en línea con la nunca demostrada relación entre el PMS y una supuesta alteración mental.
El mero hecho de incluir, de forma provisional, el PMDD en el DSM-IV1 fue criticado por ginecólogos, psiquiatras, neurólogos y psicólogos de renombre ya que, en el caso de que tuviera una causa biológica concreta, no sería un trastorno mental. El PMDD es un trastorno psicológico que se distingue del PMS, donde los síntomas psicológicos están siempre acompañados de alteraciones físicas y biológicas.
Según el DSM-IV, para el trastorno disfórico premenstrual los síntomas psicológicos son determinantes y deben haberse presentado con regularidad durante la última semana de la fase lútea, y haber remitido a los pocos días del inicio de la menstruación. Estos síntomas tienen que ser de la suficiente gravedad como para interferir notablemente en el trabajo, los estudios o las actividades habituales y estar completamente ausentes durante al menos una semana después de la menstruación. De esta forma, el DSM confirma que en el PMDD los síntomas psicológicos son determinantes. El DSM advierte que se debe distinguir el PMS del PMDD (tabla 3).
Los estudios endocrinos y ginecológicos anteriores a 1983 sobre el PMS son inexactos y heterogéneos porque no utilizaron criterios diagnósticos uniformes y adecuados. Los estudios psicológicos adolecían y adolecen del mismo fallo.
De los estudios posteriores no todos cumplen los requisitos científicos actuales, con lo cual parte de sus conclusiones deben tomarse como probabilidades y no como datos ciertos.
En los últimos 20 años, los esfuerzos por aislar un mecanismo fisiopatológico específico no pudieron demostrar muchas diferencias en los valores hormonales a lo largo del ciclo entre mujeres con síntomas y sin ellos. No obstante, la noción errónea de que el PMS se debe a un «lógico» desarreglo hormonal continúa presente entre muchos profesionales, y convendría adecuar esta noción a la evidencia.
Se compararon los valores de estrógenos, progesterona, testosterona, hormona folículo-estimulante (FSH), hormona luteinizante (LH), prolactina y globulina transportadora de hormonas sexuales (SHBG), así como el aumento de peso o de los valores de sustancias relacionadas con la regulación de los líquidos, como la aldosterona2. Estos estudios incluyeron los valores circulantes, así como los patrones de secreción durante el ciclo menstrual. No se pudo demostrar conexión alguna entre el PMS y los metabólitos endógenos de la progesterona, alopregnenolona y pregnenolona3. Sin embargo, la secreción lútea de alopregnenolona es significativamente más baja en pacientes con PMS, que además muestran concentraciones de progesterona más bajas en todo el ciclo menstrual4. Asimismo, las mujeres con PMS, cuando están sintomáticas, manifiestan una respuesta anormal a la progesterona del eje hipotalámico-pituitario-adrenal (HPA), en el sentido de que no muestran la activación del eje HPA que se observa en la depresión mayor5. Esta actividad reducida del eje HPA había aparecido en un estudio anterior que comparaba la depresión premenstrual con el trastorno disfórico temporal6. Las pruebas dinámicas no revelaron anomalías en el eje hipotálamo-hipofisario (como es el caso en la depresión mayor) ni en su relación con las glándulas suprarrenales, la tiroides y los ovarios.
No se detectaron cambios en el magnesio, el cinc, la vitamina A, la vitamina E, la tiamina (vitamina B1) ni la piridoxina (vitamina B6)7. Algunos investigadores han sugerido cambios relevantes en las endorfinas y que el complejo de síntomas de la fase lútea está causada por la disminución de las concentraciones de opioides endógenos (en realidad, significaría una autoadicción y posterior abstinencia temporal), pero otros no han logrado detectar estos cambios en las endorfinas circulantes en las pacientes sintomáticas8-10.
Aunque aparecen cambios en diferentes factores biológicos, éstos no siempre son confinados a la fase lútea. Además de las endorfinas, los cambios incluyen la respuesta a la hormona liberadora de tirotropina (TRH), la secreción de melatonina, los valores de magnesio de los eritrocitos, las respuestas de la hormona del crecimiento y el cortisol al triptófano, la respuesta del cortisol a la hormona liberadora de corticotropina (CRH), y la secreción de cortisol libre.
Recientemente se encontró que el patrón de secreción de cortisol sí muestra diferencias significativas entre las mujeres con PMDD y las que no lo presentan11.
La función tiroidea en PMS es generalmente normal y, aunque no lo es en un 10% de las pacientes, esta tasa es comparable a la de la prevalencia de hipotiroidismo subclínico en la población general12,13.
Un argumento convincente en contra del supuesto de que los cambios hormonales en fase lútea sean la causa del PMS proviene de unas investigaciones realizadas en 1990 en el National Institute of Mental Health estadounidense14. En estos estudios, se utilizó un antagonista de la progesterona, RU486, combinado con gonadotropina coriónica humana (HCG) o placebo, para inducir el sangrado en diferentes momentos del ciclo. Los resultados mostraron que la alteración del ciclo menstrual no influyó en el tiempo ni en la gravedad de los síntomas de PMS; por tanto, los fenómenos neuroendocrinos y endocrinos de la fase lútea no parecían ser la causa del síndrome. Sin embargo, los estudios recientes aportan datos que sugieren que la progesterona y los progestágenos sí influyen, porque otros tipos de tratamiento basados en estos fármacos pueden ser eficaces en el PMS15.
Hay indicios interesantes acerca de la etiología de la problemática premenstrual que se derivan de dos estudios recientes, que continúan una línea de investigación que data de los años setenta. En el primero, el ensayo con tejido del hipocampo animal muestra que las fluctuaciones en los esteroides endógenos, especialmente la progesterona, causan alteraciones de la cinética de determinados receptores GABA, provocando cambios en la excitabilidad tanto del hipocampo como de la conducta. La retirada de la progesterona provocaba ansiedad y susceptibilidad a los ataques epilépticos16. También en humanos está comprobada esta correlación bimodal entre las concentraciones de progesterona y los cambios negativos anímicos y la posibilidad de ataques durante la fase lútea del ciclo menstrual en mujeres con PMS y epilepsia catamenial, respectivamente17. Por tanto, en parte podría tratarse de un «síndrome de abstinencia» de la progesterona, cuya intensidad depende de la expresión individual del receptor GABAA.
En cuanto al segundo estudio, está bien documentado que los efectos de los estrógenos en el cerebro dependen de los receptores específicos α y β, ampliamente presentes en muchas estructuras neuronales. Éstos median en la emoción, la cognición y la procreación, a través de los sistemas noradrenérgicos, dopaminérgicos y serotoninérgicos, los cuales están fuertemente implicados en los trastornos del ánimo. La relación causa-efecto entre esteroides y estrógenos se investigó con el tejido del núcleo paraventricular hipotalámico humano, y se observó que los sujetos con trastornos anímicos tenían un número mucho más elevado de neuronas de la CRH, que poseen receptores de estrógenos y, por tanto, son modulados directamente por los valores de éstos18. Se estableció que este aumento en dichas neuronas se debe a factores externos, dato importante porque sustenta la influencia del entorno psicosocial en la alteración.
Otro estudio realizado en animales, casi simultáneo al anterior, descubrió que sólo los receptores estrogénicos β tienen relevancia ansiogénica19.
Consecuentemente, se podría hipotetizar que el componente anímico del PMS y del PMDD se basa en una sensibilidad neuronal a los cambios en los valores de estrógenos, propios del ciclo menstrual, con efectos directos sobre el eje HPA, que se vería agravada por la expresión individual del receptor GABAA y de la densidad y actividad de los receptores estrogénicos β.
Los resultados poco uniformes de los estudios, en cuanto a la eficacia de los tratamientos sobre la base de las diferentes teorías, refuerzan la sospecha de que no hay una sola causa, sino un origen multifactorial. Otro dato a favor de esta hipótesis es la alta respuesta a los tratamientos con placebo en los estudios con protocolos correctos. En muchos llega a producirse un 35-50% de respuesta al placebo, más aún cuando los sujetos esperan un resultado positivo, mientras que en otros alcanza una respuesta comparable a la respuesta vera. Como uno de nosotros argumentó en otro lugar, el tratamiento con placebo no debe confundirse con un tratamiento «cero»20. En el presente caso, donde alcanza respuestas tan masivas, el tratamiento con placebo debe considerarse sin sustancia o terapia identificada activa; sin embargo, constituye un tratamiento, dada su eficacia en un alto número de casos. ¿Qué tipo de tratamiento es el placebo? Lo poco que sabemos de los mecanismos por los que actúa el tratamiento placebo nos indica que tiene efectos que se pueden calificar como amplios, u holísticos, o multifactoriales. La sensibilidad extrema al placebo que muestra el PMS revela que tiene un gran componente psicosomático. Esta sensibilidad, combinada con la influencia del aprendizaje y del condicionamiento sociocultural, sostiene que el PMS debe considerarse un síndrome biosociopsicosomático, donde son relevantes los factores biológicos, psicológicos y sociales.
Buena parte del esfuerzo investigador sobre las causas y los remedios del PMS y el PDD se ha dirigido a los factores físicos y fisiológicos, aunque desde hace siglos se reconoce que el cuadro premenstrual tiene componentes psicológicos y sociales notables21,22.
EL ESENCIAL REGISTRO DE SINTOMAS
Se ha identificado un número elevado de síntomas clínicos del PMS, que son variables y difíciles de cuantificar. Abarcan emociones, sensaciones sexuales, estados de ánimo, cambios en el comportamiento social y síntomas somáticos. A pesar de una cantidad notable de cuestionarios, propuestos desde diferentes disciplinas, sigue siendo difícil encontrar un método fiable y objetivo para observar y evaluar los síntomas que se experimentan internamente y que no se expresan --o sólo de forma indirecta o tangencial-- en síntomas o comportamientos externos23.
La elevada discrepancia entre los datos tomados de forma retrospectiva o prospectiva está bien documentada y reconocida (aunque a veces los resultados coinciden)24-26. Como consecuencia de ello, hay consenso en que el registro siempre debe ser prospectivo. Este requisito --el único sobre el que hay consenso-- se refleja en las exigencias y recomendaciones diagnósticas del DSM-IV de la Asociación Americana de Psiquiatría (APA), el Instituto Nacional de Salud Mental (NIMH) de Estados Unidos, el Colegio Estadounidense de Obstetras y Ginecólogos (ACOG), la Academia de Médicos de Familia (AAFP) de Estados Unidos y la Sociedad Española de Ginecología y Obstetricia (SEGO).
Las mujeres usan la menstruación como un marcador del tiempo, y las experiencias desagradables, fáciles de recordar, son atribuidas a un indicador reconocible. Si nuestra cultura condiciona a las mujeres a esperar síntomas premenstruales y retención de líquidos, dolor y reacciones emocionales, eso es precisamente lo que informarán24,27.
¿Hay un síndrome premenstrual específico? Una definición del PMS debería considerar que el síndrome compagina cambios fisiológicos con cambios en la conducta social, síntomas somáticos y problemas psicológicos, como si hubiera un síndrome coherente. Parte de esta dificultad es que todas las herramientas de investigación reflejan el modo en que el creador de la herramienta concibe el PMS lo que, a su vez, se basa en el bagaje cultural y académico del autor28. Es aconsejable que el registro sea un autorregistro, para controlar el efecto de las expectativas de quien realiza el ensayo29-31.
La interpretación de los resultados de los estudios se complica por el ya mencionado alto porcentaje de respuestas al placebo. Sólo son fiables los datos de estudios con un protocolo adecuado, doble ciego, controlado con placebo y aleatorizado32.
Hay más de 30 instrumentos diagnósticos para el PMS y/o el PMDD disponibles, pero pocos proporcionan una base fiable para un diagnóstico25. No disponemos de ningún cuestionario técnicamente validado.
Pocos de los cuestionarios disponibles cumplen dos criterios elementales33.
El primer criterio trata de la rigurosidad en la recogida de datos. La recogida retrospectiva distorsiona, pero la recogida prospectiva fomenta una interferencia incontrolable del factor placebo.
El segundo criterio exige una mínima interferencia en la práctica clínica por el hecho de aplicar el instrumento psicométrico. La mencionada interferencia del factor placebo desempeña también un papel determinante, pero además es excesiva la extensión de los registros y cuestionarios sobre el PMS, que intentan cumplir la exigencia del DSM-IV de que se haga el registro a diario durante al menos 2 meses, con largas listas de síntomas34,35.
Los problemas logísticos resultantes de cualquier registro diario durante un tiempo prolongado necesitan soluciones modernas. Se ha comprobado que el registro electrónico de datos es eficaz y preferido por el 70% de los usuarios36. Sin embargo, también hay la alternativa de registrar factores, o sea, grupos de síntomas en vez de síntomas aislados, con lo cual se reduciría el número de datos. Obviamente, esta tarea necesita que se entrene a la paciente en el contenido global de cada factor.
Tanto el facultativo como la paciente deben tener presente que el mismo hecho de cumplimentar el autorregistro durante 2 o 3 meses puede tener un efecto terapéutico («placebo») notable37. Llevar un adecuado registro diario de síntomas del PMS ayuda a reducir éste o el PMDD38.
En vista de la concurrencia de síntomas del PMS con trastornos depresivos y ansiosos, con una superposición a veces difícil de distinguir, es preciso que se apliquen algoritmos diagnósticos diferenciales en un momento temprano.
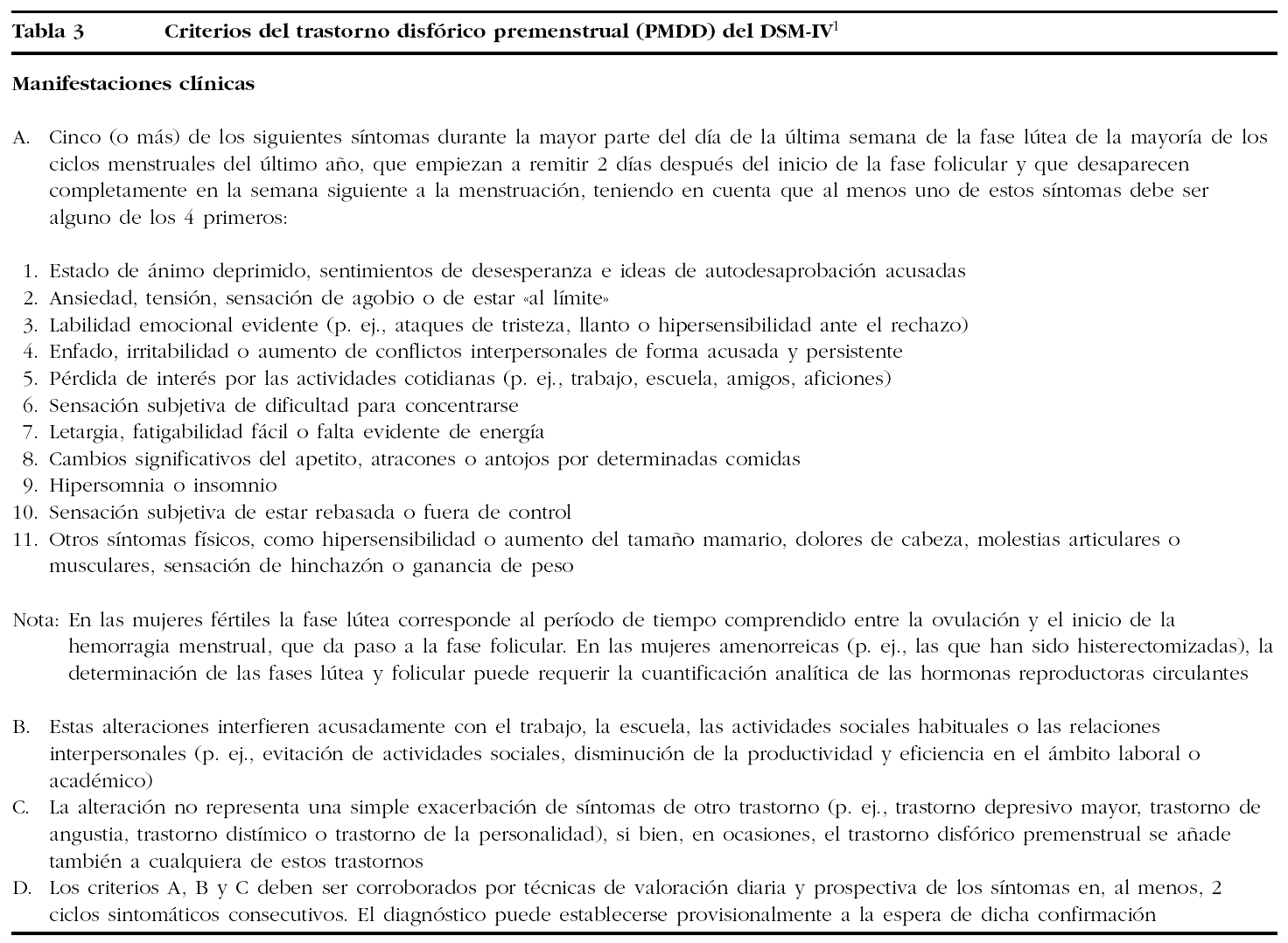
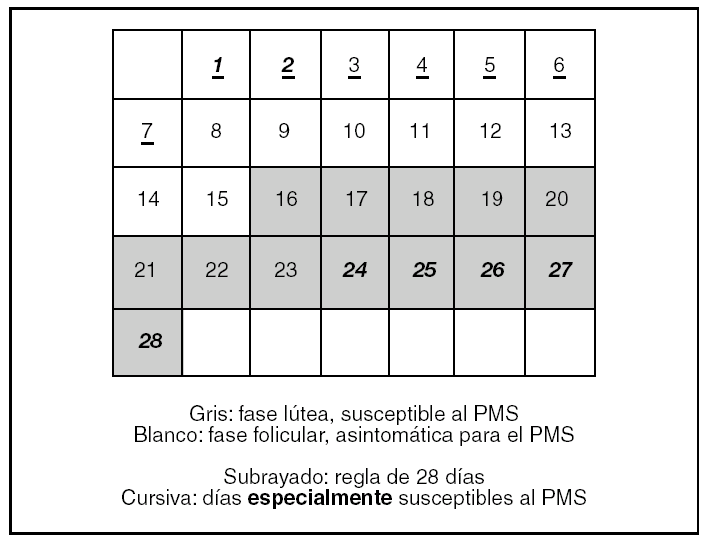
¿Durante cuántos días hay que registrar datos para medir 2 ciclos menstruales? (fig. 1)
Figura 1.Ciclo menstrual medio de 28 días. PMS: síndrome premenstrual.
Las características básicas compartidas del PMS y del PMDD son las siguientes:
1. Los síntomas son cíclicos.
2. La gravedad de los síntomas es relativa e individual.
Por tanto, el DSM-IV exige que se determine la ciclicidad, midiendo los síntomas durante 2 ciclos menstruales, y el NIMH propone el criterio de que la intensidad de los síntomas incremente al menos el 30% en el período premenstrual.
Sin embargo, para tomar los datos relevantes para el PMS o el PMDD durante 2 ciclos menstruales no basta con un registro de 2 meses, sino que debe ser un registro de 2 meses y al menos 3 días, preferiblemente una semana. No puede ser menos porque debe empezar el registro el primer día del ciclo, que es la única referencia concreta que se tiene en el ciclo menstrual. Como el primer día del ciclo es el primer día de la regla, los días de la menstruación del primer ciclo no nos ofrecen referencias premenstruales y tenemos que esperar a la próxima fase lútea que es cuando los síntomas pueden aparecer. Igualmente, al final del primer ciclo menstrual medido, necesitamos los primeros días de la menstruación del segundo ciclo para completar el primer «ciclo de datos premenstruales». En definitiva, al final del segundo mes se necesita tomar los datos de al menos 3 días de la menstruación del tercer mes para completar este segundo ciclo.
Esta realidad ginecológica no se ve recogida en el DSM-IV ni en los cuestionarios disponibles, que son estructurados para medir 2 meses ováricos pero no 2 ciclos «premenstruales» completos.
El hecho de que el registro de datos deba iniciarse el primer día de la regla, aunque el significado estadístico del registro no empiece hasta comenzar la fase lútea, ofrece --además de datos de línea base-- una posibilidad de entrenar y acostumbrar a la paciente a la tarea del registro diario, sin que las posibles equivocaciones vicien los datos relevantes.
El Perfil Premenstrual(The Premenstrual Profile)
El Perfil Premenstrual se desarrolló en 2004 como un modelo teórico psicométrico. El valor de un método psicométrico, como un cuestionario, está condicionado por los criterios diagnósticos especificados, validados y aceptados por la disciplina médica referida. En el caso del PMS no hay aún tales criterios, sólo constan sugerencias, indicios y propuestas. Además, en este caso el cuestionario debe contribuir a desgranar una aparente pero falsa continuidad y establecer una distinción clínica entre los síntomas premenstruales comunes, el PMS y el PMDD.
El desarrollo en el tiempo de cuestionarios desde los años sesenta y su análisis estadístico ha revelado que se pueden identificar «factores», o grupos de síntomas de una misma clase de manifestaciones. La investigación desde Moos empezó con 8 factores, que en posteriores comprobaciones se redujeron a 4 y, últimamente, siguiendo a Steiner39, a 3 factores provisionales de primer orden, que el Perfil Premenstrual recoge y define del modo siguiente:
-- Factor I: desánimo o ánimo negativo. Incluye DSM-IV categorías 1-7 y 10.
-- Factor II: dolor e incomodidad. Incluye DSM-IV categorías 8, 9, 11 (en parte).
-- Factor III: retención de líquidos. Incluye DSM-IV categoría 11 (en parte) (tabla 4).
A diferencia del cuestionario tradicional que aspira a tomar una cantidad de datos, necesaria para llegar a un diagnóstico por umbral calculado, un perfil psicométrico como el presente pretende recoger los datos imprescindibles para un cribado fundamentado. La utilidad de perfiles se ha establecido en otras situaciones donde el facultativo no dispone de métodos diagnósticos validados (p. ej., en el riesgo de suicidio por alteraciones anímicas durante el embarazo)40. En el presente caso, el Perfil Premenstrual se define como un autorregistro prospectivo diario por ciclo menstrual que tiene los siguientes objetivos:
1. Determinar la ciclicidad de los 3 factores primarios más comúnmente relacionados con la alteración premenstrual.
2. Valorar la percepción subjetiva de estos tres factores de forma objetiva.
La paciente indica a diario la percepción global del grupo de síntomas en cada uno de los tres factores, así como si el síntoma llega a limitar o imposibilitar la ejecución de las tareas habituales. Los datos psicométricos objetivos resultantes se valoran según criterios sintomáticos del DSM-IV además del criterio del NIMH y otros investigadores, como Rubinow y Steiner, que exigen un incremento sustancial (entre el 30 y el 50%) de los síntomas en la fase lútea tardía y de una disminución sustancial de éstos en el comienzo de la fase folicular.
El Perfil Premenstrual se utiliza para recoger datos durante al menos 2 ciclos menstruales más 3 días, con lo cual reflejará los cambios subjetivos en los 3 conjuntos de síntomas, durante 2 fases lúteas enteras y la vuelta de éstas a la fase folicular.
El Perfil Premenstrual se ha validad provisionalmente con una muestra de nacionalidad diversa (n = 20). Está pendiente de validación en población española.
TRATAMIENTOS DE LAS ANOMALIAS PREMENSTRUALES BASADOS EN LA EVIDENCIA
Cada teoría fisiológica en cuanto a la etiología del PMS ha propuesto diferentes métodos de tratamiento. Según una revisión de 1997, los estudios no demostraron beneficio concreto alguno superior al del placebo de las modalidades terapéuticas siguientes41: anticonceptivos orales, vitamina B6, bromocriptina, inhibidores de la monoaminooxidasa, progestágenos sintéticos, espironolactona, aceite de onagra (prímula) y progesterona.
Estos resultados experimentales aparentemente negativos no implican que estas sustancias no produzcan efecto terapéutico, sino que el efecto placebo puede ser tan grande como el efecto médico del tratamiento42. Las recomendaciones terapéuticas comentadas a continuación muestran la difícil dualidad entre los actuales datos experimentales no concluyentes y las posibilidades derivadas de los datos clínicos.
Anticonceptivos orales
El ACOG recomienda el uso de los anticonceptivos orales para tratar el cuadro premenstrual. Numerosos estudios cuestionan la efectividad de los anticonceptivos orales como tratamiento del PMS43 especialmente en cuanto a los síntomas anímicos44, pero nuevos estudios multicéntricos con anticonceptivos modernos de dosis baja (desogestrel, levonorgestrel, drospirenona) indican que unos reducen la dismenorrea y el PMS en general, mientras otros tienen efectos positivos sobre una amplia gama de efectos físicos45-47.
Espironolactona
Es un diurético con propiedades antiandrogénicas y antimineralcorticoides. Varios ensayos adecuados, a doble ciego y controlados con placebo, no lograron demostrar un impacto clínico ni la eliminación de edema, superior al del placebo48,49. Algunos estudios posteriores, sin embargo, revelan un efecto moderado positivo50.
Aceite de onagra
Se ha argumentado que las pacientes con PMS tienen una deficiencia en el metabolismo de ácidos grasos, y se ha recomendado tratamiento con aceite de onagra. Este aceite se extrae de la semilla de la prímula; contiene ácido linoleico y gammalinoleico, que son precursores de la prostaglandina E. En estudios adecuadamente controlados y ciegos, no se ha podido demostrar la superioridad del aceite sobre el placebo51-55.
Progesterona
Siguiendo las recomendaciones de la recién fallecida profesora Dalton56, se solían utilizar inyecciones o supositorios vaginales de progesterona en todo el mundo. Los primeros 4 estudios que no hallaron efectos positivos con este tratamiento fueron criticados por el tamaño de la muestra y la dosis de progesterona57-60. Pero también algunos estudios con un buen protocolo encontraron que ni la progesterona ni el placebo mejoraron los síntomas61-63. En sólo un estudio sobre 23 mujeres altamente motivadas se ha comunicado un efecto beneficioso del tratamiento con progesterona, aunque el mayor efecto se limitó al primer mes de tratamiento64.
Histerectomía y ooforectomía bilateral
Es cierto que no se ha encontrado una causa orgánica de la problemática premenstrual, sino indicios claros de varias causas, entre ellas orgánicas. No se ha podido definir las causas necesarias.
El síndrome sólo lo presentan las mujeres con una funcionalidad intacta, así que la ovariectomía u ooforectomía tanto quirúrgica como química --por supresión de la gonadotropina-- se presenta como una solución para el PMS grave. No todas las mujeres con PMS o PMDD querrán cambiar su problemática premenstrual por una menopausia prematura inducida.
Las respuestas a la histerectomía y la ooforectomía bilateral quirúrgicas en mujeres que no respondían al tratamiento médico son duraderas63,65-72.
En general, la respuesta a la supresión ovárica con un agonista de la GnRH sugiere que los síntomas de PMS representan una respuesta anormal a cambios hormonales normales71.
Suplementos de calcio, magnesio y vitamina B6
En un ensayo controlado con placebo y aleatorizado se encontró que el suplemento de calcio (1.200 mg/día) se asociaba con una disminución del 48% en las valoraciones atribuidas a los síntomas, mientras en el grupo tratado con placebo la reducción fue del 30%72. Algunos estudios posteriores confirman estos resultados, así como los efectos positivos73. El suplemento de magnesio (200 mg/día) y un suplemento con una reducida cantidad de vitamina B6 (50 mg/día) reducían el PMS, sobre todo a partir del segundo mes74,75.
Antidepresivos
La serotonina interviene en la regulación del comportamiento y del ánimo de las personas. Algunos estudios indican que las mujeres con PMS presentan valores bajos de serotonina durante todo el ciclo y, por consiguiente, pueden ser vulnerables al desarrollo de estados disfóricos, como en el PMS o el PMDD. Otros datos parecen indicar que los valores de serotonina pueden verse afectados durante el período premenstrual. Se han publicado ensayos aleatorizados, a doble ciego y controlados con placebo, en los que se obtuvieron resultados positivos tanto respecto a los síntomas físicos como afectivos en hasta un 60% de las pacientes con los antidepresivos fluoxetina, comipramina, sertralina, citalopram, paroxetina y (en menor grado) el ansiolítico alprazolam63,76-82. Los antidepresivos no serotoninérgicos, como maprotilina y desipramina, no presentaron los mismos resultados83. Con fluoxetina se obtenían resultados en un plazo de 2-3 meses, y una dosis de 20 mg de fluoxetina es tan efectiva como las dosis más altas, con menos efectos secundarios asociados76,77,81,82,84.
En un buen porcentaje de casos puede ser efectivo el tratamiento limitado a la fase premenstrual, que puede incluso ser más eficaz que cuando se administra de forma continuada85-87. Los efectos beneficiosos de los inhibidores selectivos de la recaptación de serotonina (ISRS) --aunque no en todos los casos-- sugieren que hay un desequilibrio serotoninérgico, relacionado con los cambios cíclicos en los esteroides gonadales88. Sin embargo, los ISRS sólo modulan lentamente los valores de serotonina, así que no está claro cómo un tratamiento intermitente puede ser eficaz. Aunque los efectos serotoninérgicos parecen más acusados que los noradrenérgicos80, la noradrenalina en plasma no muestra ciclicidad en mujeres con PMS, mientras en mujeres sin PMS es claramente cíclica, con máximos durante la ovulación y la fase lútea inicial. Se observó que los valores de noradrenalina muestran una correlación negativa con cambios de humor y cefalea89. Por tanto, puede que los inhibidores selectivos de la recaptación de serotonina y noradrenalina (ISRNS) tengan un efecto sobre el PMS, diferente de los ISRS. Como alternativa para las pacientes con problemas gastrointestinales u otros a causa de los ISRS, se ha sugerido el hipérico (hierba San Juan), que en un estudio mostró ser efectivo (n = 1)90.
Aunque en 2002 la fluoxetina se autorizó para el PMDD por las autoridades estadounidenses (FDA), en junio de 2003 la Comisión Europea estableció que el trastorno no se encuentra en la clasificación internacional de enfermedades y que en el DSM-IV sólo se describe como un diagnóstico de investigación. La Comisión obligó al fabricante de Prozac, una marca comercial de la fluoxetina, a eliminar el PMDD como indicación del prospecto del fármaco. La FDA también está bajo presión para que tome la misma medida91. Sin embargo, en 2005 autorizó otro ISRS, la paroxetina, para el PMDD.
Además de los ISRS, parecen modestamente efectivos la buspirona y el alprazolam63,92-94. El triptófano reduce los síntomas más que el placebo, pero su uso es limitado por razones de seguridad. En cambio, el litio no produce ningún efecto.
Hábitos alimentarios
Los cambios en la dieta habitual han demostrado una eficacia parcial en ciertos síntomas. Esta eficacia tiene fundamentos biológicos:
-- Una posible deficiencia en los valores de serotonina circulante puede compensarse aumentando la presencia de triptófano mediante la toma de más carbohidratos u otros alimentos altos en triptófano, con lo cual mejorarían los síntomas anímicos.
-- La reducción de ingesta de azúcares refinados y sales reduce la retención de líquidos95.
-- La reducción de ingesta de metilxantinas (café, té, colas, chocolate) reduce la molestia mamaria96.
Fitoterapia
La eficacia del tratamiento fitoterapéutico de la problemática premenstrual con Vitex agnus castus está bien demostrada y recogida en Evidence Based Mental Health (Salud Mental Basada en la Evidencia).
Schellenberg encontró que el tratamiento con 20 mg una vez al día de Vitex agnus o sauzgatillo o pimienta de los monjes reducía en un 50% o más la irritabilidad, la alteración anímica, la ira, la cefalea y el aumento mamario97,98. El extracto actúa como un agonista dopaminérgico, inhibiendo la liberación de prolactina y probablemente incrementando la secreción de estrógenos. La planta contiene flavonoides que se ligan a los receptores benzodiacepínicos y presenta propiedades antidepresivas y ansiolíticas similares a los estrógenos y a la progesterona, cuyas concentraciones descienden durante el período premenstrual, lo que se asocia con la disforia premenstrual98. Un estudio comparativo, prospectivo, doble ciego con fluoxetina y Vitex agnus castus demostró una eficacia comparable (el 68,4 frente al 57,9%), aunque la fluoxetina era más eficaz para los síntomas psicológicos y agnus castus reducía principalmente los síntomas físicos99.
Terapia psicológica
El PMS debe considerarse una condición sociopsicosomática, correlacionada con una ciclicidad biológica. No debe limitarse, pues, al tratamiento farmacológico de los síntomas fisiológicos o anímicos, sino abarcar el tratamiento adecuado de todos los factores implicados. La bibliografía moderna sobre el síndrome hace hincapié en que el médico intente conseguir que la paciente considere los síntomas premenstruales con menor negatividad, instigándole de esta forma a aplicar una especie de terapia psicológica «ligera», aunque su labor sigue enfocándose en la farmacoterapia o la cirugía.
Si los componentes psicológico y social del síndrome representan una influencia tan notable, los tratamientos psicológicos y sociales deben de ocupar un lugar destacado tanto en la investigación como en la práctica clínica, no en versiones light sino de forma profesional y validada100,101.
Hace unos 20 años, Keye y Trunnell combinaron lo que se sabía desde hace tiempo en un modelo biopsicosocial del síndrome premenstrual, con su correspondiente forma de evaluar a las mujeres con PMS sobre la base de seis factores. Aunque su modelo no se adecua del todo a la problemática premenstrual, desde entonces ha ganado terreno la convicción de que, en la mayoría de los casos, no basta con prescribir un fármaco, no es suficiente cambiar hábitos ni tampoco reducir el estrés, sino que debe aplicarse una apropiada terapia multidisciplinaria102,103.
La importancia de lo que se ha identificado como «vías sociales hacia los síntomas premenstruales» se analizó en un estudio publicado en 1995, en que se identificaron tres patrones de síntomas perimenstruales: el síntoma de baja intensidad (PS), el PMS y la magnificación premenstrual (PMM). El análisis funcional discriminatorio por pasos demostraba que la diferencia entre mujeres con PS y con PMM radica en el contexto del estrés vital, la socialización menstrual y las expectativas acerca de los síntomas relacionados con la menstruación. Además, el factor diferenciador entre los tres grupos fue el ánimo depresivo104. Un pequeño estudio español del mismo año estableció que una charla informativa sobre la menstruación tiene un efecto positivo duradero sobre el PMS105.
La ansiedad como rasgo y como estado tiene correlaciones destacadas con la problemática premenstrual. La fase premenstrual suele incrementar el nivel de estrés en las mujeres, tanto si padecen PMS como si no106. En otro estudio, las mujeres con habilidades de resolución de problemas y estrategias de afrontamiento mostraron niveles bajos de dolor premenstrual y menstrual, mientras que las que se confiesan ineficaces en cuanto al control personal presentan altos niveles de malestar premenstrual y menstrual107. El autodiagnóstico de PMS tiene efectos negativos sobre la conducta y los sentimientos108,109. Todo esto demuestra el hecho conocido de que el estrés predispone y aumenta la percepción de estímulos negativos. Por tanto, mejorar la evaluación y las actitudes sociales y personales puede ayudar a reducir la percepción de síntomas aunque no se eliminarán hasta haberse reducido también el componente biológico.
Posiblemente los modelos biopsicosociales del síndrome premenstrual no podrán explicar el origen del problema, sino, a lo sumo, el alcance de la vivencia subjetiva y los factores que en él inciden. Las variaciones biológicas no necesariamente alcanzan valores de anormalidad, sino que contribuyen a un desalojo del organismo de su plataforma homeostásica, con lo cual se crea la base para una sintomatología en los casos donde la persona no tiene los medios necesarios para absorber este desarreglo, bien porque faltan respuestas bioquímicas adecuadas, o bien porque no dispone de habilidades psicológicas suficientes. De esta forma, se especifica la interacción de los factores biológicos, psicológicos y sociales en cuanto a la génesis y el mantenimiento de la problemática premenstrual. Nuestro modelo acepta que hay una base biológica real del problema (el fallo homeostásico), y no trata de achacar la sintomatología a aspectos sociales o psicológicos exclusivamente. La propuesta desengrana la supuesta aparente continuidad entre el PMS y el PMDD, y deja de un lado el PMDD como trastorno anímico específico del período premenstrual y de otro, el PMS como desequilibrio cíclico biológico con componentes sociopsicosomáticos. De este modo, el modelo rechaza la sugerencia de diversos autores de que el PMS implica un «problema comportamental», porque las manifestaciones biológicas pueden ser muy reales. Sólo si se tratara de una problemática de estado de ánimo, que coincida con los criterios diagnósticos del DSM-IV, estaría justificado el diagnóstico de «problema mental».
El hecho de que el PMS tenga un factor psicológico importante no significa que durante la fase lútea tardía la mujer vea mermada sus facultades cognitivas. Aunque algunas teorías sugieren algo parecido, se ha demostrado que no hay una reducción de las capacidades cognitivas en las mujeres con PMS, aunque ellas mismas se sientan más torpes110. Lo que aportó este estudio también es el dato ya comprobado clínicamente por la eficacia de los antidepresivos ISRS, de que la mujer con PMS muestra un estado significativamente más depresivo que el grupo control.
Las mujeres premenstruales se sienten a veces torpes sin serlo, también creen que están más tristes o emotivas en esos días de lo que en realidad son. Los datos prospectivos de un amplio estudio (n = 2.447) demostraron que estas mujeres no lloran más durante el período premenstrual, aunque en sus opiniones retrospectivas decían que sí111.
El tratamiento del factor psicológico del PMS con terapia cognitivo-conductual ha demostrado su eficacia comparada con los conocidos tratamientos farmacológicos112. Una investigación del John Radcliffe Hospital de Oxford determinó que la terapia cognitiva provocaba una remisión casi total a medio plazo de los síntomas psicológicos y somáticos113. Los antidepresivos ISRS se han popularizado por su eficacia relativa, pero varios estudios que compararon los efectos de la fluoxetina con los efectos de la terapia cognitivo-conductual en mujeres con PMDD confirman que esta última es igual de efectiva que la fluoxetina a 6 meses, y más efectiva a 12 meses por haber aprendido estrategias conductuales adaptativas (doping). La combinación de ambos tratamientos no aumentó los beneficios114,115.
Faltan más estudios controlados para verificar la eficacia de las terapias cognitivo-conductuales.
Estrategias conductuales adaptativas(coping): pasos a seguir
El ACOG acordó en 2000, sobre la base de la evidencia disponible en aquel momento, unas recomendaciones que, curiosamente, priman los tratamientos que no gozaban de apoyo científico suficiente, pero que se consideraban clínicamente mejores entre las alternativas disponibles. Dichas recomendaciones se dividen en 3 grupos, según el nivel del apoyo científico que tienen, para concluir con los 3 pasos en que debe estructurarse la aproximación clínica que, según el ACOG, empieza por los tratamientos más livianos, aunque de menor nivel de evidencia. Se trata, por tanto, de una «intuición clínica compartida», solo parcialmente respaldada por hechos experimentalmente comprobados.
La AAFP y el ACOG, como se refleja en las tablas 4 y 5, consideran que a todas las pacientes con PMS inicialmente se debe ofrecer tratamiento no farmacológico, incluidos los tratamientos sociopsicológicos, como son: educación de la paciente, terapia de apoyo y cambios de conducta116. Aun así, no han llegado a un consenso en cuanto a la definición del PMS o de sus características diagnósticas. Tampoco se han adaptado las recomendaciones de tratamiento a la evidencia disponible.
En 2005 la SEGO publicó un Informe de Consenso que, tanto en su descripción de la problemática como en las recomendaciones de tratamiento, dista notablemente de los consensos estadounidenses y británicos referidos, así como los datos experimentales más recientes. Es necesaria una unificación de criterios diagnósticos y pautas de tratamiento (tablas 6 y 7).
CONCLUSION Y RECOMENDACIONES CLINICAS
La ciclicidad ovárica de la mujer en edad reproductiva afecta a diversos parámetros fisiológicos, hormonales y neurológicos, lo cual produce una sintomatología premenstrual diversa sin causa única específica. Los problemas clínicos que resultan de ella pueden mermar notablemente la calidad de vida, o bien impedir la funcionalidad de la mujer durante un tiempo de varios días antes de la regla. Los desarreglos hormonales cíclicos pueden ser una de sus causas, pero se han identificado otras, entre ellas una especial sensibilidad a la retirada (parcial) de sustancias hormonales o neurosteroideas relacionadas con los cambios cíclicos. Además, la gravedad percibida de los síntomas depende de las habilidades psicológicas de la persona y, por tanto, de una valoración sujetiva (fig. 2).
Figura 2. Algoritmo diagnóstico de síntomas premenstruales (PS), síndrome premenstrual (PMS) y trastorno disfórico premenstrual (PMDD). (Modificado de Campagne et al, 2004.)
Las 2 vertientes «anormales» de los cambios premenstruales son el PMS y el PMDD. El requisito indispensable para el primero es la presencia de síntomas biológicos y posiblemente anímicos, mientras que el segundo requiere la presencia dominante de síntomas anímicos. El primero produce una considerable merma de la calidad de vida, mientras el segundo ocasiona necesariamente la disfuncionalidad durante unos cuantos días. En la figura 2 se incluye un algoritmo clínico elemental relacionado con ello.
Si el diagnóstico inicial es de PMDD, el facultativo debe remitir o al menos consultar al especialista en psiquiatría, para el adecuado tratamiento de este (provisional) trastorno mental. La revisión actual de Grady-Weliky117 establece una orientación sobre el tratamiento clínico del PMDD.
En otros muchos aspectos el PMS y el PMDD pueden compartir elementos. Es importante que se establezca y se tenga presente la distinción clínica entre ambas «anomalías», para evitar que se aplique, sin razón fundada, el estigma de «trastorno mental» o «anomalía comportamental» a la mujer que padece el PMS. Es imprescindible, además, que se verifique, mediante el diagnóstico diferencial, que la sintomatología no se deba a otras causas, como podría ser la exacerbación durante la fase premenstrual de cuadros psíquicos o físicos subyacentes. A tal fin es de obligado uso un registro de los síntomas premenstruales durante al menos 2 ciclos completos.
Finalmente, se necesita más investigación en cuanto a los efectos de los fármacos, la fitoterapia, los tratamientos psicológicos y de otras intervenciones de los que ya se ha evidenciado su eficacia, con el fin de determinar un algoritmo de tratamiento clínico multifactorial y multidisciplinario. Hasta entonces, el clínico puede guiarse por las recomendaciones y evidencias que se recopilan en las tablas 5-7.
Correspondencia:
Dpto. Personalidad. Universidad a Distancia (UNED). Ciudad Universitaria, s/n. 28040 Madrid. España.
Correo electrónico: danplaton@hotmail.com
Fecha de recepción: 22/4/05.
Aceptado para su publicación: 16/3/06.