PREAMBULO
Es una realidad que la relación de los profesionales de la medicina --y entre éstos el especialista en ginecología y obstetricia-- con la industria farmacéutica y la de productos sanitarios es muy estrecha, basada en principios de información y promoción, pero abarca además otras áreas más genéricas y de más impacto en la competencia profesional, a través de las acciones de formación continuada. Esta relación tiene una serie de claroscuros que en nada benefician a unos y a otros, motivo por el que la Sociedad Española de Obstetricia y Ginecología (SEGO), a través de su Comisión de Bioética, quiere hacer un análisis de ella, anteponiendo los principios éticos a todos los demás.
La industria farmacéutica y, en menor proporción, la de productos sanitarios, se ha transformado en el proveedor de formación médica continuada (FMC) más significativo, ejerciendo funciones propias de otras entidades de ámbito sanitario, en la práctica inexistentes o con actuaciones escasas. Esto posibilita la actuación de la industria en parcelas que no serían en principio de su incumbencia, y hace que el médico reciba una formación potencialmente sesgada, no sólo en términos de contenidos, en algunas ocasiones de manera notable, sino también de oportunidades, es decir, con desviación en su formación hacia temas cercanos a los intereses industriales. Por tanto, aún a pesar de todas las excepciones posibles y siempre loables, la FMC en nuestro ambiente está desvirtuada.
Las sociedades científicas, sensibles a esta problemática, han querido subsanar este déficit desde hace un tiempo, diseñando estrategias formativas que palien las necesidades del sector. Sin embargo, ante la insuficiencia de medios disponibles, la financiación de los planes formativos recae, en multitud de ocasiones, sobre la propia industria, quien de manera sutil puede marcar, en algunas ocasiones, la hoja de ruta del proceso, lo cual debilita dicha estrategia.
Así pues, para el profesional sanitario, la industria desempeña un papel que va más allá de la fabricación de un producto, como puede ser el medicamento, que alivia el dolor, salva vidas, cura y previene enfermedades y, en definitiva, contribuye a mejorar la calidad de vida y la salud pública. El médico reconoce la contribución del sector farmacéutico y el de productos sanitarios a la I+D pública y privada, así como el valor añadido que dicha investigación biomédica aporta a la sociedad. Además, los profesionales sanitarios hallan, sobre todo en la industria farmacéutica, una fuente de información constante y actualizada sobre el abordaje terapéutico más apropiado y novedoso de las enfermedades a las que deben hacer frente en su quehacer diario.
Este documento se inicia con una introducción sobre el papel que desempeña la industria en el campo investigador, haciendo hincapié en la transparencia investigadora que debe primar en todo momento. A continuación analiza cómo la información se transmite al médico y cómo éste la interioriza, revisando los mecanismos incentivadores tanto desde la óptica del profesional, para tener el acicate de mantener su competencia profesional, como desde la óptica de la industria, a través de las estrategias del marketing. Se revisa de manera muy particular los límites de éste, citando de forma explícita dos artículos del Código de Buenas Prácticas de Farmaindustria. Finalmente, se exponen las conclusiones. El documento se complementa con 3 anexos:
Anexo I. El medicamento. Cómo se genera. Controles.
Anexo II
a. El Código Español de Buenas Prácticas para la promoción de los medicamentos.
b. Aplicación del Código.
Anexo III. FENIN, Código de Buenas Prácticas.
LA INDUSTRIA COMO FUENTE DE INVESTIGACION
Hoy en día, es indudable que una importante cantidad de investigación, tanto básica como aplicada, está financiada por entidades no libres de intereses, ya sean políticos, económicos, religiosos, etc. Actualmente hay poca investigación no finalista, es decir, no interesada en una serie de campos con un gran componente de utilidad, no estrictamente científica, de manera que se ha creado una cierta desarmonía entre las distintas parcelas estudiadas. Un ejemplo de ello es el gran interés despertado por la introducción de determinada tecnología (p. ej., la de la imagen), mientras se dedican muy pocos recursos para planes de prevención de la prematuridad o del transporte materno/fetal, o para ciertos aspectos de la investigación básica, como el inicio del parto, el desarrollo embrionario, etc. Es una obligación de la SEGO, en tanto sociedad científica, denunciar los intereses economicistas de las investigaciones, así como el poco rigor exigido en las publicaciones procedentes de ciertas áreas de influencia o las editadas en publicaciones poco contrastadas, muchas veces esponsorizadas por la propia industria. Las entidades científicas, juntamente con las autoridades gubernamentales, tienen la obligación de velar para que se cumplan los requisitos de la verdad científica. Tal como ocurrió en los albores de los años cincuenta, ahora hay que realizar un importante esfuerzo para reivindicar la ciencia como tal y no como herramienta en manos de intereses ajenos a la medicina.
La industria farmacéutica y la de productos sanitarios no dejan de ser entidades comerciales que, legítimamente, mediante la producción de un bien, intentan conseguir unos beneficios financieros. Sin embargo, su competencia y competitividad frente a terceros se basa en la consecución de un buen producto, que sea eficaz para lo diseñado y efectivo, aplicable y eficiente, es decir, al mínimo coste.
Todo ello es un propósito que cada vez es más difícil y que requiere un gran esfuerzo. Este esfuerzo está directamente relacionado con la posibilidad de conseguir, mediante investigaciones propias o en colaboración, una molécula novedosa, suficientemente segura, que aporte beneficios en la salud de los pacientes. Como es lógico pensar, estas investigaciones son cada vez más complejas, sofisticadas y costosas. Llegar a conseguir una nueva sustancia es el fruto de muchos años de investigación, más de 10 de promedio y a un coste muy alto, dado que cada ensayo, desde la fase 1 hasta la fase 4, tiene unos costes de procedimiento cada vez más elevados. Como ejemplo, de cada 100 líneas de investigación iniciales, probablemente sólo 2 o 3 llegarán a un nivel aceptable como para poder pensar en su comercialización, previa aprobación por parte de las agencias evaluadoras de las distintas Administraciones sanitarias.
Todo ese camino convierte a la industria, especialmente la farmacéutica, en el paradigma de las entidades investigadoras, en las que partiendo de una idea abstracta, gracias a todo un gran proceso de ingeniería química, se llega al diseño de una familia molecular. Cada pequeño paso hacia la meta final requiere un gran esfuerzo investigador y, por ello, este tipo de industria constituye una de las fuentes de investigación más ricas de las que disponemos. Además, en cada nivel investigador, desde el nivel básico hasta los clínicos, se utilizan escenarios y elementos muy diferentes. En los primeros niveles, el esfuerzo del laboratorio y de la investigación con animales es fundamental. La tecnología utilizada es muy vanguardista, y no es raro que los laboratorios dispongan de grandes científicos dentro de su equipo investigador, con gran generosidad de medios. Sin embargo, no es raro que se produzcan sinergias con empresas investigadoras, o con centros universitarios, que realicen parte de la investigación con el concierto económico correspondiente.
Por tanto, las características que mejor pueden definir la investigación que lleva a cabo la industria farmacéutica son las siguientes:
-- Su larga duración. La investigación de un medicamento dura una media de 10-12 años.
-- Es una actividad de alto riesgo. De cada 10.000 moléculas que se empiezan a investigar, sólo una será finalmente registrada y autorizada, y sólo 3 de cada 10 medicamentos comercializados producen beneficios que superan los costes de I+D.
-- Es muy costosa. Obtener una nueva entidad química medicamentosa tiene un coste que puede superar los 800 millones de euros.
-- Es muy compleja. Requiere el concurso de varias disciplinas y un gran número de profesionales (médicos, farmacéuticos, biólogos, estadísticos, ingenieros, químicos, epidemiólogos, juristas y economistas, entre otros).
-- Está sometida a una gran competitividad, ya que los fármacos innovadores experimentan una cada vez más rápida competencia de los genéricos.
-- Se enfrenta constantemente a nuevas dificultades. La industria farmacéutica es la principal fuente de esperanza ante nuevos retos al ser la que investiga, desarrolla y produce las nuevas aportaciones terapéuticas. Además, debe hacer frente al desafío de una sociedad cada vez más informada, que incrementa cada día sus demandas y exigencias a las administraciones públicas en materia de salud, las cuales las trasladan a la industria. Junto a esto, las nuevas tecnologías, la biotecnología y la genómica elevan aún más la presión de la sociedad para mejorar y prolongar la calidad de vida de los ciudadanos.
Por tanto, se está hablando de una industria basada fundamentalmente en la investigación, pero que tiene como connotación la consecución de beneficios financieros. No es raro que en ciertas ocasiones, la presión financiera mediatice la propia investigación en sí, distorsionando el proceso, lo que podría conducir a productos no siempre seguros o pertinentes. En los últimos tiempos, lamentablemente, se han vivido ejemplos poco satisfactorios en este aspecto y han surgido informaciones sobre los efectos adversos de diversos fármacos en nuestra especialidad, que probablemente no hubieran aparecido si la presión financiera no hubiese mediatizado la metodología investigadora de una molécula determinada. Una información reciente manifestaba que en Estados Unidos cada año mueren 100.000 personas debido a los efectos adversos de los medicamentos, lo cual hace pensar que se ha obviado algún paso en el largo recorrido investigador o que no se ha aplicado la tecnología adecuada en los distintos modelos de investigación. Tal como mencionamos anteriormente, el promedio de tiempo invertido es de 10 años. En ese tiempo, la tecnología y los avances fisiopatológicos son de tal calibre que, con mucha probabilidad, las bases investigadoras pueden haber quedado obsoletas y los resultados obtenidos no ser tan fiables como se consideraron en su momento y sobre los que se basaron los pasos siguientes. De ahí que, en ciertas ocasiones, se ha podido observar que algunos fármacos, muy bien estudiados, en un momento dado son capaces de acompañarse de efectos no esperados que pueden invalidar su eficacia.
La industria, que ha vivido ese ejemplo varias veces, intenta paliar los errores basándose en investigaciones de primer orden, realizadas con las máximas garantías, tanto científicas como tecnológicas, lo que redunda en unos costes astronómicos, pero que, sin lugar a dudas, hacen avanzar el conocimiento global. Por todo ello, en este tipo de desarrollo industrial se une ciencia con economía, dado que el fallo de la primera constituiría el desastre de la segunda. Todos hemos sido testigos de verdaderos derrumbes comerciales, especialmente bursátiles, cuando un fármaco ha demostrado su peligro o su ineficacia, lo que indudablemente no debería suceder. Es lógico, pues, que sea la propia fuente financiera la más interesada en conseguir en estos momentos que los resultados de la investigación sean intachables y que las conclusiones de los estudios iniciales se ajusten fielmente a los resultados obtenidos.
La introducción y el conocimiento de la biotecnología y la farmacogenética han representado uno de los avances más significativos de las últimas décadas y ya se está cerca de conseguir moléculas específicas para cada persona y con acciones biocontroladas. Cada vez más, determinadas áreas de la patología llegarán a ser más fármaco-dependientes. Ejemplo de ello es la patología oncológica, en la que los avances terapéuticos a través de los medicamentos han sido espectaculares.
TRANSPARENCIA INVESTIGADORA
En los últimos años ha aparecido un sinfín de moléculas farmacológicas, cuyos resultados han sido presentados a la comunidad científica a través de diversos canales de información. Como se ha dicho anteriormente, la obtención de una nueva entidad farmacológica requiere inexorablemente toda una serie de pasos investigadores, que a grandes rasgos se han denominado fases (normalmente, fases 1-4), sin lo cual las administraciones sanitarias vinculadas al medicamento no aceptan las eventuales acciones farmacológicas positivas o negativas de una determinada molécula.
Sin embargo, no siempre los resultados presentados gozan de la transparencia requerida. Ensayos muy bien diseñados y presentados en distintos foros, o divulgados a través de los canales científicos habituales y de gran prestigio, pueden carecer de la información completa de todo el proceso, magnificando algunas acciones (positivas o negativas, en función de la industria pertinente) y/o no reportando todos los efectos favorables o desfavorables que la molécula puede tener. Esto hace que el profesional poco avezado en esas lides pueda asumir unos resultados que, en realidad, podrían ser discutibles desde la óptica del beneficio-riesgo-fracaso.
Este planteamiento pone sobre la mesa un problema muy interesante que circunscribe la responsabilidad en la transparencia. Es obvio que en este campo ha habido mejoras sustanciales, y ahora la mayoría de las legislaciones sanitarias y del medicamento obliga al análisis metodológico estricto por parte de agencias ad hoc antes del inicio de cualquier proyecto de investigación, con lo que se ha obviado una gran cantidad de sesgos metodológicos, mejorando, en definitiva, el producto final. Fruto de ello ha sido la posibilidad de generar incluso niveles de evidencia y/o grados de causalidad. Todo ello era poco común hace unos lustros. Sin embargo, el problema continúa persistiendo cuando se ha finalizado la investigación. Hay poca cultura de evaluación de los resultados de las investigaciones a través de las agencias de evaluación, y la mayoría de ellas basa sus conclusiones en la información proporcionada por el equipo investigador. Por tanto, parecería correcto que el propio equipo asumiera la responsabilidad de la transparencia, con el fin de que las agencias externas evaluasen si las conclusiones ofrecidas están acordes con los resultados obtenidos. Todo ello parece lógico. Sin embargo, muy pocas veces se brinda toda la información, a veces muy farragosa, que solamente controla el monitor y de la que se responsabiliza el investigador principal. No ha sido una rareza que algún efecto deletéreo observado no haya sido identificado como tal hasta pasado un tiempo, a veces excesivamente largo, cuando ya ha causado males, en ocasiones, irremediables. Recientemente, hemos tenido ejemplos muy elocuentes de lo dicho hasta ahora, procedentes de ensayos muy bien diseñados y, en principio, totalmente transparentes. Sin embargo, los problemas finalmente han aparecido.
Todo lo expuesto conduce a la conclusión de que la transparencia se puede conseguir, pero desde distintos puntos de origen. No siempre, por diversos motivos, cada uno de los elementos implicados cumple escrupulosamente con las premisas mencionadas. Por todo ello, se debe hacer una llamada de atención colectiva a los comités de ensayos, grupos investigadores, promotores, agencias de evaluación, canales de comunicación, etc., para que los preceptos de la transparencia se cumplan.
El profesional de la medicina, en la mayoría de las ocasiones, no tiene la preparación adecuada para hacer el análisis que le permita la elección pertinente de una molécula sobre otra, y basa su decisión en la información proporcionada. Casi siempre tal acción la realiza la propia industria a través de sus distintos canales de información y de marketing. Con el fin de dar una calidad supuesta, informa de los efectos beneficiosos, dejando al margen los efectos adversos o minimizándolos, que a veces son tan importantes como los primeros. Actualmente, la propia industria farmacéutica ha intentado regular esta acción a través de su Código de Buenas Prácticas. Efectivamente, ha habido ejemplos muy encomiables de transparencia. Sin embargo, eso no siempre ha ocurrido así. De manera similar, podríamos citar el Código de Buenas Prácticas de Fenin, en relación con el producto sanitario.
Otro apartado poco elaborado es el de los fracasos o de los efectos placebo. Hay habitualmente poca transparencia en relación con los fracasos, que quizá deberíamos definir de forma previa. Se entiende como fracaso la acción esperada y no obtenida, que es distinto de los efectos indeseables. Un fracaso no es un efecto placebo, ni tampoco una complicación, siempre y cuando no se asocie a un empeoramiento del proceso por la falta de eficacia. Un ejemplo paradigmático de ello sería el tratamiento con un antibiótico para un germen no sensible a él, o con una dispensación incorrecta. El proceso empeoraría debido al fracaso. Muy pocas veces se habla de este tema en los ensayos clínicos. Es importante recalcar que ninguna molécula, por causas diversas, tiene un efecto total y únicamente beneficioso, y es necesario tener presente la falta de respuesta a una acción esperada, con el fin de plantear alternativas.
En resumen, quisiéramos hacer un llamamiento a las agencias evaluadoras de todo el proceso y a las sociedades científicas, para que ayuden a conseguir la transparencia en la información sobre los productos de las industrias tanto de medicamentos como de productos sanitarios, dado que de su actividad se derivarán las decisiones de los profesionales para con sus pacientes.
La SEGO, desde hace tiempo, a través de documentos de consenso, de documentos de bioética o de comunicados específicos, ha ido proporcionando información científica a sus afiliados sobre diversas problemáticas surgidas en el ámbito de la dispensación o utilización de fármacos y de material médico. Esa información, elaborada de forma independiente, ha sido una de las maneras más eficaces de brindar al ginecólogo un elemento de ayuda de inestimable valor en su toma de decisiones.
COMO RECIBE EL MÉDICO LA INFORMACION
La FMC es una parcela inherente al ejercicio profesional del posgrado y complementa, en todo momento, los contenidos doctrinales, las habilidades y las actitudes de los médicos. Sin embargo, no está claro sobre quién recae la responsabilidad de tal acción. Para unos sería de la Administración sanitaria, para otros de las sociedades científicas, y para los más de las empresas proveedoras de servicios. Pero de lo que no cabe ninguna duda es que ha de ser el propio médico quien exija la formación necesaria para poder continuar siendo competente.
La industria se ha transformado en uno de los proveedores de FMC más significativos, ejerciendo funciones propias de otras entidades. Las administraciones sanitarias se han caracterizado por la dejación de funciones que les correspondería cumplir en multitud de campos y áreas de conocimiento, en el terreno de la FMC. Es una realidad que la empresa de servicios sanitarios más importante de nuestro Estado es la Administración sanitaria (Ministerio de Sanidad y Consumo y consejerías de sanidad y salud de las distintas comunidades autónomas) y, paradójicamente, en términos de inversión real en FMC le corresponde un porcentaje ínfimo, en comparación con los recursos invertidos por las industrias farmacéutica y de productos sanitarios, así como por las sociedades científicas. Los unos por sus intereses particulares y los otros por la falta de inversiones han dado lugar a que un proceso de tal envergadura e importancia esté bajo control, sobre todo económico, del sector privado. Las administraciones sanitarias han creído que con el simple control acreditativo, que en realidad debería ser competencia de las sociedades científicas, cumplen con su obligación. Y nada más alejado de la lógica en un sistema sanitario tan socializado como el nuestro. Hay muy pocas empresas que dejen la responsabilidad de todo el proceso de formación continuada de su personal a una entidad ajena y sin apenas control. Ha de recordarse aquí la importante cantidad de bibliografía que demuestra que la eficiencia y la calidad de los servicios están directamente relacionadas con la inversión en formación continuada de sus miembros. Y en nuestro ambiente, la mayor parte de la FMC recae, tal como ya se ha dicho, en la industria privada. Es justo reconocer que su papel se ha visto reforzado en la medida en que las otras instituciones no han realizado su función de manera adecuada.
El profesional médico también ha reivindicado en multitud de ocasiones que su FMC estuviese diseñada y ejercitada por las empresas sanitarias para las que brinda sus servicios. La óptica del médico en este punto es meridiana. Cuando se trata de definir y estipular un programa, no una actividad única, de FMC, el especialista entiende que la responsabilidad ha de ser de la sociedad científica como proveedora de servicios, con financiación pública de la Administración sanitaria. Ésta es la razón por la que, desde hace tiempo, las sociedades científicas, sensibles a esta problemática, han querido obviar el déficit diseñando estrategias formativas que palien las necesidades del sector.
Por otra parte, la globalización de la economía ha hecho que las fuentes de financiación de la FMC se hayan concentrado en grandes instituciones supranacionales, con intereses ajenos y/o lejanos a los del escenario para el que fueron diseñadas, perdiendo con ello un valor intrínseco importante. Esta afirmación no quiere decir que se esté frontalmente en contra de los procesos evolutivos económicos del entorno, pero vale la pena hacer una llamada a los responsables para que el interés común y colectivo no menoscabe el interés de las minorías ni de los colectivos genuinos. Éste es un peligro que la sociedad científica ha de saber y poder vigilar. No ha de pensarse sólo en la formación médica de los profesionales de los grandes hospitales o de los centros primarios, sino también en la existencia de colectivos minoritarios: la medicina de guerra, los profesionales que tratan a los colectivos marginales del cuarto mundo, los médicos especialistas dedicados a las enfermedades de los inmigrantes, etc. Muchas veces son precisamente estos últimos colectivos los que necesitan una mayor inversión.
Ni que decir tiene que se ha de velar para evitar la FMC interesada. La industria, con el fin de conseguir sus objetivos comerciales, que por otro lado son legítimos, suele utilizar la FMC para sus propios intereses. Los cursos sobre determinados equipos ecográficos, material de endoscopia, etc., son simples ejemplos. Aquí, la sociedad científica ha de tener un papel preponderante y pactar con la industria una metodología que pueda satisfacer a todas las partes interesadas, pero preservando el principio de la verdad científica. El médico, que a veces está ajeno a los intereses en juego, puede ser embaucado por el falso artilugio o por el sensacionalismo de un resultado que, a la hora de la verdad, es inexistente o al menos mucho menos efectivo de lo esperado. La rigurosidad en la acreditación de esas actividades debe ser misión de la sociedad científica correspondiente.
Por todo lo dicho, la información científica se convierte en el cordón umbilical de la relación entre la industria y el médico.
Insistimos en que la actualización de conocimientos científicos que necesita el facultativo para el ejercicio de su profesión la recibe, en muchas ocasiones, de las diferentes industrias, directamente a través de la visita al médico o de reuniones científicas, como cursos, simposios, etc.
Por tanto, la industria lleva a cabo una importante labor en la formación de los profesionales sanitarios que, de otra manera, por las características y las limitaciones especialmente presupuestarias del Sistema Nacional de Salud, verían significativamente limitado su acceso a una información que les resulta de vital importancia para el mejor desarrollo de su actividad profesional. No debe olvidarse que la formación de los médicos es una garantía del cumplimiento de los derechos de los pacientes y que éstos puedan acceder a las mejores opciones terapéuticas disponibles en cada caso, como exigen los principios de equidad y justicia.
De todo lo dicho se deduce que, actualmente, corresponde a la industria el mérito fundamental en materia de formación de los profesionales sanitarios. Esto no significa que no haya margen para la mejora y que la industria no trabaje para que la promoción de los productos a los profesionales sanitarios se base cada día más en principios de profesionalidad y responsabilidad.
Recordemos que la adquisición de conocimientos y la información pueden realizarse por dos vías:
-- El autoaprendizaje, mediante el estudio, la visita de centros o las conversaciones más o menos formales entre colegas.
-- La formación estructurada, compuesta por cursos, simposios, congresos, etc., a los que los profesionales acuden con objeto de adquirir determinados conocimientos o habilidades.
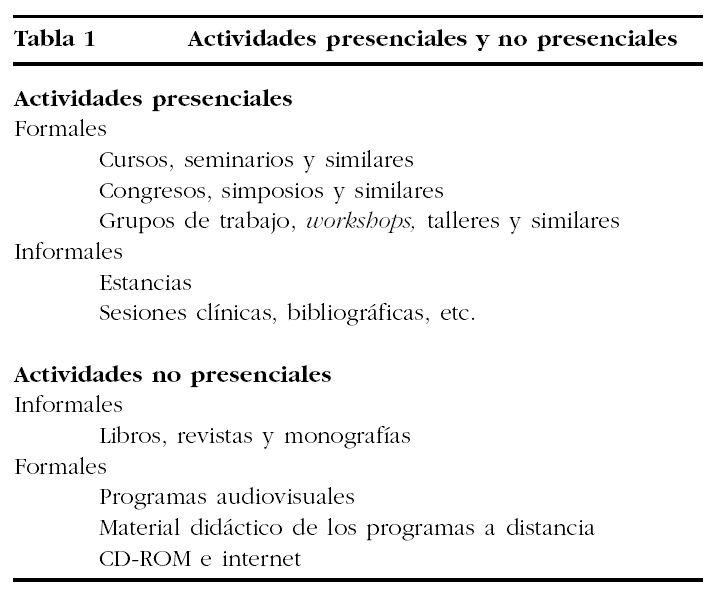
Habitualmente, la clasificación de las actividades de formación continuada e información puede realizarse sobre la base de distintos criterios. El más frecuente es el que se basa en el carácter presencial de estas actividades (tabla 1).
Si se observa cada una de estas actividades, apreciaremos que muchas de ellas están facilitadas y controladas por la industria, con excepciones bien notorias, como las que realiza nuestra sociedad científica.
Otro aspecto que cabría comentar es la problemática que plantea la asimilación de los conceptos. Cada sujeto puede asimilar conclusiones distintas en función del nivel del que se parte. Esto conlleva que la información ha de ser suministrada de manera muy profesionalizada para que pueda utilizarse pertinentemente por el médico en beneficio del paciente. De esto se deduce que deban estipularse medidas evaluativas que informen del grado de asimilación, lo que tiene interés tanto para el propio proveedor de la información como para el sujeto que la recibe. Para el primero si la estrategia y técnica utilizada es la adecuada. Para el segundo si ha valido la pena el esfuerzo y, en último extremo, si le es útil para su ejercicio diario. En todo momento la información, y con ello la formación, debe tener como objetivo final prioritario la mejora de la competencia profesional.
La Union Européenne des Médecins Spécialistes (UEMS) estipula que la FMC ha de estar organizada, realizada y supervisada por los propios profesionales, completamente independientes de las fuentes de financiación, así como de los diversos grupos de opinión, los intereses políticos y económicos, las entidades aseguradoras, el gobierno y las universidades. Además, ha de ser voluntaria, aunque incentivada, y solamente será útil si afecta a la práctica diaria. Un punto de interés capital es cuando remarca que la calidad ha de estar controlada por los propios profesionales, preferentemente mediante comités, en los que estén representadas las sociedades científicas, las universidades y los colegios médicos. Cabe destacar que la entidad europea correspondiente no descarta ningún elemento o pilar, e integra a todos en un esquema tripartito, si bien los profesionales son los que lo organizan, realizan y supervisan, independientemente de otras entidades que puedan caer en el dirigismo.
Un aspecto de enorme interés es la incentivación del profesional para que se acoja a los programas de FMC, lo que no debe confundirse con los incentivos o las estrategias incentivadoras que diseñan las empresas para sensibilizar al profesional.
Vale la pena analizar los dos aspectos. La incentivación del profesional para mejorar su competencia a través de programas de FMC y los incentivos de las empresas (marketing y sus límites).
LA INCENTIVACION DEL MÉDICO
En puridad, debería ser una buena forma de incentivación considerar que con una mejor capacitación se realiza una praxis mejor, convirtiéndose la práctica médica satisfactoria en el elemento más incentivador. En este sentido la Administración debería superar ciertas actitudes desmotivadoras del ejercicio profesional.
Como elementos incentivadores pueden aceptarse el soporte económico, la promoción del trabajo en equipo, la incorporación en el diseño de programas de FMC, docencia e investigación, la eliminación de barreras dentro de los sistemas y, por supuesto, la baremación pertinente con la incorporación debida de la FMC.
La razón de la incentivación es conseguir los objetivos de la FMC, lo cual solamente se conoce a través de un proceso evaluativo de su impacto. No cabe duda de que un esfuerzo personal y colectivo de esta envergadura ha de tener un resultado adecuado objetivable. Para poder realizar la correcta evaluación, se han de marcar los objetivos, que deben ser cuantificables y mensurables. Es más, se han de establecer los indicadores pertinentes, definiendo hasta qué nivel de objetivo cumplido puede aceptarse (sobre la base de un criterio, establecer un estándar). La evaluación ha de poder analizar y detectar zonas de mejora en todos los sentidos: en los aspectos docente y discente, así como en la propia estructura, como los elementos técnicos disponibles de audiovisuales, zonas hospitalarias, etc.
Esta tarea evaluadora es de primordial importancia en el proceso incentivador y, en definitiva, es su colofón final. Es obvio que, en la medida del grado de incumplimiento, se ha de establecer un círculo de control de calidad, revisando cada uno de los elementos y pasos establecidos. El círculo debe iniciarse en el propio candidato: ¿los criterios de inclusión eran los pertinentes?, ¿se requería un nivel de competencia previo que el candidato no tenía?, ¿se solicitaba un tiempo de dedicación que no se podía alcanzar? Todo ello podría conducir a que el candidato no fuese adecuado al programa. Por otra parte, quizá el programa o la actividad de FMC no era la adecuada para el objetivo. ¿No era adecuada por el contenido o por la forma? Cuando decimos forma, nos referimos al método docente más participativo o más pasivo. Es necesario aclarar si el docente realizó la función adecuadamente. Como puede comprenderse, hay toda una serie de variables que puede influir en el indicador del resultado.
Por último, no cabe olvidar el grado de cumplimiento del candidato, que a su vez ha de evaluarse. Hay diversos métodos de control del cumplimiento, acordes con cada actividad realizada, desde la contestación de cuestionarios hasta el simple control de presencia, etc.
EL MARKETING Y SUS LIMITES
La definición de marketing o mercadotecnia de la Real Academia de la Lengua muestra que se trata del «conjunto de principios y prácticas que buscan el aumento del comercio, especialmente de la demanda».
No cabe ninguna duda sobre las intenciones de las acciones del marketing. Sin embargo, debe estar sujeto a unas limitaciones.
La industria utiliza muchas veces la información como herramienta de marketing de un producto determinado. No obstante, una cosa es la información científica de una molécula o utensilio determinado y otra es la manipulación de esa información. En ese terreno, especialmente, es donde deben establecerse los límites. La información ha de ser veraz, completa, transparente, adecuada al profesional y establecer de manera ponderada las cualidades de la molécula, o del instrumento médico, de acuerdo con los resultados de la investigación que la sustenta. No cabe resaltar un efecto determinado en detrimento de un efecto secundario o adverso, ni debe generalizarse un resultado cuando el beneficio se obtiene bajo unas circunstancias concretas. Todos estos hechos son los que configuran las acciones de marketing correctas.
No debe olvidarse que, en muchas ocasiones, el profesional recibe por parte de la propia industria la información correspondiente a una sustancia o instrumento. En pocos casos es el propio profesional el que obtiene la información de las fuentes del conocimiento habituales, como publicaciones, revistas, comunicaciones a congresos, etc. Tal como se mencionaba en el apartado anterior, la transparencia investigadora ha de estar preservada para que la información sea la correcta. Pero si a ello le sumamos que es la propia industria la que canaliza la información incluida en la ficha técnica oficial, es posible que la información llegue sesgada o incompleta, lo cual debe evitarse a toda costa.
La definición de marketing incluía además la posibilidad de utilizar un «conjunto de prácticas», lo cual implica otro tipo de connotaciones que prefiguran los límites del marketing. En no pocas ocasiones, la puesta en escena de un nuevo fármaco o utensilio médico ha ido acompañada de grandes esfuerzos incentivadores por parte de las empresas con el fin de introducir en el mercado el producto y rentabilizar, mediante sus beneficios, la inversión. Estos esfuerzos pueden ser muy variados y pueden incluir muchas formas distintas. Por ejemplo, anteriormente se ha analizado la calidad de la información, pero es necesario también evaluar la manera de transmitirla. Es decir, en no pocas ocasiones, se ofrece al profesional un conocimiento del producto disfrazado de conferencias o cursos o presentaciones científicas, que sitúan al médico en el centro de todo el proceso, enmarcado además, con la atracción adicional de un entorno festivo o turístico, lo que crea un clima de acercamiento hacia el producto, que en definitiva es lo que se pretende. Cuántas reuniones «científicas» se han organizado en indiscutibles parajes turísticos, con viajes muy amenos y con gastronomías incomparables, pero con el fin de intentar inducir o provocar la decisión de la prescripción de un fármaco o la utilización de un aparato. Todo ello, sin duda, con la complicidad del propio médico asistente.
Farmaindustria, en un gesto loable y muy bien recibido por las sociedades científicas, ha creado la Unidad de Supervisión Deontológica, con el fin de supervisar el cumplimiento y aplicación del Código Español de Buenas Prácticas para la Promoción de los Medicamentos, que define de manera diáfana los límites de la promoción. No todo es válido en el marketing y no todo es aceptado por la propia industria. Este acotamiento de actuaciones y actividades es una de las mejores acciones que tanto el profesional como la industria pueden realizar para establecer una relación ética entre ellos. Es lógico que se haga promoción incentivadora de una sustancia y que se establezca una competencia sana entre distintos proveedores. Al fin y al cabo, en tanto industria, se ha de rentabilizar un producto. Pero también es lógico y éticamente exigible que no se transgredan los límites. A la postre, toda acción desmesurada significa costes adicionales que alguien ha de sufragar, y ese alguien es la sociedad en su conjunto, ya sea directamente el paciente, la Administración sanitaria o la corporación correspondiente. Es decir, se va a pagar mucho más por un producto, dado que lo que no es esperable es que se reduzca el margen de beneficio.
Es cierto que en estos momentos la Administración ha fijado una serie de precios de referencia, que dejan menos capacidad de maniobra a las empresas farmacéuticas, provocando con ello una contención del gasto en acciones de marketing, con lo que si se une el Código con la reducción de ingresos, se podría abocar a una promoción más responsable y objetiva. Junto con la aparición de los genéricos, ciertas acciones han ido desapareciendo y, en cambio, se ha ido de nuevo a las fuentes del conocimiento. Ése es el camino correcto. En este sentido, cabe reforzar la idea de la información proporcionada por fuentes distintas de la propia industria, como las agencias de evaluación sobre las que recae la responsabilidad de aportar a los profesionales el estudio crítico y científico de las distintas moléculas o utensilios médicos. Las industrias tendrán que evaluar de forma muy precisa la conveniencia o no de la puesta en escena de un producto, analizando si los beneficios que aporte superarían a los ya disponibles en el mercado y/o a un precio más razonable para lograr la eficiencia, puesto que podrían sufrir el percance de la inversión sin el beneficio, lo que sin lugar a dudas mermaría la viabilidad empresarial. Todo ello ha dibujado un nuevo escenario en la industria y en sus estrategias de marketing, intentando cubrir sus objetivos mediante otros caminos mucho más adecuados y que no traspasen los límites éticos.
Hay un aspecto sobre el que vale la pena insistir, no relacionado con los fármacos, sino con los utensilios o las prótesis médicas, sobre los que no hay una cultura de evaluación y fácilmente se magnifican sus prodigios. El material endoscópico, los ecógrafos, los artilugios sustentadores de las uretras, los nuevos apósitos o las sustancias antiadherencias, etc., han de ser también tratados por el mismo tamiz, con el agravante de que, a veces, son utensilios de gran valor económico y sobre los que se han hecho estrategias de marketing, en algunos casos fuera de los límites que se han mencionado anteriormente. A veces, el ilusionismo o el afán de novedad ha hecho que se adoptaran o aceptaran utensilios que no aportan beneficio alguno en términos de resultados y, en cambio, pueden encarecer la práctica médica de manera injustificada. Pocas veces, las agencias de evaluación han ejercido su papel en este campo, al menos en el área de nuestra especialidad.
Recientemente, FENIN, que se constituye como la Federación Española de Empresas de Tecnología Sanitaria de ámbito nacional, ha hecho público su propio Código de Buenas Prácticas (en su anexo III), aunque todavía falta el proceso de implementación real del comité encargado de su aplicación y seguimiento, así como de las guías para su correcta interpretación. Es decir, todavía el código está en una fase inicial. Sin embargo, el hecho mismo de que se haya emprendido el buen camino con la promulgación del Código es motivo de felicitación, y confiamos en que pronto se dote de los elementos verificables y exigibles de credibilidad y transparencia.
Dicho esto, es necesario insistir también que el profesional ha de saber medir sus propios límites en el campo del marketing. Una cosa es que el médico esté acostumbrándose a que su formación continuada sea proporcionada por la industria (hecho totalmente anómalo), y otra es que participe activamente en la transgresión. Dicho de otra forma, que sea el propio especialista quien proponga o exija un tipo de acción a las empresas que comporte un beneficio no científico, con el subterfugio de la utilización de un determinado producto. A lo largo de la historia ha habido ejemplos puntuales, en ningún caso generalizados, en que se ha llegado a reclamar una participación económica por producto utilizado, o bien establecer unos niveles a partir de los cuales alguien podría recibir compensaciones no razonables. Este tipo de planteamiento no es aceptable bajo ningún punto de vista. Una cosa es la cortesía con que una industria puede tratar a los profesionales y otra es la exigencia de compensaciones personales o colectivas en una acción de marketing determinada. Por tanto, unos y otros, industria y profesionales, han de saber mantener una relación que se enmarque en las buenas prácticas, sin perderse el respeto y aceptando las normas éticas establecidas de buena conducta.
Hemos citado, en diversas ocasiones, el Código Español de Buenas Prácticas para la Promoción de los Medicamentos, y consideramos que ésta es una de las estrategias más sensatas que se han realizado en los últimos tiempos con el fin de racionalizar la relación entre la industria del medicamento y el profesional de la medicina. En realidad, su ámbito de competencia es el sector farmacéutico, con un Jurado de Autocontrol, que se constituye en un órgano externo encargado de la aplicación del código, lo que garantiza independencia, profesionalidad y credibilidad, especialmente para la solución de conflictos; se puede sancionar al infractor de manera punitiva en función de la gravedad de la infracción. El Código cuenta además con unas guías de desarrollo que versan, entre otros aspectos, sobre los incentivos que se aplican en las promociones del medicamento, así como los aspectos de hospitalidad y reuniones (en su anexo II). Dos artículos del Código son especialmente importantes, el artículo 10 y el 11. Los transcribimos a continuación:
Artículo 10
10.1. No podrán otorgarse, ofrecerse o prometerse obsequios, ventajas pecuniarias o en especie a los profesionales sanitarios implicados en el ciclo de prescripción, dispensación y administración o al personal administrativo para incentivar la prescripción, dispensación, suministro y administración de medicamentos, salvo que se trate de obsequios de poco valor y relacionados con la práctica de la medicina o la farmacia. Por tanto, es admisible la entrega de obsequios tales como utensilios de uso profesional en la práctica médica o farmacéutica o utensilios de despacho de valor insignificante.
10.2. Se considerará que el obsequio es de poco valor cuando no supere los 30 euros. Esta cantidad se actualizará periódicamente atendiendo a criterios de mercado.
10.3. Se exceptúa la entrega de objetos como libros o material en soporte óptico, magnético, electrónico o similar, bajo el patrocinio de la compañía, sobre temas de medicina o farmacia, siempre que cumplan los requisitos legales establecidos.
10.4. No será admisible la entrega de regalos de mayor valor o de naturaleza distinta a la científico-técnica.
10.5. Estos obsequios deberán incluir toda la información recogida en el artículo 2.1. No obstante, cuando el medicamento lleve autorizado al menos dos años y sea por tanto posible efectuar publicidad de recuerdo, podrá incluirse sólo la información prevista en el artículo 2.3.
Artículo 11 (Se transcriben los apartados de mayor interés)
Hospitalidad y reuniones
11.1. La hospitalidad en manifestaciones de carácter profesional o científico debe siempre ser razonable y su coste no puede exceder del que los destinatarios estarían normalmente dispuestos a pagar en las mismas circunstancias. El concepto de hospitalidad incluye los gastos reales de desplazamiento y estancia que sean abonados por el laboratorio. Éstos deberán ser mesurados y no exagerados, y habrán de ajustarse a los días en los que esté prevista la reunión científica. En este sentido, la hospitalidad no podrá extenderse más allá de lo razonable tras la realización del evento.
11.2. La hospitalidad debe ser siempre accesoria en relación con el objeto principal de la reunión. Los objetivos científicos deberán constituir el foco principal en la organización de tales reuniones. En ningún caso podrán prevalecer los aspectos culturales o sociales sobre los científicos.
11.3. La hospitalidad no debe extenderse a otras personas distintas a profesionales sanitarios, considerándose profesionales sanitarios únicamente las personas facultadas para prescribir o dispensar medicamentos.
11.4. No pueden realizarse pagos a favor de facultativos o grupos de facultativos, ya sea de forma directa o indirecta, para alquilar salas para reuniones, a menos que se acredite debidamente que se destinan a reuniones de contenido científico o profesional.
Por tanto, la propia industria farmacéutica se autorregula, entre otros aspectos, en el ejercicio de sus actuaciones de incentivos y hospitalidad. Este hecho ha de ser conocido y valorado por el profesional. Ya decíamos anteriormente que, en ciertas ocasiones, es el propio profesional el que solicita o exige ciertas «prestaciones» compensatorias a su capacidad de dispensar y es en ese terreno donde ha de haber una estrecha colaboración de los profesionales médicos responsables con Farmaindustria con el fin de mantener las más elementales reglas de interrelación honestas y sensatas, que a buen seguro repercutirán en beneficio del paciente.
Es de justicia señalar que la realidad actual ha evolucionado muy favorablemente en comparación con lo vivido unos años atrás. Han quedado relegadas ciertas prácticas, como el denominado «tarugo» o las hospitalidades desmesuradas o incluso las reuniones científicas en las que se hacían prevalecer los exquisitos detalles turísticos sobre lo puramente docente. Gracias a todos los agentes involucrados, hoy día, las actividades se centran en lo que realmente siempre hubieran debido ser: formación e información al mejor servicio del paciente.
CONCLUSIONES
1. Hay una relación estrecha entre los profesionales médicos y las industrias farmacéutica y de productos sanitarios.
2. Esta relación contempla la información sobre medicamentos y productos, pero, en ocasiones, dicha información puede ser interesada, incompleta o sesgada.
3. En la información científica proporcionada por las industrias, no hay siempre la transparencia necesaria para que el profesional pueda tomar las decisiones adecuadas.
4. La formación médica continuada, base de la competencia profesional, no está adecuadamente establecida ni desarrollada en España y aparece excesivamente ligada a la industria.
5. La formación médica continuada, que ofrecen las industrias, no siempre se ajusta a las necesidades reales de los profesionales y, en ocasiones, es tendenciosa y puede caer en el dirigismo.
6. La industria traspasa, en ocasiones, los límites del marketing. Esos límites están perfectamente regulados en los Códigos de Buenas Prácticas de Farmaindustria y de FENIN.
7. Se considera muy positivamente la existencia de ambos códigos de buenas prácticas. Instamos a que el Código de FENIN sea operativo y que se dote de los controles imprescindibles para su riguroso cumplimiento.
8. Por consiguiente, con las anteriores conclusiones, las industrias han de preservar los principios de los Códigos en todo momento y bajo todas las circunstancias.
9. En algunos casos, el médico acepta, indebidamente, una compensación al apoyo que presta a determinados fines comerciales, lo que es totalmente rechazable.
10. Las sociedades científicas han de ser las responsables de la provisión de las actividades de la FMC.
11. Las administraciones sanitarias hacen notoria dejación de sus funciones y responsabilidades en la FMC, a la que deberían favorecer e incentivar.
12. Las sociedades científicas han de velar por la utilización racional del medicamento y de los productos sanitarios mediante la publicación de guías de actuación y/o de protocolos, para actualizar las conductas médicas de acuerdo con los principios bioéticos de beneficencia y justicia, en favor de los pacientes y de la sociedad en general.
Correspondencia:
Dr. J. Zamarriego.
SEGO.
P.º. de La Habana, 190 bajos.
28036 Madrid. España.
Correo electrónico: sego@sego.es
Fecha de recepción: 19/4/05
Aceptado para su publicación: 16/3/06