Los miomas uterinos (MU), también conocidos como leiomiomas o fibromiomas, son los tumores sólidos más frecuentes de la pelvis de la mujer. Derivan del miometrio y presentan una abundante matriz extracelular rodeados de una fina seudocápsula de tejido conectivo y fibras musculares comprimidas.
Estrógenos y progesterona están relacionados con su desarrollo y crecimiento pero en la actualidad también las citocinas y los factores de crecimiento relacionados con la fibrosis y la angiogénesis parecen estar implicados.
Se estima que el 70% de las mujeres desarrollan miomas a lo largo de su vida, siendo máxima su incidencia en la quinta década de la vida1. Aunque frecuentemente asintomáticos, causan síntomas en el 25% de las mujeres en edad fértil.
Son múltiples los factores que influyen en la aparición y evolución de los miomas2:
- –
Raza: las mujeres afroamericanas tienen de 3-9 veces mayor prevalencia de MU, comparadas con las asiáticas y las de raza blanca3.
- –
Agregación familiar: la miomatosis uterina familiar es factor de riesgo para la aparición de MU con un comportamiento diferente a los MU no familiares. Su incidencia es 2,5 veces mayor en mujeres con al menos 3 familiares de primer grado con MU y aumenta el riesgo relativo a 5,7 si el familiar desarrolló el mioma antes de los 45 años4.
- –
Factores de la reproducción: la menarquia precoz (< 10 años) y la exposición intraútero al dietilestilbestrol5 se han relacionado con la aparición de MU. Los miomas son menos frecuentes en las mujeres que han gestado, que han tenido una maternidad temprana, multíparas (a mayor número de gestaciones mayor es el efecto protector) y con un corto intervalo desde la última gestación2. Solo las gestaciones que alcanzan la viabilidad fetal disminuyen la incidencia de MU6.
- –
Tratamientos hormonales: la respuesta de los miomas al estímulo hormonal varía en función de dosis, vía de administración, sustancia empleada y tiempo de administración7.
- –
Otros factores: el tabaco reduce la aparición de miomas, sobre todo en mujeres que consumen más de 10 cigarrillos/día, excepto en mujeres de raza negra8. La hipertensión, la obesidad y la diabetes mellitus también se han asociado con un aumento del riesgo en el desarrollo de miomas9,10. La dieta rica en vitamina A y el alto consumo de carnes rojas parecen aumentar la incidencia de miomas11.
Los mecanismos patológicos de desarrollo de los MU están por esclarecer. La hipótesis tradicional considera que la formación de los miomas semeja un proceso oncológico: primero existe una transformación del miocito normal en anormal. En una segunda fase, la replicación monoclonal de esta célula alterada daría lugar a un mioma clínico. Una nueva hipótesis considera que la formación de los miomas responde a una alteración de la cicatrización de los miocitos.
Los miomas se pueden clasificar según su localización en el miometrio en subserosos (localizados en la superficie uterina, deformando la serosa), intramurales (situados en el espesor de la pared muscular, sin relación con la serosa ni la mucosa), transmurales (son miomas en el espesor de la pared muscular que deforman la serosa y la mucosa endometrial) y submucosos (se desarrollan bajo el endometrio desplazándolo en su crecimiento).
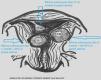
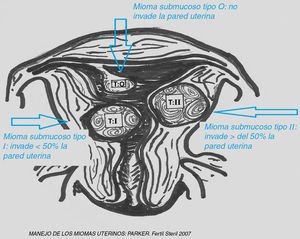
La clasificación de Wamsteker 1993 divide los miomas submucosos en (fig. 1):
- 1.
Tipo 0: el mioma está situado en su totalidad en el interior de la cavidad uterina, bien sea sésil o pediculado.
- 2.
Tipo I: el mioma tiene una extensión intramural menor del 50%.
- 3.
Tipo II: la extensión intramural del mioma es mayor del 50%.
Actualmente, se tienen muy en cuenta determinados factores para clasificar la complejidad de extirpación de los miomas. La clasificación de Lasmar (tabla 1) se basa en puntuaciones que pronostican la dificultad de la extirpación del mioma. Recientemente, ha publicado un estudio prospectivo multicéntrico12,13 en el que participan 4 centros de histeroscopia de Brasil, China, Italia y EE. UU, en el que proponen para histeroscopia 465 miomas submucosos y comparan la clasificación de la European Society for Gynaecological Endoscopy (ESGE) y la clasificación de STEPW (tabla 2).
Clasificación de Lasmar 2011
| Score | Grupo | Complejidad y opciones terapéuticas |
| 0-4 | I | Baja complejidad. Miomectomía por histeroscopia |
| 5-6 | II | Alta complejidad. Miomectomía por histeroscopiaConsiderar el uso de GnRHConsiderar miomectomía histeroscópica en dos pasos |
| 7-9 | III | Considerar alternativas a la técnica histeroscópica |
Tomado de Lasmar et al.64.
La clasificación STEPW tiene en cuenta los siguientes factores:
- 1.
Size (tamaño). Es el diámetro más grande por cualquier método de imagen. Cuando el mioma mide ≤ 2cm: score 0. Si mide 2,1-5: score es 1. Si mide más de 5cm, el score es 2.
- 2.
Topografía. Se refiere a dónde está situado el mioma en el útero. En el tercio inferior el score es 0. Si está en el tercio medio, el score es 1. Si está en el tercio superior, el score es 2.
- 3.
Extensión de la base del mioma. Cuando el mioma cubre una tercera parte o menos de la pared, el score es 0. Si la base ocupa entre un tercio y dos tercios de la pared, el score es 1. Cuando afecta a más de dos tercios de la pared, el score es 2.
- 4.
Penetración del mioma dentro del miometrio. Si el mioma está completamente dentro de la cavidad uterina, el score es 0. Si tiene la mayor parte dentro de la cavidad uterina, el score es 1. Si la mayor parte del mioma está en el miometrio, el score es 2.
- 5.
Wall (pared). Cuando el mioma está en la pared lateral, se añade un punto extra al score.
El objetivo es comparar la clasificación de la ESGE con la de STEPW, en términos de predecir cuándo la extirpación de un mioma submucoso por histeroscopia será parcial o completa.
ClínicaLa mayoría de los MU no ocasionan síntomas. Cuando las pacientes con miomas presentan manifestaciones clínicas, las que con más frecuencia se pueden atribuir a ellos incluyen:
Sangrado uterino anormalEs el síntoma más común. La gravedad dependerá del número, la localización y el tamaño (suele ser de importancia secundaria) de los miomas. El sangrado prolongado o abundante es el típico patrón asociado14, pero ninguna forma de sangrado es diagnóstica de miomas. Las menorragias o hipermenorreas son las formas más comunes de sangrado de las mujeres con miomas15,16.
Aunque es infrecuente, un mioma submucoso pediculado se puede prolapsar a través del cérvix (coloquialmente conocido como «mioma parido») y ulcerarse, infectarse o incluso necrosarse, ocasionando hemorragia importante, a veces escasa y prolongada, o en ocasiones aguda y abundante.
Secundariamente, el sangrado uterino abundante y/o prolongado puede ser causa de problemas asociados tales como anemia ferropénica, vergüenza social y pérdida de productividad laboral.
En todas las pacientes con miomas que consultan por sangrado se debe realizar una biopsia de endometrio con cánula de Cornier, para descartar patología endometrial.
Presión pélvica y dolorLa sensación de presión pélvica aparece cuando aumenta el tamaño uterino. La presión ocasionada por el tumor y el aumento del perímetro abdominal por el efecto masa de los miomas son, de hecho, más frecuentes que el dolor17. Con el crecimiento del mioma se ejerce presión sobre los órganos adyacentes, pudiendo causar síntomas específicos.
- –
A nivel urinario, tales como frecuencia urinaria, dificultad del vaciamiento vesical y retención urinaria aguda. La obstrucción urinaria que termina produciendo hidronefrosis es rara. Parece que la prevalencia de la incontinencia urinaria está aumentada en pacientes con miomas.
- –
La compresión ejercida por un mioma puede conllevar síntomas a nivel digestivo, como estreñimiento y tenesmo17.
- –
Los miomas de gran tamaño pueden llevar asociados por efecto compresivo, complicaciones como trombosis.
En cuanto al dolor, se puede manifestar de diferentes formas:
- –
Dismenorrea.
- –
Dispareunia.
- –
Dolor abdominopélvico agudo, que se puede encontrar en las degeneraciones de los miomas (por necrosis natural del mioma llamada degeneración roja, más frecuente durante el embarazo) y en las torsiones del mioma, en caso de miomas pediculados.
- –
Dolor en la parte baja de la espalda, lumbociática, por compresión del nervio ciático, lo cual se manifiesta raramente.
Los miomas que distorsionan la cavidad uterina (submucosos o intramurales con un componente intracavitario) suponen una dificultad para la concepción y un incremento de la tasa de abortos.
Además, los miomas han sido asociados a efectos adversos durante la gestación, tales como sangrado en el primer trimestre, rotura prematura de membranas, presentación de nalgas, trabajo de parto prolongado, desprendimiento prematuro de placenta, restricción del crecimiento fetal, amenaza de parto pretérmino y parto prematuro, y mayor tasa de cesáreas. Todas estas entidades están en relación con la distorsión de la cavidad uterina que puede producir el mioma, ocasionando problemas de espacio que dificultan el desarrollo o la posición fetal, o bien con alteraciones en la vascularización placentaria cuando esta se inserta sobre el lecho del mioma. Además, los miomas pueden interferir en la transmisión normal de la contracción uterina de las fibras musculares normales, así como obstruir el canal del parto. También durante el embarazo se describe un aumento del tamaño de los miomas (ocurre en un 20-30% de los casos), constatándose aumentos de volumen de no más del 25% durante el primer trimestre, manteniéndose el tamaño e incluso disminuyendo éste durante la segunda mitad del embarazo y el puerperio16,18.
Síntomas infrecuentes:
- –
Policitemia por la producción autónoma de eritropoyetina.
- –
Hipercalcemia por producción autónoma de hormona paratiroidea.
- –
Hiperprolactinemia por producción autónoma de prolactina.
- –
Síndrome de Meigs (enfermedad benigna con muy buen pronóstico si es bien manejada. Se puede ver en casos de MU, más frecuentemente en fibromas ováricos, presentada como ascitis acompañada con derrame pleural, sobre todo en lesiones de gran tamaño) o seudosíndrome de Meigs (un tumor pélvico benigno no ovárico, como es el mioma, que se presenta con ascitis y derrame pleural asociado)19.
- –
Localizaciones inusuales de los miomas, como pueden ser a nivel vaginal, vesical, cavidad oral, etc...
- –
Leiomioma benigno metastatizante, rara entidad caracterizada porMU que desarrollan un lento crecimiento metastásico principalmente en el pulmón.
- –
Leiomiomatosis hereditaria con carcinoma de células renales.
- –
Leiomiomatosis intravenosa, que es una entidad rara derivada de un MU o de los vasos de las paredes del útero con extensión dentro de los canales venosos.
Para hacer el diagnóstico de miomas, la exploración ginecológica (tacto bimanual) sigue siendo de gran utilidad, aunque las técnicas complementarias actuales sean muy precisas en el diagnóstico. La valoración del tamaño, la consistencia, la movilidad y la forma uterina, y la asociación con dolor a la palpación, dan una idea inicial del proceso que puede presentar la paciente.
Las técnicas complementarias más utilizadas incluyen:
Ultrasonidos. La ecografía transvaginal tiene una alta sensibilidad (95-100%) para detectar miomas en úteros menores de 10 semanas. La localización de miomas en úteros mayores o cuando estos son múltiples está limitada20. Es por este motivo que debemos tener en nuestro protocolo realizar siempre una ecografía abdominal que nos evitará que miomas no accesibles por vía vaginal pasen inadvertidos.
La ecografía con infusión salina intracavitaria (sonohisterografía) mejora la definición del contorno del mioma submucoso que protruye en la cavidad uterina y nos facilita su clasificación según la Sociedad Europea de Histeroscopia (tipo 0, I y II)21.
Histeroscopia. Esta técnica ayuda en el diagnóstico (y tratamiento) de los miomas submucosos, valorando su componente intracavitario y resecabilidad por esta vía.
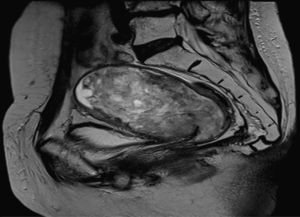
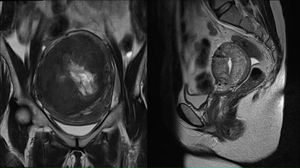
Resonancia magnética. Es la mejor técnica para visualizar todos los miomas y la localización de los mismos. Permite diferenciar entre leiomiomas, adenomiosis y sarcomas.
Tomografía computarizada. Tiene poca utilidad para delimitar la posición de los miomas en relación con el miometrio o el endometrio22.
En cuanto al diagnóstico diferencial, los miomas deben ser distinguidos principalmente de 2 entidades fundamentales:
- –
Adenomiosis. La diferencia fundamental es la ausencia cápsula que separe la formación del tejido miometrial normal presente en los miomas y ausente en las adenomiosis y sarcomas. La ecografía transvaginal con Doppler y la RM son técnicas adecuadas para el diagnóstico de esta entidad. En los casos de duda diagnóstica al realizar la ecografía transvaginal, se recomienda la realización de RM con gadolinio para establecer el diagnóstico diferencial.
- –
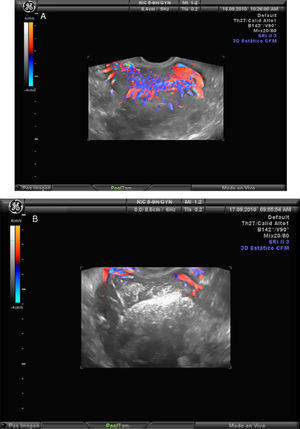
Sarcomas. La mayoría aparecen en la menopausia. La RM y la biopsia de endometrio son las pruebas diagnósticas adecuadas, pero el diagnóstico definitivo será anatomopatológico. La evaluación con ecografía de una masa uterina puede indicar un sarcoma (ecogenicidad mixta, necrosis central, vasos de distribución irregular y baja impedancia del flujo en el estudio Doppler-color, y aumento en la velocidad pico-sistólica). Sin embargo, muchas de estas características se encuentran también en los leiomiomas23.
Los leiomiosarcomas (LMS) uterinos son tumores malignos del útero compuestos completamente por músculo liso. Su incidencia se estima entre 0,67-0,70 por 100.000 mujeres y año24,25. La edad media de las mujeres con LMS es de 50-55 años y son más frecuentes en la raza negra. Los principales síntomas de aparición de los LMS son el sangrado vaginal anómalo, el dolor en el hipogastrio y la masa pélvica o abdominal.
El problema se plantea en el diagnóstico diferencial, ya que el LMS puede ser asintomático por periodos largos y la patología benigna, como los leiomiomas o la adenomiosis, pueden mimetizar clínicamente al primero. Solo la RM puede dar patrones que sirvan para sospechar la presencia de malignidad en el tumor.
En general, parece que los LMS no surgen de leiomiomas benignos. Si se produce la transformación maligna de los leiomiomas uterinos, este es un raro evento. El consenso de estudios genéticos ha sido que la mayoría de los sarcomas surgen de manera independiente24 y solo un número limitado de casos publicados ha demostrado la transición histológica desde un leiomioma benigno a un LMS27–29.
La hipótesis de que los LMS uterinos surgen o son el resultado de una transformación maligna de los leiomiomas benignos no ha podido probarse30 (tabla 3).
Manifestaciones clínicas de los miomas uterinos
| Sangrado uterino anormal | Presión pélvica | Dolor pelviano | Efectos reproducción | Síntomas infrecuentes |
| Menorragia/hipermenorrea | Molestia hipogástrica | Dismenorrea | Dificultad para la concepción | Secreción hormonal ectópica |
| Anemia ferropénica | Dificultad vaciamiento vesical | Dispareunia | Aumento tasa abortos | Síndrome Meigs/seudo-síndrome Meigs |
| Vergüenza social | Retención urinaria aguda | Dolor abdominal pélvico agudo | Efectos adversos en gestación (amenaza de aborto, RPM, presentaciones anómalas, APP, parto pretérmino, CIR, parto prolongado, aumento tasa cesáreas, DPPNI, aumento miomas) | Localizaciones inusuales |
| Pérdida productividad laboral | Incontinencia urinaria | Lumbociática | Leiomioma benigno metastatizante | |
| Obstrucción urinaria/hidronefrosis | Leiomiomatosis hereditaria con carcinoma de células renales | |||
| Estreñimiento | Leiomiomatosis intravenosa | |||
| Tenesmo rectal | ||||
| Trombosis pélvica |
Los miomas asintomáticos pueden ser seguidos normalmente sin tener que realizar ninguna intervención31 (tabla 4).
Tratamiento de los miomas
| Tratamiento médico | |
| AINE | Si síntoma principal dismenorrea |
| Antifibrinolíticos | Si síntoma principal menorragia |
| Estrógenos/gestágenos | Si síntoma principal menorragia |
| Análogos GnRH | Disminuye tamaño mioma. Inhibe sangrado |
| Antagonistas GnRH | Requieren más estudios para su uso clínico |
| SERM | Requieren más estudios para su uso clínico |
| Inhibidores aromatasa | Disminuye tamaño mioma. Inhibe sangradoRequieren más estudios para su uso clínico |
| Antiprogestágenos (acetato ulipristal) | Disminuye tamaño mioma. Inhibe sangrado |
| Fármacos androgénicos | Los estudios actuales no recomiendan su uso clínico en el tratamiento de los miomas |
| DIU liberador levonorgestrel | Si síntoma principal menorragia |
| Tratamientos no hormonales | En estudio |
| Tratamiento quirúrgico | |
| Histerectomía abdominal | Cuando no dan resultados los tratamientos más conservadoresPara el control de los síntomasSospecha de sarcomaLa paciente rechaza tratamiento conservador |
| Miomectomía | Como control síntomas en mujeres con deseo genésico inconcluso o si se prevé mejorar capacidad reproductiva con la extirpación del mioma |
| Histeroscopia | En miomas submucosos tipo 0/i sintomáticos |
| Miólisis | Se requieren más estudios para establecer claramente sus indicaciones |
| Oclusión arterias uterinas | Mismas indicaciones que embolización de las uterinas |
Los miomas asintomáticos que por estudio Doppler color no presenten vascularización intramiomatosa ni perimiomatosa no precisan seguimiento.
El tratamiento profiláctico para prevenir futuras complicaciones de los miomas no se recomienda salvo algunas excepciones, como mujeres con miomas submucosos importantes que desean gestación o mujeres que presentan compresión ureteral que cause hidronefrosis moderada o severa32.
En mujeres sintomáticas, el control de los síntomas (sangrado uterino anormal, dolor o presión) es el objetivo principal del tratamiento.
Manejo expectanteNo existen estudios de alta calidad sobre qué tipo de seguimiento debe realizarse en pacientes asintomáticas o en las que declinan el tratamiento debido a que es imposible predecir el crecimiento futuro de un mioma o la aparición de síntomas33. Esta actitud puede ser una opción razonable en pacientes sin anemia o metrorragia cercanas a la menopausia porque presentan un tiempo limitado de desarrollo de los síntomas.
Tratamiento médicoAntiinflamatorios no esteroideosLos AINE no parecen reducir la cantidad de sangrado (o con menos eficacia que otros tratamientos) (NE: Ib-A) en mujeres con miomas, pero pueden ser útiles en esta población para mejorar la dismenorrea (NE: IIa-B)34,35. Se considera que los AINE son fármacos que pueden ser prescritos para tratar los síntomas asociados con los miomas (NE: IIa-B).
AntifibrinolíticosEl ácido tranexámico fue aprobado por la FDA en el año 2009 para el tratamiento del sangrado menstrual abundante. Se considera un fármaco eficaz en el tratamiento del sangrado menstrual abundante asociado con MU y, por tanto, puede ser prescrito para ello (NE: IIa-B).
Tratamientos hormonalesEstrógenos y gestágenosLos tratamientos con anticonceptivos combinados o con solo gestágenos son, a menudo, de primera línea para pacientes con sangrado uterino anormal en mujeres con y sin miomas.
Los progestágenos no son un tratamiento para los miomas, pero pueden ser usados para el sangrado aumentado asociado con ellos a corto-medio plazo (NE: IV-C).
Agonistas de la hormona liberadora de gonadotropinasConstituyen el tratamiento médico más establecido y más efectivo para los miomas, pero los beneficios de los agonistas de la hormona liberadora de gonadotropinas (a-GnRH) se ven limitados por sus efectos secundarios, que incluyen sofocos, alteraciones del sueño, sequedad vaginal, depresión y pérdida de masa ósea después de un uso prolongado. Se han estudiado varias terapias add-back para intentar reducir estos efectos adversos permitiendo así un uso más prolongado de los a-GnRH (acetato de medroxiprogesterona, estroprogestágenos o gestágenos solos, raloxifeno)36. El uso de estas terapias parece mejorar los efectos adversos del uso de los a-GnRH sin impedir la reducción del volumen del mioma (tibolona: NE: IIa-B; estrógenos: NE: III-B).
Antagonistas de la hormona liberadora de gonadotropinasSe requieren más estudios para investigar el comportamiento de los miomas tras suspender el tratamiento, para evaluar su uso preoperatorio y que comparen directamente la respuesta con los agonistas. No parece existir contraindicación para el uso de estos fármacos durante las técnicas de reproducción asistida en pacientes con MU (NE: IV-C).
Moduladores selectivos de los receptores de estrógenosEn la actualidad no existe suficiente evidencia para el uso de raloxifeno en mujeres premenopáusicas en el tratamiento de los miomas y el tamoxifeno tiene efectos adversos inaceptables para ser usado como tratamiento en estas pacientes.
Inhibidores de la aromatasaSon fármacos que actúan rápida y eficazmente contra los síntomas de los miomas y reducen su volumen (NE: IV-C). Aunque estos agentes tienen menos efectos secundarios que muchas terapias hormonales, se requieren más estudios para establecer la duración de la respuesta, los riesgos y el coste-efectividad.
Antiprogestágenos: mifepristona (RU-486), asoprisnil (J-867)La mifepristona parece reducir el tamaño de los miomas y mejorar los síntomas asociados a ellos (NE: Ib-A). Son fármacos que, entre otros efectos secundarios, producen hiperplasia endometrial, lo cual puede limitar el empleo a largo plazo de estas medicaciones37.
El acetato de ulipristal (CDB-2914) es uno de los tratamientos más novedosos y de alta efectividad en el tratamiento de los síntomas asociados a los MU. Recientemente, se han completado con éxito 2 estudios clínicos en fase III (PEARL I y II)38,39 que demuestran su seguridad y eficacia en el tratamiento de los MU sintomáticos (NE: Ia-A), consiguiendo la reducción del sangrado en 7 días. Está exento de los efectos negativos de los análogos, puesto que mantiene los niveles de hormona foliculoestimulante y es por esto que no provoca sofocos en las pacientes. Como efecto indeseable, provoca una dilatación glandular del endometrio quística que desaparece al dejar el tratamiento.
En la actualidad, en Europa, la dosis comercializada del acetato de ulipristal indicada para el tratamiento de los miomas es de 5mg durante 13 semanas. En España puede utilizarse esta medicación como medicamento extranjero en espera de la aprobación por el Ministerio de la financiación pública.
Fármacos androgénicosEl danazol y la gestrinona parecen ser efectivos en el tratamiento de algunos síntomas asociados a los miomas pero los efectos secundarios son su principal inconveniente. En la actualidad, los estudios con danazol son muy limitados y no existen estudios controlados y aleatorizados sobre los riesgos y los beneficios del uso de este medicamento en el tratamiento de los miomas, por lo que no está recomendado (NE: IV-C).
Dispositivo intrauterino liberador de levonorgestrelExiste una revisión sistemática en la que se concluye que las pacientes con miomas y sangrados excesivos a las que se les pone un DIU de levonorgestrel tienen menos pérdida de sangre y mejoran la hemoglobina, el hematocrito y la ferritina, aunque tienen mayor tasa de expulsión del DIU que las que no presentan miomas (NE: IIa-B).
Tratamientos no hormonalesLas posibilidades para tratamientos futuros incluyen sustancias que actuarían inhibiendo la transformación de una célula miometrial en leiomiomatosa, ejerciendo su acción sobre los factores implicados en la angiogénesis, la fibrosis, la regulación genética o interfiriendo en el crecimiento del mioma.
Medicina alternativaEn un estudio no controlado de 110 mujeres tratadas con hierbas de la medicina china Kuei-chin-fu-ling, en miomas de <10cm durante ≥ 12 semanas, se realizó evaluación clínica y ecográfica, encontrándose la desaparición completa de los miomas en el 19% de las pacientes, una disminución en el tamaño de 43%, no hubo cambios en el 34% y aumentaron un 4%. La menorragia mejoró en 60 (95%) de 63 mujeres y la dismenorrea mejoró en 48 casos (94%) de 51. Sin embargo, 15 pacientes (14%) de las 110 mujeres eligieron realizarse una histerectomía durante los 4 años de seguimiento del estudio40.
Tratamiento quirúrgicoHisterectomía abdominalEs el tratamiento quirúrgico tradicional en pacientes que han completado su deseo genésico. Las vías de abordaje pueden ser abdominal (laparoscópica o laparotómica) y vaginal. La preservación del cérvix en la intervención acorta el tiempo de cirugía (NE: Ib-A). No ocurre así en la histerectomía laparoscópica subtotal, en la que influye el tiempo de morcelación. Se puede concluir que la histerectomía subtotal es una alternativa a la total si la vía de abordaje es laparotómica (recomendación grado B), mientras que parece similar el número de complicaciones si la vía es laparoscópica.
No existen diferencias entre la histerectomía total y la subtotal en términos de calidad de vida, calidad de relaciones sexuales y aparición de trastornos pélvicos, urinarios o gastrointestinales (NE: Ib-A).
Varios estudios han demostrado que, en pacientes en las que es posible realizar una histerectomía vaginal, la laparoscopia no aporta beneficios porque aumenta el tiempo quirúrgico y el coste de la intervención31,41.
MiomectomíaEs el procedimiento quirúrgico de elección para mujeres sintomáticas con deseo genésico o que desean conservar su útero. El procedimiento se puede llevar a cabo mediante laparotomía, laparoscopia, histeroscopia (en miomas submucosos) o vía vaginal.
La miomectomía laparoscópica está asociada a un menor sangrado intraoperatorio, menor descenso de los valores de hemoglobina, disminución del dolor postoperatorio y una mejor recuperación, pero el tiempo de cirugía aumenta42 (NE: Ia-A). El límite del tamaño para la miomectomía laparoscópica depende de la experiencia del ginecólogo y del tiempo quirúrgico previsto. Lo lógico es consensuar con la paciente la vía de acceso. Tres horas de cirugía por laparoscopia quizás tengan más efectos negativos en la paciente que una laparotomía. El límite razonable son miomas únicos de 12cm o más de 3 miomas de 6cm.
Un parámetro importante es la optimización del estatus hematológico de la paciente, previo a la cirugía. Por eso, en mujeres con una anemia importante, puede ser útil el tratamiento con análogos GnRH o gestágenos, aunque la literatura actual sugiere no usar de rutina análogos GnRH previos a la cirugía43. Actualmente, según la evidencia científica, el acetato de ulipristal sería la medicación de elección previa a la cirugía38,39, dado que permite conseguir mejores valores hematológicos y no afecta al plano de clivaje en la miomectomía, además de no producir sofocos en la paciente.
En miomas submucosos sintomáticos la resección histeroscópica es el tratamiento quirúrgico de primera línea en los miomas tipo 0 y i (grado de recomendación B) y en los de tipo i hasta 4cm. No obstante, en manos expertas, es posible hasta 4-6cm (grado de recomendación C), siempre que la distancia a la serosa sea mayor de 5mm. Si la resección es incompleta, se recomienda completar en un segundo tiempo.
Alternativas a la cirugía convencionalMiólisisSe trata de la destrucción in situ de los tumores por vía laparoscópica mediante láser NdYAG, electrocoagulación, radiofrecuencia o crioterapia. El riesgo desconocido de recidiva y la falta de estudios con largas series de pacientes hacen que esta técnica aún no esté muy extendida.
Oclusión de la arteria uterinaEste procedimiento consiste en bloquear el flujo de sangre al útero mediante ligadura de la arteria uterina. Se puede realizar por vía laparoscópica con endoclips o coagulación vascular, o por vía vaginal. La técnica vía laparoscópica es una posible alternativa, aunque es menos eficaz a largo plazo que la embolización de las arterias uterinas (EAU), si bien es mejor tolerada (NE: IIa-B). Actualmente, los estudios con esta técnica son muy limitados44,45.
Ablación endometrialEn las mujeres que han completado su deseo genésico, la ablación endometrial, tanto sola como en combinación con la resección histeroscópica del mioma, es una opción para el tratamiento de las alteraciones del patrón de sangrado46 (NE: IIa-B). El método más eficaz y con menos complicaciones es en la actualidad la ablación con balón térmico (Novasure®, Thermachocie®), que se adapta a las paredes del útero y tiene una tasa más elevada de éxitos que la ablación con asa.
Embolización de las arterias uterinasEs una opción de tratamiento no quirúrgica para mujeres premenopáusicas con clínica relacionada con los miomas, tanto sangrado anormal como dolor o peso en el hipogastrio, que desean conservar su útero. El procedimiento está basado en la hipótesis de que la reducción bilateral de flujo en las arterias uterinas produciría un infarto de los miomas sin ocasionar lesión permanente en el miometrio normal.
La seguridad del embarazo tras la EAU no está aún establecida, por lo que el procedimiento se reserva habitualmente para mujeres con deseo genésico cumplido. El procedimiento no está indicado en mujeres menopáusicas.
La técnica es realizada por los radiólogos intervencionistas bajo anestesia epidural o intravenosa.
Se puede concluir que la EAU es un tratamiento efectivo y con baja morbilidad, siendo una buena opción de tratamiento en mujeres que presentan miomas sintomáticos y no quieren volver a quedar embarazadas (NE: Ia-A). El riesgo de amenorrea después del procedimiento es de un 3% en <45 años y de un 15% en ≥ 45 años47,48, en relación con el paso de partículas de embolización a las arterias ováricas y a las anastomosis de las arterias uterinas y las ováricas47,48.
Tratamiento con ultrasonido focalizado guiado por resonancia magnéticaAprobada en 2004 por la FDA, se trata de una nueva opción de tratamiento para mujeres premenopáusicas con miomas sintomáticos y sin deseo genésico. Se trata de un procedimiento no invasivo que usa ultrasonidos de alta intensidad aplicados en la pared abdominal. Las múltiples ondas de energía ultrasónica son focalizadas en un volumen reducido de tejido, permitiendo la destrucción térmica del mismo. Los ultrasonidos terapéuticos se monitorizan mediante RM.
Ofrece la ventaja de ser una técnica mínimamente invasiva, que no necesita incisión ni punción, únicamente sonda vesical y una vía periférica para una sedación moderada. Se puede realizar de forma ambulatoria.
Miomas y fertilidadCon el éxito de las técnicas de reproducción asistida, cada vez más mujeres de edad avanzada buscan gestación, por lo que el número de mujeres con deseo genésico y miomas está aumentando49,50. Los miomas pueden ser identificados en un 5-10% de pacientes estériles, pero la esterilidad solo puede ser atribuida a los mismos en un 2-3% de los casos50–52. Hoy día existe consenso en que la localización de los miomas y su relación con la cavidad uterina son los factores claves de la influencia negativa de los mismos sobre la fertilidad50,53.
Los mecanismos causantes de esterilidad se engloban en50,51,54,55:
- 1.
Interferencia en el transporte de gametos:
- –
Distorsión anatómica del cérvix.
- –
Alargamiento y deformidad de la cavidad uterina.
- –
Obstrucción de los ostia tubáricos.
- –
Deformidad tubo-ovárica que interfiere en la captura del ovocito.
- –
Incremento de la contractilidad uterina.
- –
- 2.
Fallo de implantación:
- –
Distorsión de la vascularización endometrial.
- –
Secreción de fluidos intracavitarios.
- –
Secreción de sustancias vasoactivas y factores inflamatorios locales.
- –
Elevación del ambiente estrogénico a nivel endometrial.
- –
Incremento de la contractilidad uterina.
- –
La localización se reconoce como el factor fundamental respecto a la fertilidad. Los miomas submucosos están asociados a una reducción de la fertilidad y un aumento de la tasa de aborto54 (NE: Ib-A). Los miomas intramurales podrían estar asociados a una reducción de la fertilidad y un incremento en las tasas de aborto54 (NE: Ib-A). Los miomas subserosos no parecen tener efecto en los resultados reproductivos54 (NE: Ib-A).
En cuanto al resto de los parámetros valorados en los miomas (tamaño o número), su relación inversa con la fertilidad ha sido menos estudiada.
Aborto y miomaLas tasas de aborto son superiores en las mujeres con miomas submucosos o intramurales. En conjunto, las mujeres con miomas presentan el doble de riesgo de aborto que aquellas sin miomas (el 7% frente al 14%). La miomectomía reduce a más de la mitad el riesgo de aborto en estas mujeres frente al tratamiento expectante (el 69% frente al 25%)56.
Ninguna técnica, excepto la miomectomía, puede ser aceptada como tratamiento de la pérdida gestacional en pacientes con miomas.
Tratamiento del útero miomatoso y fertilidadEl abordaje del útero miomatoso debe ser diferente si se enfoca desde el punto de vista reproductivo. Conocer qué tratamientos favorecen la fertilidad reduce la espera reproductiva de nuestras pacientes.
Tratamiento médicoNo hay evidencia de que el tratamiento médico mejore la fertilidad. La Sociedad Americana de Medicina de la Reproducción (ASRM) acepta la utilización de ciclos cortos de análogos de GnRH en la corrección prequirúrgica de la anemia o en la reducción del volumen solo si favorece un abordaje menos agresivo.
Tratamiento quirúrgicoHisterectomía: es el tratamiento definitivo de los miomas, pero cada vez es una técnica menos utilizada, excepto en úteros de gran tamaño o en los que fracasan las técnicas más conservadoras.
Miomectomía: se considera el tratamiento de elección en pacientes con deseos genésicos no cumplidos por la gran experiencia existente, pero aun así no debe realizarse sin una indicación clara y una evidencia de beneficio53. La vía de abordaje depende de la localización del mioma y de la experiencia del equipo quirúrgico:
- –
Miomectomía histeroscópica: es el tratamiento de elección de los miomas submucosos. Está indicada en aquellas pacientes que tienen un mioma con protrusión en la cavidad antes de realizar cualquier tratamiento de reproducción asistida porque mejora los resultados gestacionales51,53–55. También aquellas pacientes en las que se descubre un mioma submucoso, aunque sea asintomático, van a verse beneficiadas en su fertilidad si este se reseca por histeroscopia, tanto si van a ser sometidas a técnica de reproducción asistida, como si no (NE: Ia-A). La reciente introducción y mejora de los morceladores histeroscópicos facilita y acorta el tiempo quirúrgico en las miomectomías histeroscópicas, puesto que a la vez que morcelan recogen el material en una bolsa. Actualmente, el Myosure® de Hologic y el Truclear System® son los 2 disponibles en España.
- –
Miomectomía abdominal: se realiza en pacientes con miomas intramurales o subserosos. Entre 3-6 meses es el tiempo mínimo de espera de los diferentes autores antes de buscar de nuevo una gestación54.
Tras la miomectomía las tasas de gestación ascienden hasta el 40-50%50. En la mayoría de los estudios, el incremento en esta tasa ocurre en el primer año tras el tratamiento. Las vías de abordaje posibles son: laparotómica o laparoscópica. No hay diferencia significativa en relación a la fertilidad (tasa de gestación clínica o tasa de parto) si se realiza por una u otra vía57. La tasa de aborto espontáneo es similar con ambas técnicas51.
Un grupo de expertos de la Sociedad Australiana de Ginecología estableció en 2011 una serie de recomendaciones en función de la evidencia existente para la realización de miomectomía en mujeres infértiles51,54 recomendándola en:
- –
Mujeres infértiles con mioma/s submucoso/s (NE: Ib-A).
- –
Mujeres infértiles con miomas sintomáticos (NE: III-B).
- –
Fallos repetidos de fertilización in vitro en mujeres con mioma/s intramural/es (NE: III-B).
Miólisis: tanto la miólisis quirúrgica como la miólisis guiada por RM con ultrasonidos focalizados (RMgFUS) son técnicas cuyos resultados sobre la fertilidad aún no han sido evaluados correctamente, por lo que no se recomiendan en pacientes con deseos genésicos58.
Oclusión de las arterias uterinas: los resultados reproductivos con esta técnica son aún escasos como para poder ofrecerla a pacientes con deseo genésico no completado59,60.
EAU: los inconvenientes principales de la EAU sobre la fertilidad son: la lesión de la vascularización endometrial por embolización de vasos de pequeño tamaño, lo que provocaría atrofia-necrosis endometrial y la embolización ovárica debido a colaterales uterováricas61.
El American College of Obstetricians and Gynecologists considera la EAU como una contraindicación relativa en el tratamiento de los miomas para mujeres con deseos genésicos no cumplidos. Concluye que las tasas de gestación son inferiores que con la miomectomía. También en la base de datos Cochrane del año 2012 se señala que la miomectomía se asocia a mejores tasas de gestación y de recién nacido vivo que la EAU62,63. En cuanto a la tasa de aborto, esta parece duplicarse en mujeres tras EAU frente al tratamiento expectante62.
Actualmente, la miomectomía es el tratamiento de elección en mujeres con miomas que desean gestación. La EAU, la miólisis quirúrgica, la RMgFUS y la oclusión de las arterias uterinas son técnicas que no han demostrado aún la eficacia y la seguridad suficientes para poder ser recomendadas en mujeres con deseo gestacional (figs. 2–5).
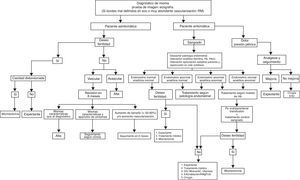
Propuesta manejo de la paciente con miomasEn cuanto al manejo de la paciente diagnosticada de miomas, no hay ninguna publicación basada en cuál es el mejor esquema de seguimiento. Recientemente, se ha publicado una guía clínica francesa64 que hace un análisis de las herramientas actuales de tratamiento basadas en la evidencia científica.
Una propuesta de unidad funcional para el manejo de las pacientes diagnosticadas de MU podría ser la propuesta por la Unidad de Miomas de Toledo, pionera en Europa desde el año 2009 y que se refleja en la figura 6 (NE: IV-C).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Clasificación de las recomendaciones en función del nivel de evidencia disponible | |
| Ia | La evidencia científica procede a partir de meta-análisis de ensayos clínicos controlados y aleatorizados |
| Ib | La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa | La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb | La evidencia científica procede de al menos un estudio casi experimental, bien diseñado |
| III | La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles |
| IV | La evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio |
| Grados de recomendación | |
| A | Existe buena evidencia sobre la base de la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica ia y ib) |
| B | Existe moderada evidencia sobre la base de la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica iia, iib y iii) |
| C | La recomendación se basa en la opinión de expertos o en un panel de consenso. (Recoge el nivel de evidencia iv) |
Los Protocolos Asistenciales de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en Departamentos y Servicios Hospitalarios.