El desarrollo de la histeroscopia (HSC) ha proporcionado un abordaje mínimamente invasivo para problemas ginecológicos frecuentes como son las metrorragias anormales.
La introducción de esta técnica en la formación clínica, la aparición de histeroscopios con menor diámetro y un peso cada vez mayor de los procedimientos ambulatorios en la práctica médica, ha posibilitado el uso generalizado de esta técnica.
Las indicaciones de la HSC en consulta han variado desde su inicio, bien por la aparición de estudios con un buen nivel de evidencia que han ajustado la recomendación de estas o por la fabricación de dispositivos que han posibilitado nuevas aplicaciones, como es la esterilización tubárica.
Es importante reseñar que, aunque existen numerosas técnicas, tanto invasivas como no invasivas, para evaluar las metrorragias anormales o las lesiones intrauterinas (ecografía, histerosonografía, histerosalpingografía, biopsias endometriales, legrados uterinos), la HSC ofrece el beneficio potencial de combinar el diagnóstico con el tratamiento. También mejora el rendimiento diagnóstico en las patologías focales en comparación con las tomas endometriales a ciegas, ya que permite biopsias dirigidas.
IndicacionesLa HSC ambulatoria está indicada como procedimiento diagnóstico o terapéutico de procesos que afectan a la cavidad endometrial, los ostiums tubáricos o el canal endocervical en las siguientes situaciones:
- 1.
Hemorragia uterina anormal (HUA) en mujeres premenopáusicas.
- 2.
HUA en mujeres posmenopáusicas.
- 3.
HUA en otras situaciones.
- 4.
Hallazgos ecográficos en pacientes asintomáticas.
- 5.
Anomalías müllerianas.
- 6.
Estudio de esterilidad/infertilidad.
- 7.
Extracción de DIU u otros cuerpos extraños.
- 8.
Diagnóstico y extracción de restos trofoblásticos.
- 9.
Lesiones endocervicales.
- 10.
Esterilización tubárica.
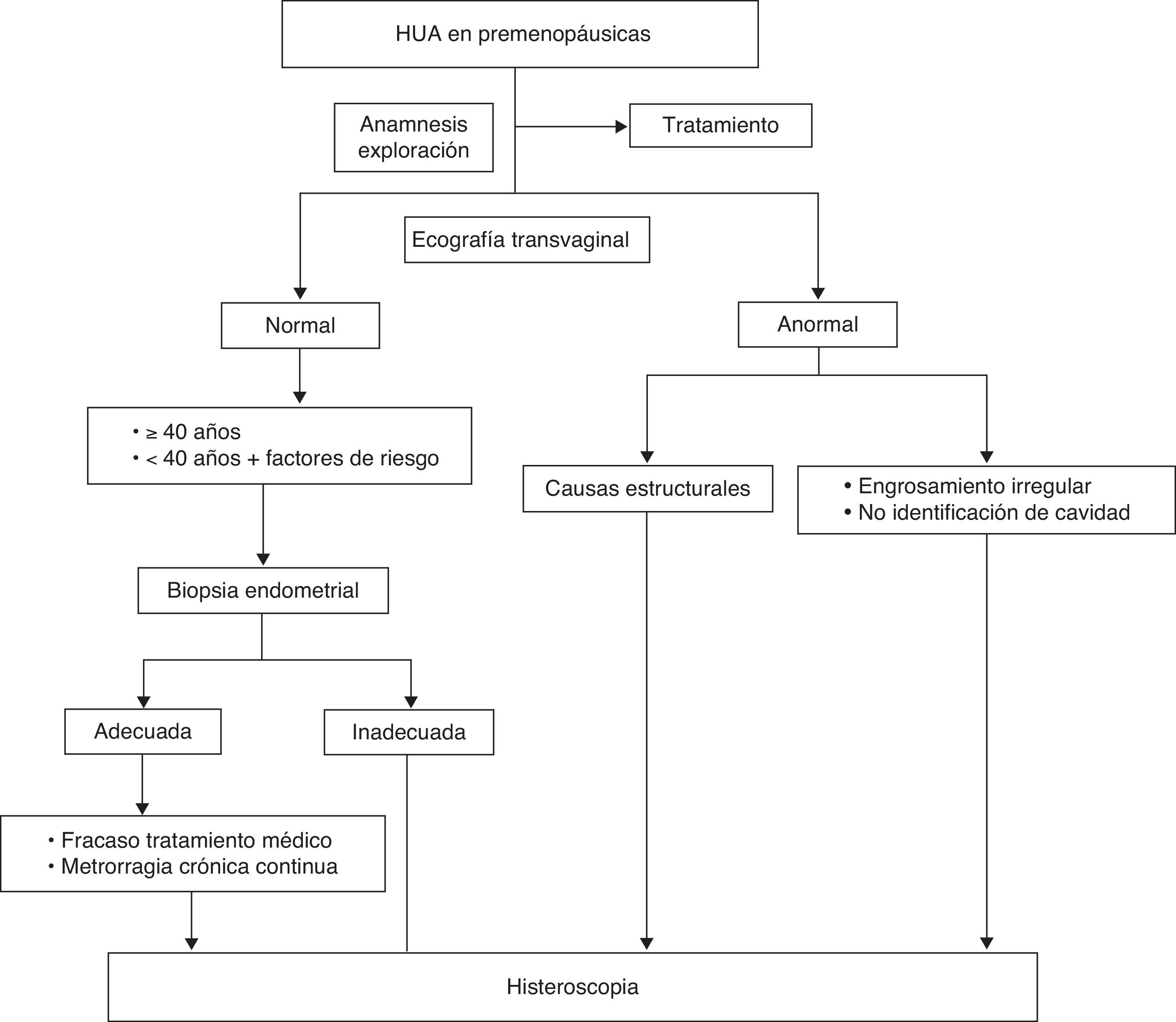
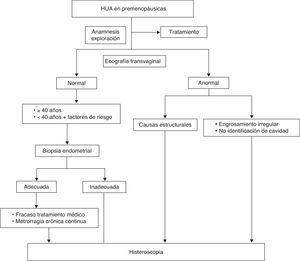
La metrorragia anormal en las mujeres premenopáusicas es responsable al menos de un 30% de las consultas ginecológicas, siendo más frecuente tras la menarquia o en el periodo perimenopáusico1 y en la mayoría de los casos está relacionada con patología uterina estructural (miomas, pólipos, adenomiosis), anovulación, alteraciones de la hemostasia o neoplasia.
La capacidad de la HSC de proporcionar una visualización directa de la cavidad y permitir la biopsia o escisión de lesiones, hace que esta técnica esté considerada como el patrón oro para el diagnóstico de la HUA en este grupo de pacientes, aunque es más costosa e invasiva que las técnicas de imagen para la valoración del endometrio y requiere formación específica2,3.
Está indicada la evaluación del endometrio cuando existe un incremento del riesgo de hiperplasia o neoplasia (B)4: mujeres > 40 años y < 40 años con factores de riesgo (hallazgos indicativos de anovulación crónica o > 90 kg). Si no se puede realizar una biopsia de endometrio o la muestra es inadecuada, está indicada una HSC para biopsia dirigida. (C)5.
La biopsia dirigida por histeroscopia está indicada en mujeres con sangrado irregular persistente y fracaso de tratamiento médico. (B)6.
Si la paciente presenta una metrorragia crónica continua, a pesar de una biopsia de endometrio normal, está indicada la realización de una HSC. (A)5.
Está indicada una HSC cuando se aprecian irregularidades ecográficas en el endometrio, no se visualiza en su totalidad la cavidad endometrial o existe sospecha de causas estructurales (pólipos o miomas) que afectan a la cavidad. (A)5.
Está indicada la valoración de los pólipos endometriales sintomáticos por HSC. (B)5.
La propuesta de algoritmo de decisión a seguir se muestra en la figura 1.
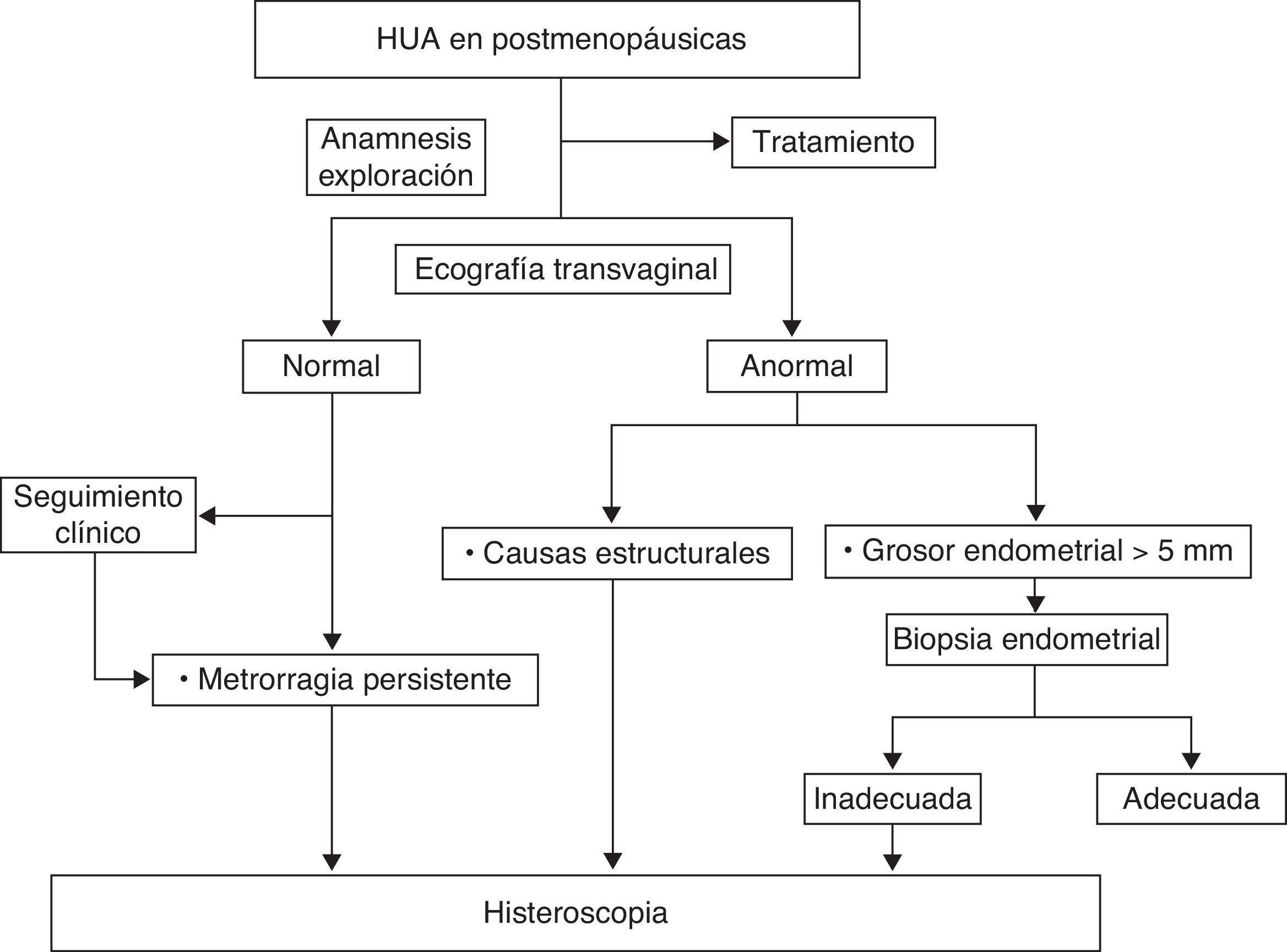
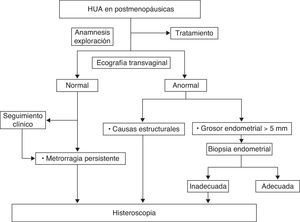
Hemorragia uterina anormal en mujeres posmenopáusicasLa consulta por metrorragia en las mujeres posmenopáusicas representa el 5% de las consultas ginecológicas y aproximadamente en un 10% de los casos se deben a un carcinoma endometrial. No obstante, la causa más común de sangrado es debida a la atrofia de la mucosa endometrial y vaginal7.
La biopsia endometrial está considerada como patrón oro para el diagnóstico de la HUA en este grupo de pacientes donde las lesiones premalignas y malignas son probables. La HSC aumenta además la sensibilidad en el diagnóstico de anomalías focales y estructurales, posibilitando su biopsia o extirpación8.
Como primer paso diagnóstico, está indicada la realización de una ecografía transvaginal para medir el grosor endometrial.
En mujeres con alta sospecha clínica y ecográfica de carcinoma endometrial o hiperplasia, se debe considerar la realización de una biopsia endometrial junto con una HSC en el mismo acto médico, para identificar y biopsiar selectivamente las lesiones focales. Con esto se evitan los falsos negativos descritos al emplear aisladamente una de las técnicas9,10.
Está indicada la biopsia del endometrio en pacientes con metrorragia posmenopáusica y grosor endometrial >5mm (B). Cuando la biopsia está indicada y no se puede realizar por razones técnicas o cuando no es concluyente, debe indicarse una HSC. (B)11.
Está indicada una HSC en mujeres con metrorragia posmenopáusica persistente, independientemente del grosor endometrial. (B)11.
La HSC debe realizarse cuando se sospeche por ecografía patología endometrial susceptible de ser tratada por esta técnica. (B)11.
La propuesta de algoritmo de decisión a seguir se muestra en la figura 2.
Hemorragia uterina anormal en otras situacionesSeguimiento de hiperplasiasLa hiperplasia endometrial se presenta clínicamente como una HUA, más común en post y perimenopáusicas. Su diagnóstico es histológico tras la realización de una biopsia, donde se visualiza una proliferación de glándulas endometriales que puede coexistir o progresar hacia carcinoma endometrial12. Por todo esto, una vez diagnosticada, precisa seguimiento. En cualquiera de los casos en que la biopsia endometrial está indicada, la imposibilidad de su realización o la obtención de una muestra inadecuada obligan a la indicación de una HSC con biopsia dirigida.
Mujeres con terapia hormonal sustitutivaEl aumento de riesgo de hiperplasia endometrial y carcinoma con el tratamiento con estrógenos es contrarrestado por la acción de los progestágenos, ya sea en régimen cíclico o continuo13,14.
Como en el caso anterior, la imposibilidad de la realización de una biopsia de endometrio o la obtención de una muestra inadecuada obliga a la indicación de una HSC con biopsia dirigida.
Se recomienda la valoración histológica del endometrio de las mujeres con spotting o metrorragia escasa si persiste más allá de los 6 meses tras la instauración de terapia hormonal sustitutiva continua. (A)9,10.
El tamoxifeno, por su acción moduladora selectiva de los receptores de estrógeno, tiene una acción agonista sobre el útero, por lo que se ha asociado con hiperplasia endometrial, pólipos y cáncer de endometrio15,16.
Estas pacientes presentan características especiales:
- 1.
Premenopáusicas: en este grupo no existe un incremento de riesgo de cáncer de endometrio debido a que la acción del tamoxifeno en presencia de estrógenos no interfiere en la apoptosis de las células endometriales, mientras que su ausencia en la menopausia hace que el tamoxifeno presente un efecto antiapoptosis que puede contribuir a la oncogénesis en este tejido17. Por todo lo anterior, estas pacientes no requieren monitorización adicional en ausencia de clínica18.
- 2.
Posmenopáusicas: hay evidencias que indican la presencia de grupo de alto y de bajo riesgo para el desarrollo de hiperplasias atípicas debidas al tratamiento con tamoxifeno en estas pacientes basadas en la presencia o ausencia de pólipos endometriales benignos antes del tratamiento19–21. Esto justifica la realización de un cribado pretratamiento con ecografía. La HSC está indicada en casos con ecografía dudosa o con sospecha de patología estructural antes de la iniciación del tamoxifeno18.
Está indicada una HSC con biopsia endometrial en mujeres en tratamiento con tamoxifeno que presenten una metrorragia posmenopáusica, independientemente de los hallazgos de la ecografía vaginal por la baja sensibilidad y especificidad de la misma. (A)11.
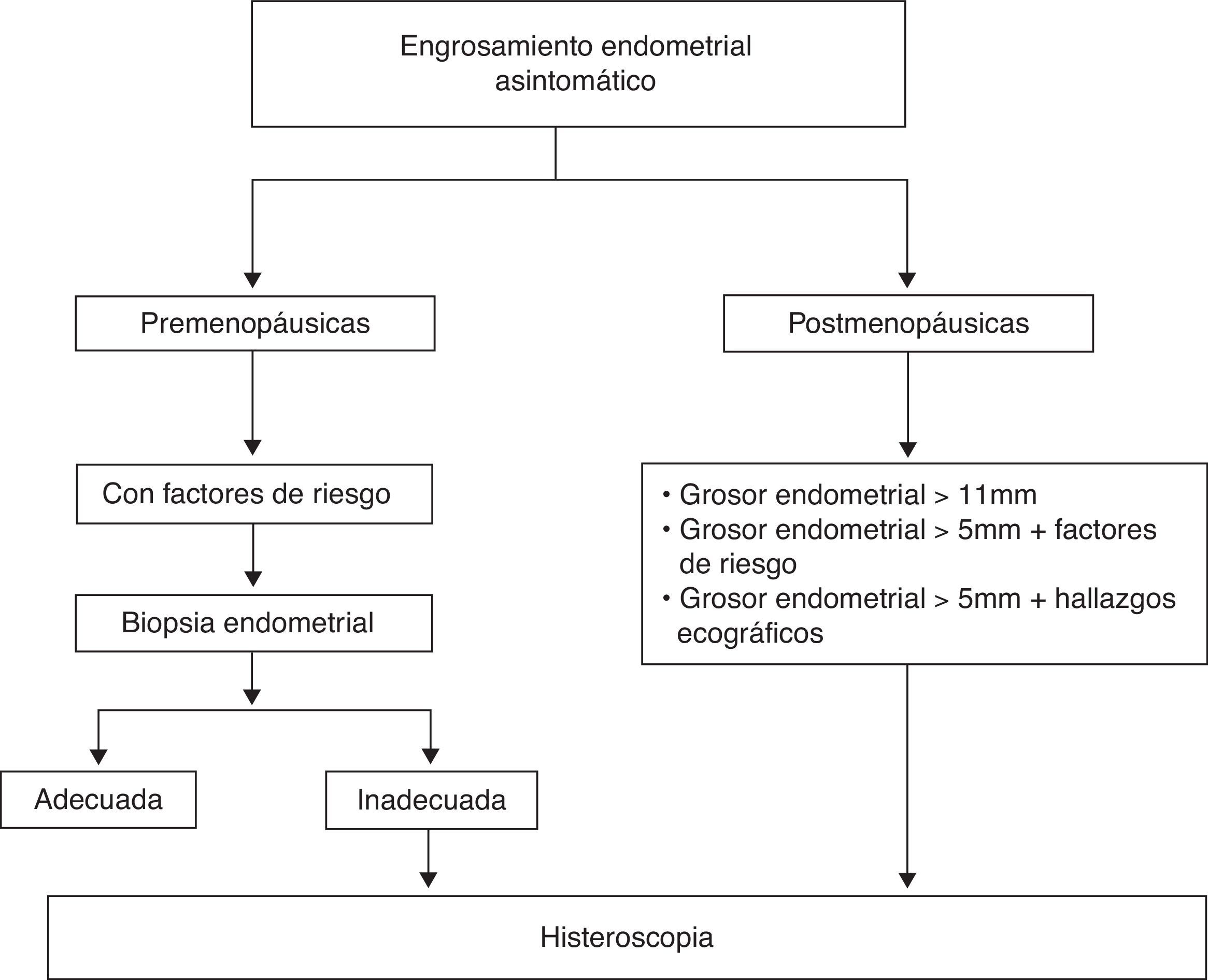
El engrosamiento endometrial, el acúmulo de líquido dentro de la cavidad uterina o la sospecha de anomalías estructurales pueden ser hallazgos en una ecografía de rutina en mujeres asintomáticas.
La realización de una HSC y valoración histológica están indicadas en casos seleccionados que dependen, a su vez, del estado menopáusico de la mujer.
Engrosamiento endometrial- –
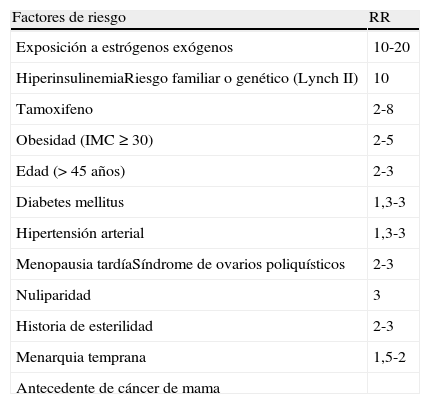
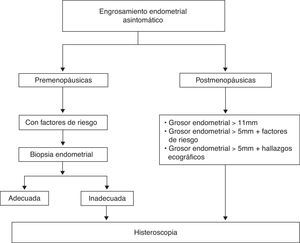
Premenopáusicas: el grosor endometrial por sí solo no es indicación para biopsia, ya que la utilidad de los ultrasonidos para excluir lesiones malignas o premalignas en este grupo de pacientes aún no está establecido22,23. Se debe tener en cuenta la realización de una biopsia endometrial cuando coexiste un engrosamiento con algún factor de riesgo para cáncer de endometrio (tabla 1). Se considera engrosamiento un endometrio > 8mm en fase proliferativa y > 14mm en fase secretora23.
Tabla 1.Factores de riesgo del cáncer de endometrio
Factores de riesgo RR Exposición a estrógenos exógenos 10-20 HiperinsulinemiaRiesgo familiar o genético (Lynch II) 10 Tamoxifeno 2-8 Obesidad (IMC≥30) 2-5 Edad (> 45 años) 2-3 Diabetes mellitus 1,3-3 Hipertensión arterial 1,3-3 Menopausia tardíaSíndrome de ovarios poliquísticos 2-3 Nuliparidad 3 Historia de esterilidad 2-3 Menarquia temprana 1,5-2 Antecedente de cáncer de mama - –
Posmenopáusicas: la ecografía transvaginal no se debe utilizar como cribado para el cáncer de endometrio en mujeres asintomáticas, ya que existe hasta un 17% de mujeres que presentan un grosor ≥5mm, con una incidencia de carcinoma endometrial inferior al 1%24-28 (NE=1a).
Está indicada la realización de HSC en:
- –
Mujeres con engrosamiento endometrial > 11mm. El riesgo de cáncer de endometrio en este grupo es del 6,7%, semejante al riesgo que presenta una mujer posmenopáusica con metrorragia y grosor endometrial > 5mm, frente al 0,002% si el grosor endometrial es < 11mm29,30 (NE=1a).
- –
Mujeres con engrosamiento endometrial > 5mm unido a la presencia de otros hallazgos ecográficos, como son un aumento de la vascularización, la existencia de líquido intracavitario o endometrio dishomogéneo29 (NE=1a).
- –
Mujeres con grosor endometrial > 5mm y con algún factor de riesgo para cáncer de endometrio, fundamentalmente obesidad, HTA o menopausia tardía29 (GR=B).
No se recomienda la utilización de la ecografía transvaginal como cribado para cáncer de endometrio en mujeres asintomáticas. (A)29.
Es recomendable la realización de HSC y valoración histológica en mujeres asintomáticas con un engrosamiento endometrial en la ecografía transvaginal > 11mm. (A)29.
Es recomendable la realización de HSC y valoración histológica en mujeres asintomáticas con un engrosamiento endometrial > 5mm unido a otros hallazgos ecográficos, como son aumento de vascularización, endometrio heterogéneo o existencia de líquido intracavitario. (A)29.
Es recomendable individualizar la necesidad de realización de otras pruebas complementarias en aquellas mujeres asintomáticas con engrosamiento endometrial > 5mm y la presencia de algún factor de riesgo para cáncer de endometrio, como obesidad, HTA y menopausia tardía. (B)29.
La propuesta de algoritmo de decisión a seguir se muestra en la figura 3.
Pólipos endometrialesPremenopáusicas: en cuanto a los pólipos endometriales asintomáticos en pacientes premenopáusicas, el inconveniente es que no hay datos de ensayos aleatorios que puedan orientar el tratamiento y el seguimiento en estos casos, por lo que los protocolos de actuación mayoritariamente utilizados están en función de la existencia o no de factores de riesgo para hiperplasia endometrial o carcinoma.
Por tanto, se realizará HSC y polipectomía en mujeres asintomáticas con factores de riesgo31 (NE=IV).
No existe consenso para la indicación de polipectomía por el tamaño del pólipo ni por el número. Algunos autores recomiendan manejo expectante con seguimiento ecográfico en mujeres asintomáticas sin factores de riesgo con pólipo único ≤ 1,5cm, ya que es probable su regresión31.
Posmenopáusicas: aunque algunos autores recomiendan la extirpación de los pólipos asintomáticos en las mujeres posmenopáusicas en función de su tamaño, de la edad de la paciente (> 60 años) y de otros factores de riesgo de cáncer de endometrio (sobre todo HTA)29, actualmente se recomienda la extirpación de todos los pólipos endometriales en mujeres posmenopáusicas, con independencia de su sintomatología, ante la posibilidad de la existencia de lesiones premalignas o malignas31 (NE=1b). Se identifica patología maligna en un 0,5-4,8% de todos los pólipos encontrados en mujeres posmenopáusicas29.
Está indicada la polipectomía en mujeres premenopáusicas asintomáticas con factores de riesgo de cáncer de endometrio. (C)31.
Se recomienda la extirpación de todos los pólipos endometriales en posmenopáusicas con independencia de su sintomatología. (A)31.
En premenopáusicas, la HSC está indicada para confirmar la porción intracavitaria del mioma previo a la resección32. También se utiliza para confirmar su diagnóstico en caso de ecografía transvaginal no concluyente, independientemente del estado menopáusico.
Anomalías müllerianasActualmente, los métodos de imagen son consideradas las pruebas diagnósticas indicadas en caso de sospecha de malformación uterina. Dentro de éstas, se encuentran la resonancia magnética y la ecografía 3D, con una validez muy alta en el diagnóstico de estas anomalías33.
Estudio de esterilidad/infertilidadEn este grupo de pacientes, la HSC no se considera una técnica para la evaluación básica de la pareja estéril y solo está indicada en determinadas circunstancias:
La HSC no está indicada en el inicio del estudio de infertilidad. (B)34.
Ante la sospecha de miomas, pólipos, adherencias o anomalías müllerianas en pacientes estériles en las que se va a realizar una técnica de reproducción asistida, debe indicarse una HSC. (C)31,35.
Se recomienda realizar una HSC en pacientes estériles con fracasos de implantación tras técnicas de reproducción asistida. (C)36.
Dado que esta técnica es la más indicada para la valoración de la cavidad bajo visión directa, también lo es para la extracción de DIU y cuerpos extraños37.
Diagnóstico y extracción de restos trofoblásticosLas ventajas de la utilización de la HSC en estos casos son que define mejor las irregularidades focales en la cavidad uterina, diferencia las masas libres endocavitarias de las adheridas a la pared uterina y posibilita su resolución en el mismo procedimiento.
Está indicada en pacientes estables, sin metrorragia abundante y con sintomatología que persiste más allá de 3 semanas38.
En este contexto, se puede utilizar para la toma de muestras de vellosidades para cariotipo en mujeres con abortos de repetición.
Lesiones endocervicales- –
Benignas: la utilización de la HSC en este grupo está limitada a los casos de pólipos endocervicales que plantean dudas diagnósticas con miomas submucosos pediculados o pólipos endometriales y al estudio de las pacientes estériles en las que se sospechen anomalías estructurales del canal cervical39.
- –
Citología cervical con atipias glandulares: las indicaciones de biopsia de endometrio para el cribado de lesiones endometriales en estas pacientes está en función de 3 variables: edad, tipo de atipia de células glandulares y la existencia de factores de riesgo de carcinoma endometrial40-42.
Se utilizará la HSC cuando no sea posible la biopsia endometrial o la muestra sea inadecuada.
Esterilización tubáricaCon la técnica actual, la esterilización por HSC se puede realizar fácilmente de forma ambulatoria y es el método menos invasivo para la anticoncepción irreversible, con una eficacia similar o mayor que otros métodos de esterilización43,44. Se describe ampliamente en el protocolo correspondiente de la SEGO45.
ContraindicacionesLas contraindicaciones absolutas han seguido una evolución inversa a las indicaciones de la HSC hasta reducirse a46:
- –
Gestación intrauterina viable.
- –
Infección pélvica activa (incluye también la infección por herpes simple).
- –
Cáncer cervical o uterino conocido.
Aunque la metrorragia abundante puede limitar la visualización durante el proceso, no se puede considerar como una contraindicación.
EquipamientoSalaDado que cada día se lleva a cabo un mayor número de procedimientos diagnósticos y terapéuticos en la consulta de HSC, esta debe tener unas características determinadas48:
- –
Debe ser espaciosa para poder acomodar todo el equipamiento necesario.
- –
Permitir la adecuada movilidad del personal sanitario y de la paciente.
- –
Puede ser exclusiva para este uso o bien una sala multidisciplinar.
Es preciso que la consulta esté bien organizada. Esto nos permite el buen desarrollo de la intervención y disminuir sus costes. Antes de iniciar cualquier procedimiento, es necesario comprobar el funcionamiento de todo el instrumental48. Habitualmente se trabaja con una enfermera en consulta que está pendiente del instrumental durante la realización de la prueba.
Dado que la HSC diagnóstica genera gran ansiedad en la paciente, la sala debe tener la privacidad adecuada y es recomendable que disponga de una zona anexa de cambio, si es posible con aseo incluido47.
Idealmente, debería disponer de una sala adyacente para permitir el reposo posterior a la realización de la prueba, que algunas pacientes van a necesitar. Es adecuado disponer en la consulta de medicación, sistemas de sueros y sueros, que pueden ser necesarios en caso de complicaciones.
La HSC diagnóstica no se debe realizar en quirófano de forma habitual, dado que aumenta la ansiedad de la paciente y los costes económicos asociados47.
Todos los servicios de Ginecología deberían disponer de una unidad de HSC para el manejo de la paciente con HUA. Existen beneficios clínicos y económicos asociados a este recurso. (C)47.
Existen diferentes modelos de mesas de exploración disponibles en el mercado. Los mejores modelos son los regulables en altura mediante motor eléctrico y con cajón para recogida de suero fisiológico bajo el asiento.
Sistema videópticoSe compone de 4 elementos básicos:
- 1.
Monitor de televisión: existen diferentes tipos en el mercado, desde los más sencillos a los más sofisticados. Para conseguir un buen rendimiento de la cámara, es preciso tener un buen monitor y viceversa. Todo el equipo debe ir en consonancia de calidad.
- 2.
Videocámara endoscópica: para elegir una videocámara hay que tener presente:
- –
La resolución: expresada por número de líneas en píxeles.
- –
Sensibilidad por unidades de lux.
- –
Alta calidad de salida y de imágenes de video.
Actualmente, existen en el mercado sistemas que proveen una alta resolución y una reproducción casi real de los colores naturales.
- –
- 3.
Unidad de vídeo para grabación de imágenes.
- 4.
Impresora para obtener material fotográfico.
Como la HSC se realiza siempre bajo visión videoendoscópica, las características de la fuente de luz tienen una gran repercusión en la calidad de la imagen. La fuente de luz fría puede ser convencional (halógena), que proporciona una luz más amarillenta o de xenón, más recomendable y también más cara, con la que se obtienen mejores resultados pues brinda una luz blanca y una calidad superior de imagen. En general, 175W de potencia son suficientes para intervenciones rutinarias. Para realizar todo tipo de intervenciones, son recomendables potencias de 300W48.
Este debe ser el último elemento que se encienda al inicio de una exploración y el primero que se apague al finalizar. Cuando no se está utilizando, es mejor dejarlo en «stand by». La repetida conexión y desconexión puede estropear la lámpara49.
Cable de luzEs un cable de fibra óptica que conecta la óptica con la fuente de luz. Debe ser manipulado con cuidado para evitar su desgaste y prolongar su tiempo de uso. Evitar doblarlo en exceso y usar un sistema de esterilización adecuada49.
HisteroscopiosExisten diferentes modelos de histeroscopios diagnósticos:
- –
Histeroscopios flexibles: son muy bien tolerados y muy útiles en pacientes con úteros irregulares50. Son difíciles de esterilizar, más frágiles y más caros. En general, no han demostrado ventajas sobre los rígidos.
- –
Histeroscopio semirrígido: son histeroscopios con fibra óptica de 1,9mm, con vaina de flujo continuo desechable, con canal operatorio de 7 Fr y un calibre global de 3,5mm. Es muy bien tolerado, aunque el campo de visión es limitado (óptica de 0°) y exige destreza histeroscópica. Su coste es mayor.
- –
Histeroscopio rígido: aunque parece que ocasionan un mayor dolor intraoperatorio, en la mayoría de los casos son bien tolerados. Ofrecen una mejor calidad de imagen y tienen menor coste51.
Los histeroscopios flexibles se asocian a menor dolor durante la HSC comparados con los rígidos. Sin embargo, los rígidos se asocian a mejor calidad de imagen, menos fallos de realización, menos tiempo en el procedimiento y coste menor. (B)47.
No existe suficiente evidencia para recomendar un tipo u otro. La elección debe quedar a criterio del ginecólogo. (B)47.
El histeroscopio se compone de:
ÓpticaEs el telescopio de pequeño calibre, los más utilizados son de 2,7-2,9mm. Está compuesto por una serie de lentillas convenientemente colocadas para conseguir una visión adecuada. El extremo distal tiene una angulación (visión foroblicua) que puede oscilar entre 0, 12 y 30°. Las más utilizadas son las de 30° porque facilitan la exploración de los cuernos y cantos uterinos sin tener que mover el histeroscopio de un lado a otro48.
No existe suficiente evidencia para recomendar un tipo de óptica. La elección debe quedar a criterio del ginecólogo. (C)47.
- –
Interna, que alberga el canal de entrada del medio de distensión uterino y el canal de trabajo (generalmente de entre 5 y 7 Fr).
- –
Externa, que alberga el canal de drenaje del medio de distensión.
Su calibre global oscila entre 3,5 y 5mm. Podemos mejorar el bienestar de la paciente trabajando sin la vaina externa, si el procedimiento lo permite.
Tres estudios aleatorizados comparan el dolor asociado al uso de histeroscopios de 5mm frente a histeroscopios de 3-3,5mm. El dolor fue significativamente menor con los histeroscopios de menor calibre en 2 de los 3 estudios (p < 0,001 en ambos)52,53; en el tercero no se encontraron diferencias estadísticamente significativas54.
Los minihisteroscopios (con 3-3,5mm) reducen significativamente el dolor que experimenta la paciente en la HSC diagnóstica. (A)47.
Podemos utilizar distintos elementos, todos insertados a través del canal de trabajo del histeroscopio diagnóstico:
- –
Mecánicos: o instrumentos semirrígidos, especialmente diseñados para introducirse en la cavidad uterina a través del canal de trabajo. Tienen un diámetro de 2-3mm. Los más usados son las pinzas de agarre, pinzas de biopsia y tijeras48.
- –
Electroquirúrgicos: en la consulta, se emplea energía bipolar que permite emplear suero fisiológico como medio distensor. El sistema Versapoint® consiste en un generador electroquirúrgico bipolar coaxial que proporciona distintos modos operativos (modo corte, modo coagulación y modo blend) y un electrodo flexible de reducido calibre (5 Fr) que puede ser introducido a través del canal de trabajo del histeroscopio diagnóstico55.
- –
Láser: se trata de energía liberada por un átomo en forma de fotones cuando es estimulado por una fuente externa de energía. Se utilizan átomos de distintos elementos para crear los haces de luz láser. Se puede utilizar con suero fisiológico, permite la realización de procedimientos quirúrgicos ambulatorios que con el instrumental mecánico no se pueden realizar en consulta y es muy bien tolerado por la paciente si se coloca anestesia cervical.
- –
Micromorcelador: dispositivo de 35cm de longitud constituido por 2 tubos de metal huecos, rígidos y desechables que se introducen uno dentro de otro y, a su vez, en un histeroscopio rígido. El tubo interno gira dentro del externo a una velocidad de 750 revoluciones. El material es extraído por aspiración y recogido para estudio histológico. Hasta ahora se introducía en un canal de trabajo de 9mm, por lo que era necesaria la dilatación del cérvix y su realización en quirófano. Con la llegada de los nuevos micromorceladores que permiten ser introducidos en canal de trabajo de 6,5mm se podría emplear de forma ambulatoria sin necesidad de dilatación cervical. No utiliza electrocoagulación, por lo que no permite coagular los vasos sangrantes encontrados en la cirugía.
La cavidad uterina requiere distensión para una adecuada visualización, pero es necesario evitar la sobredistensión que puede causar dolor (para ello no usaremos presiones altas de forma innecesaria). Actualmente, el medio de distensión más utilizado es el suero fisiológico.
Aunque en los inicios de la HSC se utilizaron medios de distensión gaseosos (CO2), a pesar de presentar buenas propiedades ópticas, quedaban muy limitados, pues ante cualquier elemento que enturbiara el campo (sangre, moco…) la exploración no podía llevarse a cabo. Además, existe el riesgo importante de embolia gaseosa. Existe mayor probabilidad de imágenes insatisfactorias, por burbujas o sangrado con dióxido de carbono frente a suero salino (RR 4,75; IC del 95%, 1,61-16,4)56.
El suero fisiológico es de elección cuando se va a realizar algún tipo de intervención o se va a usar energía bipolar57. Al ser isotónico, el riesgo de hiponatremia y la disminución de la osmolaridad son muy bajos. Se puede realizar un lavado continuo de la cavidad uterina.
Es el medio de distensión más recomendado por su bajo peso molecular, su contenido electrolítico, amplia disponibilidad, bajo coste y reabsorción fisiológica a través del peritoneo. Además, permite la utilización de electrodos bipolares y láser (no permite utilizar energía monopolar).
El riesgo de reacciones vasovagales es significativamente menor con suero que con dióxido de carbono (OR 3,24; IC del 95%, 1,23-8,54)58.
El suero salino da mejores imágenes más frecuentemente y permite realizar la exploración más rápidamente que con dióxido de carbono. (A)4.
Ningún medio ha demostrado ser mejor para reducir el dolor, si bien el suero salino disminuye la incidencia de reacciones vasovagales. (A)47.
La cirugía ambulatoria histeroscópica, utilizando energía bipolar o láser, precisa utilización de suero salino como medio de distensión y de conducción. (C)47.
Para perfundir el medio de distensión se puede utilizar varios sistemas:
- –
Caída por gravedad. Elevando la bolsa de suero unos 90-100cm sobre el periné de la paciente.
- –
Manguito de presión: colocado alrededor de la bolsa de suero. Un asistente debe mantener una presión en torno a 80mmHg.
- –
Bomba electrónica de perfusión. Para realizar procedimientos más allá de la simple HSC diagnóstica y biopsia dirigida, es aconsejable perfundir el medio de distensión con bomba (combinada de succión e irrigación, con presiones controladas electrónicamente), para evitar en lo posible la contracción uterina inoportuna. Para alcanzar una distensión uterina de alrededor de 50mmHg, hay que tener en cuenta los siguientes ajustes: flujo de 200ml/min, presiones de irrigación 75mmHg y presiones de succión de (–) 0,25bar48.
Es fundamental una correcta selección y preparación previa a la realización de una HSC en consulta. En aquellas candidatas con estenosis cervical, ansiedad importante y comorbilidades, y en las que se prevea realizar técnicas quirúrgicas, la preparación previa es aun más importante para evitar el fracaso de la técnica. Las principales causas del fracaso de la HSC en consulta incluyen: dolor, estenosis cervical y una mala visualización durante la exploración59.
Se ha comprobado una correlación significativa entre el dolor percibido durante la HSC y el tiempo de espera previo de la paciente en la puerta de la consulta; así, en esperas mayores de 60 min, el RR de tener un dolor moderado mayor de 4 (sobre 10) es de 5,21 (IC del 95%, 1,29-35,50)60.
Información previa a la pacienteTambién es obligada la correcta cumplimentación del consentimiento informado previo a la realización de la prueba (véase el consentimiento informado de histeroscopia ambulatoria de la SEGO).
Se recomienda, como norma de buena práctica, la entrega a la paciente de una hoja informativa sobre la técnica, las indicaciones, qué se va a realizar (solo diagnóstico o intentar técnicas quirúrgicas), las normas de preparación previas, el día, el lugar y la hora de la cita47.
El momento de realizar la prueba es importante en mujeres premenopáusicas61. La realización en la primera mitad del ciclo (días 5.°-14.°) tiene como ventajas: a) un mejor paso por el canal cervical gracias a que el moco está más limpio y el istmo hipotónico; b) una menor probabilidad de embarazo, y c) una mejor evaluación de la descamación menstrual.
Sus inconvenientes son: a) un mayor sangrado; b) peor valoración de la hiperplasia y endometritis, y c) menor utilidad en caso de esterilidad e infertilidad.
En la segunda mitad del ciclo (días 14.°-26.°), las ventajas son: a) poder valorar un endometrio totalmente desarrollado; b) obtener imágenes más estables; c) menor sangrado, y d) mayor adecuación para el diagnóstico de las alteraciones funcionales, así como de los procesos inflamatorios.
Por el contrario, los inconvenientes son: a) un moco más espeso que dificulta la visión, y b) un endocérvix más sangrante y con mayor dificultad a su paso.
En mujeres premenopáusicas con ciclos regulares, de forma general, el momento óptimo es durante la fase proliferativa, después de la menstruación; si los ciclos son impredecibles, se puede hacer en cualquier momento, siempre que se haya descartado la posibilidad de gestación59.
Si la paciente está tomando anticonceptivos, se podrá hacer en cualquier momento del ciclo, siendo las ventajas y los inconvenientes una mezcla de las anteriores.
Cuando se prevé la necesidad de realizar una polipectomía, la toma de anticonceptivos (bien 10 días antes62 o en el mes previo63) parece que mejora la calidad de la visualización y la satisfacción de la paciente, y acorta el tiempo de realización de forma significativa.
AnalgesiaEl principal motivo de fracaso en la HSC en consulta es el dolor (la tasa de éxito varía entre el 77 y el 97%). Además, este puede tener una repercusión negativa sobre la capacidad de la paciente para cooperar y, por tanto, limita el poder completar la exploración64.
El dolor durante la HSC en consulta se define como leve a moderado y sus causas son múltiples64:
- –
Durante la realización de la prueba, se debe a la manipulación cervical, la distensión y la contractilidad uterina.
- –
Tras su realización, se debe a la contractilidad uterina y a la descarga de prostaglandinas que se produce.
A los 5 o 10 min de finalizar el procedimiento, el dolor comienza a disminuir y a los 30 min la mayoría de las pacientes lo refieren como malestar. La mayoría de los estudios sobre analgesia previa con opioides o antiinflamatorios no esteroideos no demuestran una disminución del dolor durante la realización de la prueba frente al placebo ni tampoco una disminución en la frecuencia de reacciones vasovagales, si bien sí disminuye de forma significativa el dolor al finalizar la prueba y pasados 30 min64.
El uso rutinario de los analgésicos previo a la realización de la prueba debe desaconsejarse porque puede causar efectos secundarios, no disminuyendo el dolor durante la prueba. (B)47.
El momento óptimo de su toma, si decidimos indicarlos, es una hora antes de su realización, siendo preferible que dicha toma se haga antes de la llegada al hospital. (B)47.
Hasta el año 2007 no existían estudios de buena calidad para establecer conclusiones respecto al uso de antibióticos profilácticos para prevenir infecciones intrauterinas tras la HSC65.
En mujeres sometidas a HSC en consulta que tenían lesiones intrauterinas que precisaban extirpación (pólipos, útero septo, adherencias….), no hay diferencias en relación con complicaciones infecciosas entre los grupos de administración de antibióticos profilácticos frente a placebo66. En mujeres infértiles sometidas a una HSC en consulta no se ha demostrado que la profilaxis antibiótica disminuya la frecuencia de infecciones67.
No está recomendada su administración para una HSC en consulta, salvo historia reciente de enfermedad inflamatoria pélvica o hidrosalpinx. (B)68.
La profilaxis de endocarditis bacteriana en pacientes con cardiopatías no está indicada cuando se vaya a realizar una HSC ambulatoria. (C)69.
La HSC en consulta no se encuentra entre las técnicas que se asocian a un riesgo aumentado de sangrado en tomadoras de fármacos antitrombóticos. Este riesgo se encuentra más aumentado cuanto menos tiempo hace de la toma del fármaco70.
En mujeres que tomen fármacos antagonistas de la vitamina K (Sintrom®), si bien lo normal en procedimientos quirúrgicos es dejar de tomarlos 5 días antes; en procedimientos menores con sangrado autolimitado, como es la HSC en consulta, puede bastar con suspender la toma durante 2-3 días o bien continuar su ingesta, tomando además durante el día de la prueba ácido tranexámico por vía oral70.
En pacientes que toman ácido acetilsalicílico o derivados, en procedimientos menores no está documentado un mayor riesgo de sangrado. Por tanto, pueden continuar tomándolos, especialmente si el riesgo de evento cardiovascular es alto. Si el riesgo es bajo, se puede suspender su toma 7 días antes70.
En pacientes que reciben heparina de bajo peso molecular a dosis profilácticas, basta con dejar 12 h entre su administración y la prueba. Si es a dosis terapéuticas, el tiempo mínimo deberá ser de 24 h70.
En pacientes o grupos seleccionados, puede valorarse su uso. Así, algunos estudios en mujeres posmenopáusicas al administrar 400mg de misoprostol por vía vaginal 4-8 h antes de la realización de la técnica refieren una disminución del dolor, si bien estos hallazgos no son consistentes ni los estudios están bien diseñados47.
En mujeres infértiles, sin usar anestesia, la administración de misoprostol vaginal 400mg el día previo reduce el dolor percibido durante la realización de la HSC frente al placebo o la administración por vía oral de misoprostol y también acorta el tiempo para su realización71.
No se recomienda la preparación cervical sistemática, pues no existe beneficio en términos de reducción del dolor, disminución del número de fallos de la técnica o disminución de traumatismos uterinos, ni en premenopáusicas ni en posmenopáusicas para HSC en consulta. (A)47.
Al comparar la administración de fentanilo con atropina y midazolam frente a anestesia local paracervical con mepivacaína, no se encontraron diferencias en dolor durante la realización de la técnica o posteriormente, ni en satisfacción72.
No se recomienda la sedación, ya que no ofrece ventajas en términos de control del dolor o satisfacción frente a la anestesia local. (A)47.
La realización de la exploración bimanual previa no es imprescindible y si bien puede ayudarnos a conocer el tamaño y la posición uterina no debemos olvidar que puede producir molestias a la paciente y que no siempre podrá realizarse. Si vamos a usar la técnica de vaginoscopia, su realización no está indicada.
Desinfección vaginalNo es necesaria su realización, si usamos la técnica de la vaginoscopia73. Cuando sospechemos infección vaginal o cervical, se debería posponer la prueba y realizar un cultivo y/o pautar tratamiento.
AnestesiaSe debe usar de forma obligada anestesia local cuando usemos histeroscopios mayores de 5mm o cuando sea necesario la dilatación cervical por sospecha de estenosis. El alivio efectivo del dolor con anestesia local depende de distintos factores, como la vía de administración, la concentración, el tipo de fármaco y el intervalo entre la administración y el comienzo del procedimiento64.
El fracaso de la técnica por dolor es menor en el grupo con anestésico (OR 0,29; IC del 95%, 0,12-0,69) frente a placebo, pero no hay diferencias en el fracaso de la técnica por estenosis cervical (OR 1,31; IC del 95%, 0,66-2,59)64. No hay diferencias en los efectos adversos o en el fracaso de la técnica según la vía de administración64.
No está indicado su uso para disminuir la incidencia de reacciones vasovagales. (A)64.
Anestesia tópica: que puede aplicarse como:
- –
Gel en cérvix: no existen diferencias en dolor frente a placebo74.
- –
Transcervical: no existe diferencia en la reducción del dolor durante la realización de la histeroscopia, aunque sí disminuye la incidencia de reacciones vasovagales (OR 0,29; IC del 95%, 0,12-0,74)75.
No disminuye el dolor durante su realización pero sí la frecuencia de reacciones vasovagales. (A)64.
Se debe considerar cuando sea necesario aplicar pinzas de Pozzi en el cérvix. (A)64.
Anestesia local inyectable en forma de:
- –
anestesia intracervical o
- –
bloqueo paracervical.
Existe una reducción significativa de la puntuación media del dolor con el uso de anestésicos locales en comparación con placebo durante el procedimiento (OR 0,45; IC del 95%, 0,17-0,73) y a los 30 min posteriores (OR 0,51; IC del 95%, 0,21-0,81). (A)64.
No está claro que esa disminución tenga relevancia clínica, ya que la reducción de las puntuaciones medias del dolor es pequeña, lo que hace que la importancia clínica de los resultados sea limitada. Esta reducción es algo mayor en posmenopáusicas64. Esta ventaja en la disminución del dolor puede desaparecer con el uso de un histeroscopio más pequeño y usando la técnica de vaginoscopia47,74.
Solamente el bloqueo paracervical tiene un efecto anestésico demostrado, aunque en algunos trabajos se observa que el tiempo de espera fue menor que el tiempo requerido para el efecto máximo del anestésico76.
Esta técnica no ha demostrado diferencias en cuanto al dolor frente al placebo en la parte alta uterina o en la manipulación tubárica al colocar dispositivos para esterilización. (A)68,77.
Se aconseja un intervalo entre la administración del anestésico y el comienzo de la técnica de al menos 10 min. (A)64.
Esta debería ser la técnica estándar, especialmente cuando la introducción del espéculo se sospecha difícil o imposible.
Cuando se compara la técnica tradicional de espéculo con esta, no se encuentran diferencias en el número de fallos de la prueba, pero la vaginoscopia se asocia a menor dolor69.
La vaginoscopia reduce el dolor durante la realización de la HSC en consulta con histeroscopio rígido. (A)47.
Por este motivo, no se recomienda de forma rutinaria ni la colocación de espéculo, ni el pinzamiento cervical, ni la dilatación cervical previa.
Exploración del canal cervicalAdaptando el histeroscopio a la anatomía cervical y teniendo en cuenta la visión foroblicua.
Exploración de la cavidad uterinaEn cuanto el histeroscopio se encuentra en la cavidad uterina, se sitúa en el centro, manteniendo su extremo distal a una distancia de 1,5-2mm del fundus. Mientras se sujeta el cable de luz y se mantiene inalterada la posición de la cámara, se gira el telescopio 180° en el sentido de las agujas del reloj y 180° en sentido contrario a las agujas del reloj, lo que permite el examen completo del fondo uterino con mínimas incomodidades para la paciente.
ComplicacionesLa HSC ambulatoria realizada en la consulta es una exploración segura. La frecuencia de complicaciones descritas a corto plazo es de un 0,13% para las diagnósticas solo y de un 0,95% para las terapéuticas. Esta tasa de complicaciones puede ser aún menor si usamos la técnica de la vaginoscopia.
La frecuencia de complicaciones a largo plazo es del 0,001% en seguimiento a un año73.
Traumatismo uterinoAquí englobamos laceraciones del cérvix y la perforación uterina. Su frecuencia está entre el 0,002-1,7%73, siendo menor cuanto menor es el diámetro del histeroscopio47.
Si se encuentra una resistencia importante al paso del histeroscopio por el cérvix, este puede necesitar preparación, y si está disponible un histeroscopio flexible, debería usarse para conocer el ángulo de inclinación del cérvix47.
Los factores asociados con la perforación son: dilatación a ciegas, estenosis cervical, canal cervical tortuoso y cavidad uterina en posición forzada47.
Las perforaciones uterinas en la línea media raramente producen morbilidad, salvo que sean con elementos electroquirúrgicos o láser. Las perforaciones laterales pueden ocasionar hematomas retroperitoneales. Las perforaciones cervicales pueden producir sangrado59.
Síncope vasovagalEn ocasiones, el paso a través del orificio cervical interno puede desencadenar reflejos vagales intensos, provocando bradicardia, hipotensión y mareo. Es más frecuente que ocurra en pacientes nulíparas, en mujeres posmenopáusicas y en pacientes sometidas a una conización.
La mayoría se resuelve de forma espontánea, manteniendo a la paciente en ligero Trendelenburg. No obstante, en ocasiones es necesario utilizar atropina para ayudar a recuperarse a la paciente.
Complicaciones infecciosasLa presencia de infección tras una HSC es extremadamente rara, menor del 1%58,67, siendo más frecuente en aquellas mujeres con infección pélvica latente (endometritis, salpingitis, etc.). Es por esta baja tasa de complicaciones infecciosas que no se justifica el uso de profilaxis antibiótica, salvo historia reciente de enfermedad inflamatoria pélvica o hidrosalpinx.
| Clasificación de las recomendaciones en función del nivel de evidencia (NE) disponible | |
| Ia | La evidencia científica procede a partir de metaanálisis de ensayos clínicos controlados y aleatorizados |
| Ib | La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa | La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb | La evidencia científica procede de al menos un estudio casi experimental, bien diseñado |
| III | La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles |
| IV | La evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio |
| Grados de recomendación (GR) | |
| A | Existe buena evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica Ia y Ib) |
| B | Existe moderada evidencia sobre la base de la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica IIa, IIb y III) |
| C | La recomendación se basa en la opinión de expertos o en un panel de consenso. (Recoge el nivel de evidencia IV) |
Los Protocolos Asistenciales de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en Departamentos y Servicios Hospitalarios.