Las infecciones del tracto urinario (ITU), son junto con la anemia del embarazo, una de las complicaciones médicas más frecuentes de la gestación y su importancia radica en que pueden repercutir tanto en la salud materna, como en la evolución del embarazo.
Su incidencia se estima en 5-10% de todos los embarazos. Aunque la mayor parte de las veces se trata de bacteriurias asintomáticas (2-11%), en ocasiones son procesos clínicos sintomáticos como cistitis (1,5%) o pielonefritis (1-2%).
DefiniciónSe considera ITU, la presencia de bacterias en el tracto urinario capaces de producir alteraciones morfológicas y/o funcionales. En el cultivo de orina debe existir una bacteriuria significativa [>100.000 unidades formadoras de colonias (UFC)/ml de un único uropatógeno] en orina recogida por micción espontánea, o>1.000UFC/ml si se recoge la orina por sondaje vesical o cualquier cantidad si la muestra es obtenida por punción suprapúbica1.
En la mujer no gestante se precisan dos urocultivos positivos para confirmar el diagnóstico de bacteriuria asintomática. Por el contrario, durante el embarazo basta un único urocultivo positivo para considerar que existe una bacteriuria asintomática.
Las infecciones sintomáticas son más frecuentes en las gestantes que en la población no gestante. La razón hay que buscarla en las modificaciones anatómicas y funcionales que tienen lugar en el aparato urinario durante la gestación y que aumentan el riesgo de ITU.
Fisiopatología del tracto urinario durante el embarazo2Los cambios fisiológicos del tracto urinario durante el embarazo son importantes y facilitan el desarrollo de la ITU, su recurrencia, persistencia y, a menudo, su evolución a formas sintomáticas, que no se produce en la mujer no gestante, en la que la ITU tiene menos impacto y no suele ser persistente. En estas modificaciones fisiológicas caben destacar:
- •
La dilatación bilateral, progresiva y frecuentemente asimétrica de los uréteres, que comienza hacia la 7a semana y progresa hasta el término. Tras el parto, se reduce con rapidez (un tercio a la semana, un tercio al mes y el tercio restante a los dos meses).
- •
La dilatación comienza en la pelvis renal y continúa de forma progresiva por el uréter, es menor en el tercio inferior y puede albergar hasta 200ml de orina, lo que facilita la persistencia de la ITU. Esta dilatación suele ser mayor en el lado derecho.
- •
Por otra parte, a medida que el útero aumenta su volumen comprime la vejiga y los uréteres. Esta compresión es mayor en el lado derecho debido a la dextro-rotación habitual del útero a partir de la segunda mitad del embarazo. La compresión vesical favorece la aparición de residuo posmiccional.
- •
Además de estas razones anatómicas, la influencia hormonal también contribuye a estas modificaciones, tanto o más que las modificaciones mecánicas reseñadas. La progesterona disminuye el tono y la contractilidad de las fibras musculares lisas del uréter. Esto reduce el peristaltismo ureteral desde el segundo mes, observándose etapas de auténtica atonía hacia el séptimo y octavo mes, lo que favorece el estancamiento de la orina y el reflujo vésico-ureteral. Igualmente disminuye el tono del esfínter ureterovesical, favoreciendo su reflujo. Los estrógenos favorecen también en parte, la hiperemia del trígono y la adherencia de los gérmenes sobre el epitelio.
- •
Otros factores son:
- ∘
Aumento de la longitud renal en 1cm.
- ∘
Cambio en la posición de la vejiga que se hace más abdominal que pélvica.
- ∘
Aumento de la capacidad vesical por descenso progresivo de su tono por factores hormonales. En el tercer trimestre puede llegar a albergar el doble de volumen, sin generar molestias en la gestante.
- ∘
Aumento del volumen circulante que implica un incremento del filtrado glomerular. El flujo urinario aumenta al principio del embarazo, pero a medida que progresa, el estasis urinario es más frecuente, lo que favorece la bacteriuria.
- ∘
Alcalinización del pH de la orina.
- ∘
Aumento de la concentración de azúcares y aminoácidos.
- ∘
Anomalías del tracto urinario, nivel socioeconómico bajo, antecedentes de ITU, diabetes, litiasis renal, etc…
- ∘
La disminución de la capacidad de concentración de la orina por el riñón de la embarazada puede ocasionar una disminución de la capacidad antibacteriana de la orina.
- ∘
Los microorganismos que causan infecciones urinarias son los habituales de la flora perineal normal y en general se trata de los mismos gérmenes que fuera del embarazo.
Los gérmenes aislados habitualmente son los bacilos gramnegativos, aunque también se pueden observar microorganismos grampositivos que suelen ser los responsables del 10-15% de las infecciones sintomáticas agudas de la mujer joven.
La microbiología de las bacterias en la orina es la misma que en las mujeres no embarazadas. Se trata en general de enterobacterias (Escherichia coli, Klebsiella y Enterobacter), de gramnegativos (Proteus mirabilis, Pseudomonas, Citrobacter), de grampositivos (Staphylococcus aureus, Estreptococos del Grupo B) y de otros gérmenes (Gardnerella vaginalis, Ureaplasma urealyticum)3.
Bacteriuria asintomáticaEs la presencia de bacterias en la orina de la embarazada en ausencia de síntomas clínicos. Su prevalencia es del 2-11% siendo más frecuente en multíparas, mujeres con nivel socioeconómico bajo, infección urinaria previa, diabetes y otras enfermedades4.
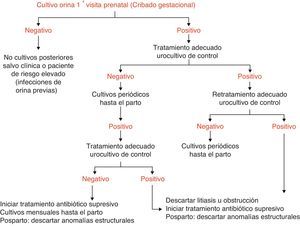
En general la frecuencia de aparición de bacteriuria asintomática durante el embarazo no difiere de la de una mujer no gestante de la misma edad. Aunque el embarazo no aumenta su aparición, sí que agrava sus consecuencias y favorece la aparición de formas sintomáticas, complicándose hasta un 35% de los casos con pielonefritis agudas5. Las bacteriurias asintomáticas son detectables ya en las primeras semanas de embarazo. Por ello se recomienda el cribado de todas las gestantes para la detección de la bacteriuria asintomática durante el primer trimestre. Por ello la recomendación de la Sociedad Española de Ginecología y Obstetricia6 y de otras sociedades científicas7 es que en el primer trimestre de la gestación, coincidiendo con la primera analítica que se le solicita a la gestante, se realice un cultivo de orina. En el gráfico 1 se presenta el algoritmo diagnóstico-terapéutico.
Si el cultivo es negativo no se recomienda un nuevo cribado en mujeres de bajo riesgo; aunque sí es conveniente repetirlo en gestantes de alto riesgo de infección (p. ej. infecciones de repetición, anomalías del tracto urinario, amenaza de parto pretérmino, etc…).
Si se detecta bacteriuria asintomática, se deben realizar cultivos de orina periódicos con posterioridad para detectar recidivas de la misma, debido a que aunque no se suele encontrar relación entre la presencia de bacteriuria asintomática y cistitis, sí que se ha encontrado entre bacteriuria asintomática y pielonefritis, que es la principal complicación de la misma durante el embarazo.
Aunque, por el riesgo de recidiva, se sugiere la realización de cultivos de orina mensuales hasta el parto tras una bacteriuria asintomática, en la actualidad no hay estudios clínicos adecuados que aporten evidencias suficientes para señalar cuál es la frecuencia con que se deben realizar los cultivos de control en este grupo de pacientes con bacteriuria asintomática8.
Se ha podido comprobar que el cribado y tratamiento de la bacteriuria asintomática para prevenir la pielonefritis es costo-efectivo con una gran variedad de estimaciones, aunque el costo-beneficio disminuye si la tasa de bacteriuria asintomática es inferior al 2%9. El objetivo del cribado es realizar un tratamiento y control de estas gestantes ya que sin tratamiento el 30% de las mismas desarrollarán una pielonefritis aguda, en comparación con el 1,8% de los controles no bacteriúricos9,10.
El efecto beneficioso para la prevención de la pielonefritis aguda queda reflejado en un metaanálisis de 13 ensayos clínicos aleatorizados o casi aleatorizados, sobre el tratamiento antibiótico frente al no tratamiento de la mujer embarazada con bacteriuria asintomática que encuentra que el tratamiento reduce sustancialmente el riesgo de pielonefritis aguda (OR 0,24; IC 95% 0,19-0,32)9. Aunque la calidad de los estudios no es muy alta y menos de la mitad fueron controlados con placebo, los resultados fueron consistentes entre los estudios y la reducción de la incidencia de pielonefritis. Se estimó que el número de mujeres que era necesario tratar para prevenir un episodio de pielonefritis era de 7 (IC 95%: 6-9) y que el tratamiento de la bacteriuria se asociaba con una reducción del 75% del riesgo de pielonefritis aguda.
La relación entre la bacteriuria asintomática con el bajo peso al nacer y el parto pretérmino es polémica. La revisión Cochrane sobre el tratamiento antibiótico de la bacteriuria en la gestante incluye 10 ensayos clínicos controlados aleatorizados o casi-aleatorizados y concluye que el tratamiento antibiótico se asocia con una reducción de la tasa de prematuridad o de bajo peso al nacer (OR 0,60; IC 95% 0,45-0,80)9.
El Cardiff Birth Survey, un estudio prospectivo sobre 25.844 nacimientos, indica que la bacteriuria asintomática, corregida para los factores demográficos y sociales, no se asoció con el parto pretérmino (OR 1,2; IC 95% 0,9-1,5)11. Sin embargo, cuando los partos pretérminos se categorizaron en partos pretérminos médicamente indicados o espontáneos, hubo una asociación significativa entre la bacteriuria asintomática y los partos pretérminos médicamente indicados (OR 2,03; IC 95% 1,5-2,8), pero no la hubo para los partos pretérminos espontáneos (OR 1,07; IC 95% 0,78-1,46)11. Los autores establecieron la conclusión de que si la bacteriuria asintomática no progresa hacia la pielonefritis, no causa un aumento de la tasa de parto pretérmino.
En otro metaanálisis de 17 estudios de cohortes que informan sobre la incidencia de nacidos con bajo peso al nacer en mujeres con o sin bacteriuria y otros 4 que informan sobre la incidencia de bajo peso al nacer, Romero12 concluye que existe una fuerte asociación entre la bacteriuria asintomática no tratada y el bajo peso al nacer/parto pretérmino, y que el tratamiento antibiótico es eficaz para reducir la ocurrencia de nacidos de bajo peso. A partir de los estudios de cohortes se puede estimar que el riesgo de bajo peso al nacer se reduce alrededor de 1/3 (RR 0,65; IC 95% 0,57-0,74).
En general se admite que:
- •
Un tercio de las bacteriurias asintomáticas no tratadas adecuadamente, evolucionarán a pielonefritis7,13,14.
- •
Más de la mitad de las pielonefritis que aparecen durante el embarazo han presentado previamente una bacteriuria asintomática.
- •
El tratamiento adecuado de la bacteriuria asintomática previene la pielonefritis y sus consecuencias sobre el embarazo13,14.
- •
Cuanto mayor sea la duración de la bacteriuria y más episodios de infección sucedan durante el embarazo, mayor es la posibilidad de repercusión materno-fetal.
Por el contrario no está tan clara la relación de la bacteriuria asintomática con otros procesos como anemia, preeclampsia y enfermedades renales crónicas.
La persistencia de un cultivo positivo tras el tratamiento de la bacteriuria asintomática sugiere infección del parénquima renal. La posibilidad de recidiva es del 30% (aun recibiendo tratamiento), debido quizás a una infección parenquimatosa asintomática que sería la responsable de la recolonización de la orina.
El diagnóstico se establece con un urocultivo con>100.000UFC/ml (bacteriuria significativa) de un único germen uropatógeno en una paciente sin clínica urinaria. En caso de contajes entre 10.000 y 100.000UFC/ml o cultivos polimicrobianos, debe repetirse el cultivo, extremando las precauciones de la toma de la muestra y envío al laboratorio. La presencia de más de una especie de bacterias, en general, indica contaminación.
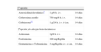
Para el diagnóstico no son válidos ni el estudio microscópico de la orina, ni las tiras reactivas (esterasa leucocitaria, nitritos etc…), pues la mayoría de las bacteriurias asintomáticas cursan sin leucocituria. En general, su sensibilidad y valor predictivo positivo son bajos (tabla 1).
Capacidad de las pruebas de cribado rápido de la bacteriuria asintomática en el embarazo sobre el resultado del cultivo de orina(1)
| Sensibilidad | Especificidad | Valor predictivo positivo | Valor predictivo negativo | |
| Prueba enzimática | 100 | 81 | 30 | 100 |
| Sedimento urinario | 56 | 91 | 27 | 97 |
| Nitritos | 37 | 99 | 95 | 96 |
| Esterasa leucocitaria | 52 | 90 | 25 | 97 |
| Nitritos+esterasa | 68 | 86 | 23 | 97 |
La recogida de la orina debe ser cuidadosa para evitar la contaminación de la orina. En la tabla 2 se muestran las instrucciones a entregar a las gestantes para una adecuada recogida de la muestra.
Normas para la correcta recogida de muestra de orina para cultivo
| 1. Recoja la primera orina de la mañana.2. Utilice un frasco estéril de tapón de rosca.3. Es imprescindible una rigurosa higiene previa a la recogida de orina. Se recomienda lavarse los genitales con agua y jabón. Este lavado se hará siempre de delante a atrás y posteriormente enjuáguese con agua y séquese.4. Una vez realizado el lavado, recoja la parte media de la micción. Deberá hacerlo separando con la mano los labios vulvares y orinando de manera que el chorro salga directamente sin tocar los genitales externos.5. Orine primero fuera del frasco, continúe orinando directamente dentro de él hasta llenar aproximadamente medio frasco. Cierre herméticamente el frasco y anote el nombre y los dos apellidos del paciente.6. No utilice recipientes de uso doméstico, ni ningún contenedor que requiera otra manipulación que la de apertura y cierre.7. Entregue la muestra de orina a la mayor brevedad. Si por cualquier causa, esto no es posible, guardar la muestra en nevera (4°C, no congelar). |
Es muy importante que en el laboratorio se empleen técnicas adecuadas que permitan detectar el Streptococcus agalactie (EGB), pues ante su presencia en orina durante el embarazo estará indicada la profilaxis antibiótica intraparto para evitar la enfermedad neonatal por EGB.
La que queda fuera de toda duda es que la bacteriuria asintomática debe ser tratada con antibióticos. Una revisión Cochrane del año 20089 con catorce estudios, señala que el tratamiento con antibióticos comparado con placebo o ningún tratamiento fue efectivo para eliminar la bacteriuria asintomática (cociente de riesgos [CR] 0,25; intervalo de confianza [IC] 95% 0,14-0,48), así como para reducir la incidencia de pielonefritis (CR 0,23; IC 95% 0,13-0,41). El tratamiento con antibióticos también se asoció con una reducción en la incidencia de recién nacidos con bajo peso al nacer (CR 0,66; IC 95% 0,49-0,89), pero no se observaron diferencias en las tasas de parto pretérmino.
Aunque el tratamiento antibiótico es eficaz para reducir las pielonefritis y los recién nacidos de bajo peso al nacer, una reciente revisión Cochrane3, no ha podido establecer conclusiones definitivas sobre cuál sería el régimen antibiótico más efectivo y seguro para el tratamiento inicial de la bacteriuria asintomática en el embarazo. Se incluyeron cinco estudios con un total de 1.140 mujeres con bacteriuria asintomática. No se realizó un metaanálisis porque cada ensayo analizaba diferentes regímenes del antibiótico, por lo que no se podían agrupar los resultados.
En un estudio que comparó una dosis única de fosfomicina trometamol 3 gramos, con un ciclo de cinco días de cefuroxima, no hubo diferencias significativas en la infección persistente (CR 1,36; IC 95% 0,24-7,75), en el cambio a otros antibióticos (CR 0,08; IC 95% 0,00-1,45) o en la alergia o el prurito (CR 2,73; IC 95% 0,11-65,24). Una comparación de ciclos de siete días de 400mg de pivmecilinam frente a 500mg de ampicilina, ambos cuatro veces al día, no mostró diferencias significativas en la tasa de infección persistente a las dos semanas, ni en la infección recurrente, pero hubo un aumento de los vómitos (CR 4,57; IC 95% 1,40-14,90) y fue más probable que las mujeres interrumpieran de forma precoz el tratamiento con pivmecilinam (CR 8,82; IC 95% 1,16-66,95). Cuando se administró cefalexina 1g frente a Miraxid® (pivmecilinam 200mg y pivampicilina 250mg) dos veces al día durante tres días, no hubo diferencias significativas en la infección persistente ni recurrente. Un ciclo de un día frente a siete días de nitrofurantoína dio lugar a más infecciones persistentes con el ciclo más corto (CR 1,76; IC 95% 1,29-2,40), pero no hubo diferencias significativas en la infección sintomática a las dos semanas, ni en las náuseas, ni en las tasas de parto pretérmino. Con otras comparaciones tampoco se observaron diferencias significativas en las infecciones sintomáticas, persistentes ni recurrentes.
Debido a esta falta de pruebas definitivas puede ser útil para seleccionar la mejor opción de tratamiento, considerar factores tales como el coste económico, los efectos secundarios, las tasas de resistencia o la disponibilidad del producto3.
El tratamiento antibiótico supresivo (profilaxis antibiótica hasta el parto) puede ser adecuado en gestantes con bacteriuria asintomática que persiste tras dos o más ciclos de un tratamiento adecuado. Se puede usar una dosis única diaria de nitrofurantoína oral (50-100mg al acostarse) durante el resto del embarazo, si el microorganismo es sensible. Cuando se emplee la terapia supresiva, no son precisos los cultivos de orina mensuales, pero como la bacteriuria puede recidivar a pesar del tratamiento, se recomienda realizar un nuevo urocultivo al inicio del tercer trimestre para asegurar la eficacia del tratamiento15. También se puede emplear como tratamiento profiláctico, una dosis diaria de cefalexina oral o de cotrimoxazol (aunque este último debe evitarse durante el tercer trimestre16. Un reciente estudio publicado en 2013 señala que en una cohorte noruega con 180.120 gestaciones, 5.794 de las cuales recibieron el fármaco, el potencial teratogénico de la nitrofurantoína es bajo. Su uso durante el primer trimestre no produjo un aumento de la tasa de malformaciones (OR 0,79; IC 95% 0.51-1.23). Tampoco se constató un incremento de efectos secundarios adversos sobre la gestación. Únicamente se pudo observar que cuando se empleó durante los últimos 30 días de la gestación, hubo un incremento de la tasa de ictericia neonatal (OR 1,31; IC 95% 1,02-1,70)17.
Si apareciera un urocultivo positivo (>105 UFC/ml) durante el tratamiento supresivo, se tratará adecuadamente según el antibiograma y luego, se seguirá con el tratamiento profiláctico, ajustado si es preciso, a la sensibilidad del microorganismo15.
En aquellas gestantes que presenten infecciones del tracto urinario de repetición y que parezcan estar en relación con el coito, se recomienda la profilaxis poscoital (o al acostarse) con una dosis única de cefalexina (250-500mg oral) o de nitrofurantoína (50-100mg oral)(15).
Cistitis y síndrome uretralLa cistitis en el embarazo se considera una ITU primaria pues no se desarrolla a partir de una bacteriuria asintomática previa. Se observa hasta en el 1,5% de los embarazos y su incidencia no disminuye aunque se traten las bacteriurias asintomáticas.
Desde un punto de vista microbiológico los gérmenes implicados son los mismos que los de las bacteriurias asintomáticas. La vía de infección más común suele ser ascendente debido a que la menor longitud de la uretra femenina facilita el ascenso de las bacterias hacia la vejiga.
El cuadro clínico presenta clínica miccional de aparición repentina: disuria, polaquiuria, tenesmo vesical, dolor retro o suprapúbico y en la uretra durante o después de la micción. La orina suele ser de aspecto turbio (presencia de leucocitos) y con poso purulento (leucocitos en gran cantidad o piuria). En las fases agudas puede presentar hematuria macroscópica. La hematuria microscópica aparece hasta en el 60% de las cistitis18.
El diagnóstico se basa en la clínica descrita, la ausencia de sintomatología del tracto urinario superior y apoyado en las pruebas complementarias:
- •
Sedimento urinario con leucocituria (>10 leucocitos/ml en cámara o>3-5 leucocitos/campo de 40 aumentos).
- •
Urocultivo con>1.000UFC/ml, confirma el diagnóstico. En la actualidad, para el diagnóstico de este cuadro, no se considera preciso un urocultivo positivo con>100.000UFC/ml para confirmar el diagnóstico; basta con>1.000UFC/ml si la clínica es sugestiva de infección del tracto urinario(15).
La cistitis asociada a dolor lumbar, signos sistémicos de infección y fiebre indica siempre afectación renal.
Hasta en un 50% de mujeres con clínica de cistitis, el urocultivo es negativo y estos casos se denominan síndrome uretral agudo o cistitis abacteriúrica y están asociados en ocasiones a Chlamydias. El diagnóstico microbiológico del síndrome uretral requiere una muestra del primer chorro de orina sin contaminación (lo que puede necesitar sondaje o punción suprapúbica) y usar métodos especiales de cultivo o bien técnicas de amplificación genética (PCR), cuyo rendimiento diagnóstico es incluso superior al cultivo del exudado uretral.
Pielonefritis agudaEs una infección de la vía excretora alta y del parénquima renal de uno o ambos riñones, que suele presentarse durante el segundo-tercer trimestre de la gestación y es casi siempre secundaria a una bacteriuria asintomática no diagnosticada o tratada incorrectamente y que ocasiona signos y síntomas muy floridos que alteran el estado general de la paciente. Es una de las indicaciones más frecuente de hospitalización durante el embarazo.
El diagnóstico es fundamentalmente clínico (tabla 3). La sintomatología incluye al margen de la clínica típica de la cistitis, alteración del estado general, fiebre, sudoración, escalofríos y dolor lumbar intenso y constante. La exploración física presenta una puñopercusión lumbar homolateral muy dolorosa. En el 90% de los casos, el lado derecho es el afectado y puede ser bilateral en un 25%.
Puntos clave en el diagnóstico de infección urinaria en el embarazo
| 1. Un urocultivo al principio del embarazo es el procedimiento diagnóstico de elección de la bacteriuria asintomática.2. La bacteriuria asintomática presenta cultivos con >100.000 colonias de un sólo microorganismo (casi siempre Escherichia coli).3. La mayoría de los urocultivos mixtos se deben a contaminación o a mala conservación de las muestras.4. En muchas bacteriurias asintomáticas no aparece piuria.5. La persistencia de un urocultivo positivo después del tratamiento de la bacteriuria asintomática sugiere infección del parénquima renal.6. Síntomas miccionales con cultivo negativo y leucocituria sugieren la existencia de un síndrome uretral.7. En la pielonefritis aparece sintomatología general y en la orina, piuria y en ocasiones cilindros leucocitarios. |
Su incidencia es del 1-2% de todas las gestantes. Las tasas varían en dependencia de que se haga o no cribado de la bacteriuria asintomática y de la eficacia del tratamiento de la misma. Un tratamiento adecuado de la bacteriuria asintomática disminuye en un 80% la incidencia de pielonefritis. Factores predisponentes para la pielonefritis son los cálculos ureterales y renales, así como la bacteriuria asintomática.
El diagnóstico clínico se confirma con el urocultivo con>100.000UFC/ml en orina. El 80% son causadas por Escherichia coli. En el sedimento encontraremos leucocituria y pueden aparecer también cilindros leucocitarios, proteinuria y hematíes.
El diagnóstico diferencial debe hacerse con procesos como corioamnionitis, colecistitis, mioma degenerado, rotura de quiste de ovario y sobre todo con la apendicitis.
El tratamiento de la pielonefritis requiere hospitalización de la paciente y las medidas a tomar son las siguientes:
- •
Valoración obstétrica: exploración vaginal, test de Bishop, monitorización de la FCF y dinámica uterina si fuera preciso y exploración ecográfica para valorar el estado fetal.
- •
Hemograma, proteína C reactiva, función renal y electrolitos.
- •
Hemocultivo (si es preciso) y urocultivo previo al tratamiento.
- •
Monitorización periódica de signos vitales.
- •
Hidratación intravenosa para conseguir diuresis>30ml/hora y evaluación del balance hídrico.
- •
Iniciar inmediatamente el tratamiento antibiótico de forma empírica.
- •
Si persiste la fiebre tras 48 horas de tratamiento antibiótico, es conveniente realizar una ecografía renal para descartar una obstrucción de la vía urinaria o un absceso renal o perinefrítico. Al ingreso, la ecografía no suele modificar la actitud terapéutica.
- •
Control de posibles complicaciones médicas.
- •
Controles analíticos periódicos.
- •
Cuando la paciente lleve 48-72 horas afebril, se pueden cambiar los antibióticos intravenosos a vía oral.
- •
Una vez la paciente apirética, podremos valorar el alta hospitalaria y completar de forma ambulatoria el tratamiento durante 14 días.
- •
Se debe hacer un urocultivo de control 1-2 semanas tras finalizar el tratamiento y luego mensualmente hasta el parto.
Complicaciones que pueden aparecer en el curso de una pielonefritis aguda son:
- •
Distrés respiratorio.
- •
Disfunción renal transitorio.
- •
Complicaciones urinarias: absceso renal/perinefrítico, litiasis coraliforme y pielonefritis enfisematosa.
- •
Anemia hemolítica.
- •
Septicemia y choque séptico.
En las cistitis y en las pielonefritis, el tratamiento debe iniciarse inmediatamente de forma empírica, antes de disponer del resultado del urocultivo y antibiograma, para así evitar la extensión de la infección. En el momento de elegir el tratamiento debemos valorar la prevalencia de los gérmenes más frecuentes, la gravedad del cuadro clínico, los riesgos del fármaco para el feto y la tasa de resistencias al antibiótico en nuestra área y centro hospitalario.
De forma general, el uso de beta-lactámicos, fosfomicina y nitrofurantoína cumple con los criterios de seguridad y eficacia en la mayoría de los casos. En las bacteriurias asintomáticas y cistitis la pauta tradicional dura 7-10 días y erradica la bacteriuria en el 80% de las gestantes. También se puede emplear pautas cortas con fosfomicina-trometamol, siempre que se realicen controles posteriores. Entre las ventajas de las pautas cortas se encuentran su menor costo, menor dosis, mejor cumplimiento del tratamiento, menor alteración de la flora intestinal y menor incidencia de candidiasis vaginal.
Existe controversia acerca de la eficacia y equivalencia de las pautas cortas y largas. La FDA acepta el empleo de fosfomicina-trometamol en pauta corta, dado que es un antibiótico con una semivida larga (aproximadamente 4,5 horas) y eliminación urinaria prolongada de 48-72 horas. Se puede administrar en monodosis (3 gramos) o en pauta de dos días, consiguiendo unas tasas de erradicación>85%. Otros antibióticos como la amoxicilina-clavulánico, nitrofurantoína y cefalosporinas no han demostrado la misma eficacia en monodosis, debido a su rápida eliminación urinaria.
La mayoría de los fármacos usados en el tratamiento de las ITU alcanzan eficazmente las vías urinarias debido a su eliminación a través del riñón sin una metabolización previa importante, siendo otro factor favorecedor de su efecto el incremento del aclaramiento renal que ocurre durante la gestación.
Independientemente de la pauta terapéutica empleada, la bacteriuria recurre en el 20-30% de los casos, por eso se aconseja realizar un urocultivo de control 1-2 semanas después de finalizado el tratamiento. En las embarazadas con ITU recurrentes por microorganismos distintos o por reinfecciones, se aconseja realizar una profilaxis antibiótica hasta el parto con cefalexina o nitrofurantoína. Además se recomienda practicar un cultivo de orina tras el parto. El síndrome uretral agudo por Chlamydia trachomatis responde al tratamiento con eritromicina.
Las pielonefritis agudas requieren tratamiento hospitalario por vía intravenosa para alcanzar unos niveles tisulares adecuados de antibiótico.
En las tablas 4–6, se presentan una serie de pautas antibióticas para el tratamiento de las diferentes formas clínicas de ITU durante el embarazo. Tanto las dosis como la duración del tratamiento son orientativas, pues muchas veces van a depender de la susceptibilidad de los microorganismos en cada centro y finalmente del resultado del antibiograma, si se dispone de él.
Tratamiento de la bacteriuria asintomática y de la cistitis
| 1a opción: | ||
| Amoxicilina/clavulánico | 500mg/8 h. Oral | 5-7 días |
| Cefuroxima axetilo | 250mg/12 h. Oral | 5-7 días |
| Cefixima | 400mg/24 h. Oral | 5-7 días |
| 2aopción y/o alergia a beta-lactámicos | ||
| Fosfomicina trometamol | 3g. Oral (dosis única) | |
| Nitrofurantoína | 50mg/6 h. Oral | 7 días |
| 100mg/12 h. Oral | 5 días | |
En general, debe evitarse el tratamiento de la infección urinaria o la bacteriuria asintomática durante el embarazo con una dosis única de antibiótico. Sin embargo, la administración de una dosis única de fosfomicina trometamol en el tratamiento de la bacteriuria asintomática en la embarazada ha mostrado la misma eficacia que la terapia durante 7 días con el tratamiento convencional.
Tratamiento de la pielonefritis aguda
Tratamiento de la sepsis de origen urinario
| 1a opción: | ||
| Aztreonan* | 1g/8 h. i.v. | 14 días** |
| Ceftacidina* | 1g/8 h. i.v. | 14 días** |
| Cefepime* | 1g/8 h. i.v. | 14 días** |
| 2aopción y/o alergia beta-lactámicos: | ||
| Amikacina | 15mg/kg/día | 14 días** |
| Fosfomicina# | 200mg/kg/día | 14 días** |
El aztreonam se considera un fármaco de primera elección que puede administrarse incluso, en pacientes con alergia a los betalactámicos al no presentar reacciones cruzadas con este grupo de antibióticos.
Si se sospecha infección por enterococo (tinción de gram que muestra gérmenes grampositivos), administración previa de aztreonam o de cefalosporinas, añadir ampicilina 1 g/6 horas o valorar iniciar tratamiento en monoterapia con piperacilina-tazobactam 4 g/8 horas.
- 1.
Las gestantes con bacteriuria asintomática presentan un mayor riesgo de pielonefritis que la población no gestante.
- 2.
La infección urinaria conlleva un mayor riesgo de parto pretérmino, de recién nacidos con bajo peso, y por todo ello aumento de la morbi-mortalidad perinatal.
- 3.
La existencia de pielonefritis aguda en la gestante implica un riesgo de bacteriemia, lo que ensombrece el pronóstico fetal.
- 4.
El tratamiento correcto de la bacteriuria asintomática en la gestante elimina casi todas las complicaciones.
Los Protocolos Asistenciales de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en Departamentos y Servicios Hospitalarios.