Desde el inicio de la epidemia en España se han notificado un total de 72.099 casos de sida. El 36,5% de las personas diagnosticadas de sida en 2004 no eran conscientes de estar infectadas por el virus de la inmunodeficiencia humana (VIH) en el momento del diagnóstico. Esta proporción llega al 58,5% entre las personas que se infectaron por vía heterosexual.
Desde la extensión de nuevos tratamientos antirretrovirales a finales de 1996, la incidencia de sida ha disminuido en España un 72%. No obstante, España sigue siendo uno de los países de mayor incidencia de la Europa Occidental1.
La prevalencia de VIH en madres de recién nacidos se estima entre el 1,6 y el 1,9 y varía según las comunidades autónomas: las más afectadas son Canarias, Baleares y la Comunidad Valenciana1.
LA TRANSMISIÓN DEL VIH EN OBSTETRICIA
El VIH se transmite por vía sexual, por vía parenteral y por transmisión vertical (transmisión madre-hijo).
La transmisión vertical del VIH, en ausencia de terapia y profilaxis materna, se produce en un 14-25% de los casos en países desarrollados. La transmisión vertical se puede producir intraútero (25-40% de los casos) o intraparto (60-75% de los casos). La lactancia materna aumenta el riesgo en un 15% en casos de infección establecida y en un 29% en casos de primoinfección.
En España, se han identificado hasta diciembre 2005, un total de 916 casos de sida por transmisión vertical. El mayor número de casos fue en 1988, con 89, y a partir de ese momento se produjo un descenso, hasta llegar a los aproximadamente 10 casos anuales desde el año 20001.
En ausencia de tratamiento, el riesgo de transmisión vertical se asocia al estado de salud materna, a factores obstétricos y al parto pretérmino. Existe una relación lineal entre la tasa de transmisión y la carga viral materna, y no hay un valor umbral por debajo del cual no exista riesgo de transmisión2,3. El estadio clínico de la enfermedad y el número de linfocitos CD4+ se han asociado también al riesgo de transmisión vertical. Los únicos factores obstétricos que se han relacionado de forma consistente con el riesgo de transmisión son la vía del parto y la duración de la rotura de las membranas amnióticas. Los procedimientos invasivos, como amniocentesis, microtomas intraparto, etc., aumentan también el riesgo de transmisión4,5.
En 1994 se demostró la eficacia de la zidovudina (ZDV) en la disminución de la transmisión vertical, aún sin modificación del valor de la carga viral materna. Con el uso de ZDV en el embarazo, el parto y el posparto al recién nacido, se redujo la tasa de transmisión del 25,5 al 8,3%6. Un estudio no aleatorizado evaluó el efecto de añadir 3TC a la pauta estándar de ZDV; se halló unas tasas de transmisión del 1,6%, en comparación con el 6,8% de transmisión en el grupo histórico de ZDV sola7.
En 1996 se introdujo la terapia antirretroviral de gran actividad (TARGA) en el tratamiento del adulto. La mejora espectacular de los resultados obtenidos hizo que en pocos años se generalizara su uso también a la mujer gestante. En un estudio longitudinal iniciado en 1990 en EE.UU., la tasa de transmisión vertical del VIH pasó del 20% en la era pretratamiento al 10,4% en las mujeres que sólo recibieron ZDV, y finalmente al 3,8% en las mujeres que recibieron terapia combinada sin inhibidores de las proteasas y del 1,2% en pautas que incluían inhibidores de las proteasas8.
En ausencia de tratamiento profiláctico de transmisión vertical, la cesárea electiva, entendiéndose como tal antes del inicio del trabajo de parto, ejerce un efecto protector para el feto9. Un metaanálisis concluyó que la cesárea programada reducía la tasa de transmisión vertical en un 50%, incluso en mujeres que recibieron ZDV. En este estudio no se incluyeron gestantes con tratamiento TARGA10.
La baja incidencia de transmisión vertical con el uso de tratamientos TARGA durante el embarazo (< 1%) impide evaluar el efecto protector de la cesárea electiva en este colectivo. Un estudio reciente concluye que, con independencia del tratamiento recibido, la transmisión vertical del virus se asocia a la carga viral materna y la cesárea electiva es capaz de reducir la tasa de transmisión vertical, incluso en aquellas madres con una carga viral indetectable11.
Sin embargo, la embarazada infectada por el VIH presenta mayor riesgo de complicaciones poscesárea, tales como la anemia y especialmente la fiebre posparto, por lo que la indicación de cesárea electiva a todas las gestantes infectadas debe valorarse con cautela.
DIAGNÓSTICO DE LA GESTANTE INFECTADA POR EL VIH
Se tiene que ofrecer a toda gestante la serología VIH en la primera consulta, sea cual sea el momento del embarazo (nivel de evidencia Ib, grado de recomendación A). Todas las medidas preventivas de la transmisión vertical requieren del conocimiento previo de la infección materna.
Se repetirá la serología VIH durante el tercer trimestre de embarazo a todas las gestantes, con el fin de identificar las seroconversiones producidas durante el embarazo (nivel de evidencia IV, grado de recomendación C). A las gestantes con conductas de riesgo, se les realizará serología frente al VIH en cada trimestre. En caso de sospecha de primoinfección, se realizará la determinación de una PCR cuantitativa del VIH.
Las pruebas que se realizarán para el cribado y el diagnóstico de confirmación son las mismas que en la población no gestante (test de ELISA para la identificación de anticuerpos frente al VIH, Western-blot posteriormente como prueba de confirmación). Dadas las implicaciones del diagnóstico, se debe confirmar la infección antes de informar a la gestante.
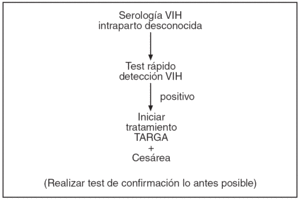
Se ofrecerá la realización de una prueba rápida de VIH a toda gestante que llegue en trabajo de parto sin una serología VIH previa durante el transcurso de la gestación. Ésta nos permite la determinación, en menos de una hora, de la presencia de Ac-VIH, lo que nos permitirá, a su vez, una rápida actuación en el período de dilatación para la prevención de la transmisión durante el parto y posparto (tratamiento al recién nacido e inhibición de la lactancia materna). Las pruebas rápidas deben confirmarse posteriormente por una determinación de ELISA y Western-blot12,13. El centro sanitario debe garantizar la posibilidad de realizar una prueba rápida a toda paciente que acude en trabajo de parto con serología VIH desconocida. En caso de positividad, se actuará según se especifica en el protocolo de vía de parto sin esperar el resultado de la prueba de confirmación, que deberá realizarse lo antes posible.
PREVENCIÓN DE LA TRANSMISIÓN VERTICAL
1. Información adecuada a la gestante
Las mujeres deben estar informadas del beneficio potencial y la seguridad de la administración de los fármacos antirretrovirales (nivel de evidencia Ib, grado de recomendación A) y de la posibilidad de realización de profilaxis para las infecciones oportunistas en la gestación y en el período neonatal.
Dada la gravedad de la infección por el VIH y del riesgo materno y fetal, se informará de la posibilidad de solicitar una interrupción legal del embarazo por grave enfermedad materna o por riesgo de afectación fetal.
2. Tratamiento antirretroviral
Existen pocos datos sobre la seguridad de los antirretrovirales durante el embarazo. El manejo adecuado de la gestante infectada por el VIH requiere un análisis de la necesidad de tratamiento para la propia enfermedad, la necesidad de minimizar el riesgo de transmisión vertical y los posibles efectos secundarios del tratamiento para el feto y el recién nacido.
El tratamiento de la gestante infectada por el VIH tendrá, por tanto, además del objetivo de disminuir el riesgo de transmisión vertical, prolongar y mejorar la calidad de vida, disminuir los valores de carga viral a concentraciones indetectables durante el mayor tiempo posible y preservar o restaurar la función inmunitaria.
En España, donde las mujeres infectadas por el VIH tienen acceso a un adecuado tratamiento antirretroviral, una correcta asistencia al parto y posparto con inhibición de la lactancia materna, la tasa de transmisión vertical esperable se sitúa alrededor del 1%14.
Inicio del tratamiento antirretroviral en la gestante
La decisión de iniciar el tratamiento antirretroviral en el adulto no gestante se basa en 3 pilares: la sintomatología, el número de linfocitos CD4+ y la carga viral15.
1. Pacientes pertenecientes a la categoría B y C de la clasificación de los CDC: se recomienda iniciar tratamiento en todos los casos (grado de recomendación A).
2. Pacientes con linfocitos CD4+ < 200 cél/mm3: se recomienda iniciar tratamiento (grado de recomendación A).
3. Pacientes con linfocitos CD4+ entre 200-350 cél/mm3: se recomienda iniciar tratamiento (grado de recomendación B). Sin embargo, se puede diferir si la cifra se mantiene próxima a los 350 cél/mm3 de forma estable y tiene una carga viral baja (< 20.000 copias).
4. Pacientes con linfocitos CD4+ > 350 cél/mm3: puede diferirse el tratamiento (grado de recomendación B).
Las indicaciones y el tipo de tratamiento antirretroviral en la gestante no deben diferir de las consideraciones generales para el adulto no gestante, con algunas salvedades:
1. Se ofrecerá a la gestante la posibilidad de realizar tratamiento antirretroviral sea cual sea su estadio de la enfermedad, con la finalidad de prevenir la transmisión vertical del virus. El tratamiento se recomienda incluso en aquellas mujeres que no requerían tratamiento antes de la gestación (grado de recomendación A).
2. Debe iniciarse el tratamiento a partir del segundo trimestre de gestación si el estado materno lo permite.
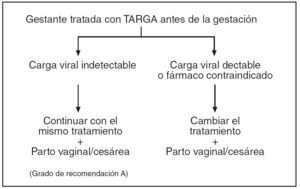
3. Las pacientes que inician el embarazo y están ya recibiendo tratamiento antirretroviral, continuarán con el mismo tratamiento si éste era efectivo. Habrá que modificar aquellos fármacos de mayor potencial teratógeno.
4. Debe escogerse un régimen de tratamiento que haya demostrado efectividad en la reducción de la transmisión vertical y que no presente efectos teratógenos.
5. Debe procurarse la mínima toxicidad posible, tanto para la madre como para el feto y el recién nacido.
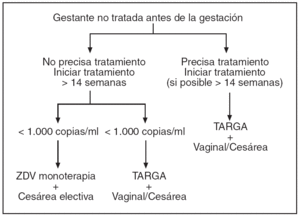
6. En aquellas gestantes que presenten un buen estado inmunológico, con una carga viral baja (bajo riesgo de transmisión y de adquisición de resistencias en estas circunstancias), se puede ofrecer monoterapia con ZDV.
7. Deben considerarse las variaciones farmacocinéticas que se producen durante el embarazo.
Efectos del tratamiento antirretroviral. Toxicidad
En el caso de la infección por el VIH, la rápida evolución en el tratamiento y el grave riesgo que conlleva para la salud de la madre la propia enfermedad han obligado a incorporar fármacos potencialmente tóxicos durante la gestación, sin disponer de la información sobre teratogenia y farmacocinética habitualmente requeridas.
Existen 3 grandes grupos de antirretrovirales:
1. Inhibidores de la transcriptasa inversa nucleósidos (ITIN).
2. Inhibidores de la transcriptasa inversa no nucleósidos (ITINN).
3. Inhibidores de las proteasas (IP).
Los ITIN atraviesan la barrera placentaria, no han demostrado ser teratogénicos en animales a dosis similares a las utilizadas en humanos y generalmente son bien tolerados durante la gestación. Muestran afinidad por la ADN-polimerasa mitocondrial, por lo que pueden producir disfunciones mitocondriales que se pueden manifestar como cardiomiopatía, neuropatía, acidosis láctica, pancreatitis o esteatosis hepática. Es fácil confundir los cuadros asociados a estos fármacos con afecciones propias de la gestación, como el síndrome HELLP. El cuadro tóxico es potencialmente más grave en la gestante, más frecuente en tratamientos de larga duración y es reversible al cesar el tratamiento.
Se han descrito diversos cuadros de muertes maternas por acidosis láctica en mujeres tratadas con la asociación estavudina + didanosina (d4T + ddI) de forma prolongada (desde la concepción y durante toda la gestación)16. Por tanto, debe evitarse el uso de tal asociación durante el embarazo. Las gestantes tratadas con ITIN deberán seguir un control estricto de la función hepática, enzimas pancreáticas y ácido láctico durante toda la gestación.
No se han demostrado efectos sobre el crecimiento o el desarrollo de los niños expuestos a este tipo de antirretrovirales intraútero17. Inicialmente, la cohorte francesa publicó el fallecimiento de 2 niños expuestos a ITIN intraútero debido a encefalopatías graves causadas por la toxicidad mitocondrial de estos fármacos18. Sin embargo, estos hallazgos no se han corroborado por otros grupos de estudio19.
Los ITINN atraviesan la placenta. De ellos, el efavirenz se ha asociado a malformaciones graves del sistema nervioso central por lo que no se recomienda su uso durante el embarazo. La nevirapina ha demostrado ser un fármaco muy eficaz en la prevención de la transmisión vertical, tanto en pautas ultracortas (nevirapina en dosis única durante el parto y al recién nacido, muy utilizadas en países en vías de desarrollo) como formando parte de pautas combinadas. Sin embargo, ha mostrado una mayor frecuencia de reacciones adversas (hepatotoxicidad y rash cutáneo) en mujeres que inician el tratamiento con valores de CD4 > 250 cél/mm3, situación muy frecuente en las embarazadas que comienzan el tratamiento antirretroviral combinado como profilaxis de la transmisión vertical. Su uso durante el embarazo, particularmente como iniciación a la terapia antirretroviral en mujeres con CD4 > 250 cél/mm3, debe realizarse con precaución y requiere una estricta monitorización de la función hepática durante los primeros meses de terapia20-22.
Los IP tienen un paso transplacentario mínimo y no parecen tener efectos teratogénicos. Sin embargo, favorecen las alteraciones del metabolismo de los hidratos de carbono, por lo que incrementan el riesgo de aparición de diabetes gestacional23. El nelfinavir es el único fármaco que, en términos de experiencia, ha demostrado una eficacia similar a la nevirapina en la profilaxis de la transmisión vertical, por lo que se considera una buena alternativa a la nevirapina en las mujeres que deben iniciar tratamiento antirretroviral con valores de CD4 > 250 cél/mm3. También pueden considerarse como alternativa a la nevirapina, el lopinavir o saquinavir, aunque en ambos casos potenciados con ritonavir.
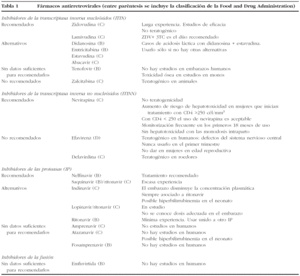
En la tabla 1 se incluye una descripción y algunos comentarios de los diferentes fármacos antirretrovirales disponibles en la actualidad.
Efectos del tratamiento antirretroviral sobre los resultados perinatales
Las mujeres infectadas por el VIH tienen un mayor riesgo de presentar abortos espontáneos, muerte fetal intraútero y retraso del crecimiento intrauterino24-27.
El uso de antirretrovirales se relaciona con una mayor tasa de prematuridad, especialmente aquellos tratamientos combinados que llevan IP28-31.
El tratamiento antirretroviral no parece asociarse a una mayor tasa de malformaciones en los recién nacidos, ni a una variación en la frecuencia de aparición de éstas32.
Estudios realizados en España27 y en el Reino Unido33 han demostrado una disminución de la incidencia de preeclampsia en mujeres infectadas por el VIH sin tratamiento antirretroviral, mientras que la tasa de preeclampsia en mujeres tratadas con tratamientos combinados supera las tasas establecidas para la población general (nivel de evidencia III, grado de recomendación B). En las mujeres infectadas por el VIH que se presentan durante el embarazo con síntomas propios de preeclampsia o disfunción hepática, debemos descartar que se deban a la medicación (nivel de evidencia III, grado recomendación B). Debe realizarse un control clínico y analítico exhaustivo en gestantes tratadas con pautas combinadas para detectar a tiempo el inicio de estas afecciones.
De igual forma, el grupo de estudio español demostró un incremento en la tasa de muertes fetales intraútero en mujeres tratadas con terapia combinada. Este dato, combinado con el mayor riesgo de retraso de crecimiento intrauterino, sugiere la necesidad de una estricta monitorización del bienestar fetal en estas gestaciones27.
CONTROL DE LA GESTACIÓN EN LA MUJER INFECTADA POR EL VIH
1. Primera visita
1. Estas mujeres deben ser atendidas durante el embarazo, parto y posparto por un equipo multidisciplinario: obstetra, internista, pediatra, etc. (nivel de evidencia IV, grado de recomendación C).
2. Citología cervical: la inmunosupresión por la infección por el VIH permite una mayor replicación del virus del papiloma humano (VPH) en la zona genital y una progresión más rápida de neoplasia intraepitelial cervical (CIN) a carcinoma cervical34.
3. Evaluación clínica: estadiaje clínico.
4. Historia de uso previo o actual de antirretrovirales.
5. Descartar enfermedades de transmisión sexual (facilitan la infección de la pareja sexual y pueden transmitirse al recién nacido) (nivel de evidencia IV, grado de recomendación C).
6. Determinación de serologías frente al VHC, citomegalovirus.
7. Hemograma y bioquímica con perfil hepático.
8. Ecografía: determinación de la edad gestacional.
9. Cribado de anomalías cromosómicas.
10. Estudios específicos de la infección por el VIH: determinación de la carga viral del VIH en plasma y recuento de linfocitos CD4+.
11. Cribado de diabetes gestacional en pacientes tratadas con IP.
2. Visitas sucesivas
1. Respetar, después del asesoramiento adecuado, la decisión de la mujer de seguir o no con el embarazo y de usar o no antirretrovirales.
2. Iniciar el tratamiento adecuado para cada paciente según la carga viral, el recuento de CD4+ y la edad gestacional, considerando el potencial impacto para el feto y el recién nacido.
3. Ofrecer las condiciones óptimas para la realización de amniocentesis, si precisa.
4. Control periódico de la carga viral:
* A los 15 días del inicio del tratamiento antirretroviral.
* Bimensual, una vez conseguida una carga viral indetectable.
* Entre las 34-36 semanas para establecer la posibilidad de un parto por vía vaginal.
* En el momento del parto o inmediatamente posterior.
5. Profilaxis de las infecciones oportunistas si CD4 < 200 cél/mm3.
6. Control del bienestar fetal:
* Ecografía y Doppler fetal periódico a partir de las 20 semanas.
* Registro cardiotocográfico en caso de alteración del Doppler o de bajo peso para la edad gestacional.
7. Controles seriados de proteinuria y presión arterial materna.
3. Posparto
1. Analítica: hemograma, bioquímica con perfil hepático y proteinuria.
2. Carga viral materna y recuento de linfocitos CD4+.
3. Revalorar la necesidad de tratamiento TARGA.
ELECCION DE LA VÍA DEL PARTO
El objetivo será establecer la vía de parto más adecuada en cada caso, de forma que se garantice el mínimo riesgo de transmisión vertical del VIH y la mínima morbilidad materna y fetal.
La decisión debe implicar a la madre y al equipo médico a cargo de la paciente, teniendo en cuenta la carga viral, la eficacia de la cesárea electiva en la prevención de la transmisión vertical, el uso de la terapia combinada durante el embarazo y los deseos de la paciente, tomando en consideración múltiples factores, tales como las condiciones cervicales y la integridad de las membranas amnióticas.
Recomendaciones para la elección de la vía de parto
Se permitirá un parto vaginal si hay:
* Buen control gestacional y correcto cumplimiento terapéutico.
* Viremia < 1.000 copias/ml y tratamiento antirretroviral combinado (nivel de evidencia III, grado de recomendación B).
Se indicará una cesárea electiva si:
* Gestante sin tratamiento antirretroviral o con carga viral desconocida (nivel de evidencia Ib, grado de recomendación A).
* Gestante en monoterapia con ZDV (nivel de evidencia Ib, grado de recomendación A).
* Gestante en tratamiento combinado con viremia > 1.000 copias/ml (nivel de evidencia III, grado de recomendación B).
* Necesidad de inducción de parto (nivel de evidencia IV, grado de recomendación C).
* No aceptación de parto vaginal por parte de la paciente.
Se indicará una cesárea intraparto si:
* Amniorrexis prolongada (nivel de evidencia III, grado recomendación B).
* Previsión de parto prolongado (nivel de evidencia IV, grado de recomendación C).
* Monitorización patológica (contraindicada la realización de microtoma en la calota fetal) (nivel de evidencia III, grado recomendación B).
Tratamiento antirretroviral durante el parto vaginal o la cesárea
* No suspender la administración oral de TARGA (nivel de evidencia IV, grado de recomendación C).
* Añadir ZDV por vía intravenosa durante el parto (pauta ACTG 076: 2 mg/kg inicial + 1 mg/kg/h hasta ligar el cordón del recién nacido) (nivel de evidencia Ib, grado de recomendación A).
* En ausencia de tratamiento durante el embarazo: realizar tratamiento intraparto con ZDV + lamivudina + nevirapina.
Durante el puerperio
* ZDV oral al recién nacido, iniciar durante las 6-8 primeras horas (pauta ACTG 076: 2 mg/kg/6 h oral durante 4-6 semanas) (nivel de evidencia Ib, grado de recomendación A).
* En caso de madres no tratadas o con mal control valorar: nevirapina al recién nacido a las 48-72 h.
* Reevaluar régimen tomando en consideración el riesgo de monoterapia encubierta.
Consideraciones especiales durante el parto de una mujer VIH (grado de recomendación C)
* Determinación de la carga viral alrededor de la semana 36 de gestación para establecer la vía de parto adecuada.
* En caso de cesárea electiva, planificarla entre la 37-38 semana.
* Mantener las membranas íntegras tanto tiempo como sea posible.
* Evitar las maniobras invasivas durante el parto (monitorización interna del feto, amniorrexis artificial, parto instrumental, episiotomía).
* En caso de cesárea, emplear antibioticoterapia profiláctica después de pinzar el cordón umbilical.
* El cordón debe ligarse lo antes posible.
* El recién nacido debe ser lavado inmediatamente tras el parto.
LACTANCIA MATERNA
En los países desarrollados, la lactancia materna se desaconseja para todas las mujeres VIH positivas, desde que se demostró que la lactancia materna incrementa el riesgo de transmisión en un 14%35 (nivel de evidencia Ib, grado de recomendación A).
El TARGA disminuye la excreción de HIV-1 ARN en la leche materna, pero no parece tener efecto sobre el HIV-1 ADN celular en la leche materna36.
CONSIDERACIONES ESPECIALES
Diagnóstico prenatal
La gestante con VIH debe realizar la mejor prueba de cribado de anomalías cromosómicas lo antes posible. En caso de un resultado alterado, debe informarse de los riesgos y beneficios de la realización de una prueba invasiva.
La infección por el VIH no contraindica la práctica de técnicas invasivas de detección de anomalías cromosómicas. Sin embargo, se debe ofrecer a la gestante la situación óptima para la realización de éstas asumiendo el mínimo riesgo de provocar una transmisión vertical iatrogénica: tratamiento antirretroviral, carga viral indetectable, evitando el paso transplacentario (nivel de evidencia III, grado de recomendación B) y la realización de una biopsia corial por el mayor riesgo teórico de transmisión37,38 (nivel de evidencia IV, grado de recomendación C).
Coinfección por virus de la hepatitis C
En madres coinfectadas por el virus de la hepatitis C (VHC), la tasa de transmisión vertical del VHC asciende hasta un 15% (6% en madres VHC+/VIH). La transmisión vertical del VHC puede producirse por vía transplacentaria o bien durante el parto39.
El riesgo se relaciona de forma directa con la viremia materna y en algunos estudios se encuentra una asociación con la instrumentación del parto. Algunos estudios sugieren que la práctica de una cesárea electiva podría reducir los casos de transmisión40.
El control del VIH, con tratamiento antirretroviral, parece estar asociado a una reducción de la tasa de transmisión del VHC41,42.
Estudio de resistencias
Se ha demostrado que mujeres con cepas resistentes a la ZDV tienen 5 veces más riesgo de transmisión vertical del VIH y este factor es independiente de la carga viral43. Se recomienda el estudio de resistencias en mujeres embarazadas no tratadas previamente con antirretrovirales en la infección aguda por VIH y en todos los casos de fracaso de tratamiento15.
CONSEJO PRECONCEPCIONAL
El objetivo del consejo preconcepcional en la mujer infectada por el VIH será obtener un óptimo estado de salud previo a la gestación. Un buen consejo preconcepcional se basará en los siguientes puntos:
1. Contracepción efectiva mientras se obtiene un estado óptimo para la gestación.
2. Informar del riesgo de transmisión vertical, estrategias de prevención, potenciales efectos adversos de la medicación durante el embarazo y al recién nacido.
3. Cribado de enfermedades infecciosas y de transmisión sexual.
4. Seguir las recomendaciones de tratamiento antirretroviral del adulto no gestante:
* No tratar de forma específica sólo por el deseo gestacional.
* En caso de estar usándose fármacos con potencial teratogénico, modificar el tratamiento.
* Usar en lo posible antirretrovirales de eficacia demostrada en la reducción de la transmisión vertical.
5. Evaluación y profilaxis de las infecciones oportunistas.
6. Realizar las inmunizaciones que sean necesarias.
7. Identificar factores de riesgo que puedan tener resultados adversos para la madre o el feto.
8. Cribado de abusos de sustancias tóxicas.
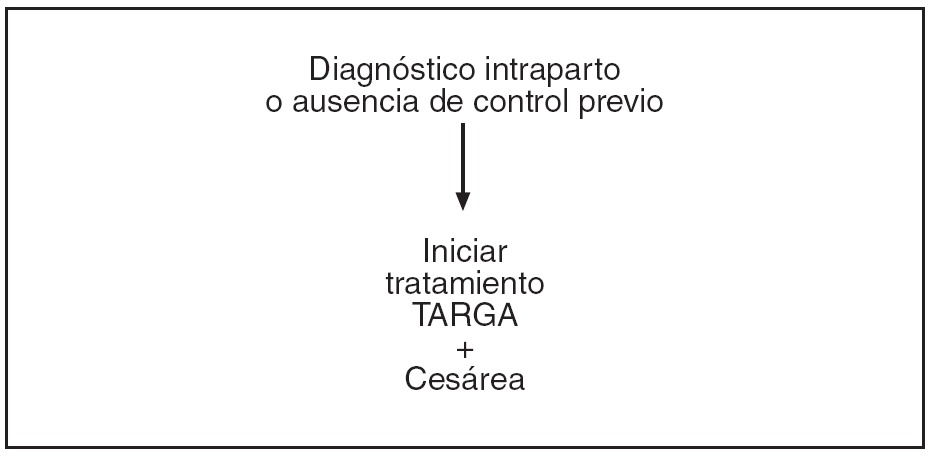
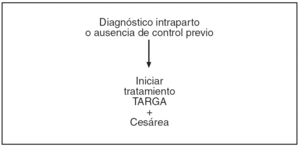
En las figuras 1-4 se puede apreciar de forma resumida el protocolo de actuación en la gestante infectada por el VIH (tratamiento antirretroviral y finalización de la gestación).
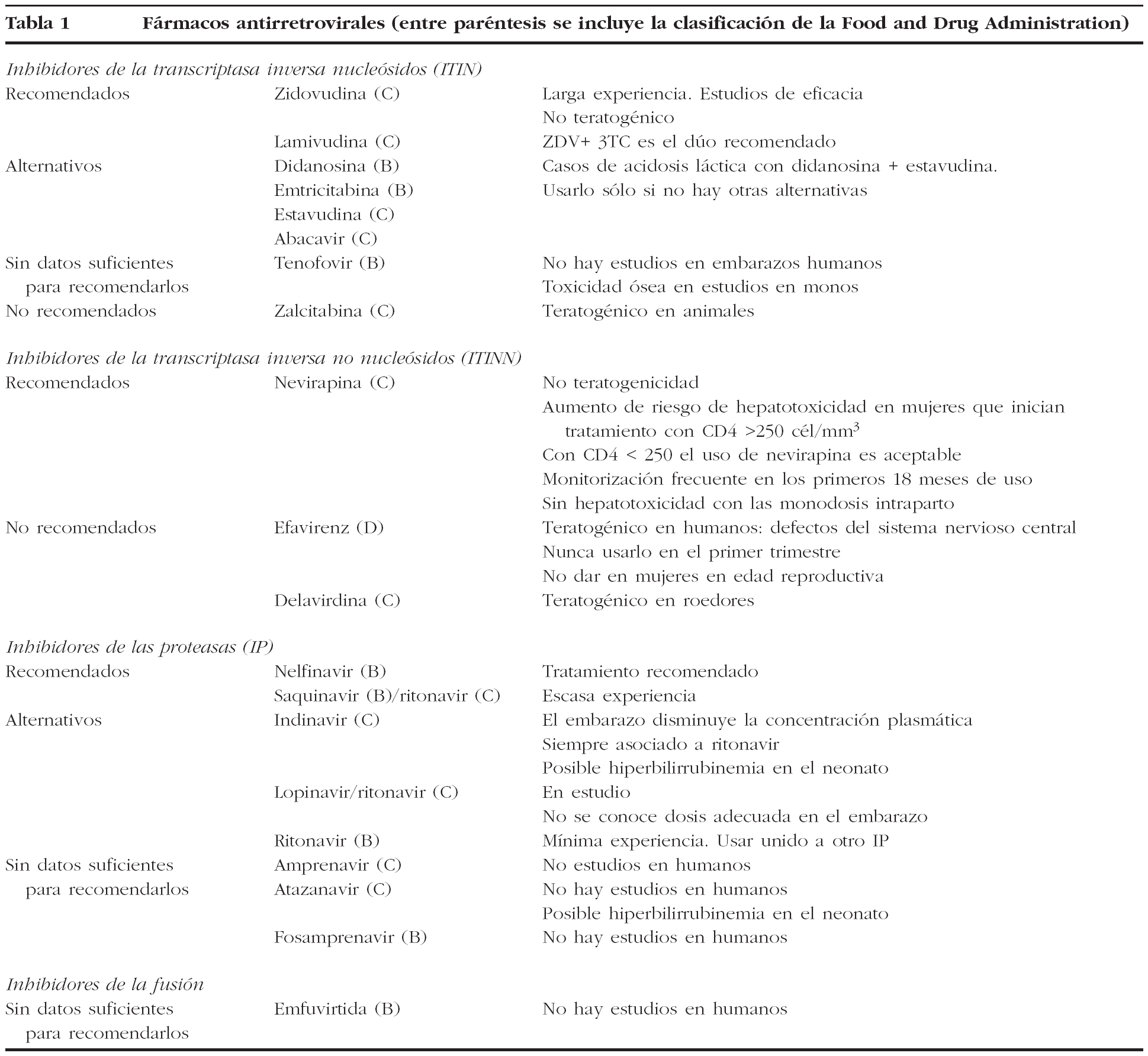
Figura 1. Protocolo de actuación en la gestante infectada por VIH, tratamiento antirretroviral y finalización de la gestación. Gestante no tratada antes de la gestación. ZDV: zidovudina. TARGA: terapia antirretroviral de gran actividad.
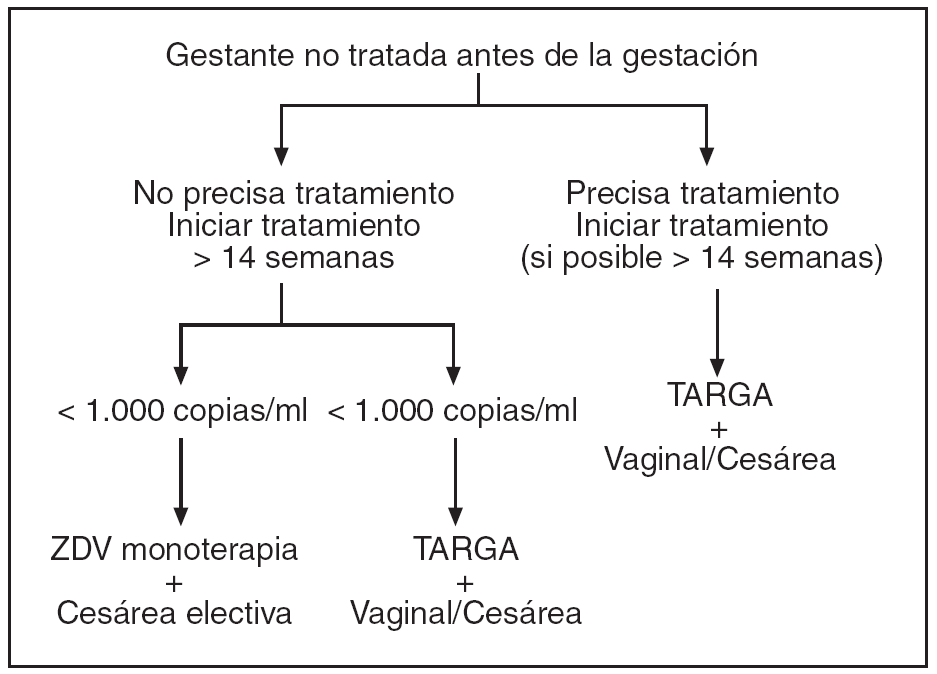
Figura 2. Protocolo de actuación en la gestante infectada por VIH, tratamiento antirretroviral y finalización de la gestación. Gestante tratada con TARGA antes de la gestación.
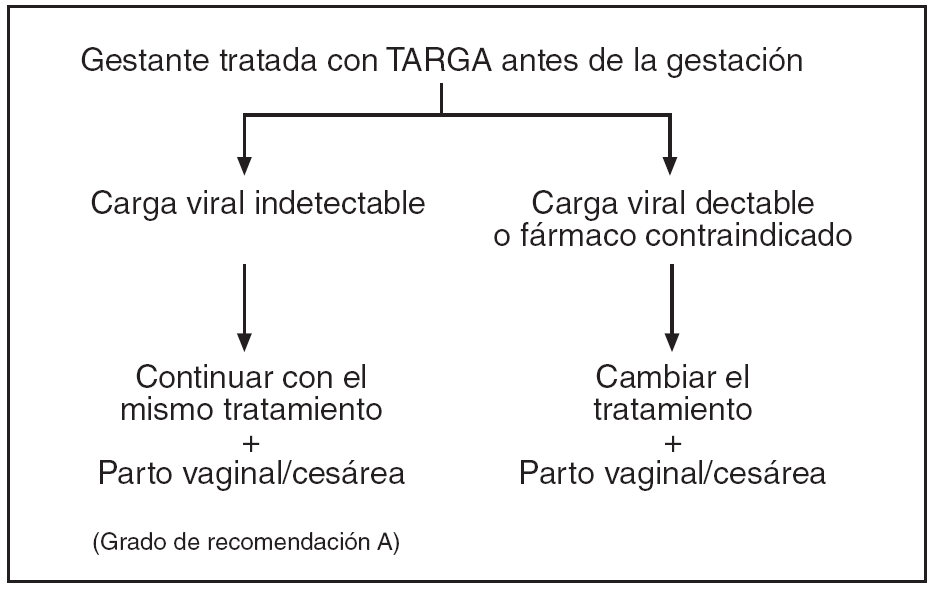
Figura 3. Protocolo de actuación en la gestante infectada por VIH, tratamiento antirretroviral y finalización de la gestación. Serología VIH intraparto desconocida.
Figura 4. Protocolo de actuación en la gestante infectada por VIH, tratamiento antirretroviral y finalización de la gestación. Diagnóstico intraparto o ausencia de control previo.
Clasificación de las recomendaciones en función del nivel de evidencia disponible
IaLa evidencia científica procede a partir de metaanálisis de ensayos clínicos controlados y aleatorizados
IbLa evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado
IIaLa evidencia científica procede de al menos un estudio prospectivo, controlado, bien diseñado y sin aleatorizar
IIbLa evidencia científica procede de al menos un estudio casi experimental, bien diseñado
IIILa evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles
IVLa evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio
Grados de recomendación
AExiste buena evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica Ia y Ib)
BExiste moderada evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica IIa, IIb y III)
CLa recomendación se basa en la opinión de expertos o en un panel de consenso. (Recoge el nivel de evidencia IV)
Los Protocolos Asistenciales en Ginecología y Obstetricia y los Protocolos de Procedimientos Diagnósticos y Terapéuticos de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en Departamentos y Servicios Hospitalarios.