Analizar retrospectivamente las características histológicas e inmunohistoquímicas de los carcinomas diagnosticados en pacientes de más de 70 años, intervenidas entre los años 2003 y 2005, y compararlas con las características del grupo de pacientes de menor edad.
Material y métodosSe estudiaron las características de 483 carcinomas diagnosticados durante los años 2003 a 2005 en el Servicio de Ginecología del Hospital Universitario 12 de Octubre (Madrid); 153 (31,7%) correspondieron a pacientes de 70 o más años. Para el estudio estadístico se utilizó el programa SPSS (versión 12). Se aplicó la prueba de la χ2 para las variables cualitativas (o prueba exacta de Fisher si se requirió), y las variables continuas se expresaron como media ± desviación estándar y mediana con rango intercuartílico.
ResultadosEn nuestras pacientes de 70 o más años, se hizo menos frecuentemente el diagnóstico tras sólo el hallazgo mamográfico. El carcinoma in situ y el microinvasivo fueron menos frecuentes y la media de tamaño de los carcinomas infiltrantes fue mayor (debido a la falta de cribado mamográfico). No encontramos otras diferencias histológicas ni inmunohistoquímicas con las pacientes de menor edad, ni de afectación ganglionar axilar en los casos en que se realizó linfadenectomía.
ConclusionesEl tratamiento debe decidirse tras el análisis conjunto de las características tumorales, el estado de salud y la expectativa de vida, sin dar por hecho que las pacientes mayores, por serlo, tendrán una evolución más indolente que las pacientes de menor edad.
We retrospectively analyzed tumoral characteristics (histology and immunohistochemistry) in a group of elderly patients (≥ 70 years old) after surgery between 2003 and 2005, and compared these characteristics with those of younger patients.
Material and methodsWe studied the characteristics of 483 breast carcinomas diagnosed sfrom 2003 to 2005 in the Gynecology Service of the 12 de Octubre Hospital in Madrid. Of these, 153 (31.7%) corresponded to patients aged 70 years old or older. Data were analyzed using the SPSS 12.0 program, and the groups were compared using chi-square analysis (or Fisher’s test when required). Quantitative data were expressed as mean±standard deviation and median with interquartile range.
ResultsIn our patients aged 70 years or older, diagnosis after mammography was less frequent. In situ and microinvasive carcinomas were less frequent and the mean size of invasive carcinomas was larger. These findings can be explained by the lack of mammographic screening. No other histological or immuno-histochemical differences were found in comparison with younger patients and no differences were found in axillary lymph node involvement in women with axillary dissection.
ConclusionsTreatment in elderly patients should be individually tailored according to the biological characteristics of the tumor, comorbidity, and life expectancy. Age per se should not be considered a predictive factor of worse outcome.
El cáncer de mama es la neoplasia más frecuente en la mujer y causa el 20% de las muertes por cáncer. Su incidencia va en aumento, sobre todo en pacientes de más de 50 años. Aproximadamente, el 35% de las mujeres diagnosticadas de cáncer de mama son mayores de 70 años, y casi el 50% tiene más de 65 años. La edad avanzada es un factor de riesgo de presentar esta afección, y por la creciente mayor supervivencia general, cada vez será más numeroso el grupo de pacientes geriátricas con cáncer de mama. El conocimiento acerca de las posibles diferencias en la biología del cáncer de mama y su evolución clínica en las pacientes mayores es limitado, debido sobre todo a que en los ensayos clínicos generalmente no se suele incluir a pacientes de más de 65 años. Por ello, puede no ser razonable extrapolar los hallazgos de éstas a pacientes mayores excluidas de esos estudios. Las pacientes mayores difieren de las más jóvenes en muchos aspectos, y ello puede afectar tanto a la elección del tratamiento como a su evolución clínica: su expectativa de vida es menor, es mayor el porcentaje de comorbilidad y existe un amplio abanico de perfiles, tanto funcionales como psicológicos.
Distintos autores han establecido distintos niveles de edad a partir de los cuales han considerado a la paciente como añosa, pero la gran mayoría ha puesto el punto de corte en los 70 años a la hora de considerar a la paciente como mayor (elderly patient).
En general, ha habido un largo debate acerca de la naturaleza del cáncer de mama en la paciente anciana, con algunos autores que han aseverado que en la paciente mayor el cáncer de mama (como parecían demostrarlo estudios previos al año 20001–3) tiene características biológicas menos agresivas (índices de proliferación más bajos, menores grados histológicos, mayor porcentaje de receptores hormonales positivos, ausencia de sobreexpresión de cerb-B2 [HER-2 neu], etc.). Trabajos antiguos parecían demostrar, sin embargo, que la supervivencia tras el cáncer de mama era peor en la paciente mayor4. Incluso trabajos recientes5 encuentran que a igualdad de histología (para los casos de factores histológicos adversos), la tasa de recurrencia local puede ser incluso algo más elevada en pacientes de más de 70 años. Otro estudio retrospectivo mostró que, a igual estadio de la enfermedad, la supervivencia era similar, salvo en las pacientes muy jóvenes y en las muy mayores (de más de 85 años), en las que la supervivencia fue peor6.
Lo que puede ensombrecer el pronóstico de las pacientes mayores es el hecho de que, debido a que el cribado mamográfico ya no se realiza a estas edades, suelen consultar en estadios más avanzados, y que el tratamiento en este tipo de pacientes suele ser menor que el estándar recomendado, incluso en los casos en que, por el estado funcional y la comorbilidad, se hubiese permitido realizarlo.
Todas estas diferencias potenciales entre las pacientes de más de 70 años con sus homólogas de menor edad harían recomendable realizar estudios específicos que incluyesen a este tipo de pacientes para poder sacar conclusiones con el fin de optimizar su tratamiento.
MATERIAL Y MÉTODOSSe estudiaron las características de 483 carcinomas diagnosticados en el período 2003–2005 en el Servicio de Ginecología del Hospital Universitario 12 de Octubre (Madrid). Dividimos a nuestras pacientes en 2 grupos: las de menos de 70 años y las de 70 o más años. Estudiamos retrospectivamente: la forma de diagnóstico, la histología, el grado histológico para los ductales (in situ o infiltrantes), el tamaño histológico, pT del sistema de estadificación TNM del American Joint Committee on Cancer, y la afectación axilar histológica en los casos en que se llevó a cabo linfadenectomía.
También se realizó un estudio inmunohistoquímico (IHQ) para determinación de los receptores hormonales (de estrógeno y progesterona), cerb-B2 (HER-2/NEU), p53 e índice de proliferación MIB-1. Se consideraron valores de p53 positivos, los porcentajes mayores del 10%. Asimismo los receptores de estrógeno o progesterona se consideraron positivos cuando fueron mayores del 10%. El cerb-B2, en un principio, se estudió mediante el HercepTest, y cuando dicha prueba fue positiva en grados 2 o 3, se procedió al estudio de hibridación in situ en busca de la amplificación del HER2/NEU.
Los carcinomas se consideraron microinfiltrantes, cuando existieron células cancerosas más allá de la membrana basal, pero en una extensión menor a 0,1cm.
Para el estudio estadístico, se utilizó el programa de procesamiento estadístico SPSS para Windows (versión 12). Se aplicó la prueba de la χ2 para tablas de contingencia de variables cualitativas, o la prueba exacta de Fisher cuando el caso así lo requirió. Los datos de variables continuas se expresan en forma de media ± desviación estándar y mediana con rango intercuartílico. Se consideraron diferencias estadísticamente significativas los valores de p < 0,05.
RESULTADOSDurante los años 2003 a 2005 se diagnosticaron en el Servicio de Ginecología del Hospital Universitario 12 de Octubre de Madrid, 483 carcinomas de mama. La edad media ± desviación estándar fue de 60,8 ± 13,4 años y la mediana de 60,6 (rango intercuartílico de 49,5 a 72,3 años). La edad media de las mayores de 70 años fue de 76,2 ± 4,7 años; en 129 casos (26,7%) las pacientes tenían menos de 50 años, 201 estuvieron comprendidos entre los 50 y los 69,9 años (41,6%) y los 153 (31,7%) casos restantes tuvieron más de 70 años. De este último grupo de mayor edad, el 49,7% (76 casos) tenía entre 70 y 74,9 años; el 30,1% (46 casos), entre 75–79 años; el 13,7% (21 casos), entre 80 y 84,9 años, y el 6,5%, más de 85 años (10 pacientes, la mayor de ellas de 91 años).
Los carcinomas se diagnosticaron tras la confirmación de la alteración mamográfica (biopsia con arpón guiada por mamografía), menos frecuentemente en pacientes del grupo de edad superior (tabla 1) que son diagnosticados tras la aparición de un nódulo clínico de forma más frecuente, que en las pacientes menores de 70 años. Considerando a las mayores, el carcinoma se diagnosticó sólo tras la alteración mamográfica en el 38,5% de las pacientes con edades comprendidas entre los 70 y los 79,9 años (47/122), porcentaje mayor pero sin significación estadística (p = 0,09) que entre las de 80 o más años, en las que se diagnosticó de esta forma el 22,6% (7/31).
En nuestro período de estudio se sometieron a quimioterapia neoadyuvante, y posteriormente a cirugía de rescate, 7 pacientes con carcinoma localmente avanzado (CMLA): 2 carcinomas inflamatorios y 5 casos de CMLA no inflamatorios. El carcinoma inflamatorio (diagnosticados con punción con aguja gruesa) supuso un 0,7% (2/267 carcinomas infiltrantes) en el grupo de menores de 70 años y un 0% (0/137) de las pacientes de mayor edad (p = 0,55). En el grupo con CMLA no inflamatorios, existió un 1,1% (3/267) en pacientes más jóvenes y un 3,6% (5/137) de las pacientes de 70 o más años (p = 0,13).
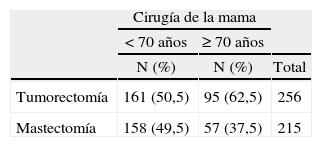
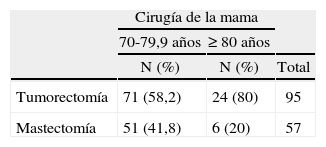
En cuanto al tratamiento quirúrgico de la mama, la mastectomía se realizó más frecuentemente en el grupo de edad de menos de 70 años (tabla 2); después de dividir al grupo de pacientes de 70 o más años en otros 2 subgrupos (uno de 70 a 79,9 años y otro de 80 o más años), pudimos comprobar (tabla 3) que en las pacientes de 80 o más años el porcentaje de mastectomías fue significativamente menor.
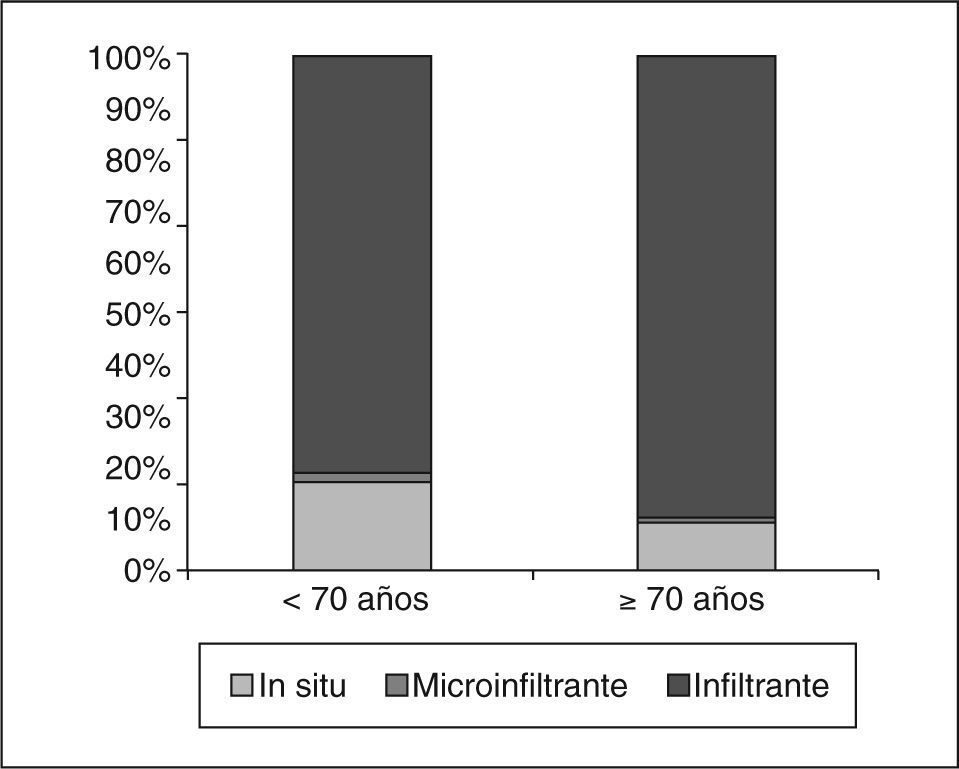
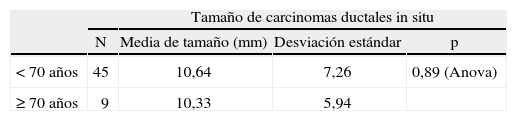
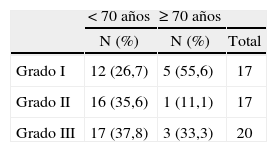
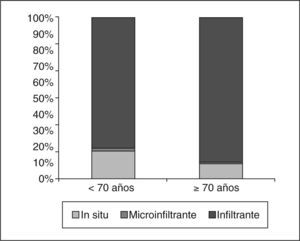
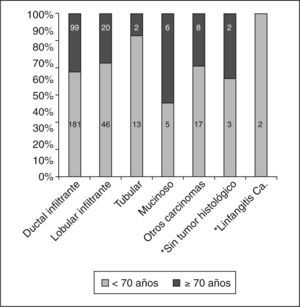
En nuestras pacientes, los carcinomas in situ (CDIS) fueron estadísticamente más frecuentes en el grupo de menor edad (fig. 1). No hubo diferencias en cuanto al tamaño de los CDIS dependiendo de la edad (tabla 4), contrariamente a lo que ocurrió en los carcinomas infiltrantes, que tuvieron una media de tamaño histológico estadísticamente menor en el grupo de las menores de 70 años que en el grupo de mayor edad (tabla 4).
Media de tamaños según edad (excluidos los carcinomas lobulillares in situ)
| Tamaño de carcinomas ductales in situ | ||||
| N | Media de tamaño (mm) | Desviación estándar | p | |
| < 70 años | 45 | 10,64 | 7,26 | 0,89 (Anova) |
| ≥ 70 años | 9 | 10,33 | 5,94 | |
| Tamaño de carcinomas infiltrantes | ||||
| N | Media de tamaño (mm) | Desviación estándar | p | |
| < 70 años | 262 | 19,45 | 11,68 | 0,03 (Welch) |
| ≥ 70 años | 35 | 23,14 | 11,54 | |
Para el cálculo de media del tamaño de los carcinomas infiltrantes, se excluyeron los carcinomas sometidos a neoadyuvancia.
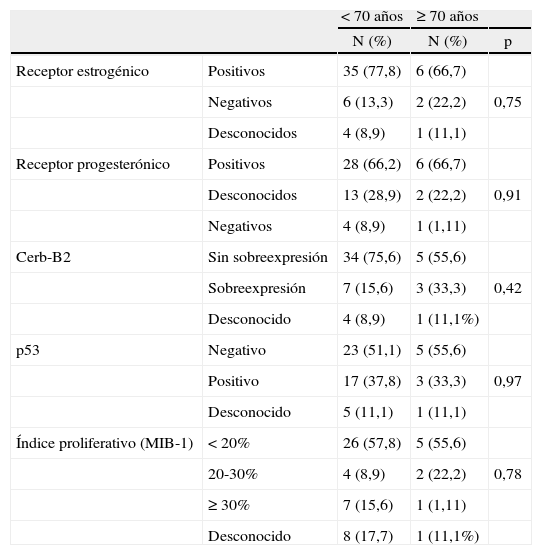
Dentro de los CDIS, no hallamos diferencias en cuanto a grado histológico para los 2 grupos de edad (tabla 5), ni tras el estudio IHQ (tabla 6) en porcentajes de receptores hormonales positivos, sobreexpresión de HER-2/NEU, p53 o índice de proliferación. Dentro de los CDIS que tuvieron receptor estrogénico (RE) positivo, no hubo diferencias (p = 0,39) en cuanto a la media de porcentaje de positividad entre las pacientes de menos de 70 años (n = 35; media de positividad del RE del 81,7 ± 18,5%) y las pacientes de mayor edad (n = 6; media de positividad del RE de 83,3 ± 8,7%), ni en la positividad del receptor de progesterona (RP) (p = 0,94) cuando éste fue positivo para menores de 70 años (n = 28; media de positividad del RP del 81 ± 23,1%) y del grupo de mayor edad (n = 6; media de positividad del RP de 81,7 ± 16,0).
Inmunohistoquímica en los carcinomas ductales in situ, según grupos de edad
| < 70 años | ≥ 70 años | |||
| N (%) | N (%) | p | ||
| Receptor estrogénico | Positivos | 35 (77,8) | 6 (66,7) | |
| Negativos | 6 (13,3) | 2 (22,2) | 0,75 | |
| Desconocidos | 4 (8,9) | 1 (11,1) | ||
| Receptor progesterónico | Positivos | 28 (66,2) | 6 (66,7) | |
| Desconocidos | 13 (28,9) | 2 (22,2) | 0,91 | |
| Negativos | 4 (8,9) | 1 (1,11) | ||
| Cerb-B2 | Sin sobreexpresión | 34 (75,6) | 5 (55,6) | |
| Sobreexpresión | 7 (15,6) | 3 (33,3) | 0,42 | |
| Desconocido | 4 (8,9) | 1 (11,1%) | ||
| p53 | Negativo | 23 (51,1) | 5 (55,6) | |
| Positivo | 17 (37,8) | 3 (33,3) | 0,97 | |
| Desconocido | 5 (11,1) | 1 (11,1) | ||
| Índice proliferativo (MIB-1) | < 20% | 26 (57,8) | 5 (55,6) | |
| 20-30% | 4 (8,9) | 2 (22,2) | 0,78 | |
| ≥ 30% | 7 (15,6) | 1 (1,11) | ||
| Desconocido | 8 (17,7) | 1 (11,1%) | ||
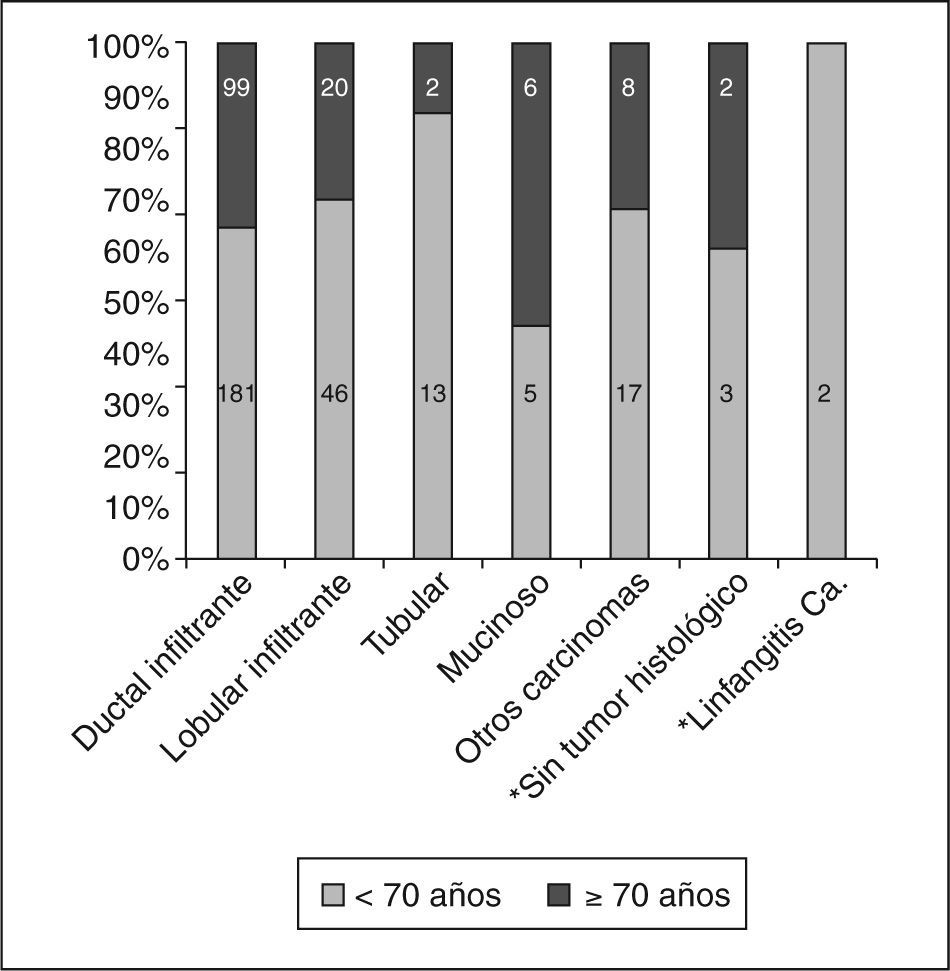
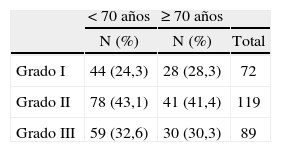
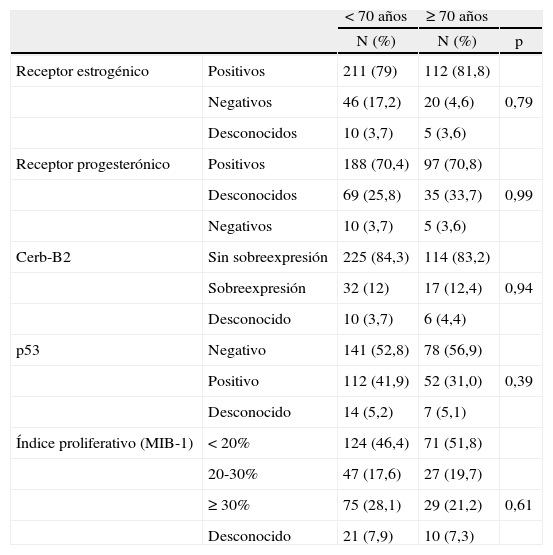
Tampoco vimos diferencias en cuanto a los tipos histológicos entre los carcinomas infiltrantes dependiendo de la edad, con un punto de corte a los 70 años (fig. 2). El carcinoma infiltrante más frecuente en las pacientes de más de 70 años fue el ductal infiltrante, que supuso el 72,3% (99/137) de estos casos, seguido por el lobulillar infiltrante (20/137, es decir, el 14,6% de los casos). Al considerar los grados histológicos de Bloom-Richardson para los carcinomas ductales infiltrantes, no pudimos observar diferencias en cuanto a los porcentajes de los distintos grados según la edad (tabla 7), ni tampoco (como había ocurrido en el caso de los CDIS) tras el estudio IHQ (tabla 8) en porcentajes de receptores hormonales positivos, sobreexpresión de HER-2/NEU, p53 o índice de proliferación.
Inmunohistoquímica en los carcinomas infiltrantes según grupos de edad
| < 70 años | ≥ 70 años | |||
| N (%) | N (%) | p | ||
| Receptor estrogénico | Positivos | 211 (79) | 112 (81,8) | |
| Negativos | 46 (17,2) | 20 (4,6) | 0,79 | |
| Desconocidos | 10 (3,7) | 5 (3,6) | ||
| Receptor progesterónico | Positivos | 188 (70,4) | 97 (70,8) | |
| Desconocidos | 69 (25,8) | 35 (33,7) | 0,99 | |
| Negativos | 10 (3,7) | 5 (3,6) | ||
| Cerb-B2 | Sin sobreexpresión | 225 (84,3) | 114 (83,2) | |
| Sobreexpresión | 32 (12) | 17 (12,4) | 0,94 | |
| Desconocido | 10 (3,7) | 6 (4,4) | ||
| p53 | Negativo | 141 (52,8) | 78 (56,9) | |
| Positivo | 112 (41,9) | 52 (31,0) | 0,39 | |
| Desconocido | 14 (5,2) | 7 (5,1) | ||
| Índice proliferativo (MIB-1) | < 20% | 124 (46,4) | 71 (51,8) | |
| 20-30% | 47 (17,6) | 27 (19,7) | ||
| ≥ 30% | 75 (28,1) | 29 (21,2) | 0,61 | |
| Desconocido | 21 (7,9) | 10 (7,3) | ||
En los carcinomas infiltrantes con RE positivos, el porcentaje de pacientes con RP negativos tampoco fue diferente en los 2 grupos de edad (tabla 9). Sólo tuvimos 1 caso que se consideró receptor hormonal positivo y que, con RE negativo, tuvo RP positivo (en el grupo de menos de 70 años).
Pacientes con carcinomas infiltrantes y receptor estrogénico positivo: estado de receptor de progesterona según la edad
| < 70 años | ≥ 70 años | ||
| N (%) | N (%) | Total | |
| Receptor de progesterona positivo | 187 (88,6) | 97 (86,6) | 284 |
| Receptor de progesterona negativo | 24 (10,4) | 15 (13,4) | 39 |
p = 0,60.
Existió 1 caso considerado receptor hormonal positivo, con receptor estrogénico negativo y receptor de progesterona positivo en el grupo de mayores de 70 años.
De los carcinomas infiltrantes que tuvieron RE positivo, hubo una diferencia en la media de positividad del RE (p = 0,01), aunque fue pequeña, y las pacientes de menos de 70 años (n = 211; media de positividad del RE de 79,1 ± 21,8%) tuvieron un porcentaje medio algo menor que las pacientes de mayor edad (n = 112; media de positividad del RE del 85,2 ± 17,6%). Sin embargo, no hubo diferencia en la positividad del RP (p = 0,48) cuando éste fue positivo para menores de 70 años (n = 188; media de positividad del RP del 73,8 ± 23,3) con el grupo de mayor edad (n = 97; media de positividad del RP del 71,6 ± 26,2).
El carcinoma mucinoso supuso un 4,4% de los carcinomas infiltrantes en las mayores de 70 años (5/267) comparado con el 1,9% (6/137) de las de menor edad (p = 0,09); cuando dividimos a nuestras pacientes en 3 grupos de edad, en las menores de 50 años supuso un 1,8% (2/109), un 1,9% en el grupo de 50 a 69,9 años (3/158) y un 4,4% (6 /137) en el de más de 70 años (p = 0,34). Hemos encontrado los carcinomas papilares infiltrantes con igual frecuencia (1,5%) en el grupo de menos de 70 años (4/267) y en el de 70 o más años (2/137), pero en el grupo de menor edad todos los casos los encontramos en edades comprendidas entre los 50 y los 69,9 años, y en el grupo de mayor edad todos los casos se concentraron en las mayores de 80 años. Los tubulares, sin embargo, supusieron un 4,9% en el grupo de las pacientes más jóvenes (13/267) frente al 1,5% de las mujeres de 70 o más años (2/137) (p = 0,19).
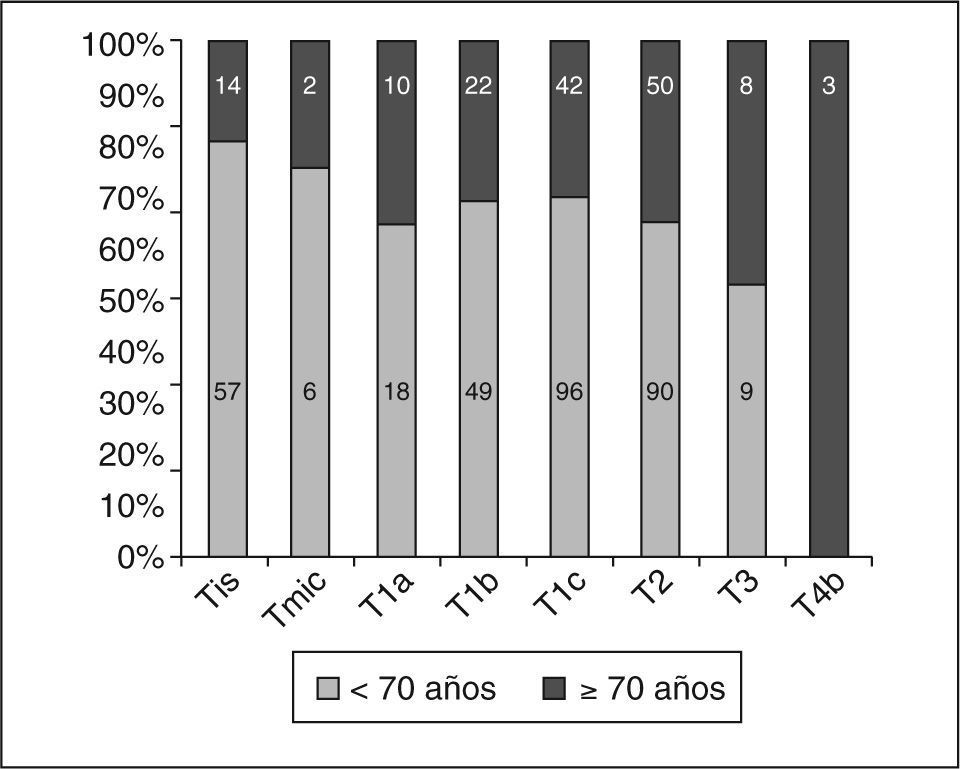
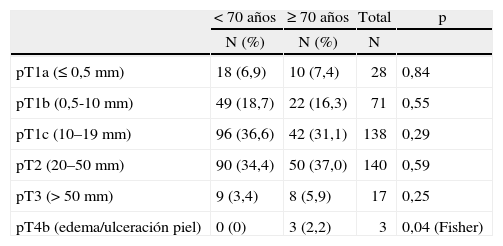
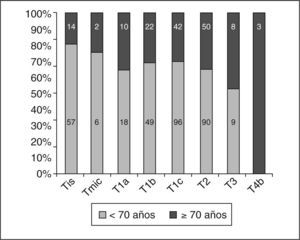
En cuanto al tumor primario (pT de la clasificación TNM posquirúrgica) observamos (excluidos los 7 casos sometidos a neoadyuvancia quimioterápica por CMLA) que los CDIS, los microinfiltrantes y los más precoces de entre los infiltrantes tuvieron mayor representación en porcentaje de pacientes menores de 70 años (fig. 3). Sin embargo, al considerar cada pT de los carcinomas infiltrantes por separado, no hubo diferencias (tabla 10) entre las menores de 70 años y las de menor edad, salvo en los casos pT4b (edema o ulceración de la piel), más frecuentes en el grupo de mujeres mayores.
pT de los carcinomas infiltrantes según grupos de edad (excluidos los casos intervenidos tras quimioterapia neoadyuvante)
| < 70 años | ≥ 70 años | Total | p | |
| N (%) | N (%) | N | ||
| pT1a (≤ 0,5mm) | 18 (6,9) | 10 (7,4) | 28 | 0,84 |
| pT1b (0,5-10mm) | 49 (18,7) | 22 (16,3) | 71 | 0,55 |
| pT1c (10–19mm) | 96 (36,6) | 42 (31,1) | 138 | 0,29 |
| pT2 (20–50mm) | 90 (34,4) | 50 (37,0) | 140 | 0,59 |
| pT3 (> 50mm) | 9 (3,4) | 8 (5,9) | 17 | 0,25 |
| pT4b (edema/ulceración piel) | 0 (0) | 3 (2,2) | 3 | 0,04 (Fisher) |
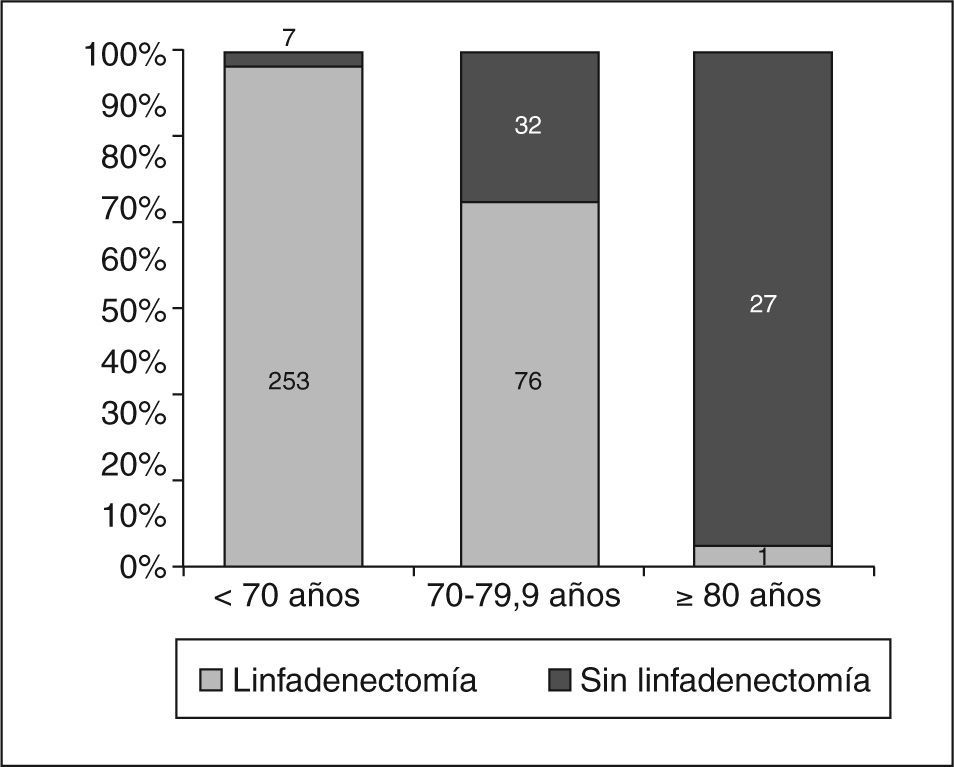
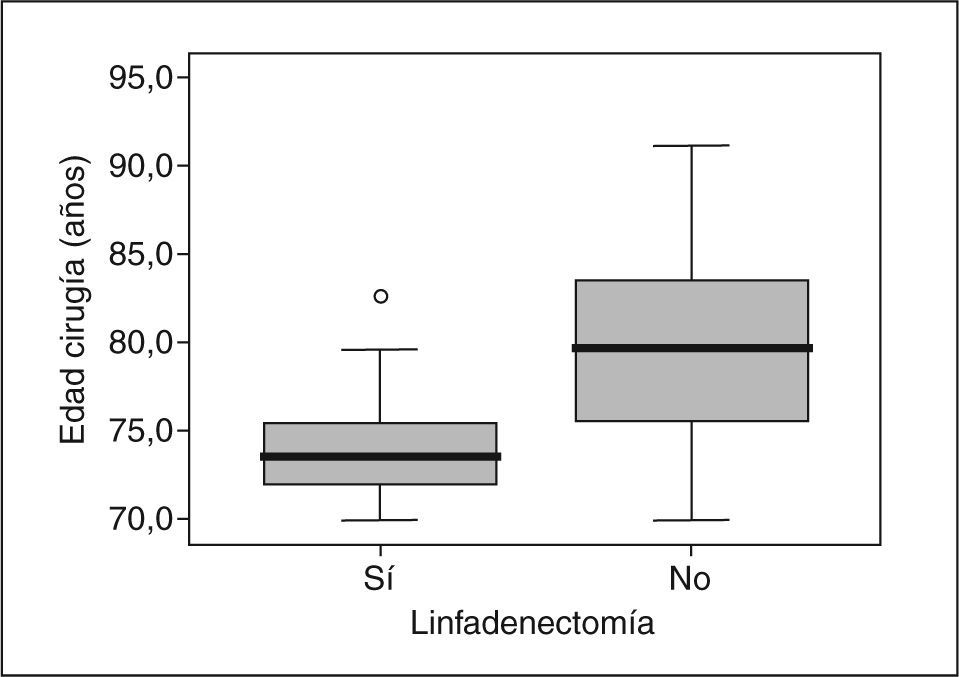
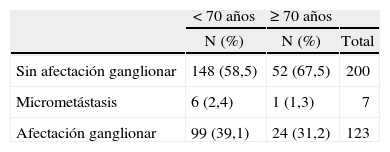
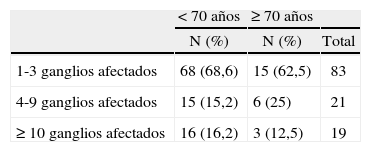
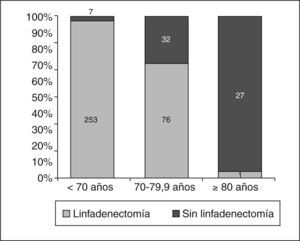
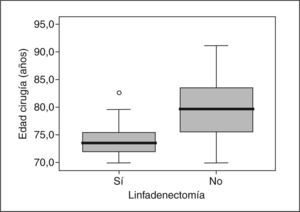
En los carcinomas infiltrantes, se realizó linfadenectomía axilar más frecuentemente (fig. 4) en las pacientes de menos de 70 años (97,3%), mientras que sólo se realizó en el 70,4% en las pacientes de 70 a 79,9 años, porcentaje que bajó al 3,6% en las de 80 o más años. En 8 casos la linfadenectomía ya se había realizado en una cirugía previa por carcinoma infiltrante (se trataba de recidivas locales), 7 de ellas en menores de 70 años. En nuestras pacientes, en general y para los carcinomas infiltrantes, la media de edad de los casos en que se realizó linfadenectomía fue significativamente mayor (n = 330; media = 58,3 ± 12,2 años) que la de los casos en que ésta no se realizó (n = 66; media = 76,8 ± 10,2; p = 0,001). La media de edad de las pacientes de 70 o más años y con diagnóstico de carcinoma infiltrante en que se realizó linfadenectomía (fig. 5) fue significativamente menor (n = 77; media = 73,9 ± 2,6 años) que la de pacientes a en que no se realizó (n = 59; media = 79,6 ±5,1 años). En cuanto a número de ganglios aislados según el corte de edad a los 70 años, no fue diferente en menores de esta edad (media = 13,74 ± 7,25 ganglios) que en las de 70 o más años (media = 13,04 ± 5,53 ganglios). En los casos en que se realizó linfadenectomía axilar, no encontramos diferencias en cuanto al porcentaje de no afectación, afectación ganglionar y micrometástasis con un punto de corte a los 70 años (tabla 11). Cuando hubo afectación ganglionar, tampoco observamos diferencias en cuanto al número de ganglios afectados según la edad (tabla 12).
Número de ganglios afectados según grupos de edad en los casos de afectación axilar de carcinomas infiltrantes
| < 70 años | ≥ 70 años | ||
| N (%) | N (%) | Total | |
| 1-3 ganglios afectados | 68 (68,6) | 15 (62,5) | 83 |
| 4-9 ganglios afectados | 15 (15,2) | 6 (25) | 21 |
| ≥ 10 ganglios afectados | 16 (16,2) | 3 (12,5) | 19 |
p = 0,50.
El cáncer de mama en la paciente anciana es un problema frecuente (el 31,7% de nuestras pacientes con carcinoma de mama tenía 70 o más años); su incidencia previsiblemente irá en aumento en los próximos años. La edad cronológica no debe ser motivo para privar a la paciente del mejor tratamiento disponible en cada caso, y el tratamiento sólo debe decidirse tras una evaluación adecuada del estado de la paciente y las características biológicas de la enfermedad, intentando evitar tanto el subtratamiento como el sobretratamiento. Se ha demostrado que en estas pacientes, el subtratamiento empeora su pronóstico sustancialmente7.
A nuestras pacientes de más de 70 años, consideradas globalmente, realizamos una mastectomía en un 37,5% de los casos, porcentaje menor que el que refiere Litvak y Arora8, que realizaron un 50% de mastectomías en sus pacientes de más de 70 años, pero mayor que el de Genaro et al9 que, en tumores < 3cm, realizaron sólo un 2,7% de mastectomías en pacientes mayores de esta edad. Al analizar otros 2 subgrupos dentro de las mayores, observamos que se había realizado un 41,8% en las mujeres entre 70 a 79,9 años y un 20% en el grupo de más de 80 años (debido a que el mayor porcentaje de comorbilidad en este grupo de las más ancianas, se realizó con mayor frecuencia cirugía de tumorectomía o cuadrantectomía, porque esta intervención se consideró menos agresiva quirúrgicamente). Además, muchos autores defienden que las pacientes mayores pueden desear conservar la mama independientemente de su edad (siguen dando importancia a su imagen corporal) cuando se les puede asegurar un resultado oncológico similar al de la mastectomía, y recomiendan la radioterapia adyuvante en estas pacientes. Sin embargo, uno de los problemas que tienen estas pacientes de edad avanzada es la dificultad a la hora de recibir radioterapia, por la necesidad de desplazamientos frecuentes al hospital durante un período prolongado, lo que era otro de los motivos por los que, en tiempos pasados, la mastectomía se llevaba a cabo en un porcentaje muy elevado de pacientes mayores.
En cuanto a las características tumorales, sólo encontramos 4 diferencias entre las pacientes menores de 70 años y las de 70 o más años: en nuestras pacientes menores de 70 años el diagnóstico se hizo de forma más frecuente mediante biopsia con arpón que en el grupo de mayores; los CDIS fueron más frecuentes en este tipo de pacientes; los carcinomas microinvasivos e invasivos más precoces también fueron más frecuentes, y la media del tamaño histológico de los carcinomas infiltrantes fue significativamente menor en el grupo de menor edad. Estos hechos se pueden explicar porque el cribado mamográfico en el período que comprendió este estudio se realizaba hasta los 65 años, razón por la que las pacientes de 70 o más años se presentaban ya de forma más frecuente con nódulo clínico. En nuestras pacientes, hasta un 64,7% acudió con nódulo clínico, porcentaje que para Djordjevic et al10 es del 53,86% (si bien estos autores consideran pacientes mayores a partir de los 65 años). Por ello, y para poder diagnosticar a estas pacientes en estadios más tempranos, muchos autores recomiendan el cribado anual hasta los 75 años, e incluso continuar pasada esta edad cuando no existe ninguna comorbilidad, o ésta es de escasa trascendencia.
Hay pocos estudios sobre CDIS en pacientes mayores. Vicini y Recht11 afirman que en sus CDIS no existieron diferencias en cuanto a características biológicas tumorales entre las pacientes mayores y las de menor edad, a pesar de lo cual observaron una menor incidencia de recidivas locales en el grupo de mayor edad. Rodrigues et al12 tampoco encuentran diferencias en las características histológicas en los CDIS en las pacientes mayores, y atribuyen la menor frecuencia de recidivas locales de estos CDIS en el grupo de mayor edad a la menor frecuencia de sobreexpresión de HER-2/NEU en estos casos; el resto de los factores inmunohistoquímicos son similares en ambos grupos. Sin embargo, en un estudio realizado por Smith et al13 en pacientes de más de 66 años con CDIS y cirugía conservadora, la radioterapia adyuvante confirió un beneficio sustancial, incluso en los casos de CDIS con factores histológicos e inmunohistoquímicos de bajo riesgo (grado I, sin sobreexpresión de HER-2/NEU, receptores hormonales positivos), por lo que para estos autores el CDIS en la paciente mayor no sería más indolente que en pacientes de menor edad.
En nuestros CDIS no hemos encontrado diferencias en cuanto al grado histológico ni las características inmunohistoquímicas en ambos grupos de edad.
En los carcinomas infiltrantes, todos los autores coinciden en que el tipo histológico más frecuente, tanto en pacientes mayores de 70 años como en menores de esta edad, es el carcinoma ductal infiltrante. Nosotros también hemos podido constatar este hecho. Diab et al3 observaron que los tipos histológicos menos agresivos son más frecuentes en pacientes mayores, y así los carcinomas mucinosos sólo suponen el 1% de sus pacientes premenopáusicas, el 4% de las mujeres de 75 a 85 años y el 6% de las pacientes de más de 85 años. También en nuestros casos los carcinomas mucinosos fueron más frecuentes en las pacientes de 70 o más años, aunque sin significación estadística. Estos mismos autores describen una frecuencia de los carcinomas papilares infiltrantes del 0,3% en pacientes premenopáusicas y del 1% en las pacientes de más de 70 años. Para este último tipo histológico, hemos encontrado la misma frecuencia para mujeres menores de 70 años que para las mayores de esta edad. El hecho de que en nuestras pacientes tuviéramos más carcinomas tubulares infiltrantes (4,9%) (tipo de especial buen pronóstico) en el grupo de menor edad (13/267) que en el de mujeres mayores (1,5%; 2/137), se puede deber a que todos ellos se diagnosticaran mediante biopsia con arpón, y esta forma de diagnóstico fue más frecuente antes de los 70 años.
En cuanto a estado de los receptores hormonales en los carcinomas infiltrantes, tuvimos un porcentaje similar en los 2 grupos de pacientes. Genaro et al9 refieren un porcentaje muy semejante al nuestro en los casos de carcinomas infiltrantes en porcentajes de RE y RP en su grupo de mayores de 70 años.
Bardou et al14 demostraron mediante análisis multivariado que el subgrupo de pacientes con RE positivo y RP negativo parece tener un valor predictivo (probable menor respuesta al tamoxifeno) y pronóstico (peor pronóstico) independiente dentro de todos los demás cánceres con RE positivo. Tampoco en este subgrupo de pacientes encontramos diferencias en ambos grupos de edad.
A pesar de que en las pacientes mayores de 70 años el porcentaje de linfadenectomía axilar fue menor que en las más jóvenes, no hubo diferencias en cuanto a la afectación axilar en ambos grupos, ni en los casos de axila afectada, en número de ganglios positivos en cada grupo (similar a lo que describen Genaro et al9). Tampoco encontramos diferencias por edad en relación con ganglios aislados cuando se realizó una linfadenectomía, mientras que Truong et al5 encontraron un significativo menor número de ganglios aislados en las pacientes de más de 70 años de edad.
Recientemente el Internacional Breast Cancer Study Group (IBCSG) ha publicado los resultados de un ensayo aleatorizado que comparaba la linfadenectomía axilar frente a la no linfadenectomía en pacientes mayores15. Se aleatorizó a 474 pacientes de más de 60 años (media = 74 años), de las que el 80% tenía RE positivo, axila clínicamente negativa y tumores T1, T2 y T3. A todas se pautó hormonoterapia adyuvante con tamoxifeno; el seguimiento medio fue de 6,6 años. Concluyen, tras analizar supervivencias libres de enfermedad y global, que la no realización de linfadenectomía en pacientes de más de 60 años con RE positivos y hormonoterapia adyuvante ofrece similares resultados al procedimiento estándar. Sin embargo, otros autores siguen considerando, siempre que el estado general de la paciente permita el procedimiento quirúrgico, conocer el estado ganglionar axilar. Quizá lo ideal esté en un punto medio: la técnica del ganglio centinela en las pacientes con axila clínicamente negativa. Muchos autores9,16 consideran la técnica del ganglio centinela no sólo practicable en el grupo de pacientes ancianas, sino también de gran utilidad. La información que se obtuvo de los ganglios centinela influyó, para estos autores, a la hora de decidir completar el tratamiento en las pacientes ancianas (cuando fue positivo se realizó una linfadenectomía axilar reglada, e incluso quimioterapia en los casos con buen estado de salud general y expectativa de vida de más de 5 años). Ambos autores no han encontrado recurrencias axilares en los casos en que sólo se realizó la técnica del ganglio centinela y éste fue negativo. Por esto, concluyen que esta técnica es una forma segura y eficaz de evaluar el estado de los ganglios axilares en pacientes ancianas con cáncer de mama operable de menos de 3cm. En el período de nuestro estudio aún no realizábamos la técnica del ganglio centinela en nuestras pacientes mayores (en la actualidad la realizamos a un gran número de nuestras enfermas mayores, por lo que conocemos el estado axilar en un porcentaje muy superior al de la época motivo del actual estudio).
Son muchos los autores que mencionan el subtratamiento de las mujeres mayores como la causa de un empeoramiento de su pronóstico17–20. Enher et al21, al estudiar las características de 1.859 pacientes de más de 65 años que en distintas comunidades habían recibido subtratamiento, observaron que la mayoría de las pacientes subtratadas tenía características tumorales de bajo riesgo, pero que hasta un 30% de las subtratadas tenía características histológicas o inmunohistoquímicas de alto riesgo y no se beneficiaron de un tratamiento adecuado a su perfil, incluso muchas de ellas tenían un estado de salud bueno, por lo que concluyen que la edad es un factor de riesgo independiente de no recibir tratamiento óptimo (independientemente de la comorbilidad y los factores de riesgo inherentes al tumor primario).
Por otro lado, es bastante bajo el porcentaje de pacientes de más de 70 años que recibe radioterapia adyuvante tras la cirugía conservadora de la mama. Por la falta de estudios prospectivos con un número suficientemente elevado de pacientes añosas de los que poder sacar conclusiones, existen estudios retrospectivos con resultados para todas las opiniones. Hay autores que afirman que su omisión no parece producir grandes perjuicios3,22. Otros23, sin embargo, encuentran porcentajes de recurrencias locales de hasta el 30%. En un estudio publicado recientemente, Troung et al24 comentan que mientras en pacientes con cirugía conservadora de mama entre los 65 y los 74 años, en un 9% no se realiza radioterapia adyuvante, en pacientes de 75 o más años se omite en un 26% de los casos. Estos autores encuentran, en pacientes de más de 75 años con cirugía conservadora sin radioterapia posterior, un mayor porcentaje de recurrencias locales e incluso menor supervivencia, tanto global como específica, por cáncer de mama, esto a pesar de que se omitió la radioterapia en los casos con características tanto histológicas como inmunohistoquímicas más favorables. Hay que tener en cuenta que las recurrencias suelen ser devastadoras para la paciente, tanto física como psíquicamente, y que la radioterapia actualmente es un procedimiento generalmente bien tolerado por la paciente mayor, con pocas secuelas agudas y tardías, y sin toxicidad añadida debida a la edad. Sin embargo, sigue siendo infrautilizada, probablemente debido a su coste y a las inconveniencias que aporta a la paciente anciana, ya que tiene que acudir al hospital repetidamente y durante varias semanas. En este sentido, tal vez las nuevas estrategias (irradiación parcial acelerada o incluso radioterapias más breves o intraoperatorias), puedan resultar atractivas para estas pacientes.
La edad por sí misma25,26 no es un factor de riesgo independiente en las pacientes ancianas; sí lo son la realización de la cirugía de urgencia, la clasificación en grados 3 o 4 de la American Society of Anesthesiologists y la existencia de enfermedad grave hepática o renal. Dado que la cirugía mamaria se puede realizar con anestesia local con sedación, regional o general, serán pocas las pacientes que no puedan ser operadas con relativa baja morbilidad peroperatoria tras una correcta evaluación preoperatoria y la estabilización de las enfermedades concurrentes (evaluación y tratamiento multidisciplinario). Además, por los recientes avances en anestesia, cada vez se puede operar a pacientes a edades más avanzadas y con afecciones generales más importantes.
El riesgo en la cirugía mamaria viene dado por la duración de la intervención, la intensidad del estrés (especialmente hemodinámico) y por el efecto que la cirugía produzca sobre la función respiratoria. En 2002, el American College of Cardiology/American Heart Association27clasificó las intervenciones por su riesgo específico cardíaco en alto, intermedio o bajo riesgo. Considera la cirugía mamaria sin complicaciones, conservadora o mastectomía, de bajo riesgo. Sin embargo, cuando se prevén problemas técnicos, el riesgo se puede elevar considerablemente. En los casos en que se realiza la cirugía de urgencia (tras hemorragia o infección) el riesgo se triplica, y según estos autores, el tratamiento hormonal neoadyuvante de las pacientes ancianas puede llevarlas, en algún momento de su evolución, a estos resultados, con la consiguiente necesidad de tener que realizar cirugía de urgencia.
En general, pensamos que, siempre y cuando el estado general de la paciente lo permita y la expectativa de vida así lo justifique, todas las pacientes ancianas deben poder beneficiarse del tratamiento lo más cercano posible al estándar, incluidas todas las modalidades terapéuticas (cirugía, radioterapia y hormonoterapia) y en algunos casos muy seleccionados, incluso quimioterapia.