REVISIÓN DE CONJUNTO
Estimulación folicular ovárica y riesgo de cáncer ginecológico (con especial referencia al cáncer de ovario)
Ovarian follicle stimulation and risk of gynecological cancer (with special reference to ovarian cancer)
J. Balasch
J. González-Merlo1
Institut Clínic de Ginecologia, Obstetrícia i Neonatologia Facultat de Medicina-Universitat de Barcelona
Hospital Clínic-Institut d''Investigacions Biomèdiques
August Pi i Sunyer
Barcelona.
1 Catedrático Emérito
Correspondencia:
J. Balasch
Servicio de Obstetricia y Ginecología
Hospital Clínico
Villarroel, 170
08036 Barcelona
Fecha de recepción: 16/7/99
Aceptado para publicación: 9/9/99
RESUMEN
La nuliparidad constituye un riesgo bien establecido para diferentes tipos de cáncer ginecológico, riesgo que se incrementa cuando la esterilidad participa como factor independiente adicional. Un metanálisis de 12 estudios casos-control norteamericanos publicado en 1992 sugería además un incremento de riesgo de hasta tres veces para cáncer invasivo de ovario en las mujeres estériles que habían sido tratadas con «fármacos de la fertilidad» (supuestamente inductores de la ovulación). En este artículo se realiza un análisis crítico de los estudios tanto descriptivos como analíticos que se han publicado acerca de la potencial asociación entre estimulación folicular y cáncer de ovario. Se incluye también la información disponible en relación al cáncer de mama, de útero y algunas otras neoplasias. Del análisis de la literatura se puede concluir que no existe evidencia para establecer una relación de causalidad entre el uso de inductores de la ovulación y riesgo de cáncer ginecológico, pero se discuten las implicaciones clínico-prácticas que se derivan de esta controversia.
PALABRAS CLAVE
Cáncer de ovario; Cáncer de mama; Clomifeno; Esterilidad; Gonadotrofinas; Inducción de la ovulación.
ABSTRACT
Nulliparity is a well-established risk factor for different types of gynecological cancer. The risk increases when sterility is involved as an additional independent factor. A metaanalysis of 12 North American case-control studies, published in 1992, suggested that the risk of invasive ovarian cancer increased by as much as three-fold in sterile women who had been treated with fertility drugs (supposedly ovulation inductors). A critical analysis was made of published descriptive and analytical studies of the potential association between follicular stimulation and ovarian cancer. Information regarding the relation to cancer of the breast and uterus, as well as other neoplasms, is also included. Our analysis of the literature suggested that there is no evidence of a causal relation between the use of ovulation inductors and the risk of gynecological cancer. However, the clinical and practical implications of this controversy are discussed.
KEY WORDS
Ovarian cancer; Breast cancer; Clomifen; Sterility; Gonadotrophins; Induction of ovulation.
INTRODUCCIÓN
Los potenciales efectos secundarios a corto plazo de la inducción y estimulación de la ovulación para la terapéutica de la esterilidad, esencialmente el síndrome de hiperestimulación ovárica y el embarazo múltiple, son complicaciones bien conocidas por el ginecólogo(1,2,2bis). Sin embargo, en el momento actual se dirime además la posibilidad de que la estimulación folicular ovárica pueda asociarse como complicación a largo plazo a un incremento del riesgo de cáncer ginecológico, esencialmente a la neoplasia de ovario. Resulta fácil comprobar al revisar la literatura actual el interés y la controversia que el tema está suscitando, hecho comprensible si se tiene en cuenta el importante auge que están teniendo las técnicas de reproducción asistida en las que la inducción del desarrollo polifolicular múltiple constituye un requisito esencial. Pero es que, además, se ha producido, en base a la generalización de dichas técnicas, un cambio sustancial en la filosofía original del empleo de los fármacos inductores de la ovulación.
En efecto, en estos últimos años los fármacos estimulantes de la ovulación están siendo profusamente utilizados no ya en pacientes anovuladoras, sino en mujeres normo-ovuladoras para conseguir el reclutamiento de múltiples folículos/ovocitos en cada ciclo de tratamiento, práctica denominada hiperestimulación ovárica controlada. Y es importante destacar que hay varios factores que diferencian la hiperestimulación ovárica controlada de la práctica tradicional de inducción de la ovulación con citrato de clomifeno o gonadotrofinas. La diferencia más importante es que el desarrollo de más de un folículo maduro era antes un problema que se intentaba evitar o que pasaba inadvertido; con la hiperestimulación ovárica controlada éste es precisamente el objetivo del tratamiento. Por otra parte, estas dos formas terapéuticas se diferencian también por ciertos elementos subjetivos introducidos por el médico. En la inducción de la ovulación convencional se actúa de forma cautelosa y conservadora. En la práctica de la hiperestimulación ovárica controlada no hay estrictas «reglas a seguir» y se es terapéuticamente «más agresivo», tal como se refleja en la cantidad de gonadotrofinas empleadas, los niveles de estradiol alcanzados y el número de folículos que maduran(2).
Aun cuando no hay evidencia de que los fármacos inductores de la ovulación puedan actuar directamente como carcinógenos o como inductores/promotores de tumores a través de la interferencia con el equilibrio hormonal endógeno de la mujer, el marcado incremento de niveles de esteroides ováricos y gonadotrofinas circulantes a los que se asocia su empleo podría teóricamente estar implicado en casos de neoplasias hormono-dependientes.
La asociación entre el empleo de «fármacos para el tratamiento de la esterilidad» y el incremento del riesgo de cáncer fue sugerido inicialmente por la descripción de diferentes casos de cáncer de ovario y de mama diagnosticados en mujeres que habían sido tratadas previamente con dichos fármacos (el término anglosajón «fertility drugs» [«fármacos de la fertilidad»] es utilizado de forma universal en la literatura actual sobre el tema sin que se especifique en ocasiones de qué tipo de fármaco se trata aun cuando se infiere en general, pero no siempre, que hace referencia a los inductores de la ovulación). A ello siguieron posteriormente diferentes estudios epidemiológicos de cohortes o de casos-control que intentan dar respuesta a la interrogante esencial del problema: ¿existe una relación de causalidad entre la administración de los fármacos inductores de la ovulación y el riesgo de ciertas neoplasias? O para ser más exactos: teniendo en cuenta que las mujeres nulíparas tienen un mayor riesgo de presentar ciertos tipos de cáncer genital, ¿supone el empleo de estos «fármacos de la fertilidad» un incremento adicional sobre el riesgo específico de la mujer para padecer un cáncer determinado por encima del que sería predecible por su esterilidad o baja paridad? Y aún más, ¿supone la esterilidad un riesgo adicional al de la nuliparidad o es la primera y no la segunda el verdadero factor de riesgo?
En este artículo se analiza la literatura que intenta dar respuesta a estas interrogantes.
CÁNCER DE OVARIO
Introducción
El cáncer de ovario constituye la causa más frecuente de muerte por cáncer ginecológico en el mundo occidental y la cuarta causa más importante de muerte por cáncer tras las neoplasias de mama, pulmón e intestino grueso(3-5). Se trata de una enfermedad que afecta fundamentalmente a las mujeres peri o postmenopáusicas, con una edad media de presentación entre los 50 y 59 años. En el 85-90% de casos en el adulto el cáncer se origina en el epitelio superficial del ovario(3,6) y los estudios epidemiológicos indican la existencia de factores etiológicos de tipo ambiental, genéticos y endocrinológicos(4,7,8).
Aun cuando no existen datos en la literatura que permitan incriminar un factor etiológico individual para este grupo de tumores, existe evidencia creciente en favor de una predisposición genética en algunos subgrupos de pacientes y de una clara relación con la historia reproductiva. El cáncer de ovario es una enfermedad esencialmente de los países desarrollados en los que la limitación del tamaño familiar es habitual y diferentes estudios han demostrado el alto grado de protección que la gestación confiere frente a la enfermedad, y viceversa, que las mujeres que por alguna razón nunca han quedado gestantes tienen una incidencia elevada de esta neoplasia(9,10). Así pues, la paridad constituye el factor «natural» más importante capaz de influir sobre el riesgo de cáncer de ovario y el único factor protector «exógeno» que se equipara al embarazo en su efecto potencial es el uso de los contraceptivos orales(11). Dado que el efecto protector del embarazo aumenta con el número de gestaciones de la mujer y que la protección conferida por la toma de los anticonceptivos orales se incrementa con la duración de uso, se ha sugerido que el nexo o mecanismo protector común de la multiparidad y la toma de los contraceptivos sería la supresión de la ovulación(9,12).
En contraste con lo anterior, se ha sugerido que la «ovulación incesante» estaría positivamente asociada al riesgo de cáncer de ovario. Esta teoría etiológica para el cáncer de ovario fue propuesta por primera vez hace más de 25 años por Fathalla(13) en una carta a The Lancet. La hipótesis es que con cada ovulación se produce un mínimo trauma en la superficie ovárica que de forma repetitiva y acumulativa podría contribuir al desarrollo del cáncer de ovario. El cese de las ovulaciones debido al embarazo o a la toma de contraceptivos orales interrumpiría este proceso de microtraumatismo repetido y podría proteger frente al desarrollo del cáncer. De esta manera la «edad ovulatoria» (período de tiempo entre la menarquia y el diagnóstico del cáncer de ovario o el cese de las menstruaciones menos los períodos de tiempo de «protección» por la anovulación debida al embarazo o los anticonceptivos orales) estaría en relación con el riesgo de cáncer de ovario(14).
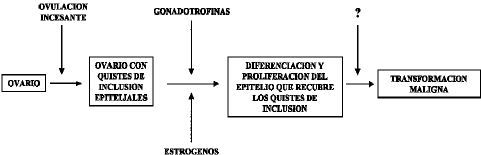
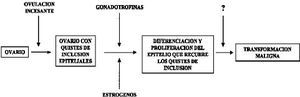
Por otra parte, tanto la gestación como el uso de anticonceptivos orales se asocian también a unos niveles bajos de gonadotrofinas en plasma, mientras que clásicamente se ha atribuido una potencial relevancia a la elevación de los niveles gonadotróficos en los primeros años postmenopausia en relación al cáncer de ovario(15). De esta manera se ha propuesto el siguiente modelo en la patogenia del cistoadenocarcinoma de ovario en los humanos (Fig. 1)(16). En una primera fase se formarían quistes de inclusión por atrapamiento del epitelio de superficie en el estroma ovárico tras cada ovulación. En una fase ulterior se produciría la eventual transformación maligna del epitelio que recubre los quistes de inclusión(17) como consecuencia de la estimulación directa por las gonadotrofinas y/o estrógenos o por la estimulación indirecta a través del incremento de la esteroidogénesis inducida por las gonadotrofinas. En este modelo, todos los factores que predisponen a la formación de quistes, los que inducen una hiperestrogenemia y/o los que provocan una elevación de los niveles de gonadotrofinas, contribuirían a incrementar el riesgo de cáncer de ovario(16).
Figura 1. Hipótesis etiológica sobre el cáncer de ovario (Cramer y Welch, 1983)(16).
Si esta hipótesis resultara ser cierta, entonces el empleo de los inductores de la ovulación que promueven la poliovulación en un mismo ciclo podría teóricamente incrementar el riesgo de cáncer de ovario. De hecho, en la década de los 90 se ha reabierto con gran interés este postulado etiológico sobre el cáncer de ovario y la «hipótesis de las gonadotrofinas/ovulación incesante» ha sido re-examinada en su potencial valor etiopatogénico en este tipo de neoplasia en base a: a) los estudios que han sugerido la importancia etiológica del lado ovulatorio en el cáncer epitelial de ovario; b) los casos clínicos publicados de cáncer de ovario en pacientes sometidas a estimulación folicular ovárica, y c) especialmente en base a un análisis combinado de 12 estudios casos-control norteamericanos previos que concluía que las mujeres estériles que habían recibido «fármacos de la fertilidad» tenían un riesgo casi tres veces superior al de las mujeres no estériles de padecer un cáncer invasivo epitelial de ovario(18).
Lado ovulatorio y cáncer de ovario
En base a una publicación que indicaba que la ovulación se produce con más frecuencia en el ovario derecho (65%)(19), Cruickshank(20) postulaba que si la ovulación era etiológicamente importante en el cáncer epitelial de ovario, era de esperar que esta enfermedad se ubicara también con más frecuencia en el lado derecho. En un estudio de 214 mujeres con cáncer de ovario confirmaba aparentemente su postulado y concluía que su estudio era el primero en demostrar que dicho tipo de neoplasia se origina más frecuentemente a partir del ovario derecho. Sin embargo, los hallazgos de dicho estudio se basaron en la presunción de que en las pacientes con cáncer bilateral el lugar de origen del tumor era aquel en el que el tamaño tumoral era mayor. Tal como indicaba el mismo autor en el artículo, no hay evidencia directa que permita apoyar esta suposición(20). Por otra parte, hay que destacar que entre el 30 y el 60% de neoplasias ováricas, tanto invasivas como de bajo potencial maligno, implican a ambos ovarios(3,21) y el 52% de las pacientes estudiadas por Cruickshank(20) tenían un cáncer bilateral o indeterminado. El recálculo de los datos de aquel estudio, excluyendo los tumores bilaterales, demuestra incidencias similares para los tumores ováricos derechos e izquierdos lo que coincide con un estudio nuestro basado en 293 casos de cáncer epitelial de ovario(22).
El estudio de Potashnik et al.(19) en el que se concluía que la ovulación en el lado derecho se daba con una prevalencia mayor que en el ovario izquierdo incluía tan sólo 16 mujeres en las que el lado de la ovulación se estableció mediante ecografía practicada «al menos en una ocasión y lo más próxima posible al punto más bajo de la curva de temperatura basal». Otros estudios realizados en monas o en humanos indican que la ovulación se produce de forma alternante(23), ipsilateral(24) o aleatoriamente(25) entre uno y otro ovario pero sin predilección significativa por ninguno de los dos lados. En un estudio nuestro en el que se incluyeron pacientes sometidas a fecundación in vitro en ciclo no estimulado y en las que por tanto se realizó una estricta monitorización tanto hormonal como ecográfica del desarrollo folicular, no pudo demostrarse el supuesto predominio de las ovulaciones por el lado derecho entre el total de 156 ciclos estudiados(22).
Inducción de la ovulación y cáncer de ovario: estudios descriptivos
Aun cuando la publicación de casos aislados o series cortas sobre una enfermedad proporcionan fundamentalmente datos clínicos y no científico-epidemiológicos, contribuyen a concienciar a la clase médica y a incrementar la vigilancia respecto a dicha enfermedad. Los primeros casos de carcinoma de ovario en pacientes que habían sido sometidas a estimulación folicular ovárica se publicaron en 1982(26,27). A ello le han seguido diferentes publicaciones, especialmente en años recientes, acerca de otros casos aislados o series cortas de pacientes (tablas 1 y 2). Ello puede explicarse tanto por una mayor concienciación sobre el tema en la época de auge de la reproducción asistida como por el hecho de que los modernos inductores de la ovulación (citrato de clomifeno y gonadotrofinas) comenzaron a generalizarse a finales de la década de los 60 y principios de los 70, con lo cual es posible que las primeras mujeres que recibieron aquellos tratamientos estén alcanzando en la actualidad la edad de máxima incidencia (50-60 años) del cáncer de ovario.
Tabla 1 Casos de cáncer epitelial de ovario en pacientes sometidas a tratamiento inductor de la ovulación o estimulación folicular ovárica | ||||||
| Autores | Edad de la paciente | Causa de la esterilidad | Tipo de tratamiento (duración) | Gestación | Cáncer de ovario (tipo, estadío) | Meses desde el primer/ último tratamiento |
| Bamford y Steele, 1982(26) | 32 | Anovulación | HMG (8 ciclos), HMG (3 ciclos) | No | Endometrioide, IIa | 40/4 |
| Atlas y Menczer, 1982(27) | 26 | Anovulación | CC (»repetidamente») | No | Seroso borderline, Ic | Varios años |
| Ben-Hur, et al., 198628) | 27 | Anovulación | CC (»repetidamente 1 año») | -- | Seroso borderline, IIIb | 12/1 |
| 22 | Anovulación | CC (3 ciclos) | -- | Seroso, IIIc | 3/1 | |
| Carter y Joyce, 1987(29) | 25 | Tubárica | CC + HMG (3 ciclos) (FIV) | No | Seroso, IIIc | 14/0 |
| Kulkarni y McGarry, 1983(30) | 34 | Anovulación | CC (3 ciclos), ciclofenilo (15 meses) | Sí | Seroso, I | 96/60 |
| Dietl, 1991(31) | 34 | Endometriosis | CC (1 año), HMG (1 ciclo) | No | Seroso, IIIb | ~ 24/4 |
| Goldberg y Runowicz, 1992(32) | 32 | ? | HMG (2 ciclos) (FIV) | Sí | Seroso borderline, Ic | 11/9 |
| 25 | ? | HMG (3 ciclos) (FIV) | Sí | Seroso borderline, Ia | 8/5 | |
| 28 | ? | HMG (2 ciclos) | Sí | Seroso borderline, Ia | 7/5 | |
| Balasch y Barri, 1993(33) | 35 | Disovulación | CC (6 ciclos) | No | Seroso borderline, IIc | 32/26 |
| Burger, et al., 1993(34) | 38 | Tubárica | HMG (1 ciclo) (FIV) | Sí | Seroso borderline, IIIa | 1/0 |
| Lopes y Mensier, 1993(35) | 39 | Tubárica | HMG (4 ciclos) (FIV) | -- | Borderline | ? |
| 36 | Desconocida | CC + HMG (2 ciclos), HMG (5 ciclos) (FIV) | -- | Indiferenciado | ? | |
| 36 | Endometriosis | CC + HMG (8 ciclos) (FIV) | -- | Borderline | ? | |
| 37 | ? | CC + HMG (? ciclos) | -- | Borderline | ? | |
| 37 | Tubárica | HMG (3 ciclos) (FIV) | -- | Endometrioide | ? | |
| 36 | Tubárica | CC + HMG (20 ciclos) (FIV) | -- | Seroso | ? | |
| 34 | Desconocida | CC + HMG (10 ciclos) (FIV) | -- | Adenocarcinoma células claras | ? | |
| 36 | Endometriosis | CC + HMG (6 ciclos) | No | Adenocarcinoma células claras | ? | |
| 35 | Desconocida | CC (1 ciclo) | -- | Endometrioide | ? | |
| 39 | Masculina | CC+HMG (8 ciclos) | -- | Endometrioide | ? | |
| 41 | Tubárica | CC+HMG (4 ciclos) (FIV) | -- | Borderlirne | ? | |
| 34 | Tubárica | HMG (4 ciclos) (FIV) | -- | Borderline | ? | |
| 34 | ? | CC + HMG (6 ciclos) | -- | Borderline | ? | |
| Karlan, et al., 1994(36) | 39 | Oligoovulación | CC (5 ciclos) | No | Seroso, IIIc | 5/0 |
| Grimbizis, et al., 1995(37) | 29 | Anovulación | CC+HMG (6 ciclos) HMG (1 ciclo) (FIV) | Sí | Seroso borderline, IIa | 14/8 |
| Salle, et al., 1997(38) | ? | Anovulación | CC (7 ciclos) | Sí | Seroso borderline, Ic | > 48/6 |
| 29 | Masculina | CC (7ciclos) | No | Mucinoso borderline, I | > 12/? | |
| Unkila-Kallio, et al., 1997(39) | 28 | Anovulación | CC (24 ciclos) | No | Seroso, IIc | 34/9 |
| 31 | Anovulación | CC (33 ciclos), HMG (3 ciclos) | Ectópico | Seroso, IIIc | 128/12 | |
| 33 | Anovulación | CC (13 ciclos) | No | Seroso, IIIc | 75/0 | |
| 38 | Tubárica | CC (3 ciclos) | Sí | Seroso, IIIc | 67/64 | |
| 38 | Tubárica | CC (2 ciclos), HMG (3 ciclos), FIV | Sí | Mucinoso, Ia | 50/44 | |
| 47 | Anovulación | CC (12 ciclos) | Sí | Seroso, IIIc | 108/84 | |
| CC = citrato de clomifeno; HMG = gonadotrofinas menopáusicas humanas; FIV = fecundación in vitro. | ||||||
Tabla 2 Casos de tumores ováricos de los cordones sexuales/estroma descritos en pacientes sometidas a tratamiento inductor de la ovulación o estimulación folicular ovárica | ||||||
| Autores | Edad de la paciente | Causa de la esterilidad | Tipo de tratamiento (duración) | Gestación | Cáncer de ovario (tipo, estadío) | Meses desde el primer/ último tratamiento |
| Lappöhn, et al., 1989(40) | 29 | Anovulación | CC (1 ciclo) | No | Células granulosa | 1/1 |
| Willemsen, et al., 1993(41) | 37 | Anovulación | CC (?), HMG (4 ciclos) | Sí | Células granulosa, Ia | 36/24 |
| 27 | Anovulación | CC (?), HMG (3 ciclos) | Sí | Células granulosa, Ia | ?/0 | |
| 30 | Anovulación | CC (?), HMG (1 ciclo) | No | Células granulosa, Ia | ? | |
| 35 | Anovulación | CC (?), HMG (4 ciclos) | No | Células granulosa, Ia | ? | |
| 30 | Anovulación | CC (?) | Sí | Células granulosa, Ia | ? | |
| 25 | Anovulación | CC (?) | Sí | Células granulosa, Ia | ? | |
| 31 | Anovulación | CC (12 ciclos), HMG (8 ciclos) | No | Células granulosa, Ia | ~24/2 | |
| 27 | Anovulación | CC (6 ciclos) | Sí | Células granulosa, Ia | ?/6 | |
| 38 | Anovulación | CC (?), HMG (5 ciclos) | No | Células granulosa, Ia | ?/60 | |
| 33 | Fase lútea corta | CC + Tamoxifeno (36 ciclos) | No | Células granulosa, Ia | ? | |
| 32 | Anovulación | CC (?), HMG (2 ciclos) | No | Células granulosa, Ia | ? | |
| 31 | Anovulación | CC (?) | No | Células granulosa, Ia | ? | |
| Unkila-Kallio, et al., 1997(39) | 29 | Anovulación | CC (1 ciclo) | Sí | Células granulosa | 8/8 |
| 32 | Anovulación | CC (8 ciclos), HMG (1 ciclo) | Sí | Células granulosa | ~72/3 | |
| CC = citrato de clomifeno; HMG = gonadotrofinas menopáusicas humanas. | ||||||
Estas publicaciones, sin embargo, no parecen apoyar una relación directa causa-efecto entre tratamiento de la esterilidad y cáncer de ovario aun cuando difieren mucho en términos del grado de información clínica presentada. El tipo de esterilidad a veces no se especifica o se hace vagamente y en casi ningún caso se incluye información sobre potenciales factores de sesgo tales como los antecedentes familiares de cáncer de ovario. En algunos casos no se especifica la dosis por ciclo o total de fármaco(s) administrada ni el lapso de tiempo exacto transcurrido desde el primer/último ciclo de tratamiento y el momento del diagnóstico.
De acuerdo con la histología, los 51 tumores descritos pueden dividirse en tres grupos: tumores de los cordones sexuales-estroma (tumores de células de la granulosa) (29,5% de casos), tumores boderline (33,5% de casos) y adenocarcinomas (37% de casos). La juventud de estas pacientes (media de edad 32 años, con tan sólo dos de ellas en la década de los 40) refleja probablemente el hecho de que la mayoría de ellas (63%) presentaban tumores de bajo potencial maligno. Estos tumores representan tan sólo el 10-15% de las neoplasias epiteliales de ovario y dado que la edad media de presentación de aquellos es alrededor de unos 10 años menos que para la neoplasia maligna(3,42), es probable que en estas pacientes se haya interrumpido, con la intervención y diagnóstico precoz, la historia natural de un cáncer que se hubiera manifestado 10 ó 15 años más tarde en forma de neoplasia diseminada32. Además, tal como indica una reciente revisión sobre el tema(43) que incluye seis estudios publicados entre 1988 y 1997, un incremento en la incidencia de tumores epiteliales borderline se relaciona con la esterilidad de la mujer, pero no con la nuliparidad, lo que sugiere que el tumor ovárico en sus fases iniciales preclínicas interfiere de alguna manera con la fertilidad, tal como ocurre con los tumores de los cordones-sexuales estroma que se comentan más abajo. Ello se ve apoyado además por los casos de gestaciones obtenidas en estas pacientes, ya de forma espontánea o médicamente asistida, tras la resección del tumor.
Globalmente, el citrato de clomifeno fue el fármaco más empleado, especialmente en las mujeres con más de seis ciclos de tratamiento, que fueron algo menos de una tercera parte. Aquel antiestrógeno se empleó solo (43% de pacientes) o asociado a las gonadotrofinas menopáusicas humanas (39% de pacientes) en el 82% de casos. Este fármaco induce la ovulación a través de un mecanismo indirecto por el que se fija a los receptores estrogénicos hipotalámicos y desencadena así la liberación de gonadotrofinas hipofisarias. Esta elevación de los niveles gonadotróficos se inicia a los 2-3 días tras el comienzo de la medicación y suele prolongarse hasta uno o dos días después de la última dosis de tratamiento, el cual dura habitualmente cinco días(44). La elevación inicial de la FSH endógena resulta crucial para conseguir la puesta en marcha de la foliculogénesis, pero una vez el desarrollo folicular se ha iniciado, éste prosigue como en el ciclo espontáneo a pesar de unos niveles de FSH en descenso. Por tanto, el incremento de los niveles de gonadotrofinas es tan sólo transitorio y aun cuando muchos de los casos publicados datan de la época en que no estaba generalizada la monitorización de la inducción de la ovulación por ecografía, se puede asumir que la mayoría de ciclos eran monofoliculares o al menos no iban asociados al desarrollo folicular múltiple que caracteriza los ciclos de fecundación asistida. Por otra parte, en los ciclos inducidos con clomifeno los niveles de estradiol habitualmente aumentan gradualmente como reflejo de la maduración folicular hasta niveles similares a los observados en el ciclo espontáneo(45).
De las diez pacientes en las que se puede deducir que recibieron 12 o más ciclos de tratamiento con clomifeno, ocho presentaron un carcinoma epitelial invasivo y dos un tumor de células de la granulosa. Sin embargo, en siete de estas pacientes y en el 57% de los 51 casos incluidos en las tablas 1 y 2, la indicación de la administración de los fármacos inductores de la ovulación era un trastorno ovulatorio, esencialmente la oligoamenorrea por anovulación. Por tanto, teniendo en cuenta que el citrato de clomifeno carece de acción carcinogénica directa(46) y que los ciclos inducidos con el fármaco son mono u oligofoliculares, que la ovulación se consigue en alrededor del 80% de ciclos de tratamiento y que la mayoría de mujeres tratadas eran anovuladoras, resulta difícil poder atribuir un efecto causal del fármaco sobre el desarrollo de la neoplasia, ya sea de forma directa o indirectamente a través del supuesto microtrauma epitelial de acuerdo con la teoría de la ovulación incesante.
De las 31 mujeres que fueron tratadas con gonadotrofinas menopáusicas humanas, 24 recibieron tan sólo seis ciclos o menos de tratamiento, siete fueron tratadas con este fármaco entre siete y 12 ciclos y en una paciente se repitió la terapéutica en 20 ciclos. Ello representa un período muy corto de exposición al fármaco en unas mujeres en las que, además, el diagnóstico de la tumoración se ha realizado en general durante el tratamiento inductor de la ovulación o poco tiempo después del mismo (corto período de latencia). En este sentido es importante destacar que aun cuando se ha postulado un papel de la hipergonadotrofinemia en la etiología del cáncer de ovario(16), los estudios epidemiológicos indican que el pico en la incidencia del cáncer de ovario en la menopausia se produce unos 15-20 años después del pico en las concentraciones de gonadotrofinas propias de esta época de la vida de la mujer(15,16,42,47). Por tanto, la duración de la exposición, la propia naturaleza del fármaco y los niveles fisiológicos séricos alcanzados no coinciden con el perfil de una sustancia potencialmente carcinogénetica. Por otra parte, diferentes estudios han demostrado que los tumores epiteliales de ovario carecen de receptores para las gonadotrofinas y son por tanto insensibles a estas hormonas(48-51) y no existen estudios que demuestren que las mujeres nulíparas presenten unos niveles de gonadotrofinas más elevados que los de las mujeres multíparas de su misma edad.
Estudios en animales indican que la exposición continuada a niveles altos de gonadotrofinas pueden jugar un papel en la producción del cáncer de ovario, pero los tumores son de origen estromal, un tipo de neoplasia que ni es muy frecuente ni de elevada malignidad en el hombre(52,53) pero en la que existen receptores para la FSH al igual que en el tejido ovárico normal(48,50). El artículo más interesante respecto a este grupo tumoral y que ha sido ampliamente discutido en la literatura es el de Willemsen et al.(41) que incluye 12 casos de tumores de células de la granulosa diagnosticados tras la estimulación ovárica con clomifeno y/o gonadotrofinas (tabla 2). A éstos se pueden añadir al menos tres casos más descritos por otros autores y que se indican en la misma tabla.
Los tumores de las células de la granulosa pueden manifestarse clínicamente en forma de alteraciones del ciclo y anovulación debido a su elevada producción de estrógenos y llevar, por tanto, al tratamiento con inductores de la ovulación. Todas las pacientes incluidas en la tabla 2 presentaban una esterilidad de causa ovárica asociada a trastornos del ciclo antes de la inducción de la ovulación. Al menos once de las quince pacientes presentaron la regularización de sus ciclos menstruales tras la extirpación del tumor correspondiente y al menos siete de ellas quedaron gestantes espontáneamente (una de las pacientes en tres ocasiones sucesivas). Por todo ello es de suponer la existencia de estos tumores previas al tratamiento inductor de la ovulación siendo en realidad la masa tumoral la responsable de la disfunción ovulatoria que obligó al tratamiento. Aun cuando en las publicaciones no se especifica con exactitud para cada paciente individual, se puede deducir que el período de latencia entre la primera administración del fármaco y el diagnóstico de la tumoración fue en general inferior a los 24 meses y en varias pacientes incluso inferior al año, por todo lo cual resulta harto difícil imputar un papel directo al tratamiento inductor de la ovulación en la génesis de estos tumores.
En conclusión, tal como se apuntó antes, debe tenerse en cuenta que los casos aislados o series cortas de casos que se publican proporcionan información de tipo clínico pero no estrictamente científico y su aparición en la literatura tiende a crear falsas impresiones, pudiendo causar una inseguridad y ansiedad innecesarias tanto a médicos como pacientes. Así, de los 66 casos de tumores ováricos recogidos en la tablas 1 y 2, tan sólo 16 (24%) fueron publicados antes de la aparición en la literatura del artículo de Whittemore et al.(18) mencionado más arriba y que fue el que despertó el interés y la controversia actuales sobre el tema. Por otra parte, seis de los 15 casos no publicados pero informados a la Food and Drug Administration (FDA) americana habían sido diagnosticados hasta casi cuatro años antes, pero sólo fueron remitidos a dicha agencia tras la publicación del artículo de Whittemore et al.(18). Esto indica la posibilidad tanto de que la publicidad acerca de un problema médico determinado promueva la presentación de casos (ya sean nuevos o antiguos) en la literatura y con ello una tendencia a la hipertrofia del problema (sesgos de publicación)(54), como el hecho de que otros casos no salgan a la luz y minimicen la situación. Además, en estas publicaciones retrospectivas siempre existen sesgos en cuanto a la capacidad de la paciente para recordar terapéuticas que recibió en épocas pretéritas o en cuanto a si la tumoración existía ya o no antes del tratamiento con inductores de la ovulación.
Si la estimulación folicular fuera realmente un factor predisponente al cáncer de ovario, el marcado incremento de uso y la amplia difusión que han tenido los inductores de la ovulación a nivel mundial a lo largo del último cuarto de siglo tendría que haberse asociado a un mayor número de casos de la enfermedad. Ni los informes americanos de la FDA(55,56) o del National Institutes of Health (NIH)(57), ni un estudio multicéntrico francés incluyendo 116 centros de fecundación in vitro(58), apoyan aquel postulado, ya sea en relación a la práctica de esta técnica de reproducción asistida o en cuanto a la inducción de la ovulación en conjunto.
Así, por ejemplo, la FDA estimaba en 1993 que hasta aquel año se habían prescrito tan sólo en los Estados Unidos más de 13 millones de ciclos de tratamiento con inductores de la ovulación desde la comercialización de estos fármacos en aquel país y hasta el 31 de diciembre de 1994 sólo se habían comunicado a dicha agencia 15 casos de tumores ováricos (nueve neoplasias epiteliales malignas, dos tumores epiteliales borderline, un tumor de las células de la granulosa maligno, un teratoma inmaduro metastásico y dos casos benignos o de malignidad desconocida) en pacientes sometidas a inducción de la ovulación y que habría que añadir a los casos publicados (tablas 1 y 2).
El estudio «Health Surveillance of Women Treated for Infertility by in Vitro Fertilization» esponsorizado por el NIH no había registrado hasta 1993 ningún caso de cáncer de ovario entre más de 3.000 mujeres. Lopes et al.(58) recogieron información de 53 centros franceses en los que se habían practicado casi 17.000 ciclos de fecundación in vitro y de 32 centros en los que se habían realizado unos 9.000 ciclos de inducción de la ovulación y sólo se registraron 12 neoplasias de ovario.
Finalmente, un estudio epidemiológico muy reciente realizado en Finlandia, país caracterizado por una población homogénea, un eficaz sistema sanitario universal y gratuito y con un registro de cáncer a nivel nacional, demuestra una clara disminución en la incidencia de tumores de células de la granulosa concomitantemente con el incremento de uso de los fármacos inductores de la ovulación(59).
Por tanto, los hallazgos de estos casos clínicos publicados reflejarían en realidad unas mayores posibilidades de detectar tumores de ovario en pacientes sometidas a repetidos estudios y valoraciones de sus gónadas por su esterilidad más que un efecto del empleo de los inductores de la ovulación sobre el riesgo de cáncer de ovario. Sin embargo, en ausencia de grupos comparativos apropiados, los estudios descriptivos no permiten plantear la posible relación directa entre esterilidad y riesgo de cáncer de ovario pero pueden resultar útiles para generar hipótesis con fines a nuevas y más precisas investigaciones.
Inducción de la ovulación y cáncer de ovario: estudios analíticos
En la tabla 3 se resumen 17 estudios, seis de cohortes y 11 de casos-control, sobre riesgo de cáncer de ovario en pacientes tratadas farmacológicamente por su esterilidad. En la mayoría de aquéllos se especifica el tipo de terapéutica recibida por las pacientes, en general inducción/estimulación de la ovulación con citrato de clomifeno y/o gonadotrofinas, pero en otros se aplica simplemente el término de «fertility drugs» al que nos hemos referido más arriba (indicado en la tabla 3 con una interrogante). En dicha tabla se exponen los estudios, no cronológicamente, sino de acuerdo con las necesidades expositivas para facilitar la lectura y comprensión del texto. Las estimaciones se dan para todos los estudios en forma de riesgo relativo (RR) con el intervalo de confianza del 95% (IC 95%) correspondiente siempre que fue posible, considerándose como no significativo cualquier resultado que en su IC incluya la unidad.
Tabla 3 Resumen de los estudios sobre riesgo de cáncer de ovario en pacientes tratadas farmacológicamente por su esterilidad | ||||
| Estudio, año | Diseño | Nº de pacientes | Grupos comparados | RR (IC 95%) |
| Ron, et al., 1987(60) | Cohorte | 2.575 | Estériles tratadas (CC, HMG) vs. población general | 2,1 (N.S.) |
| Estériles tratadas (CC, HMG) vs. no tratadas | N.S. | |||
| Modan, et al., 1998(61) | Cohorte | 2.496 | Estériles tratadas (CC; CC + HMG; HMG) vs. población general | 0,83 (N.S.) |
| Estériles tratadas (CC; CC + HMG; HMG) vs. no tratadas | 0,95 (0,54-1,68) | |||
| Potashnik, et al., 1999(62) | Cohorte | 1.197 | Estériles tratadas (CC; CC + HMG; HMG) vs. población general | 0,75 (N.S.) |
| Estériles tratadas (CC; CC + HMG; HMG) vs. no tratadas | 0,77 (0,19-3,07) | |||
| Rossing, et al., 1994(63) | Cohorte- casos | 3.837 | *Estériles tratadas (CC) vs. población general | 3,1 (1,4-5,9) |
| *Estériles tratadas (CC, HMG) vs. no tratadas | 2,3 (0,5-11,4) | |||
| --1-11 meses de tratamiento | 0,8 (0,1-5,7) | |||
| -->= 12 meses de tratamiento | 11,1 (1,5-82) | |||
| Venn, et al., 1995(64) | Cohorte (FIV) | 10.358 | Estériles tratadas (CC + HMG; HMG) vs. población general | 1,7 (0,6-5,3) |
| Estériles tratadas (CC + HMG; HMG) vs. no tratadas | 1,5 (0,3-7,6) | |||
| Venn, et al., 1999(65) | Cohorte (FIV) | 29.700 | Estériles tratadas (CC + HMG; HMG) vs. población general | 0,91 (0,7-1,13) |
| Estériles tratadas (CC + HMG; HMG) vs. no tratadas | N.S. | |||
| Whittemore, et al., 1992(18) | Casos- control | 622/1101 (Ca. invasivo) | Estériles tratadas (?) vs. población general: *ca. invasivo | 2,8 (1,3-6.1) |
| --nuligrávidas | 27 (2,3-315) | |||
| --grávidas | 1,4 (0,5-3,6) | |||
| Estériles tratadas vs. no tratadas | P significativa | |||
| Harris, et al., 1992(66) | Casos- control | 88/752 | Estériles tratadas (?) vs. población general: | 4,0 (1,1-13,9) |
| (borderline) | Estériles tratadas (?) vs. no tratadas | N.S. | ||
| Shu, et al., 1989(67) | Casos- control | 229/229 | Estériles tratadas (?) vs. población general | 2,1 (0,2-22.7) |
| Horn-Ross, et al., 1992(68) | Casos- control | 18/1.142 (tumores células germinales) 45/2.617 (tumores del estroma) | Estériles tratadas (?) vs. población general | 13,4 (0,9-191) |
| Franceschi, et al., 1994(69) | Casos- control | 195/1.339 | Estériles tratadas (?) vs. controles hospitalarios | 0,7 (0,16-3,30) |
| (ca. invasivo) | Estériles tratadas (?) vs. no tratadas | 1,3 (0,7-2,4) | ||
| La Vechia, et al., 1995(70) | Casos- control | 208/873 (ca. invasivo) | Estériles tratadas (?) vs. controles hospitalarios | 1,1 (0,4-3,6) |
| Parazzini, et al., 1997(71) | Casos- control | 971/2.758 | Estériles tratadas (?) vs. controles hospitalarios | 1,1 (0,4-3,3) |
| (ca. invasivo) | Estériles tratadas (?) vs. no tratadas | 0,5 (0,1-3,6) | ||
| Parazzini, et al., 1998(72) | Casos- control | 93/273 (borderline) | Estériles tratadas (?) vs. controles hospitalarios | P = 0.004 |
| Shushan, et al., 1996(73) | Casos- control | 200/408 | Estériles tratadas (CC; CC + HMG; HMG) vs. población general: | 1,31 (0,63-2,74) |
| *borderline | 3,52 (1,23-10,1) | |||
| *ca. invasivo | N.S. | |||
| *CC >= 12 ciclos | 1,44 (0,34-5,82) | |||
| *HMG | 3,19 (0,86-11.82) | |||
| --borderline | 9,38 (1,7-52,0) | |||
| Mosgaard, et al., 1997(74) | Casos- control | 684/1.721 (ca. invasivo) | Estériles nulíparas tratadas (CC, HMG) vs. población general (nulíparas) | 2,26 (0,92-5,58) |
| Estériles secundarias tratadas (CC, HMG) vs. población general (hijos previos) | 0,73 (0,29-0,82) | |||
| Estériles nulíparas tratadas (CC, HMG) vs. no tratadas | 0,83 (0,35-2,01) | |||
| Estériles secundarias tratadas (CC, HMG) vs. no tratadas | 0,56 (0,24-1,29) | |||
| Mosgaard, et al., 1998 (75) | Casos- control | 231/1721 (borderline) | Estériles nulíparas tratadas (CC, HMG) vs. población general (nulíparas) | 2,88 (0,95-8,74) |
| Estériles secundarias tratadas (CC, HMG) vs. población general (hijos previos) | 1,11 (0,37-3,30) | |||
| Estériles nulíparas tratadas (CC, HMG) vs. no tratadas | 1,50 (0,51-4,39) | |||
| Estériles secundarias tratadas (CC, HMG) vs. no tratadas | 1,46 (0,56-3,81) | |||
| RR = riesgo relativo; IC = intervalo de confianza; CC = citrato de clomifeno; HMG = gonadotrofinas menopáusicas humanas; N.S. = no significativo; FIV = fecundación in vitro; ? = tratamiento no especificado. | ||||
Estudios de cohortes. En un estudio de cohortes en Israel, Ron et al.(60) observaron cuatro casos de cáncer de ovario entre un total de 2.575 mujeres tratadas por esterilidad primaria o secundaria entre los años 1964 y 1974 y seguidas durante 12,3 años de media. El número de casos esperados de acuerdo con el Registro Nacional del Cáncer en Israel era de 1,9, lo que supone un incremento no significativo del riesgo (RR = 2,1) entre las estériles tratadas. El riesgo de cáncer asociado al uso de citrato de clomifeno o de HMG fue similar al riesgo observado en pacientes estériles que recibieron otros tratamientos hormonales o que no fueron tratadas con hormonas. Uno de los aspectos positivos de este estudio es la existencia de un seguimiento casi completo, ya que ello se consiguió en el 96% de casos y sus controles correspondientes del registro de población. Los datos del registro y de las historias clínicas fueron la fuente de la información relativa a los datos de diagnóstico y tratamiento, por lo que se descartan así posibles sesgos debidos a inexactitudes cuando la información la proporciona retrospectivamente la paciente. Este estudio incluía además información sobre importantes factores de riesgo tales como la paridad y el uso de contraceptivos orales. Sin embargo, dado que se trataba de una cohorte de mujeres jóvenes (media de edad al final del seguimiento, 41 años), el estudio tenía la limitación del escaso número de casos observados además de no proporcionar información detallada acerca de los diferentes tipos de tratamiento hormonal y sus estimaciones de riesgo correspondientes.
Las limitaciones del estudio de Ron et al.(60) se soslayan en gran parte en una publicación reciente del mismo grupo de investigadores(61) en la que se actualizan los datos de la cohorte de pacientes (media de seguimiento ahora de 21,4 años y media de edad de las pacientes al final del seguimiento 50 años). Tal como señalan los autores(61), las pacientes de la cohorte están alcanzando en el momento del estudio la edad natural para el desarrollo del cáncer y el mayor número de casos permite un análisis más detallado, incluyendo el efecto de los fármacos inductores de la ovulación. El tratamiento con citrato de clomifeno y/o HMG no se asoció en esta cohorte de 2.496 mujeres a incremento del riesgo de cáncer de ovario (tabla 3).
Otro estudio israelí, aún más reciente(62), que utiliza el mismo registro nacional de tumores que los dos estudios anteriores pero en el que la cohorte de 1.197 pacientes estériles procede de otro hospital, coincide también en señalar la no asociación entre el uso de inductores de la ovulación y un incremento del riesgo de cáncer de ovario. Estas pacientes habían consultado por esterilidad entre los años 1960 y 1984, siendo la media de edad al final del seguimiento de 44 años. Esto implica que no todas las mujeres habían alcanzado el período de la vida de mayor riesgo para desarrollar este tipo de cáncer. Otra limitación del estudio es el de carecer de datos sobre la historia familiar de cáncer y sobre el uso de contracepción hormonal oral. Entre los aspectos positivos del estudio hay que destacar el largo período de latencia para analizar el potencial efecto nocivo de los fármacos empleados en el tratamiento de la esterilidad; la exactitud de los datos en relación al diagnóstico de la causa de esterilidad, así como del número de ciclos de tratamiento y dosis de los fármacos utilizados que se obtuvieron exclusivamente de las historias clínicas de las pacientes, y la verificación de los diagnósticos de cáncer mediante la revisión de los informes histopatológicos originales de todos los casos de cáncer.
En 1994, Rossing et al.(63) publicaron los resultados de un estudio de cohorte-casos de cáncer en mujeres que habían sido estudiadas por esterilidad en las clínicas del estado de Washington. Un estudio de este tipo es un estudio de cohortes que incluye un análisis más detallado de datos para una sub-cohorte que comprende los individuos que presentan el problema en cuestión (en este caso el cáncer de ovario) y una muestra de individuos no afectos por el problema. Este tipo de diseño hace que el estudio tenga muchas de las ventajas tanto de los estudios de cohortes como de casos-control. La cohorte incluía 3.837 mujeres que habían intentado quedar gestantes durante al menos un año y que habían realizado al menos dos visitas a clínicas de esterilidad durante los años 1974 y 1985. Dichas mujeres fueron seguidas durante 11,3 años de media. Los casos de cáncer se compararon con la población general del área geográfica del estudio, así como también con un grupo control de 135 mujeres sin cáncer seleccionadas aleatoriamente de la cohorte. Se detectaron 11 cánceres de ovario en la cohorte: cuatro epiteliales invasivos y cinco borderline, y dos tumores de las células de la granulosa. En comparación con el número de casos esperados en la población general, el riesgo relativo de cáncer de ovario (incluyendo los tumores borderline) entre las pacientes estériles resultó ser de 2,5 (IC 95%, 1,3-4,5) y el de cáncer invasivo de 1,5 (IC 95%, 0,4-3,7). Por tanto, el empleo «alguna vez» de citrato de clomifemo supuso un incremento de riesgo relativo de hasta 3,1 veces en comparación con la población general (tabla 3), pero a expensas de los tumores borderline, no del cáncer invasivo. El riesgo relativo era aún mayor (3,7, IC 95% 1,4-8,1) en las mujeres estériles anovuladoras en comparación con las pacientes con otras causas de esterilidad independientemente del tratamiento recibido.
Rossing et al.(63) compararon la exposición a tratamientos inductores de la ovulación en las 11 mujeres con cáncer de ovario y en la subcohorte de 135 casos tomados al azar lo que permitió una estimación de los riesgos relativos corregidos para la edad y año de inclusión en el estudio y para la paridad y causa de esterilidad. El riesgo de cáncer de ovario no se incrementó con el uso de gonadotrofinas pero sí con el empleo de clomifeno. El empleo de este antiestrógeno entre las mujeres estériles no produjo un incremento significativo global del riesgo de cáncer de ovario (2,3, 95% IC 0,5-11,4), pero sí cuando se consideró el uso prolongado (12 meses o más de tratamiento) de este fármaco (RR = 11,1, IC 95% 1,5-82) (tabla 3). A destacar que esto se cumplía tanto para pacientes nulíparas como multíparas y tanto para pacientes con trastornos ovulatorios (RR = 7,4, IC 95% 1-53) como sin ellos (RR = 9,1, IC 95% 1-86).
Sin embargo, resulta sorprendente que el incremento de RR asociado a 12 meses o más de uso del clomifeno resultara más elevado para las mujeres con hijos previos (RR = 17, IC 95% 1,2-243) que para las estériles nuligrávidas (RR = 10,8, IC 95% 1,5-80). Por otra parte, si hubiera un efecto carcinogenético directo, sería de esperar una relación dosis-dependiente y no una asociación que se expresa únicamente tras 12 ciclos de terapéutica. Quizás ello pueda explicarse por el escaso número de efectivos en este sentido, ya que sólo cinco mujeres fueron tratadas durante 12 o más ciclos y éstas pueden representar un subgrupo de pacientes con disfunción ovárica especialmente refractaria al tratamiento y que las hace más susceptibles de per se a padecer una neoplasia. Además, el uso de gonadotrofina coriónica humana (HCG), que con frecuencia se asocia al citrato de clomifeno para la la inducción de la ovulación, no implicó ningún incremento en el riesgo de cáncer de ovario (RR = 1, IC 95% 0,2-4,3) en el estudio de Rossing et al.(63).
Entre los aspectos destacables de este trabajo, que ha sido ampliamente discutido en la literatura, están la información exacta acerca de las causas de esterilidad, así como de los fármacos usados y del número de ciclos que se administraron, datos que se obtuvieron directamente de las historias clínicas con desconocimiento para el investigador de si la paciente había sido diagnosticada o no de cáncer. Con todo, hay que destacar también diferentes limitaciones del estudio que se suman a las comentadas antes. En primer lugar, posibles variables de confusión como el uso previo de anticonceptivos orales o la historia familiar de cáncer de ovario no se contemplan en el estudio. En segundo lugar, los resultados se basan en un pequeño número de tumores, de los cuales la mitad eran del tipo borderline y representan por tanto un porcentaje excesivamente alto dentro de la serie. En el análisis intra-cohorte se agruparon conjuntamente todos los tipos de tumores y los riesgos asociados al uso de clomifeno no se calcularon separadamente para los tumores invasivos y borderline. Idealmente, en un estudio de este tipo ambos tipos tumorales deberían analizarse por separado ya que difieren en términos de edad de presentación, historia natural y pronóstico. Además, aun cuando puedan compartir algunos factores de riesgo, es posible que existan diferencias etiológicas entre los tumores de bajo potencial de malignidad y los cánceres invasivos.
Por otra parte, la inclusión de los tumores de células de la granulosa junto con las neoplasias epiteliales para la evaluación de los resultados en el estudio de Rossing et al.(63), fue criticada en la literatura dadas las diferentes características embriológicas, histopatológicas y epidemiológicas de ambos tipos tumorales(76). Rossing et al.(77) respondieron a estas críticas suprimiendo a las pacientes con tumores de células de la granulosa para el re-análisis de sus resultados, con lo cual el RR de cáncer de ovario asociado a 12 ó más ciclos de tratamiento con clomifeno seguía manteniéndose elevado, pero descendiendo casi a la mitad (RR = 6,7) y con unos intervalos de confianza que incluían la unidad (IC 95%, 0,8-59). El amplio margen de los IC tanto en el estudio original como en este re-análisis de los datos, refleja la incertidumbre acerca de esta estimación del efecto de los ciclos de tratamiento repetidos. Además, otros autores sugirieron que el elevado número de tumores borderline detectados en esta cohorte de mujeres y la elevada proporción de los mismos en relación a los cánceres invasivos podía ser el resultado de un sesgo de detección por los controles ecográficos repetidos a que son sometidas este tipo de pacientes(78), hecho al que ya hemos hecho referencia anteriormente. En contra de este postulado, sin embargo, los autores(63) argumentan que el intervalo de tiempo transcurrido entre la inclusión en la cohorte y el diagnóstico del tumor fue relativamente largo (6,9 años de media), lo que sugeriría que el incremento de riesgo observado no fue debido al diagnóstico de tumores preexistentes y causantes de la esterilidad de la mujer. Por otra parte, el hecho de que el incremento de riesgo se diera tanto en mujeres con disfunción ovulatoria como sin ella, sugeriría también que la asociación podía no ser debida simplemente a un trastorno ovárico responsable tanto de la esterilidad como del tratamiento con clomifeno. Sin embargo, el 54% de las pacientes tenían una disfunción ovulatoria.
Hasta el momento, el estudio de cohortes con un mayor número de pacientes es el publicado por Venn et al. en 1995(64) y que muy recientemente ha sido actualizado(65). Este estudio va dirigido a determinar la incidencia de cáncer en una cohorte de mujeres australianas que habían sido sometidas a fecundación in vitro. En la publicación original del año 1995 se incluían 10.358 pacientes que se compararon tanto con mujeres de la misma edad de la población general como con pacientes del programa de fecundación in vitro que no habían recibido fármacos estimulantes de la ovulación (citratro de clomifeno asociado a las HMG o HMG solas) (tabla 3). Este último grupo estaba constituido por las pacientes estériles que habían sido remitidas al programa de fecundación asistida pero que eligieron no continuar debido a una serie de razones tales como problemas económicos, gestación espontánea ocurrida antes de ser incluidas, no aceptación de los potenciales riesgos asociados a la técnica o problemas de pareja. Fueron tratadas con inductores de la ovulación 5.564 pacientes, de las que un porcentaje relativamente bajo tenían trastornos ovulatorios (6,2%), mientras que el grupo de estériles control lo constituían otras 4.794 mujeres. Se detectaron tres casos de tumores ováricos malignos en cada grupo. En comparación con la población general (incidencia esperada de 1,85 casos), los RR en los grupos de pacientes estériles tratadas y no tratadas resultaron ser de 1,7 (IC 95% 0,6-5,3) y de 1,6 (IC 95% 0,5-5,0), respectivamente (P no significativa en ambos casos). Para todas las pacientes de fecundación in vitro en conjunto el RR resultó ser de 1,66 (IC 95% 0,75-3,7) y sin que se apreciaran diferencias al comparar las estériles tratadas versus las no tratadas (tabla 3). Sin embargo, al examinar la relación entre las causas de esterilidad y el riesgo de cáncer se observó un incremento significativo de casos de cáncer de ovario en las mujeres con esterilidad de causa desconocida, pero independientemente de que hubieran sido sometidas a fecundación in vitro o no, en comparación con lo esperado en la población general femenina de la misma edad (RR = 6,98, IC 95% 2,9-16,8)(64).
Aun cuando se trata de la cohorte con un mayor número de casos, el estudio de Venn et al.(64) tiene algunas limitaciones. 1) El número de casos de cáncer de ovario es reducido. 2) El período de seguimiento tras la exposición al tratamiento es relativamente corto, con tan sólo un 51% de las mujeres expuestas al tratamiento seguidas durante al menos cinco años. 3) No se analiza específicamente el tipo de fármaco administrado, señalándose únicamente la «exposición» como «tratamiento de fecundación in vitro». 4) El número de ciclos de fecundación in vitro por paciente era relativamente bajo (media de 2 ciclos, rango de 1 a 22), habiendo recibido el 77% de las pacientes 3 ciclos o menos de tratamiento, lo que limita la posibilidad de analizar un efecto dosis-respuesta. 5) Las mujeres que habían iniciado, pero no completado, un ciclo de estimulación ovárica para fecundación in vitro fueron incluidas en el grupo «tratado o expuesto a los fármacos». 6) No se proporciona información acerca de variables de confusión relacionadas con la historia reproductiva (paridad, toma de contraceptivos orales, etc.). 7) Las mujeres estériles del grupo «no tratado» tendían a haber sido remitidas al programa de fecundación in vitro en los primeros años del mismo, por lo que en este grupo son más probables los casos con pérdida de seguimiento, los fallos de identificación de los casos de cáncer, una mayor inexactitud de los datos en las historias clínicas y posiblemente también un mayor número de cambios de nombre por separaciones de la pareja.
Estas potenciales limitaciones llevaron a los autores a desarrollar un estudio más importante, conocido como «Australian Multicenter Study of Cancer after Infertility and In Vitro Fertilization», en el que colaboran muchas de las clínicas australianas de fecundación asistida(65). El objetivo de este importante estudio multicéntrico que implica el seguimiento de una cohorte de 29.700 pacientes de fecundación in vitro es determinar la incidencia de cáncer de ovario, mama y útero en este tipo de pacientes y analizar si la causa de la esterilidad o la exposición a los fármacos inductores de la ovulación se asocian o no a un incremento del riesgo de cáncer. El estudio pretende establecer también si el uso reciente de estos fármacos de asocia o no a un incremento en la incidencia de cáncer, lo que sugeriría un efecto promotor de las drogas sobre el desarrollo del tumor, o si la detección de cánceres preexistentes está incrementada en mujeres que están sometidas a exploraciones repetidas como parte del diagnóstico y tratamiento de su esterilidad. Según los autores(65), la mejor manera de analizar estos dos objetivos es el seguimiento a corto y medio plazo de una gran cohorte de pacientes.
El estudio ha sido diseñado en dos fases. En la primera fase se emplearon registros de cáncer en la población general para establecer las comparaciones pertinentes con la incidencia de cáncer observada en la cohorte de fecundación in vitro de acuerdo con cada grupo de edad. La segunda fase del estudio fue diseñada en forma de «nested case-control study» («estudios de modelos anidados»), en los que se hace una estratificación por «clusters» o grupos de variables (en este caso factores de riesgo), lo que permite tener en cuenta la interrelación de una variable con otra para reducir los sesgos por diferencias interindividuales en el análisis. Esta segunda fase, que todavía no se ha completado, se lleva a cabo revisando las historias clínicas y mediante cuestionarios enviados por correo para recoger información detallada acerca del tiempo de exposición a los fármacos inductores de la ovulación y de otros factores de riesgo de cáncer que no constan normalmente en las historias clínicas. El estudio incluye a todas las mujeres con cáncer de ovario, mama y útero y un grupo control seleccionado aleatoriamente de pacientes de fecundación in vitro sin cáncer (más de 700 mujeres en total). Hasta ahora, sólo se han presentado los datos referentes a la cohorte(65).
El estudio de cohorte renovado(65) que incluye las 10.358 pacientes del estudio inicial(64) seguidas ahora durante un período de tiempo más prolongado, implica a diez clínicas de fecundación in vitro, cada una de las cuales dispone de datos computadorizados para las mujeres incluidas en el programa antes del 1 de enero de 1994. Las 29.700 mujeres de la cohorte fueron distribuidas en dos grupos, tratadas y no tratadas, según hubieran sido sometidas o no a ciclos de fecundación in vitro con estimulación ovárica para inducir una foliculogénesis múltiple. Los fármacos empleados fueron el clomifeno solo o asociado a las HMG o las HMG solas. El número de ciclos de tratamiento osciló entre 1 y 29, pero sólo el 2% de las pacientes tenían 10 o más ciclos y la mayoría de ellas (71%) entre 1 y 3. La media de edad al entrar en el estudio era de 31 años y al final del período de seguimiento de 40 años.
Los resultados de esta gran cohorte de pacientes resultan muy tranquilizadores, ya que en comparación con la población general, la incidencia global de cáncer de ovario no fue superior a la esperada (tabla 3). Los resultados disponibles hasta el momento confirman los del estudio previo de los autores(64) incluyendo también la ausencia de relación dosis-respuesta, ya que para ninguno de los tres grupos de exposición considerados (1, 2, 3-5 ó >= 6 ciclos de tratamiento) se observó asociación con el incremento de riesgo de cáncer de ovario. Al igual que en el estudio anterior, sin embargo el riesgo de cáncer de ovario resultó significativamente elevado (RR = 2,64, IC 95% 1,10-6,35) en las mujeres con esterilidad de causa desconocida. Esto se cumplía independientemente de que las pacientes hubieran sido sometidas o no a estimulación folicular para fecundación in vitro(65), lo que sugiere de nuevo la presencia de subgrupos de alto riesgo entre la población de estériles. La potencial influencia sobre los riesgos relativos estimados de otros factores de riesgo para cáncer tales como paridad, edad al tener el primer hijo, uso previo de contraceptivos orales, edad de la menarquia, historia familiar de cáncer de ovario, nivel socioeconómico e índice de masa corporal, se presentarán en el futuro cuando se dispongan de los resultados del estudio de «modelos anidados». Asimismo, se prosigue el seguimiento de la cohorte hasta que las mujeres entren en la edad de máxima incidencia del cáncer(65).
Estudios de casos-control. Tal como se mencionó más arriba, el estudió que originó esencialmente el interés y la controversia actual sobre la potencial asociación entre estimulación folicular e incremento del riesgo de cáncer de ovario fue el meta-análisis de Whittemore et al.(18) basado en los datos de 12 estudios casos-control americanos previos sobre factores de riesgo para el cáncer de ovario. Se incluían los datos de 2.197 mujeres caucásicas con cáncer de ovario y de 8.893 mujeres caucásicas control en estudios realizados entre 1956 y 1986. Tan sólo tres de los 12 estudios incluían datos acerca de la esterilidad o no de las pacientes, el empleo o no de «fármacos de la fertilidad» y su asociación al cáncer epitelial invasivo de ovario. Los resultados de Whittemore et al.(18) indicaban que si bien las mujeres nulíparas tenían un incremento de riesgo de cáncer de ovario invasivo debido a su esterilidad, el uso previo de «fármacos de la fertilidad» podía constituir un factor de riesgo aún más importante.
Los datos relativos al empleo de estos medicamentos se referían a 622 casos y 1.101 controles. Entre los primeros, 76 pacientes tenían historia de esterilidad y 20 habían utilizado «fármacos de la fertilidad». Para los controles las cifras correspondientes eran de 135 y 11, respectivamente. Esto significa que en relación con la población general de no estériles el riesgo de cáncer epitelial invasivo de ovario estaba incrementado en las mujeres tratadas con aquellos fármacos (RR = 2,8, IC 85% 1,3-6,1), cosa que no ocurría para las mujeres estériles que no habían recibido dicho tratamiento (RR = 0,91, IC 95% 0,66-1,3). El riesgo, sin embargo, era mucho mayor para las mujeres que siguieron nuligrávidas a pesar del tratamiento (RR = 27, IC 95% 2,3-315) que para mujeres que habían tenido algún hijo con el tratamiento, en las que el incremento de riesgo no resultaba estadísticamente significativo (RR = 1,4, IC 95% 0,5-3,6) (tabla 3). Los «fármacos de la fertilidad» habían sido utilizados tan sólo por 12/34 estériles nuligrávidas entre los casos frente a 1/23 estériles nuligrávidas control y de ahí los amplios intervalos de confianza. El escaso número de efectivos se repite en un artículo publicado por el mismo grupo de autores(66) conjuntamente con el de Whittemore et al.(18) y en el que en base a tan sólo cuatro casos se concluye que el uso de «fármacos de la fertilidad» se asocia a un incremento de riesgo de tumores borderline de hasta cuatro veces, siendo por ello también muy amplios los intervalos de confianza (IC 95% 1,1-13,9) (tabla 3).
En los estudios de Whittemore et al.(18) y de Harris et al.(66) se tuvieron en cuenta la edad, paridad, lactancia materna, uso previo de contracepción oral y estudio de procedencia de los datos para las estimaciones de los riesgos. Sin embargo, aun cuando los resultados resultaron estadísticamente significativos, las comparaciones combinan dos posibles factores causales: la esterilidad y el uso de «fármacos de la fertilidad», cada uno de los cuales puede afectar de forma independiente el riesgo de cáncer de ovario(79). Por tanto, lo apropiado sería la valoración del riesgo asociado al uso de aquellos fármacos dentro de la población de mujeres estériles. Un recálculo de los datos de aquellos dos estudios utilizando pacientes estériles no tratadas como grupo control reduce el RR de cáncer epitelial de ovario estimado para las estériles nuligrávidas casi a la mitad, acercando el límite inferior del intervalo de confianza a la unidad(56). El mismo reanálisis de los datos para los tumores borderline(56) hace que se pierda la significancia estadística en el estudio de Harris et al.(66). (No se proporcionan RR exactos e IC 95% para el recálculo de los datos en la tabla 3, ya que no es posible dar los valores corregidos de acuerdo con las variables reproductivas citadas antes.)
Por otra parte, el mayor riesgo para las mujeres nuligrávidas versus las que quedaron gestantes en el estudio de Whittemore et al.(18) contrasta con los resultados del estudio de Rossing et al.(63) en el que el incremento de riesgo para cáncer de ovario asociado al empleo de «fármacos de la fertilidad» se daba tanto para nuligrávidas como para grávidas tras el tratamiento. Una posible explicación a este hecho podría estar en que las mujeres con incremento de riesgo de cáncer de ovario en el estudio de Whittemore et al.(18) eran mujeres nuligrávidas con esterilidad refractaria y que fueron tratadas durante períodos de tiempo más prolongados que las mujeres que concibieron con el tratamiento. Sin embargo, frente a esto se ha argumentado que la magnitud de la diferencia en el RR para mujeres nuligrávidas y grávidas es demasiado importante para estar relacionada con el efecto protector del embarazo o con diferencias en el tipo, dosis o duración de los fármacos administrados; lo probable es que sea atribuible a diferencias en otras características de las pacientes (factores de sesgo desconocidos y relacionados con la esterilidad de la mujer)(80).
El artículo de Whittemore et al.(18) causó una importante conmoción tanto en la literatura médica como en la prensa de la calle(81,82), siendo ampliamente contestado desde el ámbito científico(33,80,83-87). Este análisis crítico del artículo ha puesto en evidencia diferentes limitaciones del mismo que se añaden a las ya discutidas y cuya existencia fueron en gran parte admitidas por la propia Whittemore(88):
1. El número de mujeres incluidas en el estudio que habían recibido los «fármacos de la fertilidad» es muy pequeño, por lo que, a pesar de ser los RR muy elevados, las estimaciones son muy imprecisas. Ya se ha comentado antes que los IC 95% alrededor de los RR son muy amplios, con límites inferiores tan bajos como el 1,3. Y así, aunque el análisis sugiere que el riesgo de cáncer invasivo epitelial de ovario entre las usuarias de aquellos fármacos podía estar aumentado hasta tres veces en relación a la población general, estos datos implican también la posibilidad de que el incremento de riesgo relativo sea tan bajo como el 30%. Asimismo, el reanálisis de los datos indica que el incremento de riesgo entre las nuligrávidas estériles tratadas podría ser tan bajo como el 40%(56).
2. En el estudio no se especifican las causas de la esterilidad, sin que se diferencie entre pacientes ovuladoras y anovuladoras.
3. No se especifican tampoco el tipo o tipos de fármacos recibidos por las pacientes (sin que se distinga entre inductores y no inductores de la ovulación ni entre los diferentes tipos del primer grupo), así como tampoco se indica la dosis ni duración de los tratamientos. El fármaco específico recibido se desconocía para 16 de los 20 casos y para ocho de los 11 controles(89). Tras obtener información de los autores de los estudios originales incluidos en el meta-análisis de Whittemore et al.(18), Shapiro(76) obtuvo una lista específica de los denominados «fármacos de la fertilidad» en el meta-análisis. Sólo una de las 20 mujeres tratadas con cáncer de ovario y una de las 11 controles habían recibido clomifeno. Para diez y cuatro mujeres, respectivamente, de dichos grupos, el preparado recibido no se especificaba y las restantes habían sido tratadas con estrógenos, dietilestilbestrol, combinaciones de estro-progestágenos, hormonas tiroideas y anfetaminas.
A efectos prácticos, por tanto, el estudio de Whittemore et al.(18) no aporta información útil alguna acerca del riesgo de cáncer asociado al uso de los fármacos empleados actualmente en la estimulación folicular ovárica. Y es que, en realidad, dada la edad de las pacientes (nacidas entre los años 1914-1950, media año 1924) la mayoría de ellas fueron tratadas por esterilidad en una época que estos fármacos modernos aún no estaban comercializados en los Estados Unidos(56,80). Además, la prevalencia del uso de «fármacos de la fertilidad» entre las pacientes estériles control (4%) parece ser mucho más bajo que lo esperado (20-30%), de acuerdo con estudios realizados en los Estados Unidos(90,91). Por otra parte, un estudio de cohorte (n = 2.335) compuesto por mujeres estudiadas por esterilidad entre los años 1935 y 1964, indica que el tratamiento con estrógenos o con progestágenos no se asocia a ningún incremento significativo del riesgo de cáncer de ovario ni cuando se compara el grupo tratado con la población general ni cuando se comparan las pacientes estériles tratadas (n = 530) con las no tratadas (n = 1805)(92).
4. No se proporciona información en el estudio acerca de los criterios aplicados para el diagnóstico del cáncer de ovario, ni constan el tamaño tumoral o el estadío en el momento del diagnóstico. Tampoco se tienen en cuenta los antecedentes familiares de cáncer de ovario.
5. Es probable la existencia de un sesgo en el sentido de que es más probable que las pacientes con cáncer recuerden con más exactitud los fármacos recibidos que las mujeres control.
6. Finalmente, existe otra posibilidad de sesgo que deriva del tipo de estudio efectuado y que es discutida por el mismo grupo de autores en un artículo(93) simultáneo al primero(18). Se trata de un meta-análisis (revisión y síntesis de datos publicados previamente por otros autores), y por ello, a pesar de las definiciones comunes empleadas para cada variable analizada y de todos los esfuerzos para asegurar la comparabilidad inter-estudio, los datos disponibles para un análisis combinado de este tipo derivan de cuestiones que se plantean de manera distinta en cada estudio individual y que por tanto pueden sugerir respuestas diferentes. La interpretación de los resultados finales se ve limitada por la posibilidad de defectos en el diseño de los estudios originales, incluyendo tanto sesgos de inclusión de los casos o de los controles como imprecisiones en la valoración de cada variable. El análisis conjunto de varios estudios que tienen el mismo tipo de sesgo puede conducir a estimaciones de RR que son estadísticamente altamente significativas pero que no son en cambio convincentes de una relación causa-efecto subyacente.
En realidad, a la vista de todo ello, los propios autores concluían que «sus datos se basaban en un número de casos muy pequeño y por tanto la existencia o no de una relación causal entre el uso de ''''fármacos de la fertilidad'''' y el cáncer de ovario sigue siendo una cuestión por contestar»(89,94). Pero, a pesar de sus limitaciones, este provocativo estudio estimuló la discusión sobre el tema y llevó al reconocimiento general de la necesidad de nuevas investigaciones en esta área. Ello se ha plasmado en la aparición de la literatura de otros estudios de casos-control que se resumen en la tabla 3, y de los cuales sólo el de Shu et al.(67) era anterior al de Whittemore et al.(18).
En el estudio de Shu et al.(67) se compararon 22 mujeres con cáncer de ovario diagnosticado de novo entre 1984 y 1986 con el mismo número de mujeres de la población general de edades similares, todas ellas residentes en Shangai, China. Las mujeres que «habían tomado hormonas para intentar quedar gestantes» tenían un incremento no significativo de riesgo de cáncer de ovario (RR = 2,1; IC 95% 0,2-22,7) en base a seis mujeres tratadas en el grupo de casos y uno en el de controles. El reducido número de efectivos y la falta de concreción de los tratamientos recibidos por las pacientes limitan el valor del estudio.
El mismo grupo de autores del artículo de Whittemore et al.(18), y en base al mismo meta-análisis, publicaron aquel mismo año un estudio de casos-control en el que se concluye que el tratamiento con «fármacos de la fertilidad» no incrementa de forma significativa el riesgo de cáncer no epitelial de ovario(68). Se basan para ello en la información disponible tan sólo en dos de los doce estudios incluidos en el meta-análisis que proporcionaron un caso (nuligrávida) con un tumor del estroma y dos mujeres control (una nuligrávida y la otra multípara) que habían sido tratadas con aquellos fármacos.
Franceschi et al.(69) publicaron un estudio de casos-control realizado en cuatro zonas de Italia. Los casos los constituían 195 mujeres ingresadas en el hospital por cáncer de ovario invasivo durante los años 1992-1993. Las 1.330 mujeres controles hospitalarios fueron seleccionadas entre las pacientes ingresadas por una serie de procesos que no incluyeran enfermedades ginecológicas, hormonales o malignas. Los datos para el estudio fueron recogidos mediante entrevista personal tanto para los casos como para los controles. No se detectó asociación entre el cáncer de ovario y el uso de «fármacos de la fertilidad»: dos casos y quince controles habían recibido alguna vez dichos fármacos para un RR = 0,73 (IC 95% 0,16-3,30) tras corrección para edad, residencia, nivel educacional, uso de anticoncepción oral y paridad. Restringiendo el análisis a las mujeres estériles, el RR para el uso de los fármacos era de 1,3 (IC 95% 0,7-2,4). Los casos eran nulíparas con más probabilidad que las controles pero el diagnóstico de esterilidad no se asoció a un incremento de riesgo de cáncer de ovario.
Datos adicionales de este estudio fueron publicados poco después(70) en base a 208 casos y 873 controles referidos a una de las cuatro regiones italianas del primer estudio. Los «fármacos de la fertilidad» habían sido empleados por cuatro de los 208 casos y por 13 de los 873 controles, arrojando una cifra de RR = 1,1 (IC 95% 0,4-3,6). Ninguna de las 34 mujeres nulíparas en el grupo de casos y tan sólo dos de las 135 nulíparas en el grupo de controles habían sido tratadas alguna vez con aquellos fármacos.
El estudio italiano no fue diseñado inicialmente para valorar la esterilidad, haciendo en cambio énfasis en los hábitos dietéticos y los niveles hormonales en relación al riesgo de cáncer de ovario. Por ello, no proporciona datos ni sobre las causas de esterilidad ni sobre los tipos específicos de fármacos utilizados. Los resultados se basaron, además, en números muy reducidos de usuarias de los fármacos.
Con el fin de analizar mejor y más específicamente la relación entre tratamiento de la esterilidad y riesgo de cáncer, el mismo grupo de autores publicó un nuevo estudio en 1997 basado en 971 casos y 2.758 controles, constituyendo así el estudio de este tipo con un mayor número de mujeres(71). Los datos fueron recogidos por entrevistas personales con confirmación en la historia clínica cuando fue necesario. Las 971 mujeres con cáncer de ovario confirmado histológicamente tenían menos de 75 años y fueron entrevistadas en el primer año tras el diagnóstico. El estudio confirma los hallazgos previos de este grupo de autores en el sentido de que el uso de los «fármacos de la fertilidad» no se asociaba a un incremento de riesgo de cáncer de ovario en comparación con el grupo control de mujeres que no había sido tratado con estos fármacos (RR = 1,1, IC 95% 0,4-3,3). No hubo tampoco diferencias cuando se consideraron las mujeres tratadas durante >= 6 ciclos y las que recibieron tratamiento menos de seis ciclos. Entre las mujeres estériles tampoco hubo diferencias entre las pacientes tratadas y las no tratadas (RR = 0,5, IC 95% 0,1-3,6). Tampoco al considerar la nuliparidad el tratamiento con aquellos fármacos implicó ningún incremento de riesgo de cáncer de ovario (RR = 0,6, IC 95% 0,1-3,5).
Sin embargo, a diferencia del estudio previo que incluía un menor número de casos(69), los autores señalan ahora que la esterilidad se asociaba a un incremento significativo de riesgo de cáncer de ovario (RR = 2,6, IC 95% 1,5-4,6). La principal limitación del estudio de Parazzini et al.(71) es su bajo poder estadístico ya que a pesar del número de pacientes incluidas, tan sólo cinco de los casos y 11 de los controles habían recibido tratamiento por su esterilidad. Con este porcentaje de uso sólo se hubieran detectado diferencias para un incremento de riesgo de unas tres veces. Sin embargo, este incremento triple del riesgo es el señalado en el controvertido estudio de Whittemore et al.(18). Otra limitación del estudio es la de carecer de información acerca del tipo de fármaco(s) utilizado. Frente a esto los autores argumentan que al no observarse ninguna asociación entre la duración de uso global de «fármacos de la fertilidad» y riesgo de cáncer de ovario, es improbable que ningún tratamiento específico esté relacionado con un incremento del riesgo.
Las publicaciones anteriores de este grupo italiano de autores se refieren al cáncer invasivo de ovario. Recientemente han publicado los datos concernientes a tumores borderline(72). Utilizan para ello de forma retrospectiva los datos de un estudio casos-control sobre factores de riesgo para los tumores borderline de ovario publicado previamente por su grupo(95) en el contexto del mismo diseño de trabajo de sus otras publicaciones. Cuatro de los 93 casos (4,3%) y ninguna de las mujeres control habían sido tratadas con «fármacos de la fertilidad», resultando así una diferencia estadísticamente significativa (P = 0,004) (tabla 3).
Aun cuando los resultados favorecerían, de acuerdo con esta sencilla exposición, la asociación entre el tratamiento de la esterilidad y el riesgo de tumor borderline de ovario, existen diferentes limitaciones al estudio. En primer lugar el número de mujeres expuestas al tratamiento es muy bajo. De hecho, los propios autores destacaban que considerando conjuntamente su estudio más dos estudios previos(63,66), sólo se habían publicado en total 11 casos de tumores borderline en mujeres que hubieran sido tratadas con «fármacos de la fertilidad». Sin embargo, a éstos habría que sumar los casos clínicos señalados en la tabla 1. En segundo lugar, se desconoce el tipo de tratamiento o fármaco que recibieron las pacientes. En tercer lugar, la prevalencia de la esterilidad en el grupo de mujeres control es muy bajo (0%), y al igual que en publicaciones previas del grupo(71) los autores destacan el limitado número de mujeres (tanto casos como controles) que recibieron tratamiento por su esterilidad. Dado que, como se ha discutido anteriormente, los tumores borderline pueden interferir con la fertilidad de la mujer, éste puede ser un importante sesgo en este estudio, en el que además no se especifican los tipos histológicos. De hecho, tres de los casos (3,2%) y ninguna de las mujeres control relataban el antecedente de esterilidad, diferencia que proporciona la misma significancia estadística (P = 0,004) que la relativa al uso de «fármacos de la fertilidad». Tampoco la potencial interacción entre paridad y uso de estos fármacos pudo ser analizada dado el pequeño número de mujeres que fueron tratadas. Finalmente, las mujeres control habían sido con más probabilidad (RR = 0,3, IC 95% 0,1-0,6) usuarias de contraceptivos orales, lo que constituye otro importante motivo de sesgo.
Otro estudio de casos-control es el llevado a cabo por Shushan et al.(73) en Israel. Los casos incluían las mujeres vivas de 36 a 64 años de edad que constaban como diagnosticadas de cáncer invasivo o tumor borderline de ovario en el registro de cáncer de Israel. Los controles de la población femenina general fueron seleccionados aleatoriamente con equivalencia de edad y área de residencia. Las mujeres con ooforectomía bilateral fueron excluidas entre los controles. De todos los casos de cáncer de ovario que constaban en el registro, el 25% de las mujeres habían fallecido y el 30% de las que seguían vivas o no podían participar en el estudio o se les había perdido la pista.
Se recogieron, a través de entrevistas personales, los datos correspondientes a 200 casos de cáncer de ovario (164 invasivos y 36 borderline) y a 480 controles de la población general seleccionadas aleatoriamente en el mismo distrito de población que los casos. La prevalencia de uso de los «fármacos de la fertilidad» fue superior que en el estudio de casos-control italiano descrito antes: 22 casos y 24 controles habían sido tratadas con citrato de clomifeno solo o asociado a las HMG. En comparación con las mujeres de la población general, las mujeres estériles que habían sido tratadas no tenían un incremento significativo de riesgo de cáncer de ovario (invasivo y borderline conjuntamente) (RR = 1,3, IC 95% 0,63-2,74) (tabla 3) tras corrección para la edad, paridad, índice de masa corporal, lugar de nacimiento, nivel educacional e historia familiar de cáncer de ovario. Sin embargo, la asociación resultó significativa si sólo se consideraban los tumores borderline (RR corregido = 3,52, IC 95% 1,23-10,1). De acuerdo con el tipo de fármaco utilizado, la exposición a las HMG tenía el máximo efecto, pero la asociación no era estadísticamente significativa (RR = 3,19, IC 95% 0,86-11.82) a no ser que se considerasen de nuevo tan sólo los tumores borderline (RR corregido = 9,38, IC 95% 1,7-52). A diferencia del estudio de Rossing et al. (1994), la exposición a doce o más ciclos de clomifeno no se asoció a un incremento significativo de riesgo de cáncer de ovario (RR = 1,44, IC 95% 0,34-5,82).
La discrepancia entre el estudio de Rossing et al.(63) que detectaron un incremento del riesgo de tumores ováricos sólo tras la estimulación prolongada con clomifeno, y el incremento de riesgo tras HMG, pero no tras clomifeno, en el estudio de Shushan et al.(73), podría explicarse si la duración del tratamiento más que la droga utilizada per se constituyera el factor de riesgo. De hecho es una práctica generalizada en la paciente anovuladora el ensayar primero el citrato de clomifeno y a continuación las HMG si con el primero no se obtuvo la gestación. Además, dado que algunos estudios indican la existencia de una correlación entre la duración de la esterilidad y el riesgo de cáncer de ovario(96,97) es más probable que estas pacientes con «esterilidad refractaria al tratamiento» reciban más ciclos de terapéutica. Por otra parte, los tratamientos con citrato de clomifeno durante 12 ciclos o más ya no son práctica habitual en el momento actual. En este sentido es de destacar que tras el estudio de Rossing et al.(63) en 1994, el Comité sobre Seguridad de los Medicamentos en el Reino Unido recordó a los médicos que el citrato de clomifeno está autorizado para tan sólo seis meses de uso.
Las limitaciones al estudio de Shushan et al.(73) son varias. La recogida de datos se hizo mediante entrevista telefónica sin verificación de la información en la historia clínica. No consta, además, la causa de la esterilidad, dato que no pudo ser proporcionado por muchas de las pacientes. Supone un problema metodológico importante el hecho de que el 25% de los casos, definidos como mujeres diagnosticadas de cáncer durante el período 1990-1993 hubieran fallecido antes del estudio, y que otro 30% no pudiera participar en el mismo. El porcentaje de controles potencialmente incluible fue relativamente bajo en comparación con otros estudios. Resulta sorprendente que en este estudio el uso de contracepción hormonal oral, considerado de forma general como un importante factor determinante en la epidemiología del cáncer de ovario, no guardara relación negativa con esta neoplasia. Tal como se analizó anteriormente, el análisis conjunto de los cánceres invasivos y los tumores borderline resulta de lo más inapropiado para este tipo de estudio. Finalmente, hubiera sido de interés tener separadamente las estimaciones de riesgo para mujeres nulíparas y multíparas dados los hallazgos previos en este sentido del estudio de Whittemore et al.(18) y su discrepancia con los resultados de Rossing et al.(63). El hecho de no estratificar los resultados de acuerdo con la paridad y el antecedente de esterilidad hace muy factible que las cifras impliquen una sobreestimación, hecho que se apoya también en los amplios IC con unos límites inferiores muy próximos a la unidad.
Dos estudios casos-control recientes realizados por el mismo grupo de autores en Dinamarca analizan a partir de un mismo diseño de trabajo la posible influencia de la esterilidad y de los tratamientos inductores de la ovulación con citrato de clomifeno y/o HMG sobre el riesgo de cáncer invasivo(74) y de tumores borderline de ovario(75). Para el primer estudio, la recogida de datos se realizó a partir de un cuestionario postal enviado a las mujeres vivas con cáncer invasivo de ovario identificadas a través del registro nacional del cáncer y del registro nacional de pacientes de aquel país. Los controles de la población general se seleccionaron a partir del registro nacional danés de mujeres con equivalencia para cada caso en cuanto al lugar de residencia y a la edad en el momento del diagnóstico.
Los inductores de la ovulación habían sido utilizados por el 20,7% de los casos y por el 23,8% de las mujeres control. Los riesgos relativos se corrigieron según la edad, lugar de residencia, uso previo de contracepción oral y dispositivo intrauterino, situación de la menopausia, antecedente personal o familiar de cáncer, uso de terapéutica hormonal sustitutiva e índice de masa corporal. La paridad y la esterilidad se incluyeron también en el modelo de estudio según la asociación analizada.
Los resultados indicaron que la nuliparidad implicaba un incremento significativo de 1,5-2 veces de riesgo de cáncer de ovario y que la esterilidad (sin tratamiento alguno) en estas mujeres incrementa el riesgo aún más (RR = 3,13, IC 95% 1,60-6,08). Sin embargo, entre las mujeres estériles, ya en su conjunto o considerando independientemente las nulíparas de las estériles secundarias, el tratamiento con inductores de la ovulación no se asoció a ningún incremento del riesgo de cáncer de ovario (tabla 3). Tampoco se detectó asociación alguna al considerar el citrato de clomifeno o las HMG aisladamente. Además, la exclusión de los tumores no epiteliales no modificó las estimaciones de riesgo.
Para los tumores borderline(75) se llega a las mismas conclusiones. Mientras que para mujeres fértiles la diferencia en el riesgo de tumor borderline de ovario entre nulíparas y multíparas no fue estadísticamente significativa, las pacientes nulíparas estériles que no recibieron tratamiento médico tenían un riesgo doble de padecer aquel tipo tumoral que las nulíparas no estériles. No se observó ningún incremento significativo en el riesgo de tumor borderline entre las mujeres nulíparas sometidas a estimulación folicular ovárica en comparación con las estériles nulíparas no tratadas, ni entre las mujeres estériles secundarias tratadas en comparación con las no tratadas (tabla 3). Ninguno de los fármacos utilizados considerado individualmente se asoció a un incremento del riesgo.
Estos estudios daneses tienen datos destacables pero también sus limitaciones. Es de destacar que los casos fueron incluidos en el estudio a través de dos registros nacionales, con verificación histológica para todas las pacientes. En cuanto a los controles, hasta un 81% de las mujeres seleccionadas pudieron ser incluidas. Sin embargo, un 36% de los casos habían fallecido antes de poder ser realizado el estudio, lo cual podría ser un factor de sesgo en el caso de que los determinantes del riesgo difirieran entre estas pacientes y las incluidas en el estudio. Otro dato positivo de los trabajos daneses fue su capacidad para estimar el efecto de un número importante de covariables y de poder comparar los riesgos relativos de cáncer de ovario entre mujeres estériles tratadas y no tratadas tanto nulíparas como con gestaciones previas. A destacar que el índice de pacientes estériles (14%) entre las mujeres control concuerda con las cifras esperadas en Dinamarca y las de otras estadísticas generales. Sin embargo, el tipo de fármaco utilizado se extrapoló de su forma de administración (comprimidos orales, inyecciones o ambas) y de la respuesta de las pacientes en el cuestionario enviado por correo, lo cual implica una potencial fuente de error. Por otra parte no se proporciona información acerca de las causas específicas de esterilidad de cada paciente, ni de la duración del tratamiento o la edad en que la mujer lo recibió.
OTRAS NEOPLASIAS
Aun cuando lógicamente es el cáncer de ovario el que ha centrado el mayor interés en relación a su posible asociación con la estimulación folicular ovárica, dado que es la gónada femenina el órgano diana de los tratamientos inductores de la ovulación, los efectos endocrinos que estos tipos de terapéutica comportan hacen plausible la posibilidad de que influyan también en el riesgo de presentación de otras neoplasias hormonodependientes. Algunos estudios proporcionan datos en este sentido ya de forma complementaria a las investigaciones sobre el cáncer de ovario, ya de forma específica para estos otros tipos de cáncer.
Cáncer de mama
La hormonodependencia de este tipo de neoplasia está hoy fuera de toda duda y los factores endocrino-reproductivos constituyen determinantes esenciales al valorar el riesgo específico para cada mujer(98). La nuliparidad constituye un factor de riesgo bien aceptado. Sin embargo, mientras que la relación entre la esterilidad y el cáncer de mama ha sido motivo de controversia habiéndose descrito tanto pequeños incrementos como decrementos o no variación del riesgo, pero aceptándose en general la ausencia de asociación entre ambos procesos(99,100), estudios recientes han investigado más directamente la posible asociación entre esta neoplasia y los tratamientos con los «fármacos de la fertilidad» a raíz de la polémica surgida con el cáncer de ovario.
Existen tres estudios de cohortes(60, actualizado en 61; 62; 64 actualizado en 65), uno de cohorte-casos(101), y dos de casos-control(102,103) que analizan la relación entre riesgo de cáncer de mama y uso de «fármacos de la fertilidad»(102,103), de inductores de la ovulación (citrato de clomifeno, HMG)(60-62,101) o de tratamiento estimulante ovárico (clomifemo + HMG o HMG) para fecundación in vitro(64,65).
Todos estos estudios coinciden en señalar que estos tratamientos de esterilidad no incrementan el riesgo de cáncer de mama de la paciente estéril tratada ni en comparación con la incidencia de esta neoplasia esperada en la población general, ni en comparación con las mujeres estériles no tratadas. A destacar que en el estudio de Rossing et al.(101) se detectó una reducción no significativa del riesgo de cáncer de mama en las mujeres que habían sido tratadas con citrato de clomifeno (RR = 0,5, IC 95% 0,2-1,2), sugiriéndose que ello se podría explicar por la similitud de este fármaco con el tamoxifeno.
Por otra parte, en este contexto, hay que destacar la posibilidad de que los tratamientos con HCG puedan tener un efecto protector frente al cáncer de mama. Tanto en la mama normal como en la neoplásica existen receptores para la LH/HCG(104) y en mujeres tratadas con HCG por esterilidad o para pérdida de peso se ha descrito una reducción del riesgo de neoplasia mamaria(105). A nivel experimental se ha demostrado que la HCG retrasa o inhibe el desarrollo y progresión del cáncer de mama inducido químicamente en la rata, ya sea a través de inducir la maduración y diferenciación de los lóbulos mamarios más inmaduros al igual que ocurre en el embarazo o por un aumento del índice apoptótico(106,107).
Cáncer de útero: endometrio y cérvix
Dado que tanto la nuliparidad como la esterilidad (especialmente la debida a anovulación) constituyen factores de riesgo para el cáncer de endometrio y el empleo del tamoxifeno (un antiestrógeno con similitud con el clomifeno) ha sido relacionado con la hiperplasia y carcinoma endometriales(100), podría esperarse que las mujeres tratadas con citrato de clomifeno tuvieran un mayor riesgo de neoplasia de cuerpo uterino.
En un estudio de casos-control(60 actualizado en 61) y en un estudio de cohorte de pacientes de un programa de fecundación in vitro(64 actualizado en 65), se constata que los tratamientos inductores de la ovulación con clomifeno y/ o HMG no se asocian a un incremento del riesgo de cáncer de endometrio. Sin embargo, en ambos estudios se detecta un incremento del riesgo de cáncer corporal uterino para ciertos subgrupos de pacientes estériles. En el estudio de casos-control(60,61) se describe un incremento significativo de carcinomas endometriales, independientemente del tratamiento hormonal efectuado, en las mujeres anovuladoras en las que hay una acción estrogénica mantenida no contrarrestada por la progesterona, dato bien conocido en la epidemiología del cáncer de endometrio.
Sin embargo, en la cohorte de Venn et al.(64,65) fue un hallazgo inesperado el hecho de detectar un incremento significativo de casos de cáncer de endometrio (y también de ovario, ver antes) en el grupo de pacientes con esterilidad de causa desconocida independientemente de que hubieran sido sometidas a tratamiento de fecundación in vitro o no. La explicación a este hecho no está clara. Es posible que algunos cánceres de endometrio puedan haber sido detectados en el transcurso de la evaluación de esterilidad previa a la fecundación in vitro y ésta sea la razón por la que esta técnica de fecundación asistida no se llevó a cabo. Otra posibilidad es que un cáncer (endometrial u ovárico) en sus fases más iniciales de desarrollo fuera la causa subyacente de la esterilidad y que su existencia pasara desapercibida en la evalución de la paciente previa a la fecundación in vitro. Sin embargo, la mayoría de casos fueron diagnosticados al menos tres años después del primer ciclo de fecundación in vitro.
Por otra parte, habría que considerar en qué momento las pacientes fueron catalogadas como estériles de causa desconocida, cuánto tiempo transcurrió desde que fueron incluidas en el programa hasta que se les practicó la fecundación in vitro, y si inmediatamente antes de la misma fueron sometidas a exploraciones complementarias o no. Según los autores, un análisis más profundo de los casos de estas pacientes y los resultados del estudio multicéntrico casos-control de «modelos anidados» que está en marcha en Australia y al que hemos hecho mención anteriormente, podrán probablemente dar respuesta a alguna de estas interrogantes(65).
Existen dos estudios que han analizado la incidencia de cáncer cervical y de cáncer in situ en mujeres tratadas por esterilidad. Uno de ellos es el de Venn et al.(64) en su estudio de cohorte ya comentado y el otro es el de Rossing et al.(108) que si bien publicado de forma independiente, se basa en la misma cohorte de la que presentan previamente la incidencia de cáncer de ovario(63).
Ambos estudios demuestran una incidencia de esta patología cervical significativamente más baja entre las pacientes estériles (tratadas o no) que en la población general. En el estudio de Rossing et al.(108), además, las mujeres estériles que habían sido tratadas con citrato de clomifeno tenían una incidencia de cáncer cervical invasivo o in situ significativamente más baja que las que no habían recibido este tratamiento. Aunque los autores postulan un más que hipotético papel protector del clomifeno frente al cáncer cervical, la explicación a estas observaciones radica probablemente en la existencia de dos poblaciones muy diferentes (estériles versus población general) en cuanto a factores de riesgo para cáncer cervical y/o a un mayor control y screenings más frecuentes en las pacientes estériles dadas sus repetidas consultas al ginecólogo que permite el tratamiento de las formas más iniciales del problema (CIN I y II). Así, por ejemplo, en el registro australiano del cáncer no se notifican los casos de CIN I y II pero sí las formas más avanzadas.
Otras neoplasias no ginecológicas
Como complemento a la recogida de datos sobre la relación entre cáncer ginecológico y terapéutica de la esterilidad, el estudio de Veen et al.(64) incluye también la incidencia de melanomas y del cáncer colorrectal en su estudio de cohorte. La incidencia de ambos tipos de neoplasia fue similar entre las mujeres estériles sometidas a fecundación in vitro que en la población general y sin que el tratamiento de la esterilidad influyera en los riesgos relativos estimados.
Rossing et al.(109), de nuevo en una publicación independiente pero en base a la misma cohorte de mujeres de su estudio previo(63), sugieren una incidencia de melanoma entre las mujeres estériles superior a la esperada entre la población general (RR=1,8, IC 95% 0,9-3,1) y con un incremento del riesgo entre las estériles tratadas durante 12 ciclos o más con citrato de clomifeno (RR = 2,2, IC 95% 0,5-10,2). Sin embargo, ninguna de ambas asociaciones resultó ser estadísticamente significativa.
POTENCIALES LIMITACIONES METODOLÓGICAS A LOS ESTUDIOS SOBRE ESTIMULACIÓN FOLICULAR OVÁRICA Y CÁNCER
Los tipos de estudios discutidos antes tienen una serie de connotaciones que merecen ser comentadas desde una perspectiva epidemiológica, ya que contribuyen al análisis del potencial papel de la casualidad en los resultados observados y con ello a objetivar la validez de los mismos. Entre dichos aspectos metodológicos se incluyen la selección apropiada de los grupos poblacionales a estudiar, la definición y valoración exacta de la supuesta variable (factor) de riesgo y del resultado (proceso) investigados y la estimación de factores que pueden inducir un sesgo o error de apreciación en la asociación entre la variable de riesgo y el resultado observado.
La población a estudiar: quiénes y cuántos
Hay dos tipos de diseño de estudios observacionales que se han empleado para el análisis de la relación entre «fármacos de la fertilidad» y cáncer: estudios de cohortes y estudios de casos-control. Estos últimos valoran la exposición a un factor de riesgo en personas afectas de la enfermedad o proceso de interés (casos) y en personas sin la enfermedad (controles). Los estudios casos-control han incluido grandes grupos de mujeres con cáncer de ovario pero con frecuencia se han encontrado con muy pocas mujeres que hayan sido tratadas con aquellos fármacos.
Los estudios de cáncer en cohortes de pacientes estériles han llevado a cabo el seguimiento de importantes grupos de mujeres estudiadas por esterilidad pero han detectado pocos casos con el resultado investigado. El número de casos de cáncer esperado en una cohorte de mujeres expuestas a los tratamientos de esterilidad investigados se incrementa con el tamaño de la muestra poblacional, la duración del seguimiento, la edad de la mujer y según la incidencia general del cáncer en población general. Se acepta en general que el nivel de la evidencia obtenida a partir de un estudio de cohorte bien diseñado es superior al obtenido con un estudio caso-control(110). Si bien los estudios de cohortes sobre cáncer tras la esterilidad han sido retrospectivos, los datos sobre las terapéuticas de la esterilidad fueron obtenidos antes de cualquier diagnóstico del cáncer.
Aunque el número absoluto de mujeres que han sido tratadas con los «fármacos de la fertilidad» a nivel mundial es elevado, existen dificultades en la práctica, sea cual sea el diseño del estudio que se emplee, para la realización de estudios que tengan un poder estadístico suficiente para detectar pequeños o moderados incrementos del riesgo de cáncer con un margen de confianza aceptable. Obviamente, los estudios multicéntricos pueden generar cohortes mucho más importantes de pacientes, pero tienen también más dificultades de realización que los limitados a un centro único y son también más costosos.
La variable o supuesto factor de riesgo: definición y valoración de la exposición a los «fármacos de la fertilidad»
A lo largo de las tres últimas décadas han habido importantes cambios en el tipo, combinaciones y dosis de los llamados «fármacos de la fertilidad» que de alguna manera pueden influir sobre el riesgo de cáncer. La valoración de la exposición a los fármacos debería, por tanto, tener en cuenta estos factores, pero hasta el momento los estudios son muy limitados en este sentido.
Los casos clínicos y series cortas de casos, como los presentados en las tablas 1 y 2, sobre neoplasias diagnosticadas en pacientes estériles proporcionan en general la descripción más detallada sobre los tratamientos previos de esterilidad recibidos por las pacientes, pero tal como se comentó anteriormente suponen una débil evidencia para apoyar una relación causa efecto(110). Mientras que, como dijimos, pueden constituir el motivo de alerta acerca de la posibilidad de una asociación entre una exposición y un resultado determinados, los casos clínicos y las series cortas nos dicen poco acerca de la frecuencia de dicha asociación en un grupo clínico o poblacional más amplio.
Tal como hemos visto, pocos estudios de los discutidos antes han analizado específicamente la relación entre los diferentes tipos de fármacos empleados en la inducción de la ovulación y el riesgo de cáncer de ovario y el pequeño número de casos en cada subgrupo de tratamiento limita el valor de los resultados de cada estudio individual. Dilucidar la posible relación entre el desarrollo de un cáncer y los diferentes tipos de fármacos resulta prácticamente imposible cuando las mujeres han estado expuestas a los distintos fármacos, ya secuencialmente ya en combinación, a lo largo del tratamiento de su esterilidad.
Algunas consideraciones prácticas pueden ayudar a explicar por qué en muchos estudios no se han podido hacer distinciones entre las diferentes pautas de tratamiento. Habitualmente no es posible disponer de los datos exactos (incluyendo tipos de fármacos, combinaciones de los mismos, dosis y fechas) sobre todos los tratamientos farmacológicos de esterilidad recibidos por las mujeres a lo largo de su vida, ya sea porque ellas no lo recuerdan o por la mala descripción en las historias clínicas o por el extravío de las mismas. En los estudios casos-control, la información aportada por las propias pacientes sobre el uso previo de fármacos es muy susceptible de sufrir «sesgos de recuerdo»: las mujeres con cáncer suelen recordar mejor la exposición a fármacos que podrían estar vinculados a su enfermedad neoplásica que las mujeres no afectas de cáncer. Por otra parte, mientras que la revisión manual de los datos a partir de las historias clínicas es más factible en los estudios casos-control, ello es mucho más problemático en los estudios de cohortes con miles de mujeres.
Tal como se ha visto también anteriormente, prácticamente ninguno de los estudios analizados permite llevar a cabo un estudio de la correlación entre el número de ciclos de tratamiento con los inductores de la ovulación y el riesgo de cáncer. Además de la falta de información exacta en este sentido, la mayoría de mujeres han recibido pocos ciclos de terapéutica (especialmente fecundación in vitro) y ello limita las posibilidades de estudio estadístico. Por otra parte, es bien conocida la gran variabilidad que existe entre las diferentes pacientes en su capacidad de respuesta a los inductores de la ovulación. Ello es bien patente en fecundación in vitro donde pacientes de edades similares y sometidas al mismo régimen de estimulación ovárica pueden proporcionar importantes diferencias en el número de ovocitos obtenidos. Por el contrario, otras veces son necesarias dosis muy dispares de gonadotrofinas administradas para lograr respuestas ováricas similares entre las pacientes.
Esta carencia, por un lado, en nuestra capacidad de valorar biológicamente la respuesta a la estimulación ovárica y la falta, por otra parte, de información exacta acerca de las dosis totales de fármacos recibidas por cada paciente, son más limitaciones a tener en cuenta para la interpretación de los resultados descritos en los estudios epidemiológicos.
El problema observado: estableciendo la incidencia de cáncer
Los estudios de cohortes que describen la relación entre el uso de los «fármacos de la fertilidad» y el cáncer han determinado la incidencia de éste último a través de los registros poblacionales de cáncer. La misma fuente de mujeres con cáncer ha sido empleada en algunos estudios casos-control.
Hay varios factores que contribuyen a la exactitud de los datos sobre incidencia del cáncer: lo completo que sea el registro del cáncer en cuestión, la exactitud de los datos sobre las mujeres de la cohorte, el proceso de equiparación de variables de confusión entre casos y controles y la proporción de mujeres con pérdida de seguimiento debido a cambios de domicilio, fallecimiento, etc.
Los estudios de cáncer en cohortes de mujeres que han estado expuestas a los «fármacos de la fertilidad» han empleado como grupos comparativos mujeres estériles que no habían recibido el tratamiento o mujeres de la población general. Cualquier diferencia entre los grupos de mujeres expuestas y no expuestas en cuanto a la manera en que los casos de cáncer son detectados puede conducir a una estimación sesgada del riesgo de cáncer asociado al tratamiento con aquellos fármacos. Una detección más precoz del cáncer es de esperar en las mujeres que han sido tratadas con estos fármacos si han sido sometidas a más exploraciones y pruebas diagnósticas que las mujeres que no recibieron dichas drogas. También es posible que el cáncer sea diagnosticado con más facilidad si la causa de la esterilidad de la mujer es la forma de presentación clínica de un cáncer ovárico o uterino subyacente en fases iniciales, o bien si los fármacos estimulantes ováricos actúan como promotores de tumores pre-existentes y conducen así a un diagnóstico más precoz de la enfermedad. Tal como hemos discutido anteriormente, esto es especialmente aplicable en relación con los tumores de las células de la granulosa.
Factores de sesgo o confusión: definición y valoración
Además de la exposición a los «fármacos de la fertilidad», existen otros factores potencialmente predictivos o asociados a un incremento de riesgo de cáncer en las mujeres que consultan por esterilidad. Estas covariables de confusión son factores que están asociados independientemente tanto a la exposición o factor de riesgo en estudio como al resultado o proceso investigado; por tanto, pueden inducir un sesgo tanto en el sentido de favorecer aparentemente la existencia de una asociación entre exposición y resultado, como en el sentido de enmascarar una verdadera relación causa-efecto. Así pues, estos factores o covariables de confusión deberían ser tenidos en cuenta en el diseño y valoración de los estudios sobre aquellos fármacos y cáncer. Desafortunadamente, ello sólo se ha cumplido en mayor o menor grado en los estudios analizados antes.
Paridad y fertilidad, nuliparidad y esterilidad
Se acepta en general que las mujeres estériles, y en especial las que tienen un síndrome de ovarios poliquísticos, tienen un mayor de riesgo de padecer un cáncer ginecológico a lo largo de su vida(111,112). Sin embargo, una de las mayores dificultades a la hora de valorar el significado de la esterilidad en cuanto al riesgo de cáncer, y en especial en relación al cáncer de ovario, es la estrecha conexión entre paridad y fertilidad y entre nuliparidad y esterilidad.
Diferentes estudios epidemiológicos en los que se investiga la relación entre los factores reproductivos y el cáncer de ovario(66,96,113-117) han demostrado que la esterilidad constituye un factor de riesgo independiente que se añade al efecto de la nuliparidad. Del análisis de estos estudios se concluye que no sólo la esterilidad juega un papel importante en determinar la relación entre la paridad baja y el incremento del riesgo de cáncer de ovario, sino que es probable que un factor común, seguramente de naturaleza gonadal, predisponga a la mujer tanto a la esterilidad como al cáncer de ovario, al menos en un subgrupo de estas pacientes(33,85). En concordancia con esto, el conocido estudio de Lais et al.(118) describe una prevalencia de cáncer de ovario de 1/95 en mujeres estériles de < 40 años en el momento de la microcirugía programada por esterilidad. Se detectó un carcinoma silente de ovario en seis de 571 pacientes estériles, en comparación con tan sólo un caso entre 5.806 mujeres sometidas a otros tipos de cirugía abdominal (RR = 62, IC 95% 7-514). Esto representa una prevalencia de cáncer de ovario superior a la de las mujeres < 40 años en general (se estima alrededor de un caso de cáncer de ovario por cada 424 mujeres antes de los 40 años)(118).
Entre las mujeres que consultan por esterilidad se incluyen también las estériles secundarias pero globalmente tienden a tener una paridad más baja y con más frecuencia son nulíparas en comparación con las mujeres de la misma edad de la población general. Las mujeres nulíparas tienen un mayor riesgo de cáncer de ovario y de mama. Pero, por otra parte, la población de pacientes estériles está constituida por una mezcla de mujeres que quedan gestantes y tienen algún hijo y mujeres que persisten en su nuliparidad. Dado que el embarazo reduce el riesgo de cáncer de ovario y de mama, es esencial estratificar o controlar el efecto de la paridad al estimar el impacto de la esterilidad en si misma como factor de riesgo.
El análisis de estas interacciones en relación al cáncer de ovario y en base a las estimaciones de la literatura se han concretado de la manera siguiente(119):
a) la nuliparidad de por sí misma aumenta el riesgo de cáncer de ovario aproximadamente el doble;
b) la esterilidad en las mujeres que posteriormente quedan gestantes y dan a luz no incrementa el riesgo de cáncer de ovario. Por el contrario,
c) La esterilidad entre las mujeres que permanecen nulíparas implica un incremento adicional de riesgo del 75% en comparación con las nulíparas no estériles, y aquéllas tienen un riesgo 3,5 veces mayor en comparación con las mujeres multíparas no estériles.
La magnitud del efecto de la paridad sobre el riesgo de cáncer de mama varía según la edad de la mujer. La multiparidad se asocia a una disminución del riesgo de cáncer de mama en mujeres de más de 40 años de edad en el momento del diagnóstico, pero en cambio la paridad elevada se asocia a un incremento del riesgo en mujeres de menos de 40 años, y es que existe un incremento de riesgo a corto plazo tras el embarazo a término(120-122). En este contexto también se ha descrito que el retraso del primer embarazo y parto hasta después de los 30 años supone un incremento de riesgo mayor para cáncer de mama que en las mujeres que tienen su primer hijo antes de los 20 años(123). Por otra parte, algunos datos sugieren que el embarazo reciente es un indicador de mal pronóstico en mujeres con cáncer de mama(124). Por tanto, el potencial efecto de confusión o sesgo de la paridad sobre el riesgo de cáncer de mama puede depender de las edad de las mujeres estudiadas y, en su caso, del tiempo transcurrido desde el último embarazo y parto.
Causa de la esterilidad y plausibilidad biológica.
Al igual que existe heterogeneidad en el tipo y pautas de los fármacos empleados en la terapéutica de la esterilidad, existe también una considerable heterogeneidad en las causas que originan el problema reproductivo. En general se acepta que la esterilidad debe ser considerada como una potencial variable de confusión al analizar la relación entre exposición a los «fármacos de la fertilidad» y riesgo de cáncer. Sin embargo, quedan por aclarar todavía diferentes interrogantes en cuanto a la posible relación entre esterilidad y cáncer. Si esta asociación existe, ¿qué tipos de esterilidad son importantes?; ¿existen unos tipos determinados de cáncer que están especialmente relacionados con ciertos tipos de esterilidad?; y por último y más importante, ¿hay plausibilidad biológica para el incremento del riesgo de cáncer con el uso de inductores de la ovulación en comparación con pacientes estériles en las que no se requiere dicho tratamiento? Todas estas interrogantes requerirían el empleo de grupos de mujeres control equivalentes (con el mismo trastorno, ovulatorio o no) que no hubieran recibido tratamiento alguno cuando se investiga el efecto de la terapéutica farmacológica de la esterilidad.
La cuestión de la posible plausibilidad biológica es especialmente interesante en lo referente al cáncer de ovario, dado que es para este tipo de neoplasia para el que se ha postulado el incremento de riesgo y por ser el ovario el órgano diana de los tratamientos estimulantes de la ovulación. Dado que tal como se comentó anteriormente una acción carcinogenética directa de los fármacos empleados para la inducción de la ovulación no ha sido probada, la plausibilidad biológica de una posible asociación entre estimulación folicular y riesgo de cáncer de ovario habrá que buscarla en el sustrato de las mujeres tratadas o en la biología de la misma neoplasia.
En cuanto a las pacientes, incluso dentro del grupo de pacientes con trastornos ovulatorios pueden existir subgrupos de mujeres con factores de riesgo para cáncer muy diferentes independientemente del tipo de tratamiento de esterilidad que reciban. Así, no es lo mismo la paciente con un síndrome del ovario poliquístico que la paciente con una anovulación tipo II de la OMS pero sin ovario poliquístico o que el caso de una anovuladora por hipogonadismo-hipogonadotropo. Por no mencionar el elevado número de mujeres que siendo normoovuladoras se someten a técnicas de reproducción asistida por problemas de subfertilidad masculina en las cuales no han de existir en teoría los factores de confusión asociados o subyacentes a las causas de esterilidad femenina, aun cuando en una interpretación inversa es posible que estas mujeres en cuya pareja existe un problema seminal severo pueda existir también una esterilidad subyacente que sólo se evidenciaría o diagnosticaría en caso de que su pareja masculina fuera potencialmente fértil.
La importancia de lo anterior queda bien patente al revisar la información proporcionada en este sentido por algunos de los trabajos analizados más arriba que al estratificar de acuerdo con el tipo de esterilidad ofrecen resultados contradictorios en cuanto a estimaciones de RR para el cáncer de ovario. Así por ejemplo, Rossing et al.(63) hallan que los trastornos ovulatorios implicaban el mayor riesgo relativo (RR = 3,7), pero, en cambio, el elevado riesgo asociado al uso de clomifeno a largo plazo se observó fundamentalmente para las otras causas de esterilidad. Ron et al.(60) describen un incremento significativo del riesgo asociado a la esterilidad masculina (RR = 6,7), mientras que en el estudio de Venn et al.(64) fue la esterilidad de causa inexplicada la que implicó el RR más elevado (RR = 19,2). En estos dos últimos estudios ninguno de los casos tenía trastornos ovulatorios. Por su parte, Brinton et al.(91) encontraron que las mujeres con trastornos hormonales tenían un RR de 1,6 mientras que la esterilidad por factor masculino implicaba un RR de 2. La conclusión de todo ello es que el efecto neto de la exposición a los «fármacos de la fertilidad» sobre el riesgo de cáncer de ovario es difícilmente discernible sin un gran grupo comparativo de mujeres control que presenten el mismo tipo de disfunción/función ovulatoria y no hayan recibido aquellos fármacos.
En cuanto a la biología del cáncer de ovario hay que destacar varios hechos que hacen seriamente cuestionable la existencia de una relación directa entre estimulación folicular y el desarrollo de la neoplasia. En primer lugar, en el contexto de la teoría de la ovulación incesante, la protección ejercida por diferentes factores tales como el embarazo o la toma de contraceptivos hormonales orales debería ser proporcional a los meses de ovulación (esto es, la edad ovulatoria) que se previenen (o sea, el embarazo a término debería conferir una protección varias veces superior a la del aborto, y la edad de la mujer en el momento del embarazo no debería tener importancia alguna). Por el contrario, existen estudios que indican que el modelo basado en la edad ovulatoria no es satisfactorio al menos en términos cuantitativos(9,95,125). Tal como señala Scott(52), el problema estriba en que algunos de los hechos en los que se basa la idea de Fathalla(13) parecen demasiado buenos para encajar con la hipótesis. Así, por ejemplo, una mujer que ha tenido un embarazo a término y da lactancia materna a su hijo «perderá» alrededor del 3% de las ovulaciones que habría tenido si nunca hubiera quedado gestante; sin embargo, un único embarazo se asocia a una reducción de la incidencia de cáncer de más o menos la mitad(52). Por otra parte, hay estudios que demuestran que el primer embarazo es más protector que los siguientes y que por tanto cada gestación no es equivalente(125). De forma similar a como ocurre con la gestación, la toma de contraceptivos combinados orales se asocia a una marcada reducción del riesgo de cáncer de ovario que persiste años tras el cese en el uso de aquéllos, pareciendo existir de nuevo una desproporción entre la actuación del factor protector y la protección conferida. Por tanto, habrá que pensar que otros mecanismos biológicos (hormonales, inmunológicos, desconocidos) diferentes de la «edad ovulatoria» pueden explicar la aparente protección frente al cáncer de ovario conferida por el embarazo y parto y por los contraceptivos orales.
En segundo lugar, aun cuando se ha señalado de acuerdo también con la teoría de la ovulación incesante descrita más arriba, que es la ovulación en la etapa adulta el mecanismo responsable de la formación de los quistes de inclusión en cuyo proceso de reparación se origina la desviación de la normalidad que podría conducir al desarrollo del cáncer(126), se han observado también quistes de inclusión en los ovarios antes de la menarquia(127).
Por último, hay que destacar que los estudios citogenéticos en el cáncer de ovario demuestran la pérdida frecuente de material genético en las células cancerosas(4). Diferentes estudios han demostrado la pérdida de alelos del brazo largo del cromosoma 17 en > 80% de las neoplasias ováricas malignas y pérdidas de alelos del brazo corto del cromosoma 11 en al menos el 45% de las pacientes(128,129). Estas pérdidas de alelos representan la pérdida de genes represores tumorales. Por tanto, la promoción de células que tienen ya la pérdida de estos alelos, puede conducir a la división celular incontrolada y a la transformación maligna(130). De acuerdo con ello, pues, la reparación celular defectuosa tras la ovulación podría ser considerada como un factor de riesgo de cáncer de ovario tan sólo en aquellas mujeres en las que exista esta base genética. Esto significa, por tanto, que aun cuando aceptáramos la posible asociación entre ovulación incesante y el cáncer de ovario, ésta no sería en modo alguno una relación de causalidad.
Otras variables de confusión
Existen otros factores que pueden actuar potencialmente también como variables de confusión en la relación entre exposición a los tratamientos de esterilidad y el cáncer. Sin embargo, muchas de estas variables no fueron consideradas en los estudios sobre el tema.
Entre estos factores cabe mencionar el uso previo de contraceptivos hormonales orales (tanto en cuanto a la duración como a la edad de uso), la edad de la menarquia y/o menopausia, así como el tipo menstrual, la práctica de histerectomía y/o anexectomía a lo largo del seguimiento a largo plazo, el nivel socioeconómico, la historia familiar de cáncer, así como algunos otros factores epidemiológicos considerados como relevantes en la etiopatogenia de las neoplasias estudiadas.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
La nuliparidad constituye un factor de riesgo bien establecido para diferentes tipos de neoplasia ginecológica, incrementándose los riesgos relativos cuando se implica la esterilidad como factor de riesgo independiente adicional. Ello parece ser especialmente evidente para algunos subgrupos de mujeres estériles. En la paciente estéril no existe evidencia, de acuerdo con los datos disponibles en la literatura actual, de que el tratamiento inductor/estimulante de la ovulación se asocie a un incremento del riesgo de cáncer de mama o de útero. Para el cáncer de ovario, la evidencia actual basada en los datos proporcionados por 17 estudios epidemiológicos (seis de cohortes y 11 casos-control) puede resumirse en lo siguiente:
a) El tratamiento con citrato de clomifeno durante menos de 12 meses no implica ningún incremento del riesgo de cáncer de ovario invasivo o borderline.
b) El tratamiento con HCG no incrementa el riesgo de cáncer de ovario.
c) El tratamiento con HMG no incrementa el riesgo de cáncer de ovario invasivo.
d) Sólo un estudio ha demostrado un incremento del riesgo de cáncer de ovario (incluyendo tumores borderline) tras 12 meses o más de estimulación ovárica con clomifeno. Por otra parte, también únicamente un estudio ha indicado un incremento del riesgo de tumores borderline tras estimulación con HMG.
Globalmente, pues, no existen datos que hagan pensar en una relación de causalidad entre inducción de la ovulación y riesgo de cáncer de ovario. Por otra parte, el escaso número de casos de cáncer y/o de mujeres expuestas a los tratamientos, las diferentes drogas y pautas de terapéuticas empleadas, así como la disparidad en la duración de las mismas y las diferentes limitaciones a los estudios epidemiológicos sobre el tema, hacen difícil la implicación de un fármaco o fármacos específicos. Lo más probable es que la esterilidad y el cáncer de ovario puedan estar indirectamente relacionados al existir, al menos en un subgrupo de población de pacientes estériles, un tercer factor común desconocido que predisponga tanto a la esterilidad como al cáncer. Estas pacientes, con esterilidad especialmente refractaria al tratamiento, son las candidatas tanto a recibir ciclos repetidos de terapéutica como a desarrollar la neoplasia, y de ahí puede surgir la aparente asociación. En otros casos, la existencia del tumor puede ser la causa subyacente de la esterilidad tal como lo indican las gestaciones observadas tras la resección tumoral, especialmente para tumores borderline y de células de la granulosa.
Por tanto, uno de los objetivos esenciales para el futuro es discernir entre «los efectos del tratamiento y las indicaciones del tratamiento». Las mujeres que consultan por esterilidad son estudiadas exhaustiva y repetidamente, siendo así mayor la probabilidad de diagnosticar tumores ováricos asintomáticos. Dependiendo del momento en que la mujer sea investigada y diagnosticada puede existir un sesgo en relación al uso de los ''''fármacos de la fertilidad''''. Si el screening diagnóstico exhaustivo se realiza después de iniciar los tratamientos inductores de la ovulación, se tiende a incrementar falsamente el efecto etiopatogénico de estos fármacos.
Para los estudios futuros es necesario también separar los efectos de la baja paridad, de la nuliparidad voluntaria y de la esterilidad sobre el riesgo de cáncer de ovario, además de estratificar también para los otros posibles factores de sesgo; y lo que es más importante aún, habrá que diferenciar entre las diferentes causas de esterilidad. Por otra parte, habrá que tener en cuenta la etiología multifactorial del cáncer de ovario con los factores genéticos, ambientales y hormonales que están directa o indirectamente relacionados con la carcinogénesis. Sólo importantes estudios prospectivos de grandes cohortes de mujeres estériles podrán contribuir a dar respuesta a estas interrogantes. Al menos en cuatro países están ya en marcha estudios de este tipo: Holanda, Estados Unidos, Dinamarca y Australia. Cada uno de estos estudios incluye cohortes de entre 10.000 y 20.000 mujeres diagnosticadas de esterilidad y serán llevados a cabo de acuerdo con los registros de cáncer y a través de cuestionarios presentados a las mujeres, evaluándose los riesgos para todos los tipos de neoplasias femeninas.
Hasta que se nos proporcione esta información más veraz y exacta, por el momento no existen motivos, según agencias tales como el National Institute of Child Health and Human Development''s Contraceptive and Reproductive Evaluation Branch(131,132), para modificar fundamentalmente la práctica médica actual en relación al uso de los fármacos inductores de la ovulación. Sin embargo, a raíz de la controversia surgida a partir del artículo de Whittemore et al.(18) y de los datos disponibles en el momento actual, también se recomienda que las pacientes no sean sometidas a muchos ciclos repetidos de tratamiento inductor/estimulante de la ovulación especialmente teniendo en cuenta que en la mayoría de casos de éxito el embarazo se produce en los primeros tres a seis ciclos de terapéutica.
Estas recomendaciones parecen ser seguidas por muchos de los especialistas en países como los Estados Unidos y Canadá, donde, de acuerdo con estudios muy recientes(133,134), la mayoría de ellos no creen (70%) o dudan (14%) de que la terapéutica inductora de la ovulación aumente el riesgo de cáncer de ovario. Sin embargo, los especialistas hacen referencia a esta posibilidad al solicitar el consentimiento informado a sus pacientes (83% de encuestados) y han modificado en parte su práctica clínica en el sentido de haber acortado el número de ciclos de tratamiento que indican en sus pacientes (74% de encuestados), no son tan proclives a indicar esta terapéutica en pacientes con historia familiar de cáncer de ovario (32% de encuestados), y recomiendan el control estricto postratamiento si no hubo embarazo y la toma de contraceptivos orales como quimioprevención (30% de encuestados). Lo cierto es que la mujer estéril que queda gestante se beneficia del efecto protector que el embarazo le confiere, pero la paciente que sigue estéril a pesar del tratamiento constituye una paciente de riesgo elevado para cáncer de ovario. En estas mujeres hay que valorar con gran rigurosidad la persistencia de cualquier tumoración ovárica(135) y no emplear la terapéutica inductora de la ovulación en las pacientes tratadas por una neoplasia invasiva(136) para evitar situaciones dramáticas. En los casos de tumores borderline la situación es discutible dependiendo del tipo histológico, de la terapéutica que se pretenda aplicar, de las alternativas disponibles y de los deseos de la paciente tras una detallada y cuidadosa discusión del problema(137).
Finalmente, cabe señalar que si bien la mitad o más de las pacientes estériles están aparentemente dispuestas a aceptar un incremento de riesgo de padecer un cáncer de ovario a lo largo de su vida de hasta dos-tres veces como consecuencia de la terapéutica de la esterilidad en base a que consideran que los beneficios del tratamiento superan los riesgos, este índice de aceptación está artificialmente elevado debido a que muy pocas mujeres entienden claramente la naturaleza y significado del cáncer de ovario(138). Ello indica la necesidad de que el médico presente de forma clara y honesta la información pertinente a cada paciente en particular, especialmente teniendo en cuenta el importante auge actual de las técnicas de reproducción asistida y la liberalidad en sus indicaciones.
BIBLIOGRAFIA
001 Balasch J, Jové I, Deulofeu P, et al. Hiperestimulación ovárica y embarazo múltiple: aspectos actuales. Clin Inv Gin Obst 1989;16:385-98.
002 Balasch J, Fàbregues F. La hiperestimulación ovárica. Rev Iberamer Fertil 1998;15:41-50.
002bis Balasch J, Arroyo V, Fábregues F, et al. Teoría de la vasodilatación arterial periférica: una nueva perspectiva en obstetricia y ginecología. Prog. Obstet Ginecol 1992;35:1-17.
003 DiSaia PJ. Ovarian disorders. In Scott JR, DiSaia PJ, Hammond CB, Spellacy WN (eds.), Danforth''s Obstetrics and Gynecology, sixth edition. Philadelphia: JB Lippincott Co; 1990. p. 1067-120.
004 Pérez RP, Godwin AK, Hamilton TC, Ozols RF. Ovarian cancer biology. Sem Oncol 1991;18, 186-204.
005 González-Merlo J. Ginecología, 7.ª ed. Barcelona: Masson; 1997.
006 Krigman H, Bentley R, Robboy SJ. Pathology of epithelial ovarian tumors. Clin Obstet Gynecol 1994;37:475-91.
007 Greene M, Clark J, Blayney D. The epidemiology of ovarian cancer. Sem Oncol 1984;11:209-26.
008 Heintz A, Hacker N, Lagasse L. Epidemiology and etiology of ovarian cancer: A review. Obstet Gynecol 1985;66:127-35.
009 Negri E, Franceschi S, Tzonou A, Booth M, La Vecchia C, Parazzini F, et al. Pooled analysis of 3 european case-control studies: I. Reproductive factors and risk of epithelial ovarian cancer. Int J Cancer 1991;49:50-6.
010 Purdie G, Green A, Bain C, et al. Reproductive and other factors and risk of epithelial ovarian cancer: an Australian case-control study. Surveys of Women''s Helath Study Group. Int J Cancer 1995;62:78-84.
011 Hankinson SE, Golditz GA, Hunter DJ, et al. A quantitative assessment of oral contraceptive use and risk of ovarian cancer. Obstet Gynecol 1992;80:708-14.
012 Rosenberg L, Palmer JR, Zauber AG, et al. A case-control study of oral contraceptive use and invasive epithelial ovarian cancer. Am J Epidemiol 1994;139:654-61.
013 Fathalla MF. Incessant ovulation -a factor in ovarian neoplasia? Lancet 1971;ii:163.
014 Casagrande JT, Pike MC, Ross RK, Louie EW, Roy S, Henderson BE. «Incessant ovulation» and ovarian cancer. Lancet 1979;II:170-2.
015 Stadel BV. The etiology and prevention of ovarian cancer. Am J Obstet Gynecol 1975;123:772-3.
016 Cramer DW, Welch WR. Determinants of ovarian cancer risk. II. Inferences regarding pathogenesis. J Natl Cancer Inst 1983;71:717-21.
017 Zajicek J. Prevention of ovarian cystomas by inhibition of ovulation: a new concept. J Reprod Med 1978;2:114.
018 Whittemore AS, Harris R, Itnyre J and the Collaborative Ovarian Cancer Group. Characteristics relating to ovarian cancer risk: collaborative analysis of 12 US case-control studies. II.Invasive epithelial ovarian cancers in white women. Am J Epidemiol 1992;136:1184-203.
019 Potashnik G, Insler V, Meizner I, Sternberg M. Frequency, sequence, and side of ovulation in women menstruating normally. Br Med J 1987;294:219.
020 Cruickshank DJ. Aetiological importance of ovulation in epithelial ovarian cancer: a population based study. Br Med J 1990;301:524-5.
021 Massad LS, Verda JH, Szpak CA, Clarke-Pearson AL, Creasman WT. Epithelial ovarian tumors of low malignant potential. Obstet Gynecol 1991;78:1027-32.
022 Balasch J, Peñarrubia J, Márquez M, et al. Ovulation side and ovarian cancer. Gynecol Endocrinol 1994;8:51-4.
023 Hodgen GD. The dominant ovarian follicle. Fertil Steril 1982;38:281-300.
024 Werlin LB, Wecksterin L, Weathersbee PS, et al. Ultrasound: a technique useful in determining the side of ovulation. Fertil Steril 1986;46:814-7.
025 Check JH, Dietterich C, Houck MA. Ipsilateral versus contralateral ovary selection of dominant follicle in succeeding cycle. Obstet Gynecol 1991;77:247-9.
026 Atlas M, Menczer J. Massive hyperstimulation and borderline carcinoma of the ovary. A possible association. Acta Obstet Gynecol Scand 1982;61:261-3.
027 Bamford PM, Steele SJ. Uterine and ovarian carcinoma in a patient receiving gonadotrophin therapy -case report. Br J Obstet Gynaecol 1982;89:962-4.
028 Ben-Hur H, Dgani R, Lancet M, Katz F, Nissim F, Rosenman D. Ovarian carcinoma masquerading as ovarian hyperstimulation syndrome. Acta Obstet Gynecol Scand 1986;65:813-4.
029 Carter ME, Joyce DN. Ovarian carcinoma in a patient hyperstimulated by gonadotrophin therapy for in vitro fertilization: A case report. J in vitro Fert Embryo Transfer 1987;4:126-8.
030 Kulkarni R, McGarry JM. Follicular stimulation and ovarian cancer. Br Med J 1989;299:740.
031 Dietl J. Ovulation and ovarian cancer. Lancet 1991;338:445.
032 Goldberg GL, Runowicz CD. Ovarian carcinoma of low malignant potential, infertility, and induction of ovulation-Is there a link? Am J Obstet Gynecol 1992;166:853-4.
033 Balasch J, Barri PN. Follicular stimulation and ovarian cancer? Hum Reprod 1993;8:990-996.
034 Burger CW, Nijman HW, Baak JPA, et al. Borderline tumor of the ovary and controlled ovarian hyperstimulation: a report of two cases. Hum Reprod 1993;8 supl.1:144.
035 Lopes P, Mensier A. Ovarian cancer and assisted reproduc-tive technology. Eur J Obstet Gynecol Reprod Biol 1993; 51:171-3.
036 Karlan BY, Marrs R, Lagasse LD. Advanced-stage ovarian carcinoma presenting during infertility evaluacion. Am J Obstet Gynecol 1994;171:1377-8.
037 Grimbizis G, Tarlatzis BC, Bentis J, et al. Two cases of ovarian tumors in women who had undergone multiple ovarian stimulation attempts. Hum Reprod 1993;10:520-3.
038 Salle B, de Saint Hilaire P, Devouassoux M, et al. Another two cases of ovarian tumours in women who had undergone multiple ovulation induction cycles. Hum Reprod 1997;12:1732-5.
039 Unkila-Kallio L, Leminen A, Titinen A, et al. Malignant tumors of the ovary or the breast in association with infertility: a report of thirteen cases. Acta Obstet Gynecol Scand 1997;76:177-81.
040 Lappöhn RN, Burger HG, Bouma J, et al. Inhibin as a marker for granulosa-cell tumours. N Engl J Med 1989; 321:790-3.
041 Willemsen W, Kruitwagen R, Bastiaans B, et al. Ovarian stimulation and granulosa-cell tumour. Lancet 1993;341:986-8.
042 Trimble EL, Trimble CL. Epithelial ovarian tumors of low malignant potential. In Markman M and Hoskins WJ (eds.). Cancer of the Ovary, New York: Raven Press; 1993. p. 415-29.
043 Mosgaard BJ. Fertility drugs and risk of borderline ovarian cancer: a review. Assist Reprod 1999;9:13-6.
044 Huppert LC. Induction of ovulation with clomiphene citrate. Fertil Steril 1979;31:1-8.
045 Wu CH. Plasma hormones in clomiphene citrate therapy. Obstet Gynecol 1977;49:443-8.
046 International Agency for Research on Cancer. Clomiphene citrate (group 3). A. Evidence for carcinogenicity to humans. In: IARC monographs on the evaluation of carcinogenic risks to humans, Suppl. 7. Lyon, France: IARC, 1987. p.172-3.
047 Harlap S. The epidemiology of ovarian cancer. In Markman M and Hoskins WJ (eds.). Cancer of the Ovary, New York: Raven Press; 1993. p. 79-93.
048 Stouffer RL, Grodin MS, Davis JR, Surwit EA. Investigation of binding sites for follicle stimulating hormone and chorionic gonadotropin in human ovarian cancers. J Clin Endocrinol Metab 1984;59:441-6.
049 Graves PE, Surwit EA, Davis JR, Stouffer RL. Adenylate cyclase in human ovarian cancers: sensitivity to gonadotropins and nonhormonal activators. Am J Obstet Gynecol 1985;153: 877-82.
050 Nakano R, Kitamaya S, Yamoto M, Shima K, Ooshima A. Localization of gonadotropin binding sites in human neoplasms. Am J Obstet Gynecol 1989;161:905-10.
051 Rao BR, Slotman BJ. Endocrine factors in common epithelial ovarian cancer. Endocrin Rev 1991;12:14-26.
052 Scott JS. How to induce ovarian cancer: and how not to. Br Med J 1984;289:781-2.
053 Langley FA, Fox H. Ovarian tumors: classification, histogene-sis and etiology. In Fox H (ed.), Obstetrical and Gynecological Pathology. London: Churchill Livingston; 1987; p. 542-55.
054 Dickersin K. The existence of publication bias and risks factors for its outcome. JAMA 1990;263:1385-9.
055 Food and Drug Administration. FDA asks for fertility drug labeling change. FDA Talk Paper, January 13, 1993.
056 Kaufman SC, Spirtas R, Alexander NJ. Do fertility drugs cause ovarian tumors? J Women''s Health 1995;4:247-59.
057 Marrs RP, Hartz SC. Comments on the possible association between ovulation inducing agents and ovarian cancer. The American Fertility Society, Birmingham, Alabama, January 1993.
058 Lopes P, Julou V, Mensier A, Garnier JM, Laborde O, Sagot P, L''Hermite A, Jean M, Barriere P. Cancer de l''ovaire et procrea-tion medicalement assistee. Contracept Fertil Sex 1992;20:797-8.
059 Unkila-Kallio L, Leminen A, Tiitinen A, et al. Nationwide data on falling incidence of ovarian granulosa cell tumours concomitant with increasing use of ovulation inducers. Hum Reprod 1998;13:2828-30.
060 Ron E, Lunenfeld B, Menczer J, Blumstein T, Katz L, Oelsner G, Serr D. Cancer incidence in a cohort of infertile women. Am J Epidemiol 1987;125:780-90.
061 Modan B, Ron E, Lerner-Geva L, Blumstein T, Menczer J, Rabinovi-ci J, et al. Cancer incidence in a cohort of infertile women. Am J Epidemiol 1998;147:1038-42.
062 Potashnik G, Lerner-Geva L, Genkin L, Chetrit A, Lunenfeld E, Porath A. Fertility drugs and the risk of breast and ovarian cancers: results of a long-term follow-up study. Fertil Steril 1999;71:853-9.
063 Rossing MA, Daling JR, Weiss N, Moore D, Self S. Ovarian tumors in a cohort of infertile women. N Engl J Med 1994; 331:771-6.
064 Venn A, Watson L, Lumley J, Giles G, King C, Healy D. Breast ann ovarian cancer incidence after infertility and in vitro fertilisation. Lancet 1995;346:995-1000.
065 Venn A, Watson L, Bruinsma F, Giles G, Healy D. Breast, ovarian and uterine cancer in 29700 Australian IVF patients. In Towards Reproductive Cetainty, edited by R. Jansen and D. Mortimer. New York: The Parthenon Publishing Group; 1999. p. 109-15.
066 Harris R, Whittemore AS, Itnyre J, and the Collaborative Ovarian Cancer Group. Characteristics relating to ovarian cancer risk: collaborative analysis of 12 US case-control studies. III. Epithelial tumors of low malignant potential in white women. Am J Epidemiol 1992;136:1204-11.
067 Shu XO, Brinton LA, Gao YT, Yuan JM. Population-based case-control study of ovarian cancer in Shangai. Cancer Res 1989;49:3670-4.
068 Horn-Ross PL, Whittemore AS, Harris R, et al. Characteristics relating to ovarian cancer risk: collaborative analysis of 12 US case-control studies. VI. Nonepithelial cancers among adults. Collaborative Ovarian Cancer Group. Epidemiology 1992;3:490-5.
069 Franceschi S, La Vecchia C, Negri E, et al. Fertility drugs and risk of epithelial ovarian cancer in Italy. Hum Reprod 1994; 9:1673-5.
070 La Vecchia C, Negri E, Parazzini F, et al. Fertility drugs and breast and ovarian cancer. Lancet 1995;346:1628.
071 Parazzini F, Negri E, La Vecchia C, et al. Treatment for infertility and risk of invasive epithelial ovarian cancer. Hum Reprod 1997;12:2159-61.
072 Parazzini F, Negri E, La Vecchia C, et al. Treatment for fertility and risk of ovarian tumors of borderline malignancy. Gynecol Oncol 1998;68:226-8.
073 Shushan A, Paltiel O, Iscovich J, Elchalal U, Peretz T, Schenker J. Human menopausal gonadotropin and the risk of epithelial ovarian cancer. Fertil Steril 1996;65:13-8.
074 Mosgaard BJ, Lidegaard O, Kjaer SK, Schou G, Andersen AN. Infertility, fertility drugs and invasive ovarian cancer: a case-control study. Fertil Steril 1997;67:1005-1