El objetivo de este estudio es evaluar los factores relacionados con la presencia de tumor residual, después de tumorectomía por cáncer de mama y así poder determinar la óptima distancia tumor-margen de resección que nos garantice la ausencia de enfermedad residual.
Material y métodosSe revisaron retrospectivamente las historias clínicas de 118 pacientes con cáncer de mama, intervenidas inicialmente con tumorectomía en nuestro servicio, durante el período comprendido entre junio de 2004 y diciembre de 2006.
Los parámetros analizados fueron: edad, palpabilidad, método diagnóstico, tipo de cirugía inicial y definitiva, tipo histológico, tamaño, invasión vasculolinfática, grado, componente intraductal extenso (CIE), receptores de estrógenos (RE), márgenes quirúrgicos, rescisión y existencia de tumor residual.
ResultadosSe demostró tumor residual en el 27%. En el análisis univariante de las variables analizadas, sólo han sido estadísticamente significativas, en relación con la presencia de tumor residual, los márgenes (p = 0,015), el CIE (p = 0,026) y el tamaño (p = 0,025). En el análisis de regresión lineal simple sólo lo fueron los márgenes (p = 0,008) y el CIE (p = 0,025).
ConclusionesConsideramos suficiente para garantizar la ausencia de tumor residual una distancia mínima de 2 mm si no hay CIE. En pacientes con márgenes ≤ 2 mm, la presencia de CIE es una indicación de alto riesgo de enfermedad residual.
To evaluate which factors are related to the presence of residual tumor after lumpectomy for breast cancer with a view to determining the excisional biopsy margins that guarantee a complete excision.
Material and methodsThe records of 118 women with invasive breast carcinoma who were treated with lumpectomy in our service between June 2004 and December 2006 were retrospectively reviewed. The parameters evaluated were age, palpability, diagnostic method, type of initial and definitive surgery, histologic type, tumor size, lymphovascular invasion, presence/absence of extensive intraductal component (EIC), estrogen receptors, surgical margins, reexcision, and the presence of residual tumor.
ResultsResidual disease was found in 27%. In the univariate analysis, only margins (P=.015), EIC (P=.026) and size (P=.025) were significantly associated with the presence of residual tumor. With simple lineal regression analysis, only margins (P=.008) and EIC (P=.025) showed a significant association.
ConclusionsWe believe that a minimum margin of 2 mm is enough to guarantee the absence of residual breast cancer if there is no EIC. In patients with margins ≤ 2 mm, the presence of EIC is an indication of high risk of residual disease.
La cirugía mamaria conservadora seguida de radioterapia, para pacientes adecuadamente seleccionadas, es la opción terapéutica estándar para el carcinoma de mama en estadios I y II, pues se ha demostrado una supervivencia a los 5 años del 73 al 93%, cifras similares a las obtenidas con la cirugía radical. La tasa de recidiva local a los 5 años varía entre el 2 y el 13% para las 2 modalidades1.
La recidiva local temprana se atribuye a la persistencia de enfermedad residual tras la cirugía conservadora, dado que la mayoría de las recurrencias ocurren antes de los 5 años, en el lugar de la escisión previa, y son del mismo tipo histológico o similar que el tumor primario2.
Existe consenso acerca de que el factor más importante del control local de la enfermedad es la obtención de márgenes libres de tumor, pero en algunos estudios se demuestra existencia de tumor residual en casos con márgenes libres3.
El objetivo de este estudio es el análisis de la prevalencia de tumor residual tras las tumorectomías practicadas en pacientes con cáncer de mama para poder establecer cuál es la distancia del tumor al margen que nos garantice la ausencia de enfermedad residual y así evitar nuevas reintervenciones.
MATERIAL Y MÉTODOSSe revisaron de forma retrospectiva los datos pertenecientes a 118 pacientes con carcinoma de mama y que fueron tratadas en principio mediante cirugía conservadora en el Servicio de Cirugía del Complexo Hospitalario Xeral-Calde de Lugo, durante el período comprendido entre junio de 2004 y diciembre de 2006.
Se ha excluido a las pacientes tratadas con quimioterapia neoadyuvante.
Se analizaron las siguientes variables: edad, palpabilidad tumoral, método diagnóstico, tipo de cirugía inicial, tipo de cirugía definitiva, tipo histológico, tamaño tumoral, invasión vasculolinfática, grado tumoral, componente intraductal extenso (CIE), receptores de estrógenos (RE), márgenes quirúrgicos, reescisión en función del estado de los márgenes y existencia de tumor residual.
Se realizó una ampliación de bordes durante el primer tiempo quirúrgico, en función de la distancia del margen quirúrgico libre de tumor (cuando era<5mm), del examen radiológico de la pieza quirúrgica o ante la sospecha macroscópica de tumor residual.
La indicación de reescisión en un segundo tiempo se indicó cuando la distancia del margen libre de tumor era<2mm, tras el informe definitivo de anatomía patológica.
Se realizó un análisis de la presencia de tumor residual en función del estado de los márgenes (afectados, libres con una distancia<2mm, libres con una distancia entre 2 y 5mm y libres con una distancia>5mm), edad, palpabilidad, tamaño, tipo histológico, invasión vasculolinfática, grado histológico, existencia de CIE y RE.
El análisis estadístico se realizó con el programa SPSS 12.0, utilizando la prueba de la χ2 para el análisis de las variables cualitativas, la prueba de la t de Student para variables numéricas y regresión lineal simple.
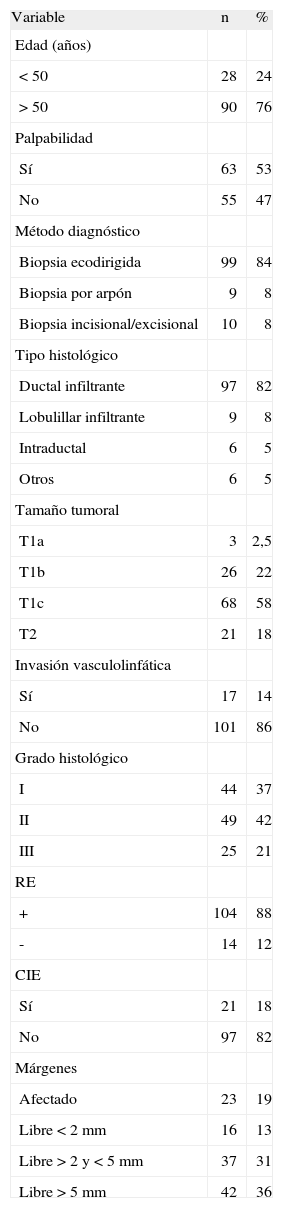
RESULTADOSLa media de edad fue de 60 años (rango: 32–85). Las características de las variables analizadas se resumen en tabla 1.
Variables analizadas
| Variable | n | % |
| Edad (años) | ||
| < 50 | 28 | 24 |
| > 50 | 90 | 76 |
| Palpabilidad | ||
| Sí | 63 | 53 |
| No | 55 | 47 |
| Método diagnóstico | ||
| Biopsia ecodirigida | 99 | 84 |
| Biopsia por arpón | 9 | 8 |
| Biopsia incisional/excisional | 10 | 8 |
| Tipo histológico | ||
| Ductal infiltrante | 97 | 82 |
| Lobulillar infiltrante | 9 | 8 |
| Intraductal | 6 | 5 |
| Otros | 6 | 5 |
| Tamaño tumoral | ||
| T1a | 3 | 2,5 |
| T1b | 26 | 22 |
| T1c | 68 | 58 |
| T2 | 21 | 18 |
| Invasión vasculolinfática | ||
| Sí | 17 | 14 |
| No | 101 | 86 |
| Grado histológico | ||
| I | 44 | 37 |
| II | 49 | 42 |
| III | 25 | 21 |
| RE | ||
| + | 104 | 88 |
| - | 14 | 12 |
| CIE | ||
| Sí | 21 | 18 |
| No | 97 | 82 |
| Márgenes | ||
| Afectado | 23 | 19 |
| Libre < 2 mm | 16 | 13 |
| Libre > 2 y < 5 mm | 37 | 31 |
| Libre > 5 mm | 42 | 36 |
En relación con el tipo de cirugía inicial, se practicó tumorectomía, biopsia de ganglio centinela y linfadenectomía axilar en el 48% (n=57), tumorectomía y linfadenectomía axilar en el 19% (n=22), tumorectomía y biopsia de ganglio centinela en el 16% (n=19) y tumorectomía en 17% (n=20). Se realizó una biopsia peroperatoria de la pieza de tumorectomía en 82% de los casos (n=97) y la ampliación de márgenes en el primer tiempo quirúrgico se llevó a cabo en el 37% (n=44).
En relación con la cirugía definitiva, fue necesario practicar un mastectomía en el 14% (n=17) y en el 46% (n=54) no se realizó ningún gesto de ampliación de bordes tras la tumorectomía inicial, por lo que son sólo 64 pacientes (54%) las que entran a formar parte del análisis de existencia de tumor residual en función de otros parámetros.
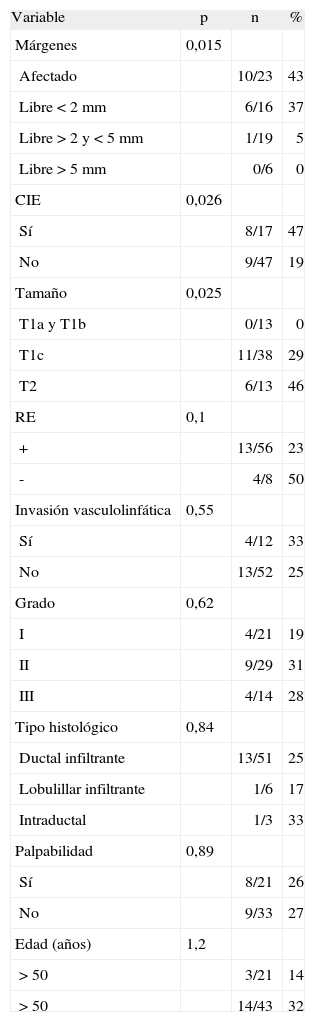
Se encontró un tumor residual en 17 (27%) de estas 64 pacientes. En 47% (8/17) la enfermedad residual se componía de un componente in situ del mismo tipo histológico que el de la biopsia inicial. En la tabla 2 se resume la prevalencia de enfermedad residual en función de otros parámetros. Se puede observar que las variables analizadas que se relacionan de modo estadísticamente significativo con la presencia de tumor residual son el estado de los márgenes, el CIE y el tamaño tumoral. Al realizar un análisis de regresión lineal simple, incluidas las variables estadísticamente significativas en el análisis univariante, encontramos que sólo se asociaron de modo significativo con la presencia de tumor residual el estado de los márgenes (p=0,008) y el CIE (p=0,025) (tabla 3). Tal como se observa en dicha tabla, existe un caso de tumor residual dentro del grupo de pacientes con márgenes≥2 y≤5mm y CIE presente. Se trataba de una paciente de 60 años, con carcinoma ductal infiltrante de 2,5cm, de grado II, CIE presente, RE positivos y con varios focos de carcinoma in situ a 2mm de un borde de resección.
Prevalencia de enfermedad residual en función de otras variables
| Variable | p | n | % |
| Márgenes | 0,015 | ||
| Afectado | 10/23 | 43 | |
| Libre < 2 mm | 6/16 | 37 | |
| Libre > 2 y < 5 mm | 1/19 | 5 | |
| Libre > 5 mm | 0/6 | 0 | |
| CIE | 0,026 | ||
| Sí | 8/17 | 47 | |
| No | 9/47 | 19 | |
| Tamaño | 0,025 | ||
| T1a y T1b | 0/13 | 0 | |
| T1c | 11/38 | 29 | |
| T2 | 6/13 | 46 | |
| RE | 0,1 | ||
| + | 13/56 | 23 | |
| - | 4/8 | 50 | |
| Invasión vasculolinfática | 0,55 | ||
| Sí | 4/12 | 33 | |
| No | 13/52 | 25 | |
| Grado | 0,62 | ||
| I | 4/21 | 19 | |
| II | 9/29 | 31 | |
| III | 4/14 | 28 | |
| Tipo histológico | 0,84 | ||
| Ductal infiltrante | 13/51 | 25 | |
| Lobulillar infiltrante | 1/6 | 17 | |
| Intraductal | 1/3 | 33 | |
| Palpabilidad | 0,89 | ||
| Sí | 8/21 | 26 | |
| No | 9/33 | 27 | |
| Edad (años) | 1,2 | ||
| > 50 | 3/21 | 14 | |
| > 50 | 14/43 | 32 |
CIE: componente intraductal extenso; RE: receptores deestrógenos
No existe un consenso acerca de cuál es la distancia óptima entre el margen de resección y el tumor que garantice la ausencia de tumor residual, pues existen estudios anatomopatológicos de piezas de mastectomía que demuestran la presencia de cáncer residual a una distancia>2cm del lecho tumoral primario en más del 25% de los casos4,5. Existen varios factores que parecen ser los causantes de las discrepancias entre la distancia de los márgenes libres de tumor y la presencia o ausencia de tumor residual. Se ha confirmado en algunos estudios, aunque no en otros, que el riesgo de carcinoma residual y, por tanto, de recurrencia local se relaciona con la edad joven, mayor tamaño tumoral, carcinoma lobulillar, alto grado histológico, invasión vasculolinfática, RE negativos, mutación BRCA 1–2 y CIE1,2,4,6–8.
Los márgenes negativos parecen ser el marcador más seguro de mínima enfermedad residual tras la tumorectomía. No existe un acuerdo en la definición de«margen negativo». La magnitud de esta distancia varía de unos autores a otros: 1mm2, pasando por 2mm4,7,9,10, que es la más comúnmente aceptada, hasta 5mm11.
Es evidente la alta incidencia de tumor residual en pacientes con márgenes afectados: el 43% en nuestro estudio y el 30–71 % en la literatura científica9,12, así como en pacientes con márgenes próximos<2mm (41% en nuestro estudio y 7-41% en la literatura científica2). Para las pacientes con márgenes>2mm, el riesgo de enfermedad residual oscila entre 0-26%4,13 (0% en nuestra casuística, dado que aunque hay un caso de tumor residual dentro del grupo≥2 y≤5mm, la distancia era de 2mm).
Otro predictor de enfermedad residual es la presencia de CIE (47% si presente frente a 19% si ausente). Estos valores son equiparables a los aportados por otros autores: el 82 frente al 31%4, el 55 frente al 0%14 y el 67 frente al 12%15.
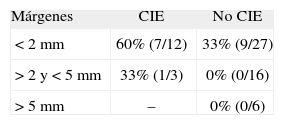
La asociación de márgenes positivos o próximos con la existencia de CIE aumenta considerablemente el riesgo de enfermedad residual (el 60% [CIE] frente al 33% [no CIE] para márgenes positivos o próximos y el 33% [CIE] frente al 0% [no CIE] para márgenes negativos). En la serie de Smitt et al7, la incidencia de tumor residual en pacientes con márgenes próximos varía del 11% (CIE ausente) al 38% (CIE presente).
No está claro si el CIE es un predictor de recidiva local cuando se consiguen márgenes negativos. Lo que está claro es que el riesgo de recidiva local con CIE presente disminuye con el aumento de volumen de tejido resecado4. En un estudio del Joint Center for Radiation Therapy16 la presencia de CIE fue predictivo de recidiva local para pacientes con márgenes positivos, pero no para pacientes con márgenes negativos o próximos (el 37 frente al 0%).
En varios estudios se demuestra que la edad joven es un indicador pronóstico de enfermedad residual y de recidiva local7,8, pero en otros no se observa ninguna asociación11, al igual que tampoco se halló en nuestra casuística. En el estudio de Smitt et al7, la edad es un importante factor pronóstico de enfermedad residual, de tal modo que en pacientes con CIE presente el riesgo varía entre el 79% (menores de 50 años) y el 40% (mayores de 65 años). En pacientes con CIE ausente varía desde un 27% (menores de 50 años) a un 10% (mayores de 65 años). Wazer et al18 encontraron que pacientes menores de 45 años con márgenes próximos tienen el mismo riesgo de recidiva que pacientes con márgenes negativos y, sin embargo, pacientes mayores de 45 años con márgenes positivos tienen la misma frecuencia de recidiva que pacientes con márgenes negativos.
De menor importancia, en relación con el riesgo de carcinoma residual y al igual que en la literatura científica revisada, son el resto de las variables analizadas. Aunque el tamaño tumoral fue estadísticamente significativo en el análisis univariante (p=0,025), no lo fue en el multivariante (p=0,08) y el factor RE, aunque no fue estadísticamente significativo, estuvo cerca de alcanzar la significación (p=0,1 en ambos análisis).
Como conclusiones de este estudio destacamos:
- −
Un margen>2mm podría ser un margen adecuado de seguridad en la cirugía conservadora por cáncer de mama.
- −
El CIE es un indicador de alto riesgo de enfermedad residual en pacientes con márgenes próximos o afectados.