La endometriosis es una patología ginecológica crónica de causa desconocida caracterizada por la presencia de tejido endometrial (epitelio glandular y estroma), funcionalmente activo, fuera de la cavidad uterina, que induce una reacción inflamatoria crónica.
EpidemiologíaAfecta al 5-10% de las mujeres en edad reproductiva, aunque si se considera de forma aislada la población de pacientes con dolor pélvico, las cifras oscilan del 40 al 60%, mientras que entre las pacientes que presentan subfertilidad el porcentaje de endometriosis alcanza el 20-40%1. La incidencia máxima se observa entre los 30 y los 45 años de edad.
EtiologíaDiversas teorías tratan de explicar el desarrollo y la progresión de la endometriosis. Sin embargo, ninguna teoría por sí sola puede explicar todos los aspectos de este trastorno.
Existen 3 grupos de teorías sobre la etiología de la endometriosis1:
- 1.
Teoría de la implantación: de acuerdo con esta teoría, postulada por Sampson, la endometriosis es la consecuencia de la implantación y el crecimiento en el peritoneo y ovario, de fragmentos de tejido endometrial que migran de forma retrógrada durante la menstruación a través de las trompas de Falopio. Esta teoría es la que mejor explica la gran mayoría de los casos. No obstante, la menstruación retrógrada se observa en el 90% de las mujeres, sugiriendo factores adicionales y una susceptibilidad que depende de una compleja interacción de factores genéticos, inmunológicos, hormonales y medioambientales.
- 2.
Teoría de la inducción: la endometriosis es el resultado de la diferenciación a partir de células mesenquimales presentes en el tejido conectivo, activadas (inducidas) por sustancias liberadas por el endometrio degenerado que llega a la cavidad abdominal.
- 3.
Teoría del desarrollo in situ: según esta teoría, el endometrio ectópico se desarrolla «in situ» a partir de los tejidos locales, incluyendo el epitelio germinal del ovario, restos de los conductos de Wolff y Müller, y a partir de células pluripotenciales presentes en la serosa peritoneal. Aunque esta teoría no es la que mejor explica la enfermedad, sí es válida para casos de localizaciones atípicas o prepúberes.
El tratamiento y el pronóstico de la endometriosis están predeterminados por la gravedad de la enfermedad. Por este motivo, es necesario disponer de un sistema de clasificación homogéneo que tenga en cuenta la distribución y la intensidad de dicha afectación. Puesto que la endometriosis es una enfermedad de la que no se conoce con exactitud su fisiopatología, actualmente no se ha logrado una clasificación ideal, lo cual sigue siendo objeto de discusión.
La clasificación más empleada es la expuesta por la American Fertility Society (AFS) en 1979, revisada en 1985 y posteriormente en 1996. Esta clasificación divide la endometriosis en leve, moderada, severa y extensa, valorando la presencia de implantes y/o adherencias a peritoneo, ovarios o trompas2. Esta clasificación, no obstante, no hace referencia al dolor pélvico ni a las posibles recurrencias o implantes a distancia del aparato genital y no tiene valor pronóstico a nivel reproductivo o de la enfermedad en sí.
De hecho, la severidad de la enfermedad puede ser descrita de forma cuantitativa según el número y el tamaño de las lesiones, sin que exista correlación entre el tipo y la severidad de los síntomas dolorosos, mientras que la profundidad de la infiltración de los implantes endometriósicos sí está relacionada con el tipo y la gravedad de los mismos.
Por ello, en la década de los años 90 del siglo pasado, se describieron clasificaciones que tenían en cuenta el grado de infiltración de la enfermedad en diferentes localizaciones o compartimentos de la pelvis (compartimento posterior con afectación de los ligamentos uterosacros, vagina, intestino o compartimento anterior afectando a la vejiga)3-5.
De forma práctica, es importante identificar a las pacientes con endometriosis profunda del resto. Estas pacientes con endometriosis profunda pueden presentar localizaciones que tengan trascendencia clínica, de tratamiento y seguimiento, como las endometriosis ureterales, intestinales o vesicales, a diferencia de las pacientes con endometriosis superficial o endometriomas ováricos aislados.
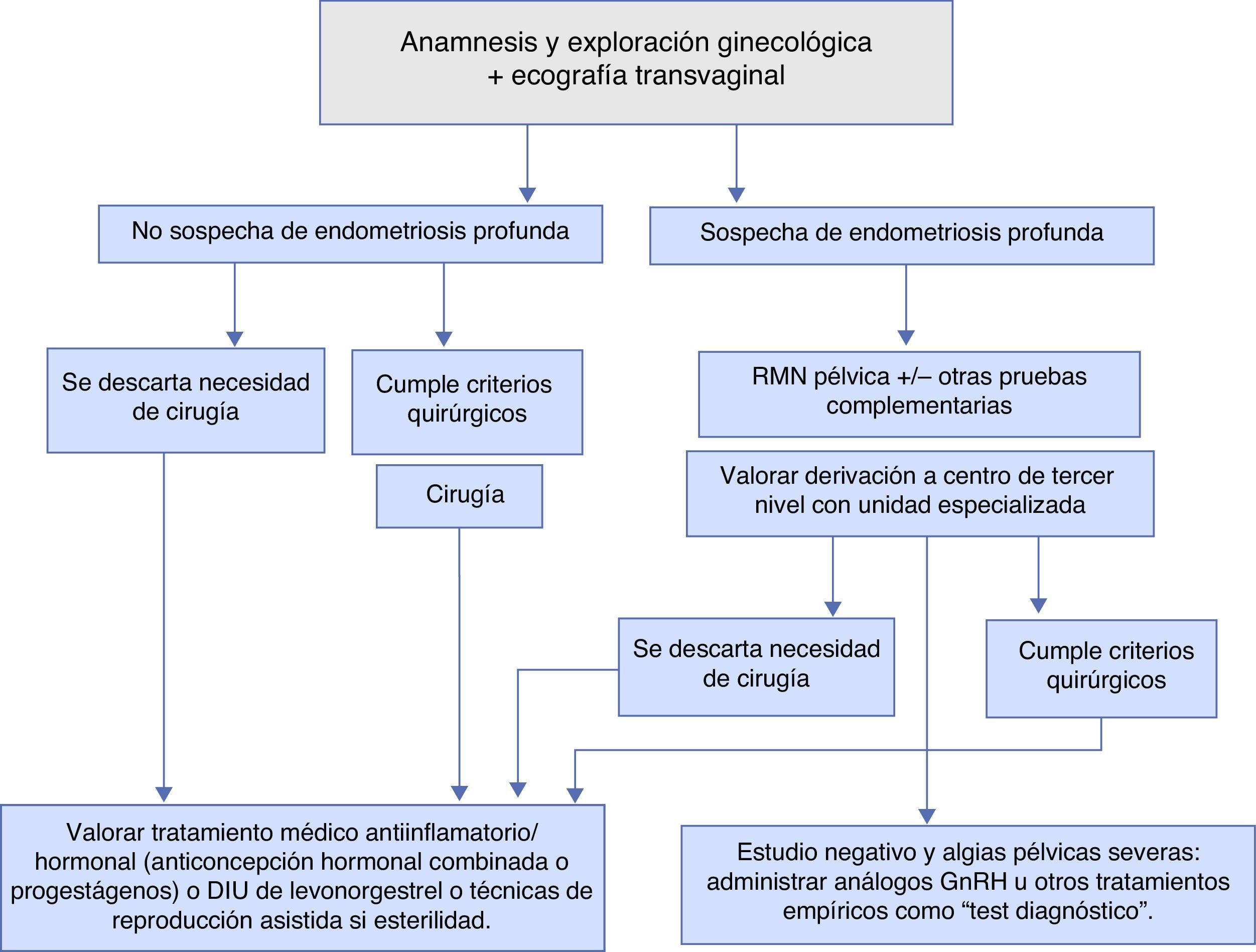
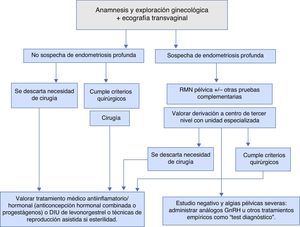
Diagnóstico (fig. 1)El diagnóstico de la enfermedad y su estadificación son fundamentales para poder realizar una correcta toma de decisiones referentes al tratamiento y seguimiento a realizar. En ocasiones, el diagnóstico será de sospecha y, actualmente, no se requiere estudio histopatológico y/o visión directa de los implantes para iniciar tratamiento médico o realizar técnicas de reproducción asistida (TRA)6,7.
Diagnóstico clínico7-9Establecer el diagnóstico de endometriosis sobre la base solo de los síntomas dolorosos es difícil, porque la presentación es muy variable y existe un solapamiento con otras condiciones, como el síndrome del intestino irritable o la enfermedad pélvica inflamatoria, u otras enfermedades digestivas o ginecológicas, lo que puede conllevar a un retraso de varios años en el diagnóstico definitivo. Se han descrito demoras de más de 10 años entre la aparición de los síntomas y el diagnóstico definitivo. Además, un elevado porcentaje de mujeres son asintomáticas (se estiman entre el 15-30% de las mujeres con endometriosis). Algunas de las pacientes con algias pélvicas y síntomas dolorosos presentarán esterilidad asociada. Otras pacientes presentarán esterilidad aislada sin otros síntomas asociados.
El síntoma principal y más frecuente es el dolor pélvico cíclico, que adopta diferentes patrones: dismenorrea severa (75%), que suele ser progresiva y bilateral; dispareunia intensa (44%); dolor pélvico crónico (70%); dolor limitado a la ovulación, y/o disquecia.
Estos síntomas alrededor de la menstruación pueden asociarse a sangrado anormal o a síntomas intestinales y vesicales, a infertilidad y/o a fatiga crónica. A pesar de la poca especificidad de los síntomas, la combinación de alguno de ellos con dismenorrea severa o bien la presencia de síntomas no ginecológicos con claro empeoramiento o comienzo catamenial (rectorragia, hematuria, disquecia, dificultad de vaciado vesical o síndrome miccional, dolor pleural catamenial con o sin neumotórax asociado, etc.), deben considerarse síntomas guía que nos deben hacer sospechar la presencia de endometriosis profunda y derivar a la paciente a centros de referencia que permitan diagnosticar correctamente a la paciente y tratarla de forma multidisciplinar.
Aunque la intensidad del dolor, generalmente, no se correlaciona con la extensión o el estadio de la enfermedad, en la enfermedad profunda o infiltrante sí se asocia a la profundidad de infiltración de las lesiones, coexistiendo un dolor severo, intenso y a menudo persistente cuando la infiltración en profundidad del peritoneo es mayor o igual a 5mm. En las pacientes que presentan una intensidad del dolor elevada se debe sospechar la presencia de endometriosis profunda, por lo que la estadificación de la enfermedad es especialmente importante en este subgrupo de pacientes.
Exploración física6-9Los hallazgos exploratorios más frecuentes en pacientes con endometriosis son la palpación de pelvis dolorosa, útero fijo en retroversión, ligamentos uterosacros dolorosos y el aumento de tamaño de los ovarios. Los signos más específicos de endometriosis son la palpación de nódulos infiltrativos profundos en los ligamentos uterosacros o el fondo de saco de Douglas y la visualización directa de lesiones características en el fondo vaginal o el retrocérvix. Sin embargo, en muchas ocasiones, la exploración puede ser normal. En pacientes con endometriosis del tabique rectovaginal, el tacto rectal puede ayudar a diagnosticar la enfermedad y conocer el grado de afectación de la pared rectal.
El rendimiento de la exploración clínica puede mejorarse si esta se efectúa durante la menstruación (NE: IV-C).
Laparoscopia diagnóstica6-9El papel de la laparoscopia y del tratamiento médico en el diagnóstico de la endometriosis está cambiando en la actualidad. Hoy en día no es necesario tener una laparoscopia con imágenes indicativas de endometriosis y estudio histopatológico confirmatorios para administrar tratamiento médico de la endometriosis6,7. La laparoscopia ha sido considerada durante décadas de elección para el diagnóstico de la endometriosis (NE: IV-C). La visualización de los implantes y, en caso de duda la toma de biopsia, han constituido clásicamente las bases del diagnóstico (NE: IV-C).
La visualización laparoscópica suele ser adecuada para el diagnóstico en la endometriosis peritoneal superficial, pero la confirmación histológica de al menos una de las lesiones es ideal. Sin embargo, es preceptiva la confirmación histológica en los casos de endometriosis ovárica y profunda. La histología positiva confirma el diagnóstico pero un resultado negativo no la excluye. Asimismo, hay que tener en cuenta la llamada «endometriosis fisiológica», identificada como implantes peritoneales sin repercusión clínica de ningún tipo que puede hallarse en laparoscopias realizadas con otras indicaciones quirúrgicas. Hay que tener en cuenta que la laparoscopia visualiza de manera óptima la cavidad peritoneal, pero va a infravalorar los nódulos profundos retroperitoneales o nódulos ocultos tras adherencias, y además, no va a permitir estimar el grado de infiltración en los órganos afectos en aquellos casos de endometriosis intestinal, de vías urinarias, etc.
Por todo ello, la utilidad de la laparoscopia diagnóstica en pacientes con endometriosis es muy escasa desde un punto de vista de coste-eficacia, por tanto, no se recomienda realizar una laparoscopia solo con fines diagnósticos y, si se encuentra enfermedad, deberá tratarse en ese acto quirúrgico (NE: Ia-A). Así pues, la tendencia actual es evitar las laparoscopias diagnósticas debido a la alta sensibilidad y especificidad de las exploraciones complementarias que se detallan a continuación, combinadas con la anamnesis y la exploración física. De esta manera, cuando se propone la realización de una laparoscopia en la paciente con sospecha de endometriosis, se aconseja que sea quirúrgica en el mismo acto operatorio. Solo se debería realizar una laparoscopia exploradora cuando las pruebas de imagen sean negativas y el tratamiento médico empírico falla, y hay que llegar a un diagnóstico para orientar el tratamiento y el seguimiento de la paciente.
Exploraciones complementarias6,7,9,10Para decidir el tipo de tratamiento médico, quirúrgico o combinado y el seguimiento a realizar en las pacientes con endometriosis, es fundamental realizar una correcta estadificación de la enfermedad y sobre todo diagnosticar a las pacientes con endometriosis profunda. La estadificación va a permitir conocer el grado de extensión de la enfermedad y los órganos que involucra para poder planificar cirugías complejas multidisciplinares y manejo conjunto con otros especialistas en las pacientes con afectación del tracto urinario y/o aparato digestivo, etc. Las diferentes pruebas complementarias consiguen hoy en día una estadificación muy precisa, sin la necesidad de realizar laparoscopias diagnósticas en la gran mayoría de las pacientes.
La ecografía ginecológica es una prueba asequible y de gran utilidad para diagnosticar o descartar la endometriosis ovárica y, además, en los últimos años, ha adquirido una gran sensibilidad y especificidad para el diagnóstico de la endometriosis profunda y su extensión. Esta prueba puede realizarse a toda paciente en la que se sospeche endometriosis al poderse realizar por ginecólogos y en cualquier centro. La ecografía transvaginal en 3D también es útil para valorar la endometriosis profunda pélvica extragenital. En las pacientes que se sospeche endometriosis profunda por la severidad de los síntomas o por la presencia de síntomas guía de afectación de otros órganos pélvicos, o por la presencia de endometriomas ováricos bilaterales adheridos entre sí y a la cara posterior uterina («kissing ovarios»), debe valorarse la realización de una resonancia magnética pélvica (RMN), además de la ecografía transvaginal para estadificar la enfermedad (NE: IIa-B).
La RMN pélvica identifica de forma precisa los endometriomas ováricos y es de especial interés en la valoración de los implantes de endometriosis retroperitoneal, y la extensión y el grado de infiltración de los mismos. Hoy en día, la RMN pélvica y la ecografía transvaginal se consideran pruebas diagnósticas y de estadificación de la enfermedad complementarias entre ellas (NE: IIa-B).
En función de la sospecha clínica y el resultado de las pruebas complementarias de afectación de diferentes órganos, se debe individualizar la realización de otras pruebas complementarias, como: la ecoendoscopia transanal para valorar nódulos intestinales rectales, de sigma o rectosigma, y su grado de infiltración en la pared intestinal; la colonoscopia, si se sospecha afectación de la mucosa del intestino grueso en cualquiera de sus tramos; el enema opaco y el tránsito intestinal, si se sospecha afectación intestinal múltiple y/o las pruebas de valoración intestinal citadas previamente son poco concluyentes; la cistoscopia, si se sospecha afectación de la mucosa vesical; la urografía endovenosa, si se sospecha afectación ureteral y/o vesical, con posible afectación del parénquima renal; la entero-RMN, en sospecha de afectaciones de intestino delgado y/o apéndice; la RMN abdominal, si se sospechan lesiones abdominal no pélvicas; renograma, si hay hidronefrosis asociada, y la RMN torácica (implantes pleurales) o craneal (implantes meníngeos), etc.
Los niveles en suero del marcador tumoral CA-125 están elevados en patologías malignas, pero también en pacientes con endometriosis. Actualmente, no se considera que su determinación tenga valor diagnóstico por la gran cantidad de situaciones fisiológicas y patológicas que pueden alterar sus niveles (NE: Ia-A). El marcador tumoral HE-4, de reciente aparición en la práctica clínica diaria, podría ser de utilidad futura para descartar malignidad en las pacientes con endometriomas ováricos atípicos.
Test diagnóstico con análogos de la GnRH8,11,12En el caso de que la mujer presente una sintomatología dolorosa, indicativa de endometriosis, sin que se haya llegado a establecer de manera definitiva el diagnóstico con las pruebas de imagen previamente citadas, y para evitar realizar una laparoscopia diagnóstica, puede realizarse un tratamiento hormonal con análogos de la GnRH o con anticonceptivos hormonales combinados tomados de manera continua, de forma que se suprima la menstruación de la paciente (NE Ia-A). Si el dolor desaparece, el diagnóstico de endometriosis es muy probable.
Tratamiento médico de la endometriosis11,12 (fig. 1)No existe, por el momento, ningún tratamiento óptimo que consiga alcanzar los 4 objetivos básicos: suprimir los síntomas (algias pélvicas, dismenorrea severa, etc.), restaurar la fertilidad, eliminar la endometriosis visible y evitar la progresión de la enfermedad. Puesto que la enfermedad se considera crónica, el tratamiento médico administrado, hasta la llegada de la menopausia o de una gestación, debe ser efectivo y seguro. Así pues, sus objetivos reales serán la reducción o la eliminación de los síntomas y/o mejoría de la fertilidad.
Como ya se ha comentado previamente, el tratamiento médico y/o quirúrgico debe individualizarse teniendo en cuenta tanto las manifestaciones clínicas en su totalidad y su severidad, como los efectos secundarios del tratamiento, la edad, la extensión y la localización de la enfermedad, la duración de la infertilidad, el deseo reproductivo de la pareja, los efectos adversos de la medicación, los antecedentes quirúrgicos y la opinión de la mujer.
Aunque la endometriosis se consideró un proceso endocrinológico, ya que puede manipularse hormonalmente, en realidad se trata de una enfermedad multifactorial y no solo endocrinológica. Lo único que pueden conseguir los tratamientos médicos de la endometriosis es frenar de manera transitoria la progresión de la enfermedad y controlar los síntomas, sin que exista evidencia clara sobre qué fármaco es superior a otro en cuanto a la reducción de la extensión de las lesiones, mejoría del dolor o disminución de las recidivas tras el cese del tratamiento. Por tanto, hay que tener en cuenta que la endometriosis se considera una enfermedad crónica y, por tanto, todo tratamiento farmacológico debe considerarse como un tratamiento a largo plazo con el objetivo de maximizar el uso del tratamiento médico y evitar las intervenciones quirúrgicas repetidas.
El tratamiento médico se basa en el uso de diferentes pautas terapéuticas que incluyen antiinflamatorios no esteroideos (AINE), analgésicos y terapéuticas hormonales, y es de utilidad en los casos de endometriosis peritoneal y menor en los casos de endometriosis ovárica y en los de endometriosis profunda. El tratamiento deberá individualizarse en función de la edad, la paridad, el deseo genésico, los síntomas asociados y las preferencias de la paciente.
Así, mujeres que rechacen el tratamiento hormonal o con contraindicación para el mismo pueden beneficiarse de uso de ibuprofeno (600mg/8h por vía oral) u otros AINE. Debe tenerse en cuenta que ninguno de estos fármacos carece de contraindicaciones y efectos secundarios, sobre todo gástricos, por lo que es necesario el uso de protectores gástricos de manera concomitante. Otros fármacos analgésicos también pueden utilizarse, ya sea de manera alternativa o concomitante (p. ej., paracetamol 1g/6-8h por vía oral, solo o asociado a codeína 30-60mg/6-8h por vía oral u otras pautas) (NE: Ia-A).
El tratamiento médico más eficaz es el hormonal (contraceptivos hormonales combinados [por vía oral, transcutánea o vaginal], danazol, gestrinona, desogestrel, acetato de medroxiprogesterona, acetato de noretisterona, dienogest, análogos del GnRH), habiéndose demostrado que la supresión de la función ovárica durante 6 meses reduce de manera significativa el dolor asociado a la endometriosis, aunque la recurrencia de los síntomas es frecuente después de la suspensión del tratamiento (NE: Ia-A).
En general, todo tratamiento que genere amenorrea y/o supresión de la ovulación y/o disminución de la frecuencia de menstruación y/o disminución de la cantidad de flujo menstrual va a mejorar los síntomas dolorosos asociados a la enfermedad. Ningún tratamiento hormonal ha demostrado ser más efectivo que otro, pero su perfil de efectos secundarios es diferente, lo que limita su uso a largo plazo y el cumplimiento del tratamiento. Entre los fármacos considerados como de primera línea para el tratamiento se encuentran los anticonceptivos hormonales combinados (en cualquiera de sus posologías). Entre los anticonceptivos orales, se prefieren los de dosis media con gestágenos de segunda generación a los más modernos, con dosis más bajas de estrógenos. No hay datos que demuestren la superioridad de una pauta convencional sobre una pauta en la que los anticonceptivos se tomen de manera continuada, sin descansos. Ambas opciones son posibles, aunque las pautas continuas alargadas trimestrales o semestrales suelen mejorar la calidad de vida de las pacientes.
Las vías de administración diferentes de la oral, como los parches y el anillo vaginal, pueden ser igualmente efectivas, aunque no han sido estudiadas ampliamente. Cabe destacar que diversos estudios aleatorizados recientes demuestran el beneficio de la anticoncepción hormonal combinada como tratamiento preventivo de las recurrencias tras el tratamiento quirúrgico de los endometriomas ováricos y, por tanto, deberían recomendarse como tratamiento crónico tras la cirugía del endometrioma ovárico cuando la paciente no desee gestación (NE: Ia-A).
Los progestágenos (acetato de medroxiprogesterona, acetato de noretisterona, dienogest, desogestrel) han demostrado también ser efectivos para el dolor pélvico secundario a endometriosis. Así pues, la administración aislada de progestágenos puede considerarse también como primera línea de tratamiento, aunque existen menos estudios al respecto. Existen diferentes opciones terapéuticas, dependiendo la elección de la necesidad contraceptiva de la paciente, el perfil de efectos adversos y las preferencias de la mujer.
El tratamiento con anticonceptivos hormonales puede mantenerse durante largo plazo; sin embargo, los análogos del GnRH deben, en principio, suspenderse a los 6 meses de tratamiento debido a sus efectos sobre la masa ósea de la paciente. Por tanto, los análogos de la GnRH se consideran una segunda línea de tratamiento en los casos resistentes a los tratamientos médicos expuestos con anterioridad. Si se decide mantener el tratamiento con análogos de la GnRH, debe asociarse un tratamiento tipo «add-back» (es decir, administrando al mismo tiempo estrógenos, progestágenos, una combinación de estrógenos y gestágenos, o tibolona) para evitar efectos secundarios, como pérdida de masa ósea (NE: Ia-A). Teniendo en cuenta sus efectos beneficiosos y sus efectos secundarios, se utilizará una combinación de estrógenos y gestágenos a dosis bajas; este tratamiento se puede mantener durante largo tiempo.
Otra posibilidad de eficacia demostrada, y considerada como primera línea de tratamiento en el manejo del dolor asociado a la endometriosis es el tratamiento con dispositivos intrauterinos liberadores de levonorgestrel (DIU Mirena®), que pueden dejarse «in situ» durante 5 años y que, además, se han demostrado especialmente útiles en casos de recurrencia/persistencia del dolor postoperatorio (NE: Ia-A).
Ante la sospecha de endometriosis no confirmada por las pruebas de imagen, se recomienda el tratamiento empírico con AINE, anticoncepción hormonal combinada, progestágenos, colocación del DIU liberador de levonorgestrel o análogos de la GnRH (elección en función de la edad, paridad, deseo genésico, síntomas asociados y preferencias de la paciente).
El danazol y la gestrinona, aunque se han demostrado eficaces en cuanto al control de las algias asociadas a la endometriosis, se consideran fármacos de segunda línea por los efectos secundarios originados por su acción androgénica y metabólica.
Los inhibidores de la aromatasa, los antagonistas de la progesterona y los moduladores selectivos de los receptores de la progesterona aún se consideran tratamientos experimentales, aunque prometedores.
Puede emplearse el tratamiento hormonal sustitutivo en pacientes menopáusicas con antecedente de endometriosis y síntomas climatéricos asociados (NE: IV-C).
Tratamiento médico de la endometriosis para mejorar la fertilidad11-13El tratamiento médico de la endometriosis con diferentes tratamientos hormonales (anticoncepción hormonal combinada, danazol, acetato de medroxiprogesterona, gestrinona o análogos de la GnRH) antes o después de un tratamiento quirúrgico, o sin tratamiento quirúrgico asociado, no ha demostrado aportar beneficios para mejorar la fertilidad en pacientes con endometriosis. Además, su efecto anticonceptivo no solo no mejora la fertilidad, sino que además retrasa la fertilidad espontánea o tras TRA. Además, el uso de análogos de la GnRH tras cirugía en pacientes con endometriosis profundas extensas no ha demostrado un beneficio en cuanto a tasas de embarazo respecto a la conducta expectante.
En las pacientes con endometriosis y esterilidad asociada, se recomienda realizar técnicas de reproducción asistida (IAC o FIV según la edad, tiempo de esterilidad, severidad y extensión de la enfermedad, antecedentes quirúrgicos, marcadores de reserva ovárica y el resultado de las técnicas de reproducción asistida realizadas previamente).
La evidencia científica actual (revisión de la base de datos Cochrane), aunque con limitaciones, recomienda el uso de análogos de la GnRH durante 3 a 6 meses antes de realizar una FIV en pacientes con endometriosis, ya que este tratamiento aumenta 4 veces la probabilidad de gestación (NE: Ia-A).
Tratamiento quirúrgico de la endometriosis (fig. 1)La cirugía está indicada en la endometriosis en 3 situaciones: diagnóstico, infertilidad y dolor.
Actualmente, no hay duda de que, salvo excepciones muy concretas, la laparoscopia es de elección. Múltiples estudios han demostrado que los resultados son similares en términos de fertilidad, mejoría sintomática y recurrencias, pero con una menor tasa de complicaciones (NE: IIb-B).
DiagnósticoVéase el apartado de «Diagnóstico».
Infertilidad14Ante pacientes con deseo gestacional a corto plazo, en las que el dolor no es intenso y no interfiere con su actividad diaria, podemos encontrar 2 situaciones:
- –
Cuando no hay confirmación quirúrgica previa de la enfermedad no es recomendable la cirugía ya que, en la endometriosis, la fecundidad tras la cirugía sigue siendo inferior a la población general y además el rendimiento de la laparoscopia para el diagnóstico y el eventual tratamiento de las lesiones es menor que el rendimiento de las TRA. Por tanto, no se recomienda la laparoscopia sistemática como parte del estudio de esterilidad en estas pacientes (NE: Ia-A).
- –
Cuando ya tenemos un diagnóstico quirúrgico previo de endometriosis, en caso de que exista infertilidad, no está justificado ni el manejo expectante (ya que la fertilidad de estas pacientes está disminuida incluso en estadios precoces), ni el tratamiento médico (NE: Ia-A). En estos casos, la indicación de una nueva cirugía debe hacerse de forma muy cuidadosa y en casos seleccionados, pero podría plantearse cuando la cirugía inicial no ha sido adecuada (incompleta), cuando existen recidivas de grandes endometriomas que dificultan la accesibilidad ovárica o si hay dolor asociado. También se debe tener en cuenta que la cirugía retrasa el inicio del tratamiento y, aunque busca mejorar la respuesta ovárica ante el desarrollo folicular múltiple, la cirugía podría también empeorar la reserva ovárica. Algunos autores afirman que las sucesivas intervenciones sobre el ovario reducen significativamente la reserva folicular, disminuyendo los resultados de la FIV. También se ha observado que el tratamiento quirúrgico sobre todo en mayores de 35 años, o en pacientes con endometriosis avanzadas, reduce la respuesta en ciclos de FIV aconsejándose no intervenir a estas pacientes15.
Se recomienda realizar cirugía de la endometriosis en pacientes con infertilidad en casos de:
- –
Endometriosis peritoneal (mínima o leve): se recomienda ablación de las lesiones y adhesiólisis frente a solo diagnóstico6 (NE: Ia-A). Esta situación no será frecuente, salvo que se trate de un hallazgo en el estudio de dolor crónico en una paciente con deseo gestacional a corto plazo o con historia de esterilidad, ya que, como se ha expuesto con anterioridad, no es recomendable la laparoscopia diagnóstica en el contexto de un estudio de esterilidad a una paciente asintomática.
- –
Endometriosis quística de ovario: debe evaluarse en cada caso el riesgo/beneficio de la quistectomía15,16:
- •
La quistectomía de endometriomas mayores de 4cm aumenta la tasa de embarazo espontáneo en mujeres subfértiles, aunque no mejora las posibilidades de embarazo con TRA (NE: Ib-A). No se recomienda realizar quistectomía en cualquier mujer que precise FIV con endometrioma asintomático y que no sea de tamaño mayor de 4cm.
- •
La quistectomía laparoscópica de los endometriomas mayores de 4cm mejora la fecundidad en mayor medida que el drenaje y la coagulación (NE: Ia-A).
- •
Por otro lado, existe un riesgo de reducción de la función ovárica en toda cirugía del endometrioma ovárico, por lo que la exéresis de la cápsula debe realizarse de forma cuidados. De esta forma, las sucesivas intervenciones sobre el ovario reducirían la reserva folicular disminuyendo los resultados en FIV. Por tanto, es aconsejable realizar TRA antes que repetidas quistectomías si no existe clínica de dolor (NE: IV-C).
- •
La quistectomía en mujeres mayores de 35 años o con endometriosis avanzadas reduce la respuesta en ciclos de FIV (NE: IIb-B). En estas pacientes sería aconsejable realizar TRA como primera opción, antes que cirugía (NE: Ia-A).
- –
Endometriosis profunda14: en casos de endometriosis infiltrante profunda, en los que la cirugía no está exenta de complicaciones severas, es recomendable intentar las TRA antes que la cirugía, salvo en casos en los que predomine la clínica de dolor intenso (NE: IIb-B).
Dado que en la mayoría de las mujeres con endometriosis el dolor es de origen nociceptivo, la eliminación de las lesiones reduce el dolor. Es decir, la cirugía es eficaz en el tratamiento del dolor asociado a endometriosis17, aunque las recurrencias del dolor son frecuentes a largo plazo (NE: Ia-A).
No existe evidencia científica que avale la eficacia de la hormonoterapia prequirúrgica (NE: IIa-B).
La ablación de los ligamentos uterosacros por laparoscopia (laparoscopic uterosacral nerve ablation [LUNA]) no reduce el dolor en la endometriosis como técnica aislada6 (NE: Ib-A).
– Endometriosis peritoneal. El tratamiento laparoscópico de la endometriosis visible da lugar a una mejoría en el dolor. Deben eliminarse las lesiones que se observen en una laparoscopia diagnóstica. El tratamiento ideal es la vaporización de las lesiones para dañar lo menos posible el tejido sano adyacente (NE: Ia-A).
– Endometriosis ovárica. Los endometriomas sintomáticos o de gran tamaño deben ser tratados con cirugía. No obstante, hay que tener en cuenta que a largo plazo, tanto en vaporización con láser, como vaporización con bipolar o decapsulación, la tasa de recidivas es elevada y por eso debe contemplarse el tratamiento médico y demorar la cirugía, especialmente si la paciente queda asintomática con el tratamiento médico, tiene cirugías repetidas y/o el endometrioma ovárico es inferior a 3cm (NE: Ib-A).
– Endometriosis profunda. El manejo de la endometriosis infiltrante profunda es complejo. Muy frecuentemente se precisan cirugías de alta complejidad con alta tasa de complicaciones. Por ello debe realizarla un ginecólogo con experiencia en laparoscopia avanzada. La afectación de otros órganos pélvicos no es infrecuente, de modo que se debe contar con la colaboración de un cirujano digestivo y un urólogo si fuese necesario. Es recomendable realizar profilaxis antibiótica y preparación intestinal.
La indicación de la cirugía es compleja y debe realizarse en casos de fracaso previo del tratamiento médico/intolerancia al mismo o de obstrucción ureteral o intestinal.
Es imprescindible liberar las adherencias para poder explorar adecuadamente el abdomen y así delimitar la extensión de la enfermedad. Posteriormente, es importante ser lo más sistemático posible, avanzando de craneal a caudal, de lateral a medial y de tejido sano a tejido afectado, haciendo reconocibles las estructuras que es necesario liberar y/o preservar, como los uréteres y los nervios hipogástricos para tratar de extirpar toda la enfermedad en un solo acto quirúrgico. Cuando existen además grandes quistes ováricos será necesario extirparlos en los primeros pasos de la cirugía para poder suspender los ovarios, maniobra que mejorará la visión y el campo quirúrgico.
El tipo de cirugía a realizar varía en función de las características de la paciente y de la localización de la enfermedad9:
- •
Pacientes con deseos genésicos no cumplidos: se intentará ser conservador con el aparato genital y restaurar la anatomía en la medida de lo posible, liberando adherencias y extirpando las lesiones. En caso de que exista extensa afectación tubárica, hay que valorar la salpingectomía (NE: Ia-A).
- •
En pacientes con deseos genésicos cumplidos, es razonable la realización de histerectomía, aunque hay estudios en los que esta variable no se relaciona con mejores resultados posquirúrgicos. La realización de ooforectomía también es razonable en pacientes de más de 40 años cuando el dolor es resistente a diferentes tratamientos médicos y la paciente está multioperada (NE: Ia-A).
- •
Pacientes con afectación del aparato urinario: si la afectación es de la vejiga, hay que valorar la realización de la extirpación del nódulo sin apertura de la misma o si, por el contrario, será precisa una cistectomía parcial. En caso de afectación ureteral, en ocasiones es suficiente con la liberación del uréter y la extirpación del nódulo, pero otras veces será necesario realizar una reimplantación ureteral o anastomosis término-terminal, para lo cual es imprescindible haber valorado previamente la función renal dado que en caso de ausencia de función, la reimplantación no será necesaria (NE: IV-C). Cuando la paciente presenta una hidronefrosis asociada a una anulación funcional renal comprobada en un renograma, hay que individualizar el manejo y, o bien realizar conducta expectante, o realizar una nefrectomía en el mismo acto quirúrgico o en una cirugía posterior si presenta complicaciones asociadas como pielonefritis crónicas, etc.
- •
Afectación intestinal: obliga a tomar decisiones importantes que a menudo las pruebas diagnósticas no pueden resolver. Por ello, el equipo debe de estar preparado para realizar cualquiera de las opciones posibles, optando por una u otra durante la intervención. Estas opciones son el «shaving» de la pared (resección de la lesión sin llegar a la luz intestinal), la resección discoide y la resección segmentaria. La necesidad de resección debería basarse en una serie de aspectos como:
- ∘
La localización (distancia de la lesión a la línea dentada) y número de lesiones: las resecciones bajas y/o múltiples se asocian a un mayor número de complicaciones (fugas anastomóticas, fístulas y problemas funcionales vesicales y en la esfera sexual).
- ∘
La extensión y la profundidad de afectación de la pared: cuando la lesión afecta a más del 50% de la circunferencia de la pared deberá realizarse una resección segmentaria.
- ∘
La existencia y la extensión de adherencias.
- ∘
Existe una serie de medidas preventivas de complicaciones:
- ∘
Preparación intestinal sistemática.
- ∘
Comprobación de estanqueidad rectal al terminar la sutura o anastomosis.
- ∘
Uso de drenajes pélvicos.
- ∘
Valorar la posibilidad de mecanismos de protección en caso de sutura muy baja o cercana a sutura vaginal (interposición de flap de epiplón, ileostomía).
En la mayoría de los casos, la exéresis completa del nódulo es posible sin necesidad de realizar resección segmentaria. Si la lesión es alta (sigma), la resección plantea menos dudas por presentar menos complicaciones (NE: IIa-B).
Evolución de la enfermedad y seguimiento18,19La endometriosis se considera, especialmente en su variante profunda, una enfermedad crónica lentamente evolutiva en la mayoría de los casos. Una gran proporción de pacientes afectadas de endometriosis profunda van a presentar síntomas que conducirán a una cirugía, por lo que la progresión a largo plazo de la enfermedad es poco conocida. Además, el hecho de que muchas de estas pacientes reciban tratamiento hormonal supresor de la ovulación puede interferir con la velocidad de progresión. La escasa evidencia científica muestra que solo un 10% de las pacientes con endometriosis del tabique rectovaginal asintomáticas presentan progresión o aparición de síntomas dolorosos. Parece que existe una disminución transitoria de los implantes durante el embarazo y posparto entre las pacientes con endometriosis del tabique rectovaginal asintomáticas (NE: III-B). Asimismo, parece que se produce una marcada reducción del volumen total de las lesiones de endometriosis profunda en aquellas pacientes no tratadas con cirugía cuando llegan a la menopausia (NE: III-B). La no total desaparición de la lesiones en la menopausia puede justificarse en las endometriosis profundas por el predominio del componente conectivo-fibroso sobre el epitelial-glandular.
En este contexto, cabe reseñar la importancia de sospechar la enfermedad y evitar demoras en el diagnóstico y el tratamiento de lesiones de endometriosis profunda que puedan obstruir de forma progresiva las vías urinarias y producir hidronefrosis secundarias, con las consiguientes insuficiencias renales, o aquellas que puedan infiltrar el intestino y producir una obstrucción intestinal, que no hubieran ocurrido de haberse realizado un tratamiento quirúrgico adecuado a tiempo.
La evolución de la endometriosis superficial peritoneal es poco conocida, aunque se cree que no siempre se trata de una enfermedad progresiva. Se han reportado regresiones de los implantes peritoneales en una cuarta parte de los pacientes y no variación de los mismos en hasta un 40% de los casos en segundas cirugías de revisión (second-look laparoscopy) en pacientes no tratadas en la cirugía previa. Cabe esperar que en las lesiones superficiales en las que el componente epitelial-glandular es mayor que el conectivo-fibroso se produzca una total o casi total desaparición de las lesiones al entrar en la menopausia.
El riesgo de malignidad de la endometriosis es muy raro. En aquellas pacientes con endometriosis ovárica y transformación a un cáncer ovárico, el subtipo histológico frecuentemente encontrado es el carcinoma de células claras y el subtipo endometrioide.
El seguimiento de las pacientes va a depender del tipo de endometriosis y los síntomas asociados. El tratamiento y el seguimiento de las pacientes con endometriosis profunda, especialmente las que presentan afectación del tracto urinario y/o intestinal, y/o multioperadas se recomienda que se realice en centros especializados de tercer nivel. Hay que tener en cuenta la alta tasa de recidivas de la enfermedad y sus síntomas, y que el tratamiento médico concomitante (véase el apartado de «Tratamiento médico») se debe contemplar a largo plazo en el contexto de una enfermedad crónica. El seguimiento debe ser clínico (anamnesis y exploración física) y mediante pruebas complementarias en función de la severidad y el órgano afectado.
Los Protocolos Asistenciales de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en Departamentos y Servicios Hospitalarios (tablas 1 y 2).
Clasificación de las recomendaciones en función del nivel de evidencia disponible
| Ia | La evidencia científica procede a partir de metaanálisis de ensayos clínicos controlados y aleatorizados |
| Ib | La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa | La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb | La evidencia científica procede de al menos un estudio casi experimental, bien diseñado |
| III | La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles |
| IV | La evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio |
Grados de recomendación
| A | Existe buena evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica ia y ib) |
| B | Existe moderada evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica iia, iib y iii) |
| C | La recomendación se basa en la opinión de expertos o en un panel de consenso. (Recoge el nivel de evidencia iv) |