El objetivo de este trabajo es analizar la sensibilidad y la especificidad en gestaciones únicas del análisis de cell free DNA (cfDNA) en sangre materna para el diagnóstico de las principales trisomías fetales (t21,t18 y t13), así como comparar los resultados con los obtenidos mediante el cribado combinado bioquímico ecográfico (CC); 582 gestaciones de más de 10 semanas fueron estudiadas. Todos los resultados con alto riesgo fueron confirmados mediante determinación prenatal del cariotipo o tras el nacimiento. Se realizó seguimiento posnatal en todos los casos, excepto en 5 gestaciones en las que no pudo ser confirmado el cariotipo por pérdida fetal tardía o aborto y renuncia de los padres a su estudio. El análisis de cfDNA fue posible tras la primera determinación en 97.1% de las muestras. En 3 (0,5%) no se obtuvo resultado tras 2 o incluso 3 extracciones; 14 fetos presentaron alto riesgo de t21 en sangre materna que fue confirmado en todos los casos; 3 fetos con alto riesgo de t18 en el estudio no invasivo fueron también confirmados tras el estudio del cariotipo fetal. No hubo falsos positivos ni negativos en la muestra analizada. La sensibilidad del CC fue del 87,5% para una tasa del 6,7% de falsos positivos. El análisis de cfDNA en sangre materna permite con alta sensibilidad y especificidad establecer el riesgo de las principales trisomías fetales. Los resultados obtenidos son probablemente superiores a los del CC. El número de procedimientos invasivos en la población de estudio se redujo de forma muy significativa.
The aim of this study was to assess the sensitivity and specificity of cell-free (cfDNA) screening for diagnosis of the main fetal trisomies (t21,t18 y t13) and to compare its efficiency with that of first-trimester combined screening (FTS). A total of 582 samples were analyzed from singleton pregnancies above 10 weeks of gestation. All abnormal results were confirmed either with a prenatal invasive procedure or by neonatal karyotyping. Postnatal follow-up was also carried out in all but 5 low-risk pregnancies in which the karyotype could not be confirmed due to late fetal loss or miscarriage or parental refusal. cfDNA determination provided a risk score at the first attempt in 97.1% of the samples. Only 3 cases failed after 2 or 3 redraws (0.5%). High-risk results were provided by the Harmony test in 14 cases for t21 and in 3 for t18. No false positive results were observed. No false negative results were obtained in any of the 557 cases with a result of low-risk and postnatal follow-up. The sensitivity of FTS was 87.5%, with a false positive rate of 6.7%. cfDNA analysis in maternal blood has high sensitivity and specificity in establishing the risk of the main fetal trisomies. The results are probably superior to those obtained with FTS. The number of invasive procedures in the study population was significantly reduced.
Evaluar la efectividad del cribado de trisomías 21,18 y 13 (t21, t18, t13) mediante análisis de ADN fetal libre en plasma materno en nuestra población de gestantes y compararla con el cribado combinado de primer trimestre (CC).
Material y métodosColección prospectiva de casos entre aquellas gestantes que han acudido a nuestro centro para realizar cribado combinado y estudio de ADN fetal en sangre materna por indicación médica y/o deseo de la paciente.
Hemos analizado muestras procedentes de 582 mujeres con gestaciones únicas, obtenidas de forma espontánea o tras la realización de técnicas de reproducción asistida con ovocitos propios o donados, de más de 10 semanas de gestación, comprobadas por la fecha de última regla y corregida por ecografía cuando la discrepancia era mayor de 3 días. La edad media de las pacientes era 36,5 años (rango 22-47).
Las muestras fueron analizadas utilizando el Harmony test (Ariosa diagnostics California, EE. UU.) basado en la secuenciación selectiva de ADN fetal de regiones seleccionadas en los cromosomas 21, 18 y 13. En 418 casos también se incluyó en el estudio la evaluación del riesgo de las anomalías de los cromosomas sexuales.
Tras la secuenciación del ADN fetal libre, el algoritmo Fetal-Fraction Optimized Risk of Trisomy Evaluation (FORTE) proporciona un riesgo numérico para cada una de las trisomías estudiadas tomando en cuenta la fracción fetal (FF), la edad materna y la edad gestacional.
En todos los casos excepto en uno se determinó el riesgo de trisomías mediante CC realizado en 2 tiempos con extracción de sangre alrededor de la semana 10 (PAAP-A y beta-hCG libre), y medición posterior del grosor de la translucencia nucal (TN) según criterios estandarizados y ampliamente conocidos1. Para el cálculo se utilizó la edad materna en el momento de la extracción o de la donante en casos de ovodonación, introduciendo los datos en el programa PRISCA 4.0 Typolog software. Se consideró riesgo alto aquel igual o superior a 1/100. En todos los casos con riesgo intermedio (1/101-1/1.000), se valoró al menos uno de los marcadores de segundo orden (hueso nasal, onda de velocidad de flujo del ductus venoso y regurgitación tricuspídea).
Para la evaluación de la sensibilidad (S) y la especificidad (E) de las técnicas se utilizó como referente el cariotipo obtenido mediante estudio de líquido amniótico o vellosidad corial en los casos en los que el resultado fue de alto riesgo para alguna de las cromosomopatías. Los resultados de bajo riesgo de trisomías se comprobaron en todos los casos tras exploración clínica al nacimiento o mediante contacto telefónico en aquellas pacientes con parto en otro centro.
ResultadosEl análisis de ADN fetal fue posible en el 99,5% de casos. En 15 pacientes (2,8%) hubo que repetir el test por baja cantidad de ADN. Tres de estas (0,5%) no obtuvieron finalmente resultado tras 2 o incluso 3 determinaciones.
El resultado fue de bajo riesgo (< 0,01%) para todas las trisomías autosómicas estudiadas en 562/579 casos (97%). De esas 562 pacientes, 7 solicitaron interrupción de la gestación (IVE) por otros motivos; 2 tras rotura prematura de membranas (RPM) en gestaciones de menos de 20 semanas, en las que no pudo comprobarse la normalidad del cariotipo, y 5 tras el diagnóstico de malformación fetal grave (2 cardiopatías complejas, 2 ventriculomegalias severas y progresivas, una de ellas asociada con defecto del vermis y agenesia de ductus venoso y otro feto fue diagnosticado de ectopia cordis), todas ellas con cariotipo normal.
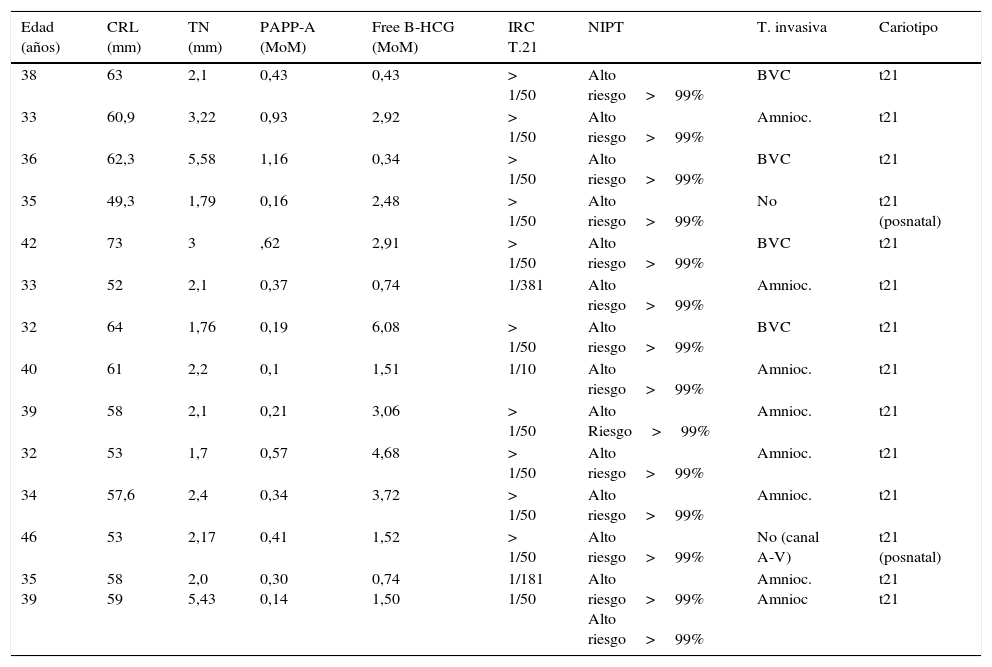
En 14 pacientes del total de 579 muestras estudiadas (2,4%) el Harmony test determinó un alto riesgo (> 99%) de trisomía 21, confirmándose en todos ellos mediante estudio citogenético del material obtenido tras amniocentesis o biopsia corial (BVC) o tras el nacimiento. Valor predictivo positivo (VPP) 100%; IC del 95%, 73,2-100.
De estos 14 casos, 11 (78,5%) solicitaron interrupción de la gestación (IVE). Doce de las gestaciones con feto portador de t21 presentaban alto riesgo de cromosomopatía (≥ 1/100) en el CC (S 85,7%; IC del 95%, 56,1-97,4). En los otros 2 casos, el resultado del CC fue de riesgo intermedio (1/101-1/1.000) con marcadores secundarios normales. En 50/581 gestaciones el resultado del CC fue riesgo alto (≥ 1/100) para síndrome de Down que fue confirmado en 12 (E 93,2%; IC del 95%, 90,7-95,1) (VPP 24%; IC del 95%, 13,5-38,4).
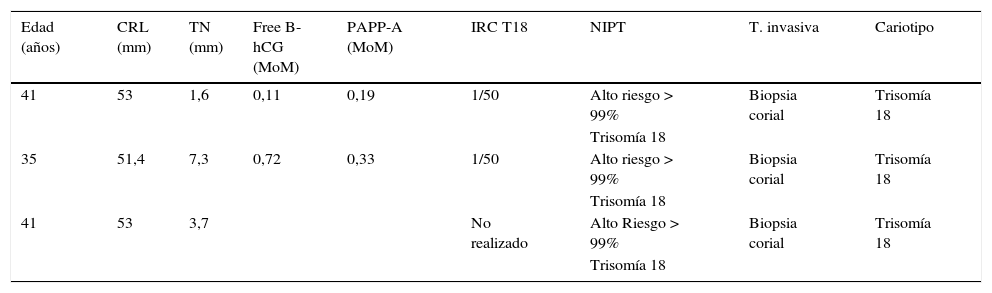
EL Harmony test resultó en alto riesgo de t18 en 3 casos (0,3%), confirmados posteriormente mediante BVC (S 100%; IC del 95%, 30,9-100) (E 100%; IC del 95, 99,1-100). En 2/3 el resultado del CC fue de alto riesgo para t18 (> 1/50) (S 100%; IC del 95, 19,7-100). La tercera paciente no se realizó CC, pero el estudio ecográfico mostraba múltiples marcadores y anomalías estructurales. Siete casos del total de la muestra presentaban riesgo alto para t18 en el cálculo de riesgo del CC (E 98,9%; IC del 95, 97,6-99,5).
Analizadas en conjunto con ambos métodos de cribado, no se observaron falsos positivos ni negativos para las 3 trisomías autosómicas estudiadas entre todos los casos analizados mediante estudio de ADN fetal en sangre materna (S 100%; IC del 95%, 77,0-100) (E 100%; IC del 95%, 99,1-100). La S y E del CC para todas las trisomías estudiadas fue S 87,5%; IC del 95%, 60-97 y E 92,3%; IC del 95%, 89,7-94,3.
Seis gestantes presentaron riesgo alto de anomalías de los cromosomas sexuales en el análisis en sangre materna. Cuatro de síndrome de Turner, confirmándose únicamente en 2 de ellas. Una para síndrome de Klinefelter, confirmada prenatalmente y, por último, una paciente con riesgo alto de triple X (47xxx) que tampoco fue confirmado tras amniocentesis. E y VPP, 50%.
En el curso del estudio, hubo 3 pérdidas fetales espontáneas, una de ellas en un feto con TN aumentada y ADN fetal normal, pero los padres renunciaron al estudio del cariotipo en los restos abortivos en todos los casos, por lo que no pudo confirmarse su normalidad. Estos pacientes junto con las 2 interrupciones por RPM precoz han sido excluidos del estudio.
DiscusiónDos son las principales premisas sobre las que actualmente se sustentan las estrategias de detección de las principales anomalías cromosómicas; seleccionar de forma adecuada aquellas pacientes que presentan alto riesgo de presentar la anomalía y, si es posible, hacerlo de forma precoz.
El CC presenta una S del 90% en las mejores series publicadas, con una tasa de falsos positivos del 5%. La S puede aumentar hasta el 93% añadiendo otros marcadores de segundo orden, como el hueso nasal, el estudio de la onda de velocidad de flujo del ductus venoso, la presencia de regurgitación tricuspídea o la valoración del flujo en la arteria hepática, aunque para su estudio se requiera un alto grado de capacitación, mayor tiempo de exploración y equipos ecográficos de alta resolución2-4.
De cualquier forma, la ecografía es una técnica operador dependiente y las tasas reportadas en la literatura no siempre reflejan la realidad de cada medio. Ni siquiera hay un claro acuerdo en dónde situar el punto de corte del cribado combinado o incluso si en pacientes de edades muy avanzadas (> 40), algo cada vez más habitual en nuestro entorno, se debe ofrecer de entrada la realización de una técnica invasiva.
Hace algo más de una década5 que se publicaron los primeros trabajos en los que se intentaba aislar y estudiar células fetales en sangre materna con la finalidad de poder analizar de forma no invasiva el cariotipo fetal pero los resultados no fueron satisfactorios debido a la imposibilidad de obtener un número suficiente de células que permitieran un diagnóstico fiable en un periodo razonable. Por el contrario, ya son muchos los grupos de trabajo que han presentado excelentes resultados mediante el análisis de ADN fetal libre en sangre materna con técnicas de secuenciación masiva paralela (MPSS) o análisis dirigido de las regiones de interés (DANSR™)6-10. Tras la secuenciación del material genético se emplea el algoritmo FORTE que cuantifica el riesgo de trisomía en el contexto de la FF, tomando en cuenta el riesgo a priori basado en la edad materna y gestacional, obteniendo un riesgo para cada trisomía que suele situarse en los rangos más extremos, tanto en pacientes de bajo riesgo (< 0,001%) como en aquellos casos de alto riesgo (> 99%), disminuyendo el número de resultados intermedios. A diferencia del CC, esta distribución en 2 clases de riesgo es de gran ayuda en simplificar la interpretación y decidir eventuales intervenciones diagnósticas invasivas de confirmación.
Doce de 14 (85,7%; IC del 95%, 56,1-97,4) gestaciones con feto portador de t21 presentaron un riesgo ≥ 1/100 en el CC, punto de corte empleado en nuestra unidad para indicar la realización de BVC o amniocentesis. Las 2 gestaciones restantes presentaban un riesgo intermedio pero con marcadores de segundo orden negativos. En 3/14 los padres decidieron continuar la gestación, uno de los fetos fue diagnosticado de canal A-V completo sospechado en la semana 15 y confirmado en controles ecográficos posteriores; los 2 restantes no presentaban ninguna anomalía estructural asociada y solo uno de ellos un marcador (hipoplasia nasal) en la exploración segundo trimestre. En todos los casos con test positivo en sangre materna el feto era portador de t21 (E 100%; IC del 95%, 99,1-100) (VPP 100%; IC del 95%, 73,2-100).
La elevada tasa de falsos positivos obtenida en el CC puede explicarse por la muestra analizada con población de edad avanzada y riesgo intermedio-alto en elevada proporción.
En todos los casos con resultado de bajo riesgo del test de ADN fetal se confirmó la ausencia de aneuploidía para los pares cromosómicos estudiados (VPN 100%; IC del 95%, 99,1-100). Es en este punto donde creemos que el análisis de ADN fetal puede tener también una mayor utilidad, ya que de confirmarse nuestros excepcionales resultados debería significar una marcada reducción en el número de pruebas invasivas realizadas incluso en población de alto riesgo manteniendo o incluso incrementando la tasa diagnóstica.
El test fue inicialmente desarrollado para el cribado de t21 en gestaciones únicas obtenidas de forma natural o con técnicas de reproducción asistida (TRA) con ovocitos propios y en fases posteriores para la detección de gestaciones con elevado riesgo de t18 y 13, y anomalías de los cromosomas sexuales, así como aquellas obtenidas tras ovodonación y recientemente también en gestaciones múltiples. En nuestra experiencia, la elevada tasa de falsos positivos para las anomalías de los cromosomas sexuales es inaceptable aumentado el número de pruebas invasivas a realizar en fetos sanos por lo que debería replantearse su inclusión en el test, al menos entre los fetos sin hallazgos ecográficos indicativos.
Pese a los excelentes resultados que reportamos, hay que tener en cuenta las limitaciones del estudio de ADN fetal en sangre materna. Debemos informar a los futuros padres de sus limitaciones, tal y como publicó el Board of the International Society for Prenatal Diagnosis11. En primer lugar, se trata de una prueba de cribado, no diagnóstica, aunque las tasas publicadas en la literatura son excepcionales, con una S y E prácticamente del 100% para t21 y de algo más del 98% para el resto de aneuploidías estudiadas (13 y 18)9-13. Su S es menor en gestaciones múltiples (experiencia personal no publicada) y en un pequeño porcentaje de casos no es posible obtener suficiente ADN fetal para determinar el riesgo. En 15 (2,5%) de nuestros casos hubo que realizar una nueva extracción, obteniendo un resultado normal en 13 tras 2 o incluso 3 determinaciones. Estos resultados son muy similares o lo publicado por otros autores que además encuentran mayor número de repeticiones por bajo ADN en pacientes obesas (Wang et al., 2013)14. El índice de masa corporal entre nuestras pacientes con bajo ADN fetal libre era concordante con lo reportado (28,53kg/m2).
Ante un resultado anómalo (alto riesgo), ha de ofrecerse a la gestante la realización de una prueba invasiva que confirme los resultados. Solo 2/14 pacientes con alto riesgo de t21 desestimaron la determinación prenatal del cariotipo, uno de los fetos fue diagnosticado desde la semana 16 de canal A-V completo, el otro no presentó ningún defecto estructural. Ambos fueron confirmados tras el nacimiento.
Uno de los aspectos más limitantes y controvertidos en la actualidad es el del elevado coste, así como determinar qué población puede beneficiarse de la prueba de forma coste efectiva. Song et al.15 publicaron un interesante trabajo basado en un modelo de decisión analítica aplicado a los 4 millones anuales de gestantes americanas comparando CC, test integrado y realizando estudio de ADN fetal en sangre materna en pacientes de ≥ 35 años (aproximadamente el 14%) o con riesgo elevado (> 1/250). El coste por cada síndrome de Down diagnosticado era sensiblemente inferior con el estudio en sangre materna y solo ocurrirían teóricamente 3 pérdidas fetales en fetos euploides versus 525 con las otras estrategias de detección, que además eran más costosas.
Entre las limitaciones de nuestro trabajo, además del número de muestras, está el no haber podido confirmar la normalidad del cariotipo entre los 3 abortos, uno de ellos con marcado aumento de TN, así como en 2 IVE por RPM precoz. Un porcentaje elevado de nuestros casos corresponden a gestaciones de riesgo intermedio o alto en el cribado combinado, por lo que nuestras conclusiones no pueden ser extrapolables a la población general. Por último, la sensibilidad del test para el diagnóstico de las anomalías de los cromosomas sexuales no puede ser confirmada ya que no se realizó cariotipo fetal a todos los recién nacidos.
El estudio de ADN fetal en sangre materna es ya una realidad en nuestro medio. El siguiente reto es determinar su utilidad en la población general en gestaciones únicas y múltiples así como eventualmente extender el número de cromosomas estudiados.
Aunque difícilmente mensurable pero de todo punto indiscutible, el resultado normal del test reduce de forma muy significativa la ansiedad de los futuros padres.
Entre sus limitaciones actuales está el elevado coste, que limita su aplicación a toda la población de gestantes (tablas 1 y 2).
Descripción de las características y la evolución de los casos con alto riesgo de trisomía 21 en el análisis de cfDNA en sangre materna
| Edad (años) | CRL (mm) | TN (mm) | PAPP-A (MoM) | Free B-HCG (MoM) | IRC T.21 | NIPT | T. invasiva | Cariotipo |
|---|---|---|---|---|---|---|---|---|
| 38 | 63 | 2,1 | 0,43 | 0,43 | > 1/50 | Alto riesgo>99% | BVC | t21 |
| 33 | 60,9 | 3,22 | 0,93 | 2,92 | > 1/50 | Alto riesgo>99% | Amnioc. | t21 |
| 36 | 62,3 | 5,58 | 1,16 | 0,34 | > 1/50 | Alto riesgo>99% | BVC | t21 |
| 35 | 49,3 | 1,79 | 0,16 | 2,48 | > 1/50 | Alto riesgo>99% | No | t21 (posnatal) |
| 42 | 73 | 3 | ,62 | 2,91 | > 1/50 | Alto riesgo>99% | BVC | t21 |
| 33 | 52 | 2,1 | 0,37 | 0,74 | 1/381 | Alto riesgo>99% | Amnioc. | t21 |
| 32 | 64 | 1,76 | 0,19 | 6,08 | > 1/50 | Alto riesgo>99% | BVC | t21 |
| 40 | 61 | 2,2 | 0,1 | 1,51 | 1/10 | Alto riesgo>99% | Amnioc. | t21 |
| 39 | 58 | 2,1 | 0,21 | 3,06 | > 1/50 | Alto Riesgo>99% | Amnioc. | t21 |
| 32 | 53 | 1,7 | 0,57 | 4,68 | > 1/50 | Alto riesgo>99% | Amnioc. | t21 |
| 34 | 57,6 | 2,4 | 0,34 | 3,72 | > 1/50 | Alto riesgo>99% | Amnioc. | t21 |
| 46 | 53 | 2,17 | 0,41 | 1,52 | > 1/50 | Alto riesgo>99% | No (canal A-V) | t21 (posnatal) |
| 35 39 | 58 59 | 2,0 5,43 | 0,30 0,14 | 0,74 1,50 | 1/181 1/50 | Alto riesgo>99% Alto riesgo>99% | Amnioc. Amnioc | t21 t21 |
Descripción de las características y evolución de los casos con alto riesgo de trisomía 18 en el análisis de cfDNA en sangre materna
| Edad (años) | CRL (mm) | TN (mm) | Free B-hCG (MoM) | PAPP-A (MoM) | IRC T18 | NIPT | T. invasiva | Cariotipo |
|---|---|---|---|---|---|---|---|---|
| 41 | 53 | 1,6 | 0,11 | 0,19 | 1/50 | Alto riesgo > 99% | Biopsia corial | Trisomía 18 |
| Trisomía 18 | ||||||||
| 35 | 51,4 | 7,3 | 0,72 | 0,33 | 1/50 | Alto riesgo > 99% | Biopsia corial | Trisomía 18 |
| Trisomía 18 | ||||||||
| 41 | 53 | 3,7 | No realizado | Alto Riesgo > 99% | Biopsia corial | Trisomía 18 | ||
| Trisomía 18 |
La determinación de ADN fetal libre en sangre materna mediante DANSR permite detectar a todos los fetos afectados de trisomía 21 y 18 en gestaciones únicas en población de riesgo intermedio-alto. Su S y E podrían ser superiores a las del cribado combinado en esta población.
Pese a tratarse de una prueba de cribado, sus resultados son superponibles a los obtenidos mediante técnicas invasivas.
La E del 100% para las trisomías 21 y 18 permite prever una disminución en el número de pruebas invasivas en fetos sanos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesL. Izquierdo y V. Cirigliano trabajan en el laboratorio desde el cual se procesan las muestras para su posterior análisis y desde el que se han realizado análisis del cariotipo en todos los casos en que este se obtuvo. Labco es el laboratorio en España que comercializa el test de Harmony.