INTRODUCCION
Fue en 1887 cuando Skene introdujo el término cistitis intersticial (CI) para referirse a un conjunto de síntomas relacionados con la micción anómala de algunas mujeres. Desde 1914, con la publicación de Hunner sobre un tipo de úlcera vesical que aparecía en las mujeres con este síndrome, esta enfermedad se conoció algo más entre los profesionales médicos. Pero es a partir de un estudio epidemiológico finlandés, publicado en 1975, cuando se prodigan los conocimientos y los trabajos sobre la CI. En 1984 se crea en Estados Unidos la Asociación de Cistitis Intersticial (ICA); en 1987 el Instituto Nacional de la Salud (NIH) convocó una reunión de expertos para adoptar criterios diagnósticos precisos.
Los trastornos urológicos que afectan a todas las mujeres en algún momento de su vida incluyen la incontinencia urinaria, los trastornos del suelo pélvico, las infecciones del aparato urinario y la CI. La CI es un complejo síndrome inflamatorio crónico vesical de difícil diagnóstico, que puede afectar a personas de cualquier edad, raza o sexo, aunque es predominante en la mujer (en el 85-90% de los casos) y poco común en personas menores de 18 años, con sintomatología miccional inespecífica del tipo urgencia miccional, diurna y nocturna, polaquiuria y/o dolor pélvico y, en ocasiones, dolor genital. Las molestias, que suelen aumentar con la distensión vesical, al aguantar las ganas de orinar, empeoran durante la menstruación y condicionan un dolor intenso durante la relación sexual.
Toda esta serie de síntomas define la inflamación crónica de la pared vesical, que presenta úlceras y áreas cicatriciales de extensión variable, acompañadas de pequeñas glomerulaciones vasculares que tienden a sangrar cuando la vejiga se distiende en exceso.
Históricamente, la CI se ha considerado como una entidad rara, difícil de diagnosticar y tratar. Sin embargo, algunos datos recientes1 muestran que es más común de lo que previamente se pensaba, y los médicos disponen hoy día de métodos diagnósticos para detectarla en pacientes con síntomas no reconocibles. Además, hay tratamientos efectivos para aliviar los síntomas en un elevado número de casos.
Por otro lado, el dolor pélvico crónico (DPC) supone para el ginecólogo un duro reto diagnóstico, debido a la multitud de cuadros que se pueden englobar dentro de esta definición. Es posible que muchas pacientes con CI no estén diagnosticadas y, por consiguiente, inapropiadamente tratadas durante años. En efecto, los síntomas de la CI (DPC con urgencia urinaria, frecuencia y nicturia) se atribuyen en muchos casos a otras posibles causas de DPC debido, en gran parte, a que los ginecólogos raramente consideran la vejiga como una posible fuente de dolor pélvico. Además, la CI puede estar enmascarada y coexistir con otras causas de dolor pélvico, en particular con la endometriosis2. De ahí que el ginecólogo debe tener presente el diagnóstico de la CI en todas las pacientes que consulten por un dolor pélvico crónico3 o un dolor urogenital4.
PREVALENCIA
La verdadera prevalencia de CI es difícil de determinar porque, como ya se ha indicado, la mayoría de las pacientes permanece sin diagnosticar, si bien se estima que ocurre en un 7,5% de la población general femenina y en un 38-85% de las mujeres que presentan un cuadro de dolor pélvico crónico5. En Estados Unidos, por ejemplo, la prevalencia de CI oscila entre 10 y 67/100.000 mujeres. En un estudio finlandés6, mediante el uso un test validado, el test O'Leary-Sant (OLS), se indica que la prevalencia clínica probable de CI en mujeres es de 230/100.000 y posible de 530/100.000. Rosenberg y Hazzard7, aplicando un test distinto, el Pelvis Pain and Urgency/Frequency (PUF), indican que la prevalencia de CI en mujeres es actualmente mucho más alta (12.600/100.000), es decir, un 12,6%, con rangos que oscilan entre 10.700 y 14.500. Por otra parte, el DPC, definido como un dolor de, al menos, 6 meses de duración localizado en la pelvis, es un cuadro muy común que afecta a 24-147/1.000 mujeres.
PATOGENIA
En la verdadera patogenia de la CI quedan muchos enigmas por resolver, hasta tal punto que se trata de un complejo síndrome en continua revisión.
En la última década se ha incorporado el concepto de «disfunción vesical», en virtud del cual en la CI subyace una alteración de la permeabilidad del urotelio, presente en el 70-90% de las pacientes con dicho síndrome, a causa del fracaso de su función protectora de barrera y, secundariamente, de la presencia de determinadas sustancias que actuarían como tóxicas en localizaciones no fisiológicas de los componentes anatómicos vesicales, las cuales habrían atravesado la mencionada barrera epitelial, produciendo una reacción inflamatoria como respuesta de estos tejidos a la presencia anormal de sustancias químicas de la orina. En este sentido, destaca el carácter tóxico de la difusión del potasio transmural vesical a partir de la superficie externa urotelial8,9. Ya iniciado el proceso inflamatorio, su evolución en el tiempo será muy variable, y de eso dependerán las manifestaciones clínicas.
Es posible identificar las múltiples hipótesis etiológicas:
-- Algunas de ellas relativamente abandonadas (linfática, neurogénica, insuficiencia vascular, infección urinaria crónica, mecanismos de naturaleza psicosomática) que coexisten con otras8,10 más vigentes.
-- Participación de mecanismos de naturaleza inmunológica y su implicación en la respuesta inflamatoria crónica del revestimiento interno vesical y otros componentes de la pared vesical. Dicha participación estaría avalada por:
• La disfunción vesical anteriormente mencionada. Dicha disfunción del epitelio vesical, que conlleva una pérdida de capacidad funcional de la barrera hematourinaria, se ha especulado que depende de la disfunción de las uniones fisiológicas entre los elementos epiteliales y las bombas iónicas, aunque actualmente se concede más importancia a las alteraciones funcionales de las moléculas que representan la principal barrera defensiva (proteoglucanos y glucosaminoglucanos).
• El papel de los mastocitos (células cebadas), presentes habitualmente en las biopsias de la pared vesical de pacientes con CI11.
• El comportamiento inmunológico anómalo vesical en pacientes con esta enfermedad, con una secreción anómala de distintas citocinas (interleucinas 2, 6 y 8).
SINTOMATOLOGIA
La CI no tiene síntomas característicos, sino los mismos que se pueden apreciar para otros tipos de cistitis, que se pueden presentar de forma variable, aislada o conjuntamente12. En efecto, aunque la mayoría de las pacientes tiene urgencia y dolor, hay algunas que sólo presentan uno de los 2 síntomas. La mayoría de los casos tiene un comienzo insidioso, aunque, a veces, la enfermedad puede presentarse de forma súbita. Los síntomas más comunes son:
-- Frecuencia. Incremento del número de veces de la micción, durante el día y/o durante la noche. Esta variación puede ser muy sutil y el único síntoma en los casos iniciales o leves, pero, en ocasiones, es muy importante, cada 10-15 min. El número promedio diario de micciones es de 16, pero con fines diagnósticos se considera que más de 8 micciones por día, con dolor y urgencia, es indicativo de CI. No obstante, algunos pacientes pueden llegar a miccionar más de 40 veces al día; el volumen de las micciones suele ser menor de 100 ml.
-- Urgencia. Sensación de tener que miccionar de inmediato, hasta el punto de poder llegar a provocar una incontinencia urinaria totalmente incontrolable. Se puede acompañar de dolor, presión o espasmos («pujos») en la zona vesical.
-- Dolor. Puede ser abdominal, en el hipogastrio, pero también se puede manifestar en la uretra o en la zona genital. Puede expresarse como una sensación de evacuación incompleta vesical. En algunos casos, el dolor sólo se manifiesta durante o después de las relaciones sexuales13. La dispareunia puede ser tan intensa que muchas mujeres se abstienen de la actividad sexual. En general, las molestias aumentan con la distensión vesical, al aguantar las ganas de orinar, suelen empeorar durante la menstruación y, como ya se ha referido, condicionan un dolor intenso durante la relación sexual.
-- Otras manifestaciones. Algunas pacientes refieren otros síntomas muy diversos, como frecuentes vaginitis e infecciones del tracto urinario, fibromialgia, migrañas, reacciones alérgicas y trastornos gástricos o intestinales14.
DIAGNOSTICO
La mayoría de las pacientes con CI se diagnostican con cierta dificultad, debido a los síntomas no característicos ya mencionados y, sobre todo, porque el médico que evalúa el caso no tiene presente esa posibilidad. Por ello, su diagnóstico en muchas ocasiones se plantea por exclusión y, otras veces, con la mejoría clínica que suponen ciertas maniobras terapéuticas, como la sobredistensión. Si lo que predomina es la urgencia/frecuencia, muy probablemente se confundirá con una infección urinaria de causa bacteriana; si lo que destaca es el dolor, es muy probable que la paciente sea derivada al ginecólogo con diagnósticos presuntivos erróneos, como endometriosis, vaginitis, etc. Generalmente, las pacientes visitan a distintos especialistas y se realizan múltiples pruebas diagnósticas sin obtener resultados satisfactorios. Por ello, es importante resaltar que los ginecólogos deben tener presente el diagnóstico de la CI en todas las pacientes que consultan por un dolor pélvico o presencia de síntomas urinarios.
La historia clínica, como en cualquier otro proceso, debe ser la primera fuente de información, descartando las circunstancias que puedan afectar la micción normal, como tratamientos con radioterapia o quimioterapia, cirugía pélvica anterior, historia de litiasis renal, problemas neurológicos, etc.
También es importante realizar un examen físico, principalmente concentrado en la parte inferior del abdomen y la pelvis. En el caso concreto de la mujer, es especialmente importante el tacto vaginoabdominal combinado y el examen vaginal, que nos permite descartar la presencia de vaginitis que pudiera llevar a un diagnóstico y tratamiento inapropiados. Hay un dato que está presente en el 95% de las pacientes con CI: un suave dolor en la base de la vejiga que se pone de manifiesto al palpar la pared vaginal anterior.
Ante la sospecha clínica, avalada por la acusada sintomatología dolorosa (dolor pélvico y, en ocasiones, genital) y miccional (urgencia y frecuencia miccional, diurna y nocturna) de estas pacientes
--síntomas que pueden ser cuantificados con cuestionarios breves validados--, el diagnóstico debe basarse en:
1. Hallazgos cistoscópicos: presencia o no de lesión vesical endoscópica típica, ya sea úlcera de Hunner o glomerulaciones, o lesión sangrante tras distensión vesical.
2. Ausencia de otras causas de la sintomatología. En efecto, la CI se diagnostica generalmente por descarte, es decir, se deben ir eliminando otras posibles enfermedades que puedan manifestarse con síntomas parecidos.
Aunque la cistoscopia resulta fundamental para el diagnóstico de la CI, algunos autores15 no la consideran necesaria.
Mediante la cistoscopia, se distinguen 3 fases evolutivas:
1. Cistopatía intersticial inicial (fase I). La alteración vascular, con petequias subepiteliales redondeadas (granulaciones vasculares o glomerulaciones), aisladas o en pequeños grupos, se ubica preferentemente en la pared posterior, aunque puede observarse en cualquier parte de la vejiga, pero siempre respetando el trígono.
2. Cistopatía intersticial clásica (fase II). Corresponde al período de estado de la enfermedad, y la ulceración es su lesión característica. La clásica úlcera de Hunner es única, de forma triangular o alargada, de fondo rojizo granulado y que sangra con facilidad; se localiza preferentemente en la cara anterior, aunque también puede apreciarse en las paredes laterales, respetando siempre el trígono. La capacidad vesical se encuentra disminuida por debajo de la normalidad.
3. Estado final (fase III). Las paredes vesicales son muy poco distensibles, de poca capacidad y fácil sangrado; la mucosa vesical es pálida y está cruzada por la lesión característica de ese estado, la brida retráctil. El trígono, aunque al igual que en las anteriores fases se halla respetado, presenta un desplazamiento de los meatos uretrales, que se encuentran entreabiertos por la retracción de las paredes.
Las distintas fases descritas se corresponden, en definitiva, con 2 subgrupos distintos de CI:
1. Forma clásica. Se aprecian en la cistoscopia áreas vasculares mucosas que se rompen con la sobredistensión.
2. Forma no ulcerativa. Típicamente, muestra petequias glomeruloides a la sobredistensión. Este subgrupo correspondería a la CI precoz.
Con frecuencia, además de la cistoscopia, es conveniente efectuar otros estudios diagnósticos:
-- Análisis básico de orina y urocultivo, a fin de descartar la cistitis «común». El sedimento urinario, en la mayoría de las pacientes con CI, es normal y el urocultivo, por definición, debe ser negativo.
-- Los cultivos uretrales y vaginales son también negativos para infecciones por hongos, gonococos, clamidias y tricomonas.
-- Examen citológico de la orina, a fin de hacer un cribado de los cambios celulares que indiquen la presencia de displasia, carcinoma in situ o cáncer vesical.
-- Análisis de sangre sistemático para descartar la diabetes mellitus, estudiar la función renal...
-- También es recomendable solicitar una ecografía abdominopélvica, realizar una ecografía vaginal y, a veces, una urografía.
-- Estudios urodinámicos. A este respecto, la cistometría es una prueba útil, pues si es normal, se descarta una CI; en la mayoría de los casos, las pacientes presentan urgencia miccional con volúmenes inferiores a 150 ml de agua. El 90% de las afectadas por una CI tienen una capacidad vesical funcional por debajo de los 350 ml, y sólo en las pacientes afectadas por una miopatía del detrusor (el 5% de los casos) presentarán vejigas atónicas con grandes volúmenes premiccionales y un significativo residuo posmiccional16.
-- Biopsia de la pared vesical. Ningún hallazgo patológico es patognomónico de diagnóstico de CI; los hallazgos son inespecíficos, y es frecuente encontrar mastocitos, células inflamatorias y una mucosa vesical adelgazada. Una biopsia normal no excluye la enfermedad.
-- Test de sensibilidad al potasio9 (PST). Es un método opcional que puede ser usado como ayuda para confirmar la sospecha de CI. Está diseñado para detectar una disfunción del epitelio vesical usando potasio como un irritante. En efecto, si se infunde en una vejiga sana una solución de cloruro de potasio, ésta no provocará ningún síntoma, mientras que si se trata de una vejiga con su mecanismo de impermeabilidad epitelial alterado, el potasio se difundirá a través de las células transicionales y despolarizará las terminales nerviosas sensitivas, causando dolor y/o frecuencia miccional. Parsons et al9 revisaron los resultados de este test en diversos centros hospitalarios de todo el mundo y hallaron que 1.746 (78%) de 2.234 pacientes con sospecha de CI tuvieron un test positivo; por tanto, queda claro que un test negativo no descarta la enfermedad. Parsons, en un trabajo más reciente17, argumenta la importancia del uso del PST en el diagnóstico de la CI, de modo que, si el test es positivo, determinado por la presencia de dolor o urgencia en las pacientes, como respuesta al potasio intravesical, es una clara indicación diagnóstica de que hay una permeabilidad epitelial anormal. Por otra parte, se ha achacado al PST una alta tasa de falsos positivos, cuando, en realidad, este porcentaje es de sólo un 2%18. El uso de este test es particularmente válido en pacientes que presenten un cuadro de DPC, pues ofrece al clínico una vía para establecer si el dolor pélvico es de origen vesical.
-- Evaluación psicosocial.
-- A veces, y para excluir otros posibles cuadros causantes de dolor pélvico crónico, puede requerirse la realización de una laparoscopia diagnóstica.
Actualmente, la CI se diagnostica a partir de unos criterios internacionalmente aceptados19:
1. Criterios de inclusión (ambos deben estar presentes):
-- Dolor asociado con la vejiga o urgencia miccional.
-- La ya mencionada úlcera de Hunner.
2. Criterios de exclusión, dictados en 1987 por el Instituto Nacional de Salud Americano (tabla 1).
En definitiva, para el diagnóstico de CI debe darse la tríada siguiente: síntomas irritativos (polaquiuria, disuria, nicturia y dolor suprapúbico) que disminuyen tras la micción, ausencia de otros procesos patológicos vesicouretrales y petequias, y hemorragias submucosas en la cistoscopia. La reducción de la capacidad funcional de la vejiga es una constante del proceso, aunque el hallazgo de fibrosis y contractura vesical no se presenta en todos los casos.
DIAGNOSTICO DIFERENCIAL
A la hora de hacer el diagnóstico diferencial de este complejo síndrome doloroso, se deben tener en cuenta todas las estructuras presentes en la pelvis (aparato genital, urológico y digestivo), además de las estructuras musculosqueléticas que la componen. Por tanto, se hará el diagnóstico diferencial con los cuadros que pueden originar un dolor pélvico crónico3:
-- Procesos ginecológicos:
• Dolor ginecológico cíclico: dismenorrea, endometriosis, síndrome premenstrual, síndrome intermenstrual.
• Dolor ginecológico no cíclico: enfermedad pélvica inflamatoria, retroflexión uterina, síndromes congestivos, síndrome del ovario restante, dolor tras la esterilización quirúrgica, cuadros que originan dispareunia (vulvovaginitis, vulvodinia, distrofia vulvar, divertículos uretrales, etc.), adherencias pélvicas, etc.
-- Procesos gastrointestinales: colon irritable, enfermedad inflamatoria intestinal, diverticulosis, dolor de causa neoplásica, dolor no neoplásico del esfínter anal, apendicitis, etc.
-- Causas urológicas: síndrome uretral crónico, vejiga irritable, tumores vesicales, cistitis común, etc.
-- Causas musculosqueléticas: fibromialgia, miositis, traumatismos, etc.
-- También, y como en todo síndrome doloroso crónico, deben tenerse siempre presentes las alteraciones psicológicas que pueden ser causa de dolor o del empeoramiento de un dolor de origen orgánico: depresión, somatización, hipocondriasis, etc.
Es importante resaltar que, ante un cuadro de DPC, hay que realizar una anamnesis lo más pormenorizada posible20, en la que es fundamental que la paciente describa el dolor, el tipo, la localización, las irradiaciones, las agravaciones, las mejorías, etc. Detrás de un cuadro de algia pélvica, lo más frecuente, desde el punto de vista ginecológico, es observar alguno de los siguientes procesos: vestibulitis vulvar, síndrome uretral, cervicitis, endometriosis, enfermedad inflamatoria pélvica residual, varicocele y lesiones ligamentarias, aunque, como hemos referido, hay que descartar procesos urológicos, entre ellos la CI.
En efecto, con los recientes avances experimentados en el conocimiento de la CI, se ha profundizado en los complejos síntomas distintivos de la CI, y están disponibles nuevas técnicas diagnósticas. Los ginecólogos podemos sospechar, ante una paciente con DPC, la presencia de una CI mediante:
-- Un simple cuestionario, el Pelvis Pain and Urgency/Frequency (PUF) Patient Symptom Scale1, que debe usarse antes de cualquier procedimiento invasivo. Sólo se tarda 5 min en completarlo, y la puntuación está comprendida entre 0 y 35, de modo que una puntuación total ≥ 10 se correlaciona directamente con un PST positivo, mientras que una puntuación ≥ 15 indica, con una gran posibilidad, la presencia de una CI.
-- El PST1,17.
Parsons et al1, mediante el PUF y el PST, estiman que aproximadamente 130 millones de mujeres americanas, una de cada 4,5, pueden tener IC.
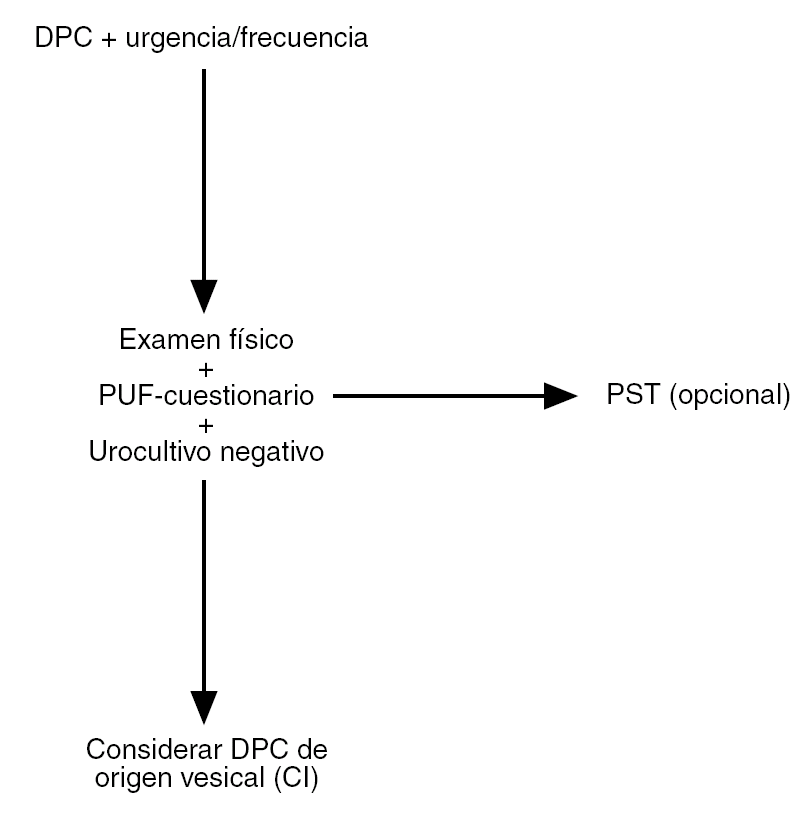
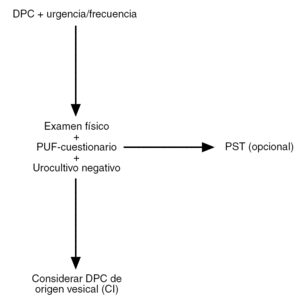
En resumen, tras realizar una cuidadosa historia clínica, el PUF y el PST pueden ayudar al ginecólogo a establecer un diagnóstico de sospecha de CI21, y así ofrecer a las pacientes un tratamiento lo más precoz posible (fig. 1).
Figura 1. Algoritmo simplificado para el diagnóstico de cistitis intersticial (CI)/dolor pélvico crónico (DPC) de origen vesical. PST: Test de sensibilidad al potasio; PUF: Pelvis Pain and Urgency/Frequency Test. Adaptado de Parsons et al. The Female Patient. 2002; Suppl:14.
TRATAMIENTO
Una vez diagnosticado este síndrome, es fundamental realizar una terapéutica eficaz y ágil, pues, si no se trata o si se demora el tratamiento, puede progresar a síntomas graves y continuos, deteriorar sustancialmente la calidad de vida y provocar un daño tisular permanente22. Asimismo, el tratamiento debe ser multimodal23 para poder controlar los distintos mecanismos de la enfermedad responsables de los síntomas mencionados.
No hay tratamientos que sean igual de eficaces para todas las pacientes con CI. Como indican Wesselmann et al4 y Sant24, el tratamiento del dolor asociado a CI, así como de otros síntomas, debe considerarse como parte de un plan terapéutico integral para la CI. Tanto los médicos como los pacientes tienen que trabajar en estrecha colaboración para adaptar el tratamiento y conseguir buenos resultados.
Normas generales
Dichas normas están dirigidas a suprimir o intentar evitar en lo posible los modos de vida estresantes y excluir los posibles irritantes de la dieta. Así, los alimentos que causan irritación son sustancias que contienen cafeína (café, chocolate), frutas ácidas (incluidos zumos), alcohol, tomates y bebidas carbónicas. Sin embargo, cada paciente es diferente. Seguir a diario los alimentos consumidos y los síntomas que aparecen puede ayudar a las pacientes a identificar el alimento causante.
Tratamiento farmacológico de uso sistémico
En términos generales, los buenos resultados se apoyan en la siguiente tríada terapéutica:
1. Lograr la desactivación de las terminaciones nerviosas sensitivas mediante el empleo de amitriptilina, imipramina o algún inhibidor de la recaptación de serotonina.
2. Inhibir la respuesta alérgica con el uso de antihistamínicos.
3. Control del epitelio disfuncional mediante compuestos heparinoides.
Por tanto, usaremos:
-- Antidepresivos tricíclicos, como la amitriptilina, para aumentar el umbral del dolor25. Hay que tener en cuenta que la CI es un complejo sindrómico y el dolor es, generalmente, el peor de los síntomas. La dosis de amitriptilina será de 25 mg/día, tomada a la hora de acostarse, y se incrementará a 50 mg/día después de 1-2 meses. Su principal efecto secundario es la sedación. En general, su administración a largo plazo es un aceptable, seguro y efectivo tratamiento de la CI26.
-- Antihistamínicos, cuya presunta acción sería inhibir los efectos producidos por la histamina liberada por los mastocitos, con un índice de respuesta de alrededor del 50%:
• Hidroxicina diclorhidrato (Atarax®), con la misma posología que la amitriptilina. Es un antagonista de receptores H1.
• Cimetidina (anti-H2).
-- Heparina de bajo peso molecular, con efecto antiinflamatorio y antihistamínico. Pudiera actuar restituyendo la capa de mucina del urotelio vesical.
-- Pentosanpolisulfato (PPS) oral (Elmiron®) en tandas de 2 meses. Se trata de un agente anticoagulante, con menos efectos adversos que una anticoagulación convencional con agentes antivitamina K. La estructura molecular del PPS es similar a la de los glucosaminoglucanos presentes en la superficie mucosa vesical. Este medicamento, que es el único por vía oral aprobado para el tratamiento de la CI en Estados Unidos, se cree que ayuda a restaurar la capa mucosa y así, restablecer la impermeabilidad a las soluciones urinarias. Diversos estudios clínicos27-34 muestran que el PPS es eficaz en el tratamiento de la CI. Sus efectos adversos tienden a ser leves, infrecuentes y transitorios, y los más frecuentes son: alopecia, diarrea, náuseas, cefalea, exantema cutáneo, dispepsia y dolor abdominal31. La dosis estándar es de 100 mg, 3 veces al día, administrado 1 h antes o 2 h después de la comida31. El PPS se puede asociar con hidroxicina o amitriptilina para tratar los síntomas relevantes en casos graves o avanzados.
-- Otros fármacos de uso sistémico35:
•L-arginina oral, en dosis de 1.500 mg/día.
•Ciclosporina, en dosis de 1,5 mg/kg 2 veces al día. Diversos estudios recientes36,37 llegan a la conclusión de que este preparado es superior al PPS desde el punto de vista de los resultados terapéuticos, de tal forma que debe considerarse como una opción en pacientes con CI grave en las que ha fallado otros tratamientos.
• Inmunosupresores (azatioprina), con mejoría clínica evidente, pero con importantes efectos secundarios (leucopenia, inmunodepresión).
• Corticoides, que mejoran la inflamación, pero cuyo uso prolongado se debe desaconsejar por sus efectos colaterales. Soucy y Gregoire38 administraron prednisona, 25 mg/día durante 1-2 meses, disminuyendo posteriormente la dosis, en casos de pacientes con CI grave ulcerativa que no respondían a tratamientos convencionales, y obtuvieron buenos resultados, especialmente en el control del dolor asociado al cuadro.
• Analgésicos no opiáceos u opiáceos (fundamentalmente estos últimos, en casos muy seleccionados).
• Montelukast (Singulair), antagonista de receptor de leucotrieno I, usado habitualmente en el tratamiento del asma. En el caso de la CI y en dosis de 10 mg/día, durante 2 meses, consigue disminuir el dolor y la frecuencia miccional.
• Factor de crecimiento nervioso, usado una vez por semana durante 3 meses.
• Glicerofosfato cálcico.
• Dextroanfetamina sulfato, que puede ser una terapia muy eficaz en los recalcitrantes casos de CI39.
Tratamiento farmacológico de aplicación intravesical
Los pacientes con CI se pueden beneficiar de la instilación intravesical40 de soluciones terapéuticas. Dicha terapia, no ha experimentado grandes cambios durante los últimos años41. Se usan los siguientes preparados:
-- Instilaciones intravesicales con dimetilsulfóxido (DMSO) que, gracias a su efecto analgésico, espasmolítico y antiinflamatorio, se han mostrado eficaces en el 70-80% de las pacientes, con una duración entre 2 y 12 meses. Se administra en dosis de 50 ml al 50%, que se retiene en la vejiga 15-30 min, repitiendo su administración a intervalos de 2-4 semanas. La mayoría de los autores16,41 confirma su eficacia y seguridad, y no presenta efectos secundarios. Es uno de los pocos fármacos aprobados por la Food and Drug Administration en el tratamiento de la CI. Es raro, pero puede aparecer dolor durante su instilación, en cuyo caso se debe usar lidocaína, 10 ml al 1%. Más raro aún es que provoque una alteración del cristalino y la elevación de las enzimas hepáticas.
-- Nitrato de plata. En desuso, por disponerse de mejores terapias y por sus posibles complicaciones, al ser un cáustico.
-- Capsaicina, que puede actuar causando una desensibilización de las fibras nerviosas aferentes del dolor.
-- Ácido hialurónico42, cuya instilación local intentaría reponer los valores normales subepiteliales previos a la instauración de la enfermedad.
-- Bacilo Calmette-Guérin (BCG). Aunque su perfil de seguridad es aceptable, su efectividad en el tratamiento de pacientes con CI moderada o grave no ha sido corroborada43.
-- Cromoglicato sódico al 4%. Se trata de un agente estabilizador de mastocitos que inhibiría la liberación de histamina.
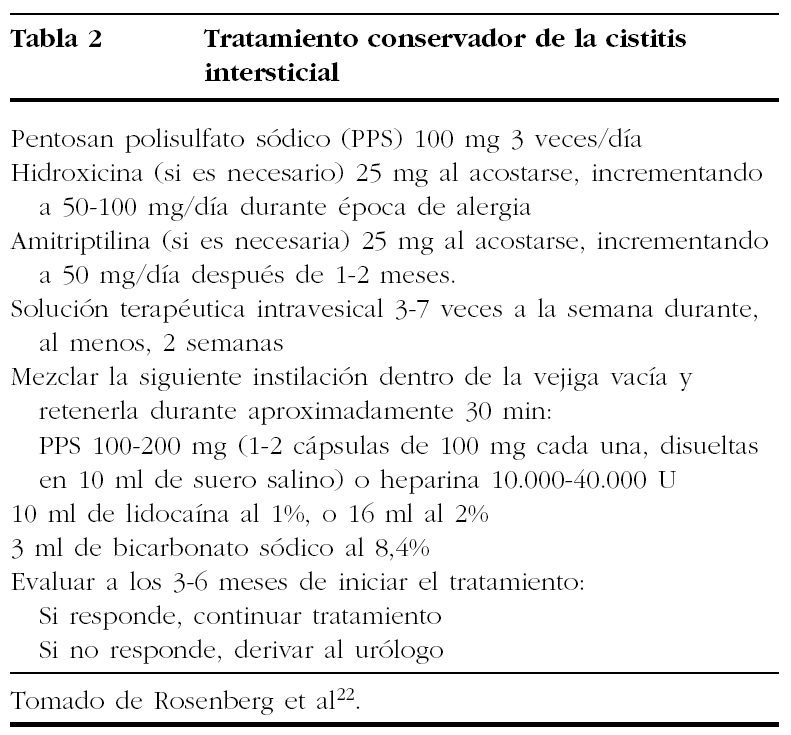
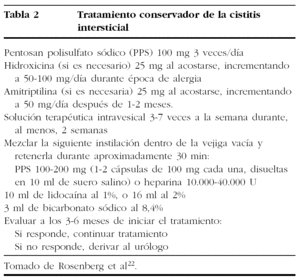
-- Nuevas soluciones. Incluyen la combinación22 de PPS 100-200 mg (1-2 cápsulas de 100 mg cada una disueltas en 10 ml de solución salina) o heparina, 10.000-40.000 U, y ayudan a reparar y restaurar la mucosa vesical, con 10 ml de lidocaína al 1% o 16 ml al 2%, usada como anestésico, y 3 ml bicarbonato sódico al 8%, empleado para incrementar la absorción de la lidocaína. En un estudio31, dicha solución intravesical alivió los síntomas inmediatamente y de forma significativa en 41 (75%) de 55 pacientes con CI. Se puede enseñar fácilmente a las pacientes a preparar la solución en casa.
En estos tratamientos farmacológicos con instilación intravesical se debe hacer una evaluación a los 3-6 meses de iniciar el tratamiento22 (tabla 2):
-- Si responden al tratamiento, se debe mantener la misma pauta.
-- Si no hay una respuesta adecuada, se debe derivar a las pacientes al urólogo, para realizar un estudio cistoscópico.
En una reciente revisión realizada por Karsenty et al44 de las publicaciones en inglés sobre la CI, desde enero de 1966 hasta agosto de 2005 listadas en MEDLINE, y seleccionando los estudios clínicos sobre el tratamiento de la CI, estos autores hallan que 3 terapias están sustentadas con un alto nivel de evidencia: la cimetidina y la amitriptilina orales y la aplicación intravesical de DMSO.
Tratamientos físicos
-- TENS (transcutaneous electrical nerve stimulation). Método no invasivo que influencia la señal sensorial de un área dolorosa. Aunque es un tratamiento prometedor, que consigue una disminución de la frecuencia miccional y el dolor, la experiencia clínica con esta nueva modalidad terapéutica es aún muy limitada.
-- Distensión vesical, practicada al mismo tiempo que la cistoscopia, aunque también es factible realizarla con balón de Helmstein. Tiene un triple valor: terapéutico (mejoría de la clínica), diagnóstico (el que nos proporciona ya de por sí la cistoscopia) y pronóstico (una capacidad inferior a 200 ml indica un peor pronóstico). Esta técnica, que se debe practicar siempre con anestesia general, se realiza distendiendo la vejiga durante 1-2 min a una presión de 80 cmH2O, y procediendo tras la cistoscopia a una segunda distensión vesical durante 8 min.
El mecanismo por el cual la hidrodistensión mejora los síntomas se desconoce. La mejoría producida por este mecanismo tiene una duración relativamente corta, con una media de 2 meses45; puede repetirse el procedimiento, aunque parece ser que, a medida que la enfermedad progresa, los síntomas se hacen más refractarios al tratamiento mediante hidrodistensión vesical16. Un grupo de investigadores canadiense45 halló que la hidrodistensión vesical tiene una escasa aplicación como método diagnóstico, mientras que, como terapéutica, en el 56% de las pacientes se obtuvo una mejoría clínica.
Sus posibles complicaciones incluyen la hematuria, la retención urinaria y la rotura vesical.
-- Acupuntura, con efectos limitados. Pretende tratar la frecuencia y la urgencia.
-- Denervación periférica, rara vez indicada.
-- Fotorradiación con láser, con escasos resultados.
-- Terapia con oxígeno hiperbárico. Van Opphoven et al46 comunican que un total de 30 sesiones constituye un tratamiento seguro y efectivo, y con él se obtiene una importante mejoría sintomática.
-- Masaje transvaginal de la musculatura del suelo pélvico mediante la técnica de Thiele47.
Tratamiento quirúrgico
Cirugía endoscópica
-- Resección transureteral (RTU) de lesiones vesicales. Puede producir remisiones parciales, aunque la clínica suele recidivar y su práctica repetida puede condicionar la aparición de microvejiga retráctil. Es una técnica que no tiene ninguna aplicación en la forma no ulcerativa.
-- Láser. Se usa el de neodimio-Yag. Su ventaja con respecto a la RTU es que disminuye la formación de cicatrices, y se puede aplicar a las formas ulcerativas.
Cirugía abierta
-- Denervación vesical. Método antiálgico en pacientes que no responden a ninguna terapéutica y con una clínica muy acusada; se puede realizar una resección presacra, radiculotomías de los plexos sacros, cordotomías, etc. Todas éstas son técnicas agresivas, con resultados dispares y que pueden tener como complicación fundamental el desarrollo de una vejiga neurógena.
-- Cistoplastia de aumento, indicada en los casos con reducción grave de la capacidad funcional vesical.
-- Cistectomía supratrigonal.
-- La cistectomía total, con derivación urinaria externa, también podría estar indicada, aunque esta opción radical debe reservarse como último recurso, cuando la enfermedad es totalmente refractaria a cualquier otro tratamiento.
El seguimiento de estas pacientes es esencial. Es importante realizar un tratamiento y un seguimiento apropiados, para evitar, por ejemplo, tratamientos quirúrgicos innecesarios. Rosenberg et al22 llevan a cabo revisiones mensuales durante los 3 primeros meses y, posteriormente, cada 3 meses. Las pacientes deben comprender que la enfermedad se caracteriza por la aparición de períodos intermitentes de exacerbaciones y remisiones. Las exacerbaciones periódicas se tratan cuando se presentan, porque no se ha demostrado que la terapia a largo plazo sirva para prevenir o retrasar los episodios recurrentes.
Correspondencia:
Dr. J.L. Gallo Vallejo.
Acera del Darro, 92, 3.o F. 18005 Granada. España.
Correo electrónico: jgallov@sego.es
Fecha de recepción: 8/9/2006.
Aceptado para su publicación: 12/12/2006.