INTRODUCCIÓN
El cáncer de cérvix es todavía el cáncer genital que causa más muertes en el mundo1, con una incidencia estimada en casi medio millón de casos anuales2, sólo inferior a la del cáncer de mama. En Europa occidental, Estados Unidos y Canadá, países en los que sus tasas han disminuido mucho en los últimos años, su incidencia es superada por la del cáncer de endometrio.
El cáncer invasivo de cérvix, cuya incidencia ha estado habitualmente en España por debajo de la de otros países de su entorno, es un proceso en retroceso, debido verosímilmente a la generalización de los cuidados médicos dentro del Sistema Nacional de Salud y de la práctica de los estudios citológicos, al igual que ha sucedido en otros países3-7. No existen en España datos ciertos de su prevalencia y mortalidad para todo el país y algunos estudios presentan los datos de cérvix junto a los de endometrio, con una tasa de mortalidad de 8,62/100.0008, y los datos de los registros de cáncer españoles son citados entre los más bajos de la bibliografía2. La incidencia de cáncer cervical uterino oscila entre 6,3 y 16,6 casos por cada 100.000 mujeres, siendo la mortalidad de 3 por 100.0009 en 1995, lo que representaría aproximadamente el 1,6% de las muertes por tumores malignos y el 0,3% de todas las muertes en mujeres10. En Estados Unidos es de 9,3 por 100.000 personas, con una tendencia de cambio anual del 2,6% y la tasa de mortalidad de 2,9 por 100.00011. En Suecia, la incidencia es de 10 por 100.000 mujeres.
Los estudios citológicos y colposcópicos que permiten diagnosticar la enfermedad en estadios premalignos han sido elementos fundamentales en la disminución de su prevalencia, al facilitar el tratamiento preventivo del cáncer de cérvix o en sus grados invasivos más limitados12, aunque no dejen de establecerse críticas a los programas de cribado establecidos13.
En los últimos años se ha hecho evidente el papel necesario de la infección por virus del papiloma humano (VPH) en su oncogénesis, lo que comienza a favorecer cambios en el diagnóstico y, obligatoriamente en el futuro, en su tratamiento14-18. Otros factores de riesgo como el tabaquismo, la paridad, la utilización de contraceptivos hormonales, otras infecciones (como la del sida), la dieta o la susceptibilidad del huésped deben integrarse en el contexto de la infectabilidad por el VPH o de la historia natural del cáncer cervical después de la infección19.
Con respecto al tratamiento, a las 2 grandes corrientes existentes, la quirúrgica y la radioterápica, ha venido a sumarse con éxito el empleo de la quimioterapia asociada a la radioterapia20-26.
Para conocer la situación actual de la atención al cáncer invasivo de cérvix en España, la Sección de Ginecología Oncológica y de Patología Mamaria de la Sociedad Española de Ginecología y Obstetricia (SEGO), que ya había recogido datos acerca de esta patología para casos diagnosticados entre 1982 y 198927, determinó realizar una encuesta nacional sobre los casos atendidos en 1995 en hospitales españoles. Como objetivos principales se consideraron la forma de realizar el diagnóstico, su tratamiento y, sobre todo, las tasas de supervivencia.
SUJETOS Y MÉTODOS
En el año 2001, la Sección de Ginecología Oncológica y de Patología Mamaria de la SEGO realizó una encuesta sobre casos de cáncer invasivo de cérvix diagnosticados y tratados en 1995, dirigida a todos los hospitales españoles con departamentos o servicios de ginecología y canalizada por medio de su web (www.segoncol.es); en ella se establecían ítems sobre factores epidémicos, diagnóstico, características de los tumores, tratamiento, complicaciones, evolución y supervivencia. Sus resultados preliminares y la metodología empleada fueron presentados en la XXIV Reunión de la Sección, en Madrid en 200128.
Contestaron a la encuesta 45 hospitales de 15 de las 17 comunidades de España, que informaron de 633 casos. El número de casos informados por hospital osciló entre 1 y 40, siendo la mediana de 11 casos. Pudieron procesarse 578 fichas, aunque no todas respondían a todos los apartados.
Para el procesamiento estadístico de los datos se utilizó un paquete estadístico Statscalc. Para el análisis estadístico de la supervivencia se empleó el método de Kaplan-Meyer, y con objeto de determinar si las variables estudiadas tenían relación con los resultados a los 5 años se llevó a cabo un análisis univariante mediante el test de la χ2. El grado de asociación se determinó mediante el cálculo de la odds ratio (OR) y su intervalo de confianza (IC) del 95%. Se estudiaron todas las variables incluidas en la recogida de datos, y se agruparon en 4 apartados: variables dependientes de la paciente (edad, edad de inicio de las relaciones sexuales, paridad, edad del primer parto, número de compañeros sexuales y patología cervical previa); variables dependientes del tumor (localización, histología, diferenciación tumoral, estadio y afección ganglionar); variables dependientes del tratamiento realizado (primario o secundario, cirugía frente a radioterapia), y variables dependientes de la evolución (recidivas pelvianas y metástasis). Se realizó también el análisis multivariante de las variables pronósticas de supervivencia a 5 años mediante regresión logística paso a paso (regresión de Cox) de las variables que en análisis univariante presentaron p < 0,01.
RESULTADOS
Epidemiología
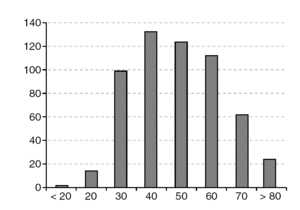
La edad media de las pacientes al diagnóstico fue de 51,2 años (desviación estándar [DE]: 15,5 años). La década de mayor incidencia fue la de los 40 años (fig. 1). El rango estuvo comprendido entre 5 y 92 años.
Figura 1.Numero de casos por décadas de edad.
El 50,2% de las pacientes referían haber iniciado las relaciones sexuales antes de los 20 años y de éstas el 27% antes de los 16 años. El 38% las inició entre los 21 y 25 años y el resto, el 11,4%, después de los 26 años. No se obtuvieron datos significativos sobre promiscuidad sexual u otros factores posiblemente etiológicos. Eran casadas o tenían una pareja estable el 82,4% de las pacientes en las que pudo determinarse el dato (319 fichas); el 17,6% tenía o había tenido más de un compañero sexual. El 28,5% de estas mismas mujeres tuvo su primer hijo antes de los 21 años.
Ocho de las 578 (1,6%) pacientes estudiadas eran seropositivas para el virus de la inmunodeficiencia humana (VIH) y 4 más se consideraron en inmunosupresión; una paciente tenía sífilis.
En 65 (11,2%) pacientes se encontraron antecedentes de diagnóstico de lesiones premalignas o microinvasivas (4 casos). A 16 (2,7%) pacientes se les había diagnosticado infección por el VPH.
Diagnóstico
El diagnóstico definitivo de cáncer de cérvix se llevó a cabo en el 74% de los casos por biopsia de cérvix; en el 11% después de conización y en el 8,5% por otras pruebas como colposcopia o legrado fraccionado. En el 6,5% solamente se cita la citología como prueba diagnóstica, y 2 casos se hallaron casualmente en el estudio de la pieza de histerectomía realizada por otro proceso.
En 302 (52,4%) casos el tumor estaba localizado en el exocérvix y en 103 (17,9%) en el endocérvix. En 106 (18,3%) casos se afectaban ambas partes. Diez casos se citaban en otra localización y no constaba ésta en 56 (9,7%).
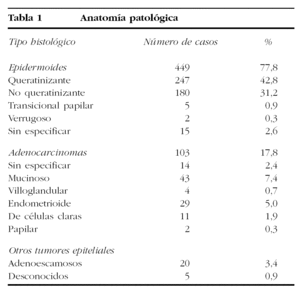
En cuanto a su histología (tabla 1), la mayor parte de los tumores eran epidermoides (77,8%), pero se refirieron como adenocarcinomas el 17,8%. Poseían tejidos malignos de ambas líneas el 2,4% de los casos; se diagnosticaron 6 casos como adenoacantomas y en 5 más no se conocía la variedad histológica.
El grado histológico de diferenciación se desconocía en el 20% de los casos y el 3% de los tumores se refirió como inclasificable. El resto de los tumores mostraban bajo grado de diferenciación en el 30,9% de los tumores epidermoides queratinizantes, en el 32,8% de los tumores epidermoides no queratinizantes y en el 12,9% de los adenocarcinomas.
Se diagnosticaron 283 (49,3%) casos en estadio I; 158 (27,5%) en estadio II; 93 (16,2%) en estadio III, y 27 (4,6%) en estadio IV. Los estadios IB fueron los más frecuentes (37,5%), seguidos de los IIB (19,7%) y de los IIIB (14,8%).
Tratamiento (tabla 2)
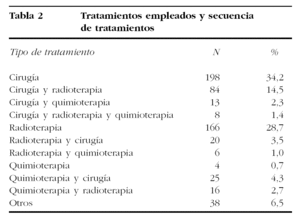
El tratamiento inicial más empleado fue la cirugía, en el 50,7% de las ocasiones. Se empleó radioterapia como primer tratamiento en el 34,4% de las pacientes, y quimioterapia en primera instancia en el 5,4%. Radioterapia y quimioterapia simultáneas se emplearon de entrada en el 2,4% de los casos. La cirugía fue el único tratamiento de 198 (34,2%) pacientes, y la radioterapia de 166 (28,7%). En 104 (18%) casos se emplearon secuencialmente cirugía y radioterapia. Generalmente, la cirugía (84 casos) precedió a la radioterapia, aunque en 20 casos se realizó antes la radioterapia. Después de quimioterapia se practicó cirugía al 4,3% de las pacientes.
La intervención quirúrgica más practicada fue la operación de Wertheim-Meigs (el 65% de todas las intervenciones); seguida de la histerectomía extrafascial (25%), asociada en el 20% de las ocasiones a linfadenectomías pelvianas y paraaórticas. La histerectomía radical de Shauta se hizo al 0,7% de las pacientes. El 9,5% de los casos se hicieron conizaciones o intervenciones paliativas. La cirugía fue el arma más empleada en el tratamiento de los estadios tempranos de cáncer de cérvix, llegando a ser el tratamiento de elección del 97, el 81,7 y el 62% de los estadios IA, IB y IIA, respectivamente.
Cuando la cirugía fue precedida de radioterapia, la intervención más practicada fue la histerectomía extrafascial (55,5%), seguida de la intervención de Wertheim (27,5%). Solamente se realizó 1 (0,3%) exenteración pelviana e intervenciones paliativas en el 7,9%.
El 22,5% de las intervenciones de Wertheim tuvieron alguna complicación, fundamentalmente urinaria; las lesiones vesicales que fueron la complicación más frecuente (20,4%) se repararon habitualmente durante la intervención. Hubo un 8,1% de fístulas.
La radioterapia fue el primer tratamiento en los estadios más avanzados: el 70,3, el 83,5 y el 63,5%, respectivamente, para los estadios IIB, IIIA y IIIB, aunque la quimioterapia se emplea cada vez más en los más avanzados.
Se utilizó fundamentalmente con las técnicas de radioterapia externa a dosis de 50 Gy, generalmente complementada con sobreimpresiones de hasta 20 Gy. No se indicaron datos concretos de braquiterapia.
Se presentaron complicaciones en el 35% de las pacientes tratadas con radioterapia, siendo las más frecuentes la enteritis (14%), la cistitis (11,4%) y la fibrosis pelviana (10%). Fístulas, sin especificar, sucedieron en el 7,1% de los casos tras el tratamiento radioterápico.
La quimioterapia se empleó como primer tratamiento en el 14,1% de los estadios IIIB y en el 13,7% de los estadios IV.
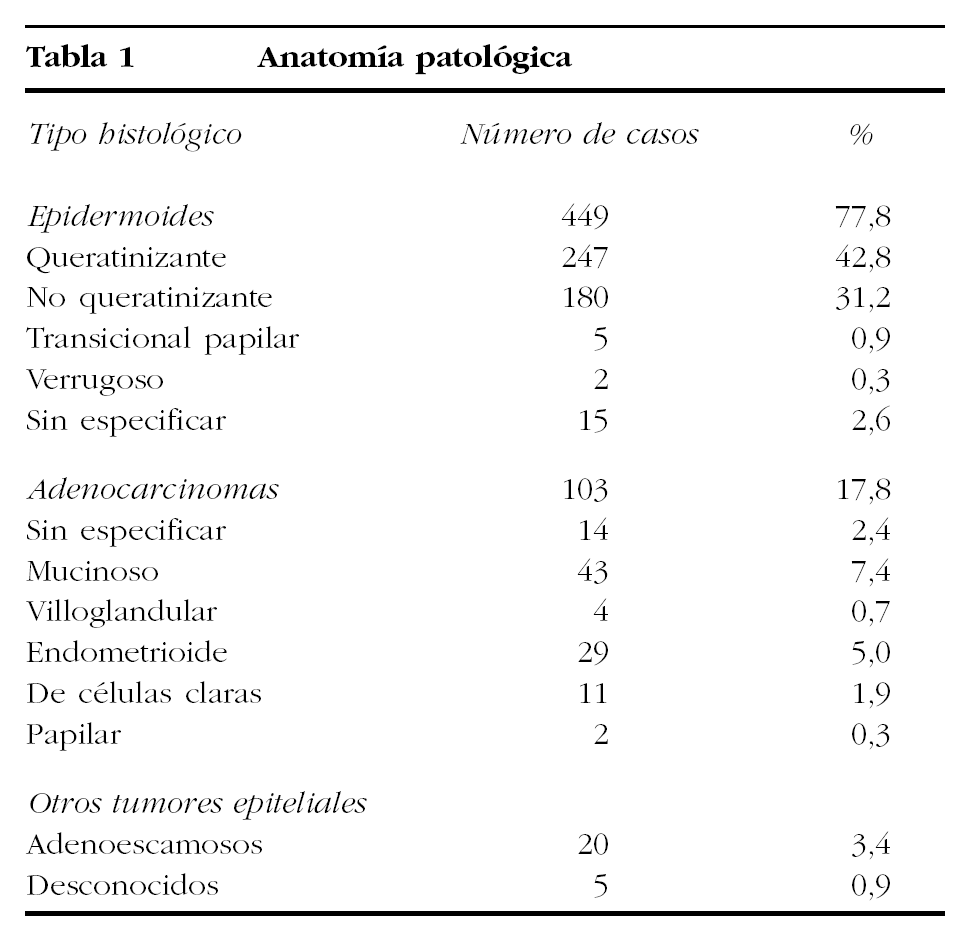
Evolución y supervivencia (fig. 2)
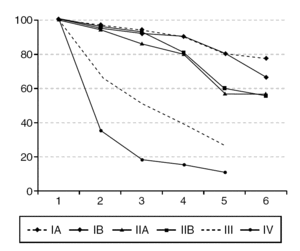
Figura 2. Supervivencia del cáncer invasivo de cérvix, según estadios en porcentajes y años de seguimiento.
Al evaluar la supervivencia a los 5 años del diagnóstico, se observa que 322 (56,4%) pacientes estaban vivas, de ellas 304 (52,5%) en remisión completa, y el resto 18 (3,1%) con enfermedad. Habían muerto 143 (24,7%) pacientes, de ellas 129 (22,3%) por el cáncer y 14 (2,4%) por enfermedad intercurrente. Se desconocía su estado o se habían perdido en el seguimiento 113 (19,4%) pacientes.
La supervivencia de las pacientes muestra una tendencia descendente a medida que la edad es mayor.
La supervivencia se relaciona con la estadificación de la enfermedad, de forma que como se ve en la figura 2, el 84,6% de las pacientes en estadio IA y el 80,8% de aquellas en estadio IB sobreviven; las pacientes en estadio II sobreviven a los 5 años entre el 52,3 y el 54,7%, según se clasifiquen como IIB o IIA. La supervivencia de los estadios III es del 24,4% para los casos IIIA y del 26,4% para los IIIB. El 19% de las pacientes clasificadas en estadio IVA sobrevivieron a los 5 años, y no sobrevivió ninguna de los estadios IVB.
Las pacientes con carcinomas epidermoides sobrevivieron en el 55,6% de los casos y en el 54,6% de los adenocarcinomas. Los casos bien diferenciados tuvieron una supervivencia a los 5 años del 63%, frente al 54,5% de los moderadamente diferenciados y al 45% de los indiferenciados.
Cuando la enfermedad no había producido afección ganglionar, la supervivencia fue del 61,4%, frente al 38,5% de las pacientes con afección (p = 0,00).
En relación con el tratamiento aplicado, las tasas de supervivencia oscilan entre el 75% de las pacientes tratadas con cirugía exclusivamente y el 41% de las pacientes tratadas solamente con radioterapia. Las pacientes tratadas con cirugía y radioterapia sobrevivieron en el 61% de los casos y las que se trataron con quimioterapia primero y cirugía después en el 55%.
Se analizaron los casos que recibieron tratamiento presumiblemente completo hasta el estadio IIB, y se observó que los que recurrieron después lo hicieron fundamentalmente de forma local, central o a la pared pelviana, en el 70,2% de los casos y metatastizaron a distancia el 29,8% (tabla 3). Las metástasis a distancia fueron tanto más frecuentes cuanto más avanzados eran los casos, oscilando entre el 1,5% de los estadios IA y el 7% de los estadios IIB, y entre las pacientes cuyo tratamiento había sido exclusivamente radioterápico (58,8%) que cuando había sido quirúrgico (41,1%; p = 0,00). La recidiva central fue más frecuente en las pacientes quirúrgicas (52,3%) que en las tratadas con radioterapia (47,0%; p = no significativo [NS]). La progresión a las paredes pelvianas se observó con más frecuencia entre las pacientes tratadas con radioterapia que tras cirugía (el 63,6 frente al 36,4%; p = 0,000).
Las metástasis a distancia se produjeron sobre todo en el pulmón (50%) y menos frecuentemente en el hígado, los ganglios linfáticos paraaórticos, el recto, el peritoneo y el cerebro.
El estudio estadístico univariante encontró que, aunque las variables dependientes de la paciente (inicio de las relaciones sexuales antes de los 20 años, paridad, primer parto antes de los 20 años o la existencia de múltiples parejas sexuales) tienen importancia en la aparición del cáncer invasivo de cérvix, no presentaron en esta casuística significación estadística para el pronóstico.
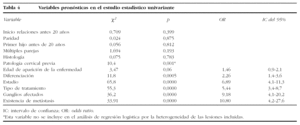
Otras variables (tabla 4) se presentaron en el análisis con significación pronóstica: la existencia de patología cervical previa, el estadio y el grado de diferenciación histológico, la existencia de ganglios linfáticos afectados o la aparición de metástasis, así como el tratamiento utilizado. La histología del tumor no mostró significación estadística.
En la tabla 5 se describen las variables "candidato" incluidas en el modelo de regresión logística que predicen la supervivencia a los 5 años: el estadio tumoral y el tipo de tratamiento. El estadio tumoral establecía peor pronóstico cuanto más avanzado fuera, con 3,4 veces más posibilidades de fallecer a los 5 años que las de estadios precoces (IC del 95%, 1,63-7,0). También las pacientes que han tenido que ser tratadas con radioterapia tienen más posibilidades de fallecimiento que las que se tratan quirúrgicamente (OR: 3,5; IC del 95%, 1,96-6,23).
DISCUSIÓN
La edad media de las pacientes de la encuesta en el momento del diagnóstico fue de 51,2 años, similar a la de las pacientes de la casuística de la FIGO (51,6 años), y de la casuística americana (52 años) del programa SEER29. Cuando se compara con la casuística anterior de nuestra sociedad27, se observa que la edad al diagnóstico es menor ahora (55,7 años en los casos de 1982-1989), lo que indica que el diagnóstico se hace más pronto, seguramente por los mejores cuidados a la mujer y la extensión de los estudios citológicos. El pico de mayor incidencia del diagnóstico se encontraba en la casuística antigua en la década de los 51 a 60 años (el 26,4% de los casos) y ahora se localiza en la década anterior (el 23,2% de todos los casos).
Desde el punto de vista epidemiológico, merece reseñarse el inicio temprano de las relaciones sexuales, antes de los 16 años, del 27% de las pacientes, lo que se acepta como factor de riesgo30-32. En cuanto al dato de la promiscuidad sexual, aunque el 17,6% tenía o había tenido más de un compañero sexual, al no constar en las historias el número concreto de compañeros sexuales, se desconoce cuántas habían tenido 4 o más compañeros, que es el nivel en el que se ha observado relación en otras casuísticas33-35.
El número de pacientes con infecciones conocidas relacionadas con la enfermedad es bajo, como lo prueba que el diagnóstico de infecciones por el VPH haya sido sólo del 2,7% de los casos, lo que indica que en esta época no se buscaba su diagnóstico. Por otro lado, se asiste ya a la recogida de casos en pacientes inmunodeprimidas (16 casos) que en la casuística anterior no se citaban.
Aunque es de suponer que la sospecha diagnóstica se haya establecido por la citología o incluso por la clínica, se refiere que la mayor parte de los diagnósticos se hicieron por biopsia y que en el 11% se hizo después de realizar conización, que lógicamente fue precedida de biopsia que seguramente indicaba una lesión menor pero obligaba a la intervención quirúrgica. El estudio de la localización tumoral no arrojaba datos de interés especial.
La distribución histológica de los casos (el 77,8% de casos epidermoides y el 9,8% de adenocarcinomas) se corresponde con lo que se encuentra en la bibliografía (el 78,9 y el 9,7%, respectivamente, en la casuística de la FIGO) y es semejante a la de nuestra casuística anterior (el 85,1 y el 11,3%), sin que parezca observarse el aumento de adenocarcinomas que también se ha referido36-39, salvo que se agrupen todos los tipos de adenocarcinomas (adenoescamosos, de células claras, etc.), en cuyo caso se alcanzaría la cifra del 17,8%, semejante al 18,3% de adenocarcinomas puros de alguna casuística nórdica40.
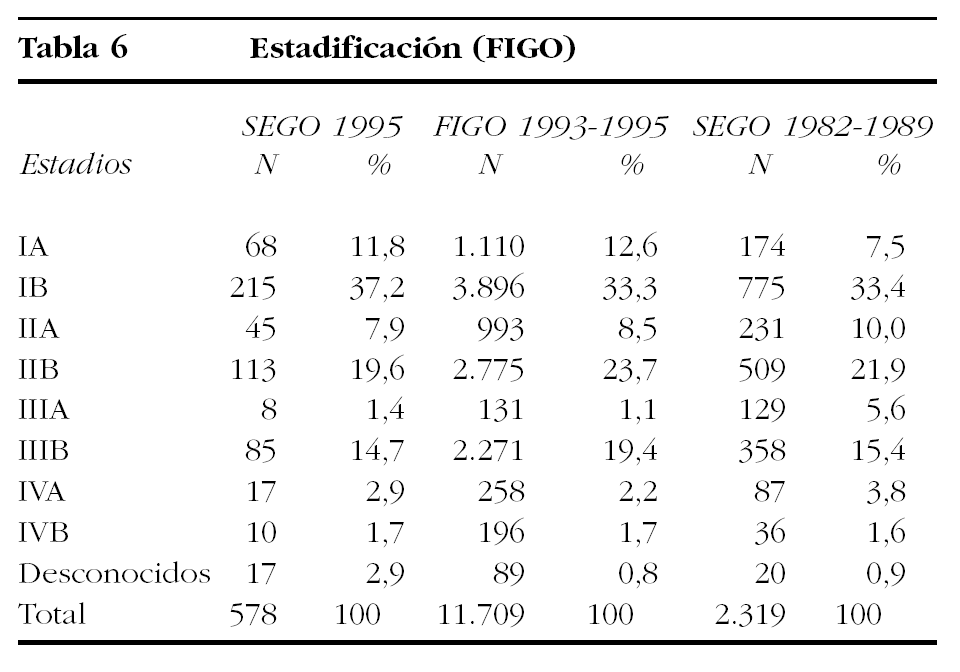
Comparando las 2 casuísticas nacionales que pueden observarse en la tabla 6, en la que se muestran también los datos del 24.o informe de la FIGO24, puede observarse que los estadios I (los preferentemente quirúrgicos) son más frecuentes en 1995 que en los años 1982-1989 (χ2 = 19,37; p = 0,0000), siendo entre ellos los estadios IB los más frecuentes (χ2 = 5,93; p < 0,016). Si se agrupan los estadios I y IIa, también eminentemente quirúrgicos, la significación se mantiene (χ2 = 12,99; p = 0,0000). Como es lógico, los estadios avanzados son también más frecuentes en la casuística anterior (χ2 = 10,89; p = 0,0000). Estos hallazgos apoyan la idea de que se ha progresado en el diagnóstico más temprano del cáncer de cérvix, aunque todavía exista un 20,8% de casos que se diagnostican en estadios avanzados que, aunque se compara favorablemente con el 24,4% que se halla en la casuística de la FIGO de los años 1993-199524, está lejos del 12,2% de los registros de la SEER29 y, también, del 15,9% de los casos de los hospitales españoles que incluyeron sus datos en el 24.o informe de la FIGO24.
En nuestro medio, la cirugía es el tratamiento más utilizado en los estadios iniciales, empleándose la radioterapia como tratamiento adyuvante a la cirugía o para los estadios avanzados, de acuerdo con lo que es habitual en muchos países de occidente41-45. Sin embargo, ya comienzan a realizarse tratamientos con quimioterapia y radioterapia simultáneas que están obteniendo una progresiva difusión en nuestros hospitales, como sucede en otros lugares46-49.
La intervención quirúrgica más realizada sigue siendo la histerectomía radical de Wertheim, como en la casuística anterior, con ella se tratan preferentemente los estadios IB y IIA. Esto contrasta con los datos de la casuística de la FIGO, en la que se refiere que el tratamiento más usado continúa siendo la radioterapia, sola o asociada a otros tratamientos24,50. El hecho de que los resultados sean en nuestra casuística notablemente superiores con cirugía que con radioterapia viene determinado por la diferencia del grado de la enfermedad en que se emplean estos procedimientos en nuestro medio.
A pesar de que la edad del diagnóstico de la enfermedad es más temprana que anteriormente y de que los casos se diagnostiquen en estadios más favorables que en la casuística previa, llama la atención que los resultados en términos de supervivencia sean ahora peores. El 64,3% de las pacientes de 1982-1989 estaban vivas a los 5 años, frente al 56,4% de los casos de 1995 (el 54,8% a los 10 años). La supervivencia actuarial de los casos de la FIGO de 1990-19921 fue del 65,4% y del 72,2% para los casos de 1993-199524. La supervivencia actuarial a los 5 años de los tumores recogidos por la SEER es del 70,7% para los casos de 1992-1994 y del 72,7% para los comprendidos entre 1995 y 200011.
En nuestra encuesta se cita que el 22,3% de las pacientes habían muerto por cáncer frente al 27,6% de las pacientes de 1982-1989, y se habían perdido del seguimiento el 19,4% de las pacientes, frente al 10,6% de las pacientes de la casuística más antigua.
De los análisis estadísticos practicados se desprende que algunos factores como las relaciones sexuales tempranas, la promiscuidad sexual y la paridad temprana se asocian con la aparición del cáncer de cérvix, lo que se comprueba en otras casuísticas31-34, aunque no tienen importancia pronóstica. Se han encontrado diversos factores que influyen en el pronóstico de la enfermedad en análisis univariados, como la profundidad de la invasión, el tamaño del tumor, el estadio tumoral, la afección ganglionar y la del espacio linfovascular51. En estudios realizados con análisis multivariante en pacientes tratadas con cirugía radical, se halló que los factores más importantes en el pronóstico fueron el estado ganglionar, la invasión parametrial, la afección del espacio linfovascular, así como el tipo histológico del adenocarcinoma52,53. Las variables pronósticas identificadas por el análisis de regresión logística, en nuestro estudio fueron la extensión de la enfermedad, el estadio y el tipo de tratamiento empleado que, como sabemos, están muy relacionadas en la práctica. Esta última variable, el tratamiento, no podría valorarse correctamente salvo por la realización de estudios prospectivos aleatorizados, muy difíciles en la práctica. Con los datos obtenidos, se halla que las pacientes con estadio tumoral avanzado presentan 3,4 veces más posibilidades de fallecer en los primeros 5 años que las pacientes con estadios precoces, y que las pacientes tratadas con radioterapia tienen 3,5 veces menos posibilidades de supervivencia en nuestra casuística, que las que son tratadas con cirugía exclusivamente, pero esto tiene el sesgo del diferente empleo de estas técnicas; la radioterapia se emplea preferentemente en casos más avanzados.
La comparación de los datos actuales con los de la casuística previa permite encontrar discordancias importantes en los resultados que se obtienen en términos de supervivencia a los 5 años, por lo que conviene realizar alguna reflexión. Para la explicación de esta discordancia, consideramos que existen 2 posibles razones que es necesario tener en cuenta para su análisis y eventual corrección. Por un lado, el número de pacientes que se pierden en el seguimiento es relativamente alto en la casuística de 1995; por otro, la recogida de datos de los casos de 1995 es más heterogénea (recogida en 45 hospitales) que la de 1982-1989 (17 hospitales). En la casuística de 1982-1989 había 7 hospitales con un número muy bajo de casos que solamente representaban el 11% de los 2.139 casos; los otros 10 hospitales trataron al 89% restante, lo que seguramente significa mayor homogeneidad en las conductas y, posiblemente, mayor entrenamiento de los equipos. En la casuística de 1995 solamente hay 25 hospitales que presenten 25 o más casos por año y la mediana del número de casos es de 11. Cuando se analizó la supervivencia de las pacientes de estos últimos hospitales se encontró que la supervivencia era mayor: 61%28.
Estos hechos abogan, en el sentir de algunos ginecólogos, por la agrupación de las pacientes para la realización de los tratamientos oncológicos en algunos centros, en los que deberían poder participar también los responsables de los casos.