Comparar las concentraciones plasmáticas de fetuína-A en pacientes con preeclampsia y gestantes normotensas sanas.
Materiales y métodoSe seleccionó un total de 100 pacientes. Se incluyeron 50 pacientes con preeclampsia como los casos (grupo A) y un grupo control seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio que consistió en 50 gestantes normotensas sanas (grupo B). Las muestras de sangre se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo B para determinar las concentraciones plasmáticas de fetuína-A.
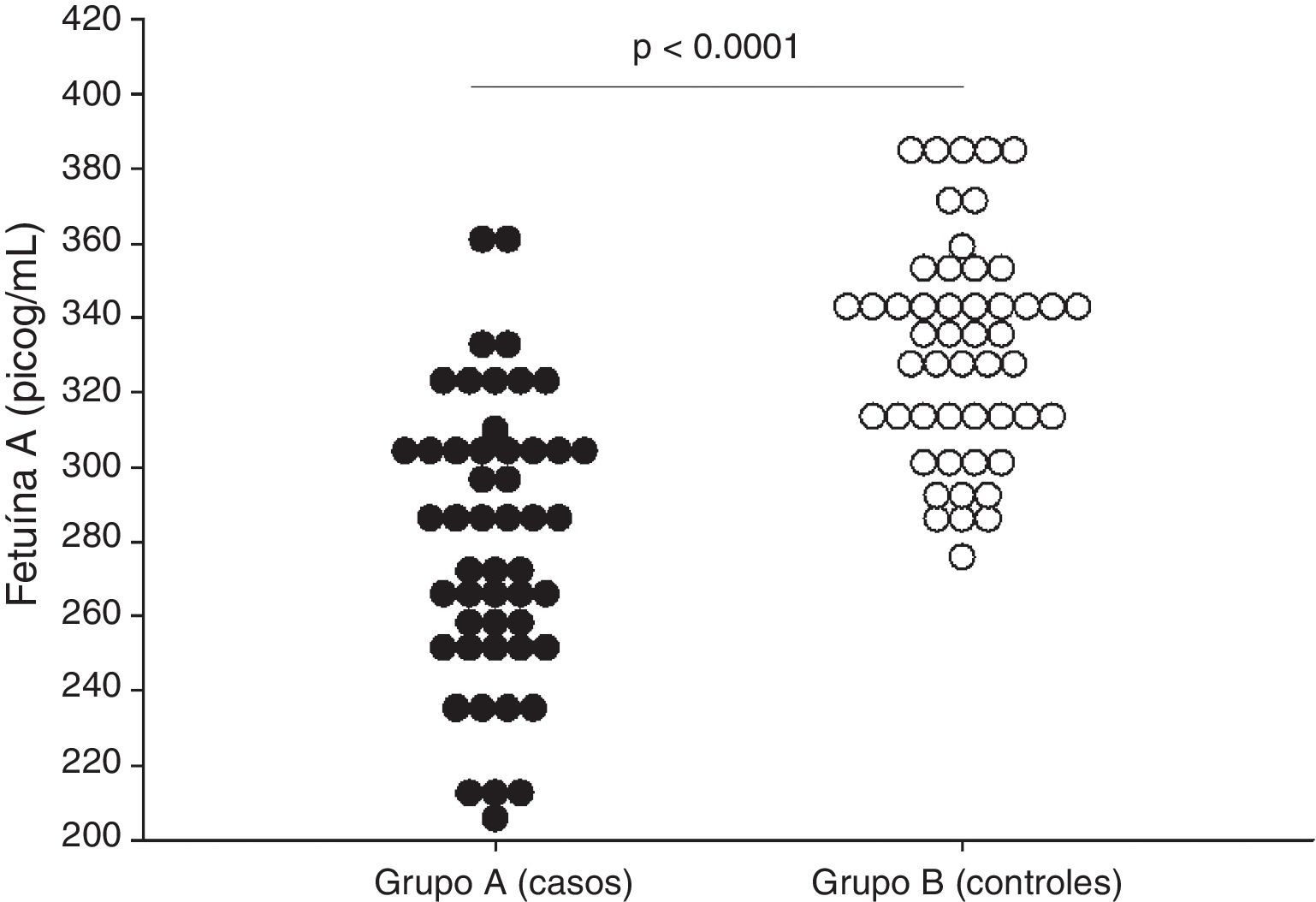
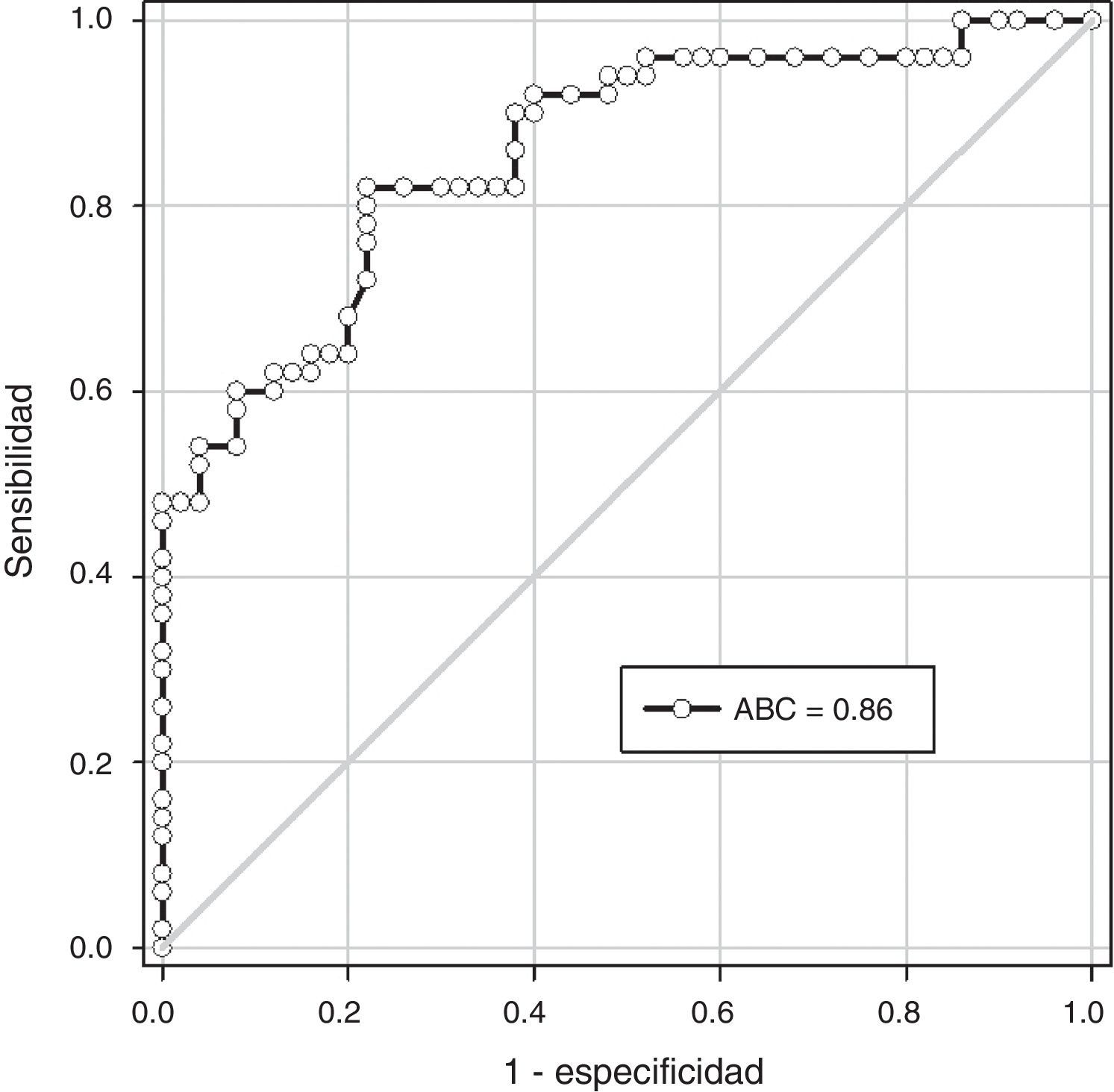
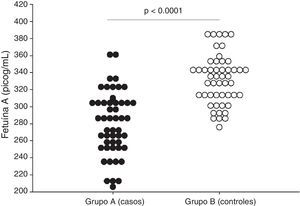
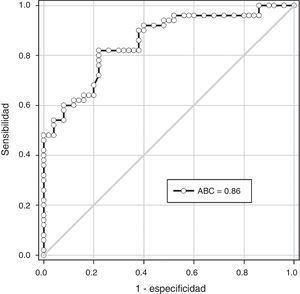
ResultadosSe encontraron diferencias estadísticamente significativas en las concentraciones plasmáticas de fetuína-A entre las pacientes del grupo A (279.1 ± 29.1 picog/mL) y las pacientes del grupo B (328.1 ± 37.2; p < 0.001). No se observó correlaciones con los valores de presión arterial sistólica y diastólica (p = ns). Se observaron correlaciones significativas entre las concentraciones de fetuína-A con las concentraciones de aspartato aminotransferasa (p < 0.05). Un valor de corte de 300 picog/mL presentó un valor por debajo de la curva de 0.86 y tiene una sensibilidad del 79.3%, una especificidad del 70.7%, un valor predictivo positivo del 65.7% y un valor predictivo negativo del 82.6%.
ConclusiónLas pacientes con preeclampsia presentaron concentraciones plasmáticas significativamente más bajas de fetuína-A al compararlo con gestantes normotensas sanas.
To compare plasma fetuin-A concentrations in patients with preeclampsia and healthy normotensive pregnant women.
Materials and methodA total of 100 patients were selected. Fifty patients with preeclampsia were selected as cases (Group A), and a control group selected with the same age and body mass index as the study group that consisted of 50 healthy normotensive pregnant women (Group B). Blood samples were collected from all patients before labour, and immediately after diagnosis in Group B to determine plasma fetuin-A concentrations.
ResultsThere was a statistically significant difference in plasma fetuin-A concentrations between patients in group A (279.1 ± 29.1 pg/ml) and patients in group B (328.1 ± 37.2; p<.001). There was no significant correlation with values of systolic and diastolic blood pressure (p= ns). Significant correlations were found between fetuin-A and aspartate transaminases (p<.05). A cut-off value of 300 pg/ml had a value under the curve of 0.86, sensitivity of 79.3%, specificity of 70.7%, a positive predictive value of 65.7%, and a negative predictive value of 82.6%.
ConclusionPatients with preeclampsia had significantly higher plasma concentrations of fetuin-A when compared with healthy normotensive pregnant women.
La preeclampsia es un desorden caracterizado por la aparición de hipertensión y proteinuria después de las 20 semanas de embarazo, afecta al 3-8% de todas las embarazadas y es una de las principales causas de morbimortalidad materna1. Sin embargo, la patogénesis subyacente de la preeclampsia es desconocida. Está caracterizada por liberación hacia la circulación materna de diferentes factores por la placenta, lo que produce inflamación sistémica excesiva en respuesta a la hipoxia / isquemia y al estrés oxidativo. La disfunción endotelial generalizada produce los síntomas característicos de la preeclampsia durante la segunda mitad del embarazo2.
La fetuína-A (glicoproteína alfa 2-Heremans-Schmid) es una proteína sérica y tisular de 49 Kda que desempeña un papel en la defensa del huésped y el metabolismo óseo3. Es un reactante negativo de la fase aguda de la inflamación, ya que actúa como un mediador antiinflamatorio y protege contra el choque inducido por lipopolisacáridos. Su producción hepática disminuye durante la respuesta de fase aguda durante infecciones, trauma y cirrosis hepática4,5. Puede afectar la función de los macrófagos al inhibir la liberación de las proteínas específicas y contribuir a la eliminación de los neutrófilos apoptoicos6,7. La administración exógena puede proteger contra la muerte durante la evolución de la endotoxemia y sepsis experimental7. También ha sido identificada como mediador de la lipotoxicidad a través de la vía de receptor 4 similar al Toll y puede contribuir a la insulinorresistencia8.
La preeclampsia es el resultado de una respuesta inflamatoria sistémica materna exagerada común a todos los embarazos y es consistente con las observaciones clínicas9. Sin embargo, existe controversia sobre las concentraciones de fetuína-A en la preeclampsia, por lo que el objetivo de la investigación fue comparar las concentraciones de fetuína-A en pacientes con preeclampsia y gestantes normotensas sanas.
Materiales y métodosSe seleccionó a un total de 100 pacientes entre enero y octubre de 2016. Se incluyó a 50 pacientes con preeclampsia los casos (grupo A) y un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio, que consistió en 50 gestantes normotensas sanas (grupo B). Todas las pacientes eran primigestas. Se obtuvo la firma del consentimiento informado para la obtención de las muestras. El comité de ética del hospital aprobó el estudio.
La preeclampsia se definió como la presión arterial sistólica de 140mmHg o más, o presión arterial diastólica de 90mmHg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Se excluyó a las embarazadas polihidramnios, hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre- o gestacional, hábito tabáquico y tratamiento con medicamentos que puedan alterar las concentraciones de la fetuína-A. También se excluyeron a las pacientes que se negaron a participar en la investigación.
Las muestras de sangre (10ml) se recolectaron en tubos con EDTA en todas las pacientes en forma consecutiva antes del parto e inmediatamente después del diagnóstico en el grupo de casos de la vena antecubital. Las muestras fueron centrifugadas (15,000g por 10 min a 4°C) y diluidas con un buffer salino con fosfato, se almacenaron a -70°C para medir las concentraciones de fetuína-A usando una prueba de ELISA (Epitope Diagnostics, San Diego, EE. UU.). La prueba usa anticuerpos policlonales que se unen a los diferentes epítopes de la fetuína-A humana. La prueba no tiene reacciones cruzadas con fetuína-B según el fabricante. Las mediciones fueron realizadas por duplicado y el resultado es el promedio. Los coeficientes de variación intra- e interensayo de 3.3 y 9.1%, respectivamente.
Los valores obtenidos se presentaron como promedio ± desviación estándar. Se utilizó la prueba de Kolmogorov-Smirnov para comprobar la distribución normal de los datos (p > 0.05) y posteriormente se utilizó la prueba t de Student para muestras no relacionadas para el análisis de los grupos y comparar las variables continuas. Los coeficientes de correlación entre la fetuína-A con la presión arterial y los valores de laboratorio se evaluaron usando la prueba de Pearson. La precisión de la fetuína-A para el diagnóstico de preeclampsia se presenta en función de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Se utilizó el análisis receptor-operador para determinar el mejor valor de corte. Se consideró p < 0.05 como estadísticamente significativa.
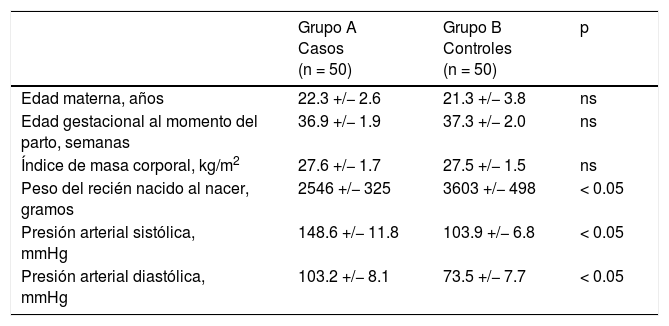
ResultadosLas características generales de los dos grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, la edad gestacional al momento del parto y el índice de masa corporal al momento de la toma de la muestra (p = ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de peso del recién nacido al nacer, presión arterial sistólica y presión arterial diastólica (p < 0.05).
Características generales
| Grupo A Casos (n = 50) | Grupo B Controles (n = 50) | p | |
|---|---|---|---|
| Edad materna, años | 22.3 +/− 2.6 | 21.3 +/− 3.8 | ns |
| Edad gestacional al momento del parto, semanas | 36.9 +/− 1.9 | 37.3 +/− 2.0 | ns |
| Índice de masa corporal, kg/m2 | 27.6 +/− 1.7 | 27.5 +/− 1.5 | ns |
| Peso del recién nacido al nacer, gramos | 2546 +/− 325 | 3603 +/− 498 | < 0.05 |
| Presión arterial sistólica, mmHg | 148.6 +/− 11.8 | 103.9 +/− 6.8 | < 0.05 |
| Presión arterial diastólica, mmHg | 103.2 +/− 8.1 | 73.5 +/− 7.7 | < 0.05 |
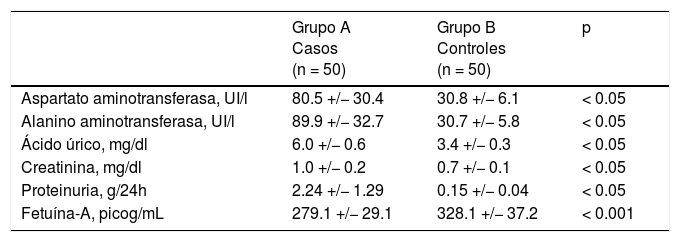
En la tabla 2 se muestran las variables de laboratorio. Se observó que las pacientes con preeclampsia presentaban valores significativamente más altos de transaminasas, ácido úrico, creatinina y proteinuria en 24 h que las pacientes del grupo control (p < 0.05). Se encontraron diferencias estadísticamente significativa en las concentraciones de fetuína-A entre las pacientes en el grupo de estudio (grupo A; 279.1 ± 29.1 picog/mL) y las pacientes del grupo control (grupo B; 328.1 ± 37.2; p < 0.001; figura 1).
Variables de laboratorio
| Grupo A Casos (n = 50) | Grupo B Controles (n = 50) | p | |
|---|---|---|---|
| Aspartato aminotransferasa, UI/l | 80.5 +/− 30.4 | 30.8 +/− 6.1 | < 0.05 |
| Alanino aminotransferasa, UI/l | 89.9 +/− 32.7 | 30.7 +/− 5.8 | < 0.05 |
| Ácido úrico, mg/dl | 6.0 +/− 0.6 | 3.4 +/− 0.3 | < 0.05 |
| Creatinina, mg/dl | 1.0 +/− 0.2 | 0.7 +/− 0.1 | < 0.05 |
| Proteinuria, g/24h | 2.24 +/− 1.29 | 0.15 +/− 0.04 | < 0.05 |
| Fetuína-A, picog/mL | 279.1 +/− 29.1 | 328.1 +/− 37.2 | < 0.001 |
Al realizar la correlación entre las concentraciones de fetuína-A y los valores de presión arterial, no se observó una correlación con los valores de presión arterial sistólica (r = 0.282) ni con los valores de presión arterial diastólica (r = 0.033; p = ns). Solo se observó correlación significativa (p < 0.05) entre las concentraciones de fetuína-A con las concentraciones de aspartato aminotransferasa (r = -0.303).
En la figura 2 se muestra la curva receptor operador para la precisión de la fetuína-A para el diagnóstico de preeclampsia. Un valor de corte de 300 picog/mL presentó un valor por debajo de la curva de 0.86 y tiene una sensibilidad del 79.3% (intervalo de confianza [IC] del 95%; 60.2 – 92.1), especificidad del 70.7% (IC del 95%, 54.4 – 83.8), valor predictivo positivo del 65.7% (IC del 95%; 47.7 – 80.8) y valor predictivo negativo del 82.6% (IC del 95%; 66.3 – 93.4).
DiscusiónEn el presente estudio, las pacientes con preeclampsia presentaron concentraciones significativamente más bajas de fetuína-A en comparación con gestantes normotensas sanas. Estudios previos han reportado resultados contradictorios. Dos investigaciones10,11 reportaron que las concentraciones de fetuína-A aumentaban en las preeclámpticas, mientras que Molvarec et al.12,13, al igual que lo reportado en la presente investigación, reportaron que las concentraciones eran significativamente menores en las preeclámpticas comparado con aquellas mujeres con embarazos no complicados.
La evidencia de que la fetuína-A es un reactante negativo de la fase aguda incluye la evidencia de que las concentraciones disminuyen en pacientes con infecciones bacterianas y presentan correlaciones negativas con alfa1-tripsina y haptoglobina y correlaciones positivas con reactantes negativos de albúmina y transferrina4,14. La administración de interleucina 6 e interleucina 1β humana recombinante disminuye la síntesis en las células HepG2 del hepatoma humano14. Además, en un modelo animal de inflamación sistémica letal, las concentraciones de fetuína-A circulante disminuyen a las 24-48 h después de la aparición de la endotoxemia o sepsis para regresar a los valores previos a las 72 h6.
El hígado es el principal sitio de síntesis de la fetuína-A; sin embargo, la unidad fetoplacentaria puede ser otra fuente de esta proteína, ya que es uno de los componentes principales en la matriz ósea no colágena en el feto. Esto es apoyado por la elevación de las concentraciones durante el transcurso del embarazo, la cual es especialmente marcada en el tercer trimestre5. Se ha demostrado que potencia la fagocitosis de las células apoptoicas mediada por los macrófagos al estimular la macropinocitosis in vitro7. La disminución de las concentraciones séricas puede ser negativa en la evolución del embarazo ya que se ha asociado con disminución de la depuración de las células trofoblásticas necróticas y apoptoicas, lo que puede llevar a un incremento de la liberación de restos placentarios a la circulación materna.
La posible explicación para las bajas concentraciones de fetuína-A en la preeclampsia es la inflamación sistémica que la caracteriza, demostrada por estudios de citometría de flujo al igual que por determinación de citocinas / quimiocinas y productos del complemento15–19. Se ha descrito que las células mononucleares periféricas maternas de las preeclámpticas producen mayores cantidades de citocinas proinflamatorias que los de las embarazadas sin complicaciones20. La fetuína-A puede unirse al factor transformante y de crecimiento β (TGF- β) bloqueando su actividad21. De forma interesante, se ha observado que las concentraciones elevadas de TGF- β1 están asociadas con un incremento en el riesgo de preeclampsia22.
Un mecanismo protector de la fetuína-A es su relación con la calcificación vascular23,24. Los ratones que carecen de la glicoproteína desarrollan calcificaciones severas en múltiples órganos23 y la administración exógena en cultivos de células de músculo liso vascular de origen bovino produce rigidez por mineralización24. En los humanos, las concentraciones plasmáticas de fetuína-A tienen una correlación inversa con la rigidez arterial determinada por la dilatación mediada por el flujo en sujetos sanos y en aquellos con enfermedad renal crónica25. Se ha encontrado disfunción endotelial e incremento de la rigidez arterial en pacientes con preeclampsia, lo cual puede ser un efecto de las bajas concentraciones26.
Las diferencias reportadas en las concentraciones observadas en esta y otras investigaciones pueden ser parte de la respuesta inflamatoria sistémica materna causada por placenta hipóxica que colabora con el estrés oxidativo y podría también reflejar la lesión endotelial y hepatocelular al igual que colaborar con las alteraciones microagniopáticas. Las bajas concentraciones de fetuína-A sugieren la presencia de inflamación marcada en la preeclampsia12. En un estudio previo se reportó que las pacientes preeclámpticas con pielonefritis aguda presentaban más bajas concentraciones de fetuína-A que las embarazadas normales. También se ha demostrado que existe una correlación significativa entre las concentraciones de fetuína-A con la albumina y la transferrina en pacientes con preeclampsia27.
Los hallazgos de esta investigación demuestran que las pacientes con preeclampsia presentaron concentraciones significativamente más altas de fetuína-A al compararlo con gestantes normotensas sanas, lo cual lo convierte en un marcador de riesgo útil en pacientes con preeclampsia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.’