La restricción del crecimiento intrauterino (RCIU) está asociada con morbimortalidad perinatal, causante del aumento de la morbimortalidad fetal y neonatal, incluyendo prematurez. Los glucocorticoides se administran de forma rutinaria a las mujeres con embarazos entre 24 y 34 semanas de gestación en riesgo de parto prematuro para promover la producción de surfactante; sin embargo, se ha postulado que su administración exógena en fetos con RCIU podría no brindar ningún beneficio extra: no existe suficiente evidencia para apoyar su uso en este subgrupo de pacientes.
MétodosPara la creación de esta revisión sistemática, se realizaron búsquedas en las bases de datos Medline, PubMed y Cochrane para citas relevantes. Se han utilizado estudios con mayor nivel de evidencia que en los que se administraron glucocorticoides (dexametasona o betametasona) como inductores de maduración pulmonar y se ha comparado su uso con no aplicar ningún tratamiento, durante las semanas 24-34 semanas de gestación, en embarazos con diagnóstico de RCIU.
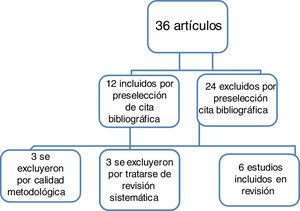
ResultadosTras la evaluación metodológica, se utilizaron 6 artículos para la creación de esta revisión.
ConclusionesEl uso de glucocorticoides en la población de fetos pretérmino con restricción del crecimiento aún es controvertido, sin estudios clínicos aleatorizados en humanos que nos permitan emitir recomendaciones adecuadas para su uso.
Intrauterine growth restriction (IUGR) is associated with perinatal morbidity and mortality. This includes increased foetal and neonatal morbidity and mortality, as well as prematurity. Glucocorticoids are given routinely to women between 24-34 weeks gestation at risk of preterm delivery. These are given to promote the production of surfactant. Although it has been postulated that the exogenous administration in IUGR may not provide any extra benefit, there is insufficient evidence to support its use in this sub-group of patients.
MethodsIn order to perform this systematic review, a search was made of the Medline, PubMed and Cochrane databases for relevant literature references. Those studies with a higher level of evidence that administered glucocorticoids (dexamethasone or betamethasone) to induce pulmonary maturation were selected and were compared with those using no treatment, during weeks 24-34 weeks gestation in pregnancies diagnosed with IUGR.
ResultsAfter assessment of the methodology, 6 items were used to create this review.
ConclusionsAssessing the use of glucocorticoids in the pre-term foetus population with growth restriction remains controversial, with no randomised clinical studies in humans that allow us to make recommendations suitable for use.
Los glucocorticoides se administran de forma rutinaria a las mujeres con embarazos entre 24 y 34 semanas de gestación (sdg) en riesgo de parto prematuro, para promover la producción de surfactante, reduciendo así la incidencia de síndrome de distrés respiratorio (SDR) en un 35-45%1. Sin embargo, se ha postulado que su administración exógena en fetos con restricción del crecimiento intrauterino (RCIU) podría no brindar ningún beneficio extra y que más bien aumentan su mortalidad, como lo demostrado por Liggins y Howwie en 19722, debido al nivel de cortisol elevado por sobreproducción de la glándula suprarrenal fetal secundario a estrés crónico intrauterino, lo que conllevaría la maduración pulmonar temprana3, además de la exposición a mayor cantidad de esteroides maternos debido a la degradación de la enzima que normalmente previene el paso del cortisol materno a la placenta (11-beta-hidroxisteroide deshidrogenasa tipo II (11-βHSD II)4. Con base en estos resultados, estos fetos se excluyen de los estudios subsiguientes sobre glucorticoides, que limitan la obtención de información a estudios en animales o a estudios de tipo retrospectivo.
AntecedentesFisiopatología de la restricción del crecimiento intrauterinoBajo condiciones de oxígeno y aporte de nutrientes limitados, se produce una redistribución de flujos sanguíneos a órganos vitales como mecanismo de adaptación fetal. Cuando la condición persiste, esta redistribución se vuelve insuficiente y lleva a aumentos en las resistencias vasculares umbilicales y a disminución en las cerebrales, cambios que pueden ser evidenciados en la evaluación con Doppler. Estos cambios hemodinámicos se establecen mucho antes de las alteraciones en los patrones de frecuencia cardíaca fetal. La hipoxia fetal causada por cualquier factor que interrumpe la circulación uteroplacentaria genera, además, reducción en la disponibilidad de glucosa y en las reservas de glicógeno fetal y genera, como consecuencia, que el feto se adapte a este estado de hipoxia-hipoglucemia conservando energía. Lo anterior lleva a la secuencia de eventos que sigue: disminución o cese del crecimiento fetal, disminución en la actividad fetal, redistribución del gasto cardíaco favoreciendo a órganos vitales como cerebro, corazón y glándulas adrenales, aumento del número de glóbulos rojos circulantes, lo que causa policitemia (HTO> 65%) y hematopoyesis extramedular5, aumento de gluconeogénesis hepática por movilización de grasa y glicógeno almacenada y desarrollo de metabolismo anaerobio de la glucosa para producir lactato y piruvato (acidosis metabólica). En fetos hipóxicos, además, existe un limitante intrínseco en la transferencia transplacentaria de glucosa, lo que indica inanición intrauterina debido a la falta de transporte placentario6. Lo anterior se traduce clínicamente, a la evaluación del feto, en peso bajo para edad gestacional, oligohidramnios y alteraciones hemodinámicas como: aumento en índices de pulsatilidad de arteria umbilical y uterinas, disminución en índice de pulsatilidad de arteria cerebral media y alteración en índice de pulsatilidad y onda A del ducto venoso, lo que lleva en muchas ocasiones al ginecoobstetra a la necesidad de interrumpir el embarazo de forma prematura. Esto va de la mano de la duda razonable sobre el uso o no de esteroides para la maduración pulmonar.
1.1Papel de los esteroides como inductores de maduración pulmonarEl efecto bioquímico más conocido de los corticosteroides exógenos es la inducción de las células alveolares de tipo ii, que son capaces de aumentar la producción de surfactante a través del aumento de la inducción de expresión de proteínas A, B, C y D y de todas las enzimas necesarias para la síntesis de fosfolípidos. Todas estas acciones resultan en el desarrollo de cuerpos lamelares que se secretan a la luz alveolar y aumentan el contenido de fosfatidilcolina saturada en la superficie activa del alvéolo.
La administración materna de glucocorticoides ha demostrado mejoría en la maduración pulmonar fetal y reducción en el número de complicaciones neonatales7, como se demuestra en la figura 1.
Fuente: Reproducido de Crowley7.
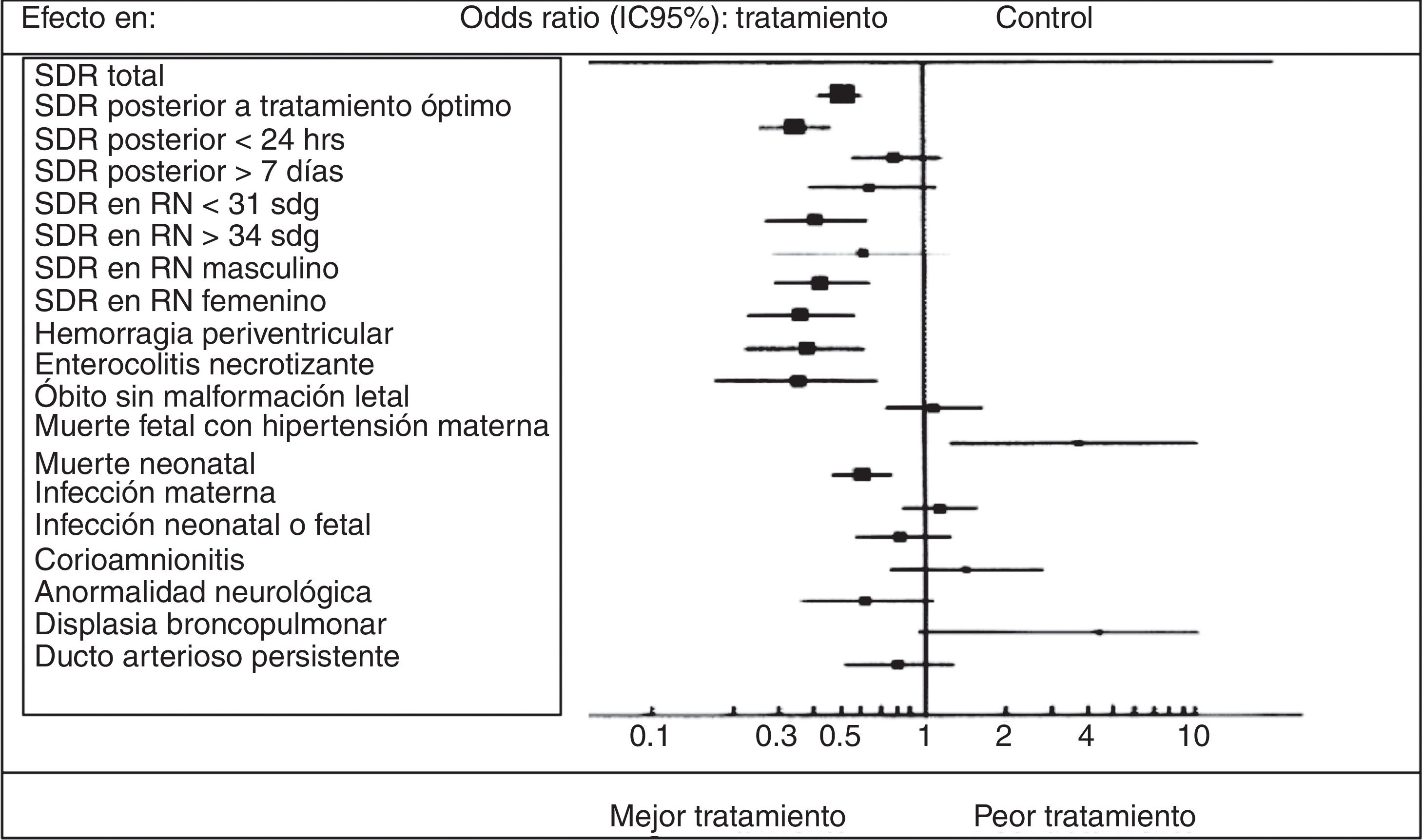
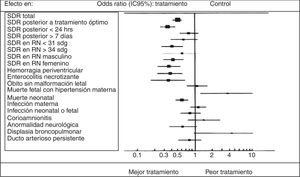
En la revisión más reciente de Cochrane de marzo de 20138 sobre corticosteroides prenatales en mujeres con riesgo de embarazo pretérmino en la que se incluyeron 21 estudios de 38,885 pacientes y 4,269 infantes, que evaluaba las comparaciones aleatorizadas de corticosteroides prenatales (betametasona, dexametasona o hidrocortisona) contra placebo o contra sin tratamiento en mujeres con parto pretérmino, se obtuvieron los resultados siguientes: muerte neonatal en el 31% (IC 95%: 19-42%; 3,956 niños). El riesgo de SDR se redujo en un 34% (IC 95%: 27-41%; 4,038 niños), la hemorragia interventricular en el 46% (IC 95%: 31-57%; 2,872 niños), la enterocolitis necrosante en el 54% (IC 95%: 26-71%; 1,675 niños) y las infecciones en las primeras 48h de vida en el 44% (IC 95%: 115-62%; 1,319 niños). La necesidad de soporte ventilatorio y la admisión a unidades de cuidado intensivo neonatales (UCIN) también se redujeron con la terapia. En estudios que examinan resultados perinatales a largo plazo con periodos de seguimiento a 6 años, el tratamiento con corticosteroides se ha asociado al 51% de reducción de retraso en el desarrollo en la infancia (IC 95%: 0-76%; 518 niños) y a una menor tendencia de generar parálisis cerebral (RR 0.6; IC 95%: 0.34-1.03; 904 niños) (fig. 2).
Todos estos beneficios, sin embargo, no han sido del todo demostrados en fetos complicados con RCIU, en ausencia de estudios aleatorizados diseñados específicamente en este grupo. Las consideraciones a su eficacia son basadas en información observacional y retrospectiva, e incluso llegan a tener interpretaciones contrarias al respecto. Por ejemplo, en 2009, Torrence et al.9, con una revisión sistemática sobre el tema, concluyeron que el tratamiento con corticosteroides prenatales en RCIU no tenía ningún efecto en la morbimortalidad en esta población. Es más, en el SDR, que es la entidad en la que los esteroides han demostrado mayor efecto, su aplicación en estos fetos no parece reducir la incidencia, posiblemente debido a que la maduración pulmonar ya se encuentra aumentada, producto de la asociación de estrés intrauterino crónico y de la disminución de 11-βHSD II10 (fig. 3).
Un estudio realizado en una población grande de niños con RCIU demostró que los beneficios de los esteroides prenatales son similares a aquellos vistos en fetos normales. Este estudio incluyó a 1,720 infantes entre 25 y 30 sdg, con resultados perinatales descritos en la base de datos del Vermont Oxford Network11. El riesgo de SDR, de IVH y de muerte neonatal son similarmente reducidos en este grupo. Solo la enterocolitis necrosante no se redujo en neonatos con RCIU. Cabe señalar que se obtuvo una reducción pequeña en el SDR (OR 0.7) en comparación con fetos sanos (OR 0.5). Esta información pareciera refutar la teoría del «estrés inútero». En otro estudio de casos y controles en el que buscaban resultados a largo plazo en niños nacidos pretérmino con RCIU de origen placentario12, de 124 niños nacidos entre 26 y 32 sdg, la superviviencia sin incapacidad a 2 años de vida fue mayor en el grupo que se manejó con esteroides que en el que no.
Todos estos efectos contradictorios generados por los mismos corticosteroides a las mismas dosis en los diferentes grupos de fetos (sanos y con RCIU) pueden deberse a la vía de acción que tomen. Por ejemplo, si estimulan la acción genómica, su efecto estará mediado por receptores en el núcleo; si su expresión es no genómica, su mecanismo será mediado por receptores en membrana o con interacción fisicoquímica directa con la membrana celular. Los esteroides generan maduración tisular y diferenciación esencialmente a través de los efectos genómicos, pero pueden deprimir el crecimiento tisular en diferentes órganos vía dosis dependiente por efectos no genómicos. Según Burrgereit et al.13, bajas dosis de corticosteroides producen exclusivamente efectos genómicos. Con el incremento en la dosis, los efectos no genómicos se vuelven aparentes, como en el caso de los fetos con RCIU. En cuanto al tipo de glucocorticoide utilizado, aunque la dexametasona y la betametasona tienen actividad farmacológica similar, no son idénticas, debido a la configuración espacial y a la afinidad por sus receptores. Parece ser que la dexametasona es más potente que la betametasona en los efectos no genómicos14, como lo demostrado por Ozdemir et al.15, que refirieren una gran reducción del peso hepático y pulmonar en ratones con dosis repetidas de dexametasona, más que con betametasona.
En modelos animales de RCIU, los esteroides prenatales han mostrado una reducción en el crecimiento cerebral fetal, flujos sanguíneos cerebrales alterados y daño cerebral16, alteraciones que se han estudiado en fetos de ovejas en embarazos tardíos expuestos a glucocorticoides, que demostraron reducción en el peso cerebral, retraso en la mielinización y reducción en la densidad astrocítica, con alteración en el citoesqueleto neuronal. También existe evidencia del daño producido al sistema nervioso central en modelos con primates, en los que los glucocorticoides disminuyen el número de neuronas piramidales17. Además, Miller et al.18, en su estudio, demuestran alteración en la integridad neuronal y muerte celular secundaria al aumento en el estrés oxidativo posterior a la administración de betametasona, debido a la disminución de perfusión cerebral con posterior reperfusión, por lo que se podría suponer que, en células comprometidas metabólicamente de manera previa, como en el caso del cerebro del RCIU, la peroxidación lipídica resulta en una generación de radicales libres en exceso y, como el cerebro es particularmente vulnerable al daño oxidativo debido a la alta composición lipídica y a la baja concentración de enzimas antioxidantes, el aumento del estrés oxidativo también aumenta el daño cerebral. Sin embargo, aún no existen este tipo de estudios aleatorizados en humanos con seguimiento a largo plazo, por lo que aún es un área con potencial explotación futura y en la que existen aún muchas dudas, sobre todo, en lo que respecta al neurodesarrollo infantil.
Por otro lado, se ha demostrado ampliamente que los glucocorticoides son reguladores poderosos de la función vascular y un número grande de estudios refieren que los de origen sintético como la betametasona alteran los parámetros vasculares en los embarazos normales. En estudios con ovejas sanas, la administración de glucocorticoides en los últimos trimestres del embarazo puede llevar a hipertensión fetal, acompañada de aumento en la resistencia vascular, hipoxemia leve y disminución de flujo cerebral19-23, lo que perpetúa el daño tisular en el feto con RCIU. Además del daño directo en el desarrollo de las células cerebrales provocado por la administración de glucocorticoides, gran parte de la alteración neuronal se debe a la regulación cerebro-vascular obtenida después de su aplicación. Por ejemplo, el efecto vasodilatador de la betametasona resulta en la redirección de flujo sanguíneo lejos del cerebro, lo que llevaría a un compromiso mayor de la función cerebral y estructural en estos fetos. Esto último fue demostrado por Miller et al.18, al reportar que los fetos con RCIU demuestran una reperfusión en el flujo sanguíneo carotídeo en respuesta a la administración de betametasona, lo que lleva a una peroxidación lipídica en el cerebro fetal que contribuye a un aumento en la muerte celular.
La secreción placentaria de hormona liberadora de corticotropina aumenta dentro de las 3h posteriores a la administración de corticosteroides. Se supone que el aumento en esta hormona genera, en la placenta, un efecto vasodilatador, lo cual se ha demostrado in vitro en la arteria umbilical humana24. El monitoreo realizado en fetos sanos de ovejas, babuinos pretérmino y en ovejas con RCIU demostró que, durante las primeras 12 h después de la administración directa fetal de betametasona a dosis equivalentes a las usadas en la clínica, se genera vasoconstricción con aumento de la resistencia vascular fetal e hipertensión sistémica, aumento de la resistencia vascular cerebral con reducción en un 50% en el flujo sanguíneo cerebral, hipoxemia y aumento de los niveles de lactato.
Por último, se ha demostrado que la betametasona está asociada al retorno transitorio del flujo en el final de diástole, en el Doppler de la arteria umbilical, en 2/3 de los embarazos con RCIU. La persistencia de la ausencia del flujo al final de la diástole puede identificar a un subgrupo de fetos con RCIU en un mayor grado de deterioro, lo que lleva a que necesiten ventilación asistida y a una duración prolongada en ventilación y suplemento de oxígeno25.
Ante tales contradicciones, se decidió iniciar esta revisión sistemática con los siguientes objetivos:
Objetivo generalConocer los efectos de los esteroides administrados como inductores de maduración pulmonar en los fetos con RCIU.
Objetivos específicosConocer los efectos en la morbilidad a corto y a largo plazo en los fetos con RCIU tratados con glucocorticoides prenatalmente.
Conocer los efectos de los esteroides en el Doppler arterial y venoso de los fetos con RCIU.
Evaluar qué tipo de glucorticoides debe usarse en los fetos con RCIU como inductores de maduración pulmonar.
MetodologíaLos siguientes constituyen los criterios de inclusión y exclusión de los artículos incluidos en la revisión.
Criterios de inclusiónEstudios clínicos aleatorizados, estudios de cohortes o de que casos y controles (esto en caso de encontrar estudios con los primeros 2diseños), en los que se administró glucocorticoides (dexametasona o betametasona) como inductores de maduración pulmonar.
Que comparen el uso de glucorticoides con ningún tratamiento.
Que se inicie el tratamiento durante las semanas 24-34 de gestación.
Que se administren los glucorticoides en embarazos con diagnóstico de RCIU realizado de forma prenatal bajo la definición de la ACOG.
Que el estudio evalúe por lo menos uno de los siguientes desenlaces: SDR, muerte fetal, broncodisplasia pulmonar, hemorragia intracerebral, Apgar bajo, ingreso a UCI, acidosis metabólica, alteraciones en desarrollo neurológico, alteraciones en la ondas de flujo del Doppler.
Criterios de no inclusión de los artículosSe perdió más del 10% de mujeres o de recién nacidos durante el seguimiento.
Que las participantes tuvieran signos o síntomas de parto pretérmino o rotura de membranas al momento de iniciarse el tratamiento.
Que se incluyeran fetos con malformaciones.
Tipo de participantesMujeres embarazadas entre las semanas 26 y 34 de gestación única con RCIU.
Tipo de intervenciónAdministración de glucocorticoides: dexametasona (total 24mg) o betametasona (12mg cada 24 h, #2) para la inducción de maduración pulmonar entre las semanas 26 y 34 de gestación, en embarazos con RCIU.
Tipo de resultadosMuerte fetal, muerte neonatal, admisión en UCIN, ventilación mecánica, hemorragia intraventricular, SDR, broncodisplasia pulmonar, acidosis metabólica neonatal, alteraciones en los patrones de flujo Doppler, alteraciones en el neurodesarrollo infantil.
Estrategia de búsquedaSe realizaron búsquedas en las bases de datos Medline, PubMed y Cochrane para citas relevantes, combinando los siguientes términos y sus sinónimos: effects-intrauterine growth restriction-antenatal glucocorticoids. Estas palabras se combinaron usando el conector lógico AND. No se aplicaron restricciones del idioma ni del tiempo de publicación.
Métodos de revisiónSe revisaron los estudios encontrados y se evaluó su calidad metodológica de acuerdo con el U.S. Preventive Task Force 14, además de los criterios de JAMA y de la jerarquización de los estudios por el tipo de diseño (USPSTF) (figs. 1 y 2).
ResultadosEs importante señalar que, tras la búsqueda de información, no se logró encontrar ensayos clínicos aleatorizados en humanos. Se resumen los resultados de los artículos encontrados para dar respuesta a los objetivos planteados al inicio de esta revisión (tabla 1).
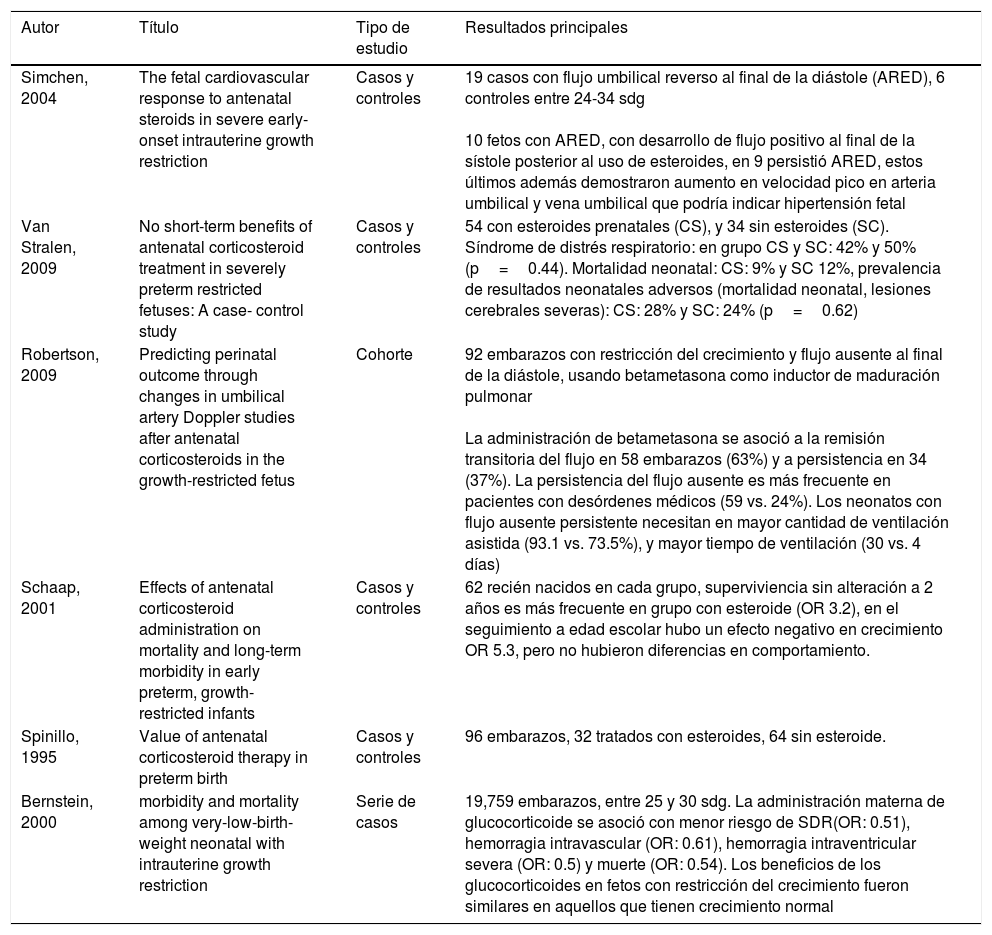
Resumen de los artículos incluidos
| Autor | Título | Tipo de estudio | Resultados principales |
|---|---|---|---|
| Simchen, 2004 | The fetal cardiovascular response to antenatal steroids in severe early-onset intrauterine growth restriction | Casos y controles | 19 casos con flujo umbilical reverso al final de la diástole (ARED), 6 controles entre 24-34 sdg 10 fetos con ARED, con desarrollo de flujo positivo al final de la sístole posterior al uso de esteroides, en 9 persistió ARED, estos últimos además demostraron aumento en velocidad pico en arteria umbilical y vena umbilical que podría indicar hipertensión fetal |
| Van Stralen, 2009 | No short-term benefits of antenatal corticosteroid treatment in severely preterm restricted fetuses: A case- control study | Casos y controles | 54 con esteroides prenatales (CS), y 34 sin esteroides (SC). Síndrome de distrés respiratorio: en grupo CS y SC: 42% y 50% (p=0.44). Mortalidad neonatal: CS: 9% y SC 12%, prevalencia de resultados neonatales adversos (mortalidad neonatal, lesiones cerebrales severas): CS: 28% y SC: 24% (p=0.62) |
| Robertson, 2009 | Predicting perinatal outcome through changes in umbilical artery Doppler studies after antenatal corticosteroids in the growth-restricted fetus | Cohorte | 92 embarazos con restricción del crecimiento y flujo ausente al final de la diástole, usando betametasona como inductor de maduración pulmonar La administración de betametasona se asoció a la remisión transitoria del flujo en 58 embarazos (63%) y a persistencia en 34 (37%). La persistencia del flujo ausente es más frecuente en pacientes con desórdenes médicos (59 vs. 24%). Los neonatos con flujo ausente persistente necesitan en mayor cantidad de ventilación asistida (93.1 vs. 73.5%), y mayor tiempo de ventilación (30 vs. 4 días) |
| Schaap, 2001 | Effects of antenatal corticosteroid administration on mortality and long-term morbidity in early preterm, growth- restricted infants | Casos y controles | 62 recién nacidos en cada grupo, superviviencia sin alteración a 2 años es más frecuente en grupo con esteroide (OR 3.2), en el seguimiento a edad escolar hubo un efecto negativo en crecimiento OR 5.3, pero no hubieron diferencias en comportamiento. |
| Spinillo, 1995 | Value of antenatal corticosteroid therapy in preterm birth | Casos y controles | 96 embarazos, 32 tratados con esteroides, 64 sin esteroide. |
| Bernstein, 2000 | morbidity and mortality among very-low-birth- weight neonatal with intrauterine growth restriction | Serie de casos | 19,759 embarazos, entre 25 y 30 sdg. La administración materna de glucocorticoide se asoció con menor riesgo de SDR(OR: 0.51), hemorragia intravascular (OR: 0.61), hemorragia intraventricular severa (OR: 0.5) y muerte (OR: 0.54). Los beneficios de los glucocorticoides en fetos con restricción del crecimiento fueron similares en aquellos que tienen crecimiento normal |
Bernstein et al. (2000), para el Vermont Oxford Network, en el que se incluyó a 1,720 infantes entre 25 y 30 sdg con RCIU y peso entre 501 y 1,500 g, demostraron que la administración de glucocorticoides prenatales estaba asociada a una disminución significativa del riesgo de: SDR (OR 0.51; IC 95%: 0.44-0.58), hemorragia interventricular severa (OR 0.5; IC 95%: 0.43-0.57) y muerte (OR 0.54; IC 95%: 0.48-0.62). Solo la enterocolitis necrosante no tuvo una reducción en asociación con el uso de esteroides. Sin embargo, una debilidad que se puede observar en este estudio es que solo se tomó como criterio para ser considerado como RCIU el peso por debajo del P10, lo que puede llevar a incluir en este grupo a fetos pequeños para la edad gestacional y que, por tanto, no tuvieran el mismo grado de descompensación y adaptación hemodinámica.
Debido a los resultados anteriores, Van Stralen en 2008 en su estudio de cohorte retrospectiva demostró lo contrario, al evaluar a 54 pacientes que recibieron esteroides y tenían diagnóstico de RCIU, y a 34 sin esteroides. Obtuvo que la incidencia de SDR en el grupo con esteroide era del 42% (22/54) y en el grupo sin esteroide del 50% (17/34) (p=0.44). La mortalidad neonatal en el grupo con esteroides era del 9% (5/54) y del 12% (4/34) en el grupo sin esteroides (p=0.73) y la prevalencia de lesiones mayores (incluidas la lesión cerebral severa) era menor en el primer grupo (28%; 15/54) que en el segundo (24%; 8/34), con p=0.62. Llegamos entonces a la conclusión de que la administración de esteroides prenatales a fetos con restricción del crecimiento, aparentemente, no brinda ningún beneficio en el resultado perinatal a corto plazo.
Schaap et al. en 2001 evaluaron, además, la morbilidad a largo plazo en fetos con RCIU tratados con esteroides prenatalmente a través de un estudio de casos y controles. También demostraron que no existe una diferencia significativa en morbilidad perinatal a corto plazo, pero en su seguimiento a largo plazo (2 años y escolares) demostraron una supervivencia mayor sin incapacidad. Con un OR de 3.1 (1.2-8.3) para supervivencia sin incapacidad y un OR de 4.9 (1.3-9.3) para crecimiento por debajo del percentil 10.
Efectos de los esteroides aplicados prenatalmente como inductores de maduración pulmonar en el Doppler arterial y venoso de los fetos con restricción del crecimiento intrauterinoLa alta resistencia vascular placentaria es una de las causas importantes de restricción de crecimiento y, subsecuentemente, de mortalidad perinatal. La identificación de esta a través de Doppler de la arteria umbilical ha sido utilizada para detectar y dar seguimiento a los embarazos en riesgo. Por tanto, cualquier cambio en el Doppler puede suponer progresión en la enfermedad. Por ello, es importante tener en cuenta que la administración exógena de esteroides aumenta la liberación de hormona liberadora de corticotropina, que es un potente vasodilatador fetoplacientario y genera alteración en las ondas de flujo arterial o venoso obtenidas por Doppler, lo que limita su capacidad diagnóstica y su utilidad para el seguimiento.
Con base en lo anterior, muchos autores han investigado sobre los posibles efectos de los esteroides en las resistencias y flujos placentarios a través del análisis de las ondas de flujo arterial o venoso obtenidas por Doppler. Dentro de los primeros en investigar esta situación se encuentran Wallace y Baker, quienes en 1999 en un estudio observacional retrospectivo revisaron las ondas de flujo de la arteria umbilical antes y después de la administración de betametasona en embarazos con aumento de la resistencia vascular placentaria y con flujo diastólico ausente. Obtuvieron como resultado principal que la duración media de la gestación fue de 27 sdg en 19 embarazos (68%; IC 95%: 49-86). En estos embarazos, el flujo diastólico en la arteria umbilical remitió dentro de las siguientes 24 h de la administración de betametasona, lo que resultó consistente con una disminución en la resistencia. La media de este efecto fue de 3 días, con un rango de 2-7 días. Sin embargo, no existieron diferencias en la duración de la gestación, ni en el peso de los fetos tanto de los que tuvieron retorno del flujo como de los que no.
Debido a lo anterior y a los datos de los ensayos que se obtuvieron posteriormente en animales, en los que se proponía que los esteroides inducían de forma transitoria acidosis fetal, Simchen et al. en 2002 llevaron a cabo un estudio prospectivo observacional bajo la hipótesis de que la administración de esteroides en fetos con flujo ausente o reverso al final de la diástole (ARED) podía estar asociada con deterioro fetal por exacerbación de cualquier acidosis metabólica preexistente. En este estudio con fetos entre las 24 y las 34 sdg con ARED más diagnóstico de RCIU sin preeclampsia y sin cumplimiento previo de esteroides prenatales, se les realizó evaluación Doppler de manera previa a la administración de esteroides y a las 24, 48 y 72h después de la administración de 2dosis de betametasona de 12mg separadas por 24h. Se obtuvo que 10 fetos tuvieron un retorno del flujo en los siguientes 3días postadministración y que 9 de ellos no tuvieron retorno, en los que quedó como ARED persistente y no existió cambio significativo en el IP ni de la velocidad del pico sistólico en ambos grupos. Se obtuvo que tanto el grupo control (sin esteroide) como los que reganaron flujo diastólico demostraron una velocidad de flujo estable en las arterias umbilicales (56-49cm/s), a diferencia del grupo con flujo ausente o reverso al final de la diástole (ARED) persistente, en el que la velocidad de flujo máximo en la arteria umbilical se mantuvo significativamente incrementada en las siguientes 24h postadministración (p<0.002; 34-62cm/s). Se observó además que el IP de la ACM era significativamente menor en los fetos con ARED y consistente con la redistribución esperada en estos fetos con hipoxemia arterial progresiva. Los valores de índice de pulsatilidad de la arteria cerebral media ni ducto venoso en los fetos con retorno de flujo y controles fue transitoriamente menor (p<0.001). No existieron cambios en la velocidad de flujo en los 3grupos. En cuanto a los resultados perinatales, no existió diferencia significativa en los pesos fetales al nacimiento en los grupos de flujo ausente persistente y en los de retorno de flujo; sin embargo, 8 de 9 pacientes del grupo ARED persistente (89%) presentaron deterioro agudo fetal intraútero, contra 4 de 10 (40%) en el grupo con retorno. Además, 2fetos en el grupo ARED presentaron acidosis severa (pH<7.1) al nacimiento y hubo 2muertes intraútero en este mimo grupo. Esto lleva a la conclusión de que aquellos fetos sin retorno de flujo posterior a la administración de esteroides, tienen un riesgo aumentado de muerte perinatal y acidosis en las siguientes 24h postexposición a esteroides y, por tanto, debería tenerse un estricto control y monitoreo a base de Doppler de estos fetos en las siguientes 24h postadministración.
Esto mismo fue demostrado por Wijnberger et al. en 2004 y Robertson et al. en 2009. En ambos estudios se concluye que la administración de betametasona está asociada con un retorno del flujo diastólico en arteria umbilical en 2/6 de los embarazos complicados con RCIU y que no existen cambios en la onda de flujo e índice de pulsatilidad de la arteria cerebral media ni ducto venoso ni DV, además de que la persistencia de ausencia de flujo diastólico al final de la diástole puede ayudar a la identificación de un subgrupo de fetos con RCIU con mayor riesgo de complicaciones perinatales y neonatales, principalmente asociadas a la necesidad de días en ventilación mecánica o de oxígeno suplementario (nivel de evidencia II-2).
Evaluar qué tipo de glucorticoides debe usarse en los fetos con restricción del crecimiento intrauterino como inductores de maduración pulmonarSegún lo ya descrito, no existe evidencia en humanos suficiente que apoye el uso de forma segura en fetos con RCIU. Y debido a la evidencia existente en experimentos en animales, se hace necesario el continuar con investigación principalmente en el campo de la afectación del neurodesarrollo.
Puntos de práctica clínicaNo existe evidencia suficiente que demuestre que la administración de corticosteroides prenatales en fetos con RCIU brinde beneficios en los resultados prenatales a corto plazo (nivel de evidencia II-c).
La administración prenatal de betametasona se ha asociado al retorno transitorio de flujo al final de la diástole en 2/3 de los embarazos con RCIU y a flujo ausente al final de la diástole en arteria umbilical, sin embargo, esto no representa mejoría en el feto (nivel de evidencia III).
La evaluación Doppler en fetos con RCIU a los que se les administraron corticosteroides en las 24-72h previas no es confiable para la toma de decisiones, por lo que deberá tenerse en consideración para el seguimiento de los fetos con alteraciones hemodinámicas (nivel de evidencia III).
El seguimiento con Doppler 24-72h posterior a la administración de corticosteroides en embarazos con RCIU y flujo ausente al final de la diástole en la arteria umbilical identifica a aquellos fetos predispuestos a descompensación, acidosis severa y muerte fetal (nivel de evidencia III).
La supervivencia sin discapacidad importante a 2años es menor en fetos con RCIU entre 26-32 sdg expuestos a corticosteroides prenatales (nivel de evidencia III).
ConclusionesAunque el uso de corticoesteroides para maduración pulmonar es una práctica establecida, con amplio nivel de evidencia, su uso en la población de fetos pretérmino con restricción del crecimiento aún es controvertido, sin estudios clínicos aleatorizados en humanos que nos permitan emitir recomendaciones adecuados para su uso. La mayoría de las guías de práctica clínica indican su uso si se encuentran en riesgo de parto pretérmino, sin contar si tienen restricción del crecimiento o no. Esto, a pesar de los efectos deletéreos demostrados en estudios en animales. Ante esta premisa, sería importante establecer estudios bien diseñados en humanos, sobre todo con seguimiento a largo plazo para valorar su impacto, no solo en los desenlaces perinatales a corto plazo, sino también en lo relacionado con desarrollo neurológico y cognitivo a largo plazo. Por el momento y mientras no se cuente con este tipo de estudios, dependerá de cada institución y médico tratante el individualizar cada caso y valorar su utilización dependiendo de la severidad de la restricción, posibilidad de interrupción y de supervivencia según cada hospital. Cada uno de estos casos es manejado por un equipo multidisciplinario.
Conflicto de interesesNo existe conflicto de intereses.