Establecer la utilidad de las concentraciones plasmáticas de angiopoyetina-1 en el segundo trimestre como predictor del desarrollo de preeclampsia.
Material y métodosLa investigación fue prospectiva y observacional en 504 pacientes nulíparas con embarazos simples de entre 17 y 20 semanas que acudieron a la consulta prenatal en el Hospital Central Dr. Urquinaona de Maracaibo (Venezuela). Se evaluaron las características generales, las concentraciones plasmáticas de angiopoyetina-1 y la eficacia pronóstica.
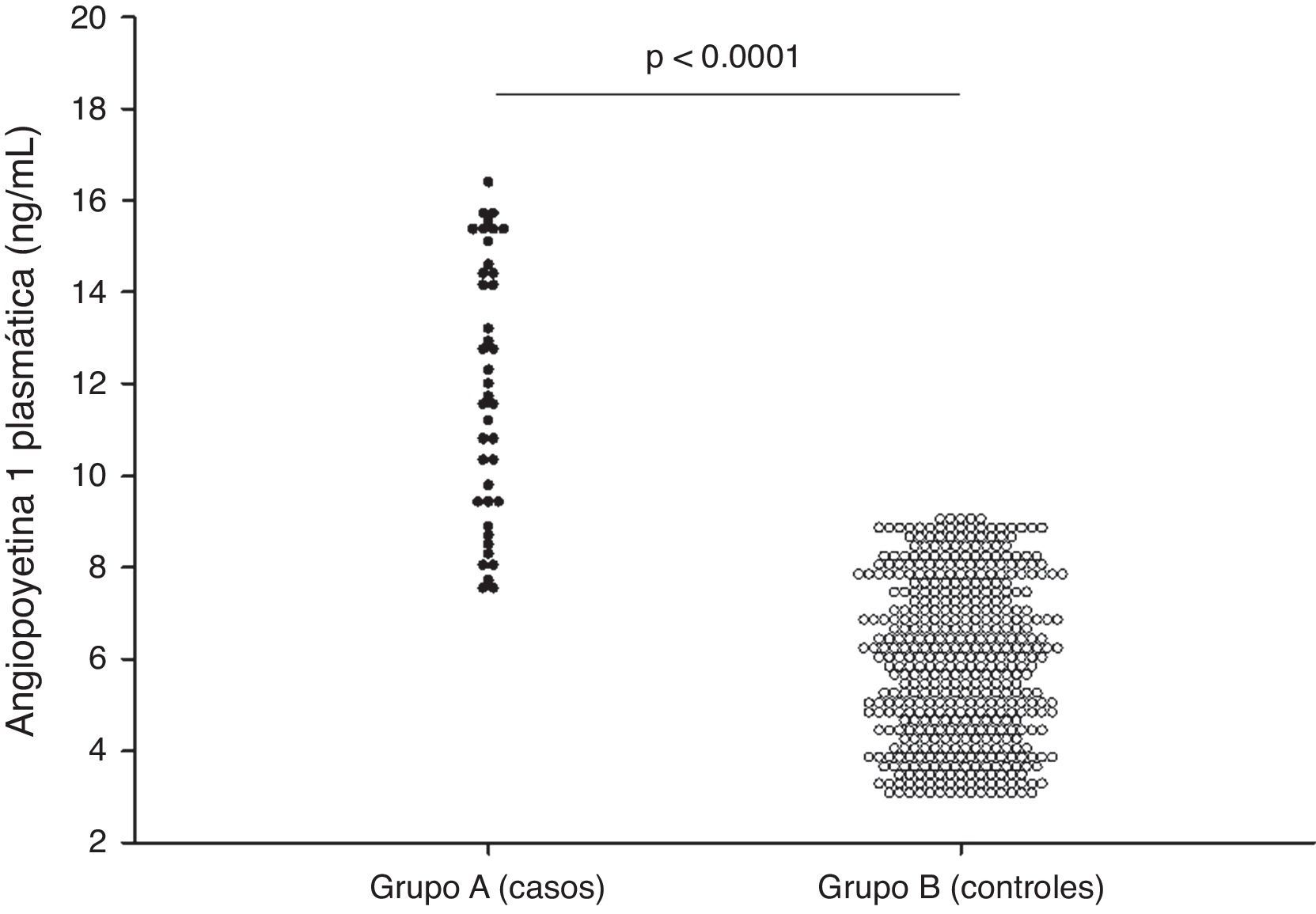
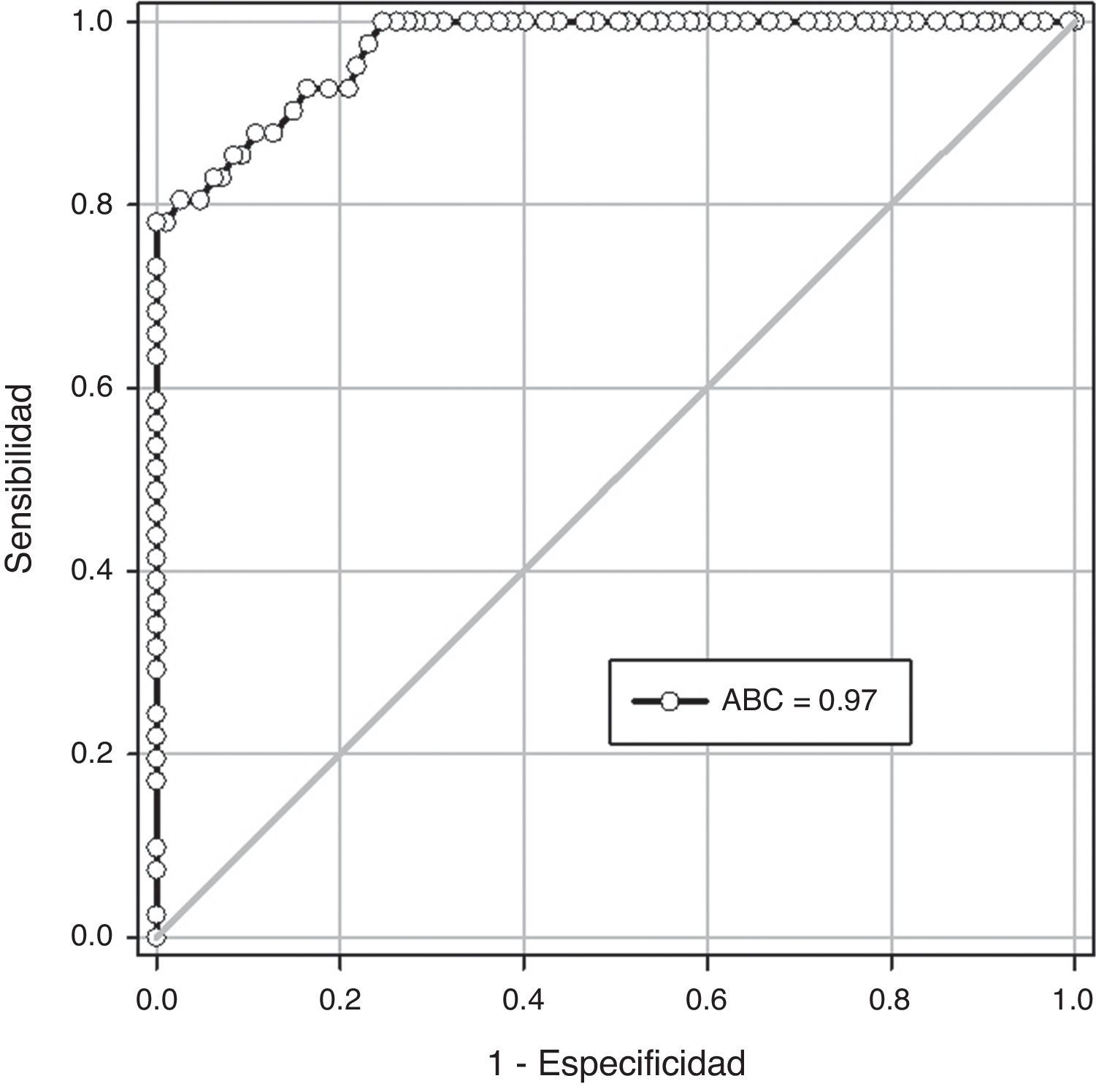
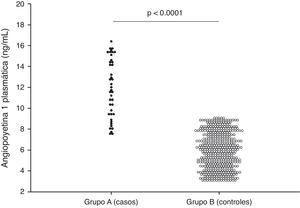
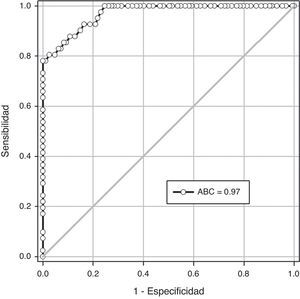
ResultadosLos casos fueron 41 embarazadas que desarrollaron preeclampsia (grupo A) y 463 embarazadas fueron consideradas como controles (grupo B). No se encontraron diferencias estadísticamente significativas en la edad materna, la edad gestacional y la presión arterial sistólica y diastólica en el momento de la realización de la ecografía (p=ns). La edad gestacional en el momento del diagnóstico de preeclampsia en el grupo A fue de 35.0±3.2 semanas. Se encontraron diferencias estadísticamente significativas en los valores de angiopoyetina-1 entre las pacientes del grupo A (11.8±2.8ng/mL) y las pacientes del grupo B (5.9±1.7ng/mL; p<0.0001). Un valor de corte de 8ng/mL presentó un valor por debajo de la curva de 0.97 y tiene una sensibilidad del 80.4%, una especificidad del 97.4%, un valor predictivo positivo del 73.3% y un valor predictivo negativo del 98.2%.
ConclusiónLas concentraciones plasmáticas de angiopoyetina-1 en el segundo trimestre pueden predecir el desarrollo de preeclampsia en nulíparas sin otro factor concomitante.
To establish the usefulness of plasma concentrations of angiopoietin-1 in the second trimester as a predictor of the development of pre-eclampsia.
Material and methodsA prospective and observational study was conducted on 504 nulliparous pregnant women between 17 and 20 weeks gestation who attended the Antenatal Clinic of the Hospital Central Dr. Urquinaona, Maracaibo, Venezuela. An evaluation was made of the general characteristics, plasma angiopoietin-1 concentrations, and prognosis efficacy.
ResultsThe cases were 41 pregnant women who developed pre-eclampsia (group A), and 463 pregnant women that were considered as controls (group B). No significant differences were found in maternal age, gestational age, and systolic and diastolic blood pressure at the time of the ultrasound evaluation (p=ns). Gestational age at the time of pre-eclampsia diagnosis in group A was 35.0±3.2 weeks. Significant differences were found in the plasma angiopoietin-1 concentrations between patients in group A (11.8±2.8ng/mL) and patients in group B (5.9±1.7ng/mL; P<.0001). A cut-off value of 8ng/mL had an under the curve value of 0.97, a sensitivity of 80.4%, a specificity of 97.4%, a positive predictive value of 73.3%, and a negative predictive value of 98.2%.
ConclusionPlasma angiopoietin-1 concentrations in the second trimester could predict the development of pre-eclampsia in nulliparous pregnant women without any other concomitant factor.
La preeclampsia, descrita como la presencia de hipertensión y proteinuria de nueva aparición después de las 20 semanas de embarazo, es un desorden multiorgánico específico del embarazo que causa morbimortalidad materna y fetal1. La patogénesis es desconocida, pero las investigaciones actuales apuntan a la placentación inadecuada debida a la invasión trofoblástica anormal de los vasos uterinos, al igual que a factores genéticos y epidemiológicos2. Se ha propuesto que la inadecuada invasión trofoblástica induce hipoxia placentaria, que lleva a la alteración de los diferentes factores que regulan la vasculogénesis y la angiogénesis3.
La angiogénesis, el desarrollo de nuevos vasos sanguíneos a partir de los preexistentes, está involucrada en los eventos fisiológicos al igual que en los desórdenes patológicos, incluyendo crecimiento tumoral4,5. El factor de crecimiento vascular endotelial (VEGF) es un estimulador de la angiogénesis y promueve la proliferación y migración de las células endoteliales y la permeabilidad vascular. La cinasa-1 de tirosina similar a FMS soluble, un antagonista del VEGF y del factor de crecimiento placentario, actúa como inhibidor de la angiogénesis6.
La familia de las angiopoyetinas (Ang) representa un papel importante en el desarrollo de la vasculatura sanguínea y linfática7. La Ang-1 y la Ang-2 se unen al mismo receptor 2 específico de tirosina cinasa de la célula endotelial, el cual es activado por la Ang-1 y bloqueado por la Ang-27,8. La Ang-1 y la Ang-2, expresadas en la placenta temprana, son fundamentales para el desarrollo vascular placentario8. Durante la evolución del embarazo, la expresión placentaria de Ang-1 aumenta, mientras que las concentraciones de Ang-2 disminuyen9–11. En las embarazadas con preeclampsia establecida, las concentraciones de Ang-1 están más elevadas comparadas con las de las embarazadas normotensas12. Sin embargo, existe poca información sobre si la Ang-1 puede ser un marcador confiable para el desarrollo de preeclampsia.
El objetivo de la investigación fue establecer la utilidad de las concentraciones plasmáticas de Ang-1 en el segundo trimestre como predictor del desarrollo de preeclampsia.
Material y métodosSe realizó una investigación explicativa, prospectiva y longitudinal en pacientes nulíparas con embarazos simples que fueron atendidas en la consulta prenatal ambulatoria del Hospital Central Dr. Urquinaona de Maracaibo (Venezuela), entre enero de 2012 y marzo de 2016. El protocolo de estudio fue aprobado por el Comité de Ética del hospital antes del inicio de la investigación y se obtuvo consentimiento por escrito de todas las pacientes.
Se excluyeron las embarazadas con polihidramnios, hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (hipertensión antes de las 20 semanas de embarazo), enfermedad cardiaca, hematológica, hepática, renal o sistémica crónica, diabetes mellitus pre o gestacional, hábito tabáquico, aquellas embarazadas en las cuales no se pudieron obtener muestras de sangre y las que hubieran utilizado medicamentos que alteren la concentración de Ang-1. También se excluyó a las pacientes que se negaron a participar en la investigación.
La preeclampsia se definió como la presión arterial sistólica de 140mmHg o más, o la presión arterial diastólica de 90mmHg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación13. La presión sanguínea se midió en posición sedente después de 15min de descanso usando un esfigmógrafo de mercurio estándar con un manguito de 14cm. Las presiones arteriales sistólica y diastólica (tomada en relación con el quinto ruido de Korotkoff) se ubicó con relación al punto de 2mmHg más cercano. El método palpatorio se utilizó para verificar las lecturas auscultatorias de la presión arterial sistólica. Las presiones arteriales sistólica y diastólica se calcularon del promedio de la presión arterial de cada brazo.
Una vez seleccionadas las pacientes para el estudio, se rellenó una ficha de recogida de datos que incluyó: identificación de la paciente, antecedentes personales y ginecoobstétricos, control prenatal, edad de gestación (por fecha de la última regla o ecografía del primer trimestre) y concentraciones séricas de Ang-1. La edad gestacional se calculó sobre la fecha de la última menstruación y se corrigió por ultrasonido si las mediciones durante el primer trimestre mostraban una diferencia de más de 7 días. Las muestras de Ang-1 se tomaron entre las 17 y 20 semanas de embarazo para determinar las concentraciones de Ang-1. Todos los embarazos fueron seguidos hasta el parto y se catalogaron de acuerdo con el desarrollo de preeclampsia (casos; grupo A) o no (controles; grupo B).
Las muestras de sangre de la vena antecubital para la determinación se recogieron en el momento de la realización de la evaluación ecográfica. Las muestras coagularon a temperatura ambiente en un tubo con litio/heparina y se almacenaron a −70°C hasta el momento de procesarlas. Posteriormente, fueron centrifugadas a 1.500rpm durante 10min luego de 30min de la toma la muestra y almacenadas con posterioridad a −80°C. La determinación de las concentraciones de Ang-1 fue realizada utilizando una prueba de ELISA (R&D Systems, Inc., EE. UU.). Todas las mediciones se realizaron por duplicado y el promedio fue utilizado como resultado final. La sensibilidad fue<10ng/ml. Los coeficientes de variación intra e interensayo fueron de 4 y 7%, respectivamente.
Los valores obtenidos se presentaron como promedio±desviación estándar. Se utilizó la prueba de Kolmogorov-Smirnov para comprobar la distribución normal de los datos (p>0.05). La prueba de la t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y para comparar las variables continuas. La precisión de las determinaciones de Ang-1 para la predicción del desarrollo de preeclampsia se presenta en función de la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo. Se utilizó el análisis operador-receptor para determinar el mejor valor de corte. Se consideró p<0.05 como estadísticamente significativa.
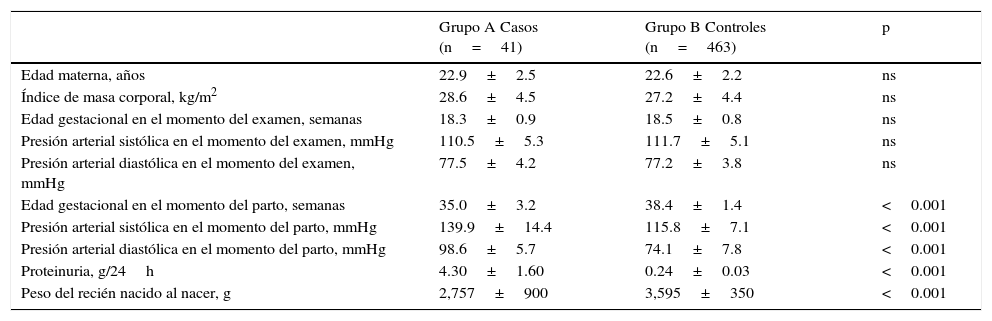
ResultadosSe obtuvieron los resultados de las mediciones de 504 mujeres embarazadas, de las cuales 41 (8.1%) desarrollaron preeclampsia (grupo A) y 463 (91.9%) fueron consideradas como controles (grupo B). Las características generales de los 2 grupos de embarazadas se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas en la edad materna, la edad gestacional y las presiones arteriales sistólica y diastólica en el momento de la realización de la ecografía (p=ns). La edad gestacional en el momento del diagnóstico de preeclampsia en el grupo A fue de 35.0±3.2 semanas. Se observaron diferencias estadísticamente significativas en la edad gestacional en el momento del parto, las presiones arteriales sistólica y diastólica en el momento del parto, la proteinuria de 24h y el peso del recién nacido al nacer entre los 2 grupos de embarazadas (p<0.0001).
Características generales
| Grupo A Casos (n=41) | Grupo B Controles (n=463) | p | |
|---|---|---|---|
| Edad materna, años | 22.9±2.5 | 22.6±2.2 | ns |
| Índice de masa corporal, kg/m2 | 28.6±4.5 | 27.2±4.4 | ns |
| Edad gestacional en el momento del examen, semanas | 18.3±0.9 | 18.5±0.8 | ns |
| Presión arterial sistólica en el momento del examen, mmHg | 110.5±5.3 | 111.7±5.1 | ns |
| Presión arterial diastólica en el momento del examen, mmHg | 77.5±4.2 | 77.2±3.8 | ns |
| Edad gestacional en el momento del parto, semanas | 35.0±3.2 | 38.4±1.4 | <0.001 |
| Presión arterial sistólica en el momento del parto, mmHg | 139.9±14.4 | 115.8±7.1 | <0.001 |
| Presión arterial diastólica en el momento del parto, mmHg | 98.6±5.7 | 74.1±7.8 | <0.001 |
| Proteinuria, g/24h | 4.30±1.60 | 0.24±0.03 | <0.001 |
| Peso del recién nacido al nacer, g | 2,757±900 | 3,595±350 | <0.001 |
En la figura 1 se muestran los valores de las mediciones biométricas fetales y las concentraciones de Ang-1. Se observaron diferencias estadísticamente significativas en las concentraciones de Ang-1 entre las pacientes del grupo A (11.8±2.8ng/mL) y las pacientes del grupo B (5.9±1.7ng/mL; p<0.0001).
En la figura 2 se muestra la curva operador-receptor para la precisión de las concentraciones de Ang-1 en la predicción de la preeclampsia. Un valor de corte de 8ng/mL presentó un valor bajo la curva de 0.97 (intervalo de confianza de 95% [IC 95%] 0.94-0.99) y tiene una sensibilidad de 80.4% (IC 95% 65.1-91.1), una especificidad de 97.4% (IC 95% 95.5-98.6), un valor predictivo positivo de 73.3% (IC 95% 58.0-85.4) y un valor predictivo negativo de 98.2% (IC 95% 96.5-99.2). La razón de posibilidad positiva fue de 31.0 (IC 95% 17.5-54.9) y la exactitud pronóstica fue de 96.0%.
DiscusiónLos resultados de la presente investigación aportan evidencia de un aumento de las concentraciones de Ang-1 en el segundo trimestre en embarazadas nulíparas que posteriormente desarrollan preeclampsia, y que esta tiene una importante capacidad de discriminar entre las embarazadas que desarrollan preeclampsia y las que no.
Las Ang son necesarias para la vasculogénesis y la angiogénesis. El proceso de neovascularización es iniciado por los factores angiogénicos, los cuales tienen un papel crucial en el crecimiento y el desarrollo de la placenta14. La Ang-1 y el receptor 2 específico de tirosina cinasa son expresados en los pericitos y actúan sobre las células endoteliales vecinas para estabilizar la interacción célula endotelial-pericito y se considera que son importantes para la maduración, la estabilización y la supervivencia endotelial15,16. Los factores que regulan la expresión de la Ang-1 no son completamente comprendidos. La hipoxia regula la expresión del gen de VEGF-A y puede regular la expresión de Ang-117.
Varias publicaciones se han enfocado en la importancia de las Ang9,14, las cuales actúan en conjunto con el VEGF. Se ha demostrado que el VEGF es importante para la vasculogénesis, la angiogénesis y el desarrollo de la placenta18. Geva et al.10 demostraron que las concentraciones de ARN mensajero tanto de VEGF como de Ang-1 están aumentadas en la placenta durante el embarazo normal. Seval et al.14 reportaron que las Ang y sus receptores son cruciales en el desarrollo temprano de la placenta e identificaron la presencia de Ang-1 tanto en células endoteliales como en el sincitiotrofoblasto.
En embarazos complicados por la preeclampsia generalmente se asume que la placenta es hipóxica. Esto se considera así por la reducción del flujo sanguíneo materno al espacio intervelloso, la cual es secundaria a la conversión incompleta de las arterias espirales endometriales por el trofoblasto extravelloso migratorio, el cual no logra invadir los segmentos miometriales de estas arterias19,20. Sin embargo, en ausencia de mediciones directas de la presión parcial de oxígeno en el espacio intervelloso, este aspecto está basado en la determinación de marcadores menores, los cuales se consideran que pueden estar afectados por la presión parcial de oxígeno local. Estos análisis se vuelven más complicados por las diferentes categorías de hipoxia y la sobreagregación de factores adicionales19,21. Desde la perspectiva histomorfométrica, existe dilatación de los capilares fetales sin evidencia de proliferación de los vasos21,22. Estos cambios se cree que son secundarios a la disminución en el área de superficie vellosa total más que a la hipoxia per se21.
Se ha demostrado previamente que las concentraciones maternas de Ang-1 estaban aumentadas en las preeclámpticas con enfermedad establecida12. Sin embargo, la presente investigación logró demostrar una asociación entre las concentraciones en el segundo trimestre del embarazo y el posterior desarrollo de preeclampsia. Leinonen et al.23 no pudieron comprobar esta relación, ya que solo una paciente que desarrolló preeclampsia después de las 20 semanas presentó valores elevados de Ang-1. Es posible que el pequeño tamaño del grupo de embarazadas que desarrolló preeclampsia en esa investigación no permitiera establecer una conclusión firme sobre el posible papel de la Ang-1 en la aparición de la preeclampsia.
Para esta investigación se tomó el valor de Ang-1 de 8ng/mL como punto de corte óptimo, ya que es aquel que minimiza de forma máxima la suma de los errores (falsos positivos+falsos negativos) y verifica el comportamiento de otros estadígrafos como la sensibilidad, la especificidad y el índice de Youden. Otro factor importante es la proporción relativa de la preeclampsia que se pretende discriminar con la prueba, es decir, la prevalencia o probabilidad a priori del desarrollo de preeclampsia en la población.
El estudio tiene algunas limitaciones, ya que no fue posible incluir información sobre algunos factores de confusión. Schneuer et al.24 han descrito que la edad materna, la ganancia de peso, el lugar de nacimiento y la condición socioeconómica pueden modificar de forma significativa las concentraciones de algunas de las sustancias angiogénicas, como las Ang y su relación. Por otra parte, esta investigación se limitó solo a pacientes nulíparas sin otras enfermedades asociadas. Se necesitan estudios en un futuro para confirmar los hallazgos de esta investigación en diferentes grupos de embarazadas.
Durante la última década, se han propuesto varios marcadores bioquímicos y biofísicos para predecir qué embarazadas desarrollarán preeclampsia. Se han planteado los factores involucrados en el balance angiogénico como marcadores bioquímicos. Los factores antiangiogénicos y angiogénicos han sido investigados como predictores de preeclampsia, pero no hay suficientes datos sobre estos como pruebas de pesquisa25. Las Ang tienen el potencial de ser marcadores bioquímicos para la preeclampsia ya que son de gran importancia durante la implantación y el desarrollo placentario. Esta investigación ha demostrado que las concentraciones de Ang-1 en el segundo trimestre son útiles para discriminar a las embarazadas que desarrollarán preeclampsia de aquellas que no. Los hallazgos de esta investigación se relacionan con otros datos que describen concentraciones elevadas de factores angiogénicos, antes de las manifestaciones clínicas de la preeclampsia26–28. Todos estos datos indican que la alteración del desarrollo vascular placentario y de la función vascular materna está asociada a la alteración del balance entre los factores angiogénicos y antiangiogénicos en las preeclámpticas.
ConclusiónLos hallazgos de la presente investigación permiten concluir que las concentraciones plasmáticas de Ang-1 en el segundo trimestre pueden predecir el desarrollo de preeclampsia en nulíparas sin otro factor concomitante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.