Determinar las concentraciones de adiponectina en mujeres obesas y no obesas con diagnóstico de síndrome de ovarios poliquísticos (SOPQ).
Materiales y métodosSe realizó un estudio de casos y controles en mujeres con diagnóstico de SOPQ y controles sanas de edades similares, con menstruaciones regulares y ovarios normales por ecografía y fueron divididas en 4 grupos (grupo A: SOPQ obesas; grupo B: SOPQ no obesas; grupo C: controles obesas, y grupo D: controles no obesas) de acuerdo con el índice de masa corporal (obesas >30kg/m2 y no obesas <25kg/m2). Se midieron las concentraciones de hormonas sexuales, globulina fijadora de hormonas sexuales, glucosa sérica, insulina y adiponectina.
ResultadosLas mujeres con SOPQ obesas y no obesas presentaron concentraciones más elevadas de hormonas sexuales e insulina comparadas con el grupo control de obesas y el de no obesas (p<0.0001). Se observó que las mujeres con SOPQ presentaron concentraciones significativamente más bajas de adiponectina (grupo A: 8.3±1.6ng/mL y grupo B: 10.1±1.4ng/mL) comparado con los controles (grupo C: 12.1±2.8ng/mL y grupo D: 14.7±2.6ng/dL; p<0.0001). Se observó que las concentraciones de adiponectina presentaban correlación positiva y significativa con los valores de glucemia e insulina en ayunas en las mujeres con SOPQ (p<0.05).
ConclusiónExisten diferencias significativas en las concentraciones plasmáticas de adiponectina entre las mujeres con SOPQ obesas y no obesas respecto a los controles normales.
To determine plasma adiponectin concentrations in obese and non-obese women with polycystic ovary syndrome (PCOS).
Materials and methodsA Case control study was conducted on women with a diagnosis of PCOS and age-matched healthy controls, with regular menstruation and normal ultrasound ovaries, were selected. Participants were divided into four groups (Group A: PCOS and obese; Group B: PCOS and non-obese; Group C: obese controls, and Group D: non-obese controls) according to body mass index (obese >30kg/m2 and non-obese <25kg/m2). Concentrations of sexual hormones, sex hormone-binding globulin, serum glucose, insulin, and adiponectin, were measured.
ResultsObese and non-obese women with PCOS had higher luteinising hormone, follicle stimulating hormone, androstenedione, testosterone, and insulin levels compared to women in the obese and non-obese control group, respectively (P<.0001). Women with PCOS had a significantly lower concentration of adiponectin (Group A: 8.3±1.6ng/mL and Group B: 10.1±1.4ng/mL), compared with controls (Group C: 12.1±2.8ng/mL and Group D: 14.7±2.6ng/dL; P<.0001). It was observed that adiponectin concentrations had a positive and significant association with fasting blood glucose and insulin in PCOS women (P<.05).
ConclusionThere are significant differences in plasma adiponectin concentrations between obese and non-obese women with polycystic ovary syndrome and normal controls.
La resistencia a la insulina en el síndrome de ovarios poliquísticos (SOPQ) es en parte debida a la alta prevalencia de obesidad en el desorden. Sin embargo, se ha descrito que aproximadamente el 40% de las mujeres con SOPQ no son obesas y que la obesidad en el SOPQ parece reflejar principalmente los factores ambientales y tiene un modesto impacto sobre las características del desorden1,2. Las mujeres con SOPQ desarrollan resistencia a la insulina más allá de lo determinado por el índice de masa corporal (IMC)3. Sin embargo, mientras que la obesidad per se puede no ser la alteración primaria en el SOPQ, es posible que la disfunción del tejido adiposo puede representar un papel en la resistencia a la insulina y la inflamación subclínica, llevando a las consecuencias metabólicas y cardiovasculares del síndrome1.
El tejido adiposo es un órgano activo desde el punto de vista endocrino que produce un número de péptidos (en los que destacan las adipocinas y factores de crecimiento), lípidos y esteroides4,5. Las adipocinas actúan en forma autocrina y paracrina en el tejido adiposo mismo y en una forma endocrina para afectar otros órganos o tejidos, incluyendo el músculo esquelético, glándulas suprarrenales y el sistema nervioso central, modulando diferentes funciones, incluyendo la acción de la insulina5. En forma general, el tejido adiposo es un determinante importante de la sensibilidad corporal total in vivo a la insulina4.
La adiponectina es una proteína específica del adipocito con un papel importante en la homeostasis de la glucosa y la insulina6, por lo cual posee propiedades antidiabéticas, antiaterogénicas y de sensibilización a la insulina. Puede inducir una disminución de los ácidos grasos libres circulantes liberados de los músculos esqueléticos, disminuir la entrada de estos ácidos grasos libres al hígado y estimular la captación de glucosa en los adipocitos. Esta disminución del contenido tisular de triglicéridos mejora la sensibilidad a la insulina7. Además de sus efectos metabólicos, muestra acciones antiinflamatorias y ateroprotectoras las cuales afectan particularmente la función vascular endotelial, por lo que la disminución de las concentraciones circulantes puede contribuir al aumento de la resistencia a la insulina y a la disfunción endotelial8, debido a lo cual es un marcador temprano de aterosclerosis9.
Es ampliamente conocido que varios factores de riesgo cardiovascular están presentes en las mujeres con SOPQ, pero los datos sobre las concentraciones de adiponectina, tanto en mujeres obesas como en no obesas con SOPQ son controversiales, por lo que el objetivo de esta investigación fue determinar las concentraciones plasmáticas de adiponectina entre mujeres obesas y no obesas con diagnóstico de SOPQ.
Materiales y métodosEntre septiembre de 2009 y enero de 2016, se incluyeron en el estudio explicativo, prospectivo, transversal de casos y controles mujeres que asistieron a las consultas de Medicina Interna, Endocrinología y Ginecología del Hospital Central Dr. Urquinaona, Maracaibo, Venezuela, con diagnóstico de SOPQ. El Comité de Ética del hospital aprobó el estudio, y se obtuvo consentimiento por escrito de todas las mujeres.
El diagnóstico de SOPQ se confirmó por los siguientes criterios: evidencia de oligoanovulación (menos de 6 periodos menstruales en el año previo), signos clínicos o bioquímicos de hiperandrogenismo (concentraciones de testosterona plasmática por encima del límite superior normal y relación LH [lutoprina]/FSH [folitropina] anormal >2), y ovarios normales o aumentados de tamaño (>10mL) con la presencia de microquistes subcapsulares (en número de 12 o más) de 2-9mm de diámetro en la evaluación ecográfica abdominal10.
Se seleccionaron mujeres con SOPQ y obesidad (IMC >30kg/m2; grupo A, n=34) y no obesas (IMC <25kg/m2; grupo B, n=13). Las pruebas hormonales y la ecografía abdominal se realizaron durante la fase folicular temprana, entre el tercer y quinto día del ciclo menstrual espontáneo. El grupo control (n = 47) consistió en mujeres de edades similares, con menstruaciones regulares (entre 21 y 35 días), que asistieron a la consulta para sus controles ginecológicos rutinarios; fueron divididas de acuerdo con el IMC en obesas (IMC > 30 kg/m2; grupo C, n = 33) y no obesas (IMC < 25 kg/m2; grupo D, n = 13). Todos los controles se estudiaron del día 3 al 5 de su ciclo menstrual. Se excluyeron las mujeres con enfermedad tiroidea o suprarrenal, presencia de hiperprolactinemia, mujeres con hipertensión secundaria, insuficiencia renal con aclaramiento de creatinina <30mL/min por 1.73m2 de superficie corporal, excreción de proteína urinaria mayor de 1g/día, ángor pectoris, infarto del miocardio o enfermedad cerebrovascular reciente, y aquellas mujeres que no aceptaron participar en el estudio. Las mujeres que tomaban fármacos antihipertensivos fueron excluidas del estudio, y a las que tomaban fármacos hipolipemiantes se les solicitó que los suspendieran por 4 semanas antes del estudio. Ninguna paciente tomaba fármacos que afectaran las concentraciones de adiponectina (por ejemplo, anticonceptivos orales o metformina).
El IMC se calculó mediante el peso dividido por la talla al cuadrado (kg/m2), mientras que la relación cintura-cadera (RCC) se calculó por la división de la circunferencia de la cintura entre la circunferencia de la cadera. Se midió la circunferencia de la cintura y la cadera en la región más estrecha del abdomen y en la parte más ancha de la región glútea, respectivamente.
Todas las muestras de sangre venosa se tomaron en ayunas, en la primera semana posterior a la menstruación espontánea o inducida. Todas se manejaron de forma similar y se almacenaron a –80°C por 1-3 días. Las concentraciones de FSH, LH, estradiol, androstendiona y testosterona se midieron por radioinmunoanálisis y quimioluminiscencia usando kits comerciales (Immulite 2000, Diagnostic Product Corp, EE.UU.). Los coeficientes de variación intra e interensayo fueron del 4 y 7% para FSH, 6 y 7% para LH, 7 y 9% para estradiol, 6 y 10% para androstendiona, y 4 y 7% para testosterona, respectivamente. La globulina fijadora de hormonas sexuales se cuantificó por inmunoanálisis (Perkin-Elmer Auto-DELFIA Immunoassay analyzer); el coeficiente de variación interensayo fue del 3% y el de intraensayo fue del 4%, respectivamente.
La glucosa sérica se cuantificó por el método de la glucosa-oxidasa (Pointe Scientific Inc., EE.UU.). Los coeficientes de variación intra e interensayo fueron del 1.4 y 1.9%. La insulina se determinó por radioinmunoanálisis (Coat-a-Count, Diagnostic Products Corp, EE.UU.). Los coeficientes de variación intra e interensayo fueron del 1.6 y 5.5%, respectivamente. Las concentraciones de adiponectina se midieron por la prueba de ELISA (kit: B-Bridge International, EE.UU.) siguiendo las instrucciones del fabricante. Los coeficientes de variación inter e intraensayo fueron del 6.3 y 4.9%, respectivamente.
Los datos se presentan como media±desviación estándar. El análisis estadístico se realizó con la prueba de ANOVA con posprueba de Dunnett entre los grupos de mujeres con SOPQ (grupos A y B), tomando como controles a las mujeres del grupo C. Los coeficientes de correlación entre las concentraciones de adiponectina con los valores de presión arterial y los parámetros de laboratorio se evaluaron usando la prueba de Pearson. Se realizó un análisis de regresión lineal entre los diferentes parámetros de laboratorio y las concentraciones de adiponectina. Se consideró un valor p<0.05 como estadísticamente significativo.
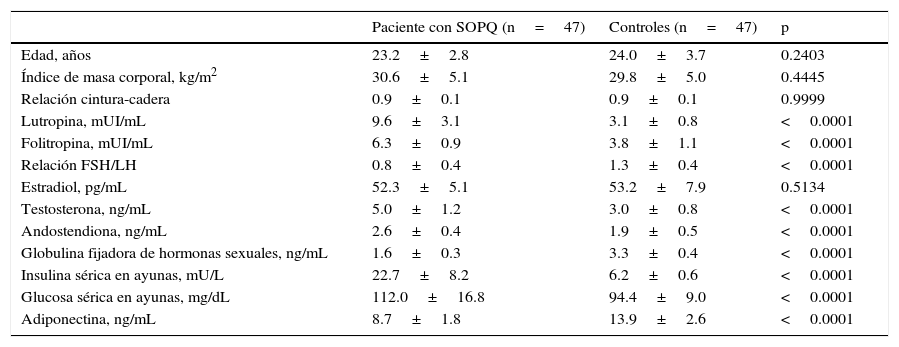
ResultadosLas características clínicas y endocrinas de las mujeres con SOPQ y los controles se muestran en la tabla 1. Los grupos eran similares en edad (23.2 ± 2.8 años para las pacientes con SOPQ y 24.0 ± 3.7 años para las pacientes del grupo control; p = 0.2403) e IMC (30.6 ± 5.1 kg/m2 y 29.8 ± 5.0 kg/m2 para las pacientes con SOPQ y las mujeres en el grupo control, respectivamente; p = 0.4445). Las concentraciones de LH, FSH y la relación FSH/LH estaban significativamente más elevadas en las mujeres con SOPQ comparado con las mujeres del grupo control (p<0.0001). No se encontraron diferencias estadísticamente significativas en las concentraciones de estradiol (52.3 ± 5.1 pg/mL para las pacientes con SOPQ y 53.2 ± 7.9 pg/mL para las mujeres en el grupo control; p = 0.5134). Los valores de testosterona y androstendiona fueron significativamente más altos en las mujeres con diagnóstico de SOPQ (p < 0.0001). Los valores de globulina fijadora de hormonas sexuales fueron significativamente menores en las mujeres con SOPQ comparado con los controles (1.6 ± 0.3 ng/mL comparado con 3.3 ± 0.4 ng/mL; p < 0.0001). También se encontraron concentraciones más altas de insulina y glucemia en ayunas en las pacientes con SOPQ comparado con los controles (p<0.0001).
Características de las pacientes con síndrome de ovarios poliquísticos (SOPQ) y controles
| Paciente con SOPQ (n=47) | Controles (n=47) | p | |
|---|---|---|---|
| Edad, años | 23.2±2.8 | 24.0±3.7 | 0.2403 |
| Índice de masa corporal, kg/m2 | 30.6±5.1 | 29.8±5.0 | 0.4445 |
| Relación cintura-cadera | 0.9±0.1 | 0.9±0.1 | 0.9999 |
| Lutropina, mUI/mL | 9.6±3.1 | 3.1±0.8 | <0.0001 |
| Folitropina, mUI/mL | 6.3±0.9 | 3.8±1.1 | <0.0001 |
| Relación FSH/LH | 0.8±0.4 | 1.3±0.4 | <0.0001 |
| Estradiol, pg/mL | 52.3±5.1 | 53.2±7.9 | 0.5134 |
| Testosterona, ng/mL | 5.0±1.2 | 3.0±0.8 | <0.0001 |
| Andostendiona, ng/mL | 2.6±0.4 | 1.9±0.5 | <0.0001 |
| Globulina fijadora de hormonas sexuales, ng/mL | 1.6±0.3 | 3.3±0.4 | <0.0001 |
| Insulina sérica en ayunas, mU/L | 22.7±8.2 | 6.2±0.6 | <0.0001 |
| Glucosa sérica en ayunas, mg/dL | 112.0±16.8 | 94.4±9.0 | <0.0001 |
| Adiponectina, ng/mL | 8.7±1.8 | 13.9±2.6 | <0.0001 |
Los valores de adiponectina se muestran en la tabla 1. Se observó que las mujeres con SOPQ mostraron concentraciones significativamente más altas (8.7±1.8ng/mL) comparado con los valores promedios en las mujeres del grupo control (13.9±2.6ng/mL; p<0.0001).
Se observó una correlación significativa entre las concentraciones de adiponectina y los valores de presión arterial sistólica y diastólica (r=0.129 y r=0.192, respectivamente; p<0.05). También se observó una correlación débil y significativa con los valores del IMC (r=0.213; p<0.05).
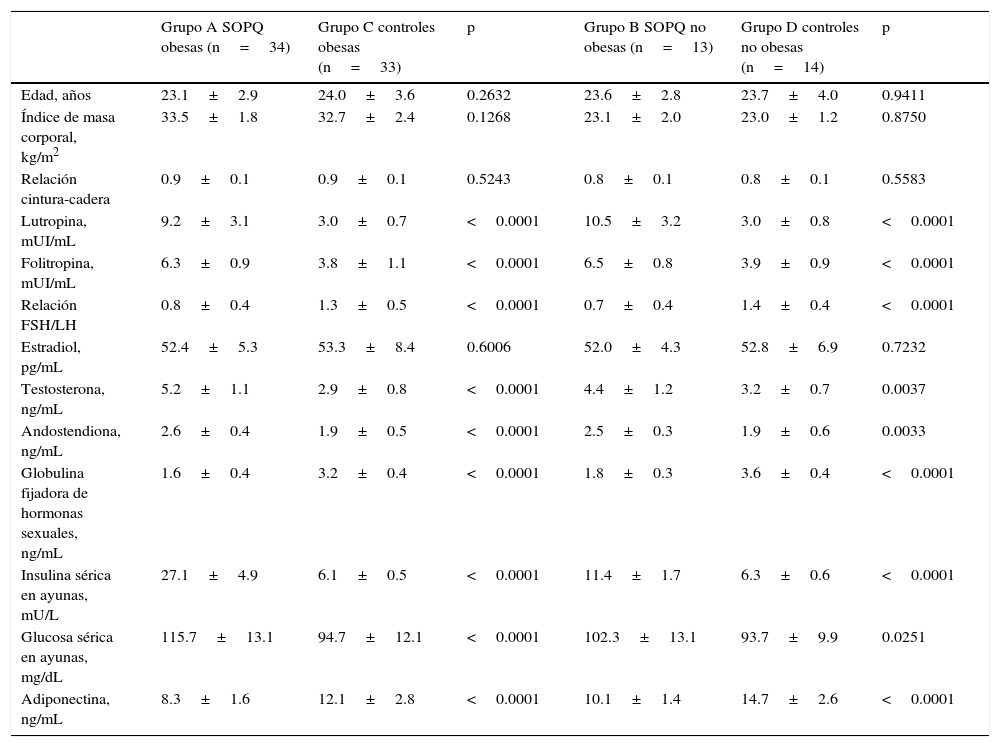
En la tabla 2 se observan las características de las mujeres con SOPQ obesas (grupo A; n=34), mujeres con SOPQ y no obesas (grupo B; n=13), controles obesas (grupo C; n=33) y controles no obesas (grupo D; n=14). Las mujeres de los 4 grupos no mostraron diferencias estadísticamente significativas con relación a la edad (p=ns). Las mujeres de ambos grupos de SOPQ (tabla 2) presentaron valores más elevados de LH, FSH, relación FSH/LH, testosterona y androstendiona comparado con las mujeres de los grupos C y D (p<0.0001). No se encontraron diferencias significativas en las concentraciones de estradiol entre las mujeres de los grupos A y B comparado con las mujeres de los grupos C y D (p=0.6006 y p=0.7232, respectivamente). Por otro lado, las concentraciones de globulina fijadora de hormonas sexuales fueron más bajas en ambos grupos de mujeres con diagnóstico de SOPQ comparado con los controles (p<0.0001). Con respecto a las concentraciones de insulina, las mujeres de los grupos A y B presentaron concentraciones significativamente más altas que las mujeres de los grupos C y D. Las mujeres con SOPQ obesas y no obesas presentaron concentraciones de glucosa sérica significativamente más altas que los controles obesos y no obesos, respectivamente (p<0.0001).
Características de las pacientes con síndrome de ovarios poliquísticos (SOPQ) y controles obesas y no obesas
| Grupo A SOPQ obesas (n=34) | Grupo C controles obesas (n=33) | p | Grupo B SOPQ no obesas (n=13) | Grupo D controles no obesas (n=14) | p | |
|---|---|---|---|---|---|---|
| Edad, años | 23.1±2.9 | 24.0±3.6 | 0.2632 | 23.6±2.8 | 23.7±4.0 | 0.9411 |
| Índice de masa corporal, kg/m2 | 33.5±1.8 | 32.7±2.4 | 0.1268 | 23.1±2.0 | 23.0±1.2 | 0.8750 |
| Relación cintura-cadera | 0.9±0.1 | 0.9±0.1 | 0.5243 | 0.8±0.1 | 0.8±0.1 | 0.5583 |
| Lutropina, mUI/mL | 9.2±3.1 | 3.0±0.7 | <0.0001 | 10.5±3.2 | 3.0±0.8 | <0.0001 |
| Folitropina, mUI/mL | 6.3±0.9 | 3.8±1.1 | <0.0001 | 6.5±0.8 | 3.9±0.9 | <0.0001 |
| Relación FSH/LH | 0.8±0.4 | 1.3±0.5 | <0.0001 | 0.7±0.4 | 1.4±0.4 | <0.0001 |
| Estradiol, pg/mL | 52.4±5.3 | 53.3±8.4 | 0.6006 | 52.0±4.3 | 52.8±6.9 | 0.7232 |
| Testosterona, ng/mL | 5.2±1.1 | 2.9±0.8 | <0.0001 | 4.4±1.2 | 3.2±0.7 | 0.0037 |
| Andostendiona, ng/mL | 2.6±0.4 | 1.9±0.5 | <0.0001 | 2.5±0.3 | 1.9±0.6 | 0.0033 |
| Globulina fijadora de hormonas sexuales, ng/mL | 1.6±0.4 | 3.2±0.4 | <0.0001 | 1.8±0.3 | 3.6±0.4 | <0.0001 |
| Insulina sérica en ayunas, mU/L | 27.1±4.9 | 6.1±0.5 | <0.0001 | 11.4±1.7 | 6.3±0.6 | <0.0001 |
| Glucosa sérica en ayunas, mg/dL | 115.7±13.1 | 94.7±12.1 | <0.0001 | 102.3±13.1 | 93.7±9.9 | 0.0251 |
| Adiponectina, ng/mL | 8.3±1.6 | 12.1±2.8 | <0.0001 | 10.1±1.4 | 14.7±2.6 | <0.0001 |
Se encontró que las mujeres con SOPQ y obesas tenían concentraciones de adiponectina significativamente más bajas que los controles obesos (8.3±1.6ng/mL comparado con 12.1±2.8ng/mL; p<0.0001; tabla 2). De igual forma, en las pacientes con SOPQ no obesas se observaron concentraciones significativamente más bajas de adiponectina al compararlas con las mujeres controles no obesas (10.1±1.4ng/mL comparado con 14.7±2.6ng/mL; p<0.0001).
Al analizar el grupo de mujeres con SOPQ obesas y no obesas, se observó que las concentraciones de la adiponectina presentaban una correlación significativa (p<0.05) con los valores de glucemia en ayunas (r=–0.367) e insulina en ayunas (r=–0.450). El análisis de regresión lineal mostró que los factores que afectaban la concentración plasmática de la adiponectina fue la glucosa sérica (beta=–0.465; p<0.05).
DiscusiónLos resultados de la investigación demuestran que las mujeres con SOPQ obesas y no obesas presentan concentraciones significativamente más bajas de adiponectina al compararla con mujeres controles sanas, lo cual puede contribuir a la resistencia a la insulina en el SOPQ. Los hallazgos de la presente investigación son consistentes con informes previos en los cuales se ha descrito disminución de las concentraciones en mujeres con SOPQ11,12.
Sin embargo, estos resultados difieren de informes previos que no encontraron diferencias estadísticamente significativas en las concentraciones plasmáticas de adiponectina en las mujeres con o sin SOPQ no obesas13. La posible explicación a estas diferencias puede deberse a las diferencias en las anomalías metabólicas, incluyendo el grado de resistencia a la insulina y la localización de la grasa corporal entre las participantes. En forma adicional, los mecanismos moleculares que modulan la resistencia a la insulina pueden variar entre individuos y, por lo tanto, las concentraciones de adiponectina también pueden mostrar marcadas diferencias.
Un hallazgo importante de esta investigación fue las diferencias significativas de las concentraciones de adiponectina en las mujeres con SOPQ divididas por IMC (más bajas en las obesas que en las no obesas). Estos resultados son similares a investigaciones previas14, lo cual demuestra que la adiponectina es la única adipocina que, a pesar de su producción exclusiva en el tejido graso, es inversamente regulada por la obesidad. Se ha reportado que las concentraciones se correlacionan negativamente con la adiposidad, dislipidemia diabética, enfermedad cardiovascular y resistencia a la insulina14,15. Además, las concentraciones se correlacionan más con la hiperinsulinemia y la resistencia a la insulina que con la obesidad o la grasa corporal14. También se ha encontrado que las bajas concentraciones plasmáticas son un factor de riesgo independiente para el desarrollo de diabetes no insulinodependiente16.
El análisis estadístico en esta investigación demostró una correlación negativa entre las concentraciones plasmáticas de adiponectina y las concentraciones de glucemia e insulina en ayunas, siendo la glucemia en ayunas el único factor determinante independiente de las concentraciones de adiponectina plasmática. El SOPQ frecuentemente está asociado con resistencia a la insulina secundaria a hiperinsulinemia compensatoria y obesidad2. Se considera que la resistencia a la insulina representa un papel fundamental en la etiología del SOPQ, ya que se ha demostrado que involucra tanto defectos del receptor como posreceptor, incluyendo defectos en la fosfatidilinositol 3-cinasa y el transportador de glucosa GLUT-417. Además, se observa alteración de la utilización de la glucosa estimulada por la insulina periférica y altas concentraciones de insulina basal, probablemente debido al incremento de la secreción de insulina o a la disminución de la depuración hepática de la hormona; tales anomalías son independientes de la obesidad18.
Es posible que la adiponectina pueda afectar directamente el grado de resistencia a la insulina y la extensión de la hiperinsulinemia. La evidencia apoya que el incremento de las concentraciones del factor de necrosis tumoral alfa (TNF-alfa) interfiere con la señalización del receptor de insulina, suprimiendo la expresión de adiponectina en el tejido adiposo19. Una investigación previa describió una relación inversa entre la adiponectina y el TNF-alfa20. Sin embargo, se ha descrito una correlación inversa entre el ARN mensajero del TNF-alfa y las concentraciones de adiponectina21. Además, aquellos sujetos con concentraciones más altas de ARN mensajero de adiponectina secretaban menores cantidades de TNF-alfa por su tejido adiposo in vitro22. Asimismo, el hecho de que la insulina estimula la secreción de adiponectina en roedores hace posible que las concentraciones de adiponectina disminuyan en la obesidad debido a la resistencia a la insulina en el adipocito23.
Los datos de la investigación indican que, en las mujeres con SOPQ, no está asociado con elevaciones de las concentraciones de testosterona ni con la globulina fijadora de hormonas sexuales debido a que no se encontró correlación entre estos dos parámetros. Estos hallazgos han sido descritos previamente13,24. Sin embargo, se deben realizar estudios más amplios para explicar la interacción entre la adiponectina y los andrógenos.
Los datos disponibles sobre la secreción de adiponectina por los adipocitos sugieren que la producción por el tejido adiposo es regulada por varios factores paracrinos y endocrinos. Las adipocinas están involucradas en la disminución de la actividad del adipocito y en el desarrollo de la resistencia a la insulina5. La comprensión de los mecanismos moleculares y celulares involucrados en la regulación de la secreción de adiponectina por los adipocitos de las mujeres con SOPQ es crítica para comprender la etiología de la resistencia a la insulina.
ConclusiónSe concluye que las concentraciones de adiponectina plasmática son más bajas en mujeres con SOPQ obesas y no obesas comparadas con controles sanos. La determinación de adiponectina puede ser útil en la determinación del riesgo cardiovascular en pacientes con diagnóstico de SOPQ.
Responsabilidades éticasProtección de personasLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de la Facultad de Medicina de la Universidad del Zulia y del Hospital Central «Dr. Urquinaona» sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AutoríaTodos los autores declaran que han realizado aportes a la idea, diseño del estudio, recolección de datos, análisis e interpretación de datos, revisión crítica del contenido intelectual y aprobación final del manuscrito.