En el servicio de oncohematología del Hospital Infantil Los Ángeles de Pasto (HILA) se diagnostican un promedio de 40 casos anuales de cáncer de novo en menores de 18 años. La neutropenia febril como evento esperable se presentó en la institución.
ObjetivoIdentificar las características clínicas y parámetros de laboratorio de los episodios de neutropenia febril en el servicio de oncohematología pediátrica del HILA de Pasto, Colombia, durante el año 2013.
MétodosSerie de casos clínicos. Se incluyeron todos los episodios de Neutropenia febril hospitalizados en el servicio de Oncohematología pediátrica del Hospital Infantil Los Ángeles de Pasto, Colombia en el 2013.
Resultados52 episodios de neutropenia febril, en 32 pacientes. La edad promedio fue de 7,2 años, hombres en su mayoría (62%), y la enfermedad de base más frecuente fue Leucemia Linfoide Aguda. La mitad de pacientes fueron diagnosticados intrahospitalariamente. El 5% presentó un conteo absoluto de neutrófilos menor a 100 células/mm3, y el rango de fiebre más frecuente fue de 38¿-38,9¿. Los focos infecciosos más comunes fueron respiratorios y gastrointestinales, y el régimen antibiótico más usado fue Piperacilina/Tazobactam + Amikacina. La complicación clínica más frecuente fue sepsis, y se presentó un caso de muerte.
ConclusionesLa neutropenia febril sigue siendo una causa frecuente de hospitalización en pacientes oncológicos. El presente estudio muestra similitudes con la literatura respecto a edad, sexo, diagnóstico de base, síntomas de ingreso y mortalidad. La neutropenia febril asociada al cáncer fue clasificada como Alto Riesgo en todos los pacientes (Consenso SLIPE).
Approximately 40 children under the age of 18 are diagnosed annually with cancer at the Hospital Infantil Los Angeles (HILA) in Pasto, Colombia. Neutropenic fever is a predictable occurrence in these children.
AimThis study attempts to identify their clinical and laboratory characteristics during 2013.
MethodsRetrospective analysis of all cases of neutropenic fever in paediatric oncology patients seen in the HILA in 2013.
ResultsA total of 52 episodes of neutropenic fever were identified in 32 individual patients, of whom two presented with four discrete episodes each. The mean age of the children was 7.2 years and the majority (62%) were male. The most common underlying malignancy was acute lymphoblastic leukaemia. Half of the patients were diagnosed while an in-patient. An absolute neutrophil count of less than 100 cells/mm3 was observed in 5% of cases. The temperatures most commonly ranged between 38 and 38.9 degrees Celsius. The respiratory and gastrointestinal tracts were the most frequently identified sources of infection, and the most commonly used antibiotic treatment regimen was the combination of piperacillin/ tazobactam and amikacin. Sepsis was the most common complication seen, resulting in the death of one child.
ConclusionsNeutropenic fever is a frequent cause of hospital admission in paediatric oncology patients, and this study confirms similar findings in other studies as regards patient age, sex, underlying diagnosis, symptoms upon admission, and mortality. Febrile neutropenia associated with cancer is classified as High Risk. (SLIPE Consensus).
La neutropenia febril (NF) es una complicación común y tratable de la terapia en los pacientes pediátricos con cáncer1,2. Se ha identificado a la Neutropenia como el factor más importante para el desarrollo de infecciones bacterianas invasivas (IBI) en este tipo de pacientes3. El manejo adecuado de esta asociación neutropenia y fiebre ayuda a controlar la morbilidad y mortalidad de pacientes con cáncer.
La presencia de un recuento absoluto de neutrófilos (RAN)<500 céls/mm3 o<1.000 céls/mm3 cuando se predice una caída a una cifra<500 céls/mm3 en las 24 ó 48 horas siguientes, y fiebre que para el caso se considera como un registro único de temperatura axilar ≥ 38,5°C o dos mediciones ≥ 38°C con una separación, entre ambas determinaciones, de al menos una hora, se considera NF.1,2,4.
Pacientes con leucemia linfoblástica aguda (LLA) y leucemia mieloide aguda (LMA), con protocolos quimioterapéuticos en promedio de 2 años, presentan aproximadamente 6 episodios de NF en este periodo de tiempo1,5, siendo la NF la primera causa de consulta posterior a quimioterapia6. La mortalidad asociada a NF se ha calculado en diferentes estudios entre el 2-3%1, por lo que se considera una urgencia oncológica1,2,6.
Presentamos a continuación las variables sociodemográficas y clínicas de una población de niños con diagnóstico de Neutropenia febril en el servicio de Oncohematología pediátrica del Hospital Infantil los Ángeles de Pasto, Colombia.
Materiales y métodosEstudio descriptivo tipo serie de casos clínicos, donde se incluyó a todos los pacientes con diagnóstico de Neutropenia febril que ingresaron o estuvieron hospitalizados en el servicio de Oncohematología pediátrica del Hospital Infantil los Ángeles, Pasto, Nariño, Colombia en el periodo del 1 de enero de 2013 al 31 de diciembre de 2013.
El objetivo general fue identificar las características clínicas y parámetros de laboratorio de los pacientes mencionados. Dentro de los objetivos específicos se incluyó clasificar los pacientes en alto o bajo riesgo para IBI, según los criterios del consenso sobre Diagnóstico y tratamiento de la neutropenia febril en niños con cáncer de la Sociedad Latinoamericana de Infectología Pediátrica (SLIPE) del año 20111.
Como criterios de inclusión se tomaron: (i) menores de 18 años (ii) temperatura mayor a 38.5 grados centígrados en una ocasión ó dos tomas de 38-38.4 grados en un lapso de 12 horas y (iii) conteo absoluto de neutrófilos menor a 1.000 elementos/mcL. (iv) diagnóstico de cáncer como enfermedad de base. No se consideraron criterios de exclusión. El estudio fue avalado por el Comité de ética de Investigación en Salud, del Hospital Infantil Los Ángeles de Pasto.
Análisis estadísticoLos datos recolectados acerca de las variables a estudio se organizaron en una base de datos en el programa Microsoft Excel 2010, ordenándolos a través de tablas de frecuencia. Las variables cuantitativas se analizaron con media o mediana. Las variables cualitativas se analizaron por medio de frecuencia absoluta y frecuencia relativa, representada por porcentajes. Se utilizó además el programa SPSS versión 22 para el análisis bivariado. Todos los intervalos de confianza (IC) se calcularon con el 95%. Se considera una p significativa menor a 0.05.
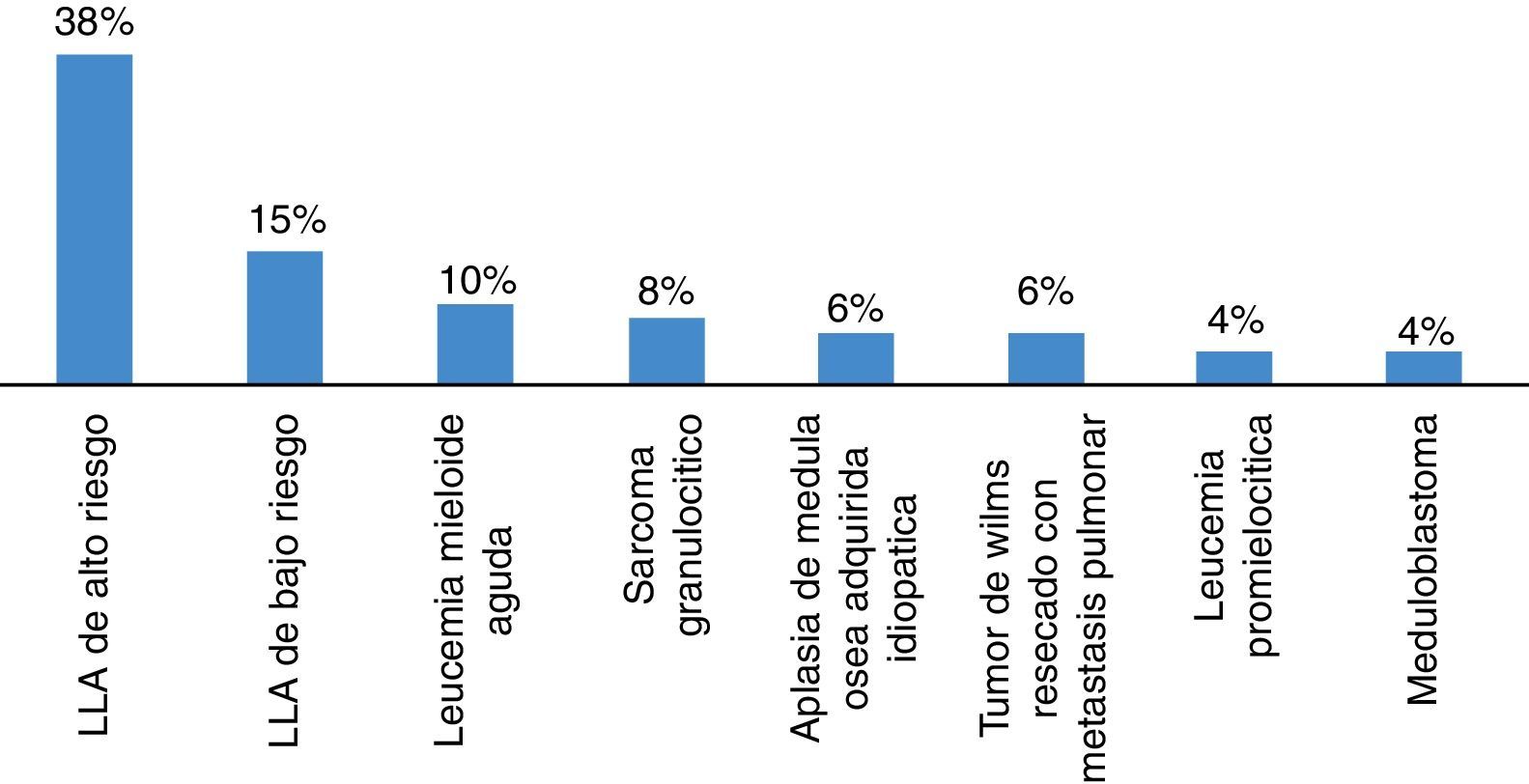
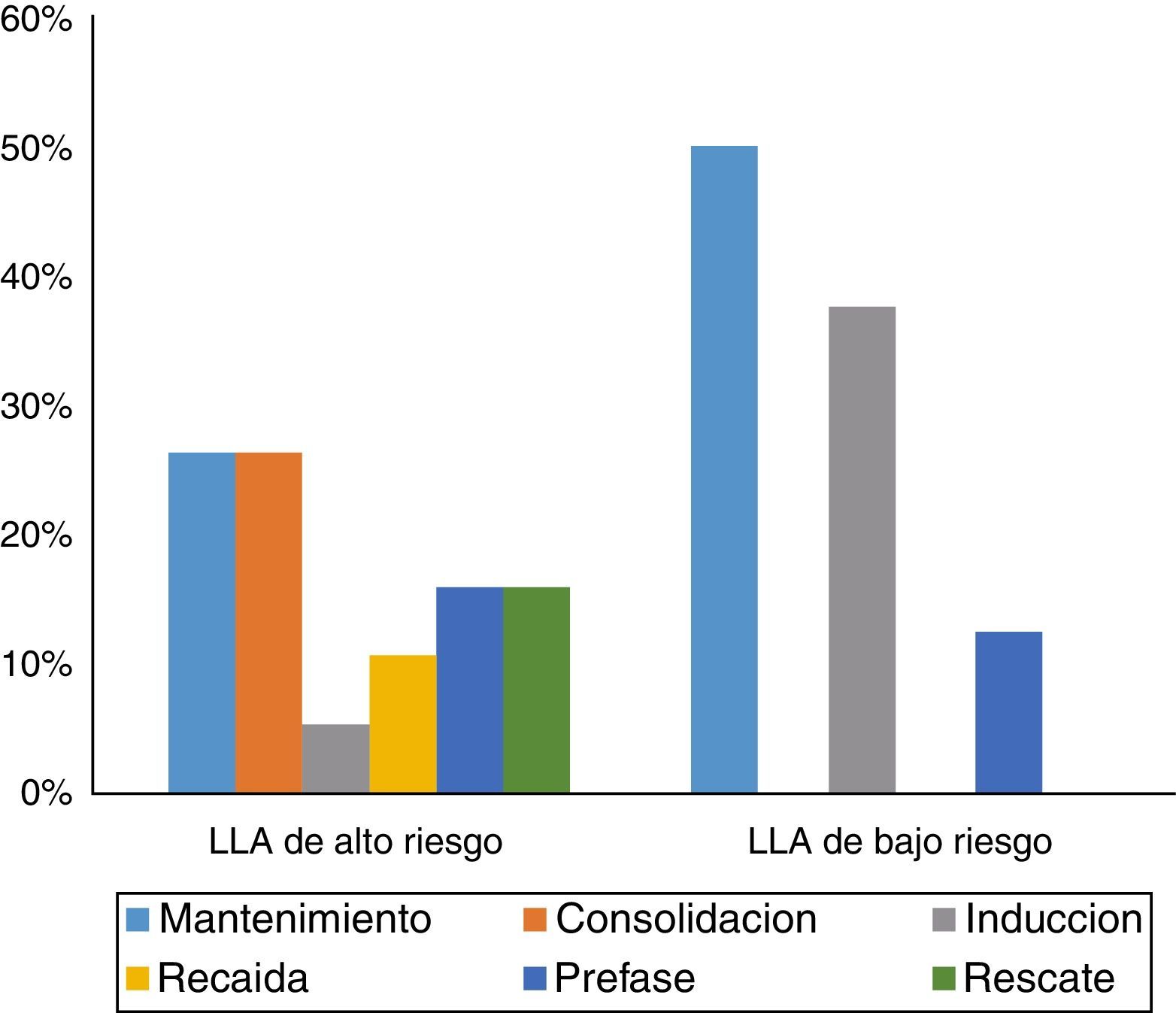
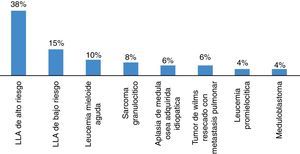
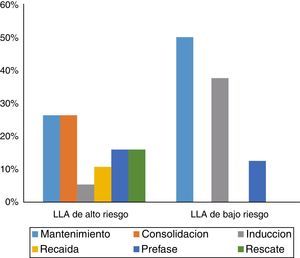
ResultadosDurante el año del 2013, se presentaron 52 episodios de neutropenia febril en un total de 32 pacientes. El 62% fueron hombres, la edad promedio fue de 7,18 años en toda la población. En LLA la edad promedio fue de 5,97 años y de 7,8 años en pacientes con LMA. Los diagnósticos más comunes se describen en la figura 1 y las etapas de tratamiento se mencionan en la figura 2. Se encontró que los quimioterapéuticos más usados de forma individual fueron: metotrexate (11%), vincristina (9%), citarabina (7%) y L-asparaginasa (4%). Mientras que las combinaciones más usadas fueron: citarabina/metotrexate (9%), ifosfamida/carboplatino/etoposido (9%), citarabina/mitoxantrona (7%), citarabina/idarrubicina (7%).
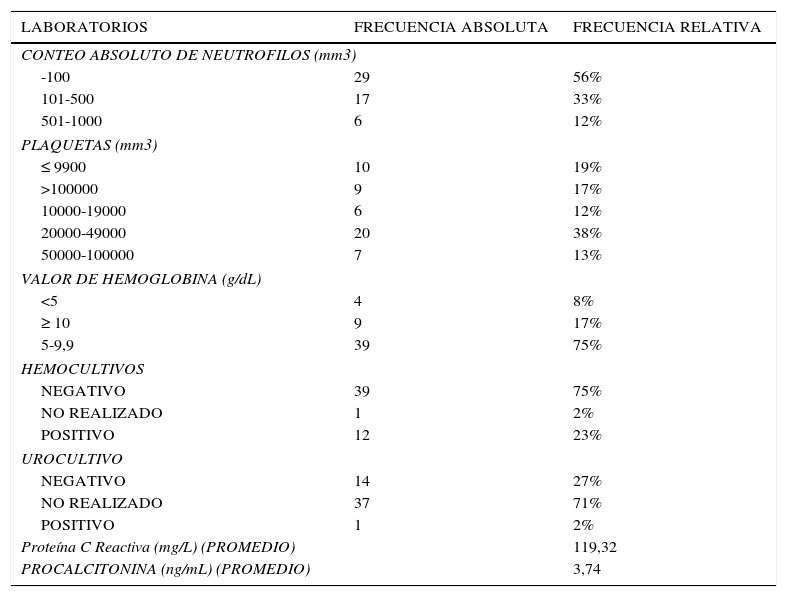
La fiebre en el momento de diagnóstico se clasificó en rangos de fiebre; el 81% presentaron temperaturas entre 38 a 38,9 grados centígrados, y el 19% tuvieron temperatura entre 39 a 39,9 grados centígrados. Ninguno de los pacientes presentó fiebre de 40 o más. El 50% de los episodios de fiebre fueron diagnosticados intrahospitalariamente, el 10% consultaron en un rango de 1 a 6 horas, 8% de 7 a 12 horas, el 6% de 13 a 18 horas, el 13% de 18 a 24 horas y el 13% consultó después de las 24 horas de presentar fiebre. Los síntomas asociados durante la consulta inicial fueron: síntomas respiratorios 36%, el 15% presentó síntomas gastrointestinales, el 12% síntomas relacionados con tejidos blandos, el 6% presentó mucositis, y el 31% de los pacientes no presentó ningún síntoma asociado. En la tabla 1 se resumen los hallazgos de laboratorio encontrados en los pacientes con NF. En los hemocultivos los microorganismos más frecuentes fueron: Streptococo Intermedius con 3 casos; Staphylococcus Aureus y Staphylococcus Coagulasa Negativo, cada uno aislado en 2 casos; mientras el Enterobacter Cloacae Blee+, Klebsiella Pneumoniae Blee Carbapenemasa Kpc, Pseudomona Aeruginosa, Streptococos Pyogenes Y Acinetobacter Iwoffi fueron positivos en 1 caso cada uno. En cuanto al único urocultivo positivo fue a causa de Staphylococcus Coagulasa Negativo
Características de laboratorio de pacientes con NF
| LABORATORIOS | FRECUENCIA ABSOLUTA | FRECUENCIA RELATIVA |
|---|---|---|
| CONTEO ABSOLUTO DE NEUTROFILOS (mm3) | ||
| -100 | 29 | 56% |
| 101-500 | 17 | 33% |
| 501-1000 | 6 | 12% |
| PLAQUETAS (mm3) | ||
| ≤ 9900 | 10 | 19% |
| >100000 | 9 | 17% |
| 10000-19000 | 6 | 12% |
| 20000-49000 | 20 | 38% |
| 50000-100000 | 7 | 13% |
| VALOR DE HEMOGLOBINA (g/dL) | ||
| <5 | 4 | 8% |
| ≥ 10 | 9 | 17% |
| 5-9,9 | 39 | 75% |
| HEMOCULTIVOS | ||
| NEGATIVO | 39 | 75% |
| NO REALIZADO | 1 | 2% |
| POSITIVO | 12 | 23% |
| UROCULTIVO | ||
| NEGATIVO | 14 | 27% |
| NO REALIZADO | 37 | 71% |
| POSITIVO | 1 | 2% |
| Proteína C Reactiva (mg/L) (PROMEDIO) | 119,32 | |
| PROCALCITONINA (ng/mL) (PROMEDIO) | 3,74 | |
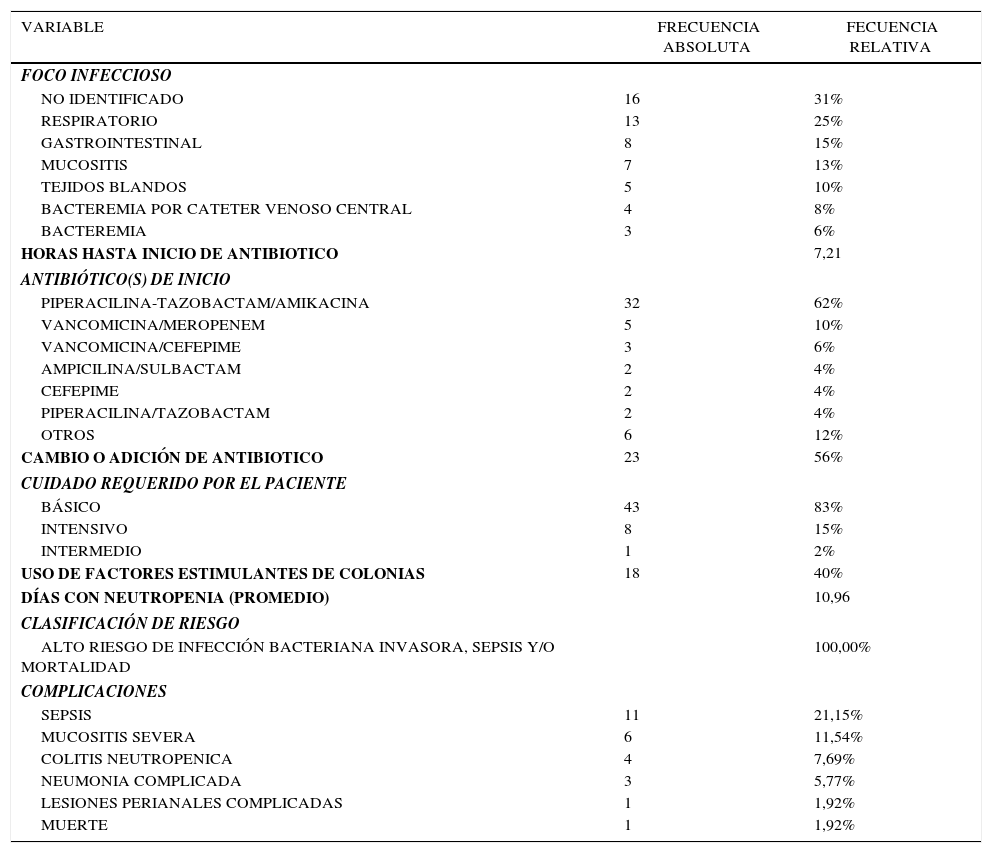
Los antibióticos utilizados como inicio de tratamiento se describen en la tabla 2, el ítem de “otros” hace referencia a esquemas antibiótico solo utilizados en 1 caso y son: cefepime/clindamicina, Ceftriaxona, Meropenem, Meropenem+Caspofungina, Meropenem+Linezolid. En un caso se usó Aciclovir sin manejo antibiótico. En el 56% de los casos se requirió un cambio o adición de manejo antibiótico, y este cambio se debió a persistencia de fiebre, o identificación de germen con patrón especifico de sensibilidad. Los focos infecciosos encontrados en el paciente después del análisis médico que se encuentran enumerados en la tabla 2, fueron similares, pero no iguales a los síntomas reportados al ingreso.
Tratamiento y seguimiento de pacientes con NF
| VARIABLE | FRECUENCIA ABSOLUTA | FECUENCIA RELATIVA |
|---|---|---|
| FOCO INFECCIOSO | ||
| NO IDENTIFICADO | 16 | 31% |
| RESPIRATORIO | 13 | 25% |
| GASTROINTESTINAL | 8 | 15% |
| MUCOSITIS | 7 | 13% |
| TEJIDOS BLANDOS | 5 | 10% |
| BACTEREMIA POR CATETER VENOSO CENTRAL | 4 | 8% |
| BACTEREMIA | 3 | 6% |
| HORAS HASTA INICIO DE ANTIBIOTICO | 7,21 | |
| ANTIBIÓTICO(S) DE INICIO | ||
| PIPERACILINA-TAZOBACTAM/AMIKACINA | 32 | 62% |
| VANCOMICINA/MEROPENEM | 5 | 10% |
| VANCOMICINA/CEFEPIME | 3 | 6% |
| AMPICILINA/SULBACTAM | 2 | 4% |
| CEFEPIME | 2 | 4% |
| PIPERACILINA/TAZOBACTAM | 2 | 4% |
| OTROS | 6 | 12% |
| CAMBIO O ADICIÓN DE ANTIBIOTICO | 23 | 56% |
| CUIDADO REQUERIDO POR EL PACIENTE | ||
| BÁSICO | 43 | 83% |
| INTENSIVO | 8 | 15% |
| INTERMEDIO | 1 | 2% |
| USO DE FACTORES ESTIMULANTES DE COLONIAS | 18 | 40% |
| DÍAS CON NEUTROPENIA (PROMEDIO) | 10,96 | |
| CLASIFICACIÓN DE RIESGO | ||
| ALTO RIESGO DE INFECCIÓN BACTERIANA INVASORA, SEPSIS Y/O MORTALIDAD | 100,00% | |
| COMPLICACIONES | ||
| SEPSIS | 11 | 21,15% |
| MUCOSITIS SEVERA | 6 | 11,54% |
| COLITIS NEUTROPENICA | 4 | 7,69% |
| NEUMONIA COMPLICADA | 3 | 5,77% |
| LESIONES PERIANALES COMPLICADAS | 1 | 1,92% |
| MUERTE | 1 | 1,92% |
Las características sociodemográficas pueden variar en cada población, en este estudio se encontró que la distribución por género fue mayor en hombres con un 62% de la población, que es similar con respecto a la literatura publicada, como lo muestran datos de publicados en el 2014 en un estudio prospectivo, multicéntrico, realizado en Chile entre abril de 2004 y junio de 2011 donde se encontró predominio del género masculino en los grupos evaluados: LMA 63%, LLA 53%7. Sin embargo en otros estudios se considera que no hay una diferencia significativa en género como los muestra el estudio en ciudad de México donde se encontró una distribución por sexo similar: 51% de los casos para niñas y 49% para niños8, datos similares muestran una revisión retrospectiva de las historias clínicas Australiana, donde observaron distribución uniforme entre mujeres y hombres9.
El promedio de edad encontrado fue de 7,18 años, con un promedio de 5,97 años en LLA y de 7,82 años en pacientes con LMA. Menor con respecto a lo reportado en México, donde la mayoría de casos se presenta en menores de 10 años7, Estadísticas Chilenas muestran edades más cercanas a las nuestras8 Con respecto a la enfermedad oncológica de base se encontró que la Leucemia Linfoide Aguda es las más prevalente en esta complicación infecciosa, encontrando en nuestra serie un 53%, seguido por leucemia mieloide aguda, linfomas y tumores sólidos, igual a lo reportado en la literatura8,10,11
Los estudios muestran que los síntomas más comunes en los pacientes con neutropenia febril en el momento de su diagnóstico son los que se asocian al tracto respiratorio superior e inferior, al tracto gastrointestinal y la piel así como también se reportan gran cantidad de pacientes sin síntomas focales claros, siendo la fiebre el único síntoma de infección12,13, como lo reportado en nuestra serie con un 36% de pacientes con síntomas respiratorios, 15% de síntomas gastrointestinales y el 31% sin ningún síntoma asociado. Se han descrito quimioterapéuticos específicos como factores de riesgo para desarrollo de neutropenia febril y sus complicaciones, como: citarabina relacionada con mucositis severa12. Se ha encontrado mayor mieolotoxicidad con quimioterapia para enfermedades malignas hematológicas que para la usada en tumores sólidos, estos últimos producen neutropenia por tiempos más cortos que los primeros, aproximadamente el 10-50% de los pacientes con tumores sólidos a diferencia del 80% de los pacientes con malignidades hematológicas presentan fiebre durante al menos un ciclo de quimioterapia asociada a neutropenia13; lo anterior en correspondencia con lo reportado en nuestro estudio encontrándose más frecuentemente neutropenia febril en pacientes con LLA y LMA que en sarcoma granulocitico o tumor de Wilms. Dentro de los patógenos más comúnmente aislados en hemocultivos según reportes realizados desde 1980 en adelante son los gram positivos con porcentajes de hasta 62% al 76% comparado con 14% al 22% de los aislamientos de gram negativos12, en contraste con lo que ocurría previo a estas fechas donde los aislamientos de microrganismos gram negativos eran más comunes14, lo cual coincide con nuestros resultados encontrando aislamientos en mayor cantidad de Streptococo Intermedius, Staphylococcus Aureus y Staphylococcus Coagulasa Negativo.
El tiempo en la administración de antibiótico se ha considerado como un factor importante en la predicción de morbilidad y mortalidad en los niños con NF. Dado el alto riesgo de bacteriemia y sepsis en niños con NF, la mayoría de centros y estudios consideran adecuada la aplicación de la primera dosis de antibiótico en un lapso no mayor a 60 minutos15. En el reporte obtenido en el hospital se presentó una media de 7,2 horas. Sin embargo, en nuestro estudio al realizar un análisis bivariado entre horas de aplicación de antibiótico (que se midió desde el diagnóstico de neutropenia febril, hasta la aplicación de la primera dosis de antibiótico) y número total de días con neutropenia; al aplicar las pruebas de asociación (Rho Spearman) no se encontró una asociación estadísticamente significativa, con un coeficiente de correlación=0.194 e Intervalos de confianza del 95%: (-0.058, 0.452), y p=0.169, lo que significa que no hubo relación entre el número horas aplicación de antibiótico y el número de días con neutropenia.
Se utilizó el factor estimulante de Granulocitos en un 40%, superior al reportado en algunas publicaciones donde solo el 14% lo recibieron16. Se analizó con Prueba Exacta de Fisher la relación entre aplicación de factor estimulante de Granulocitos e ingreso a Cuidado Intensivo, sin encontrar relación estadísticamente significativa encontrando un OR=7.636, con Intervalo de confianza 95%: (0.865- 345,635) con Valor p=0.618. Esto significa que el la aplicación del factor estimulante de granulocitos, no es un factor de riesgo ni protector con respecto al ingreso del paciente a cuidado intensivo.
Las guías Latinoamericanas recomiendan un cubrimiento antibiótico inicial de monoterapia con betalactamicos antipseudomona o carbapenemicos, y reservar adición de un segundo agente contra gram negativos solo para pacientes clínicamente inestables, cuando se sospeche una infección resistente, o centro con alta taza de patógenos resistentes1,17. En nuestro caso el 62% de los episodios iniciaron con cubrimiento con piperacilina- tazobactam y amikacina, según lo indicado por las guías. Así mismo se recomienda un cambio de antibiótico a mayor espectro cuando persista fiebre1,17, no haya mejoría de síntomas o exista inestabilidad clínica; en nuestro caso, en el 56% de los casos se tuvo que cambiar antibioticoterapia, correlacionándose este dato con una frecuencia de complicaciones del 50% de los episodios. Con respecto a la vía del paciente, solo el 2% requirió manejo en cuidado intensivo con reportes en la literatura de menos del 5%18. Encontramos solo 1 episodios de muerte correspondientes al 1.9% de los pacientes, a este respecto la literatura habla de una frecuencia menor al 5%1,11 e incluso se ha calculado en el 1% en algunos estudios18.
Estudio Chilenos prospectivos multicentricos asocian factores que están asociados independientemente a Infección Bacteriana Invasora19: concentración de PCR sérica>90mg/L, hipotensión arterial, leucemia en recaída, recuento de plaquetas <50.000 céls/mm3 e intervalo entre el término del último ciclo de QT y el inicio de la fiebre<7 día. En análisis bivariado realizado se encontró una relación estadísticamente significativa entre Proteína C Reactiva (PCR) mayor a 90mg/L con Procalcitonina positiva, se utilizó Chi Cuadrado, obteniendo un OR=5.067 con Intervalo de confianza 95%: (1.470- 17.460) con Valor p=0.007; encontrándose en concordancia con lo mencionado en el estudio Chileno. Estos hallazgos sugieren que obtener una PCR>90mg/L o una procalcitonina positiva, son sugestivos de infección bacteriana invasiva, concluyendo que la PCR >90mg/L es también un excelente marcador de esta condición.
En cuanto a la estratificación de alto riesgo de los pacientes, se tomaron como variables de alto riesgo: edad>12 años; tipo de cáncer: leucemia, enfermedad de base en inducción, recaída o segundo tumor; intervalo entre el término del último ciclo de quimioterapia y el inicio de la fiebre<7 días; predicción de duración de la neutropenia>7 días; fiebre>39°C; signos de sepsis, compromiso respiratorio y/o intestinal; comorbilidad asociada; Recuento absoluto de Neutrófilos <100 céls/mm3; Recuento Absoluto de Monocitos<100 céls/mm3; recuento de plaquetas<50.000 céls/mm3; PCR sérica>90mg/L; IL 8>300pg/mL; presencia de bacteriemia, según lo sugerido por el Consenso de la Sociedad Latinoamericana de Infectología Pediátrica1. Según estas variables todos los niños cumplían por lo menos un criterio para ser categorizados como alto riesgo como lo muestra la tabla 1. Este es un hallazgo importante, dado que el protocolo del Hospital, tomando en cuenta el limitado acceso de salud de la mayoría de sus pacientes clasifica a todo paciente que ingrese con este diagnóstico, paciente de alto riesgo, los hallazgos de este estudio muestran que clínicamente estos paciente también se clasifican en alto riesgo, por lo que la conducta de hospitalización e inicio de protocolo de alto riesgo, ha sido adecuada.
El actual estudio se ve limitado por su diseño descriptivo, su carácter retrospectivo en la recolección de los datos, que fueron tomados de las historias clínicas, no se calculó un tamaño de muestra, sino que se tomó el total de pacientes diagnosticados en el trascurso de un año, lo que no permite calcular la representatividad dela muestra.
ConclusionesLa neutropenia febril sigue siendo una causa frecuente de hospitalización en pacientes con patología oncológica. Nuestro estudio muestra similitudes con la literatura con respecto a las características de edad, sexo, diagnóstico de base, síntomas de ingreso y mortalidad. Todos los pacientes según lo evaluado en este estudio cumplen con criterios de alto riesgo propuestos por la Sociedad Latinoamericana de Infectología Pediátrica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Artículo financiado por los autores.