El asma es una enfermedad que, debido a su creciente prevalencia y a sus amplias repercusiones, sigue siendo objeto de estudio con el fin de poder comprender mejor sus mecanismos subyacentes y así mejorar tanto su manejo, como la calidad de vida de las personas que la padecen.
En el contexto del desarrollo de un documento de recomendaciones basado en opinión de expertos siguiendo la metodología RAND/UCLA, a través de una encuesta Delphi sobre infección y asma, esta revisión no sistemática de la bibliografía profundiza en las complejas interacciones entre microorganismos y asma, proporcionando una visión integral, en modo de preguntas y respuestas, sobre seis grandes aspectos que relacionan infección y asma: 1) el posible origen infeccioso del asma, con referencia a la microbiota respiratoria y a la influencia de determinados virus respiratorios, 2) el papel que algunas inmunodeficiencias pueden tener en el desarrollo de hiperrespuesta bronquial e infecciones bronquiales, 3) la asociación bidireccional entre bronquiectasias y asma y su identificación como fenotipo distinguible, 4) la importancia del fenotipo hipersecretor y de las exacerbaciones infecciosas en el control del asma y en la valoración de la respuesta a los tratamientos biológicos, 5) la utilidad de las estrategias de prevención y tratamiento de las infecciones para controlar el asma y 6) la curiosa asociación entre infección y enfermedad tuberculosas y el desarrollo de atopia y asma.
Asthma is a disease that, due to its increasing prevalence and wide-ranging impact, continues to be studied in order to better understand its underlying mechanisms and thus improve both its management and the quality of life of those who suffer from it.
In the context of developing a document of recommendations based on expert opinion following the RAND/UCLA methodology through a Delphi survey on infection and asthma, this non-systematic review of the literature delves into the complex interactions between microorganisms and asthma, providing a comprehensive view, in question and answer mode, on six major aspects relating infection and asthma: 1) the possible infectious origin of asthma, with reference to the respiratory microbiota and the influence of certain respiratory viruses, 2) the role that certain immunodeficiencies may play in the development of bronchial hyperresponsiveness and bronchial infections, 3) the bidirectional association between bronchiectasis and asthma and its identification as a distinguishable phenotype, 4) the importance of the hypersecretory phenotype and infectious exacerbations in the control of asthma and in the assessment of the response to biological treatments, 5) the usefulness of infection prevention and treatment strategies to control asthma, and 6) the curious association between tuberculous infection and disease and the development of atopy and asthma.
El asma es una enfermedad que, debido a su creciente prevalencia y a sus amplias repercusiones, sigue siendo objeto de estudio con el fin de poder comprender mejor sus mecanismos subyacentes y así mejorar, tanto su manejo, como la calidad de vida (QoL) de las personas que la padecen1.
MetodologíaPara profundizar en la compleja interacción entre microorganismos y asma se realizó una revisión exhaustiva y sistemática de la literatura para intentar dar respuesta a 32 preguntas sobre ocho cuestiones relacionadas con el binomio infección-asma (tabla suplementaria 1). En relación con estas preguntas y siguiendo la metodología RAND/UCLA, se planteó una encuesta Delphi con la que un total de 30 expertos especialistas en neumología, alergología y farmacia hospitalaria mostraron su grado de acuerdo en el marco de una jornada sobre infección y asma en Zaragoza, organizada por la Unidad Multidisciplinar de Asma del Hospital Royo Villanova. Los resultados de la mencionada encuesta Delphi se detallan en la tabla suplementaria 2.
Las consultas bibliográficas que constituyeron la base de este proceso y, finalmente, de lo descrito aquí, se limitaron a la base de datos de PubMed/Medline y se seleccionaron, de forma no sistemática, artículos, estudios y ensayos clínicos, estudios observacionales, revisiones narrativas y revisiones sistemáticas, todos ellos publicados, en inglés o en castellano, en los últimos 10 años antes de la publicación de la presente revisión, aunque también se realizaron algunas excepciones basadas en la opinión de los expertos, en cuyo caso se seleccionaron algunos trabajos más antiguos.
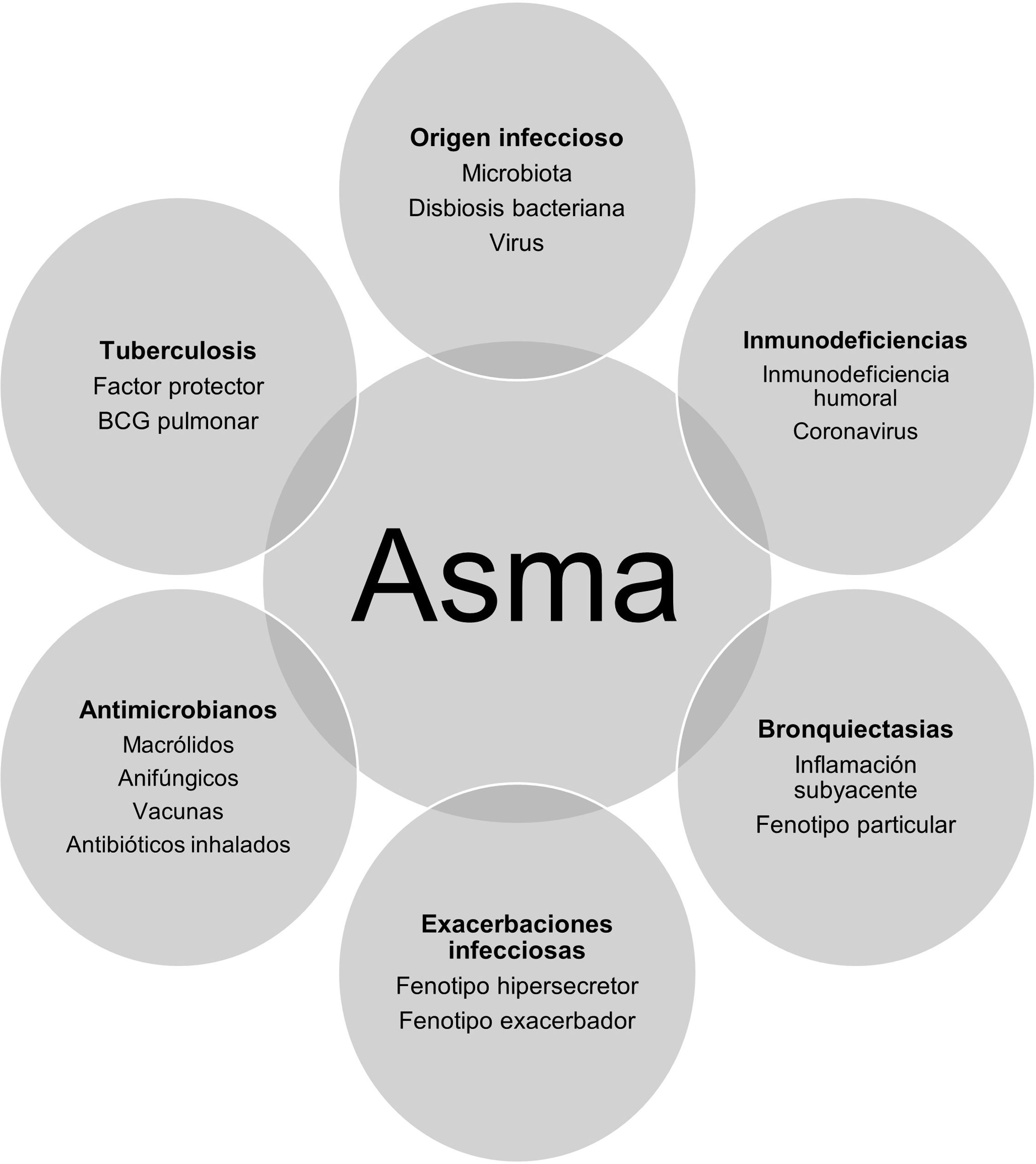
El presente documento pretende aportar una visión integral del problema en forma de preguntas y respuestas sobre el origen infeccioso del asma, la relación ente inmunodeficiencias y asma, aquella entre esta condición y las bronquiectasias (BQ), las exacerbaciones en asma y las infecciones, el uso de antimicrobianos en la prevención y tratamiento del asma y la posible relación entre tuberculosis y asma (fig. 1),
Origen infeccioso del asma¿Tiene el asma un origen infeccioso?Aunque el asma no se considera una enfermedad infecciosa en sí misma, diversas teorías y evidencias sugieren que las infecciones pueden desempeñar un papel en su desarrollo. Por ejemplo, las alteraciones de los patrones naturales de sucesión microbiana durante la colonización intestinal son una característica constante de las enfermedades inmunomediadas, incluidas la atopia y el asma2. Son varios los factores que influyen en esas primeras bacterias de nuestro intestino: la inmunidad materna, el uso de antibióticos (ATB), la dieta de la madre, la lactancia, la vía de parto y la alimentación en la infancia van a repercutir en la maduración del sistema inmunológico3,4. Así pues, el microbioma del entorno va a ser muy importante para la colonización pulmonar, sobre todo desde el nacimiento hasta los primeros meses de vida5. Además, el contacto con endotoxinas bacterianas desde la infancia parece tener un papel protector sobre la incidencia de asma6, mientras que la colonización de la vía aérea superior por Moraxella y Neumococo, aumenta la prevalencia de asma7.
¿Son las alarminas del epitelio bronquial el nexo entre bronquiolitis por virus respiratorio sincitial y desarrollo de asma?Las alarminas están implicadas en la maduración del sistema inmune desde el nacimiento8. La infección temprana del virus respiratorio sincitial (VRS) estimula la liberación de alarminas en el epitelio bronquial y podría contribuir a una respuesta inmunológica anómala en algunos individuos, lo que podría aumentar su susceptibilidad al desarrollo de asma en el futuro9.
¿El asma de inicio tras proceso infeccioso presenta un fenotipo distinguible?En algunos individuos, el asma de origen infeccioso puede estar asociado con un fenotipo atópico, tener un mayor riesgo de exacerbaciones desencadenadas por infecciones respiratorias o tener una respuesta diferente a los corticosteroides10. Son factores importantes la edad de inicio del asma y cuándo se produce dicha infección11.
Inmunodeficiencias y asma¿Las inmunodeficiencias pueden producir asma?Algunas inmunodeficiencias humorales, como la inmunodeficiencia común variable (CVID) o deficiencia de inmunoglobulina A (IgA), se han asociado con enfermedades alérgicas, entre ellas asma o rinitis. La prevalencia de asma en la CVID oscila, en diferentes estudios, entre el 2.8% y el 18%, planteándose la posibilidad de si la CVID es un simulador de asma12,13, aunque no hay muchos estudios en los que se hayan realizado pruebas diagnósticas de forma sistemática14–18. Sin embargo, la atopia tiene un papel controvertido, ya que los estudios muestran niveles de inmunoglobulina E (IgE) bajos en estos pacientes15 y quizás la relación CVID-patología alérgica podría justificarse por una respuesta inadecuada a alérgenos.
¿Es la infección bronquial secundaria a inmunodeficiencias la que puede inducir asma?El asma se ha considerado un estado de inmunodeficiencia porque se han identificado alteraciones de la barrera epitelial que alterarían la respuesta a las infecciones19. En un estudio de pacientes con CVID parece que el diagnóstico del asma es independiente del desarrollo de infecciones, y según los autores la inmunodeficiencia podría favorecer reacciones a alérgenos a nivel de la mucosa, así como inflamación e hiperreactividad13.
¿Podemos considerar que la hiperrespuesta bronquial inducida por determinadas inmunodeficiencias es un fenotipo de asma?Distintos estudios muestran que el asma en pacientes con inmunodeficiencia se caracteriza por marcadores T2 bajos, no atópicos y no eosinofílicos, tanto en niños como en adultos14,15,20,21.
En un estudio realizado en EE. UU. se identificaron grupos de pacientes con marcadores inmunofenotípicos específicos, y uno de los grupos identificados es el de pacientes con asma o alguna enfermedad alérgica, lo que apoyaría que son pacientes con un endotipo característico22.
En un estudio prospectivo en asmáticos graves con deficiencia de inmunoglobulinas (Ig), se inició tratamiento con azitromicina (AZT) en 39 pacientes con marcadores T2 bajos, al que respondieron 14 pacientes, iniciando en los 25 no respondedores tratamiento con Ig subcutáneas, con buena respuesta en ambos grupos respecto a mejoría de control del asma y reducción de exacerbaciones23. Un estudio retrospectivo coreano, que analizó la respuesta al tratamiento con Ig también en pacientes con asma y deficiencia de Ig, mostró una disminución del riesgo de exacerbaciones asmáticas24.
Asma y bronquiectasias¿La presencia de BQ puede favorecer el desarrollo de asma?La prevalencia de BQ en el asma oscila entre el 0,8% y el 77%25–28, siendo la media del 35,2%, según un metaanálisis reciente29.
Las BQ son la consecuencia de un complejo proceso de inflamación, infección, lesión del sistema mucociliar y reparación de la vía aérea, denominado círculo vicioso de Cole30. En la actualidad se observa un claro aumento de la incidencia de las BQ, quizás por la creciente longevidad de la población, la mayor cronicidad de las patologías que las generan, la mayor sensibilización de los profesionales ante esta entidad y, sobre todo, al mayor uso de la tomografía computarizada de alta resolución para confirmar su diagnóstico31. Para el diagnóstico de las BQ clínicamente significativas se ha consensuado que se necesitan tanto criterios clínicos como radiológicos32.
No existe ningún estudio publicado que haya demostrado una relación de causalidad entre el asma y las BQ. En la literatura se habla de enfermedades relacionadas33.
¿El desarrollo de BQ en asma se debe a procesos infecciosos bronquiales de repetición?La infección bronquial crónica, con mayor frecuencia por Haemophilus influenzae y Pseudomonas aeruginosa, estimula y mantiene la inflamación pulmonar y se asocia con una mayor frecuencia de agudizaciones, peor QoL y mayor mortalidad34,35.
El aclaramiento mucociliar se altera en las BQ debido a la deshidratación de las vías respiratorias y el exceso de volumen y viscosidad del moco, lo que puede producir estasis de moco, obstrucción del flujo aéreo y daño pulmonar progresivo. La falta de resolución del binomio infección-inflamación produce una situación de cronicidad con destrucción-reparación de la pared bronquial y posteriores lesiones irreversibles36.
Sin embargo, mientras que la presencia de inflamación (y sus consecuencias) parece que es indispensable para la génesis de las BQ, no lo es la infección bronquial. Así, en las primeras fases de la fibrosis quística (FQ) o en pacientes con artritis reumatoide, en los que no se ha conseguido demostrar una infección bronquial, ya pueden observarse BQ37.
El asma y las BQ pueden presentar patrones inflamatorios distintos (eosinofílicos y neutrofílicos) y características diferentes dependiendo de la inflamación subyacente26. Además, la rinosinusitis crónica, los déficits inmunitarios y el reflujo gastroesofágico podrían ser también factores que condicionaran la presencia de asma y BQ38.
Los datos del registro español de BQ indican que la primera causa son las infecciones (ya sean o no tuberculosas), mientras que las relacionadas con el asma representan solo un 5%, si bien en registros posteriores este porcentaje está aumentando39.
¿Cómo es la inflamación en las BQ en los estudios publicados?La mayoría de los estudios revisados no encuentran diferencias en la eosinofilia entre los pacientes con asma y los que tienen asma y BQ. Aquellos estudios que sí encuentran diferencias tienen cifras muy elevadas de poliposis nasal (PN), por lo que la PN podría representar un sesgo en estos estudios hacia la eosinofilia40.
La presencia de inflamación (ya sea eosinofílica o neutrofílica) parece ser fundamental en la génesis de las BQ en pacientes con asma, observándose ya en niños de ocho años con asma grave (AG), mientras que no se observan en los controles o con un patrón paucigranulocítico41. En esta línea, la neutrofilia en esputo se correlaciona con la gravedad de las BQ en los pacientes con asma42. Varios estudios muestran que los niveles de fracción exhalada de óxido nítrico (FENO) son más elevados en pacientes con asma que en pacientes con asma y BQ y en estos mayor que en los que solo tienen BQ. Además, se ha demostrado que valores más bajos de FENO pueden predecir la presencia de BQ en pacientes con asma40,43. Además, no existen diferencias significativas en el porcentaje de BQ entre el fenotipo de inicio temprano y el tardío, aunque existe un predominio numérico a favor del fenotipo de inicio tardío44,45. Otros trabajos muestran que la inflamación de pacientes con asma refractaria y BQ o bronquiolitis es muy heterogénea, con predominio de no T2 y relacionada con más infecciones, mayor uso de ATB y presencia de microorganismos patógenos46.
Exacerbaciones en asma e infección¿Tiene el fenotipo hipersecretor un origen infeccioso?Las infecciones respiratorias recurrentes graves en la infancia pueden predisponer al desarrollo de asma47. El VRS y otros virus pueden provocar sensibilización alergénica, hiperreactividad, aumento de IL-13, hipereosinofilia e hipersecreción mucosa bronquial48.
En el asma, la hipersecreción de moco en las vías respiratorias tiene características fisiopatológicas comunes con otras enfermedades, como la enfermedad pulmonar obstructiva crónica (EPOC) y la FQ49. Sin embargo, hay otras características que parecen estar específicamente asociadas con el asma como la eosinofilia, una mayor exudación plasmática o los tapones mucosos que se adhieren fácilmente al epitelio y son difíciles de expectorar49, la infección previa por Chlamydophila pneumoniae50, una alta proporción de eosinófilos en el lavado broncoalveolar51 o periférica52, expresión predominante de mucina MUC5AC y un aumento de expresión del gen MUC253.
La participación fundamental de la IL-9 y la IL-13 en la inducción de hiperplasia de células caliciformes está, también, bien documentada54–56. Otras células inflamatorias como mastocitos y neutrófilos se infiltran en las glándulas submucosas de las vías respiratorias de pacientes asmáticos57 y la degranulación de los mastocitos se asocia con aumento del moco58.
¿Existe un fenotipo exacerbador distinguible?Los factores de riesgo de exacerbaciones pueden variar según el fenotipo del asma y la edad del paciente. En niños, la sensibilización alérgica es un importante factor de riesgo, como la inflamación eosinofílica tipo 2, la inflamación neutrofílica, el grado de obstrucción bronquial, factores genéticos como los genes P2RX7, IL-33 e IL1RL1, y varias comorbilidades59.
Algunos estudios de cohortes60 han identificado que los pacientes propensos a exacerbaciones se caracterizan por ser mayores en edad, un IMC más alto y presentar más síntomas a pesar de usar más medicación; además, identificaron variables clave asociadas con las exacerbaciones frecuentes, como son la sinusitis, la enfermedad por reflujo gastroesofágico, la reversibilidad de las vías respiratorias, la IgE y eosinófilos en sangre. El uso del término «fenotipo exacerbador» por Denlinger y cols.60, puede necesitar algo de perspectiva, dado que los autores demostraron asociaciones de varios factores clínicos y comorbilidades con una característica única, la frecuencia de exacerbaciones. En otros análisis, sin embargo, no identificaron ningún «fenotipo exacerbador»61, sino más bien grupos en los que las exacerbaciones eran más frecuente62.
¿Son las exacerbaciones infecciosas el principal factor que influye en el control del asma?Existen múltiples causas para un mal control del asma, la principal es la baja adhesión al tratamiento63–68.
El 80% de los pacientes que acuden a urgencias por una exacerbación asmática, frecuentemente se deben a infecciones de las vías respiratorias superiores o a un mal control de la enfermedad69. Si bien es cierto que las exacerbaciones del asma suelen ser provocadas por virus70,71 y, en menor medida, por bacterias, las infecciones no son el principal factor que influye en un mal control del asma.
Antimicrobianos en la prevención y tratamiento del asma¿Cuándo debemos utilizar antimicrobianos en la exacerbación asmática?Se estima que las infecciones virales pueden desencadenar hasta el 85% de exacerbaciones agudas de asma en niños y 60% en adultos69,72,73, en cambio, las infecciones bacterianas solo de una minoría71,74,75 y, por lo tanto, sería esperable poco o nulo efecto de los ATB. Sin embargo, la mayoría de los estudios constatan alta prescripción de ATB en las agudizaciones de asma (4,0-4,6%)71,76 . En una revisión de la Biblioteca Cochrane77 se concluye de manera limitada que existe escasa evidencia sobre el beneficio de los ATB en pacientes con exacerbaciones de asma.
Aparte, se ha reportado, en el estudio AMAZES, que el uso de 500mg de azitromicina, tres veces a la semana durante 48 semanas, redujo las exacerbaciones y promovió la calidad de vida de los pacientes, a la vez que se observó una reducción de las infecciones de causa respiratoria y del uso de ciclos de ATB78. También se describió, en el estudio AZISAST, que el uso de azitromicina a dosis bajas (250mg/día durante cinco días, seguidos de 250mg tres veces a la semana) se asoció con una disminución de la indicación de ATB en el subgrupo no eosinofílico durante 26 semanas, pero no en el grupo total79.
Aunque es difícil diferenciar entre una exacerbación asmática no infecciosa y una secundaria a infección del tracto respiratorio inferior80, las guías aconsejan la administración solo cuando los datos clínicos o las pruebas microbiológicas sugieran infección bacteriana81–84. No obstante, aún hacen falta más estudios para identificar mejor a los pacientes que se benefician de su indicación77.
La FeNO alta podría indicar un subgrupo de AG con menos probabilidad de beneficiarse de tratamiento antimicrobiano85. Alternativamente, la medición de los niveles séricos de biomarcadores como la procalcitonina ha mostrado una correlación inversa con la prescripción de ATB en pacientes con AG, demostrándose que la prescripción de ATB en estos pacientes se reduce cuando se basa en dicha medición, al poderse diferenciar entre infecciones bacterianas y víricas, comparado con cuando se hace empíricamente por el médico86.
¿Se deben tratar las colonizaciones bronquiales por hongos en asma?Aspergillus spp. presenta un amplio espectro de interacciones en la vía aérea humana, incluyendo desde colonización, invasión de la mucosa, y respuesta alérgica87. En el caso del AGNC, hasta un 50% de pacientes están sensibilizados a hongos filamentosos como Aspergillus fumigatus88. En algunas series, más del 80% de los sujetos muestran, al menos, un cultivo positivo para A. fumigatus89–94.
La presencia de colonización fúngica puede ocurrir en ausencia de sensibilización y puede observarse tanto en asma, como en pacientes con EPOC o BQ95. El aislamiento en la vía aérea de Aspergillus se ha asociado a efectos pulmonares adversos90,92,93,96,97. Y aunque el impacto del aislamiento de hongos en la función pulmonar es negativo, el tratamiento con antifúngicos tiene poca evidencia98,99.
No obstante, existe una amplia variedad en la definición de colonización por Aspergillus en las enfermedades respiratorias crónicas, que va desde ≥1 cultivo positivo en muestras respiratorias/año hasta ≥3 cultivos positivos en seis meses separados, como mínimo, por un mes100,101, lo cual pone de manifiesto la necesidad de estandarización para poder identificar las características de los pacientes que pueden beneficiarse del tratamiento antifúngico y establecer comparaciones entre estudios. Independientemente del número de cultivos positivos, la colonización se refiere al aislamiento del hongo en muestras respiratorias en ausencia de otras entidades asociadas (asma por sensibilización a Aspergillus, aspergilosis broncopulmonar alérgica [ABPA] y enfermedad pulmonar invasiva o semiinvasiva)100. Aparte del número de cultivos positivos necesarios para definir esta colonización, se requiere la ausencia de IgE/ABPA y de datos sugestivos de enfermedad pulmonar100,101.
Los pacientes con asma y sensibilización a Aspergillus se tratan del mismo modo que aquellos con otro tipo de asma alérgica, con base en los escalones terapéuticos en función de la gravedad y las medidas de evitación de exposición al hongo83; pero el mecanismo se basa en la hipersensibilidad mediada por IgE y no requiere tratamiento antifúngico específico. En la ABPA, aparte del mecanismo de hipersensibilidad tipo I (mediado por IgE), interviene el de tipo III (mediado por inmunocomplejos), por lo que el tratamiento conlleva matices.
Un estudio en pacientes con AG con sensibilización a Aspergillus y cultivo positivo para hongos, aleatorizados a tratamiento con itraconazol o placebo, observó una mejoría significativa en la QoL y pico flujo espiratorio, pero algunos pacientes precisaron suspender el antifúngico por efectos adversos y la mitad presentaron evidencia de supresión de cortisol como resultado de interacción farmacológica102. En el momento actual, el tratamiento con antifúngicos en esta patología no tiene suficiente evidencia en relación con pacientes con un cultivo positivo, pero con sensibilización demostrada a Aspergillus.
El tratamiento con azoles en la ABPA se asoció con mejoría en el control del asma, aumento del pico flujo espiratorio, reducción de los niveles de IgE sérica y del recuento de eosinófilos94.
Algunos autores han propuesto un algoritmo para el manejo de pacientes asmáticos con bronquitis fúngica definida por síntomas y al menos dos cultivos de esputo o PCR positiva para hongos94.
¿Qué consecuencias tiene el tratamiento con ATB inhalados en el asma?Las principales guías, aconsejan su utilización en la primoinfección por P. aeruginosa con el objetivo de erradicarla, así como en la infección bronquial crónica por microorganismos potencialmente patógenos, especialmente P. aeruginosa, para disminuir las exacerbaciones y mejorar la QoL34,35,37,81.
La mayoría de los estudios sobre la eficacia de ATB inhalados no especifican si incluyen pacientes con asma y los escasos estudios con ATB inhalados que detallan BQ asociadas a asma o ABPA representan una proporción muy baja103–105.
El principal motivo de retirada de los ATB inhalados suele ser la intolerancia por tos o disnea. Terpstra y cols.106, en un estudio en 57 pacientes (28 tratados con tobramicina inhalada y 29 con placebo) analizaron los efectos secundarios y la tolerancia, en cinco casos se retiró tobramicina por obstrucción bronquial, disnea o tos frente a un caso en el grupo placebo. Aunque no hay datos específicos en pacientes con asma, es previsible una peor tolerancia y la necesidad de indicación de supervisión especial dada la hiperreactividad bronquial que caracteriza a la enfermedad106.
Tuberculosis y asmaLa infección por Mycobacterium tuberculosis, ¿previene o favorece el desarrollo de asma?Se ha encontrado de manera significativa una correlación inversa entre infección por M. tuberculosis y prevalencia de asma. Cabe resaltar que los individuos que mostraban una respuesta cuantitativa mayor a la prueba de tuberculina fueron aquellos que presentaron una menor prevalencia de asma, apoyando la hipótesis de que una mayor respuesta celular estaría induciendo un efecto protector frente al asma107.
En un modelo de asma en ratón, se sensibilizaba a los animales con ovoalbúmina (OVA) como alérgeno modelo, y posteriormente se hacía una provocación pulmonar con OVA a través de la vía intranasal para así inducir la respuesta alérgica en las vías respiratorias. Pues bien, la infección pulmonar con el patógeno M. tuberculosis en los ratones sensibilizados tenía un claro efecto protector frente a los síntomas inducidos por la provocación. La infección causaba una reducción drástica de los eosinófilos en las vías respiratorias, los cuales se inducían de manera clara en presencia del alérgeno cuando los ratones no estaban infectados. Además, un análisis de las citoquinas inducidas en las vías respiratorias durante el proceso de inducción de asma indicó claramente un aumento de IL-5, IL-13 e IL-4, citoquinas típicas de la respuesta de tipo 2, las cuales se redujeron de manera significativa en los ratones infectados con TBC108.
La enfermedad por M. tuberculosis, ¿previene o favorece el desarrollo de asma?En 85 centros sanitarios de EE. UU., Europa, Canadá, Nueva Zelanda y Australia, se encontró una correlación inversa, de manera que los centros donde más TBC se notificaba eran aquellos donde se encontraban menos pacientes con asma109.
En un caso clínico de 21 años que tenía un historial de asma no controlada a pesar de tomar altas dosis de medicamentos, en un momento dado, el paciente comienza con unos síntomas inespecíficos de pérdida de peso, malestar general, fiebre y tos. Al mismo tiempo, desaparecieron las complicaciones asmáticas, disminuyendo su tratamiento de mantenimiento. El paciente fue diagnosticado de tuberculosis (TBC), comenzó el tratamiento correspondiente y mejoró de los síntomas de TBC, al mismo tiempo, revirtió la mejoría del asma, aumentando las exacerbaciones, precisando restituir el tratamiento antiasmático a niveles anteriores a que desarrollara TBC110.
¿La vacunación frente a M. tuberculosis previene el desarrollo de asma?Los datos disponibles sobre la posible relación entre asma y la vacunación con bacilo de Calmette y Guérin (BCG), administrada en clínica por vía intradermal, son numerosos111. Bajo la hipótesis de que la respuesta de tipo 1 inducida por BCG podría contrarrestar la de tipo 2 asociada al asma, se han realizado numerosos estudios retrospectivos en poblaciones vacunadas por BCG y ensayos clínicos aleatorizados doble ciego. La variabilidad de resultados fue muy alta, probablemente por su heterogeneidad. Metaanálisis realizados de estos estudios indican que la posible protección de BCG intradermal frente al asma es controvertida, sin que exista consenso al respecto112,113.
Por otro lado, datos obtenidos en modelos preclínicos de asma indican que un cambio de intradermal a pulmonar en la ruta de vacunación de BCG tendría un efecto protector frente al asma. Así, la administración intrapulmonar de BCG (por vía intranasal) en ratones, y también de la nueva vacuna viva frente a la TBC MTBVAC, producen una reducción muy drástica de la hiper activación de las vías respiratorias inducida por la presencia de alérgenos en modelos de ratón. En concreto, la presencia de BCG o MTBVAC en los pulmones produjo un descenso de la eosinofilia en vías respiratorias y pulmón, así como una disminución de la remodelación del epitelio bronquial. Además, esta protección se observó tanto en ratones únicamente sensibilizados al OVA como en un modelo de asma establecido, en la que las vacunas se administraron ya en un escenario en el que el nivel de eosinófilos en los pulmones era elevado por la presencia previa del extracto de ácaro de polvo107.
ConclusionesLas infecciones y la exposición a la microbiota en los primeros meses de vida juegan un papel crucial en el origen multifactorial del asma. Infecciones por rinovirus y VRS en la infancia se asocian al asma de inicio temprano en individuos con susceptibilidad genética. Aunque la inmunodeficiencia humoral hace que las infecciones bronquiales sean más frecuentes, el diagnóstico del asma parece ser independiente y aún no se puede describir un fenotipo diferente. La evidencia disponible sí sugiere que el asma puede favorecer el desarrollo de las BQ, con patrones inflamatorios diferentes que definen un fenotipo de asma independiente en pacientes con ambas condiciones. La hipersecreción bronquial se puede deber a las infecciones. Se identifica un fenotipo propenso a las exacerbaciones, normalmente provocadas por virus, aunque no representan el principal factor que influye en un mal control del asma. El aislamiento de Aspergillus en esputo de pacientes con asma es frecuente, pero se sabe poco sobre el impacto de los antifúngicos. Distintas vacunas deberían administrarse a pacientes con asma grave y los antibióticos inhalados en asma e infección bronquial por Pseudomonas deben emplearse teniendo en cuenta que es previsible una peor tolerancia y la necesidad de indicación individualizada y supervisión especial, dada la hiperreactividad bronquial que caracteriza la enfermedad. Finalmente, la tuberculosis podría tener un papel protector frente al asma alérgica.
Aunque avalado por la opinión de expertos y por el seguimiento de la metodología RAND/UCLA sobre la que sustenta, este trabajo involucra las limitaciones propias de las revisiones no sistemáticas de la literatura (sesgos derivados de la selección, posible falta de reproducibilidad y compromiso en la validez de las conclusiones obtenidas). No obstante, también ofrece una visión amplia y práctica sobre aspectos clínicamente relevantes que enlazan los campos de la infección, la inmunología y el manejo del asma, y abre la puerta a investigaciones futuras que permitan una mejora en el manejo de estos pacientes.
FinanciaciónEste documento ha sido promovido y financiado por la Sociedad Aragonesa de Aparato Respiratorio (SADAR), aunque no ha participado de manera alguna en el diseño, análisis de datos o redacción del manuscrito.
Contribuciones de los autoresJACG ha diseñado y liderado el proyecto. Todos los autores han contribuido de acuerdo con criterios establecidos por el «International Committee of Medical Journal Editors» (ICMJE).
Participación de la inteligencia artificialDurante la elaboración de este manuscrito, los autores han usado ChatGPT (OpenAI) para mejorar la legibilidad y el lenguaje. Tras usar esta herramienta, los autores han revisado y editado el contenido cuando esto ha sido necesario, y asumen todas las responsabilidades sobre el contenido del manuscrito.
Conflictos de interésJLGR ha recibido honorarios en los últimos tres años por charlas en reuniones patrocinadas por GlaxoSmithKline, AstraZeneca, Grifols, Zambon, Gebro Pharma, Chiesi, Teva, Sanofi y Viso; ha recibido gastos de viaje y asistencia a conferencias de Sanofi, Teva, Novartis, AstraZeneca, GlaxoSmithKline y Gebro Pharma.
RGG ha recibido honorarios en los últimos tres años por charlas en reuniones patrocinadas por Novartis, Boehringer y Gebro Pharma; ha recibido gastos de viaje y asistencia a conferencias de Sanofi, Chiesi y Gebro Pharma.
APG ha recibido honorarios en los últimos tres años por charlas en reuniones patrocinadas por AstraZeneca, Gebro, Sanofi, Zambon, GlaxoSmithKline, Bial, Menarini y Chiesi; ha recibido gastos de viaje y asistencia a conferencias de AstraZeneca y Sanofi.
ACL ha recibido honorarios en los últimos tres años por charlas en reuniones patrocinadas por AstraZeneca, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, MSD, y Sanofi-Regeneron; ha recibido gastos de viaje y asistencia a conferencias de Gebro, GlaxoSmithKline, AstraZeneca y Sanofi-Regeneron, y ha recibido fondos/subvenciones para proyectos de investigación de varias agencias estatales, fundaciones sin fines de lucro y AstraZeneca, MSD y GlaxoSmithKline.
MBA ha recibido honorarios en los últimos tres años por charlas en reuniones patrocinadas por AstraZeneca, Sanofi, GlaxoSmithKline, Gebro, Chiesi y TEVA; ha recibido gastos de viaje y asistencia a conferencias de GlaxoSmithKline, Sanofi y AstraZeneca.
JIA ha recibido financiación de entidades públicas para el desarrollo de la investigación.
JACG ha recibido honorarios en los últimos tres años por charlas en reuniones patrocinadas por GlaxoSmithKline, Gebro, AstraZeneca, Sanofi, Chiesi, FAES y la Sociedad Aragonesa de Aparato Respiratorio (SADAR); ha recibido gastos de viaje y asistencia a conferencias de GlaxoSmithKline, AstraZeneca, Sanofi, Chiesi, Boehringer Ingelheim y Menarini.
Los autores quieren agradecer el soporte en el desarrollo del proyecto y en la redacción médica proporcionados bajo la dirección de los autores por Antoni Torres-Collado, PhD; Maria Giovanna Ferrairo, PhD; Ulises López González, MD; Julia Lamborizo, MD; y Javier Arranz-Nicolás, PhD; de Medical Statistics Consulting (MSC), Valencia, España, de acuerdo con las directrices de Buenas Prácticas de Publicación (GPP 2022).