El asma grave (AG) constituye un síndrome heterogéneo con diversas variantes clínicas y representa en muchas ocasiones, una enfermedad compleja con necesidad de un abordaje especializado y multidisciplinar, así como la utilización de múltiples fármacos. La prevalencia del AG varía de un país a otro, y se estima que el 50% de estos pacientes graves tienen un mal control de su enfermedad. Para el mejor manejo del paciente es necesario un correcto diagnóstico, un seguimiento adecuado y sin duda ofrecerle el mejor tratamiento disponible, incluyendo los tratamientos biológicos con anticuerpos monoclonales (mAb). Con este afán nació este proceso de consenso que se inició en su primera versión en el año 2018, cuya finalidad última es ofrecer al paciente el mejor manejo posible de su enfermedad para así minimizar su sintomatología. Para esta actualización del consenso 2025, se realizó por parte de los autores una revisión de la literatura, añadiéndose secciones sobre el tratamiento del asma en las comorbilidades y en pediatría, además de un apartado sobre el manejo del cambio de mAb. Posteriormente a través de un proceso interactivo tipo Delphi a dos rondas un panel amplio de expertos en asma de la Sociedad de Neumología y Cirugía Torácica (SEPAR) y las sociedades autonómicas de neumología propusieron las recomendaciones y conclusiones que se recogen en el documento.
Severe asthma is a heterogeneous syndrome with several clinical variants and often represents a complex disease requiring a specialized and multidisciplinary approach, as well as the use of multiple drugs. The prevalence of severe asthma varies from one country to another, and it is estimated that 50% of these patients present a poor control of their disease. For the best management of the patient, it is necessary to have a correct diagnosis, an adequate follow-up and undoubtedly to offer the best available treatment, including biologic treatments with monoclonal antibodies. With this objective, this consensus process was born, which began in its first version in 2018, whose goal is to offer the patient the best possible management of their disease to minimize their symptomatology. For this 2025 consensus update, a literature review was conducted by the authors, and new sections of how to treat asthma comorbidities or pediatric asthma were added, as a paragraph about monoclonal antibody switch. Subsequently, through a two-round interactive Delphi process, a broad panel of asthma experts from SEPAR and the regional pulmonology societies proposed the recommendations and conclusions contained in this document.
El asma grave (AG) es aquella que requiere múltiples fármacos y en altas dosis para mantener el control [escalones 5 y 6 de la Guía Española para el Manejo del Asma (GEMA)1] y 5 de la Global Initiative for Asthma (GINA)2, o aquella que permanece mal controlada a pesar de estos escalones de tratamiento. Mientras que en muchos pacientes el mal control se debe a un inadecuado cumplimiento terapéutico, en otros se debe a la presencia de comorbilidades o a la gravedad intrínseca de la enfermedad. La European Respiratory Society/American Thoracic Society Task Force on Severe Asthma3 considera que la definición de AG es, una vez confirmado el diagnóstico y abordadas las comorbilidades, «el asma que requiere altas dosis de glucocorticoides inhalados (GCI) además de un segundo tratamiento controlador (y/o glucocorticoides sistémicos [GCS]) para evitar su «descontrol», o que permanece «no controlada» a pesar de esta estrategia terapéutica». El AG incluye tanto a pacientes controlados como no controlados4.
La gravedad del asma se evalúa retrospectivamente partiendo del nivel de tratamiento requerido para controlar los síntomas y las agudizaciones. La gravedad del asma no es una característica estática, sino que puede cambiar a lo largo de los meses o años4.
Según el grupo de panelistas: se define como asma grave no controlada (AGNC) aquella que persiste mal controlada pese a recibir tratamiento en el último año con una combinación de GCI a dosis elevada / β2 agonista de acción prolongada (GCI/LABA) y anticolinérgicos de acción prolongada (LAMA) o requiera GCS de mantenimiento (tratamiento con duración de seis meses al año independientemente de la dosis, o dosis acumulada >1 g de prednisona o equivalente, independientemente de la duración).
EpidemiologíaSe estima que entre un 5 y un 10% de la población mundial sufre asma y, de todos estos pacientes, hasta un 10% pueden padecer AG, con variaciones de un país a otro (18% en la Europa occidental, 19% en los EE. UU. y 32% en la Europa central)5. El estudio de Melero et al., utilizando tecnología de aprendizaje de máquina, comunica una prevalencia de AG del 9,7%, frente a un 20,1% utilizando metodología de investigación tradicional6. Se estima que un 50% de los pacientes con AG tienen un mal control de su enfermedad 5. Un estudio realizado en España en 2011 en unidades hospitalarias de neumología y alergología comunicó una prevalencia de AGNC, según criterio médico, de un 3,9% sobre el total de asmáticos. Sin embargo, esta cifra era mayor si se aplicaban criterios de control de la GINA7. Otro estudio español con análisis de Big Data arrojó una prevalencia de AG del 7,7% y el 64,1% de estos no estaban controlados, siendo un 31,2% de ellos corticodependientes8.
Estos pacientes originan más de la mitad del gasto total en asma. Para el AG (población adulta), el coste sanitario incremental anual del asma en España, considerando los costes directos respecto a no asmáticos, fue de 1.1703 € y el coste no sanitario incremental (costes indirectos) fue de 3461 €9. Otro estudio reciente, estima el coste del AG en España en 8.554 €/paciente/año6.
Abordaje diagnóstico estructurado/escalonadoEl diagnóstico de AG debe realizarse en unidades o centros especializados en asma, mediante un abordaje multidisciplinar1–3 que se llevará a cabo de forma secuencial en varias visitas de seguimiento. Dicho abordaje ha demostrado buenos resultados clínicos y ser coste-efectivo10–12.
En un primer paso, se debe comprobar el diagnóstico de asma de manera objetiva, mediante las pruebas complementarias establecidas o recomendadas en las guías y consensos internacionales. Estas pruebas irán encaminadas a intentar demostrar preferentemente la existencia de variabilidad de los flujos espiratorios (tabla 1)2,13 y a descartar la existencia de otra posible enfermedad que pueda simular asma mediante un adecuado diagnóstico diferencial (tabla 2)1,2,14.
Pruebas complementarias establecidas o recomendadas en las guías y consensos internacionales para el diagnóstico del asma (adaptado de GINA2,13)
| Característica | Consideraciones, definiciones y criterios |
|---|---|
| PBD positiva (más probable demostrarla si se suspende medicación BD antes: SABA, SAMA mín. 6 h/LABA 12 h o 24 h según LABA, LAMA 36-48 h). | Aumento en FEV1 ≥12% y ≥200 mL* respecto al basal, 10-15 minutos tras 400 μg salbutamol o equivalente (mayor fiabilidad si es ≥15% o ≥400 mL), o un incremento del FEV1 o FVC>10% del valor teóricoSe recomienda que los umbrales para definir una respuesta PBD positiva con oscilometría, tanto en adultos como en niños, sean una disminución del 40% en la Rrs5 (resistencia del sistema respiratorio a 5 Hz), un aumento del 50% en la Xrs5 (reactancia del sistema respiratorio a 5 Hz) y una disminución del 80% en el AX (área de reactancia). |
| Variabilidad excesiva en el PEF domiciliario (mañana-noche) durante dos semanas. | Variabilidad>20% en>3 días de una semana en un registro de dos semanas. |
| Aumento significativo de la función pulmonar tras cuatro semanas de tratamiento (GCO o GCI a dosis altas). | Aumento en el FEV1 ≥12% y ≥200 mL (o una variación diurna circadiana de PEF ≥20%) respecto al basal tras cuatro semanas de tratamiento, en ausencia de infección respiratoria. |
| Prueba de ejercicio positiva. | Caída en el FEV1 de ≥10% respecto al basal. |
| Test de provocación positivo. | Caída en el FEV1 respecto al basal ≥20% (con metacolina o histamina) o ≥15% (con hiperventilación isocápnica, salino hipertónico o manitol). |
| Variación excesiva en la función pulmonar entre visitas (menor fiabilidad). | Variación en el FEV1 ≥12% y ≥200 mL entre visitas, en ausencia de infección respiratoria. |
Este criterio no se utiliza en pediatría.
AX, área de reactancia; BD: broncodilatador; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; GCO: glucocorticoides orales; GCI: glucocorticoides inhalados; LABA: agonista β2 de acción prolongada; LAMA: agonista de acción prolongada; PBD: prueba broncodilatadora; PEF: pico flujo espiratorio (mejor de 3 intentos); Rrs5, resistencia de las vías respiratorias a 5Hz; SABA: agonista β2de acción corta. SAMA: agonista muscarínico de acción corta; Xrs5, reactancia del sistema respiratorio a 5Hz.
| Diagnóstico diferencial / Pseudoasmas | Síntomas/clínica | Pruebas diagnósticas |
|---|---|---|
| Enfermedad orgánica vía superiorColapso dinámico de la vía aérea-traqueomalacia | Disnea que no responde al tratamiento broncodilatador | • Espirometría con asa inspiratoria• TC en inspiración/espiración de vía superior• Broncoscopia |
| Tumores de la vía aérea | Estridor, hemoptisis, infecciones de repetición, síntomas dependiendo de localización | • Broncoscopia• TC |
| Aspiración de cuerpo extraño | Si el cuerpo extraño se encuentra en la vía aérea periférica aparecerá una sibilancia unilateral localizada o un colapso del tejido pulmonar distal | • Rx de tórax• TC• Broncoscopia |
| Obstrucción laríngea inducible (OLI) | Disnea con sibilantes inspiratorios/estridor | • Laringoscopia/videoestroboscopia durante la crisis o tras provocación con metacolina o tras ergometría |
| Anillo vascular | Son comunes las sibilancias, la falta de aire y el estridor ocasional | • TC tórax con contraste |
| Rinosinusitis crónica | Puede presentarse con tos y disnea nocturna por el goteo nasal posterior. Puede coexistir con el asma | • Rinoscopia anterior o endoscopia nasal• TC de senos |
| EPOC (enfisema) | Tos productiva/disnea de esfuerzo/exposición a tóxicos-humo de tabaco | • TC de tórax• Pletismografía y difusión |
| Bronquiolitis obliterante | Disnea de esfuerzo/tos seca/obstrucción no reversible | • TC de tórax en inspiración/espiración• Pletismografía• Biopsia transbronquial/pulmonar |
| Disneas funcionales/síndrome de hiperventilación | Disnea suspirosa/mareo/parestesias | • Cuestionario de hiperventilación (Nijmegen)• Valoración psicológica |
| Insuficiencia cardíaca izquierda | Disnea de esfuerzo/síntomas nocturnos/edemas en miembros inferiores | • Electrocardiograma/ecocardiograma• NT-proBNP |
| BronquiectasiasFibrosis quísticaABPA | Tos productiva/infecciones de repetición | • TC de tórax• Test del sudor/estudio genético• IgE total y específica a Aspergillus/precipitinas |
| GEPAEosinofilias pulmonares | Infiltrados pulmonares transitorios/hipereosinofilia en sangre/síntomas sistémicos | • ANCAp/Biopsia de órgano(s) afectado(s)• Broncoscopia (con lavado broncoalveolar) |
| Inmunodeficiencia común variable | Historia de infecciones repetidas de vías respiratorias altas y bajas | • Determinación de IgG, IgM e IgA |
ABPA: aspergilosis broncopulmonar aérea; ANCA: anticuerpos anti-citoplasma de neutrófilos; EPOC: enfermedad pulmonar obstructiva crónica; GEPA: granulomatosis eosinofílica con poliangeítis; Ig: inmunoglobulina; OLI: obstrucción laríngea inducible; TC: tomografía computarizada; Rx: radiografía.
En un segundo paso, se evaluarán los factores que contribuyan a un mal control del asma y las posibles enfermedades asociadas o comorbilidades3,15 debiéndose:
- •
Evaluar el cumplimiento del tratamiento prescrito de la forma más objetiva posible. En la actualidad se dispone de comprobación de dispensación en farmacia (receta electrónica) y del test de adhesión a inhaladores (TAI)16,17.
- •
Comprobar que se realiza correctamente la técnica inhalatoria con su dispositivo o, en caso contrario, encontrar otro más adecuado.
- •
Identificar los posibles factores agravantes y/o desencadenantes de las exacerbaciones (exposición a alérgenos ambientales y ocupacionales, medicación broncoconstrictora, ácido acetilsalicílico [AAS], antiinflamatorios no esteroideos [AINE], exposición a tóxicos o contaminantes, agentes infecciosos, tabaco, etc.). De particular relevancia es descartar la existencia de una infección bronquial crónica (IBC), con o sin bronquiectasias (BQ), dado que puede contribuir a un mal control del asma y precisar de un manejo terapéutico diferente. En estudios observacionales prospectivos el aislamiento de microrganismos potencialmente patógenos (MPP) en el esputo de pacientes con asma ha mostrado amplia variabilidad debido a la inclusión de poblaciones muy heterogéneas en cuanto a gravedad y fenotipo del asma18,19. Los estudios sobre IBC de la vía aérea han observado que el MPP más frecuentemente aislado es H. influenzae, siendo más prevalente en asma neutrofílica que en asma eosinofílica20–22.
- •
Identificar y tratar las enfermedades concomitantes y comorbilidades que puedan estar contribuyendo a un control inadecuado del asma. Esto es fundamental por cuanto se ha demostrado que su presencia empeora el control del AG y aumenta el riesgo de desenlaces adversos23. Las más habituales son enfermedad rinosinusal (con o sin poliposis asociada), reflujo gastroesofágico, obesidad, apnea obstructiva del sueño, obstrucción laríngea inducible, alteraciones psicopatológicas y/o disnea funcional. Para comprobar todas ellas, se realizarán las pruebas complementarias pertinentes1.
- •
Por último, se intentará identificar el subtipo o fenotipo de asma con el fin de realizar un tratamiento individualizado y optimizado24. Para ello pueden ser de ayuda marcadores clínicos, biológicos (eosinofilia en sangre, esputo inducido, fracción exhalada de NO [FENO] e inmunoglobulina [Ig] E), de función pulmonar y la broncoscopia25. Varios estudios están evaluando marcadores de actividad biológica para seleccionar aquellos que identifiquen subtipos de enfermedades y sean capaces de predecir la progresión de la enfermedad26.
De esta manera, según el panel de expertos:
El diagnóstico de AGNC precisa llevar a cabo una evaluación sistematizada por pasos que asegure no dejar a un lado aspectos relevantes. Esta valoración se debería realizar en unidades de asma (UA) acreditadas o de referencia, por profesionales con experiencia clínica contrastada en el manejo de este tipo de pacientes y mediante visitas de seguimiento durante un tiempo en un plazo temporal adaptado a cada caso.
Ante la ausencia de confirmación diagnóstica objetiva, se descartará la existencia de otra posible enfermedad simuladora de asma.
Fenotipos de asma graveTodas las enfermedades complejas son heterogéneas y el asma no es una excepción. En el caso del AGNC se han descrito tres grandes fenotipos: el asma alérgica T2, el asma eosinofílica T2 y el asma no T2. Esta categorización contempla el mecanismo fisiopatológico subyacente (asma T2 o no T2), la presencia o ausencia de ciertos marcadores inflamatorios, la historia natural y determinadas peculiaridades clínicas1. Los fenotipos no siempre son estables, habiéndose descrito, al cabo de un año, variaciones de estos en el 30% de los pacientes con AG cuando se consideran función pulmonar y reversibilidad y casi del 50% cuando se examinan biomarcadores (eosinófilos [Eos] y neutrófilos en el esputo)27. Las razones de esta inestabilidad no son bien conocidas y se han propuesto diversas hipótesis: modificaciones en el tratamiento, cambios en la microbiología de la vía aérea o en la exposición a alérgenos, presencia de otros factores ambientales, etc.27.
Asma alérgica T2. Posee una base atópica clara, guiada por la activación de las células T colaboradoras tipo 2, la producción de interleucina (IL) 4, IL-5 e IL-13 y el cambio de isotipo en los linfocitos B hacia la producción de IgE3. Se caracteriza por ser de comienzo precoz, tener pruebas alérgicas positivas (cutáneas o en suero) con concordancia clínica, RA, valores de IgE >100 IU mL, eosinofilia moderada (< 300μL), FENo entre 30-50 ppb y periostina sérica elevada1,15. En ocasiones el patrón inflamatorio es mixto (eosinofilia y neutrofilia)15, aunque con mayor frecuencia presenta un patrón eosinofílico.
Asma eosinofílica T2. Su génesis está implicada una producción elevada de IL-5, lo que vendría a explicar la inflamación eosinofílica en ausencia del mecanismo T2 mediado por la alergia1,15. Por lo general se manifiesta después de los 20 años o algo más tarde y no es extraño que venga precedida de infección del tracto respiratorio superior o inferior e incluso de rinosinusitis crónica (RSC) y poliposis nasal (PN). Un subgrupo de ellos desarrolla adicionalmente enfermedad respiratoria exacerbada por AAS (EREA) y AINES, expresando alteraciones en el metabolismo del ácido araquidónico1,15. Los pacientes tienen pruebas alérgicas negativas (o positivas, pero sin concordancia clínica), IgE baja, y eosinofilia (≥300 Eos/μL en sangre o >3% en esputo)1,15.
Asma grave no T2. Está presente en más de un tercio de los pacientes con AG. La patobiología de dicho fenotipo viene orquestada por citocinas no T2 (IL-1ß, IL-6, IL-8, IL-17A/F, interferón [IFN] γ y factor de necrosis tumoral [TNF] α) y la existencia de anomalías estructurales del músculo liso de la vía aérea y activación neuronal errática en la pared bronquial15. Cursa sin eosinofilia (ni en sangre periférica, ni en esputo) y muestra, en el esputo inducido, un perfil neutrofílico (valores ≥ 64%) o paucigranulocítico (menos del 64% de neutrófilos y menos del 3% de Eos), con niveles bajos de FENO y una pobre respuesta a los glucocorticoides1,15. El asma grave no T2 tiende a acompañarse de limitación crónica del flujo aéreo con importante atrapamiento y, con frecuencia, hay antecedentes de tabaquismo y exposición prolongada a ciertos irritantes ocupacionales o a contaminantes emitidos por los vehículos a motor15. El perfil no T2 puede darse per se o estar vinculado a circunstancias tales como: a) cambios del funcionalismo del neutrófilo debidos a la edad del paciente; b) la presencia de enfermedades concomitantes (obesidad, resistencia a la insulina, reflujo gastroesofágico patológico); c) infecciones víricas o IBC; y d) la persistencia de inflamación residual ligada a la reducción de los Eos tras tratamientos prolongados con corticoides y el efecto inhibidor de estos sobre la apoptosis de los neutrófilos15,28,29. Por tanto, el término asma no eosinofílica engloba a un grupo amplio de pacientes, tanto verdaderos no T2 como eosinofílicos «mal clasificados»29,30. A diferencia de lo que ocurre en el asma T2, seguimos sin disponer de biomarcadores que nos permitan identificar este rasgo inflamatorio con seguridad en la práctica rutinaria y, al menos de momento, las dianas terapéuticas específicas están aquí menos desarrolladas30,31. El(los) mecanismo(s) del perfil paucigranulocítico queda(n) todavía por definir con exactitud15.
De esta manera, según el panel de expertos las recomendaciones sobre este tema son:
La coexistencia de fenotipo alérgico y eosinofílico puede tener implicaciones terapéuticas.
En un paciente con fenotipo alérgico y eosinofílico un inicio tardío de la enfermedad es un dato sugestivo de predominio eosinofílico.
Para definir asma eosinofílica en un paciente que no toma GCS, se puede considerar un recuento de Eos en sangre (actual o histórico) ≥ 300 cél/μL.
Para considerar inflamación T2 en un paciente con GCS puede considerarse un recuento de Eos en sangre ≥ 150 cél/μL.
Para considerarse inflamación T2 en un paciente con AG que realiza su tratamiento correctamente puede considerarse un punto de corte de FENO> 25 ppb.
La obesidad es un subfenotipo a considerar en pacientes con asma no T2.
Seguimiento del asma graveEl asma requiere asistencia médica periódica en todos los niveles de gravedad. Este principio general resulta, sin duda, de obligado cumplimiento con el AG. Es importante que los sistemas de salud implementen estrategias para mejorar el seguimiento de estos pacientes de acuerdo con las guías de práctica clínica (GPC)32. En las visitas de seguimiento se evaluará clínicamente al paciente y se le realizarán pruebas funcionales, analíticas u otras dirigidas a:2,15,33
- •
Conocer el momento actual del proceso y compararlo con las condiciones previas para determinar si hay mejoría, empeoramiento o estabilidad.
- •
Prevenir (en la medida de lo posible) los problemas que puedan presentarse.
- •
Realizar un control clínico de los síntomas.
- •
Evitar agudizaciones y limitaciones en la vida diaria.
- •
Evaluar la situación de las comorbilidades ya conocidas y descartar la existencia de nuevas patologías.
- •
Valorar la respuesta al tratamiento pautado comprobando su cumplimiento y el uso adecuado de los dispositivos de inhalación.
- •
Establecer un pronóstico.
- •
Planificar la atención terapéutica futura.
La consecución de buena parte de estos aspectos (objetivos) depende, en esencia, de la aplicación de indicadores que monitoricen la situación clínica, funcional y de control del paciente, su cumplimiento terapéutico y el pronóstico a medio plazo.
Indicadores de la situación del paciente. Valoración del control y remisión.
La situación clínica del paciente se interpreta en términos de control de la enfermedad y dicho concepto difiere según la GPC que se esté utilizando (GINA o GEMA).
Para la GINA2, el concepto de control clínico es dual: control actual (definido por los síntomas) y riesgo futuro. La GINA recomienda estimar los síntomas mediante cuestionarios validados —el Asthma Control Questionnaire en su versión de cinco ítems (ACQ-5), y el Asthma Control Test (ACT)—, que son útiles para reflejar cambios a lo largo del tiempo, algo fundamental para evaluar la eficacia de las intervenciones terapéuticas. Además, los resultados obtenidos con la aplicación de estas herramientas se relacionan muy estrechamente con los datos aportados por los instrumentos que miden la calidad de vida relacionada con la salud34. La GINA contempla el resultado de la espirometría como un factor de riesgo futuro (si hay obstrucción)2.
La GEMA1 coincide en la visión dual del concepto de control (control actual y riesgo futuro), aunque considera el volumen espiratorio forzado en el primer segundo (FEV1) como variable definitoria de control actual. Según la GEMA, un paciente asintomático con un valor de FEV1 bajo no estaría bien controlado, siempre y cuando revierta la obstrucción tras tratamiento esteroideo intenso, es decir, que no sea el suyo habitual o su mejor valor histórico. Para la GINA estaría controlado, pero tendría un riesgo aumentado de exacerbaciones en el futuro15. La GEMA también recomienda el uso de cuestionarios validados para medir el control actual del asma (ACT y ACQ)1. Recientemente ha sido validado en español otro cuestionario, el Asthma Impairment and Risk Cuestionnaire (AIRQ), capaz de valorar tanto control actual como riesgo futuro al incorporar las exacerbaciones en los 12 meses previos35. Conviene recordar asimismo que los síntomas deben ser interpretados con precaución, ya que las diferentes comorbilidades que acompañan a la enfermedad pueden en ocasiones causar síntomas similares, así como tener presente la valoración de estos en pacientes hiper- o hipoperceptores.
Hoy por hoy, ninguna guía contempla la necesidad de medir biomarcadores de inflamación en el seguimiento para estimar el control.
Por otro lado, con la llegada de los anticuerpos monoclonales (mAb) y su gran impacto en la evolución de la enfermedad, el objetivo final del tratamiento es más ambicioso y ya no basta con alcanzar los objetivos clásicos de ausencia de síntomas y exacerbaciones, no uso de GCS y estabilización/normalización de la función pulmonar. De aquí surge el concepto de remisión, un objetivo entre el control y la curación de la enfermedad.
La remisión espontánea en niños es muy variable. En un estudio longitudinal en niños con asma alérgica, con un seguimiento de 30 años, se alcanzó la remisión completa en el 22% de los casos y la remisión clínica en un 30% más; es decir, en el 50% de los niños al llegar a la edad adulta se conseguía la remisión sin tratamiento36. En estos casos, el factor predictivo más importante para conseguir la remisión fue una mejor función pulmonar. En el asma de inicio tardío la remisión es más rara, aunque alcanza niveles no despreciables (entre el 2-16% dependiendo de los criterios diagnósticos de asma y de remisión utilizados)37.
Para que exista la remisión deben existir tratamientos modificadores de la enfermedad, es decir, que actúen sobre los mecanismos patogénicos del asma, alteren la historia natural, disminuyan la actividad y consigan una mejoría sostenida en el tiempo e, idealmente, que permitan prescindir del mismo en un tiempo dado. La inmunoterapia se ha mostrado también como un tratamiento modificador de la enfermedad38,39.
Un consenso de expertos, mediante una encuesta Delphi, propuso el concepto de remisión clínica (ausencia sostenida de síntomas significativos de asma según un instrumento validado, mejora o estabilización de la función pulmonar, acuerdo entre paciente y médico sobre la remisión y no uso de GCS ni para tratamiento de exacerbaciones ni para control a largo plazo de la enfermedad, todo ello durante un periodo no inferior a 12 meses, con o sin tratamiento) y remisión completa (remisión clínica más mejoría objetiva o resolución de los marcadores inflamatorios de la enfermedad durante 12 o más meses, con y sin tratamiento, además de ausencia de hiperrespuesta bronquial [HRB])40.
En una revisión más reciente, los autores definen remisión clínica de manera similar a los anteriores, admitiendo algún tipo de alteración de la función pulmonar o HRB; hablan de remisión inflamatoria cuando los biomarcadores séricos o de vías aéreas son muy bajos o indetectables y aún existe alteración de la función pulmonar o HRB; y de remisión completa ante la ausencia de síntomas «sin requerir uso de medicación» y con ausencia de HRB41. Es decir, para la remisión completa se debe cumplir la condición de ausencia de necesidad de tratamiento, cosa que en las anteriores definiciones no se exigía, y la no existencia de HRB, circunstancia esta que ya se comentaba en trabajos clásicos42.
Como vemos, para alcanzar la remisión clínica se utilizan una serie de criterios de valoración (control de síntomas, función pulmonar, uso de GCS y exacerbaciones) que no difieren de los que se emplean para definir el control, pero que deben darse todos a la vez y mantenerse en el tiempo. En realidad, se está hablando de control total (actual y riesgo futuro), añadiendo la condición de perpetuarse en el tiempo.
El concepto de remisión completa establece otros objetivos terapéuticos no presentes en la remisión clínica como son la HRB y la inflamación. Es por ello, que algunos autores apuntan que centrarse en la remisión completa podría resultar útil en el objetivo final de modificar la historia natural de la enfermedad y buscar la normalidad43.
La tabla 3 resume los criterios para definir la remisión clínica y completa en asma.
Definiciones relacionadas con el concepto de remisión (adaptada de Álvarez-Gutiérrez44)
| REMISIÓN EN ASMA | |
| Remisión CLÍNICA | • Asma controlada (ACT ≥20).• Sin necesidad de medicación de alivio o rescate.• Sin exacerbaciones y sin necesidad de ciclos de esteroides sistémicos.• Espirometría con FEV1≥80%, o en previas, valores>90% de su mejor valor personal.• Espirometría con prueba broncodilatadora negativa.• Esta situación se debe mantener durante al menos 12 meses, especificando si es con o sin tratamiento. |
| Remisión COMPLETA | • Todos los criterios de remisión clínica.• Sin evidencia de inflamación sistémica o bronquial (FENO<40 ppb y Eos esputo <2%, si se realiza).• Sin hiperrespuesta bronquial.• Sin lesiones de remodelación bronquial en las pruebas de imagen.• Esta situación se debe mantener durante al menos tres años, especificando si es con o sin tratamiento. |
| REMISIÓN EN ASMA y RSCcPN (vía respiratoria única) | |
| Remisión COMPLETA | • Todos los criterios de remisión completa en asma.• Recuperación del olfato.• SNOT-22 <30.• Endoscopia nasal normal.• Esta situación se debe mantener durante al menos tres años, especificando si es con o sin tratamiento. |
ACT: Asthma control test; Eos: eosinófilos; FENO: fracción exhalada de NO; FEV1: volumen espiratorio forzado en el primer segundo; RSCcPN: rinosinusitis con poliposis; SNOT-22: Sinonasal Outcome Test-22.
El cumplimiento del tratamiento influye tanto en el control del asma como en el riesgo futuro. Se estima que el porcentaje medido de cumplimiento en asmáticos está entre el 30% y el 70%45. No obstante, la medición del cumplimiento es un problema, ya que los marcadores de incumplimiento son muy inexactos. La pregunta directa al paciente sobreestima su cumplimiento y cuestionarios no específicos para terapia inhalada, como la escala de Morisky-Green, han quedado en desuso. En su lugar, el TAI, diseñado y validado por la Sociedad de Neumología y Cirugía Torácica (SEPAR), permite estimar el cumplimiento de la terapia inhalada en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y con asma a la vez que categoriza el tipo de incumplimiento del paciente con el fin de dirigir actuaciones concretas para mejorar la adhesión. Además, el TAI incluye dos preguntas adicionales sobre la técnica inhalatoria16.
El recuento de la medicación tampoco es un método fiable, ya que muchos pacientes disparan el inhalador en el momento anterior a la consulta de revisión (dumpers). Sin embargo, la valoración indirecta de la adhesión al tratamiento mediante la revisión de la retirada del fármaco en la farmacia a través de la receta electrónica (e-receta) es un método válido y cada vez más extendido. El uso combinado del TAI con la evaluación de la retirada de e-receta supone una herramienta más sensible para detectar la falta de adhesión que el empleo de un solo método17, por lo que es la estrategia actualmente más extendida.
En cualquier caso, se siguen buscando herramientas más fiables para medir la adhesión. Un reciente estudio demostró que la telemonitorización de los valores de FENO, y su supresión con dosis altas de GCI, puede ayudar a identificar a los incumplidores46. También es probable que la medición de niveles de marcadores sanguíneos pueda ayudarnos a medir la adhesión a los GCI en un futuro próximo47.
Por último, se espera con gran expectativa el desarrollo de los prometedores Dispositivos de Monitorización Electrónica (DME) que, acoplados a los nuevos inhaladores mediante un chip, permiten el envío de información periódica sobre el cumplimiento real y la técnica inhalatoria48. En este sentido, ya se han producido los primeros intentos en vida real, pero es necesario realizar mejoras y generalizar su uso a diversos tipos de inhaladores para que constituyan una herramienta verdaderamente práctica para el clínico.
Indicadores para establecer el pronósticoEl pronóstico se establece estimando el riesgo futuro. Este comprende el mal control de los síntomas, el desarrollo de exacerbaciones, el establecimiento de una obstrucción bronquial fija o pérdida de función pulmonar y los efectos adversos (EA) del tratamiento. Por lo tanto, los marcadores de riesgo futuro se obtendrán a través de la historia clínica o el uso de cuestionarios, aunque también hay que tener en cuenta dos particularidades: los marcadores de inflamación bronquial y la función pulmonar.
Un mal control de los síntomas de asma se asocia a mayor riesgo de exacerbaciones, de hospitalización y de uso de glucocorticoides orales (GCO)49. Además, la presencia de obstrucción bronquial es un factor de riesgo independiente para sufrir exacerbaciones en el futuro, incluso si el ACT es ≥ 2050. La reversibilidad en la prueba broncodilatadora también ha sido reportada como factor que aumenta el riesgo de exacerbaciones51.
Por otra parte, aunque existen resultados contradictorios respecto a la eosinofilia como biomarcador dependiendo del tipo de paciente estudiado, en general se ha indicado que su persistencia a pesar de un tratamiento correcto con GCI es un factor de riesgo futuro52 y la concordancia de eosinofilia periférica y local (en esputo) identifica al grupo con mayor riesgo de ataques de asma53.
En lo referente a la FENO la evidencia es menos consistente, pero existen indicios que sugieren que pueda tener un papel en la predicción de exacerbaciones en algunos pacientes, especialmente en combinación con otros marcadores de respuesta T2, con el número de exacerbaciones previas y la pérdida de función pulmonar54,55. En cualquier caso, son necesarios más estudios para poder considerar a la FENO como un marcador pronóstico independiente en el momento actual.
Con respecto al desarrollo de obstrucción fija al flujo aéreo, un metaanálisis ha encontrado los siguientes factores de riesgo: sexo masculino, tabaquismo, valores elevados de FENO y la EREA56. De ellos, solo serían modificables el tabaquismo y la FENO, pero tratar a los pacientes en base a los valores de este biomarcador requiere más evidencias.
Marcadores de planificación del ajuste terapéuticoLa planificación del ajuste terapéutico se hará teniendo en cuenta el control actual de la enfermedad y el riesgo futuro. La medicación se ajustará al alza o a la baja siguiendo las recomendaciones de la GEMA1 o de la GINA2. Además, es importante actuar sobre los factores de riesgo futuro que sean modificables (tabaquismo, cumplimiento terapéutico, comorbilidad, etc.).
En la tabla 4 se recogen los marcadores que se recomiendan evaluar en el AG para el seguimiento. La eosinofilia periférica y la FENO son biomarcadores de respuesta T2 y ayudan a la selección del tratamiento con mAbs57,58. En pacientes con AGNC, especialmente en aquellos que reciben GCO, hay baja correlación entre eosinofilia en sangre y esputo, y la persistencia de eosinofilia en el esputo puede reflejar respuesta insuficiente al tratamiento con un mAb59,60.
Marcadores recomendados para el seguimiento de pacientes con AG
| ACT/ACQNúmero de exacerbaciones*Dosis diaria y acumulada de GCSFEV1 con prueba broncodilatadoraCumplimiento (TAI, e-receta)FENOEosinófilos en sangre o en esputoIgE total en sangre** |
Para fenotipado inicial y seguimiento de aspergilosis broncopulmonar alérgica.
ACT/ACQ: Asthma Control Test/Asthma Control Questionnaire; FEV1: volumen espirado forzado en el primer segundo; FENO: fracción exhalada de NO; GCS: glucocorticoides sistémicos; IgE: inmunoglobulina E; TAI: test de adhesión a inhaladores.
En cualquier caso, la generación de evidencia que respalda el uso de estos marcadores para ajustes terapéuticos en ocasiones es escasa, inconsistente, o no lo suficientemente reciente. En el caso de la eosinofilia y la FENO, por ejemplo, un metaanálisis reciente observó que los pacientes cuyo ajuste del tratamiento del asma se basaba en el recuento de Eos en esputo presentaban una reducción significativa de la probabilidad de sufrir exacerbaciones (Odds Ratio [OR]=0,36, IC 95%=0,21 a 0,62). La reducción también era significativa, aunque menor (OR adultos=0,60, IC 95%=0,43 a 0,84; OR niños=0,58, IC 95%=0,45 a 0,75) si la estrategia de ajuste se basaba en la medida de FENO. Sin embargo, no se observaron cambios con ninguna de estas estrategias en cuanto a la función pulmonar o los síntomas61, e incluso, un estudio multicéntrico posterior no logró reducir exacerbaciones a los 12 meses al combinar FENO y síntomas para realizar el ajuste terapéutico de niños con asma62. No obstante, estos biomarcadores podrían resultar de utilidad con pacientes en los que el objetivo terapéutico sea reducir exacerbaciones.
En el seguimiento del paciente con AG se recomienda aplicar en cada visita los cuestionarios de síntomas y/o calidad de vida, evaluar el cumplimiento terapéutico y la técnica inhalatoria, y realizar una espirometría15. Sin embargo, las guías son imprecisas en lo referente al periodo de tiempo que debe mediar entre visitas y las pruebas a realizar obligatoriamente. Ello no debería sorprendernos, ya que es muy difícil agrupar bajo recomendaciones comunes toda la posible variedad de pacientes en lo referente a su gravedad, tratamiento y circunstancias personales. No obstante, la GEMA1 recomienda un control del paciente con periodicidad variable en función del grado de gravedad (anual en asma intermitente o persistente leve, semestral en asma persistente moderada, y trimestral en asma persistente grave). Asimismo, la GEMA1 indica una valoración clínica que incluye cuestionarios de control de síntomas, y la valoración de la función pulmonar con espirometría o pico flujo espiratorio (PEF) (cuando la espirometría no sea posible). Se asume que los efectos del tratamiento sobre los síntomas y FEV1 deberían ser evidentes a los tres meses, y por ello se propone este periodo de tiempo para reevaluar la respuesta al tratamiento inhalado63. En el caso de pacientes tratados con mAbs, se postulan cuatro a seis meses para una primera valoración de respuesta clínica (seis meses para omalizumab), funcional e inflamatoria64. Finalmente, para comprobar la eficacia en la reducción de exacerbaciones y GCS, es preciso alargar el horizonte temporal hasta 12 meses (fig. 1).
En la actualidad están surgiendo herramientas que intentan evaluar la respuesta a los mAb en el AGNC, considerando los parámetros descritos en la tabla 5. En esta tabla queda recogida la escala multidimensional EXACTO (EXacerbaciones, ACT, CorticosTeroides sistémicos y Obstrucción-FEV165), que evalúa de forma sencilla la respuesta del paciente con AGNC al tratamiento con un mAb. Para la elaboración de EXACTO y para la ponderación del peso de cada variable, una vez realizado el modelo teórico, se realizó una encuesta Delphi de dos rondas en la que participaron 56 especialistas en neumología con experiencia en el tratamiento y seguimiento de pacientes con AGNC. Esta escala puede ser útil para la toma de decisiones terapéuticas, sobre todo en aquellos pacientes que logran una respuesta parcial al tratamiento con mAbs. EXACTO define como superrespondedor al paciente con respuesta completa65.
| Exacerbaciones& | ACT | GCS& | FEV1 | |||||
|---|---|---|---|---|---|---|---|---|
| No respuesta | >2 exacerbaciones | 0 | <20 y sin cambio o peor puntuación que al inicio | Dosis igual o mayor | 0 | Igual o menor que el de inicio. Si no hay cambios no se valora FEV1% predicho ni el histórico. | ||
| Respuesta parcial | 2 exacerbaciones | 1 | <20 y mejora <3 puntos | 0 | Disminución de dosis <50% sin retirada de GCS | 1 | (Aumento <10% y 100 mL) y (FEV1 <80% predicho o <80% del mejor histórico) | 0 |
| Respuesta buena | 1 exacerbación | 2 | <20 y mejora ≥3 puntos | 1 | Disminución de dosis ≥50% sin retirada de GCS | 2 | (Aumento ≥10% y 100 mL) y (FEV1 <80% predicho o <80% mejor histórico) | 1 |
| Respuesta completa | No exacerbaciones | 3 | ≥20 | 2 | Retirada de GCS o dosis ≤5 mg/día si insuficiencia adrenal | 3 | (Aumento ≥10% y 100 mL) y (FEV1 ≥80% predicho o ≥80% mejor histórico) | 2 |
| Respuesta | Puntuaciónsin GCS | Puntuacióncon GCS |
|---|---|---|
| mAb | ||
| No | 0-1 | 0-2 |
| Parcial | 2-4 | 3-6 |
| Buena | 5-6 | 7-9 |
| Completa | 7 | 10 |
mAb: anticuerpos monoclonales (monoclonal antibodies); EXACTO: EXacerbaciones, ACT, CorTicosteroides sistémicos y Obstrucción – FEV1; ACT: Asthma Control Test; GCS: glucocorticosteroides sistémicos; FEV1: volumen espiratorio forzado en el primer segundo.
Se hará una valoración de la respuesta al tratamiento con un mAb a los 4-6 meses y a los 12 meses. La respuesta a los 12 meses se obtiene comparando los respectivos valores de las diferentes variables a los 12 meses frente a sus valores antes de iniciar el mAb. Para el seguimiento del paciente, se recomienda aplicar la herramienta cada seis meses a partir del primer año de tratamiento.
Dada la relación entre asma y RSC con poliposis nasal (RSCcPN), es importante disponer de una herramienta que permita valorar la respuesta a los fármacos biológicos mAbs considerando esta patología. En las guías EUFOREA y EPOS20 existen sendas propuestas, pero no están validadas66,67. En la figura 2 se expone una nueva propuesta consensuada entre un grupo de expertos.
Escenarios de tratamiento combinado en pacientes con asma grave y rinosinusitis crónica con pólipos nasales. Adaptado de GEMA1.
En cuanto a la valoración del grado de satisfacción del paciente con la medicación existen cuestionarios validados, como el SATMED-Q para medicación oral68 o el FSI-10 para medicación inhalada69, pero se ha considerado que estos cuestionarios no son aplicables para evaluar el grado de satisfacción con un mAb. Para su valoración ha sido desarrollada la siguiente escala (tabla 6), aún no validada, en la que se han considerado cinco dominios: 1) EA; 2) eficacia; 3) comodidad de uso; 4) beneficio en las actividades de la vida diaria; y 5) opinión general respecto al tratamiento con el mAb. La puntuación para cada uno de los dominios va de 0 a 2, donde 0 es el peor grado de satisfacción y 2 el mejor posible. El grado de satisfacción del paciente con el mAb se definió como malo o insatisfecho (0-2 puntos), algo satisfecho (3-5 puntos), satisfecho (6-8 puntos) y muy satisfecho (9-10 puntos).
Escala de valoración del grado de satisfacción del paciente con el mAb (adaptada de Campbell70)
| Dominio | Baremo |
|---|---|
| Efectos adversos | 0: Efectos adversos importantes1: Efectos adversos leves2: No efectos adversos |
| Eficacia | 0: No eficaz o poco eficaz1: Eficaz2: Muy eficaz |
| Comodidad de uso | 0: No cómodo o poco cómodo1: Cómodo2: Muy cómodo |
| Beneficio en las actividades cotidianas de la vida diaria | 0: Poco o ningún beneficio1: Beneficio positivo2: Beneficio muy positivo |
| Opinión general respecto al tratamiento con el mAb | 0: Mala1: Buena2: Muy buena |
mAb: anticuerpo monoclonal.
Las variables RSCcPN y grado de satisfacción del paciente con el mAb son complementarias pero independientes de la escala EXACTO, por lo que no modifican su puntuación total. El paciente que alcance la respuesta completa en la escala EXACTO se considera superrespondedor en asma, y si además alcanza respuesta en la escala de poliposis (tabla 7), se define como superrespondedor para la vía respiratoria única (VRU). Estos conceptos necesitan ser validados y contrastados con futuros estudios.
Escala de valoración de respuesta a fármacos mAbs en RSCcPN
| SNOT-22 <20 y mejoría>-8,9 |
| Puntuación de síntomas nasales totales (EVA 0-10): <5 |
| Disminución de la necesidad de GCS>50% |
| Disminución del tamaño de los pólipos nasales |
| Respuesta completa: 3-4 criterios |
| Respuesta buena: 2 criterios |
| Respuesta parcial: 1 criterio |
| No respuesta: 0 criterios |
EVA: escala visual analógica; GCS: glucocorticoides sistémicos; mAb: anticuerpo monoclonal; SNOT-22: Sino-Nasal-Outcome-Test de 22 indicadores; RSCcPN: rinosinusitis crónica con poliposis nasal.
A principios de 2021, se propuso un modelo multidimensional para evaluar la respuesta al tratamiento con mAbs71. Los autores seleccionaron los ítems y los instrumentos de medida mediante metodología Delphi, se le asignó un peso a cada ítem mediante un sistema de decisión multiparamétrico utilizando la metodología Potentially All Pairwise RanKings of All Posible Alternatives (mediante el software1000 minds Ltd, New Zeland), y por último se realizó una validación externa para el score obtenido. Los ítems de mayor peso fueron las exacerbaciones graves, la utilización de GCO, los síntomas evaluados mediante el ACT y la obstrucción bronquial evaluada mediante el FEV1. En un estudio reciente de dos años de seguimiento en vida real de pacientes tratados con mAbs anti-IL-5, Eger et al.72. encontraron un 14% de pacientes con muy buena respuesta (superrespondedores), un 11% de no respondedores y un 69% de pacientes con respuesta parcial. Es en este amplio grupo de pacientes con respuesta parcial en el que es más necesaria la utilización de herramientas como la escala FEOS, que permite cuantificar la respuesta al tratamiento biológico de forma objetiva e integral71, EXACTO65 y otras, para ayudar al clínico en la toma de decisiones.
Algunos autores sugieren que mediciones de la afectación de la vía aérea pequeña, como las obtenidas por oscilometría, podrían ser una herramienta adicional para medir la respuesta a mAbs en un futuro próximo73.
En cualquier caso, y a la vista de la información aquí expuesta, resulta evidente que el seguimiento del AG es un proceso continuo que exige una dedicación y una preparación capaces de dar respuestas coherentes, planificadas y personalizadas73. En este sentido, la creación de unidades especializadas de asma dotadas de medios y personal sanitario experto aparece como una opción muy razonable, tanto desde la perspectiva de eficiencia para el sistema como desde la perspectiva de mejora de resultados para el paciente10,74.
Aunque para evaluar el control del asma la visita médica presencial es fundamental, a causa de la pandemia se ha asistido a una reestructuración de las UA y servicios de neumología que ha imposibilitado la asistencia clínica tal y como se venía realizando. Surge así la necesidad de otras formas de atención a los pacientes asmáticos. La GEMA1 habla ya de teleasistencia médica (telehealthcare) como un término general, abarcando las diferentes formas de asistencia sanitaria con tecnología (teleconsulta, telemonitorización y telemedicina). El uso combinado de estas estrategias, que incluye el manejo de telecasos o la teleconsulta, mejora el control de la enfermedad y la calidad de vida de los pacientes con asma75,76.
Recomendaciones generales sobre el seguimiento del AG:
En todo paciente con AG, el seguimiento de la evolución y la respuesta terapéutica constituyen una parte esencial de su manejo.
El periodo de tiempo que debe mediar entre visita y visita variará de unos casos a otros, pero se aconsejan tres meses para valorar los efectos del tratamiento inhalado sobre los síntomas y FEV1, y se recomienda esperar entre cuatro a seis meses para una primera valoración de respuesta clínica, funcional e inflamatoria en pacientes tratados con mAbs. Se valorará la reducción de exacerbaciones y reducción de GCS a los 12 meses.
En cada visita se debe valorar el grado de control actual y el riesgo futuro.
Cada visita es una oportunidad para estimar el grado de cumplimiento terapéutico (reforzar el cumplimiento del tratamiento) y revisar la técnica de inhalación (corrigiendo los errores detectados). También es importante identificar los posibles factores agravantes y/o comorbilidades asociadas al asma, especialmente si la enfermedad no está controlada.
La derivación de los pacientes con AG a unidades especializadas dotadas de medios y profesionales es una opción muy razonable por su eficiencia y mejora de resultados.
De forma global, los marcadores aconsejados para el seguimiento de la mayoría de los pacientes con AG en cada visita son: ACT/ACQ, número e intensidad de exacerbaciones desde la última visita, FEV1, TAI, FENO, eosinofilia en sangre y consumo de esteroides sistémicos.
La eosinofilia periférica es un biomarcador que ayuda a la indicación de un mAb.
En pacientes con AG, especialmente en aquellos que reciben GCO, hay baja correlación entre eosinofilia en sangre y esputo.
La persistencia de eosinofilia en el esputo puede reflejar respuesta insuficiente al tratamiento con un mAb.
Los nuevos inhaladores que incorporan sensores digitales para recoger datos sobre su uso pueden mejorar el cumplimiento del tratamiento del asma y podrían considerarse preferentemente en pacientes con antecedentes demostrados de incumplimiento terapéutico o de técnica inhalatoria incorrecta.
La realización de prueba broncodilatadora es recomendable en el seguimiento de pacientes con AG.
Registrar el mejor valor de FEV1del paciente (si está disponible) es útil para establecer el objetivo de función pulmonar que se debe conseguir con su tratamiento. La prueba de GCO es útil para conocer el mejor valor de FEV1del paciente.
Debería incorporarse la FENOal seguimiento del AG.
Consulta de enfermería respiratoriaDesde la consulta de enfermería respiratoria el seguimiento del paciente con AGNC se marca el objetivo principal de fomentar la autonomía del paciente para conseguir un mejor automanejo, autoeficacia y un mayor empoderamiento, consiguiendo de esta manera una mejor calidad de vida y un menor impacto de la enfermedad77.
Así pues, son varios los puntos a abordar en la consulta de enfermería respiratoria con un paciente con AGNC78: conocimientos de la enfermedad, etiopatogenia del asma, pruebas de diagnóstico y seguimiento, factores desencadenantes de exacerbaciones y medidas preventivas, y el manejo de fármacos.
En la tabla 8, en base a estos objetivos, se detallan las dimensiones que la enfermería de neumología tiene que valorar en todos los pacientes con AGNC. La enfermería, debe implementar cada una de las acciones de un programa de educación dirigido a pacientes con asma. Este programa debe de ser individualizado, progresivo, secuencial, dinámico y continuo79, y se debe implementar tras haber elaborado un diagnóstico educativo del paciente con AGNC80.
Funciones de enfermería
| EDUCACIÓN EN ASMA |
| - Información estructurada sobre la enfermedad, factores agravantes y desencadenantes- Adiestramiento en técnica inhalatoria- Formación sobre administración de tratamientos con mAbs |
| VALORACIÓN DEL CONTROL DEL ASMA: ACT/ACQ |
| ADHESÓN AL TRATAMIENTO |
| - Cuestionarios: TAI- Retirada de fármacos en farmacia |
| OTROS CUESTIONARIOS SEGÚN INDICACIÓN INDIVIDUALIZADA: Mini AQLQ, HADS, Nijmegen, etc. |
ACT/ACQ: Asthma Control Test/Asthma Control Questionnaire; AQLQ: test de calidad de vida de pacientes con asma; HADS: test de ansiedad y depresión hospitalaria; mAbs: anticuerpos monoclonales; TAI: test de adhesión a inhaladores.
La educación sanitaria en el paciente con AG no se diferencia de la habitualmente recomendada para el resto de la población asmática. No obstante, se extremarán las medidas de evitación (se evitará la exposición a contaminantes y tóxicos, y a alérgenos en pacientes alérgicos, sobre todo a hongos, pólenes, epitelios, ácaros y cucarachas). Se abandonará el tabaquismo –activo y pasivo–, se evitará el uso de AINES en pacientes con EREA1 y el consumo de los alimentos determinados en casos de alergia alimentaria confirmada1. Se establecerán planes de acción basados en síntomas y en la medición del PEF1. Además, se adiestrará a los pacientes en el correcto empleo de los dispositivos de inhalación y de los medidores de PEF1,81,82. Asimismo, debe promoverse la realización de ejercicio físico que ha demostrado mejorar el control del asma83.
El paciente con AGNC precisa de tratamientos farmacológicos complejos y, más allá de la terapia inhalada y la medicación oral, el tratamiento con mAbs representa un factor más añadido en la complejidad de los tratamientos de este grupo de pacientes. La enfermería respiratoria es fundamental en la valoración de una serie de variables que marcan la idoneidad del inicio de estos tratamientos, siendo la variable principal la valoración del grado de cumplimiento al tratamiento de base del paciente, y de esta manera poder implementar estrategias eficaces antes de iniciar el tratamiento con mAbs.
La preparación y entrenamiento del paciente es fundamental. En este sentido la autoadministración del mAb en domicilio es una propuesta que hay que hacer a todos los pacientes que cumplan unas condiciones mínimas (tabla 9). Después del entrenamiento estructurado y con el objetivo de seguir con el mAb en el domicilio, se debe analizar si el paciente es candidato a este modo de administración. De esta manera, el paciente que se incluye en un programa de autoadministración cumple unos requisitos mínimos de seguridad y control: correcta adhesión, persistencia y cumplimiento de todo el tratamiento indicado y grado de control óptimo. El paciente con AGNC en tratamiento con mAb en programa de autoadministración tiene una vía rápida y accesible a su equipo de seguimiento en todo momento, para identificar cambios clínicamente relevantes o para la resolución de dudas84.
Criterios previos a programa de autoadministración del mAb
| • El paciente acepta autoadministrarse el fármaco o tiene cuidador principal entrenado• Ha recibido al menos tres administraciones intrahospitalarias• Se ha administrado al menos una dosis supervisada por profesional sanitario• No tiene historial previo de anafilaxia• Paciente y/o cuidador han recibido entrenamiento sobre reacciones alérgicas graves en relación con el mAb• Demuestra conocer el dispositivo de inyección (pluma o jeringa precargada)• Demuestra conocer el modo de conservación del fármaco, condiciones de seguridad, transporte y desecho |
mAb: anticuerpos monoclonales.
En resumen, la evaluación de la enfermería respiratoria respecto a los mAbs debe incluir indicadores de impacto de la intervención en relación con las habilidades del paciente en la autoadministración, la correcta adhesión terapéutica, la implementación de programas de educación terapéutica y el uso de recursos sanitarios (visitas programadas/no programadas a atención primaria [AP] o neumología, servicio de urgencias, ingresos hospitalarios en neumología, etc.). La participación de enfermería mejora la atención de los pacientes con AGNC y reduce costes sanitarios85.
Asma grave y comorbilidadesLas comorbilidades son muy frecuentes en los pacientes con AG y pueden complicar el diagnóstico y la respuesta al tratamiento de la enfermedad.
Incluye comorbilidades relacionadas con el mismo proceso biológico del asma (como rinitis alérgica [RA], o no alérgica [RNA], RSC con o sin pólipos nasales [RSCcPN o RSCsPN], aspergilosis broncopulmonar alérgica), comorbilidades que modifican la percepción de los síntomas asmáticos (ansiedad, depresión, disfunción laríngea o de cuerdas vocales) y comorbilidades que pueden agravar el asma (obesidad, apnea del sueño, BQ o reflujo gastroesofágico). Todas las comorbilidades deben ser adecuadamente estudiadas y tratadas.
Asma y vía respiratoria superiorRinitis, rinosinusitis crónica y asma graveEl asma se acompaña de síntomas en la vía respiratoria superior en la mayoría de los pacientes86, como consecuencia de inflamación crónica similar. La vía respiratoria superior e inferior constituyen una unidad anatómica y funcional, interrelacionadas, de acuerdo con el concepto de VRU87. Este concepto implica la necesidad de un tratamiento integral de toda la vía aérea. La afectación de la vía respiratoria superior consiste fundamentalmente en rinitis (RA o RNA), RSCcPN o RSCsPN, según las definiciones de las guías ARIA88 y EPOS67.
Los fenotipos nasosinusales más frecuentes asociados al asma son la RA y la RSCcPN. La metodología de evaluación de los fenotipos nasosinusales en el asma, por el neumólogo, se ha descrito previamente en la literatura89.
La RA, mediada por IgE se asocia al asma de inicio precoz en la infancia o adolescencia, mientras que la RSCcPN se asocia al AG de inicio tardío y de predominio no atópico. Ambos fenotipos definen dos grandes grupos con diferente fisiopatología que, sin embargo, pueden solaparse. La RA se caracteriza por los siguientes síntomas: rinorrea, estornudos, congestión nasal y/o picor de la nariz. El estudio ISAAC mostró una prevalencia en España de síntomas de rinoconjuntivitis de 7,9% en niños de seis a siete años y del 15% en niños de 13-14 años90.
La RSC, definida por la inflamación de la mucosa nasal y sinusal se manifiesta con síntomas característicos de congestión nasal, rinorrea anterior o posterior, dolor facial y disfunción olfatoria. Su diagnóstico se basa en la presencia de síntomas nasosinusales durante más de tres meses acompañado de la evidencia de inflamación sinusal por endoscopia nasal y/o tomografía computarizada (TC) nasosinusal.
La RSC afecta a un 12% de la población91. En el caso de RSCcPN afecta al 2-4% de la población adulta, al 10-20% de los pacientes con asma, casi a la mitad de los pacientes con AG y a más del 90% de los pacientes con EREA92. Aproximadamente el 80% de los pacientes con RSCcPN tienen una inflamación T2 en Occidente (EE. UU., Europa, Australia). Este fenotipo tiende a ser más grave y se asocia a comorbilidades, incluido el asma, que con frecuencia es grave92.
Factores de riesgo y comorbilidades del asma en la vía respiratoria superiorLa prevalencia de RSCcPN aumenta con la edad, predomina entre la 4ª – 5ª década de la vida, es más frecuente en hombres93,94 y se asocia de forma característica con el asma de inicio tardío. De hecho, más del 65% de los pacientes con RSCcPN tienen asma y la comorbilidad con asma tiende a asociarse con una enfermedad nasosinusal y pulmonar más graves, con mayor tamaño de los pólipos nasales, recurrencia posquirúrgica, frecuente necesidad de GCS, peor calidad de vida y peor control del asma. La ocupación nasosinusal en la TC medida por el índice de Lund-Mackay se correlaciona con un peor control del asma por ACT93.
Por otro lado, hasta el 40-45% de los pacientes con AG tienen RSCcPN con predominio en los no atópicos93,95. Junto con la PN y el inicio tardío del asma, otra comorbilidad que identifica al AG es la EREA, que también es una enfermedad de inicio tardío. La EREA ocurre en más de un 16% de los pacientes con RSCcPN y la frecuencia aumenta a mayor gravedad del asma y de la PN96. La clásica triada de AG, PN y EREA constituye la forma más grave de asma de tipo 292.
El tabaco se ha asociado a una mayor frecuencia de RSC y especialmente de RSCsPN91.
Aunque la RA es una comorbilidad que puede estar presente en los pacientes con AG, los niveles elevados de IgE total observados en la RSCcPN son independientes de la atopia93 y es una consecuencia de la alteración del microbioma por la colonización del Staphylococcus aureus, cuyas enterotoxinas (SE) inducen una producción policlonal local y sistémica de IgE y también de IgE específica anti-enterotoxinas del Staphylococcus aureus (anti-SE). La anti-SE se ha demostrado como un factor de riesgo de desarrollo de AG97–99.
Evaluación de la vía respiratoria superior en el fenotipado del asma grave para la selección de candidatos a un tratamiento biológicoLa evaluación inicial de un paciente con AG incluye la ACT y las exacerbaciones, la necesidad de medicación de rescate y de GCS, valores espirométricos y la FENO, así como la determinación de Eos en sangre. Además, debe incluir la existencia de afectación de vía respiratoria superior, especialmente RSCcPN o RSCsPN, EREA y constatar el uso de glucocorticoides intranasales.
En el manejo de las enfermedades de la VRU y especialmente del AG con RSCcPN es crucial un manejo multidisciplinar, de neumólogos junto con alergólogos y otorrinolaringólogos (ORL), y establecer una metodología consensuada100,101 en la evaluación de síntomas (incluido el olfato), las pruebas complementarias y los test diagnósticos, que permita una comunicación fluida entre especialistas. La contribución del ORL es esencial para confirmar el diagnóstico y para evaluar la necesidad de cirugía endoscópica nasosinusal (CENS) así como en el seguimiento. El diagnóstico precoz de la RSCcPN facilita un tratamiento adecuado y puede disminuir la necesidad de GCS y un mejor control del asma. El tratamiento se basa en el uso de glucocorticoides intranasales, y según la gravedad, GCS en ciclos cortos, CENS y finalmente la opción terapéutica de los mAbs100.
En la RSCcPN asociada al AGNC, es esencial la demostración endoscópica antes de iniciar un tratamiento biológico 100 y la evaluación de su gravedad por escala visual-analógica (EVA) o por su impacto en la calidad de vida mediante el cuestionario Sinonasal Outcome Test-22 (SNOT-22)102. La EVA es la forma más simple de evaluar la gravedad que se ha validado en tres niveles: leve (0-3), moderada (> 3-7) y grave (> 7-10), demostrándose que correlaciona bien con cuestionarios de calidad de vida como el SNOT-22. Este cuestionario validado permite interpretar las puntuaciones obtenidas desde un punto de vista clínico, ya que se ha determinado el valor de la mínima diferencia relevante para el paciente que es 8,9 puntos103, y valorar los niveles de gravedad en tres grados: leve (8-20 puntos), moderada (> 20-50 puntos) y grave (> 50 puntos)104. Además, puede predecir qué pacientes se beneficiarán más de cirugía (probabilidad mayor de un 75% de mejorar más de un 45%) con un SNOT-22 preoperatorio> 30 puntos105.
La guía POLINA aconseja realizar TC nasosinusal en caso de sospecha de diagnóstico alternativo y/o candidatos a CENS.
La identificación de comorbilidades de asma como RSCcPN, alergia o EREA conlleva una probabilidad cercana al 100% de identificar endotipo inflamatorio T266,100.
En ausencia de estas comorbilidades la evaluación de eosinofilia, FENO e IgE total ayudan a identificar la presencia de inflamación T2.
Se han propuesto criterios de indicación de mAb100,106,107, en pacientes con RSCcPN grave (EVA> 7 y/o SNOT-22> 50) intervenida previamente mediante CENS junto con alguna de las siguientes condiciones: evidencia de inflamación T2, comorbilidad con asma y/o EREA, necesidad de GCS de mantenimiento o> 2 ciclos/último año, recurrencia postquirúrgica, hiposmia grave/anosmia (EVA> 7) o afectación importante de la calidad de vida. El diagnóstico de RSCcPN en un paciente con AG puede ser decisivo para iniciar, elegir o cambiar un mAb. Actualmente omalizumab108, mepolizumab109 y dupilumab110, están aprobados para el tratamiento de la RSCcPN, y los dos últimos además ya financiados en España.
Asimismo, de forma análoga al asma, se ha introducido el concepto de control en el manejo de la RSCcPN, necesario en la valoración de la respuesta al tratamiento.100 Tanto en la RSCcPN como en el asma, es importante disponer de una herramienta que permita valorar la respuesta a fármacos mAbs. Además del ACT, la necesidad de GCO y la ausencia de exacerbaciones, en las guías EUFOREA, EPOS y POLINA 2.0 existen propuestas aún no validadas,66,67,100 como la mejoría de los síntomas incluidos la disfunción del olfato, la congestión nasal, el tamaño del pólipo, o la calidad de vida medida por el SNOT-22 (tabla 7). En cualquier caso, se considera la RSCcPN mal controlada cuando el paciente tiene EVA> 7 y SNOT-22>50.
Se recomienda la evaluación a los seis y a los 12 meses. El tratamiento con el mAb debe continuarse si la enfermedad está controlada o parcialmente controlada y el tratamiento es aceptado por el paciente. Cuando el médico o el paciente consideran que la enfermedad no está controlada el mAb debe suspenderse, se prescribirá un ciclo corto de GCS, se recomienda reevaluar al paciente según escenarios indicados en la figura 2.
En este sentido, un grupo de trabajo formado por redactores de GEMA y POLINA han identificado ocho posibles escenarios de tratamiento combinado en pacientes con AG y RSCcPN 111 recogidos en la figura 2.
Otras comorbilidades y enfermedades relacionadas con el asma graveAlgunas comorbilidades pueden contribuir a la falta de control del asma y su identificación y tratamiento pueden reducir los síntomas del paciente112. Dejando a un lado la patología de la vía aérea superior, las más importantes serían:
- •
Obesidad. La obesidad (índice de masa corporal ≥ 30 kg/m2) es común en pacientes con AG. Los asmáticos obesos tienen una carga de enfermedad mayor y en caso de presentar marcadores inflamatorios tipo 2, son subsidiarios de los mismos tratamientos biológicos, si bien hay que incidir en la pérdida de peso113.
- •
Apnea obstructiva del sueño (AOS). La AOS es común en los pacientes y comparte con el asma ciertos factores predisponentes114. Se sugiere la realización de poligrafía/polisomnografía en pacientes con síntomas y características clínicas sugestivas de AOS, particularmente cuando los síntomas nocturnos de asma son persistentes. El tratamiento con una presión positiva continua en las vías respiratorias (CPAP) mejora el control del asma115.
- •
Trastornos psiquiátricos. Los pacientes con AG tienen más prevalencia de trastornos psiquiátricos, especialmente ansiedad y depresión, que la población general116, pero no está claro si son realmente factores de riesgo o consecuencia de tener un AG117.
- •
Tabaquismo. Los asmáticos que fuman tienen un mayor riesgo de sufrir exacerbaciones, tienen una función pulmonar más deteriorada y responden mal a los GCI. Es evidente que se debe hacer todo lo posible para que el asmático deje de fumar.
- •
Enfermedad por reflujo gastroesofágico (ERGE). La ERGE se observa comúnmente en pacientes con AG, pero sigue siendo controvertido si su tratamiento mejora el asma118.
- •
Bronquiectasias (BQ). Los pacientes con BQ suelen tener como principal síntoma tos y la producción de esputo, que suele ser mayor de lo que se esperaría en el asma sin BQ. La TC de alta resolución del tórax ayudará a su diagnóstico. Las BQ en el AG se asocian con inflamación eosinofílica y degranulación de los Eos119.
- •
Obstrucción laríngea inducible (OLI) (movimiento paradójico de las cuerdas vocales). Este síndrome implica el cierre involuntario de las cuerdas vocales, comúnmente durante la inspiración, y puede observarse tanto en hombres como en mujeres. Los síntomas incluyen dificultad para respirar episódica y grave, sibilancias y tos intratable, a menudo en respuesta a exposiciones irritantes (perfumes) o ejercicio. A menudo se confunde con AG, aunque algunos pacientes pueden tener ambas enfermedades. Su diagnóstico es complicado y se puede realizar mediante una laringoscopia/broncoscopia durante los síntomas o tras prueba de provocación bronquial120.
- •
Aspergilosis broncopulmonar alérgica (ABPA). La sensibilización por hongos es muy prevalente en el AG121. La ABPA consiste en una reacción de hipersensibilidad causada por la colonización bronquial por Aspergillus fumigatus que afecta fundamentalmente a pacientes con asma y/o fibrosis quística122 y típicamente se presenta con mal control del asma, impactación mucoide recurrente y atelectasia. La reacción inmunológica resultante puede conducir a BQ proximales. Se debe sospechar ABPA en pacientes con AGNC, sensibilización a Aspergillus y niveles elevados de IgE total (> 1.000 ng/mL). Los criterios diagnósticos más utilizados son los de la ISHAM 2013 (actualizados en 2016)123 y más recientemente Asano et al. proponen unos criterios más sensibles y específicos aplicables para ABPA y otras micosis broncopulmonares alérgicas124.
- •
Deficiencia de alfa-1 antitripsina (DAAT). La DAAT es uno de los trastornos autosómicos más comunes y poco reconocidos asociados con un mayor riesgo de desarrollar enfermedades hepáticas y pulmonares. Se ha observado una asociación entre la DAAT y el asma, especialmente con las formas graves de esta enfermedad125, si bien con una gran variabilidad en la prevalencia de asma en los pacientes con DAAT126. El mecanismo patogénico que subyace en la relación de estas dos entidades aún no se conoce bien. Se ha planteado la hipótesis de que el vínculo entre la DAAT y el asma podría estar representado por el desequilibrio elastasa/anti-elastasa y el efecto proinflamatorio que ocurre debido a la reducción de esta proteína127. Los pacientes con DAAT suelen presentar síntomas similares al asma en población general. Las alteraciones funcionales pueden ser comunes a ambos, como la HRB o la obstrucción fija al flujo aéreo. Aunque esta obstrucción fija o irreversible en pacientes con asma en la mayoría de los casos es secundaria a la remodelación, en algunos casos puede ser consecuencia de la DAAT. La DAAT podría provocar un desequilibrio entre factores proinflamatorios y antiinflamatorios que llevaría a que los sujetos con asma bronquial y DAAT desarrollaran un mal control de los síntomas y mayores tasas de exacerbaciones128.
- •
Excesivo colapso dinámico de la vía aérea-traqueomalacia. La traqueobroncomalacia (TBM) y el colapso dinámico excesivo de las vías aérea (CDEVA) son anomalías de las vías respiratorias que comparten una característica común de estrechamiento espiratorio, pero son entidades fisiopatológicas distintas. La malacia o debilidad del cartílago que sostiene el árbol traqueobronquial puede ocurrir solo en la tráquea (traqueomalacia), solo en los bronquios (broncomalacia), o tanto en la tráquea como en los bronquios (TBM). Por otro lado, CDEVA se refiere a la excesiva curvatura anterior de la membrana posterior hacia la luz de las vías respiratorias con el cartílago intacto129. El diagnóstico clínico a menudo se ve retrasado por comorbilidades, entre las que se incluye el asma. La afectación de las vías respiratorias de pequeño tamaño en pacientes con asma produce una disminución de la presión en la vía aérea que, junto con el aumento de la presión pleural durante la espiración (acentuada en pacientes con obesidad mórbida), conduce a un aumento del gradiente de presión transmural. Durante la espiración las vías respiratorias grandes se colapsan, lo que resulta en CDEVA129. En la mayoría de los casos, el tratamiento inicial es médico y se centra en el tratamiento de afecciones comórbidas subyacentes, como el asma130.
- •
Inmunodeficiencias. La deficiencia de anticuerpos es una de las condiciones de inmunodeficiencia más comunes. Las presentaciones habituales de deficiencia de anticuerpos incluyen hipogammaglobulinemia, inmunodeficiencia común variable (IDVC) y la deficiencia de anticuerpos específica131. En estudios que han evaluado las comorbilidades respiratorias en pacientes con IDVC, se encontró que la prevalencia de asma era de hasta el 18%. Se ha detectado una mayor prevalencia de HRB y asma en pacientes con IDVC en comparación con la población general. La mayoría de los pacientes presentan un perfil no atópico y no eosinofílico132.
- •
Hay que tener en cuenta que los pacientes con asma son más susceptibles a infecciones respiratorias virales y microbianas prolongadas, debido a la alteración de la inmunidad innata y adaptativa, lo que podría retrasar la detección de cualquier inmunodeficiencia humoral133. La IDVC podría ser una patología oculta en pacientes con AGNC.
De esta manera, según el panel de expertos las recomendaciones sobre este tema son:
El fenotipado del AGNC debe incluir siempre la evaluación de la vía respiratoria superior.
La evaluación inicial en todo paciente con AG debe incluir la presencia de afectación de vía aérea superior, especialmente RSC (con o sin pólipos nasales [PN]) y de EREA.
El diagnóstico de RSCcPN debe realizarse mediante la valoración de los síntomas nasales (incluyendo la pérdida de olfato) y la endoscopia nasal.
La coexistencia de RSCcPN, alergia o EREA permite la identificación del endotipo T2.
El tratamiento integral de la vía respiratoria en el AG con RSCcPN requiere unos criterios comunes de evaluación por todos los profesionales (neumólogos, ORL, alergólogos).
Se recomienda descartar el déficit de alfa-1 antitripsina en todo paciente con AGNC, sobre todo si presenta obstrucción al flujo aéreo y/o exacerbaciones.
Se recomienda descartar TBM o colapso excesivo dinámico de las vías respiratorias en pacientes con AGNC con síntomas persistentes a pesar de recibir un tratamiento acorde a su nivel de gravedad si no hay otra causa que lo justifique.
Se recomienda descartar una inmunodeficiencia en los pacientes con AGNC que presenten exacerbaciones frecuentes de perfil infeccioso.
Tratamiento del asma graveIntroducciónEl objetivo principal del tratamiento del asma es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones y la obstrucción crónica al flujo aéreo y reducir al máximo su mortalidad y los efectos secundarios de la medicación1. Tras la introducción de los fármacos biológicos para el tratamiento del AGNC, se han elaborado las escalas de respuesta (EXACTO, FEOS)65,71 referidas anteriormente, que pueden ser útiles para determinar la evolución del paciente y ayudar a tomar la decisión de mantener o no el tratamiento. Además, recientemente se ha ampliado el paradigma de respuesta al tratamiento con el concepto de remisión (clínica o completa)44. Actualmente se cree que la remisión clínica o completa puede ser un objetivo alcanzable del tratamiento134.
Algunos estudios en vida real sugieren la necesidad de no demorar el tratamiento con biológicos en pacientes con AG antes de que se produzca un deterioro significativo e irreversible de la función pulmonar (no siempre como consecuencia de exacerbaciones repetidas) y antes de iniciar el tratamiento a largo plazo con corticosteroides orales135–141.
En la figura 3 se muestra el algoritmo terapéutico del AG y en la figura 4 el algoritmo en tratamiento crónico con GCO.
Algoritmo terapéutico del AGNC.
ACT: Asthma Control Test; ACQ: Asthma Control Questionnaire; AGNC: asma grave no controlada; BENRA: benralizumab; DUPI: dupilumab; Eos: eosinófilos; FENO: fracción exhalada de óxido nítrico; FVC: capacidad vital forzada; GCI: glucocorticoides inhalados; GEPA: granulomatosis eosinofílica con poliangeítis; Ig: inmunoglobulina; LABA: agonistas β2 adrenérgicos de larga duración; MEPO: mepolizumab; OMA: omalizumab; PMNn: neutrófilos polimorfonucleares; RESLI: reslizumab; RSCcPN: rinosinusitis crónica con poliposis nasal; SHE: síndrome hipereosinofílico; TAI: test de adhesión a inhaladores; TEZE: tezepelumab.
(1) Si eosinofilia>500 Eos/μL, considerar benralizumab y mepolizumab como primeras opciones; (2) si eosinofilia 300-500 Eos/μL y FENO ≥50 ppb, considerar dupilumab como primera opción; (3) si eosinofilia>1.000 Eos/μL, considerar una opción distinta a dupilumab; (4) benralizumab si eosinofilia ≥150 Eos/μL con al menos uno de los siguientes: uso de corticosteroides orales de mantenimiento, RSCcPN ≥3 exacerbaciones en el año anterior, FVC <65% previsto; (5) dupilumab si FENO ≥50 ppb. Cuando los fármacos biológicos están a igual nivel se ordenan alfabéticamente y no es indicativo de orden de elección.
Algoritmo terapéutico del AGNC en tratamiento crónico con GCO.
ACT: Asthma Control Test; ACQ: Asthma Control Questionnaire; AGNC: asma grave no controlada; BENRA: benralizumab; DUPI: dupilumab; EVA: escala visual analógica; FENO: fracción exhalada de óxido nítrico; GCS: glucocorticoides sistémicos; MEPO: mepolizumab; OMA: omalizumab; SNOT-22: cuestionario de síntomas nasales.
Cuando los fármacos biológicos están a igual nivel se ordenan alfabéticamente y no es indicativo de orden de elección.
Definiciones:
AGNC: asma que precisa tratamiento con GCI dosis altas +LABA y LAMA y presenta ≥1 de los siguientes criterios:
• ACT <20 o ACQ>1,5
• ≥2 ciclos de glucocorticoides orales (GCO) de ≥3 días de duración en el año previo
• ≥1 ingreso hospitalario por agudización asmática en el año previo
• FEV1 ≤80% de esperado
Inflamación refractaria de T2: ≥1 de los siguientes criterios mientras el paciente usa GCO diarios:
• ≥150 Eos por microlitro en sangre
• FENO ≥25 ppb (American Thoracic Society Committee)
• ≥2% de Eos en esputo
• El asma está clínicamente provocada por alérgenos
Los GCO a menudo suprimen los biomarcadores de la inflamación de Tipo 2 (Eos en sangre, Eos en esputo y FENO). Por lo tanto, si es posible, estas pruebas se deben realizar antes de comenzar un curso corto o tratamiento de mantenimiento con GCO, o cuando el paciente esté con la dosis más baja posible de GCO.
Umbrales de eosinofilia en sangre: al menos una determinación de más de 300 Eos/μL en el último año. En pacientes tratados con corticoides sistémicos de forma crónica o recientemente pueden aparecer cifras bajas de Eos. En este caso puede ser de utilidad revisar valores históricos.
Umbrales de FENO. El punto de corte se establece en 25 ppb. No obstante, se debe considerar que la medida de FENO puede verse alterada por la toma reciente de corticoides sistémicos y la dosis total de corticoides inhalados, por la edad y tabaquismo (niveles más bajos en fumadores). Si aparecen niveles altos de FENO, verificar que el paciente se autoadministra correctamente la medicación inhalada (adhesión terapéutica y técnica inhalatoria).
Respuesta a fármaco biológico (escalas multidimensionales EXACTO y FEOS)
Elección entre mAbs
El orden en que aparecen los biológicos en el esquema, cuando coinciden en una indicación, obedece solo al tiempo que llevan comercializados.
En la elección deben considerarse: el recuento de Eos en sangre, la función pulmonar, el uso de corticoides orales de mantenimiento, la presencia de comorbilidades: poliposis nasal/EREA, urticaria crónica, dermatitis atópica y enfermedades asociadas a asma (granulomatosis eosinofílica con poliangeítis [GEPA], neumonía eosinófila, ABPA, esofagitis eosinofílica).
• Benralizumab (mayor eficacia>300 Eos/μL): pacientes con mala función pulmonar, poliposis, corticoides orales de mantenimiento y dificultad para acceder a unidad de asma.
• Reslizumab (mayor eficacia>400 Eos/μL): mejora la función pulmonar. No hay ensayos clínicos que demuestren que sea eficaz para reducir la dosis de GCO. Administración intravenosa.
• Mepolizumab (su indicación es a partir de 150 Eos/μL, pero mayor eficacia>500 Eos/μL): indicado en pacientes con>150 Eos /μL si existen valores históricos de>300 Eos/μL. Se ha demostrado que permite reducción o retirada de GCO.
• Dupilumab (mayor eficacia>300 Eos/μL y FENO>50 ppb): mejora la función pulmonar, la poliposis nasal y la dermatitis atópica grave. Se ha demostrado que permite reducción o retirada de GCO y aumenta los valores de Eos. La administración es quincenal. Según IPT, posible indicación en todos los pacientes corticodependientes.
• Tezepelumab según IPT está indicado en el asma grave no controlada, independientemente del valor de biomarcadores.
Para elegir entre fármacos con potencial eficacia en un determinado paciente, se deben considerar criterios de comodidad posológica (preferible mensual/bimensual en lugar de quincenal), vía de administración (preferible subcutáneo a intravenoso) y costes.
La termoplastia está indicada en pacientes sin enfisema/bronquiectasias/atelectasias ni comorbilidades importantes. Sin tratamiento con anticoagulantes o inmunosupresores y que no presenten infecciones recurrentes. La FEV1 debe ser mayor de 40% y no debe haber contraindicación para BFC con sedación.
De acuerdo con los criterios de AG, estos pacientes estarán recibiendo un tratamiento de mantenimiento con una combinación de GCI/LABA a dosis elevadas, correspondiente al escalón 5 del tratamiento del asma según la GINA o 5-6 según la GEMA1,2. Si existe control insuficiente de la enfermedad, se añadirá por lo menos uno de los siguientes fármacos: LAMA1,2,142–144, antileucotrieno145 o azitromicina146,147. En caso de AGNC se estudiará el fenotipo del paciente para establecer la indicación de mAbs. La elección del tratamiento debe tener en cuenta las opciones terapéuticas más efectivas, la seguridad, el coste de las distintas alternativas y la satisfacción del paciente con el nivel de control alcanzado2.
Las recomendaciones formuladas en relación con estos tratamientos son: en el asma persistente grave se recomienda como tratamiento de elección un GCI a dosis altas en combinación con un LABA, correspondiente al escalón 5 de la GINA o escalón terapéutico 5-6 de la GEMA.
El tratamiento general del AGNC incluye la prescripción de los fármacos recomendados en los escalones 5 y 6 (combinación de GCI/LABA a dosis elevadas y LAMA); valorar asociar de forma individualizada otras opciones terapéuticas (antileucotrienos o azitromicina).
En un paciente con AGNC en tratamiento con GCI a dosis media + LABA, añadir un LAMA es la primera opción en determinados casos, antes de escalar a dosis altas de GCI + LABA.
En todos los casos es necesario un correcto programa de educación de asma, tratamiento de las comorbilidades / agravantes y prevención / tratamiento de los efectos secundarios de los GCO (actualmente último recurso terapéutico según la GEMA y la GINA)1,2. En los últimos años diversos estudios han demostrado la eficacia de la triple terapia en un único inhalador, incluyendo diferentes combinaciones de fármacos148,149.
Tratamiento de las comorbilidadesEn el caso de haberse confirmado la existencia de una comorbilidad o agravante, se iniciarán las oportunas medidas terapéuticas. Entre las comorbilidades y factores agravantes más frecuentes se debe tener presentes la obstrucción laríngea inducible; factores psicológicos como ansiedad y depresión; el consumo de fármacos como AINE, betabloqueadores no selectivos o inhibidores de la enzima convertidora de la angiotensina (IECA); fibromialgia; hipertiroidismo; menstruación/menopausia; obesidad; reflujo gastroesofágico; RA y RNA, RSC con o sin PN; síndrome de hiperventilación; AOS; tabaquismo; BQ, ABPA, traqueomalacia y otras traqueopatías, enfermedades cardiovasculares y metabólicas1,150–160.
Manejo de los glucocorticoides sistémicos. Evaluación indicaciones, efectos secundarios y pauta de reducciónDurante mucho tiempo los pacientes con AGNC a pesar de tratamiento con GCI, LABA y un tercer fármaco, han sido tratados con GCS (orales o intramusculares). La guía GEMA recomienda el uso de GCS exclusivamente como última opción terapéutica en aquellos pacientes que ya están en un escalón 6 de tratamiento y en los que todas las otras medidas terapéuticas han resultado ineficaces para controlar el asma o para reducir el número de exacerbaciones1. Los pacientes respondedores a GCS suelen tener inflamación T2, mientras que el asma no T2 suele tener pobre respuesta, incluso a dosis altas161,162. También hay que tener en cuenta que algunos pacientes, especialmente obesos y/o fumadores, pueden presentar «insensibilidad a los glucocorticoides»163. Un estudio mostró que la inyección intramuscular de triamcinolona mejora el control, reduce la cantidad de Eos en el esputo, aumenta el FEV1 y previene las exacerbaciones en algunos de estos pacientes164. Dada la ausencia de más evidencia, habría que limitar su uso a casos excepcionales.
Es importante evaluar la respuesta a los GCS ya que varía considerablemente entre pacientes165. En este sentido, un panel de expertos internacionales consensuó que, si la indicación es reducir el número de exacerbaciones, la respuesta deberá evaluarse en un periodo no inferior a seis meses y, si la indicación ha sido la mejoría de síntomas, la respuesta puede evaluarse entre uno a tres meses una vez iniciado el tratamiento166.
Actualmente existe una gran variabilidad en la dosis y duración del tratamiento y una revisión sistemática publicada por Cochrane (18 ensayos clínicos; n=2438 pacientes), concluyó que la evidencia sobre el mejor esquema de tratamiento con GCS es aún débil167. Los problemas asociados con el tratamiento con GCS a largo plazo están bien establecidos e incluyen alteraciones cardiovasculares y metabólicas (obesidad, hipertensión arterial, hipercolesterolemia y diabetes), osteomusculares (osteoporosis, fracturas, sarcopenia), alteraciones psiquiátricas y síndrome de Cushing, además de restricción del crecimiento lineal en los niños. Sin embargo, los datos sobre los EA del uso de GCS en AG son limitados, en su mayoría extraídos de estudios retrospectivos que no están específicamente diseñados para los EA a largo plazo. Muchos EA importantes se asocian también con el uso de GCS a corto plazo en las exacerbaciones del asma (insomnio, náuseas, distensión abdominal, dispepsia, malestar general, vértigo, cefalea y, especialmente en niños, cambios conductuales)168,169. Independientemente del uso de GCS de forma fija o en ciclos, la mayoría de los autores coinciden en que la dosis de GCS acumulada anual no debería de sobrepasar los 0,5-1 g170. Price et al.171 observaron que la diabetes asociada con el uso de GCS se presentaba con dosis acumuladas de 0,5-1 g y que la mayoría de los demás EA se daban con dosis de 1-2,5 g/año. Bourdin et al.172 indican que una dosis acumulada anual> 1 g debe considerarse inaceptable e indican la necesidad de derivación de estos pacientes a unidades especializadas en AG.
Se debe plantear la retirada de GCS cuando se constata que el tratamiento no es efectivo. Aunque, por ejemplo, la GINA recomienda dosis de mantenimiento no superiores a 7,5 mg/día2 y por tanto el proceso de retirada debería ser simple, la realidad es que, en general, se usan dosis muy superiores, que de media pueden llegar a los 22 mg/día173. En los pacientes tratados durante un tiempo prolongado con dosis fijas altas de GCS se debe ser especialmente cauto al intentar su retirada con el fin de evitar la aparición de una insuficiencia suprarrenal (IA) no conocida171,174 que requiera tratamiento sustitutivo175. En el ritmo y velocidad de la reducción/retirada de los GCS deben tenerse en cuenta múltiples factores (duración del tratamiento con GCS, presentación de EA o riesgo de presentarlos y el tipo de EA)166,170. El riesgo de IA es mayor con dosis> 5 mg/día de prednisona (o equivalente) durante> 4 semanas y la recuperación es impredecible, pero generalmente tarda varios meses, lo que requiere un régimen lento de suspensión de GCS. En los pacientes que hayan recibido una dosis acumulada de GCS> 2 g en el último año, debe realizarse un estudio de cortisol plasmático basal a las 8 de la mañana cuando se quiera reducir la dosis de GCS ˂ 5 mg/día170.
Recientemente se ha propuesto una pauta de retirada en pacientes que han sido tratados con benralizumab basada en las dosis de base de GCS que tomaban y los niveles de cortisol plasmático obtenidos al llegar a dosis de 5 mg/día (valores de cortisol menores de 5 μg/dL o 100 mmol/L indica una IA)176.
- •
Dosis diaria de GCS> 20 mg/día, se debe reducir la dosis en 5 mg/día de forma semanal hasta llegar a la dosis diaria de 20 mg.
- •
Dosis diaria de GCS> 10 mg/día hasta los 20 mg/día, se debe reducir la dosis en 5 mg/día de forma quincenal hasta llegar a la dosis diaria de 10 mg.
- •
Dosis diaria de GCS> 7,5 mg/día hasta los 10 mg/día, se debe reducir la dosis en 2,5 mg/día de forma quincenal hasta llegar a la dosis diaria de 7,5 mg.
- •
Dosis diaria de GCS> 5 mg/día hasta los 7,5 mg/día se debe reducir la dosis en 2,5 mg/día de forma mensual hasta llegar a la dosis diaria de 5 mg.
Los pacientes tratados con GCS también deben evaluarse periódicamente en base a la prevención de posibles EA. Durante el primer año de su administración y probablemente de forma evolutiva, cada tres a seis meses debería monitorizarse la presión arterial, el sobrepeso, y la glucemia. También debería monitorizarse la posible afectación del sistema óseo, ocular y digestivo175,177.
En España el 4,4% de los pacientes que usan GCS lo hacen por padecer asma178.
En este sentido, un panel de expertos internacionales consensuó las recomendaciones para su uso, teniendo como objetivo que este porcentaje no aumente o incluso disminuya, serían:
El tratamiento con GCO debe reservarse para pacientes con AGNC en los que todos los demás tratamientos, incluidos los mAbs, fármacos biológicos, hayan fracasado, como último escalón terapéutico, a la dosis más baja eficaz y durante el mínimo tiempo posible.
En los pacientes que se opte por tratamiento con GCS de mantenimiento y también en aquellos en los que se prescriben ciclos de forma frecuente, las dosis acumuladas anuales deben ser especialmente monitorizadas, intentando no superar la dosis de 1 g/año.
La retirada de GCS debe ser gradual e intentando prevenir la aparición de IA.
Los ciclos frecuentes de GCO se asocian a riesgo de efectos secundarios.
Si bien no existe evidencia robusta para recomendar el uso de triamcinolona en el tratamiento del AGNC, se podría considerar su empleo en pacientes corticodependientes bien seleccionados.
Es aconsejable determinar el cortisol plasmático en pacientes en tratamiento con GCS con dosis acumulada ≥ 1 g/año.
Es aconsejable determinar el cortisol plasmático en pacientes en tratamiento con GCS de mantenimiento en cualquier dosis durante> 6 meses al año.
Otros tratamientos para el asma graveMacrólidosEn un alto porcentaje de pacientes con asma no se consigue el control de la enfermedad a pesar de usar dosis altas de GCI asociados a un LABA y/o a un tercer controlador. En estos casos, diversas GPC proponen el uso de macrólidos, en especial la azitromicina, aprovechando el efecto inmunomodulador de estos1–3.
Un estudio inicial usando dosis de 250 mg de azitromicina tres días a la semana (Estudio AZISAST) evidenció que se mejoraba la calidad de vida pero que no se reducían el número de exacerbaciones179. Sin embargo, Gibson et al. (Estudio AMAZES)180 observaron que usando 500 mg, también tres días a la semana durante al menos 48 semanas, se conseguía mejorar la tos, el FEV1 y reducir de forma significativa el número de exacerbaciones. En este sentido, un metaanálisis reciente ha evidenciado que efectivamente la administración de azitromicina puede ser útil en estos pacientes al disminuir no solo el número de exacerbaciones, sino también el uso de GCS tanto en pacientes con respuesta T2 como no T2181,182. Los autores argumentan además que, al ser un fármaco económico, la relación coste/beneficio es favorable y que, en general, fue bien tolerado en todos los estudios182. El control de la desregulación del TNF que se observa en pacientes con asma especialmente neutrofílica, parece que podría ser el mecanismo por el cual la azitromicina es útil en estos pacientes183. Además, se ha propuesto que la azitromicina puede tener una importante acción beneficiosa al evitar la remodelación bronquial aumentando tanto el diámetro como el área de la luz bronquial, aunque no se ha podido evidenciar que disminuya el grosor de la pared bronquial184. Se puede intentar tratamiento con azitromicina en pacientes mal controlados con triple terapia, especialmente si no reúnen criterios para un tratamiento biológico y cuando el objetivo terapéutico principal sea la reducción de las exacerbaciones.
TermoplastiaLa termoplastia bronquial es un tratamiento endoscópico aprobado para el tratamiento del AGNC desde 2010 para pacientes mayores de 18 años tratados con GCI a dosis altas y LABA. Consiste en la aplicación de calor a la mucosa de la pared bronquial mediante radiofrecuencia para reducir la masa de músculo liso bronquial con el fin de conseguir una reducción de la HRB, una disminución de las exacerbaciones y mejorar la calidad de vida de los pacientes con asma185.
Desde el punto de vista clínico se han desarrollado cuatro ensayos clínicos, tan solo uno controlado con placebo, que han puesto de manifiesto que la termoplastia consigue un mejor control del asma, reducir las exacerbaciones y mejorar la calidad de vida186–189. El efecto sobre el FEV1 es dudoso, ya que tan solo uno de estos estudios demostró una mejoría de este187. Los cuatro estudios demostraron que se trata de un procedimiento seguro y a los cinco años de seguimiento no se ha observado incremento en las hospitalizaciones por eventos respiratorios ni tampoco deterioro de la función pulmonar186–189. Además, el estudio de Chupp et al.189 demuestra una disminución del uso de GCS a los cinco años del procedimiento. Diversos estudios farmacoeconómicos han evidenciado que se trata de un procedimiento eficiente para el tratamiento de estos pacientes190,191.
El estudio TASMA, un ensayo clínico destinado básicamente a comprobar los efectos de la termoplastia en el músculo liso bronquial, ha puesto de manifiesto que la termoplastia reduce la masa de músculo liso cuando se compara de forma aleatorizada a pacientes en los que se aplica o no este tratamiento. Sin embargo, si bien se constataron efectos clínicos beneficiosos en los pacientes tratados, estos beneficios se relacionaron con los niveles de IgE y el número de Eos, pero no con la masa de músculo liso bronquial192.
Actualmente, tanto la GEMA1 como la GINA2 contemplan la termoplastia como opción terapéutica en el último escalón de tratamiento cuando no se consigue el control del asma con otros tratamientos. Probablemente para que esta terapia sea exitosa se debe seleccionar adecuadamente a los pacientes, en lo que, según el acrónimo inglés, se ha denominado las tres «I»: Identification, Implementation e Intense follow-up193.
De esta manera, según el panel de expertos las recomendaciones sobre este tema son:
La termoplastia podría ser recomendable en pacientes con fenotipos de AGNC no subsidiarios de tratamiento con mAbs, o en los que estos hayan fracasado, en UA con experiencia y pacientes sin contraindicación para la técnica.
Anticuerpos monoclonales disponibles actualmenteOmalizumabEs un mAb aprobado para pacientes con ≥ 6 años con asma alérgica persistente de moderada a grave, con sensibilización a un alérgeno perenne, con valores de IgE en sangre> 30 UI/mL y no controlados con GCI a dosis altas + LABA194. Evita la unión de la IgE a los receptores de alta y baja afinidad195. Se administra por vía subcutánea (s.c.) y la dosis (máxima de 1.200 mg/mes) se ajusta por peso y concentración de IgE en sangre periférica. Tanto la evidencia clínica196–199 como los estudios en vida real194,200–206 avalan sus resultados. Mejora las exacerbaciones, la calidad de vida, el consumo de GCO y del FEV1. En un análisis post hoc se agruparon los datos de adolescentes de 12 a 17 años de ocho ensayos aleatorios de omalizumab196,198,207–212. En global se observó una mejoría estadísticamente significativa en el FEV1 de 120,9 mL (3,0%) y de 101,5 mL en la capacidad vital. forzada208 Un estudio reciente (estudio CHOC) aleatorizado abierto realizado en asmáticos corticodependientes ha demostrado la reducción de uso de GCS por un lado y por otro la reversibilidad del remodelado bronquial213.
Diversos estudios indican la utilidad de este fármaco en pacientes con niveles altos de Eos en sangre periférica214,215. Han seguido publicándose estudios en vida real avalando la seguridad del fármaco y su efectividad para conseguir un mejor control de pacientes asmáticos e insinuando su utilidad en pacientes con solapamiento asma-EPOC, aunque no eran ensayos controlados con placebo216,217.
Una evaluación de estudios en vida real de duración comprendida entre 48 semanas y nueve años ha demostrado que omalizumab mejora la calidad de vida de pacientes con asma no controlada moderada/grave y que esta mejoría se mantiene en el tiempo218. Así mismo, estudios en vida real recientes indican que este fármaco puede hacer alcanzar una respuesta completa en pacientes con AG alérgica219 e incluso en pacientes sin base atópica220. Esto se corresponde con los beneficios histológicos observados en el estudio CHOC, estudio publicado que muestra la capacidad de revertir el remodelado con un fármaco biológico213.
El registro EXPECT recogió información de 250 mujeres embarazadas (64,9% con AG y 35,1% con asma moderada) que habían recibido al menos una dosis de omalizumab durante el embarazo o en las ocho semanas previas a la concepción, y se compararon con datos de una cohorte de 1153 mujeres de Quebec (Canadá) (21,2% AG y 78,8% con asma moderada) sin tratamiento biológico. No hubo evidencia de un mayor riesgo de anomalías congénitas entre las mujeres embarazadas expuestas a omalizumab por lo que su uso durante el embarazo no está asociado con un mayor riesgo221. Por último, la indicación en RSCcPN de omalizumab ha sido aprobada por la Food and Drugs Administration (FDA) desde diciembre de 2020, tras los resultados de los ensayos realizados en esta patología222.
MepolizumabEs un mAb bloqueador de la IL-5 circulante (anti-IL-5) aprobado para pacientes de> 6 años con asma eosinofílica no controlada con Eos de> 500 o <500 (con valores históricos> 300) con dos exacerbaciones graves o una hospitalización en el año previo. Ha demostrado disminución del número de exacerbaciones223,224, siendo más eficaz en pacientes con más de 500 Eos/μL, aunque también se ha observado eficacia en pacientes con ≥ 300 Eos/μL en sangre en el último año o con ≥ 150 Eos/μL en el momento del tratamiento, pero con controles históricos de eosinofilia ˃ 300/μL. La fase clínica se inició con el estudio DREAM225, seguida del SIRIUS226 y el MENSA227, que evidenciaron que el fármaco disminuye las exacerbaciones y el consumo de GCO y mejoró la calidad de vida con mejoría discreta del FEV1.
Recientemente se han publicado estudios en vida real que confirman los datos de eficacia de los estudios pivotales, así como seguridad y continuidad del tratamiento en un alto porcentaje de pacientes228 como REDES229 y REALITI-A230.
El estudio abierto COSMOS231 que incluyó pacientes de los estudios MENSA y SIRIUS, demostró la seguridad del fármaco y, posteriormente, el estudio COLUMBA reafirmó esta seguridad y eficacia a cuatro años232. Se administra por vía s.c. y a dosis fija. En trabajos recientes se ha demostrado la efectividad de este fármaco tras un cambio de tratamiento en pacientes con AG sin respuesta completa a omalizumab233.Un subanálisis reciente del estudio REDES ha demostrado que el tratamiento con mepolizumab permite la remisión de la enfermedad en un 37% de los pacientes si se utilizan los criterios de ausencia de consumo de corticoides orales, ausencia de exacerbaciones y control del asma, valorado mediante el ACT y del 30% si se añade un cuarto criterio (FEV1 ≥ 80%)234. Finalmente, la disminución del uso de GCS parece disminuir a la mitad los pacientes candidatos a tratamiento antirresortivo del hueso235.
Recientemente se han autorizado en España otras indicaciones que se comentarán a continuación.
- •
Granulomatosis eosinofílica con poliangeítis (GEPA). El estudio de Wechsler et al.236 fue un ensayo fase III, aleatorizado, doble ciego, multicéntrico, realizado en pacientes con GEPA recidivante o refractaria en tratamiento estable con glucocorticoides (prednisolona o prednisona). El objetivo fue evaluar la eficacia de mepolizumab como tratamiento complementario. Los participantes recibieron una dosis de 300 mg de mepolizumab o placebo, administrado por vía s.c. cada cuatro semanas, junto con su tratamiento de base. El tratamiento con mepolizumab aumentó significativamente las semanas de remisión y la proporción de pacientes en remisión sostenida, tanto en la semana 36 como en la 48. Además, redujo la tasa anualizada de recaídas y permitió reducir de forma significativa el consumo de GCO. El perfil de seguridad de mepolizumab fue similar al observado en estudios previos. En base a estos datos tanto la FDA como la Agencia Europea de Medicamentos (EMA) han aprobado el uso de la dosis de 300 mg s.c. cada cuatro semanas como tratamiento adicional en pacientes a partir de los seis años con enfermedad recurrente-remitente o refractaria237.
- •
RSCcPN. La RSCcPN es una comorbilidad frecuente en el AG. En el estudio SYNAPSE109, de fase III, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, multicéntrico realizado en adultos con pólipos nasales graves y al menos una cirugía endoscópica previa se observó mejoría de los síntomas y calidad de vida, disminución del tamaño de los pólipos nasales, así como reducción de la necesidad de GCO y de cirugía endoscópica. En este momento estaría indicado en pacientes en los cuales los GCS y la cirugía no proporcionan un adecuado control de la enfermedad. Estos estudios han posibilitado su financiación. Añadido al tratamiento habitual con corticoides intranasales (y lavados con suero salino como medida coadyuvante), podría considerarse una opción de tratamiento en pacientes con RSCcPN grave refractaria que no consiguen un buen control de la enfermedad a pesar de haber recibido ciclos de corticoides orales y al menos dos cirugías para la PN.
- •
Síndrome hipereosinofílico (SHE). Un estudio pivotal238 de fase III, aleatorizado, doble ciego y controlado con placebo de 32 semanas de duración con una dosis de mepolizumab s.c. 300 mg cada cuatro semanas realizado en pacientes adolescentes y adultos con SHE grave (definido como aquel que había presentado un mínimo de dos brotes en los últimos 12 meses y un recuento de Eos en sangre de>1.000 cél/μL) observó una reducción del porcentaje de pacientes con exacerbaciones (empeoramiento de síntomas o incremento en el recuento de Eos, que requieren escalado de otros tratamientos) y disminución de las exacerbaciones anuales. El estudio de extensión abierto confirmó los resultados del estudio aleatorizado239.
Es un mAb bloqueador de la IL-5 circulante. Se une a la misma región por la que la IL-5 se une a su receptor. Los estudios han demostrado que es eficaz en pacientes con AG de fenotipo eosinofílico con ≥ 400 Eos/μL. En un estudio aleatorizado controlado con placebo, que incluyó a 53 pacientes tratados con reslizumab, Castro et al.240 observaron que la disminución de Eos en sangre periférica se acompañaba de una mejoría del FEV1 y de la calidad de vida (ACQ-5), especialmente en el grupo de pacientes con PN. El desarrollo de la fase clínica incluyó varios estudios240–242, que han demostrado disminución de las exacerbaciones, mejoría en la calidad de vida y una mayor mejoría en el FEV1 que otros mAbs, si bien debe tenerse en cuenta en la valoración de este último parámetro que las poblaciones de estudio en los diferentes trabajos no fueron exactamente superponibles. Un estudio abierto de dos años de seguimiento ha evidenciado la seguridad del fármaco243.
En un análisis post hoc de un estudio que incluyó a 480 pacientes con asma eosinofílica (> 400 Eos/μL) no controlada de moderada a grave que fueron tratados con reslizumab (3 mg/kg cada cuatro semanas) durante 52 semanas, se evaluó la respuesta según la atopia (IgE específica basal positiva o no)244. Tanto en los pacientes atópicos como en los no atópicos, se observó reducción de exacerbaciones, y mejoría en el FEV1, el control del asma y la calidad de vida. Estos resultados no eran dependientes de la sensibilización alérgica244.
El reslizumab también ha sido evaluado como alternativa en un cambio de tratamiento tras otro mAb. Se evaluó la respuesta al tratamiento con reslizumab (cuatro infusiones intravenosas [i.v.] de 3 mg/kg cada cuatro semanas) en 10 pacientes corticodependientes (prednisona) que presentaban eosinofilia en esputo (> 3%) y en sangre (> 300 cél/μL) a pesar de que previamente habían sido tratados con mepolizumab (100 mg s.c. cada cuatro semanas) durante un año59. El tratamiento con reslizumab con la pauta de este estudio disminuyó la inflamación eosinofílica de la vía aérea significativamente más que la dosis fija de mepolizumab s.c., lo que se asocia a una mejoría del control del asma en estos pacientes59. También se ha evaluado el cambio desde omalizumab en un estudio prospectivo multicéntrico de 24 semanas de seguimiento. Se evaluó la eficacia y seguridad del reslizumab i.v. (3 mg/kg) en 29 pacientes con asma eosinofílica (> 400 Eos/μL) sin respuesta adecuada a omalizumab245. Los resultados mostraron una mejoría significativa en el ACT en la semana 24 de tratamiento, el objetivo principal, con un 60% del total de pacientes con buen control y sin exacerbaciones. Por lo tanto, el tratamiento con reslizumab aparece como una opción efectiva y segura para este perfil de pacientes245.
Dos estudios en fase III, aleatorizados, a doble ciego, en pacientes con>300 Eos (solo 30% podían tener <400 Eos) fracasaron en el intento de demostrar que reslizumab es eficaz a una dosis mensual fija de 110 mg246. En un estudio multicéntrico abierto, reslizumab ha demostrado ser eficaz en pacientes alérgicos con eosinofilia con mala respuesta a omalizumab245.
Un estudio post hoc ha demostrado el efecto ahorrador de GCO247. Otro análisis post hoc que incluyó seis estudios, que recoge tres casos de anafilaxia controlada clínicamente, demostró la seguridad del fármaco248.
BenralizumabEs un mAb humanizado dirigido contra la subunidad α del receptor de la IL-5 que induce la eliminación directa de Eos y basófilos a través de las células NK mediante la citotoxicidad mediada por anticuerpos249. Su uso está aprobado a partir de los 18 años. Se ha demostrado su eficacia en AGNC eosinofílica en términos de reducción de exacerbaciones graves frente a placebo hasta en un 55%, la mejora del control de los síntomas, y la reducción y suspensión del tratamiento con GCO, así como incremento de la función pulmonar (FEV1) desde la visita basal en un 25% (398 mL). Estos resultados son independientes de los niveles basales de IgE (> 30 UI) o de la presencia de atopia250–252. Los resultados son coherentes también en el estudio ZONDA253, en el que se pudo reducir la dosis de GCO a asmáticos graves corticodependientes manteniendo el control en la mayoría (75% de reducción de dosis) e incluso interrumpir su uso (en el 52% de los pacientes). Los mayores beneficios se observaron en pacientes con recuento> 300 Eos/μL en sangre periférica y> 150 Eos/μL si se trataba de pacientes con GCO de mantenimiento. En los estudios de fase III se identificaron varios factores clínicos basales asociados con una mayor eficacia de benralizumab, que eran independientes de los valores de Eos. Estos comprendían el uso de GCO; el antecedente de PN; la función pulmonar baja basada en la capacidad vital forzada <65% antes de broncodilatador; las exacerbaciones frecuentes, y que la enfermedad se iniciara en la edad adulta251,254,255. El perfil de seguridad y EA a dos años es similar al observado en el primer año254.
El estudio BORA254 es un estudio de extensión, aleatorizado, doble ciego, de grupos paralelos y 56 semanas de duración que incluyó un total de 2.123 pacientes procedentes de los estudios en fase III SIROCO, CALIMA y ZONDA con edad comprendida entre 18-75 años con AGNC. Este estudio fue seguido del estudio abierto256. El tiempo medio de seguimiento de los pacientes que recibieron benralizumab cada cuatro semanas fue de 3,9 (0,9) años y de 3,7 (0,9) para los que recibieron la dosis cada ocho semanas. Un 10,8% de los pacientes recibieron benralizumab durante cinco o más años y 35,2% durante cuatro o más años. El estudio MELTEMI certificó la seguridad del fármaco256.
El estudio PONENTE176 incluyó a 598 pacientes y evidenció una retirada de GCO en el 62,5% de los casos, disminución por debajo de 5 mg/día o retirada de GCO en el 80,6% de los pacientes tratados. La reducción se produjo independientemente del valor de Eos basales y se consiguió una disminución de las exacerbaciones. Dos aspectos adicionales del estudio merecen especial mención: Por un lado, la propuesta de descenso de GCO y por otro la descripción del número de pacientes con IA cuando se llegaba a la dosis de 5 mg/día de GCO. Un 60% de los pacientes presentaba un cierto grado de IA (33% parcial y 18,1% completa). Benralizumab también ha demostrado que un porcentaje significativo de pacientes alcanzan la remisión clínica, si bien las cifras varían en función de los estudios evaluados257,258.
Otro estudio ha mostrado que benralizumab no fue inferior a mepolizumab para la inducción de la remisión en pacientes con GEPA recurrente o refractaria259.
Con respecto a comorbilidades un estudio realizado en pacientes con AG y RSCcPN tratados con benralizumab encontró una reducción del SNOT-22. La anosmia desapareció en el 31% de los pacientes260.
DupilumabEs un mAb totalmente humano que bloquea la subunidad α del receptor de la IL-4. Tiene efecto anti-IL-4 y anti-IL-13. Disminuye la producción de IgE y la liberación de IL-5, por lo que inhibe el reclutamiento de Eos261,262. Wenzel et al.263 demostraron que, además, disminuye otros marcadores de la vía Th2. Además, observaron la eficacia del fármaco en pacientes con asma de moderada a grave con> 300 Eos/μL en sangre o más del 3% en esputo. Posteriormente, Wenzel et al.263 desarrollaron un estudio en fase IIb aleatorizado y a doble ciego en el que reclutaron 769 pacientes para 24 semanas de tratamiento con dosis de 200 y 300 mg y 16 semanas de seguimiento. Observaron una disminución de las exacerbaciones y una mejora del FEV1 a la semana 12 que se mantuvo hasta la semana 24, independientemente del valor basal de Eos (categorizado ≥ 300 o <300 cél/μL).
El estudio aleatorizado en fase III QUEST, a doble ciego y comparado con placebo, de Castro et al.57 compararon dos dosis de dupilumab (200 y 300 mg) y placebo cada dos semanas a lo largo de las 52 semanas del estudio. Con este trabajo, realizado en 1.902 pacientes a partir de 12 años y asma moderada-grave no controlada, se concluyó que el tratamiento disminuía significativamente las exacerbaciones en comparación con placebo, mejoró la función pulmonar y el control del asma. Los beneficios fueron mayores en los pacientes con mayor eosinofilia (≥ 300 cél/μL) pero el grupo con recuento entre 150 y 299 Eos/mL también presentó mejorías significativas. Los beneficios fueron más evidentes en aquellos pacientes con marcadores T2 (≥ 150 Eos/mm3 y FENO basal ≥ 25 ppb).
Estudios post hoc del ensayo QUEST57,264 mostraron que dupilumab redujo las tasas de exacerbaciones graves, mejoró el FEV1 y el control del asma, así como suprimió los biomarcadores inflamatorios de tipo 2 en pacientes con AGNC con o sin evidencia de asma alérgica, e independientemente de la presencia o no de evidencia de asma alérgica, e independientemente de la presencia o no de RSC con o sin PN como comorbilidad asociada.
VENTURE265 fue un ensayo aleatorizado y a doble ciego diseñado para demostrar que el uso de este mAb disminuía el consumo de GCO, y obtuvo un resultado positivo al alcanzar este objetivo primario con disminución de las exacerbaciones graves y mejora del FEV1 en pacientes dependientes de GCO. Mejoraron más aquellos pacientes que poseían valores más elevados de Eos y FENO. De hecho, el recuento basal de Eos y el resultado de FENO parecen ser los mejores marcadores de respuesta al fármaco226. Los resultados observados en VENTURE se mantuvieron en TRAVERSE266. Es especialmente relevante la capacidad ahorradora de corticoides que ha demostrado el fármaco.
En cuanto a EA, cabe destacar que en VENTURE267 el 14% de los pacientes tratados con dupilumab presentaron eosinofilia (1% en grupo placebo). De estos, el recuento fue superior a 3.000 cél/μL en un 13%, si bien no hubo repercusión clínica. En el estudio QUEST57 se registró eosinofilia en el 4,1% (54 pacientes) del grupo tratado frente al 0,6% (cuatro pacientes) en el grupo placebo. No obstante, únicamente cuatro pacientes del grupo tratado con dupilumab presentaron sintomatología clínica57.
El estudio TRAVERSE268 fue un estudio de extensión, abierto que demostró la seguridad y eficacia a largo plazo del fármaco. Incluyó 2.282 pacientes procedentes de los estudios en fase IIa (EXPEDITION), fase IIb (DRI), fase III (QUEST) en los que los pacientes no eran corticodependientes y el estudio en fase III que solo incluyó pacientes corticodependientes (VENTURE)267. Se observó eosinofilia en un 1,4% de los 2.062 pacientes incluidos en QUEST y DRI. Estudios en vida real mostraron la eficacia obtenida en ensayos clínicos y que la hipereosinofilia transitoria no modificaba la respuesta al tratamiento269,270. El seguimiento a largo plazo ha demostrado la seguridad del fármaco271. Estudios recientes muestran la efectividad de dupilumab en revertir ciertos componentes de la remodelación bronquial272.
Dupilumab está aprobado actualmente a partir de los seis años de edad273 como tratamiento de mantenimiento adicional para el AG tipo 2 alto que no sea controlada con altas dosis de GCI acompañados de otro fármaco controlador, y curse con un alto recuento de Eos (≥ 300 cél/μL) y/o FENO (≥ 50 ppb), o en pacientes con Eos ≥ 150 y <300 pero con más de dos exacerbaciones graves en el último año o más de una exacerbación grave que requiera hospitalización, o en pacientes con uso crónico de GCO. La dosis es de 200 mg cada dos semanas en los no corticodependientes y 300 mg cada dos semanas en los corticodependientes y en RSCcPN previa dosis de carga el primer día de la administración274.
La primera indicación con la que dupilumab fue comercializado en España fue la dermatitis atópica. Actualmente también tiene otras indicaciones aprobadas como son la RSCcPN, el prurigo nodular y la esofagitis eosinofílica110,275–277.
Por último, la EMA ha aprobado su indicación como tratamiento de mantenimiento complementario para adultos con EPOC no controlada y con niveles de Eos> 300 en sangre (ensayos clínicos BOREAS Y NOTUS)278,279.
TezepelumabBloquea la linfopoyetina del estroma tímico (TSLP) y, por tanto, actúa a nivel de la inmunidad innata, regulando la actividad de las células innatas de tipo 2 (acrónimo en inglés ILC2), y a nivel de la inmunidad adaptativa, regulando las células presentadoras de antígeno280–282. Existen dos isoformas de TSLP, la corta y la larga. Los estudios no aclaran qué isoforma bloquea tezepelumab.
En el estudio PATHWAY283, ensayo de fase II, aleatorizado, doble ciego y controlado con placebo, se compararon tres dosis distintas de tezepelumab s.c. con placebo durante un periodo de tratamiento de 52 semanas. La variable principal de eficacia fue la tasa anualizada de exacerbaciones del asma (eventos por paciente-año) en la semana 52. La tasa de exacerbaciones disminuyó con las tres dosis de tezepelumab, un mínimo del 60%. La mejoría ocurrió independientemente del nivel inicial de Eos. El FEV1 final también fue superior en los grupos tratados. También se produjo una disminución de los Eos, de la FENO y de la IgE.
En el estudio pivotal en fase III NAVIGATOR284, se realizó un ensayo, multicéntrico, aleatorizado, doble ciego y controlado con placebo que incluyó pacientes con una edad comprendida entre 12 y 80 años y que fueron asignados aleatoriamente a recibir tezepelumab (210 mg) o placebo por vía s.c. cada cuatro semanas durante 52 semanas. El objetivo principal fue la tasa anualizada de exacerbaciones del asma a las 52 semanas. La disminución de exacerbaciones fue del 44% y en los pacientes con <300 Eos, fue del 59%. También mejoró la función respiratoria, la calidad de vida y el control del asma. Si bien proporciona una reducción de la tasa de exacerbaciones graves más intensa cuanto mayor es el recuento de Eos en sangre y los valores de FENO basales, también es eficaz cuando el recuento de Eos en sangre <150 células/μL y FENO <25 ppb. Por lo tanto, es el único fármaco biológico que por el momento demuestra eficacia en el asma no T2. Análisis posteriores determinan que la reducción de exacerbaciones se da en todos los subgrupos y en cualquier estación del año285–287. Estudios en vida real corroboran estos datos y que tezepelumab puede ser útil en donde fracasan otros monoclonales287–289.
El estudio SOURCE290 es un estudio en fase III, multicéntrico, doble ciego, aleatorizado, controlado con placebo que evaluó el efecto ahorrador de GCO de tezepelumab administrado a dosis de 210 mg cada cuatro semanas comparado con placebo. Los resultados fueron numéricamente favorables al grupo tratado con tezepelumab, pero no hubo diferencias estadísticamente significativas con el placebo. A pesar de la disminución de GCO obtenida se demostró un descenso de los marcadores T2.
El estudio CASCADE291 es un estudio en fase II que intentó demostrar la disminución de infiltrado inflamatorio en la mucosa bronquial después de 28 semanas de tratamiento con tezepelumab, comparado con placebo. Los resultados mostraron una disminución significativa únicamente en el infiltrado de Eos y no mostraron cambios en el grosor ni integridad de la membrana basal292.
Con respecto a la actuación sobre RSCcPN, un análisis post-hoc de NAVIGATOR muestra que tezepelumab reduce la puntuación de SNOT 22 a las 28 y 52 semanas. Además, en la semana 52 redujo los recuentos de Eos en sangre y los niveles de FENO, IgE, IL-5, IL-13, EDN y MMP-10 versus placebo, independientemente del estado de PN293.
Recientemente se publicó el estudio WAYPOINT que demostró eficacia en pacientes con RSCcPN294.
Tratamientos futuros para AGNCDepemokimabEs un fármaco que tiene una gran afinidad de unión y potencia para la IL-5, lo que permitirá intervalos de dosificación de seis meses para pacientes con AG. Los ensayos de Fase III Swift-1 y Swift-2 han mostrado eficacia frente a placebo en reducir un 54% la tasa de exacerbaciones graves de asma136.
Tratamientos en investigación para AGNCOtras nuevas moléculas como antagonistas de la IL-33 y su receptor se encuentran en estudio. De ellas, astegolimab, un anticuerpo anti-ST2, ha mostrado eficacia en la reducción de exacerbaciones en poblaciones con inflamación T2 (Eos> 300) y no T2 (< 300) en proporción similar295.
El bloqueo de la IL-33 con itepekimab condujo a una menor incidencia de eventos que indicaban una pérdida del control del asma que el placebo y mejoró la función pulmonar en pacientes con asma de moderada a grave296.
Cambio de mAb en pacientes poco o no respondedores a un anticuerpo determinadoLa introducción de mAbs en el tratamiento del asma en España se remonta al año 2006 cuando se comercializó omalizumab. Este fue el único mAb disponible durante una década. Sin embargo, en los últimos años han aparecido otros 5 mAbs más que se disputan su indicación en el AGNC.
En caso de no respuesta o respuesta insuficiente, el clínico se debería plantear el cambio a otro mAb. No obstante, antes se debería establecer la causa del fracaso, pues en función de ella, se podrían derivar otras opciones terapéuticas previas al cambio. Se han identificado las siguientes causas de respuesta incompleta al mAb:297 incorrecta identificación de fenotipo T2; diferentes mecanismos T2 implicados (solapamiento asma T2 alérgica y eosinofílica);298 coexistencia de vías patogénicas T2 y no T2; cambio del fenotipo inflamatorio; fenómenos autoinmunes intercurrentes (autoanticuerpos, IgG anti-eosinófilo, aumento de C3c);299,300 infecciones respiratorias recurrentes como causa de exacerbación (no por fracaso del control de la inflamación eosinofílica); aparición de nuevas comorbilidades no tratadas (rinitis, RSC, reflujo gastroesofágico, apnea obstructiva del sueño, obstrucción laríngea inducible, obesidad, EPOC); y baja adhesión terapéutica (a mAb o a los fármacos inhalados que recibía previamente); dosis del mAb administrada insuficiente301. En dicho contexto y antes del cambio a otro mAb se ha recomendado efectuar los siguientes cinco pasos302:
- 1.
Evaluar y, si se precisa, corregir la posible baja adhesión terapéutica.
- 2.
Identificar y tratar las comorbilidades.
- 3.
Determinar el tipo de exacerbaciones, infecciosas o inflamatorias.
- 4.
Reevaluar el fenotipo inflamatorio (si es posible en esputo).
- 5.
Si se precisa, en función de la valoración previa, considerar otra opción terapéutica previa al cambio a un nuevo mAb, como por ejemplo azitromicina o termoplastia.
La existencia de suficiente evidencia en la literatura60,233,245,303, así como experiencia clínica, permite plantear un cambio de biológico en determinadas situaciones entendiendo que, aunque la indicación inicial fuera acertada, la respuesta al tratamiento no es nunca completa. Es de esperar que aparezcan progresivamente nuevos estudios que amplíen los conocimientos sobre el cambio de tratamiento entre diferentes mAbs.
En caso de fracaso secuencial de dos mAbs con efecto inmunológico distinto (anti-IgE y anti-eosinofílico) se podría considerar, aunque sin respaldo de evidencia sólida, en primer lugar dupilumab57, tezepelumab o incluso plantear la combinación de dos mAbs con efecto anti-IgE y anti-eosinofílico304. Se han descrito casos aislados de combinación de dupilumab con fármacos anti-eosinofílicos305.
Criterios de cambio entre mAb en asmaSiguiendo los datos que proporcionan las cohortes del Registro Internacional de AG (ISAR) y la cohorte CHRONICLE, Menzies-Gow et al. estiman que el cambio se produce en el 10% de los pacientes con AG que comienzan con un tratamiento biológico306. El tiempo medio para el cambio se estima entre los cuatro y los seis meses. Debido a la disponibilidad y al tiempo en el que han sido aprobados los diferentes mAbs el más habitual ha sido el de omalizumab por un anti-IL5/5R (casi el 50% de los cambios) seguido por el cambio entre la propia clase terapéutica de los anti-IL5/5R (30%), siendo el cambio de anti-IL5/5R a anti-IL4/13 de un 29%. Los sujetos que lo precisan presentan un recuento de Eos en sangre mayor que los que siguen con el mismo tratamiento (tanto si están en GCO como si no lo están), así como un FENO más elevado y mayor proporción de enfermedad rinosinusal. Las razones para el cambio fueron, en primer lugar, una eficacia clínica insuficiente (86%) con un 7,7% de abandonos por EA. Existen otros estudios sobre los patrones de cambio de mAbs (son trabajos realizados solamente en un centro y con un tamaño muestral mucho menor) donde se observan tasas de switch en torno al 35%307. No obstante, no son tan consistentes como el de Menzies-Gow et al.306.
Hay múltiples razones que disminuyen la validez de la evidencia en los trabajos de cambio de monoclonal:308 1) en muchos de ellos no hay datos basales que hablen de la idoneidad de los sujetos para la elección del primer mAb; 2) EA, posología o comorbilidades pueden haber influido en el control del asma con el mAb; 3) el mAb de sustitución es elegido habitualmente de forma arbitraria por el médico prescriptor; 4) la duración del tratamiento de inicio o del nuevo pueden ser demasiado cortos y 5) la mayoría de los trabajos sobre cambio de mAb en asma son estudios con escasa muestra y basados en experiencia en vida real. Con los datos actuales y la evidente falta de evidencia, es entendible que las GPC no presenten algoritmos o recomendaciones en el cambio de mAb. Mucho menos sobre qué tipo de enfermos se benefician de un cambio a un biológico particular.
Se recomienda esperar entre cuatro y seis meses para realizar la primera valoración de la efectividad del mAb.
Se recomienda esperar entre seis meses y un año en el paciente en tratamiento continuo con GCS para valorar la efectividad del mAb o si hay una respuesta parcial.
Se recomienda una valoración multidimensional (síntomas, función pulmonar, exacerbaciones y uso de GCS) para establecer la efectividad de un mAb.
Las recomendaciones elaboradas en relación con el tratamiento del paciente con AGNC con mAbs son:
Se debe realizar una valoración objetiva de la adhesión terapéutica antes de iniciar un tratamiento con mAb.
Todos los biológicos han demostrado eficacia en AGNC, si bien las poblaciones estudiadas no son superponibles.
La decisión última de la elección de un mAb concreto para un paciente corresponde exclusivamente a los especialistas (neumólogos o alergólogos) responsables de este. Esto no es óbice para que existan comisiones en las que participen además otros profesionales que evalúen los tratamientos con criterios de eficiencia.
En determinados casos de AGNC, el valor de la FENO≥ 25 ppb puede ser relevante para la elección del mAb.
En pacientes con AGNC, el diagnóstico de RSCcPN condiciona la elección del mAb.
En los pacientes que no responden adecuadamente a un primer mAb, se debe valorar el cambio a otro, considerando las evidencias en cuanto a efectividad y seguridad de cada uno en este contexto para cada paciente en concreto.
En caso de respuesta incompleta tras el tratamiento secuencial con dos mAbs con diferentes mecanismos de acción (anti-IgE y anti-IL5/anti-eosinófilo), se debe plantear como primera opción dupilumab (<1000 Eos/μL) o tezepelumab.
En asmáticos graves no controlados alérgicos con recuentos de Eos ≥ 300 cél/μL en los que ha fracasado omalizumab, tanto los anti-IL-5 como dupilumab o tezepelumab son una alternativa válida.
En los pacientes con AGNC alérgica con un recuento de Eos entre 150-300 cél/μL sin tratamiento con glucocorticoides de mantenimiento, no son alternativas igual de válidas omalizumab, benralizumab, mepolizumab, dupilumab y tezepelumab.
En los pacientes con AGNC eosinofílica en los que han fracasado los anti-IL-5 y dupilumab, si existe compatibilidad de síntomas con sensibilización a algún alérgeno específico positivo, son opciones tanto tezepelumab como omalizumab.
En AGNC con fenotipo eosinofílico están indicados tanto los anti-IL5/anti-eosinofílicos como dupilumab o tezepelumab.
En AGNC eosinofílica con más de 1.000 Eos/μL se pueden indicar indistintamente tezepelumab, benralizumab o mepolizumab.
En pacientes con AGNC puede estar indicado tezepelumab independientemente del valor de los biomarcadores T2.
En pacientes con AGNC no T2 tezepelumab es el único tratamiento biológico disponible.
En los pacientes con fracaso de todos los biológicos el tratamiento combinado de más de un mAbs puede ser una opción.
Medidas preventivas en asmaJunto con el tratamiento farmacológico existen otras estrategias como la vacunación o las medidas de control ambiental para mejorar el control de los síntomas y/o reducir el riesgo futuro. Las medidas documentadas incluyen:
Evitar el tabaquismo activo y pasivoLos asmáticos fumadores presentan síntomas más graves, una peor respuesta a los glucocorticoides y una pérdida acelerada de la función pulmonar, por lo que a menudo es necesario incrementar su escalón terapéutico. Además, el consumo de tabaco se relaciona con el desarrollo de asma tanto en adultos como en adolescentes, siendo por tanto el primer objetivo del control ambiental conseguir que el paciente abandone el tabaquismo. Para ello, se le debe informar sobre los métodos adecuados para conseguir la deshabituación. Además, la exposición pasiva al humo de tabaco empeora el curso del asma y es un factor de riesgo para desarrollar esta enfermedad en la infancia, por lo que se recomienda al paciente, o a los cuidadores de niños con asma, que las zonas donde van a permanecer (habitaciones, coche, etc.) permanezcan libres de humo1,2. Con relación al uso de cigarrillos electrónicos u otros dispositivos de inhalación, no hay evidencia de que estos dispositivos sean más seguros que el tabaco a largo plazo, por lo que no se debe respaldar su uso como una ayuda para dejar de fumar309. De hecho, la evidencia sugiere que los aerosoles de los dispositivos electrónicos de inhalación contienen numerosos irritantes respiratorios y toxinas que pueden tener un efecto citotóxico sobre el tejido pulmonar310,311. Así, en los últimos años se ha descrito la EVALI, la lesión pulmonar asociada al uso de cigarrillos electrónicos o de vapeo, con mayor porcentaje de asmáticos que en la población general312, y que en algunos casos conduce a la muerte313. Además, el uso de cigarrillos electrónicos o de otros dispositivos de inhalación que liberan nicotina e incluso la exposición pasiva al humo de estos dispositivos podría desencadenar asma, empeorar su gravedad y/o aumentar las agudizaciones314–316. Por ello, desde la clínica se debe incluir el uso de estos dispositivos, incluida la exposición pasiva, en la entrevista clínica y en las medidas de evitación.
Las recomendaciones elaboradas con relación a esto son:
Se recomienda el abandono del tabaquismo (incluido el pasivo) en los pacientes asmáticos.
Los pacientes con asma deben evitar el uso del cigarrillo electrónico o vapeadores, pipas de agua y otros dispositivos de productos de tabaco calentados o sin combustión.
Los pacientes con asma deben evitar la exposición pasiva al cigarrillo electrónico y a otros sistemas de inhalación.
En la entrevista clínica del paciente con AGNC se debe descartar como causa del mal control el uso de cigarrillos electrónicos, vapeadores, pipas de agua y otros dispositivos de productos de tabaco calentados o sin combustión, etc. o la exposición pasiva a ellos.
Se debe investigar de forma habitual la exposición a otras sustancias tóxicas inhaladas.
Se deben incluir en el tratamiento del AGNC métodos adecuados para conseguir la deshabituación del tabaquismo.
Contaminación ambiental y cambio climáticoSe ha demostrado que el cambio climático, la polución y la mala calidad del aire, tanto en el interior de viviendas y edificios como en el exterior, contribuye a la aparición, agravamiento y agudizaciones del asma311,317. Aparte del humo del tabaco en los hogares en los que se consume, otros agentes contaminantes frecuentes en interiores son el dióxido de nitrógeno, el monóxido de carbono y compuestos orgánicos volátiles, humo por combustión de biomasa (p. ej. chimeneas)318. El cambio climático, y en particular el aumento de la concentración de CO2 atmosférico y la temperatura del aire, está teniendo un impacto en los alérgenos transportados por el aire, como polen y esporas de mohos319. Así, hay evidencia de que las plantas producen más polen como respuesta a los altos niveles atmosféricos de dióxido de carbono320. Incluso se ha demostrado que las tormentas eléctricas en épocas de polinización pueden favorecer las crisis asmáticas graves en pacientes sensibilizados321. Por otro lado, la proliferación de moho aumenta con las inundaciones y las tormentas, pudiendo repercutir en el control del asma320. Por todo ello, las medidas contra el cambio climático y para reducir las emisiones de gases de efecto invernadero pueden tener beneficios positivos para la salud. A nivel individual se puede reducir la exposición a algunos agentes, como las sustancias procedentes de combustión en entornos domésticos, residenciales, escolares y profesionales; y para la lucha contra el cambio climático se pueden establecer medidas sencillas que disminuyan la huella de carbono. Sin embargo, se requiere el apoyo de políticas medioambientales para combatir el cambio climático y disminuir la presencia de muchas de estas sustancias en el aire.
Las recomendaciones elaboradas con relación a esto son:
Es necesario tener en cuenta el impacto sobre la huella de carbono que pueden tener algunos sistemas de inhalación, como los inhaladores de dosis medida que utilizan hidrofluorocarbono.
En casos en los que haya otra alternativa a los inhaladores con hidrofluorocarbono, debería modificarse su prescripción a sistemas con menos impacto sobre la huella de carbono siempre que se compruebe que el paciente puede realizarlo adecuadamente.
Siempre que sea posible, se debería priorizar la terapia con un único dispositivo frente a aquella con varios dispositivos para mejorar la adhesión.
Se recomienda a los pacientes con AG utilizar mascarillas como las FFP2, cuando los niveles de contaminación del aire sean elevados.
Antiinflamatorios no esteroideosEstos fármacos no están contraindicados de forma generalizada en los asmáticos, pero antes de prescribirlos se debe preguntar al paciente por su uso y los efectos secundarios previos1. Sin embargo, los sujetos con EREA, caracterizada por intolerancia al ácido acetilsalicílico, asma y pólipos nasales, evitarán tratamientos analgésicos o antiinflamatorios con fármacos de la clase terapéutica AINE que inhiben la ciclooxigenasa (COX) 1, ya que muchas de estas reacciones son graves o incluso mortales, por lo cual es necesario que los pacientes estén correctamente diagnosticados, bien por una historia clínica evidente (varias reacciones a distintos AINE) o mediante provocación oral, que puede ser sustituida en los casos graves por la provocación inhalatoria bronquial o nasal. Estos pacientes pueden recibir paracetamol, pero se recomienda comprobar antes su tolerancia, pues podrían presentar también reacciones adversas. Si se precisa mayor poder analgésico, podrá utilizarse tramadol, opiáceos y AINE inhibidores selectivos de la COX-2 (celecoxib, etoricoxib), estos últimos siempre tras comprobar su tolerancia1,322.
La recomendación elaborada con relación a esto es:
Los pacientes con EREA evitarán el tratamiento con cualquiera de los fármacos de la clase terapéutica AINE y los inhibidores de la COX-1.
AlérgenosLa evitación a alérgenos es la piedra angular del manejo del asma en los pacientes sensibilizados y se deben considerar recomendaciones específicas, una vez que se hayan confirmado las sensibilizaciones a los distintos alérgenos en cada paciente. En general, los alérgenos ambientales se clasifican en alérgenos interiores (ácaros del polvo doméstico, caspa de mascotas, moho, cucarachas, roedores) y alérgenos exteriores (moho, polen)323. Las medidas más eficaces son aquellas que permiten disminuir drásticamente los niveles de exposición, como son las que se pueden aplicar en muchos casos de asma ocupacional (cambio de puesto de trabajo), asma por epitelios (retirar los animales del domicilio), por cucaracha (uso juicioso de plaguicidas) o por hongos aerógenos (reducir mohos en domicilio). Las medidas individuales aisladas, como por ejemplo el uso de fundas de colchón o el de acaricidas, no son efectivas, ni siquiera en la reducción de los niveles de exposición. Sin embargo, la aplicación de intervenciones específicas combinadas ha proporcionado una reducción significativa del grado de exposición alergénica y, en consecuencia, mayor eficacia clínica1.
Vacunación antigripalLa vacunación antigripal no ha demostrado la reducción del número o la gravedad de las agudizaciones en los asmáticos324. Sin embargo, debido a que es una estrategia coste-efectiva y al elevado riesgo de complicaciones en pacientes con procesos crónicos325, el Ministerio de Sanidad de España incluye el asma como grupo de riesgo donde se recomienda la vacunación antigripal anual326.
La recomendación elaborada con relación a esto es:
Se recomienda la vacunación antigripal anual en los pacientes con AG.
Vacunación antineumocócicaLos pacientes con asma, especialmente los niños, ancianos y los que tienen AG, presentan un mayor riesgo de padecer enfermedad neumocócica invasiva. Además, se debe tener en cuenta que los pacientes con asma pueden presentar menor respuesta humoral frente a la vacunación antineumocócica 23-valente327. Actualmente, se encuentran disponibles tres tipos de vacunas frente a neumococo, autorizadas e indicadas en España: Vacuna neumocócica conjugada 13-valente (VNC13) (Prevenar 13®): autorizada a partir de las seis semanas de vida; vacuna neumocócica conjugada 20-valente (VNC20) (Apexxnar®): autorizada a partir de los 18 años; vacuna neumocócica polisacarídica 23-valente (VNP23) (Pneumovax 23®): autorizada a partir de los dos años. Sin embargo, a pesar de que no existe suficiente evidencia, diversos documentos de consenso de expertos328 y el Sistema Nacional de Salud recomiendan la administración de la vacuna antineumocócica en pacientes con AG, y algunos sistemas de salud autonómicos la recomiendan en pacientes con asma (independientemente del nivel de gravedad)1,329.
La recomendación elaborada con relación a esto es:
Se recomienda la vacuna conjugada antineumocócica 20 valente en los pacientes con AG.
Vacunación Herpes zósterRecientemente se ha autorizado en España el uso de la vacunación contra el Herpes zóster para evitar la infección por Herpes zóster y el desarrollo de neuralgia postherpética. Si bien no se ha incluido el AG como grupo de riesgo, sí está indicado en pacientes en tratamiento con fármacos inmunosupresores, como los corticoides orales de mantenimiento330, aunque en algunas Comunidades Autónomas se restringe a mayores de 50 años331.
La recomendación elaborada con relación a esto es:
Se debe informar sobre los beneficios potenciales de la vacunación frente a Herpes zóster a los pacientes mayores de 50 años con AG corticodependiente.
Vacunación frente a virus respiratorio sincitialLos adultos con infección por el virus respiratorio sincitial (VRS) presentan tasas de hospitalización entre siete y ocho veces más altas para todas las edades en comparación con los sujetos sin asma332.
Las actuales vacunas frente al VRS han demostrado su efectividad en la prevención de la infección respiratoria aguda relacionada con el VRS333. Recientemente se ha autorizado en España el uso de la vacunación contra el VRS en adultos a partir de 60 años de edad y en adultos de 50 a 59 años de edad con mayor riesgo de contraer la enfermedad por VRS, aunque esta indicación aún no está financiada por el SNS334.
La recomendación elaborada con relación a esto es:
Se recomienda la administración de la vacuna anti-VRS, sobre todo en personas> 60 años con AG.
Vacunación frente a SARS-CoV-2Debido a que los pacientes con asma suelen experimentar enfermedades virales frecuentes y más graves, y las infecciones virales del tracto respiratorio son el desencadenante predominante de exacerbaciones graves del asma, ha habido una gran preocupación sobre el riesgo de infección por SARS-CoV-2 en los pacientes con asma. Los datos agregados del informe de la Red de Vigilancia de Hospitalización por Enfermedad por Coronavirus 2019 (COVID-NET) de los Centros para el Control y la Prevención de Enfermedades indican que, hasta 2022, el 12,1% de todos los pacientes hospitalizados en EE. UU. tenían asma, una prevalencia más alta que la de la población general335. En relación a si la presencia de asma se asocia con un mayor riesgo de morbilidad y mortalidad por la infección por SARS-CoV-2, se han realizado diferentes estudios. Así, en la fase inicial de la pandemia, los Centros para el Control y la Prevención de Enfermedades identificaron a los pacientes con asma moderada a grave como un grupo de alto riesgo para el desarrollo de una infección grave por SARS-CoV-2. Estudios posteriores han mostrado resultados contradictorios. La inflamación de tipo 2 parece tener un efecto protector contra la infección por SARS-CoV-2 al disminuir la expresión del receptor de la enzima convertidora de angiotensina 2 (ECA2), un receptor importante para la entrada del virus SARS-CoV-2 en las células del huésped336. Además, los estudios observan un perfil seguro de los corticosteroides inhalados y los medicamentos biológicos en la infección por SARS-CoV-2337.
Desde el segundo año de la pandemia disponemos de varias vacunas eficaces y seguras que han cambiado el curso de la pandemia de SARS-CoV-2. Ya hay datos disponibles sobre la vacunación en pacientes con AG en tratamiento con biológicos, donde no se encontraron diferencias en comparación con otros grupos de pacientes338,339, y no hay evidencia de un aumento del riesgo de EA en estos pacientes340.
Desde la temporada 2021-2022, en España, la vacunación frente a gripe coincide con la vacunación frente a COVID-19 y los grupos de riesgo son los mismos para ambas vacunaciones, por lo que el Ministerio de Sanidad incluye el asma como grupo de riesgo donde se recomienda la vacunación frente a SARS-CoV-2 de forma anual326.
Diferentes sociedades científicas, entre ellas la SEPAR, abogan por el uso concurrente del tratamiento biológico para el asma y la vacuna frente al SARS-CoV-2, con un intervalo de al menos cinco a siete días. Las indicaciones de la vacuna COVID19 no difieren en asmáticos respecto a la población general341,342.
Las recomendaciones SEPAR342 para los pacientes con AG son:
En caso de infección por SARS-CoV-2 se aconseja demorar la administración del biológico hasta la resolución clínica (aproximadamente 10 a 14 días), ya que se desconoce su efecto en la respuesta inmune al virus.
En casos de infección por SARS-CoV-2 y asma agudizada, se debe individualizar la administración del biológico, ya que no se han observado reacciones adversas en los escasos casos administrados durante la infección.
Es recomendable retrasar la administración del tratamiento con mAb cinco a siete días tras la administración de la vacuna del SARS-CoV-2.
Es recomendable retrasar la administración de la vacuna del SARS-CoV-2 tras la administración del tratamiento con monoclonal un mínimo de tres días.
Las recomendaciones elaboradas con relación a esto son:
Se recomienda la vacunación contra el SARS-CoV-2 en los pacientes con AG.
Es recomendable retrasar la administración del tratamiento con monoclonales cinco a siete días tras la administración de la vacuna del SARS-CoV-2.
Es recomendable retrasar la administración de la vacuna del SARS-CoV-2 tras la administración del tratamiento con monoclonal un mínimo de tres días.
Organización unidades de asmaCaracterísticas generalesDotaciónLa literatura existente respalda de manera consistente que las UA son eficaces y costo-efectivas10,343. Por consiguiente, los pacientes con AG deberían ser evaluados en dichas unidades. Una UA debe estructurarse con un organigrama funcional claro y disponer de un área física adecuada para consultas y pruebas complementarias. Es esencial que estas unidades estén equipadas con tecnología informática avanzada, incluyendo bases de datos robustas, y que implementen protocolos clínicos estandarizados, englobando programas educativos integrales. Los programas de educación en asma, llevados a cabo en las consultas de enfermería, deben abarcar estrategias para la evitación de neumoalérgenos y la capacitación en la utilización de dispositivos inhaladores. Esta educación debe ser parte de un esquema programático bien definido que contemple planes personalizados de autotratamiento en formato escrito. Adicionalmente, se recomienda que las UA proporcionen servicios de atención urgente para gestionar exacerbaciones asmáticas, con el objetivo de reducir la necesidad de acudir a servicios de urgencias hospitalarias o a centros de atención continuada.
Recursos técnicosEspacio físico: deberá estar equipada con un área física dedicada, incluyendo consultorios, salas de procedimientos técnicos, espacios de enfermería y educación, así como de administración y espera, los cuales podrían ser espacios compartidos dentro de la sección correspondiente de Neumología. Además, sería beneficioso contar con una sala de reuniones para actividades educativas.
Recursos clínicos y administrativos: contará con el equipo necesario para sus funciones específicas. Esto incluye mobiliario adecuado y dispositivos para espirometría, pruebas de provocación bronquial, pruebas de alergia, mediciones de óxido nítrico exhalado (FENO), análisis inmunológicos y la administración de terapias biológicas. Unidades de mayor complejidad podrán disponer de herramientas adicionales como análisis de células inflamatorias en el esputo inducido, ergoespirómetro para la provocación de asma inducida por el ejercicio, broncoscopia para diagnóstico diferencial, toma de biopsias y procedimientos avanzados como termoplastia bronquial o pruebas de provocación específicas.
Recursos humanos: contará con un equipo multidisciplinar de profesionales sanitarios expertos en asma, capacitados en la aplicación de métodos diagnósticos y terapéuticos de esta afección. El personal de la Unidad, incluyendo médicos, enfermería y auxiliares administrativos, podrá desempeñar funciones compartidas con otras áreas del servicio.
Formación acreditada en asma: es importante que todos los profesionales involucrados en la Unidad posean formación pertinente en el manejo del asma, habiendo completado cursos especializados o másteres acreditados.
Actividad docente: la Unidad debe implementar iniciativas educativas tanto a nivel de pregrado como de posgrado. Es recomendable que se implementen cursos especializados y programas de formación práctica para residentes en rotación por la Unidad. La Unidad debe tener capacidad para realizar investigación en asma.
Acreditación de la Unidad de asmaLas sociedades científicas SEPAR y la Sociedad de Alergia e Inmunología clínica (SEAIC) han impulsado la creación de UA y han desarrollado sistemas de acreditación344,345. SEPAR clasifica las UA en tres niveles de complejidad: básica, especializada y de alta complejidad. La acreditación requiere la solicitud y la aportación de documentación que acredite su actividad asistencial, docente e investigadora. Además, se debe aportar un listado de los profesionales adscritos a la Unidad, con descripción de sus funciones y el porcentaje de tiempo que dedican a las tareas propias en la misma. La memoria de actividades debe ser remitida cada cinco años para evaluar (y reacreditar) el funcionamiento de las UA acreditadas previamente.
Unidades multidisciplinaresLa constitución de equipos interdisciplinarios y la continuidad en la atención son esenciales para el tratamiento eficaz del asma. La creación de una UA se facilita mediante la integración de diversas especialidades médicas, destacando la importancia de la colaboración con enfermería especializada en esta condición. Los pilares de este equipo son los especialistas de neumología/alergología y el personal de enfermería con formación y experiencia en AG. Además, es crucial la contribución coordinada de otros especialistas para abordar comorbilidades y factores que exacerben el asma, tales como ORL, foniatras, pediatras para la transición de la atención pediátrica a la adulta, así como psicólogos, psiquiatras, fisioterapeutas, especialistas en digestivo, dietistas y endocrinólogos. La inclusión de farmacéuticos tanto hospitalarios como de AP también resulta relevante. Aunque no todas las unidades cuenten con todas las especialidades, la diversidad y capacidad de integración de estos profesionales son determinantes para mejorar la calidad del cuidado ofrecido a los pacientes con asma346–348.
Criterios de derivaciónMás del 50% de los pacientes con asma nunca han sido visitados por un especialista349 y entre el 61% y el 72% de pacientes con posible AG son manejados en AP exclusivamente350,351. Los pacientes con AG que son atendidos en atención especializada (AE) se caracterizan por tener un asma de comienzo en la edad adulta, con mal control de síntomas, con al menos cuatro exacerbaciones anuales, más de la mitad corticodependientes y casi el 70% con terapias biológicas352.
El manejo de pacientes con AG en AE se asocia con una mejor calidad de vida, menos exacerbaciones y visitas no programadas, mejor función pulmonar y mayor reducción de la dosis de corticoides353,354. Incluso, un 20% de las muertes por asma pueden evitarse si el paciente es visitado previamente en un centro especializado355. De igual modo, ni siquiera el 40% de los pacientes atendidos en un servicio de urgencias en nuestro medio son derivados al alta al especialista356,357. Son necesarios, por tanto, documentos estratégicos de consenso que optimicen el proceso de derivación a centros de referencia, sobre todo en el AG, con la finalidad de reducir la morbimortalidad asociada a la enfermedad358.
En España, se han elaborado documentos de consenso para la derivación de pacientes con asma a AE, tanto desde AP359,360, (tabla 10) como desde los servicios de urgencias (tabla 11)361, todavía en distintas fases de implementación a nivel local.
| 1. | Confirmar el diagnóstico de asma |
| 2. | Estudio de las enfermedades concomitantes cuando no pueda completarse en AP |
| 3. | Pacientes con asma grave y con asma no controlada |
| 4. | Situaciones especiales (estudio alergológico, asma relacionada con el trabajo, EREA, asma inducida por el ejercicio y asma en embarazo) |
| 5. | Estudio de otras enfermedades que planteen diagnóstico diferencial con el asma. |
AP: atención primaria; EREA: enfermedad respiratoria exacerbada por ácido acetlsalicílico.
Criterios para la derivación al especialista desde un servicio de urgencias tras una atención por crisis de asma (adaptada de Pinera-Salmeron361)
| Derivación al especialista(aconsejable en <1 mes) | Derivación al especialista con prioridad(aconsejable en ≤2 semanas) |
|---|---|
| • Paciente sin diagnóstico objetivo de asma• Pacientes que incumplen el tratamiento o no controlados con GCI/LABA• Hiperfrecuentadores por exacerbación (≥3 veces/año) o que hayan requerido al menos una hospitalización en el año previo• Tratados con SABA únicamente y que realicen un uso>2 ocasiones a la semana o>1 cartucho al mes• Pacientes que reciben GCS de forma mantenida o repetitiva (>2 tandas de prednisona o equivalente año) | • Crisis grave• Antecedentes de ARV en el último año• Embarazadas• Uso diario de SABA a pesar de tratamiento adecuado• Anafilaxia |
ARV: asma de riesgo vital; GCI: glucocorticoides inhalados; GCS: glucocorticoides sistémicos; LABA: agonistas β2 adrenérgicos de larga acción, SABA: agonistas β2 adrenérgicos de corta acción.
La autoevaluación del paciente para saber si padece AG puede ser útil, también, para mejorar la comprensión de su enfermedad y favorecer la derivación del paciente desde AP a AE362. La aplicación de protocolos de cribado en centros de salud para identificar fenotipos de AG, en función de sus medios disponibles, favorece también el acceso a terapias avanzadas363,364.
Siempre que sea posible, debe favorecerse el acceso de pacientes con AG desde AP y AE a unidades especializadas de asma donde se ofrece un abordaje multidisciplinar de la enfermedad y se consigue un mejor control del asma, de la calidad de vida de los pacientes y un menor consumo de recursos sanitarios10,343,365. Es recomendable, además, que los pacientes derivados a estas unidades sean visitados en menos de ocho semanas, que una vez aprobado el inicio de una terapia avanzada no se demore más de cuatro semanas y que los pacientes con AG puedan tener acceso al especialista cuando sea necesario, incluso con atención domiciliaria366.
Indicadores de resultados en saludDentro de los modelos de atención basados en la enfermedad, es la práctica clínica basada en la evidencia científica con la implementación de GPC y el uso de los mejores recursos disponibles, los elementos más usados para el diagnóstico y tratamiento del AGNC, siendo la calidad asistencial un parámetro insuficientemente medido367.
Tanto la calidad como los indicadores de resultados son variables cuantitativas que permiten conocer el grado en que un aspecto relacionado con la atención sanitaria (diagnóstico, seguimiento y tratamiento) consiguen los resultados en salud esperados, tanto por los profesionales que realizan dicha actividad como por los pacientes que la reciben.
Para medir el impacto de las intervenciones que se realizan a un paciente con AGNC, es imprescindible emplear una serie de indicadores de resultados en salud1 relacionados con la enfermedad, por lo que se consigue una aproximación «más cercana» a todo el proceso asistencial. De esta manera se puede medir de una manera objetiva y previamente marcada, si se han conseguido los objetivos propuestos por los equipos de salud y valorar si se precisan cambios organizativos y/o asistenciales en caso de no alcanzarlos.
La iniciativa Carabela368, promovida por la SEPAR, la SEAIC, la Sociedad Española de Calidad Asistencial (SECA) y la Sociedad Española de Directivos de la Salud (SEDISA), tras analizar los procesos de seis centros piloto en España y, en combinación con lo recomendado por las GPC y los criterios de acreditación de las UA de la SEPAR y de la SEAIC, ha elaborado un listado de 11 indicadores de calidad asistencial en AG, que se reseñan en la tabla 12.
Indicadores de calidad asistencial en asma grave (adaptado de Crespo-Lessmann368)
| Proceso | Indicador |
|---|---|
| Derivación | Existencia de acceso prioritario para pacientes asmáticos graves a la Unidad de Asma y Hospital de Día (Fast Track): Sí/No |
| Existencia de consensos para la derivación desde Atención Primaria y otras especialidades: Sí/No | |
| Número de Programas de formación a Atención Primaria al año | |
| Existencia de sistemas de derivación no presencial (interconsulta telemática): Sí/No | |
| Diagnóstico | Porcentaje de pacientes asmáticos con prueba diagnóstica objetiva |
| Porcentaje de pacientes fenotipados con estudio de sensibilización por asma alérgica | |
| Garantía de bioseguridad en las pruebas funcionales realizadas en Atención Primaria: Sí/No | |
| Existencia de Comité de Casos Clínicos con participación de las diferentes especialidades: Sí/No | |
| Tratamiento | Medida de resultados en salud de los tratamientos (visitas a urgencias, cambios de tratamiento, retirada de corticoide sistémico) |
| Presencia de restricciones en la prescripción de algunos fármacos/tratamientos: Sí/No | |
| Porcentaje de pacientes adherentes al tratamiento farmacológico | |
| Porcentaje de pacientes con recomendación de comorbilidades, agravantes o deshabituación tabáquica registrada | |
| Porcentaje de mujeres con asma grave embarazadas que consiguen mantener el tratamiento habitual | |
| Porcentaje de pacientes con participación registrada en un programa de educación sobre enfermedad y tratamiento | |
| Seguimiento | Existencia de protocolos de seguimiento para pacientes con asma grave: Sí/No |
| Realización de cuestionarios de control de la enfermedad de forma regular: Sí/No | |
| Número de exacerbaciones graves que han requerido ingreso en el último año | |
| Valoración de la percepción del paciente acerca de su enfermedad y su grado de control de la misma: Sí/No | |
| Disponibilidad de realización de seguimiento telemático: Sí/No | |
| Enfermería | Existencia de protocolos de actuación para el Servicio de Enfermería en el manejo del paciente asmático: Sí/No |
| Número de profesionales de enfermería formados y especializados en asma asignado a la Unidad de Asma | |
| Existencia de consulta de enfermería: Sí/No |
La mayor parte de las definiciones y recomendaciones diagnósticas y terapéuticas de los adultos son aplicables a los pacientes de seis a 18 años. Este apartado se centrará en las principales diferencias y matices entre los dos grupos etarios.
Definición, diagnóstico y fenotipadoLa definición de AGNC es equiparable a la definición de los pacientes adultos teniendo en cuenta que, en niños, las dosis consideradas como medias y altas de GCI son diferentes. En la tabla 13 se exponen los límites más aceptados, aunque no existe consenso en la literatura1,2. Hay que tener también en cuenta que en la edad pediátrica se añade la afectación del crecimiento a los potenciales EA de los glucocorticoides369,370. La necesidad de GCS para mantener el control del asma, sea cual sea la dosis, debería ser considerada un criterio diagnóstico de AGNC en estas edades.
Dosis medias y altas de los glucocorticoides inhalados habitualmente utilizados en la edad pediátrica (μg/día)
| Dosis medias | Dosis altas | |||
|---|---|---|---|---|
| 6-12 años | ≥12 años | 6-12 años | ≥12 años | |
| Budesonida | >200-400 | >400-800 | >400 | >800 |
| Fluticasona propionato | >100-250 | >250-500 | >250 | >500 |
| Fluticasona furoato | - | 92 | - | 184 |
| Ciclesonida | >80-160 | >160 | >160-320 | >320 |
| Mometasona furoato* | 100 | 200-400 | 200 | >400 |
| Mometasona furoato | 100 | 200-400 | 200 | >400 |
| *breezhaler | 127,5 | 260 | ||
Para llegar al diagnóstico, es imprescindible haber optimizado previamente al máximo la adhesión al tratamiento, la exposición ambiental a factores precipitantes y las comorbilidades tratables.
En diversas cohortes de pacientes adultos se ha objetivado que el AG es más frecuente en el asma de inicio tardío371. Esto puede llevar a la conclusión errónea de que es una enfermedad poco frecuente en la infancia. En España, existe una prevalencia del 7,3% de niños con síntomas graves en el año previo372 y se estima que algo más del 5% de los niños asmáticos cumplen criterios de AGNC373. Los costes anuales en salud suponen entre el doble y 10 veces más que el del resto de niños asmáticos374,375.
No hay diferencias relevantes en lo que se refiere al abordaje diagnóstico estructurado y escalonado en unidades especializadas acreditadas y a las principales patologías con las que hacer diagnóstico diferencial (tabla 2). La rinitis afecta a un 80% de los pacientes pediátricos con AGNC. Otras comorbilidades frecuentes son la sinusitis y el reflujo gastroesofágico que aparecen en prácticamente la mitad de los pacientes376. El test de Nijmegen no está validado en niños. Aun así, se ha empleado en diversos estudios, encontrando resultados positivos hasta en un 20% de pacientes asmáticos, con mayor prevalencia en mujeres adolescentes377–379. En cuanto a la evaluación de la adhesión, hay que tener en cuenta que el TAI tampoco está todavía validado en menores de 18 años y que hay que evaluar las barreras para la adhesión en el propio paciente y en sus cuidadores. Se ha objetivado peor adhesión durante la adolescencia por lo que hay que prestar mayor atención a estos pacientes, especialmente en el proceso de transición a las unidades de adultos380.
En la práctica clínica, la clasificación por endotipos sigue realizándose en base al mecanismo patogénico de cara a seleccionar los mejores tratamientos disponibles para cada paciente. La clasificación es similar a la de los adultos, aunque el asma no T2 es raro en la infancia381,382. Existe un solapamiento entre los distintos endotipos y son poco estables a lo largo del tiempo383. La obesidad ha ido aumentando su prevalencia en la edad pediátrica en los últimos años y su presencia conlleva un fenotipo inflamatorio específico y complejo384. Valores de FENO ˃ 50 ppb (35 ppb en niños de cinco a 12 años) se correlacionan con la inflamación eosinofílica385. La eosinofilia periférica y el esputo inducido pueden ser útiles también en este sentido. La broncoscopia y el lavado broncoalveolar pueden emplearse en casos seleccionados y para el diagnóstico diferencial, pero existe controversia sobre su verdadera utilidad386,387.
SeguimientoAl igual que en los adultos, se basa en el concepto dual de control actual y riesgo futuro1,2 teniendo en cuenta ciertas peculiaridades: interviene el cuidador (habitualmente los padres), incluye la etapa de la adolescencia y el arsenal terapéutico está limitado por la edad.
Existen diversos cuestionarios clínicos validados para pacientes pediátricos388. Un consenso de expertos europeos prioriza el uso del ACT (c-ACT en pacientes entre 4 y 11 años) para el seguimiento de control de síntomas y el Pediatric Asthma Quality of Life Questionaire (PAQLQ) y el Severe Asthma Questionaire (SAQ) para la calidad de vida389. El primero de ellos, no incluyó en su validación pacientes con AG a diferencia del SAQ, que está validado en pacientes> 16 años británicos con AG390. Sin embargo, el PAQLQ tiene mayor trayectoria y facilita la comparación con visitas pasadas. Es fundamental la situación emocional de pacientes y cuidadores, así como el papel de la psicología clínica391,392.
El riesgo futuro viene determinado por la función pulmonar, exacerbaciones en el año previo, efectos secundarios de la medicación1, comorbilidades como la obesidad393,394 y factores analíticos como la eosinofilia2,395. Se debe evaluar periódicamente el cortisol matutino y valorar test de ACTH en pacientes con dosis altas de GCI, especialmente si reciben además ciclos de GCO o tratamiento crónico con corticoides intranasales396,397.
La espirometría es útil para detectar problemas de adhesión y riesgo de exacerbación. Sin embargo, el FEV1 puede estar poco alterado en AGNC y es frecuente encontrar mala correlación con el control sintomático en niños393,398. Su afectación condiciona peor pronóstico en la edad adulta393,399. El papel de la oscilometría está por determinar. Probablemente adquirirá relevancia, ya que precisa poca colaboración y valora más fielmente la afectación de la pequeña vía aérea400. Existen valores de referencia a partir de tres años401 y podría tener valor predictor para exacerbación o pérdida de control, aunque no está claramente demostrado402,403. La adhesión puede evaluarse mediante la FENO265, lo relatado por el paciente y sus cuidadores, la función pulmonar y los registros electrónicos de dispensación. La participación del paciente en la elección de su inhalador y el uso de pautas de única dosis diaria pueden ayudar a mejorarla.
La enfermera especializada y su participación en la educación entendida como un proceso dinámico junto con el repaso sistemático de la técnica de inhalación son imprescindibles404. Se debe controlar la exposición a precipitantes ambientales (alérgenos, tabaco, contaminantes…) y fomentar el ejercicio y dieta mediterránea405.
El seguimiento de los pacientes en tratamiento con mAbs debe ser, si cabe, más exhaustivo406. A la valoración sistemática de los parámetros ya referidos, se deben añadir los EA y el grado de satisfacción con el tratamiento. A los cuatro meses del inicio de un biológico debemos valorar la respuesta para decidir si continuar con el tratamiento o intentar un cambio a otro biológico en caso de mala respuesta. En caso de respuestas incompletas, si se decide continuar, habría que reevaluar esta decisión a los 12 meses de tratamiento2,407. No existe un sistema validado en pediatría para catalogar sistemáticamente la respuesta a mAbs y se tiende a extrapolar de los adultos los conceptos de superrespuesta (o respuesta completa), respuesta parcial y no respuesta407. También son necesarios estudios prospectivos que demuestren la utilidad de diferenciar entre los conceptos de remisión clínica y remisión completa, entendida como el cese de la actividad inflamatoria y la HRB40,408. Es fundamental la elaboración de registros, nacionales e internacionales, de pacientes pediátricos en tratamiento con mAbs para obtener evidencia en vida real.
Tratamiento del asma grave en niños y adolescentesEl tratamiento de base del asma del niño y adolescente es similar al adulto, pero con menos evidencia acerca de su eficacia. Los objetivos del tratamiento incluyen el control sintomático de la enfermedad, la prevención de las exacerbaciones y el mantenimiento de una función pulmonar normal, junto con la reducción de la mortalidad y de los efectos secundarios de la medicación1.
Tratamiento de basePor definición los pacientes con AG tendrán un tratamiento con dosis altas de GCI y, al menos, un segundo controlador (LABA, montelukast o ambos -escalón 5 de GEMA-)1. El concepto de dosis altas de GCI en niños no está claramente establecido, pero se considera con dosis de> 400/día de budesónida o equivalente en niños hasta 12 años2. A partir de esa edad se aplicaría la definición de adultos. Aunque no existen estudios al respecto, es prudente aplicar la definición para <12 años en adolescentes hasta los estadios finales de la pubertad, ya que los efectos sobre el crecimiento son dosis dependientes409. Se puede plantear el tratamiento con una combinación GCI/LABA en dosis única diaria o la terapia tratamiento de rescate y mantenimiento (MART), aunque los datos sobre su efectividad en población pediátrica son escasos410. También se ha demostrado eficaz el tratamiento con azitromicina 411 o el tiotropio 412 en niños a partir de los seis años con AGNC. El uso de GCS se ha abandonado en el tratamiento del AG en pediatría por la ausencia de datos de efectividad y los importantes efectos secundarios1. La falta de control o la necesidad de dosis altas de GCI, sobre todo en niños pequeños (< 12 años), hace necesario valorar el tratamiento con mAbs.
Tratamiento de las comorbilidadesLas comorbilidades son causas tratables que contribuyen al mal control del AG. Las más frecuentes en pediatría son la RA, las alergias alimentarias, la AOS y la obstrucción laríngea inducible394. En la adolescencia los problemas de salud mental, la hipopercepción de los síntomas y el tabaquismo son factores a tener en cuenta413. La obesidad es un problema relacionado con el asma cada vez más frecuente. Otros problemas como el reflujo gastroesofágico, la intolerancia a AINE o la poliposis son menos frecuentes que en el adulto394.
Anticuerpos monoclonalesOmalizumab es el mAb con mayor experiencia de uso en la población pediátrica con asma alérgica grave y sensibilización a aeroalérgenos perennes. Las revisiones sistemáticas y metaanálisis demuestran una disminución en la tasa de exacerbaciones a las 24 semanas, que se mantiene a las 52 en niños mayores de seis años414. El estudio ANCHORS, que es un estudio en vida real retrospectivo multicéntrico español, recoge la experiencia de 484 niños y adolescentes tratados con omalizumab, de los cuales 20,1% lo recibieron durante seis años, con una disminución en la tasa de exacerbaciones el primer año de un 80,2% (intervalo de confianza [IC] 95% -84,5% a -75,8%) y sin efectos secundarios adversos graves. Un 20,5% interrumpieron el tratamiento a lo largo del periodo de seguimiento por buen control del asma407.
Mepolizumab tiene una eficacia en la reducción de la tasa de exacerbaciones en adolescentes de 12 a 17 años más limitada, dado el número pequeño de pacientes incluidos en los ensayos clínicos pivotales. El estudio post hoc del grupo de 12 a 17 años, demostró una reducción de las exacerbaciones, pero con un IC más amplio que en el grupo de adultos (IC 95% 0,17-2,10)415. El ensayo clínico en niños urbanos de seis a 17 años con asma eosinofílica demostró una reducción del 27% en la tasa de exacerbaciones graves, sin mejoras en la función pulmonar ni en las puntuaciones del índice compuesto de gravedad del asma416.
Benralizumab no es un fármaco aprobado por la EMA para su uso por debajo de los 18 años, aunque los ensayos clínicos CALIMA y SIROCCO incluyeron 108 adolescentes, de los cuales 40 recibieron benralizumab con una disminución de la razón de tasa anualizada de exacerbaciones graves de 1,57 (IC 95% 0,18-13,96) y 1,77 (IC 95% 0,40-7,78), respectivamente250,251. Recientemente se ha publicado un estudio en niños de seis a 11 años417.
Dupilumab está indicado en niños por encima de los seis años con asma T2 o fenotipo eosinofílico grave. El análisis post hoc de 107 adolescentes del ensayo clínico QUEST demostró resultados similares a los adultos en las mejoras de función pulmonar, sin embargo, se observaron resultados contradictorios en la reducción de las exacerbaciones57. El ensayo clínico VENTURE observó una disminución del 59% de las exacerbaciones de asma en adolescentes de 12 a 17 años267. En el grupo de seis a 11 años, el ensayo clínico VOYAGE en 408 niños con asma moderada a grave no controlada observó disminución en la tasa de exacerbaciones y mejoras en la función pulmonar418.
Tezepelumab está autorizado desde 2023 en niños por encima de 12 años con AG tanto T2 como no T2, pero con mayor eficacia en los fenotipos T2. El ensayo clínico NAVIGATOR y su extensión el DESTINATION en 294 pacientes con AGNC, de los cuales 82 pacientes eran adolescentes de 12 a 17 años, demostró mejoras significativas en la tasa de exacerbaciones284. Por el momento no existe ensayos clínicos por debajo de esa edad.
En la tabla 14 se puede ver un resumen de los mAb usados en pediatría y sus características, así como de un algoritmo de tratamiento (fig. 5).
Anticuerpos monoclonales en población pediátrica con asma grave (adaptada de Sardon-Prado406)
| Nombre | Dianaterapéutica | Mecanismode acción | Edad de autorización EMA (años) | Indicación | DosisSQ | Comorbilidadestratables | PredictoresRespuesta | Resultados clínicos | Efectos adversos | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OMALIZUMAB | IgE | Unión a IgE circulante impidiendo su unión al receptor FcɛRI en mastocitos, basófilos y células plasmocitoides dendríticas; FcɛRII en células plasmocitoides dendríticas y Eos.Reducción IgE libre e infrarregulación de la expresión de receptores | ≥6 | Asma alérgica grave no controlada con sensibilización a neumoalérgenos perennes y en rango según peso y nivel de IgE | Según peso e IgE total75-600 mgIgE (KU/L):30-1.300cada 2-4semanasJeringa precargadaAdministración domiciliaria | Urticaria crónica idiopáticaPoliposis nasa | Eos sanguíneos≥260/μLFENO>20 ppb | ↓ | ↑ | ↑ | ↑ | ↓ | Reacción localDolor de cabezaFiebre (6-12 años)Anafilaxia (muy rara |
| MEPOLIZUMAB | IL-5 | Unión a IL-5 circulante impidiendo su unión al receptor αReducción de Eos | ≥6 | Asma grave no controlada y Eos sanguíneos≥150/μL o≥300/μL en el último año | 6-11 años:40 mg≥12 años: 100 mgcada 4 semanasJeringa precargada o autoinyector (pen)administración domiciliaria | PoliposisEGPAHES | ↑ Eos↑ EPoliposisGCS | ↓ | ↑ | ↑ | ↑ | ↓ | Reacción localDolor de cabezaCongestión nasalAnafilaxia (muy rara) |
| DUPILUMAB | IL-4Rα | Unión a IL-4Rα bloqueando señal de Il-4/IL-13Infrarregulación vía inflamatoria TH2Impiden extravasación de Eos a tejidos | ≥6 | Asma grave no controlada y Eos sanguíneos≥150/μL y≤1.500/μL y/o FeNO≥25 ppb y/o necesidad de CS | 6-11 años15-<30 kg: 300mg cada 4 semanas30-<60 kg: 200mg cada 2 semanas o 300mg cada 4 semanas≥60 kg: 200mg cada 2 semanas≥12 y: 200mg cada 2 semanas (400mg la primera dosis)*Si CS/DA moderada grave 300mg cada 2 semanas (600mg la primera dosis)Jeringa precargada o autoinyector (pen)Administración domiciliaria | DAPoliposis nasalEoE | ↑ Eos↑ FENO | ↓ | ↑ | ↑ | ↑ | ↓ | Reacción localElevación transitoria de eosinofiliaEGPA (muy rara)Anafilaxia (muy rara) |
| TEZEPELUMAB | TSLP | Unión a TSLP circulante impidiendo su unión a receptorActúa a niveles altos de cascada inflamatoria | ≥12 | Asma grave T2 o no T2 con exacerbaciones | 210mg cada 4 semanasJeringa precargada o autoinyector (pen) | ↑ Eos↑ FENONo T2 | ↓ | ↑ | ↑ | ↑ | Reacción localFaringitisArtralgiasDolor de espaldaCongestión nasalAnafilaxia (muy rara) | ||
C: control; DA: dermatitis atópica; E: exacerbaciones; EGPA: granulomatosis eosinofílica con poliangeítis; EMA: European Medicines Agency; EoE: esofagitis eosinofílica; Eos: eosinófilos; FcɛRI y II: receptor de alta y baja afinidad para región Fc de IgE; FENO: fracción exhalada de óxido nítrico; FP: función pulmonar; GCS: corticoides sistémicos; HES: síndrome hipereosinofílico; Ig: inmunoglobulina; IL-5Rα: subunidad α del receptor de IL-5; IL-4Rα: subunidad α del receptor de IL-4; ppb: partes por billón; QoL: calidad de vida; SQ: subcutánea; TSLP: linfopoyetina estromal tímica.
Algoritmo terapéutico en AGNC en niños y adolescentes (adaptado de Bacharier419). Las distintas posibilidades de tratamiento con mAbs están ordenadas por orden alfabético, al no existir estudios comparativos entre ellos. La elección entre uno u otro dependerá en la medida de los posible de las comorbilidades asociadas.
AGNC: asma grave no controlada; DUPI: dupilumab; Eos, eosinófilos; FENO: fracción exhalada de NO; GCI: glucocorticoides inhalados; Ig: inmunoglobulina; LABA: broncodilatador de acción prolongada; LAMA: antagonistas anticolinérgicos de acción prolongada; MEPO: mepolizumab; OMA: omalizumab; RSCcPN: rinosinusitis con poliposis; TEZE: tezepelumab.
* Si Eos en sangre periférica>1.500/μL descartar otras causas de eosinofilia, y en caso negativo valorar con precaución el uso de DUPI, ya que puede inducir una elevación transitoria de los Eos en sangre tras el inicio del tratamiento.
** Elegir en función de las comorbilidades asociadas: OMA si urticaria crónica idiopática, MEPO si rinosinusitis crónica con poliposis nasal o síndromes hipereosinofílicos, DUPI si dermatitis atópica, esofagitis eosinofílica o RSCcPN.
Las medidas de control ambiental son de dudosa eficacia, aunque algo más que en el adulto2. En adolescentes debe evitarse la exposición pasiva al humo del tabaco y su consumo, así como del vapeo413. La vacunación anual frente a la gripe se considera coste-efectiva en esta población1. La infección por SARS-CoV-2 podría ser más grave en niños con AGNC420, por lo que se debe valorar también su inmunización.
Transición del adolescente con AG desde unidades pediátricas a unidades del adulto
Un documento de posicionamiento de la Sociedad de Medicina del Adolescente en 1993 definía la transición como «el paso intencionado y planificado de adolescentes con enfermedades crónicas de una atención centrada en el niño a sistemas de atención sanitaria orientados a los adultos»421. Los cambios a nivel físico, emocional y psicosocial, asociado a riesgos potenciales como exposición a hábitos tóxicos, actitudes negacionistas, y falta de la adhesión a la medicación conllevan un gran riesgo de pérdida de control de la enfermedad y pueden suponer un reto e impedir o complicar una adecuada transición en el adolescente con enfermedad crónica422. Por ello es importante planificar la transición y proporcionar un modelo estandarizado y eficaz, según la Academia Americana de Pediatría: centrado en los adolescentes, mejorando sus conocimientos y habilidades para el automanejo con el apoyo de la familia, conociendo sus dificultades, actitudes y creencias individuales, los centros pediátricos y de adultos423.
Este plan de transición debe ser individualizado, elaborado con los profesionales sanitarios, y constituir una «hoja de ruta» hacia los objetivos acordados a corto y largo plazo424,425.
Debemos tener en cuenta que un proceso de transición poco estructurado y mal planificado, o la ausencia de este, aumenta el riesgo durante la transición a la atención en adultos de pérdida de seguimiento, diferencia de cuidados, incremento de morbimortalidad, deterioro de la calidad de vida e incremento de los costes relacionados con la salud426–430. La mayoría de los centros reconocen la falta de recursos e incluso inexistencia de un protocolo establecido para una adecuada transición389,431,432. Un estudio europeo realizado en 2020 que incluyó a 1.179 especialistas pediátricos y de adultos informó de que el 86% de los profesionales sanitarios no disponía de un protocolo de transición para sus servicios389, siendo similar en nuestro país431.
Una cohorte francesa, analizó la transición de 54 pacientes con AG a unidades de adulto. Los autores insisten en la importancia de un buen programa de educación terapéutica y una adecuada satisfacción del adolescente durante el proceso, siendo fundamental una discusión precoz del plan de transición para una correcta planificación y así poder mantener el control de la enfermedad, la función pulmonar y evitar pérdidas de seguimiento433.
En 2020 la Academia Europea de Alergia e Inmunología Clínica (EAACI) publicó una guía para la transición de adolescentes con asma y alergia, cuyos elementos clave son una iniciación temprana, un enfoque multidisciplinar, la educación del paciente y su familia, el seguimiento de la adhesión, centrarse de forma individualizada en las áreas de menor confianza e implicar a sus padres en el apoyo al paciente, pero no incluye recomendaciones específicas para el paciente con AG432. Posteriormente publicaron un documento de posicionamiento de recursos prácticos para que esta transición fuese efectiva434.
Recientemente se ha publicado el primer documento de consenso multidisciplinar que proporciona un marco para la transición de los adolescentes con AG a la atención de adultos (Consenso STAR). Las recomendaciones enfatizan la importancia de desarrollar un plan de transición individualizado y estructurado, centrado en mejorar la educación terapéutica y la autonomía del paciente. La coordinación entre los especialistas pediátricos y de adultos es clave si se quiere asegurar que se cubren los aspectos cruciales del proceso. La implementación de estas recomendaciones estandarizará la transición en las organizaciones sanitarias, garantizando un proceso fluido y eficiente y minimizando el impacto en el paciente adolescente424,431,433. En la figura 6 se especifican las recomendaciones para la planificación de la transición, así como para el proceso de transición en sus distintas fases, desde la preparación, la transferencia efectiva hasta el seguimiento. Estas recomendaciones podrían ser evaluadas y adaptadas en cada centro para alcanzar los mejores resultados posibles.
Recomendaciones del Consenso STAR para la transición (adaptada de Valverde-Molina431).
Las recomendaciones validadas por el panel fueron:
El AGNC en niños y adolescentes es la que presenta un paciente que no se controla a pesar de seguir el tratamiento correctamente realizado a diario con al menos un glucocorticoide inhalado (GCI) a dosis altas, un agonista adrenérgico de acción larga (LABA) y un agonista muscarínico de acción larga (LAMA) o un glucocorticoide sistémico (GCS) de mantenimiento (independientemente de la dosis).
Para llegar al diagnóstico de AGNC es imprescindible haber optimizado previamente al máximo la adhesión al tratamiento, la técnica de inhalación y la exposición ambiental a factores precipitantes.
En todo niño o adolescente que cumpla criterios de AGNC se debe realizar un abordaje en unidades de referencia para confirmar el diagnóstico y descartar comorbilidades tratables.
Se deben realizar estudios complementarios para ajustar al máximo la clasificación por endotipos en AGNC.
Valores de FENO˃ 50ppb (35 ppb en niños de cinco a 12 años), Eos periféricos ˃ 300/μL o Eos en esputo ˃ 2% orientan a fenotipo T2.
La broncoscopia y el lavado broncoalveolar pueden emplearse en casos seleccionados y para el diagnóstico diferencial, pero no deben aplicarse de rutina en todos los pacientes.
Al igual que en los adultos, el seguimiento del AGNC en el niño y adolescente se basa en el concepto dual de control actual y riesgo futuro teniendo en cuenta ciertas peculiaridades: interviene el cuidador (habitualmente los padres), incluye la etapa de la adolescencia y el arsenal terapéutico está limitado por la edad.
Entre los cuestionarios validados, se debe emplear prioritariamente el ACT (c-ACT en menores de 12 años) para el seguimiento del control sintomático y el PAQLQ para la calidad de vida.
La espirometría es útil para detectar problemas de adhesión y riesgo de exacerbación, aunque su normalidad no excluye afectación sintomática.
Se debe evaluar periódicamente el cortisol matutino y valorar test de hormona adrenocorticotrópica en pacientes con dosis altas de corticoides inhalados, especialmente si reciben además ciclos de corticoides orales o tratamiento crónico con corticoides intranasales
La adhesión debe evaluarse en todas las consultas y se debe tener en cuenta la visión del paciente y de sus cuidadores principales, así como los datos de función pulmonar y los registros electrónicos de dispensación.
Se recomienda la participación del paciente en la elección de su inhalador con el fin de ayudar a mejorar la adhesión.
Se recomienda el uso de pautas de dosis única diaria con el fin de ayudar a mejorar la adhesión.
Es necesaria la participación de la enfermera especializada en la educación y el repaso sistemático de la técnica inhalatoria.
Se debe controlar en cada consulta la exposición a precipitantes ambientales (alérgenos, tabaco, vapeadores, cannabis, contaminantes) y fomentar el ejercicio y la dieta mediterránea.
Durante el seguimiento de los pacientes en tratamiento con mAbs, se deben evaluar los posibles EA y el grado de satisfacción con el tratamiento.
A los cuatro meses del inicio de un mAb se debe valorar cambiar de tratamiento en caso de ausencia de respuesta.
En caso de decidir mantener el tratamiento con un mAb en los casos de respuesta incompleta a los cuatro meses, se debe plantear cambiar si la respuesta no es completa a los 12 meses.
Son necesarios estudios prospectivos que demuestren la utilidad de diferenciar entre los conceptos de remisión clínica y remisión completa, entendida como el cese de la actividad inflamatoria y la HRB.
Es fundamental la elaboración de registros, nacionales e internacionales, de pacientes pediátricos en tratamiento con mAbs para obtener evidencia en vida real.
Deben considerarse dosis altas de GCI el tratamiento con más 400μg diarios de budesónida o equivalente en niños hasta los 12 años.
En el niño con AGNC es preferible utilizar un segundo o tercer controlador antes de alcanzar dosis altas de GCI.
La necesidad de dosis altas de GCI para el control del AG es un motivo para valorar el tratamiento con mAbs, sobre todo en <12 años.
Se recomienda investigar acerca del consumo de tabaco, vapeadores o cigarrillos electrónicos en adolescentes con AG.
En pacientes T2, la elección entre omalizumab, mepolizumab y dupilumab debe tener en cuenta la edad del paciente y las comorbilidades asociadas.
En pacientes no T2 mayores de 12 años la primera indicación sería tezepelumab.
Se recomienda el uso de omalizumab en aquellos pacientes con sensibilización a aeroalérgenos perennes con repercusión clínica demostrada.
Los resultados de los ensayos clínicos de adultos no son totalmente extrapolables a la población en edad pediátrica, por los que es necesario impulsar la realización de estudios específicos en esa edad.
FinanciaciónEl desarrollo de este manuscrito ha sido financiado por fondos propios de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).
Contribuciones de los autoresTodos los autores firmantes participaron activamente en las reuniones de trabajo desarrolladas durante la elaboración de este artículo, desde la concepción inicial hasta la revisión final del manuscrito. Todos colaboraron en la redacción de los diferentes apartados del texto, distribuyéndose las secciones de acuerdo con su experiencia y áreas de interés. Además, llevaron a cabo revisiones críticas de las distintas versiones del documento y, como comité científico, propusieron las recomendaciones, discutieron y acordaron las directrices presentadas al panel Delphi. Finalmente, revisaron los resultados obtenidos y validaron de manera consensuada el manuscrito definitivo.
Uso de inteligencia artificialPara la elaboración de este documento no se han utilizado herramientas de inteligencia artificial
Conflictos de interésFrancisco Javier Álvarez-Gutiérrez declara haber recibido honorarios por labores de asesoría, impartir conferencias, asistencia a congresos y reuniones científicas y provisión de materiales por parte de AstraZeneca, GlaxoSmithKline, Orion Pharma y Sanofi/Regeneron. Parte de estas colaboraciones se realizaron a través de SEPAR.
Marina Blanco Aparicio declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de AstraZeneca, Chiesi, GlaxoSmithKline, Sanofi y Teva.
Francisco Casas Maldonado declara haber recibido honorarios por labores de asesoría, impartir conferencias, participar en eventos educativos, ayudas para asistencia a reuniones científicas y participación en comités asesores por parte de AstraZeneca, Boehringer-Ingelheim, CSL Behring, GlaxoSmithKline, Grifols y Sanofi/Regeneron.
Vicente Plaza declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de AstraZeneca, Chiesi, GlaxoSmithKline y Medwell. Ha recibido ayudas para asistencia a congresos y reuniones científicas de AstraZeneca. Asimismo, declara haber recibido una ayuda institucional para investigación por parte de Chiesi.
Gregorio Soto Campos declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de AstraZeneca, Gebro Pharma, GlaxoSmithKline, Menarini y Sanofi. Ha recibido ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca y Sanofi. Es coordinador del Área de Asma de SEPAR.
Francisco Javier González-Barcala declara haber recibido honorarios por labores de asesoría, impartir conferencias, participación en comités asesores y ayudas para asistencia a congresos y reuniones científicas por parte de ALK-Abelló, AstraZeneca, BIAL, Chiesi, Gebro Pharma, GlaxoSmithKline, Menarini, Novartis, ROVI, ROXALL, Sanofi, Stallergenes Greer y Teva. Además, forma parte del comité editorial de Open Respiratory Archives, European Respiratory Journal Open Research y BMC Pulmonary Medicine, habiendo permanecido al margen del proceso de evaluación y decisión relacionado con este artículo.
Carlos Almonacid declara haber recibido honorarios por labores de asesoría, impartir conferencias, participación en actividades educativas, participación en comités asesores y ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca, Chiesi, Faes Farma, GlaxoSmithKline, MSD y Sanofi. Ha recibido ayudas para investigación por parte de AstraZeneca y GlaxoSmithKline. Fue vicepresidente de SEPAR.
Ebymar Arismendi declara haber recibido honorarios por impartir conferencias y participar en actividades educativas y ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca, Gebro Pharma, GlaxoSmithKline, Menarini, MSD y Sanofi/Regeneron.
Carlos Cabrera declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de AstraZeneca, Chiesi, Gebro Pharma, GlaxoSmithKline, Menarini y Sanofi. Asimismo, ha recibido ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca y Sanofi, y ha participado en comités asesores de AstraZeneca, GlaxoSmithKline y Sanofi.
Roberto Cabestre García declara haber recibido honorarios por participar como jurado en premios vinculados a reuniones científicas patrocinadas por AstraZeneca. Ha recibido honorarios por participación en actividades educativas, ayudas para la asistencia a jornadas científicas y por participación en comités asesores por parte de Gebro Pharma y GlaxoSmithKline.
José Ángel Carretero declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, así como ayudas para asistencia a congresos y reuniones científicas, por parte de AstraZeneca, Faes Farma, Gebro Pharma, GlaxoSmithKline, Menarini y Sanofi.
Manuel Castilla Martínez declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de AstraZeneca, GlaxoSmithKline y Sanofi. Asimismo, ha recibido ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca, Chiesi, Menarini y Sanofi.
José Antonio Castillo Vizuete declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, así como ayudas para asistencia a congresos y reuniones científicas y participación en comités asesores, por parte de ALK-Abelló, AstraZeneca, GlaxoSmithKline y Sanofi/Regeneron. Es coordinador del Grupo de Rinitis, Rinosinusitis y Pólipos Nasales de la Sección de Asma de SEPAR.
Carolina Cisneros Serrano declara haber recibido ayudas para investigación, honorarios por labores de asesoría, impartir conferencias y participar en actividades educativas, ayudas para asistencia a congresos y reuniones científicas y participación en comités asesores por parte de AstraZeneca, Chiesi, Cipla, Faes Farma, Gebro Pharma, GlaxoSmithKline, Menarini y Sanofi.
Álvaro Gimeno Díaz de Atauri declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, así como ayudas para asistencia a congresos y reuniones científicas por parte de Sanofi/Regeneron.
David Díaz Pérez declara haber recibido honorarios por impartir conferencias, participar en actividades educativas y comités asesores, así como ayudas para asistencia a congresos y reuniones científicas, por parte de AstraZeneca, Boehringer Ingelheim, Chiesi, Sanofi y Teva.
Christian Domingo Ribas declara haber recibido honorarios por labores de asesoría, impartir conferencias y participar en actividades educativas, así como ayudas para asistencia a congresos y reuniones científicas, y provisión de materiales por parte de ALK-Abelló, Asac Pharmaceutical Immunology, AstraZeneca, GlaxoSmithKline, Immunotek, MSD, Novartis, Sanofi y Teva.
Juan Luis García Rivero declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, ayudas para asistencia a congresos y reuniones científicas y por participación en comités asesores por parte de AstraZeneca, Chiesi, Gebro Pharma, GlaxoSmithKline, Grifols, Sanofi/Regeneron y Zambon. Ha recibido ayudas institucionales para investigación por parte de AstraZeneca, GlaxoSmithKline y Sanofi/Regeneron.
Alejandro López Neyra declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de AstraZeneca, GlaxoSmithKline, Novartis y Sanofi. Asimismo, ha recibido ayudas para asistencia a congresos y reuniones científicas por parte de Sanofi.
Eva Martínez-Moragón declara haber recibido honorarios por conferencias, presentaciones y actividades educativas, además de ayudas para asistencia a congresos y reuniones científicas, y haber cobrado honorarios por consultoría de AstraZeneca, Chiesi, Gebro Pharma, GlaxoSmithKline, Menarini y Sanofi/Regeneron.
Ines de Mir Messa declara haber recibido honorarios por labores de asesoría, impartir conferencias, participación en actividades educativas, participación en comités asesores y ayudas para asistencia a congresos y reuniones científicas por parte de Aldo-Unión, Gebro Pharma, GlaxoSmithKline y Sanofi/Regeneron.
Xavier Muñoz Gall declara haber recibido honorarios por labores de asesoría, impartir conferencias, participación en actividades educativas y ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca, Boehringer Ingelheim, Chiesi, Faes Farma, GlaxoSmithKline, Menarini, Novartis y Sanofi. Asimismo, ha recibido ayudas para investigación por parte de AstraZeneca, GlaxoSmithKline, Novartis y Sanofi.
Alicia Padilla Galo declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, así como ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca, Chiesi, Faes Farma, Gebro Pharma, GlaxoSmithKline, Menarini y Sanofi.
Miguel Perpiñá Tordera declara no tener conflicto de interés.
Luis Pérez de Llano declara no tener conflicto de interés.
Fernando Sánchez Toril declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, ayudas para asistencia a congresos y reuniones científicas, y retribuciones por su participación en comités asesores por parte de AstraZeneca, GlaxoSmithKline y Sanofi.
Verónica Sanz Santiago declara haber recibido honorarios por impartir conferencias y participar en actividades educativas por parte de Aldo-Unión, AstraZeneca, GlaxoSmithKline y Sanofi.
José Valverde Molina declara haber recibido honorarios por impartir conferencias y participar en actividades educativas, así como ayudas para asistencia a congresos y reuniones científicas por parte de AstraZeneca, Gebro Pharma, GlaxoSmithKline y Sanofi. Asimismo, ejerce como presidente de la Asociación de Asma Grave de Murcia (España).
Los autores quieren agradecer a los panelistas especialistas en neumología su valiosa opinión: Rubén Andújar Espinosa; Aurelio Arnedillo Muñoz; Irina Bobolea; Ana Boldova Loscertales; Carlos Bujalance Cabrera; Concepción Cañete; Pilar Cebollero Rivas; Astrid Crespo; Elena Curto; Alfredo de Diego Damiá; Ana Isabel Enríquez Rodríguez; Luis Manuel Entrenas; Cleofe Fernández Aracil; Ana Fernández Tena; Rocío Garcia; Raúl Godoy Mayoral; Ana Gómez Bastero; José Antonio Gullón Blanco; Tamara Hermida Valverde; Luis Hernández Blasco; Hemily Izaguirre Flores; Antolín Lopez Viña; Carlos Martínez Rivera; Juan Francisco Medina Gallardo; Carlos Melero Moreno; Francisco Javier Michel De La Rosa; Mar Mosteiro Añón; Antonio Pereira Vega; Gerardo Pérez Chica; Francisco Pérez-Grimaldi; Cesar Picado Valles; Carolina Puchaes Manchón; Ana Pueyo; Jacinto Ramos Gonzalez; Berta Román Bernal; Auxiliadora Romero; Pedro Romero Palacios; Sylvia Sanchez Cuellar; Antonio Sebastián Ariño; Joan Serra Batlles; José Serrano Pariente; José Carlos Serrano Rebollo; Ana Isabel Sogo Sagardía; M. Agustín Sojo González; Andrea Trisán; Borja Valencia Azcona; Paz Vaquero Lozano; Elisabeth Vera Solsona. Además de a aquellos panelistas especialistas en pediatría: Sara Bellón; Silvia Castillo; Ana Díez; Mirella Gaboli; Ignacio Iglesias Serrano; Carlos Martín; Santiago Pérez Tarazona; Juan Carlos Ramos Díaz; Olaia Sardón; María del Valle Velasco
Los autores quieren agradecer el soporte y colaboración de Medical Statistics Consulting (MSC) en el proceso de actualización de las recomendaciones, así como la colaboración de Blanca Piedrafita, PhD y de Antoni Torres-Collado, PhD (MSC) en la coordinación y edición del manuscrito siguiendo la normativa de buenas prácticas en publicación (GPP 2022).




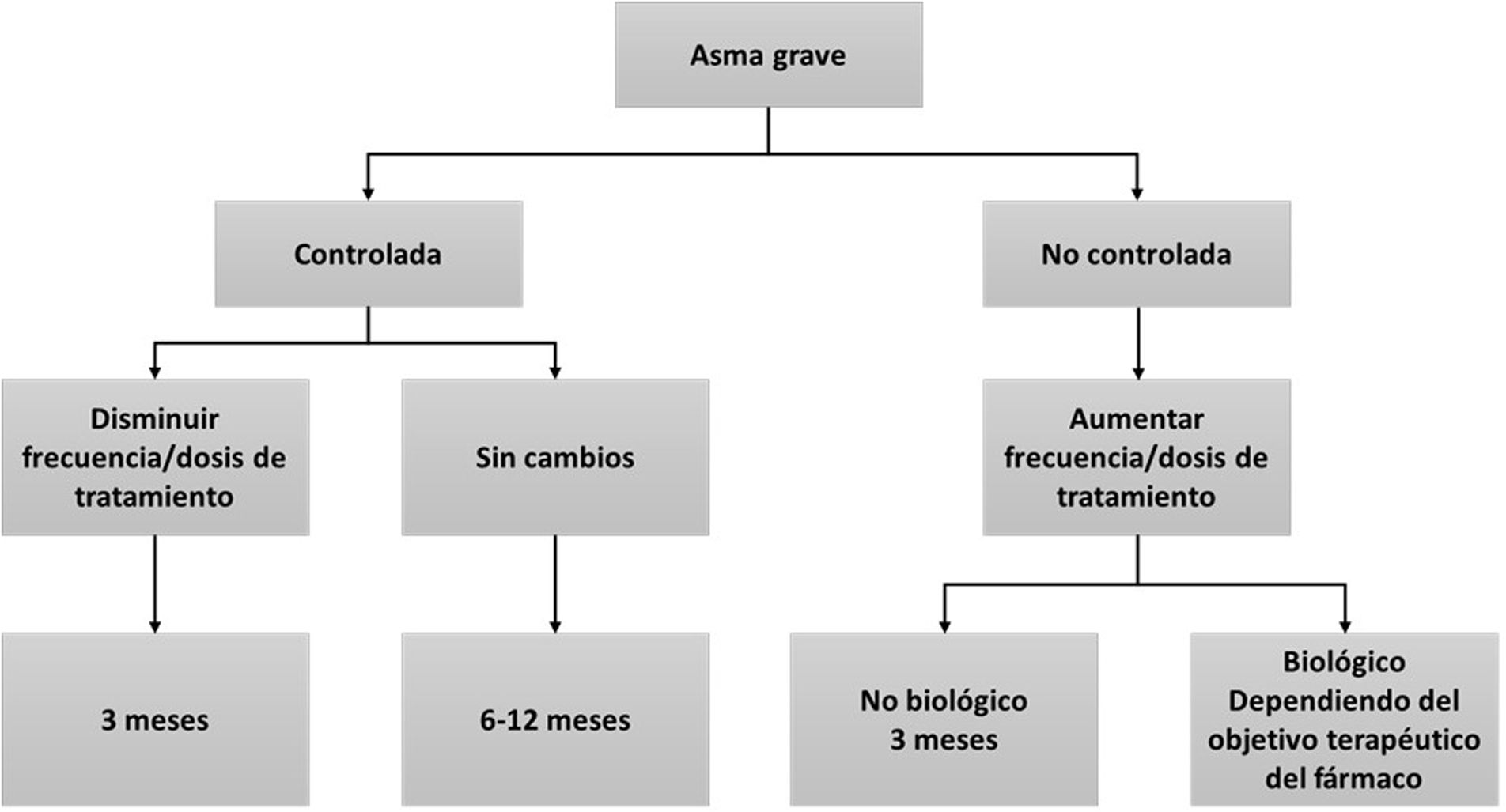

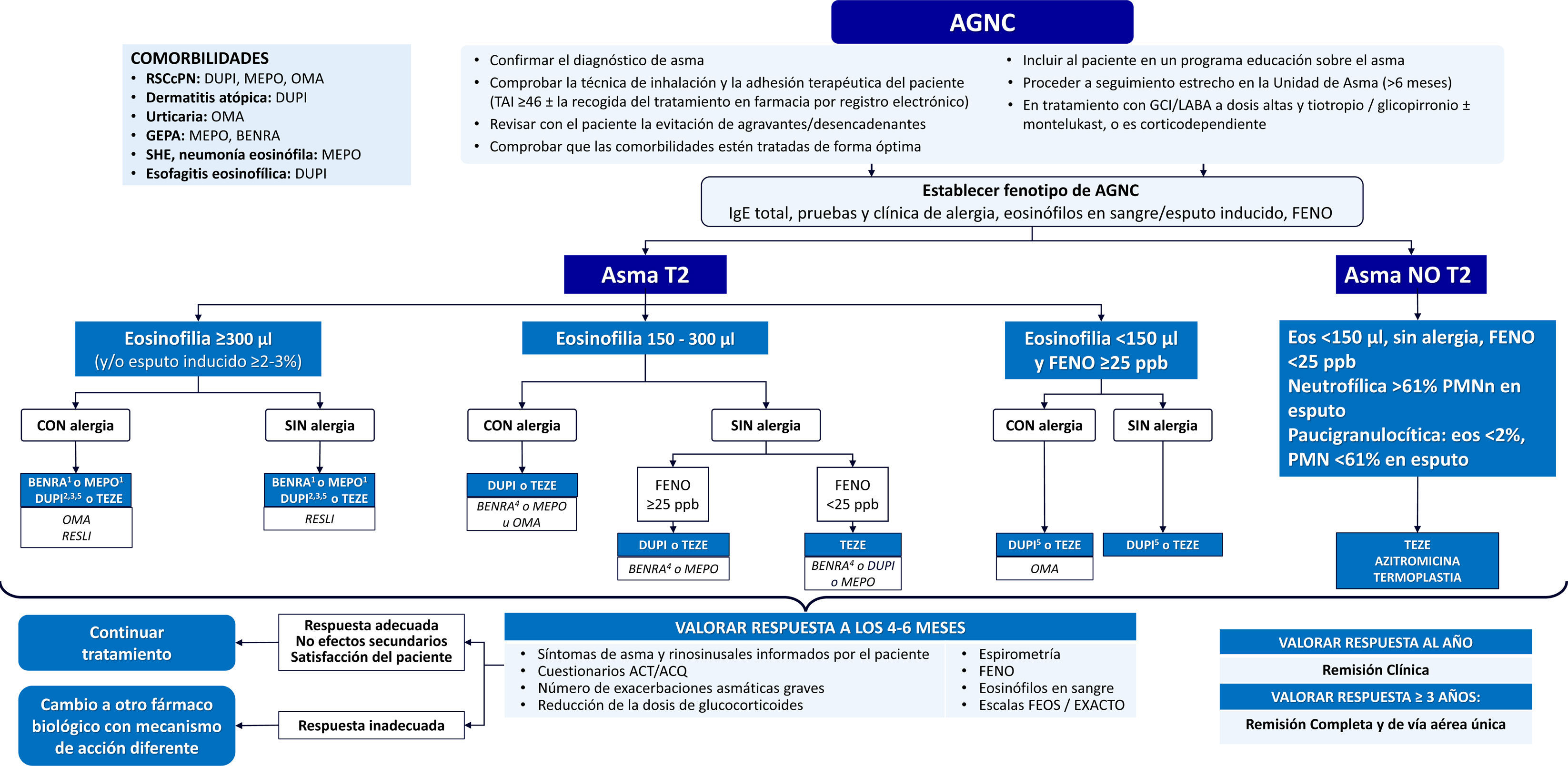
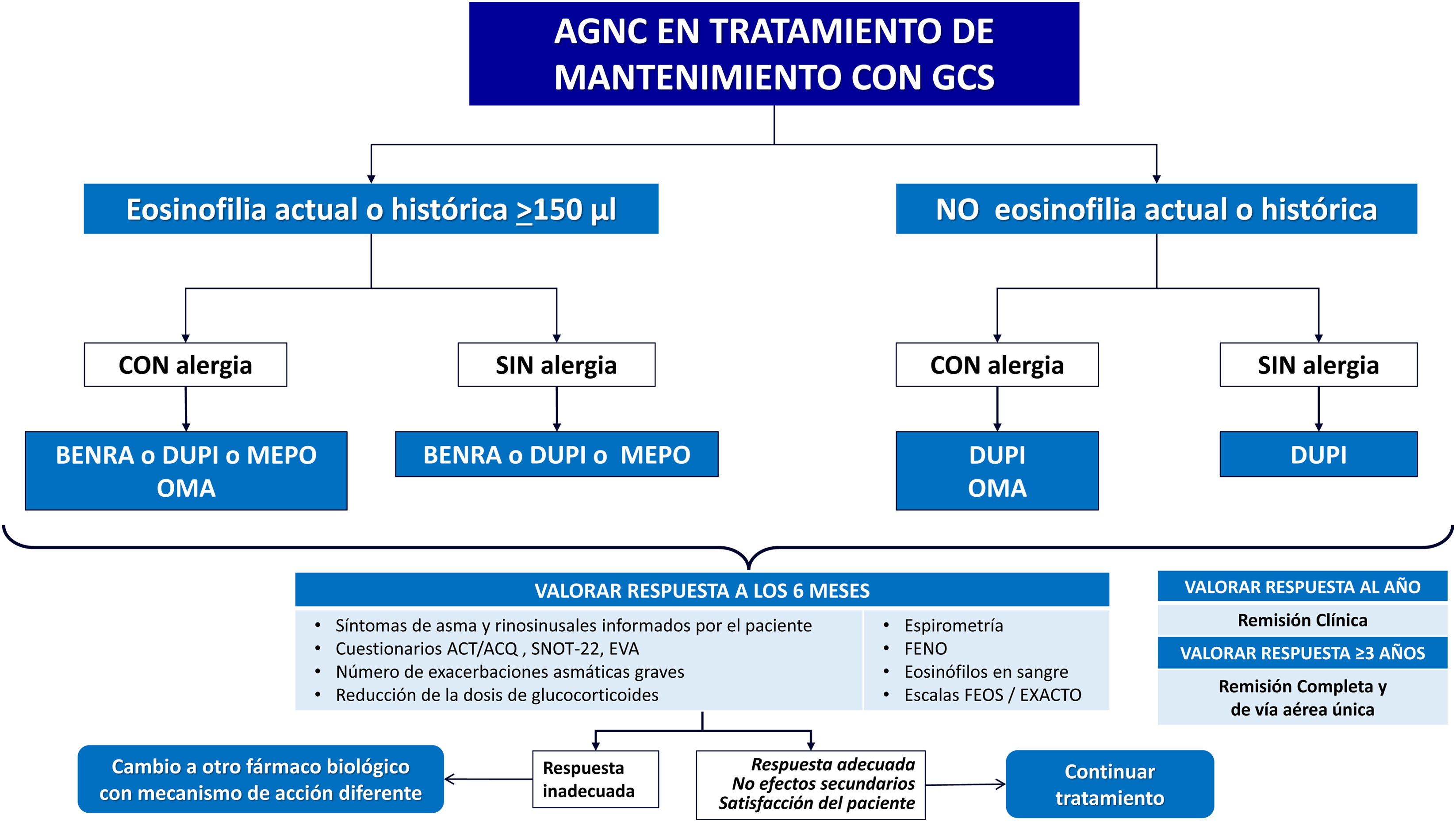
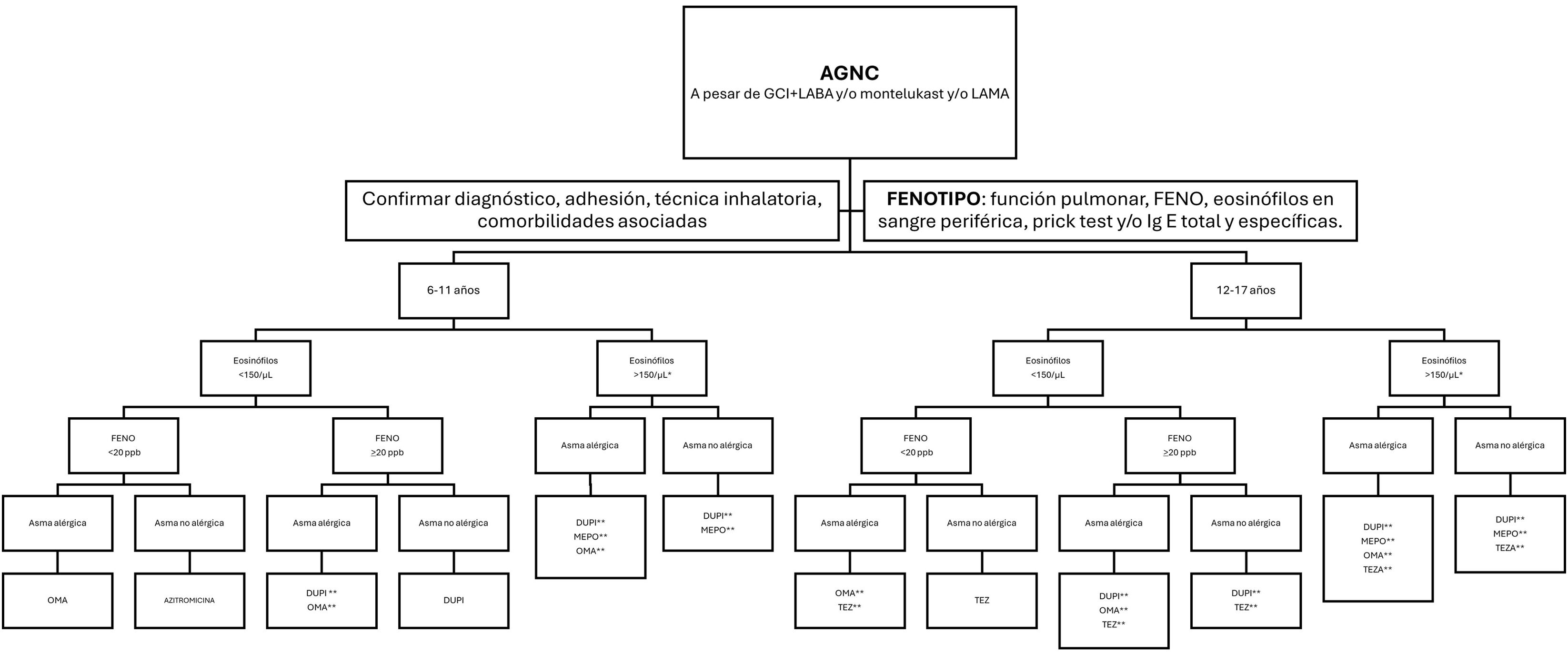
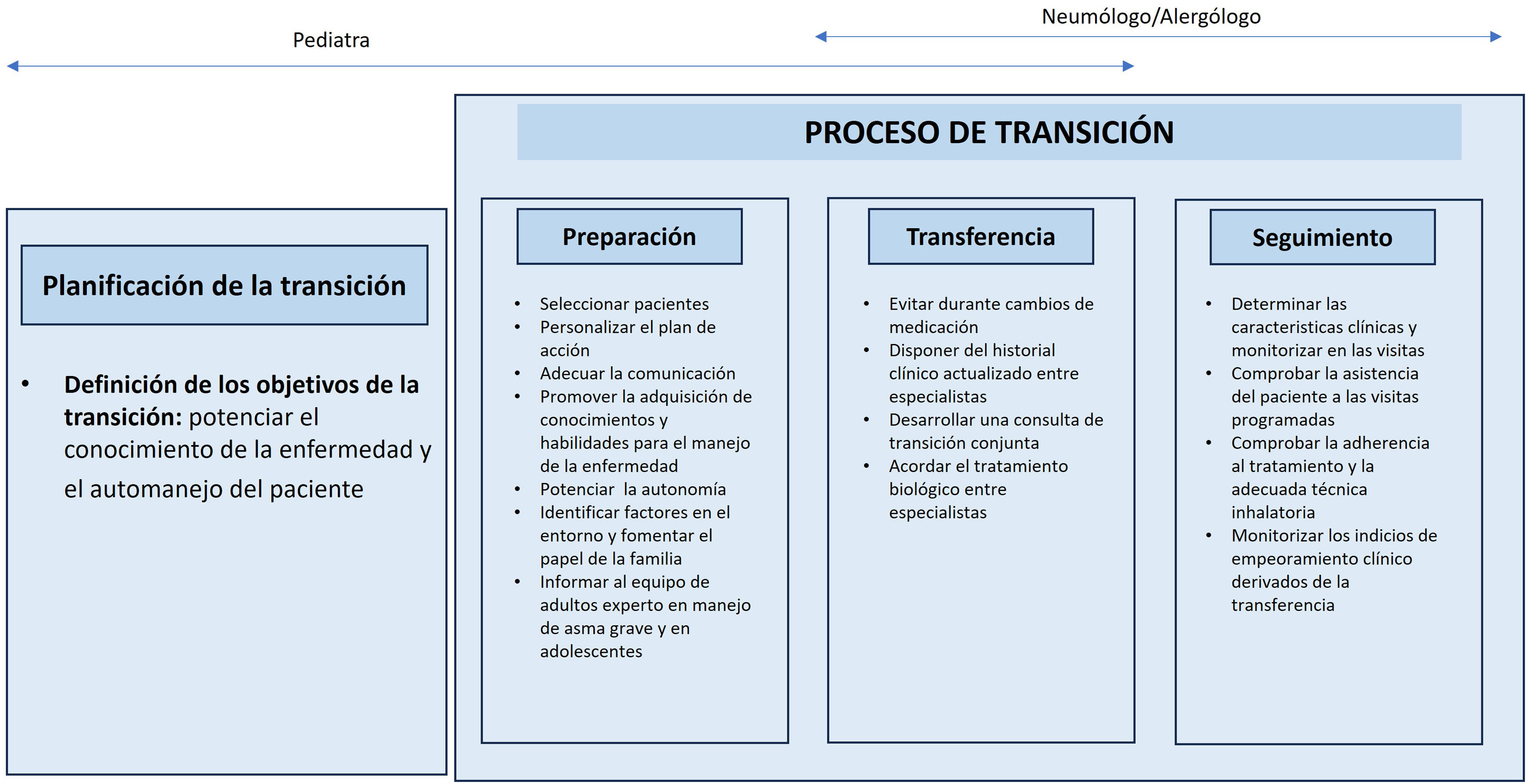

















![Algoritmo terapéutico del AGNC en tratamiento crónico con GCO. ACT: Asthma Control Test; ACQ: Asthma Control Questionnaire; AGNC: asma grave no controlada; BENRA: benralizumab; DUPI: dupilumab; EVA: escala visual analógica; FENO: fracción exhalada de óxido nítrico; GCS: glucocorticoides sistémicos; MEPO: mepolizumab; OMA: omalizumab; SNOT-22: cuestionario de síntomas nasales. Cuando los fármacos biológicos están a igual nivel se ordenan alfabéticamente y no es indicativo de orden de elección. Definiciones: AGNC: asma que precisa tratamiento con GCI dosis altas +LABA y LAMA y presenta ≥1 de los siguientes criterios: • ACT <20 o ACQ>1,5 • ≥2 ciclos de glucocorticoides orales (GCO) de ≥3 días de duración en el año previo • ≥1 ingreso hospitalario por agudización asmática en el año previo • FEV1 ≤80% de esperado Inflamación refractaria de T2: ≥1 de los siguientes criterios mientras el paciente usa GCO diarios: • ≥150 Eos por microlitro en sangre • FENO ≥25 ppb (American Thoracic Society Committee) • ≥2% de Eos en esputo • El asma está clínicamente provocada por alérgenos Los GCO a menudo suprimen los biomarcadores de la inflamación de Tipo 2 (Eos en sangre, Eos en esputo y FENO). Por lo tanto, si es posible, estas pruebas se deben realizar antes de comenzar un curso corto o tratamiento de mantenimiento con GCO, o cuando el paciente esté con la dosis más baja posible de GCO. Umbrales de eosinofilia en sangre: al menos una determinación de más de 300 Eos/μL en el último año. En pacientes tratados con corticoides sistémicos de forma crónica o recientemente pueden aparecer cifras bajas de Eos. En este caso puede ser de utilidad revisar valores históricos. Umbrales de FENO. El punto de corte se establece en 25 ppb. No obstante, se debe considerar que la medida de FENO puede verse alterada por la toma reciente de corticoides sistémicos y la dosis total de corticoides inhalados, por la edad y tabaquismo (niveles más bajos en fumadores). Si aparecen niveles altos de FENO, verificar que el paciente se autoadministra correctamente la medicación inhalada (adhesión terapéutica y técnica inhalatoria). Respuesta a fármaco biológico (escalas multidimensionales EXACTO y FEOS) Elección entre mAbs El orden en que aparecen los biológicos en el esquema, cuando coinciden en una indicación, obedece solo al tiempo que llevan comercializados. En la elección deben considerarse: el recuento de Eos en sangre, la función pulmonar, el uso de corticoides orales de mantenimiento, la presencia de comorbilidades: poliposis nasal/EREA, urticaria crónica, dermatitis atópica y enfermedades asociadas a asma (granulomatosis eosinofílica con poliangeítis [GEPA], neumonía eosinófila, ABPA, esofagitis eosinofílica). • Benralizumab (mayor eficacia>300 Eos/μL): pacientes con mala función pulmonar, poliposis, corticoides orales de mantenimiento y dificultad para acceder a unidad de asma. • Reslizumab (mayor eficacia>400 Eos/μL): mejora la función pulmonar. No hay ensayos clínicos que demuestren que sea eficaz para reducir la dosis de GCO. Administración intravenosa. • Mepolizumab (su indicación es a partir de 150 Eos/μL, pero mayor eficacia>500 Eos/μL): indicado en pacientes con>150 Eos /μL si existen valores históricos de>300 Eos/μL. Se ha demostrado que permite reducción o retirada de GCO. • Dupilumab (mayor eficacia>300 Eos/μL y FENO>50 ppb): mejora la función pulmonar, la poliposis nasal y la dermatitis atópica grave. Se ha demostrado que permite reducción o retirada de GCO y aumenta los valores de Eos. La administración es quincenal. Según IPT, posible indicación en todos los pacientes corticodependientes. • Tezepelumab según IPT está indicado en el asma grave no controlada, independientemente del valor de biomarcadores. Para elegir entre fármacos con potencial eficacia en un determinado paciente, se deben considerar criterios de comodidad posológica (preferible mensual/bimensual en lugar de quincenal), vía de administración (preferible subcutáneo a intravenoso) y costes. La termoplastia está indicada en pacientes sin enfisema/bronquiectasias/atelectasias ni comorbilidades importantes. Sin tratamiento con anticoagulantes o inmunosupresores y que no presenten infecciones recurrentes. La FEV1 debe ser mayor de 40% y no debe haber contraindicación para BFC con sedación. Algoritmo terapéutico del AGNC en tratamiento crónico con GCO. ACT: Asthma Control Test; ACQ: Asthma Control Questionnaire; AGNC: asma grave no controlada; BENRA: benralizumab; DUPI: dupilumab; EVA: escala visual analógica; FENO: fracción exhalada de óxido nítrico; GCS: glucocorticoides sistémicos; MEPO: mepolizumab; OMA: omalizumab; SNOT-22: cuestionario de síntomas nasales. Cuando los fármacos biológicos están a igual nivel se ordenan alfabéticamente y no es indicativo de orden de elección. Definiciones: AGNC: asma que precisa tratamiento con GCI dosis altas +LABA y LAMA y presenta ≥1 de los siguientes criterios: • ACT <20 o ACQ>1,5 • ≥2 ciclos de glucocorticoides orales (GCO) de ≥3 días de duración en el año previo • ≥1 ingreso hospitalario por agudización asmática en el año previo • FEV1 ≤80% de esperado Inflamación refractaria de T2: ≥1 de los siguientes criterios mientras el paciente usa GCO diarios: • ≥150 Eos por microlitro en sangre • FENO ≥25 ppb (American Thoracic Society Committee) • ≥2% de Eos en esputo • El asma está clínicamente provocada por alérgenos Los GCO a menudo suprimen los biomarcadores de la inflamación de Tipo 2 (Eos en sangre, Eos en esputo y FENO). Por lo tanto, si es posible, estas pruebas se deben realizar antes de comenzar un curso corto o tratamiento de mantenimiento con GCO, o cuando el paciente esté con la dosis más baja posible de GCO. Umbrales de eosinofilia en sangre: al menos una determinación de más de 300 Eos/μL en el último año. En pacientes tratados con corticoides sistémicos de forma crónica o recientemente pueden aparecer cifras bajas de Eos. En este caso puede ser de utilidad revisar valores históricos. Umbrales de FENO. El punto de corte se establece en 25 ppb. No obstante, se debe considerar que la medida de FENO puede verse alterada por la toma reciente de corticoides sistémicos y la dosis total de corticoides inhalados, por la edad y tabaquismo (niveles más bajos en fumadores). Si aparecen niveles altos de FENO, verificar que el paciente se autoadministra correctamente la medicación inhalada (adhesión terapéutica y técnica inhalatoria). Respuesta a fármaco biológico (escalas multidimensionales EXACTO y FEOS) Elección entre mAbs El orden en que aparecen los biológicos en el esquema, cuando coinciden en una indicación, obedece solo al tiempo que llevan comercializados. En la elección deben considerarse: el recuento de Eos en sangre, la función pulmonar, el uso de corticoides orales de mantenimiento, la presencia de comorbilidades: poliposis nasal/EREA, urticaria crónica, dermatitis atópica y enfermedades asociadas a asma (granulomatosis eosinofílica con poliangeítis [GEPA], neumonía eosinófila, ABPA, esofagitis eosinofílica). • Benralizumab (mayor eficacia>300 Eos/μL): pacientes con mala función pulmonar, poliposis, corticoides orales de mantenimiento y dificultad para acceder a unidad de asma. • Reslizumab (mayor eficacia>400 Eos/μL): mejora la función pulmonar. No hay ensayos clínicos que demuestren que sea eficaz para reducir la dosis de GCO. Administración intravenosa. • Mepolizumab (su indicación es a partir de 150 Eos/μL, pero mayor eficacia>500 Eos/μL): indicado en pacientes con>150 Eos /μL si existen valores históricos de>300 Eos/μL. Se ha demostrado que permite reducción o retirada de GCO. • Dupilumab (mayor eficacia>300 Eos/μL y FENO>50 ppb): mejora la función pulmonar, la poliposis nasal y la dermatitis atópica grave. Se ha demostrado que permite reducción o retirada de GCO y aumenta los valores de Eos. La administración es quincenal. Según IPT, posible indicación en todos los pacientes corticodependientes. • Tezepelumab según IPT está indicado en el asma grave no controlada, independientemente del valor de biomarcadores. Para elegir entre fármacos con potencial eficacia en un determinado paciente, se deben considerar criterios de comodidad posológica (preferible mensual/bimensual en lugar de quincenal), vía de administración (preferible subcutáneo a intravenoso) y costes. La termoplastia está indicada en pacientes sin enfisema/bronquiectasias/atelectasias ni comorbilidades importantes. Sin tratamiento con anticoagulantes o inmunosupresores y que no presenten infecciones recurrentes. La FEV1 debe ser mayor de 40% y no debe haber contraindicación para BFC con sedación.](https://static.elsevier.es/multimedia/26596636/0000000700000004/v1_202511190229/S2659663625000906/v1_202511190229/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)



